多酚是在植物性食物中发现的具有潜在促进健康作用的化合物,也是近年来兴起的天然抗氧化剂之一。流行病学研究发现,多酚在预防某些疾病(如心血管疾病、癌症)和维持人类健康方面具有潜在益处,食用富含多酚的植物性食品与慢性病患病风险的降低之间可能存在关联[1-2]。
已知天然多酚与各种大分子之间存在吸附行为[3]。一旦多酚接触到植物的细胞壁类似物(如纤维素、纤维素/果胶)或植物细胞壁材料,二者之间的相互作用就会自发地、广泛地发生[2]。一方面,多酚与植物细胞壁成分(尤其是膳食纤维)的结合可以显著影响它从食物基质中的释放,使其更具生物活性,更容易被人体胃肠道吸收[4-6];另一方面,某些多酚与不溶性纤维素的结合增加了纤维素的抗氧化活性,当这种纤维素/酚复合颗粒作为水包油(oil/water, O/W)型Pickering乳液的稳定剂时,能够将多酚锚定在油水界面,进而延缓乳液内油脂的氧化,这对食品加工是有利的[7-11]。基于以上的优势,越来越多的人开始研究纤维素对多酚的吸附行为和复合颗粒对多酚的生物可及性、加工利用度的影响。PHAN等[2]报道,经选择的多酚对不同的纤维素基复合材料和苹果细胞壁具有选择性的结合现象。LI等[3]制备了茶多酚改性细菌纤维素(bacterial cellulose, BC)纳米纤维,并将它作为界面抗氧化剂和胶体表面活性剂稳定Pickering乳液。结果表明,改性纳米纤维在油水界面上具有良好的自由基清除活性。尽管酚类物质与植物细胞壁材料、纯纤维素和纤维素/果胶模型之间的相互作用已经日渐清晰,但是对不同种类多酚与纤维素之间的结合行为和不同种类植物细胞壁中的纤维素与多酚的结合行为仍然知之甚少。
白果壳纤维素是一种还未被深入研究的多酚目标结合物。酸水解和高压均质(high pressure homogenization, HPH)处理能改变其光学性质和物理性质,使之成为纳米级纤维素颗粒[12]。本实验对白果壳纳米纤维素进行孔性能表征,并选取5种常见的多酚,探究其对不同种类多酚的吸附行为,研究离子强度、pH、温度3种环境因素对多酚吸附的影响,表征纤维素吸附多酚前后的表面化学结构变化,考察纤维素/酚复合颗粒的自由基清除能力。研究结果可为进一步探究其他植物细胞壁多糖和整个细胞壁系统对不同种类多酚的吸附行为及动力学提供参考依据,同时为制备一种能够在油水界面抑制油脂氧化的乳液稳定剂提供可能。
1 材料与方法
1.1 材料
白果,去除果仁得到白果壳,江苏泰州;氢氧化钠、亚氯酸钠、乙酸、硫酸,均为分析纯,国药集团化学试剂有限公司;儿茶素、茶多酚、没食子酸、阿魏酸和表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),上海源叶生物科技有限公司。
1.2 白果壳纳米纤维素的制备
按照NI等[12]的方法对白果壳进行纯化处理。将粉碎的白果壳和4%的NaOH溶液按照料液比1∶25(g∶mL)混合,在90 ℃水浴下加热2 h,随后过滤去除NaOH溶液,用去离子水洗涤。此过程重复2次,在50 ℃条件下热风干燥。随后将干燥的纤维素按照料液比1∶25(g∶mL)与漂洗液(每100 mL漂洗液中含有1.5 g亚氯酸钠,2.5 g NaOH和8 mL乙酸)混合,在80 ℃水浴下加热2 h,过滤去除漂洗液。此过程重复2次,用去离子水反复清洗至纤维素悬浮液的pH至中性。
纯化后的纤维素,采用62%的硫酸按照1∶15(g∶mL)料液比在45 ℃下水解30 min,水解结束后立即终止反应,用去离子水进行透析去除多余的无机盐离子。透析结束后,采用高压均质(30 MPa,循环2次)制备得到纳米纤维素颗粒。
1.3 白果壳纳米纤维素对酚的吸附行为
1.3.1 酚在纤维素上的吸附动力学研究
为了探究白果壳纤维素对不同酚的吸附情况,选择儿茶素、茶多酚、没食子酸、阿魏酸和EGCG作为研究对象。纤维素和酚的自发吸附实验参照LIU等[13]的方法做了一定的修改。称取1.0 g纤维素粉末倒入250 mL锥形瓶中,随后加入100 mL(200 mg/L) pH 7.0的酚溶液,将锥形瓶放入转速150 r/min和温度37 ℃的摇床中。在吸附时间分别为1、5、10、20、30、60、120、240、480、600、1 000、1 440 min时,用注射器吸取1 mL的上清液,用0.22 μm滤膜过滤,随后测定滤液的吸光值。纤维素吸附酚的量用Qt(mg/g纤维素)表示,Qt计算如公式(1)所示:
(1)
式中:ρ0和ρt分别为水相中起始酚的质量浓度和t时刻酚的质量浓度,mg/L;V,溶液体积,L;m,纤维素的质量,g。
此外,利用一级(公式2)和二级(公式3)模型对实验数据进行拟合,以评价纤维素对5种酚类物质的吸附能力。采用Weber-Morris颗粒间扩散模型(公式4)描述吸附过程:
ln(Qe-Qt)=lnQe-k1t
(2)
t/Qt=1/k2(Qe)2+t/Qe
(3)
Qt=kit1/2+C
(4)
式中:Qt为不同时间t的吸附量;Qe为平衡吸附量;k1(1/min),k2[g/(mg·min)]和ki[(min1/2·mg)/g]分别是准一级,准二级和Weber-Morris粒子间扩散模型的速率常数。
1.3.2 环境对酚吸附的影响
(1)离子强度的影响。以儿茶素为研究对象,吸附实验按照1.3.1的方法,通过加入NaCl来调节酚溶液的离子强度,使得最终酚溶液的离子强度分别为0、50和100 mmol/L。
(2)pH的影响。以儿茶素为研究对象,吸附实验按照1.3.1的方法,用磷酸缓冲液将酚溶液的pH分别调节为2.0、5.0和7.0。
(3)温度的影响。以儿茶素为研究对象,吸附实验按照1.3.1的方法,将摇床的温度分别调节为4、25、37 ℃。
1.4 纤维素颗粒的孔性能表征
使用氮气吸附仪(Autosorb-IQ,Quantachrome公司,美国)对纤维素样品进行孔性能表征。5 g样品在60 ℃和10-3 mmHg下进行脱气直到平衡。在-196 ℃下进行N2的吸附-脱附过程测试。比表面积根据Brunauer-Emmett-Teller(BET)分析方法计算。
1.5 纤维素吸附多酚前后的表面化学结构变化
使用X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)对样品表面化学结构进行分析,选取纯纤维素以及纤维素吸附儿茶素的样品。测试条件为XPS(Thermo ESCALAB 250,美国)的X射线激发源为单色Al Ka(Hv=1 486.6 eV),功率150 W,X射线束斑500 μm,能量分析器固定透过能为20 eV。
1.6 纤维素/酚复合颗粒的自由基清除力
配制0.1 mmol/L的DPPH乙醇溶液,取一定体积的样品悬浮液(2 mg/mL)用DPPH乙醇溶液补足至4 mL,充分混合后,室温避光反应30 min。反应结束后,在5 000×g离心2 min,测定上清液的吸光值,即为At。相同条件下,将去离子水代替样品溶液作为对照,将无水乙醇代替DPPH乙醇溶液作为空白,在517 nm处的吸光值分别记为Ac和Ab。DPPH自由基清除率计算如公式(5)所示:
DPPH自由基清除率![]()
(5)
将7 mmol/L ABTS溶液和2.5 mmol/L过硫酸钾溶液按1∶1的体积比混合,在避光条件下静置12 h,使用前用无水乙醇稀释至溶液在734 nm波长下的吸光度为(0.70±0.02),即为ABTS工作液。取一定体积上述样品悬浮液,用ABTS工作液补足到4 mL,摇匀后避光放置10 min,在波长734 nm下测定样品的吸光度,记为Ax管;在相同的条件下,用无水乙醇代替Ax管中ABTS工作液,记为Ax0管;用无水乙醇代替Ax管中的样品溶液,记为A0管。ABTS阳离子自由基清除率计算如公式(6)所示:
ABTS阳离子自由基清除率![]()
(6)
1.7 数据分析
各组实验重复3次,采用SPSS 18.0进行统计分析,Origin 9.0软件进行作图处理。
2 结果与分析
2.1 纤维素对不同酚类的吸附
2.1.1 纤维素孔性能表征
通过氮气吸脱附法研究纤维素的孔隙结构特征。由图1-a可知,纤维素的吸脱附曲线符合Ⅰ型吸附-脱附等温线[14]。另外,随着相对压力的增加,吸附N2的量逐渐增加,并且脱附曲线展现出H4型滞后环,属于狭缝孔,这种现象常出现在微孔和中孔混合的吸附剂中[14-15]。由图1-b可知,纤维素孔隙主要分布在1~30 nm,通过计算,样品的比表面积为246.71 m2/g,孔体积为0.35 cm3/g。氮气吸脱附法的结果说明了白果壳纳米纤维素颗粒存在着良好的吸附行为。
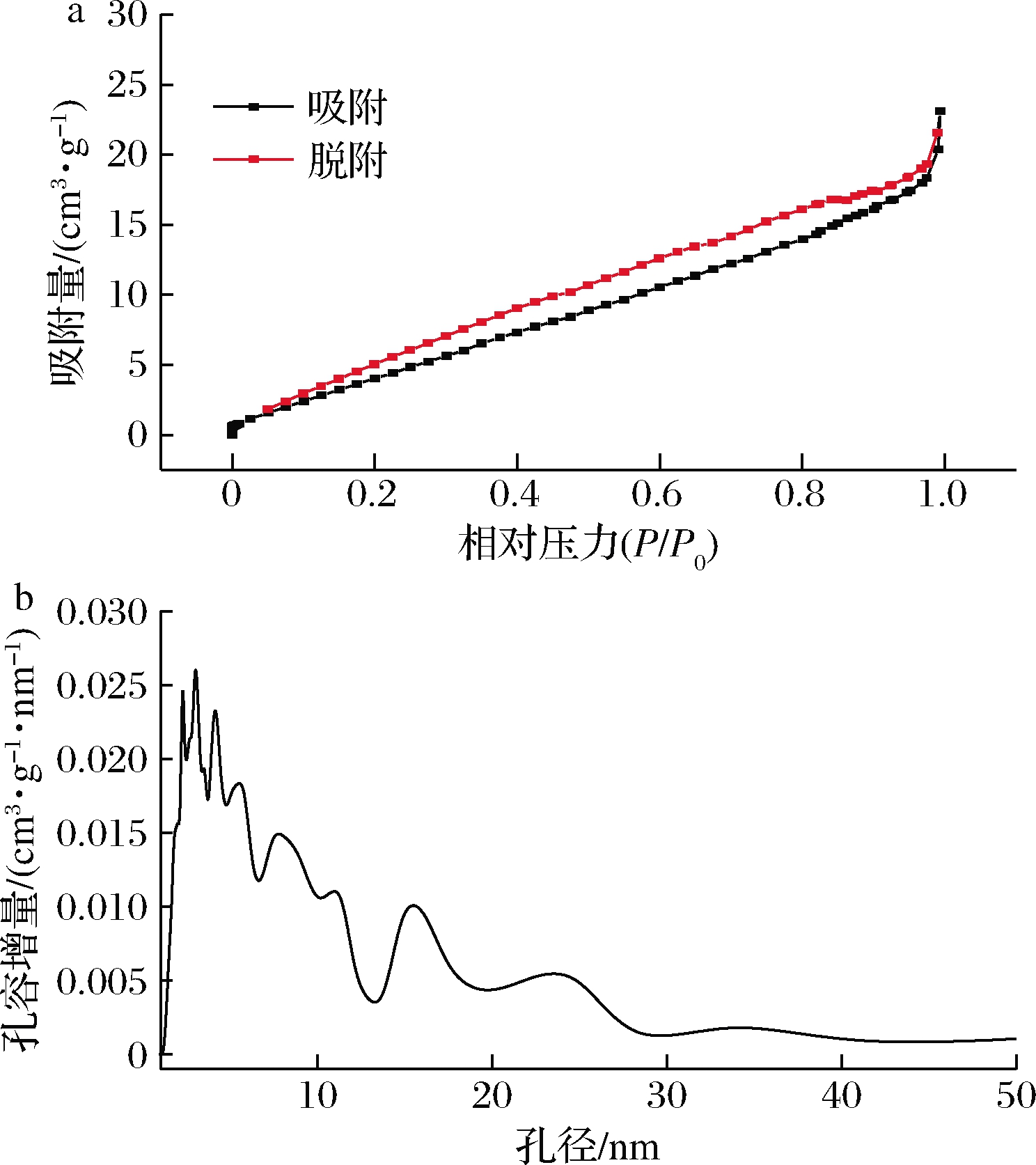
a-吸脱附等温线;b-孔径分布
图1 纳米纤维素氮气吸脱附等温线和孔径分布
Fig.1 N2 adsorption-desorption isotherm of nano cellulose and pore size distribution
2.1.2 多酚的自发吸附
5种酚类物质在白果壳纤维素上的吸附随时间变化的情况如图2所示。
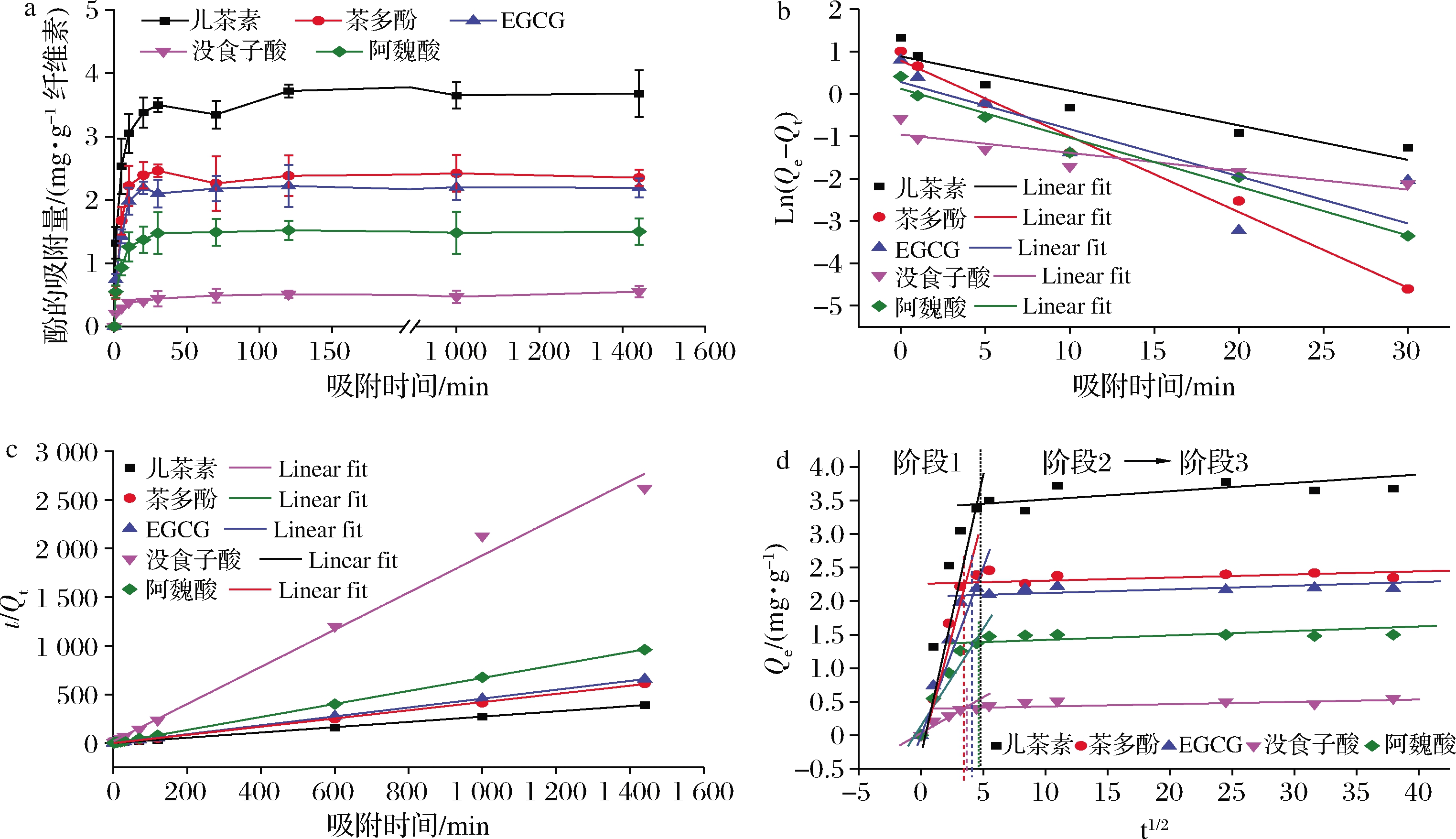
a-不同种类多酚的吸附情况;b-一级动力学模型;c-二级动力学模型;d-Weber & Morris粒子内扩散图
图2 酚类物质在白果壳纤维素上的吸附随时间的变化
Fig.2 Absorption behavior of polyphenols on gingko husk cellulose during absorption
随着时间的增加,5种酚类的吸附量都在短时间内有不同程度的增加,最终的吸附量都稳定在0.5 mg/g纤维素以上。这说明白果壳纤维素对5种酚类物质均存在自发吸附行为。吸附理论显示,如果天然化学成分在吸附剂上的吸附在几分钟至几小时这样相对较短的时间内达到平衡,表明这一过程可能是通过分子间作用力发生的[13]。
表1总结了动力学参数、相关系数和相对误差。模型拟合结果表明,采用二级动力学模型时,5种多酚的实验吸附容量(Qe,exp)均更接近计算值(Qe,cal)。这表明白果壳纳米纤维素对不同种类多酚的吸附机制可能类似,纤维素对目标吸附物的选择性较低[13]。这进一步证明了物理吸附过程的存在。
表1 不同酚在纤维素上吸附的动力学参数
Table 1 Kinetic parameters of adsorption of different polyphenols on cellulose

酚类一级动力学模型二级动力学模型k1/(min-1)R2Qe,exp/(mg·g-1)Qe,cal/(mg·g-1)相对误差/%k2/[g·(mg·min)-1]R2Qe,exp/(mg·g-1)Qe,cal/(mg·g-1)相对误差/%儿茶素0.081 50.873.742.4235.290.210.993.743.681.60茶多酚0.017 90.982.762.1422.461.980.992.762.3714.13EGCG0.111 30.762.231.2743.050.380.992.232.191.79没食子酸0.043 30.800.560.3439.280.180.990.560.535.35阿魏酸0.115 60.971.511.379.270.450.991.511.491.32
注:Qe,exp和Qe,cal分别为实验数据和模型计算数据;相对误差=100×(|Qe,exp-Qe,cal|)/Qe,exp
事实上,酚类物质对纤维素的自动吸附可能涉及到许多由氢键和疏水相互作用组合而成的低能非共价相互作用的建立[1]。PHAN等[1]发现,中性带电荷的纤维素与带负电荷的酚酸、带正电荷的花青素和中性化合物(+/-)-儿茶素相互作用的速率和程度相当。PADAYACHEE等[16]也发现,紫色胡萝卜汁中带正电的花青素或带负电的酚酸与细菌纤维素类似物之间存在程度相似的相互作用。上述结果都可以佐证这一观点。
2.1.3 多酚的吸附过程
从图2-a可知,纤维素吸附的酚量均呈先增加后不变的趋势。具体为:在实验开始后的25 min内吸附速度较快,多酚吸附量快速增加;25 min后,纤维素对5种酚类的吸附明显放缓,虽仍有波动,但总体趋于平衡;1 000 min后,5种酚类的吸附量几乎保持不变。Weber & Morris粒子内扩散模型已被用于完全定义吸附过程[13]。根据该模型,通过线性拟合将吸附过程分为2个部分,如图2-d所示,在第一阶段,纤维素对5种多酚的吸附量迅速上升;吸附由第一阶段进入第二阶段的时间集中在12.25~25 min左右;进入第二阶段后,吸附速率明显下降,拟合线斜率远小于第一阶段。这说明纤维素对酚的吸附过程存在快速、慢速和平衡3个阶段。酚类吸附速度的前后变化与吸附原理有关:在初始阶段,纤维素表面有足够多的酚类物质结合位点,因此吸附速度快;随后,由于吸附位点数的减少和酚类物质浓度降低,速率减慢,接近平衡[13](图3)。LIU等[13]在研究儿茶素在纤维素表面的吸附现象时也发现了类似的速度变化情况。
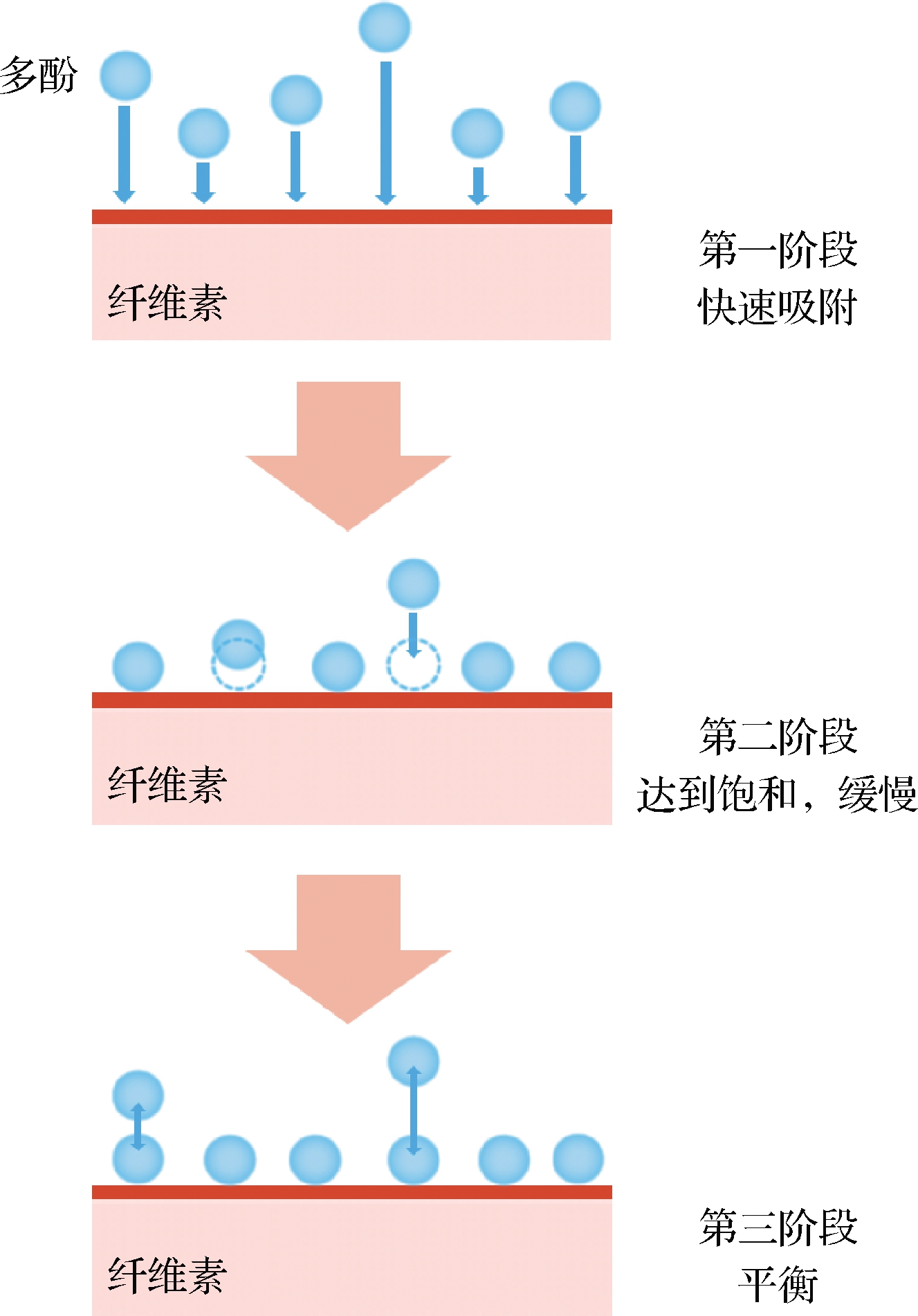
图3 纤维素对多酚的吸附过程示意图
Fig.3 Schematic diagram of the adsorption process of catechin onto cellulose
一般来说,分子从液相到固体吸附剂的吸附过程包括3个阶段:膜扩散、颗粒内扩散和平衡,而Weber & Morris粒子内扩散模型拟合线没有通过原点。这说明在吸附过程中,颗粒内扩散不是速率限制因素,由于纤维素晶体的非微孔结构,吸附主要发生在表面[13]。
2.1.4 纤维素对多酚的吸附量
纵向比较图2-a或图2-d中纤维素对5种酚类物质的吸附量,排序如下:儿茶素>茶多酚>EGCG>阿魏酸>没食子酸。5种酚类物质中,白果壳纳米纤维素对儿茶素的吸附能力最佳,吸附量可达3.7 mg/g纤维素;对没食子酸吸附能力最差,吸附量仅有0.5 mg/g纤维素。图2-b表征了不同种类多酚在吸附初期(0~30 min)的吸附速率。可以看出,在吸附初期,纤维素对茶多酚的吸附较快,而对儿茶素、没食子酸的吸附则相对较慢。图2-c表征了不同种类多酚在整个吸附过程(0~1 600 min)中的吸附速率,排序如下:儿茶素>茶多酚>EGCG>阿魏酸>没食子酸。
以上现象说明,白果壳纤维素对不同种类酚类物质的吸附量和吸附速度有所差异。这可能是由于5种酚类物质间分子结构、分子质量存在差异。如果酚类物质的分子结构中有较多的芳香环,则它相比于其他酚类更容易与纤维素结合。这是因为分子结构中芳香基团和羟基的数目,或酚类化合物的天然电荷是酚类与纤维素之间形成非共价键和疏水相互作用的重要因素[1]。
2.2 环境对纤维素吸附儿茶素的影响
酚类物质与纤维素之间的自发相互作用主要受非共价相互作用的调控,包括氢键和疏水相互作用[17-19],而这些非共价相互作用会受到体系pH、温度和离子强度的影响[20]。因此,选取白果壳纤维素吸附量最大的儿茶素来探究离子强度、pH和温度3种环境条件的改变对酚类物质吸附量的影响。
2.2.1 离子强度对吸附的影响
由图4可知,当离子强度为50和100 mmol/L时,纤维素对儿茶素的吸附量无显著性差异,而0 mmol/L的离子强度会使儿茶素的吸附量显著低于另外2组。这说明外加一定的离子有利于多酚的吸附,而外加离子强度的大小对多酚吸附无显著影响。这可能是因为纤维素聚合物的疏水区域与多酚分子结构中的疏水基团(如芳香环)之间建立了疏水相互作用,它能够随着离子强度的增加而增加[17],所以外加一定离子能够增加多酚的吸附量。PHAN等[20]在研究相同区间离子强度对阿魏酸、儿茶素和花青素-3-葡萄糖苷(Cya-3-glc)在BC上吸附情况的影响时得到了与本次实验类似的结论。但是GAO等[21]发现,离子强度为0.05~0.5 mol/L时,燕麦β-葡聚糖对茶多酚的吸附量显著减少,这与本实验的结论不同,可能是因为本实验中添加的NaCl量过少,不足以对疏水相互作用产生影响[20]。
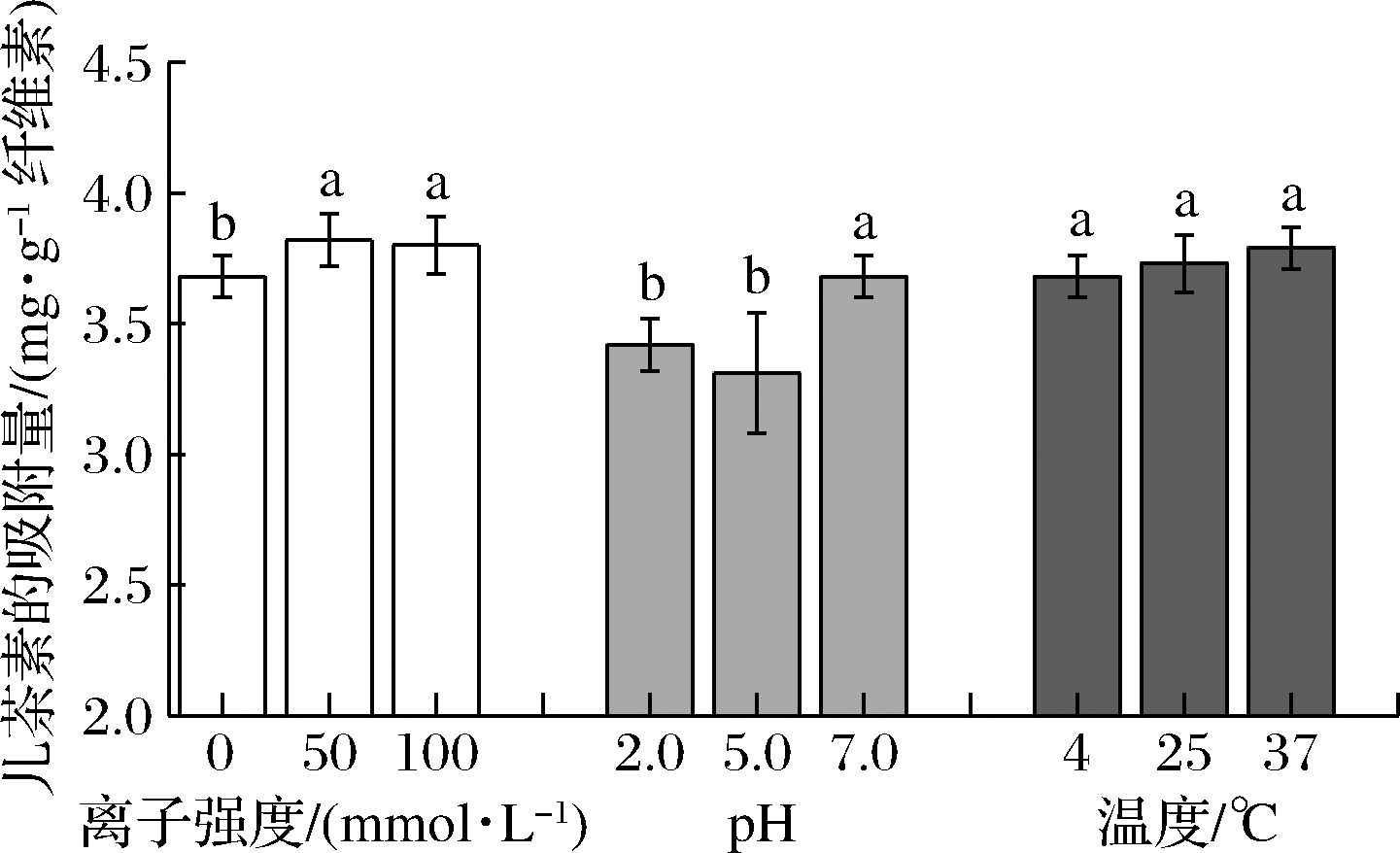
图4 不同环境中纤维素对儿茶素的吸附情况
Fig.4 Adsorption of catechins by cellulose in different environments
2.2.2 pH对吸附的影响
由图4可知,相比于其他2个环境因素,pH对儿茶素吸附量的影响最大。儿茶素的吸附量在pH从2.0上升到5.0时略有下降,但没有显著性差异;而当pH从5.0上升到7.0时,儿茶素的吸附量显著上升,并在pH 7时呈现最大吸附,说明纤维素在中性环境下可以吸附更多的儿茶素。这可能是儿茶素在较低的pH条件下电离不完全,静电相互作用对儿茶素吸附的贡献相对较小;而在较高pH时,儿茶素失去了质子,有更多的负位,从而使裸露的氧原子有更多的孤对电子从而更容易与纤维素表面发生相互作用[13]。LIU等[13]提出的键能理论同样能解释这一现象:在pH较小时,范德华力和氢键对结合的贡献大于静电相互作用,而pH对纤维素表面电位变化和儿茶素电离作用的影响又只能决定静电相互作用的大小,所以儿茶素的吸附受pH影响不大。静电相互作用对单宁和植物细胞壁材料之间的结合没有贡献[17,22]。但是,和本实验结果不同的是,PHAN等[20]研究发现,对于未带电荷的化合物(+/-)儿茶素,pH值对其被BC吸附没有显著影响。同样的,BOURVELLEC等[23]报道,未带电荷的原花青素与苹果细胞壁形成复合物在pH为2.2~7.0内不受影响。
2.2.3 温度对吸附的影响
由图4可知,相比于其他2个环境因素,温度对儿茶素吸附量的影响最小。温度的增加会使儿茶素的吸附量有极少量的增加,但是3个温度梯度之间没有统计学意义上的显著性。由此可以推测,实验中的温度变化对纤维素和酚类的物理化学性质影响不大。酚类在4~37 ℃内相对稳定,不会因为分子内能量增高而使氢键减弱,影响纤维素对其的吸附能力;其次,酚类在水中的溶解度也并不会在此温度区间内有较大的改变[20]。可以预测,无论是在低温、常温,还是在高温贮藏状态下,酚类的吸附量始终维持在一个较为稳定的水平。PHAN等[20]与本实验得到了相同的结论,但是LIU等[7]在用纤维素吸附儿茶素时,得到了吸附量随温度升高而降低的结论。
2.3 纤维素吸附酚类物质前后的化学结构变化
选取纤维素和儿茶素样品,利用XPS表征纤维素吸附儿茶素前后表面化学元素的变化。图5和表2分别展示了样品XPS扫描谱图、C1s的分峰特征曲线以及O/C值和C1s峰面积。由于纤维素和儿茶素只含有C、H和O元素,H元素对X射线不敏感,XPS不能对H进行表征,因此图5-a和图5-d中XPS图谱中只有C和O两种元素的特征峰。从表2可知,纤维素吸附儿茶素后,样品的O/C值轻微降低,这是因为纤维素吸附一定量的儿茶素(C15H14O6)后,C原子增加量相对于O原子更多。此外,植物纤维的C1s价态有4类,分别代表纤维表面不同的碳链连接方式[24]。其中,C1代表只和碳、氢连接的碳原子(—C—H,—C—C),其能谱峰大约在285 eV,主要来源于纤维素表面的木质素等;C2表示与1个非羰基类的氧原子连接的碳原子(—C—O),能谱峰为286.5 eV,主要来源于纤维素和半纤维素的羟基;C3代表2个非羰基类的氧或1个羰基类氧原子连接的碳原子(O—C—O或C![]() O),能谱峰大约在288~288.5 eV,主要来源于木质素中的酮基、醛基或纤维素分子的氧化产物;C4代表连有1个羰基类氧原子和1个非羰基类氧原子的碳原子(O—C
O),能谱峰大约在288~288.5 eV,主要来源于木质素中的酮基、醛基或纤维素分子的氧化产物;C4代表连有1个羰基类氧原子和1个非羰基类氧原子的碳原子(O—C![]() O),能谱峰为289~289.5 eV,主要是纤维素中的有机酸等[25]。从图5-b,图5-d和表2可知,样品1和2之间的C1、C2和C3峰面积变化不大,尽管C4价态所占的比例最小,但是变化最为明显。样品2的C4从0.83%增加到1.44%,这个变化说明纤维素吸附了儿茶素后,C4价态的C原子增加,可能归因于吸附在纤维素表面的儿茶素中存在羧基。这个结果与O/C值的变化一致,证实了纤维素吸附儿茶素后表面的化学结构发生了变化。
O),能谱峰为289~289.5 eV,主要是纤维素中的有机酸等[25]。从图5-b,图5-d和表2可知,样品1和2之间的C1、C2和C3峰面积变化不大,尽管C4价态所占的比例最小,但是变化最为明显。样品2的C4从0.83%增加到1.44%,这个变化说明纤维素吸附了儿茶素后,C4价态的C原子增加,可能归因于吸附在纤维素表面的儿茶素中存在羧基。这个结果与O/C值的变化一致,证实了纤维素吸附儿茶素后表面的化学结构发生了变化。
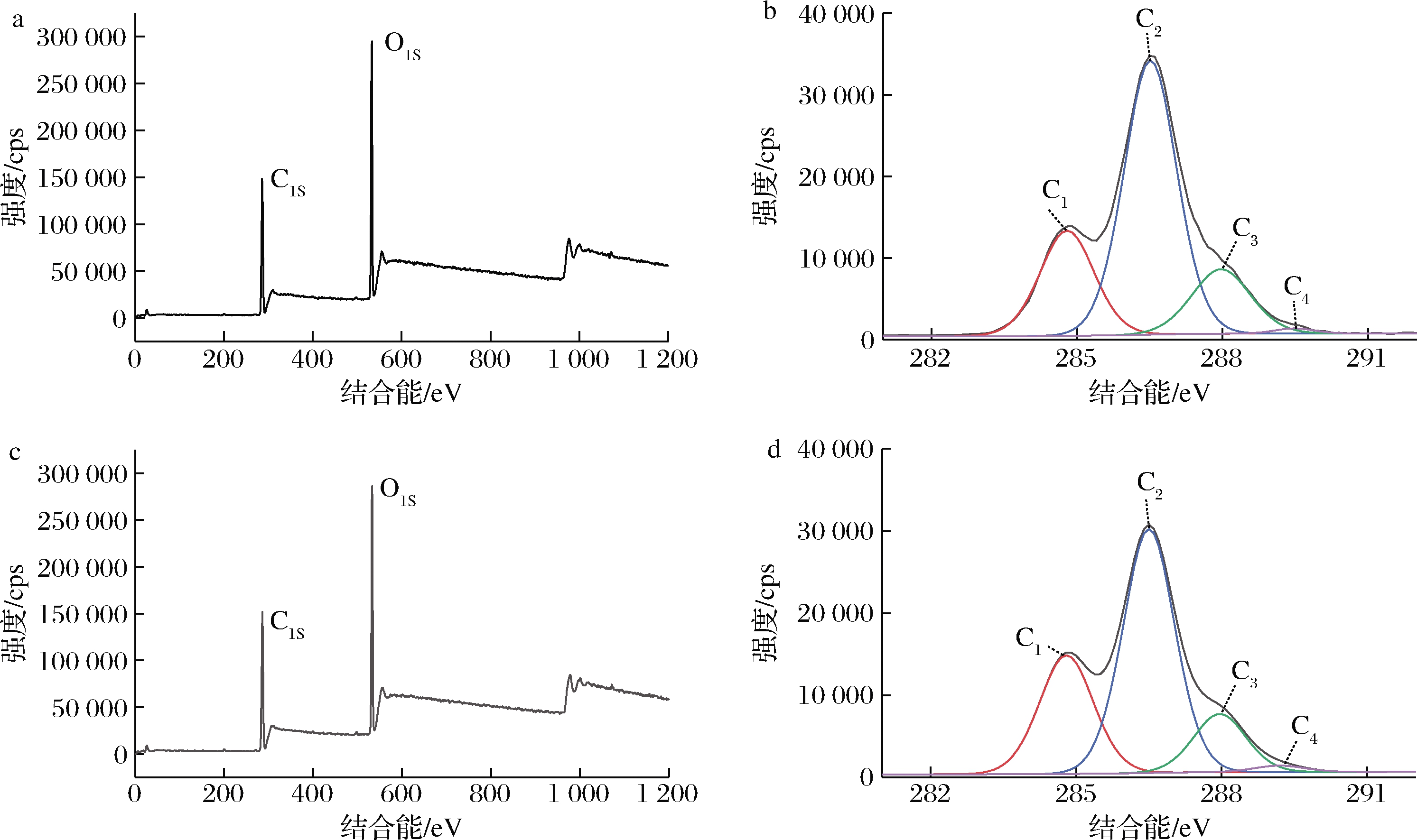
a-纤维素样品XPS图谱;b-纤维素样品C1s特征峰;c-纤维素吸附儿茶素后的样品XPS图谱; d-纤维素吸附儿茶素后的样品C1s特征峰
图5 纤维素吸附儿茶素前后的XPS图谱和C1s特征峰
Fig.5 XPS spectra and C1s characteristic peaks of cellulose before and after catechin adsorption
表2 吸附儿茶素前后纤维素表面O/C值以及C1s峰面积
Table 2 The O/C ratio and C1s peak area of cellulose surface before and after catechin adsorption
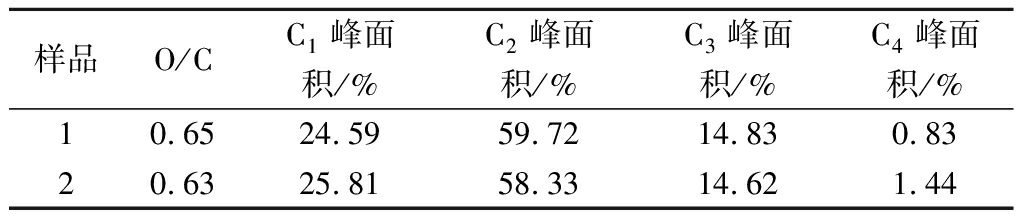
样品O/CC1峰面积/%C2峰面积/%C3峰面积/%C4峰面积/%10.6524.5959.7214.830.8320.6325.8158.3314.621.44
注:样品1,2分别为纯纤维素以及纤维素吸附了儿茶素
2.4 纤维素/酚复合颗粒的抗氧化能力
以纯白果壳纳米纤维素为对照,用DPPH和ABTS两个指标评价白果壳纤维素吸附儿茶素后形成的纤维素/酚复合颗粒的抗氧化能力。图6表明,纯纤维素颗粒的自由基清除能力约为0,即几乎没有抗氧化能力,纤维素/酚复合颗粒具有优异的DPPH自由基和ABTS阳离子自由基清除活性,且清除能力随着加入的悬浮液体积的增加而上升,两者呈线性关系。当纤维素/酚复合颗粒悬浮液加入至2 mL时,DPPH自由基清除能力可达82%,ABTS阳离子自由基清除能力略小于DPPH,为65%。由此说明,酚类物质吸附到白果壳纤维素上后依然能发挥其天然抗氧化功能,大大增强复合颗粒的抗氧化能力,这为将复合颗粒作为乳液稳定剂锚定在油水界面以防止乳液内油脂氧化提供了可能。
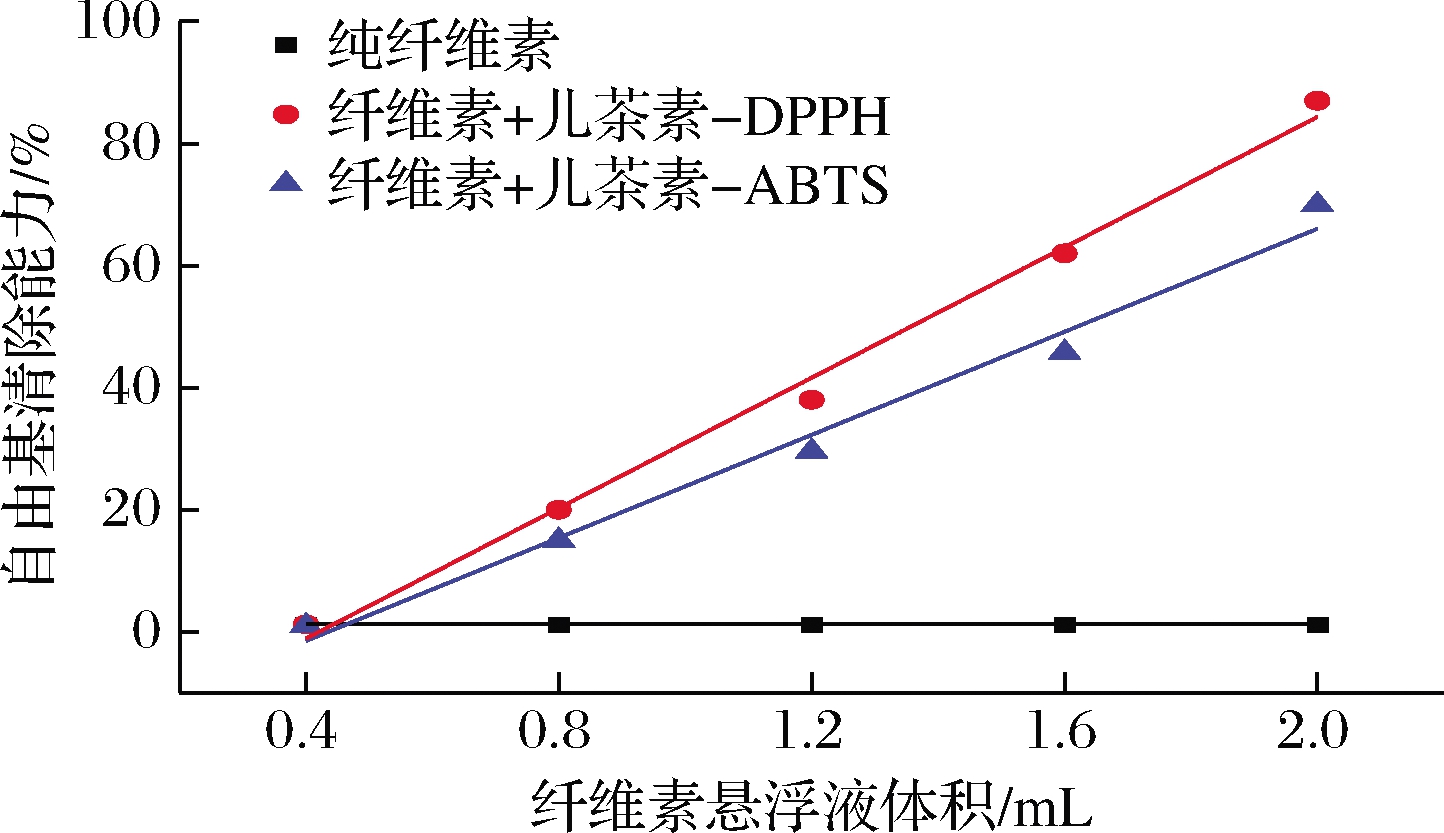
图6 吸附酚后的纤维素颗粒的自由基清除能力
Fig.6 Free radical scavenging ability of cellulose particles after adsorbing phenol
3 结论与讨论
本研究对白果壳纳米纤维素的孔性能以及儿茶素、茶多酚、没食子酸、阿魏酸和EGCG在其上的吸附特性进行了考察,探究了环境因素对多酚吸附量的影响和吸附前后纤维素表面化学结构的变化,测定了纤维素/酚复合颗粒的抗氧化能力。结果发现,纤维素具有良好的吸附行为,对酚类物质存在自发吸附过程,且吸附速率均呈先快后慢,最后达到平衡的特点。其中,纤维素对儿茶素吸附最多,为3.7 mg/g纤维素。中性pH和高离子强度有利于纤维素对酚的吸附,而温度对吸附的影响不大。纤维素吸附多酚后,其表面化学性质发生改变。纤维素对酚的吸附使纤维素/酚复合颗粒的抗氧化能力随含量的增加而增强,当加入的悬浮液体积为2 mL时,其DPPH自由基清除能力可达82%。这些发现进一步证明了白果壳纳米纤维素可以作为多酚吸附剂吸附多种酚类物质,且形成的纤维素/酚纳米颗粒能发挥良好的抗氧化活性。后续研究会尝试利用该纤维素/酚复合颗粒稳定Pickering乳液,使其在油水界面发挥一定的抗氧化作用,减缓乳液内油脂的氧化,为开发具有良好界面抗氧化活性的Pickering乳液奠定基础。
[1] PHAN A D T, NETZEL G, WANG D J, et al.Binding of dietary polyphenols to cellulose:Structural and nutritional aspects[J].Food Chemistry, 2015, 171:388-396.
[2] PHAN A D T, FLANAGAN B M, D’ARCY B R, et al.Binding selectivity of dietary polyphenols to different plant cell wall components:Quantification and mechanism[J].Food Chemistry, 2017, 233:216-227.
[3] LI Q, CHEN P, LI Y, et al.Construction of cellulose-based Pickering stabilizer as a novel interfacial antioxidant:A bioinspired oxygen protection strategy[J].Carbohydrate Polymers, 2020, 229:115395.
[4] PADAYACHEE A, NETZEL G, NETZEL M, et al.Lack of release of bound anthocyanins and phenolic acids from carrot plant cell walls and model composites during simulated gastric and small intestinal digestion[J].Food & Function, 2013, 4(6):906-916.
[5] CALANI L, DALL’ASTA M, DERLINDATI E, et al.Colonic metabolism of polyphenols from coffee, green tea, and hazelnut skins[J].Journal of Clinical Gastroenterology, 2012, 46 Suppl:S95-S99.
[6] SAURA-CALIXTO F.Dietary fiber as a carrier of dietary antioxidants:An essential physiological function[J].Journal of Agricultural and Food Chemistry, 2011, 59(1):43-49.
[7] LIU Y J, YING D Y, SANGUANSRI L, et al.Comparison of the adsorption behaviour of catechin onto cellulose and pectin[J].Food Chemistry, 2019, 271:733-738.
[8] KAREFYLLAKIS D, ALTUNKAYA S, BERTON-CARABIN C C, et al.Physical bonding between sunflower proteins and phenols:Impact on interfacial properties[J].Food Hydrocolloids, 2017, 73:326-334.
[9] LIU W, GAO H X, MCCLEMENTS D J, et al.Stability, rheology, and β-carotene bioaccessibility of high internal phase emulsion gels[J].Food Hydrocolloids, 2019, 88:210-217.
[10] 曾涛. 小麦醇溶蛋白胶体颗粒制备抗氧化Pickering高内相乳液及多孔材料的研究[D].广州:华南理工大学, 2017.
ZENG T.Fabrication of antioxidant Pickering high internal emulsions and porous materials by gliadin colloid particles[D].Guangzhou:South China University of Technology, 2017.
[11] ABDULLAH, WEISS J, AHMAD T, et al.A review of recent progress on high internal-phase Pickering emulsions in food science[J].Trends in Food Science & Technology, 2020, 106:91-103.
[12] NI Y, LI J W, FAN L P.Production of nanocellulose with different length from Ginkgo seed shells and applications for oil in water Pickering emulsions[J].International Journal of Biological Macromolecules, 2020, 149:617-626.
[13] LIU Y J, YING D Y, SANGUANSRI L, et al.Adsorption of catechin onto cellulose and its mechanism study:Kinetic models, characterization and molecular simulation[J].Food Research International, 2018, 112:225-232.
[14] SING K S W.Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (Recommendations 1984)[J].Pure and Applied Chemistry, 1985, 57(4):603-619.
[15] 郭方方. 环糊精修饰二氧化钛的制备及其光催化降解染料的行为研究[D].天津:天津科技大学, 2019.
GUO F F.Preparation of cyclodextrin modified titanium dioxide and photoc atalytic degradation of dyes[D].Tianjin:Tianjin University of Science & Technology, 2019.
[16] PADAYACHEE A, NETZEL G, NETZEL M, et al.Binding of polyphenols to plant cell wall analogues - Part 1:Anthocyanins[J].Food Chemistry, 2012, 134(1):155-161.
[17] LE BOURVELLEC C, RENARD C M G C.Interactions between polyphenols and macromolecules:Quantification methods and mechanisms[J].Critical Reviews in Food Science and Nutrition, 2012, 52(3):213-248.
[18] TANG H R, COVINGTON A D, HANCOCK R A.Structure-activity relationships in the hydrophobic interactions of polyphenols with cellulose and collagen[J].Biopolymers, 2003, 70(3):403-413.
[19] BORDENAVE N, HAMAKER B R, FERRUZZI M G.Nature and consequences of non-covalent interactions between flavonoids and macronutrients in foods[J].Food & Function, 2014, 5(1):18-34.
[20] PHAN A D T, D’ARCY B R, GIDLEY M J.Polyphenol-cellulose interactions:Effects of pH, temperature and salt[J].International Journal of Food Science & Technology, 2016, 51(1):203-211.
[21] GAO R P, LIU H, PENG Z, et al.Adsorption of (-)-epigallocatechin-3-gallate (EGCG) onto oat β-glucan[J].Food Chemistry, 2012, 132(4):1 936-1 943.
[22] HANLIN R L, HRMOVA M, HARBERTSON J F, et al.Review:Condensed tannin and grape cell wall interactions and their impact on tannin extractability into wine[J].Australian Journal of Grape and Wine Research, 2010, 16(1):173-188.
[23] LE BOURVELLEC C, GUYOT S, RENARD C M G C.Non-covalent interaction between procyanidins and apple cell wall material:Part I.Effect of some environmental parameters[J].Biochimica et Biophysica Acta, 2004, 1672(3):192-202.
[24] 王香平, 何北海, 钱丽颖, 等.桉木化学热磨机械浆的XPS和SEM分析[J].造纸科学与技术, 2009, 28(1):42-45;56.
WANG X P, HE B H, QIAN L Y, et al.Analysis of Eucalyptus CTMP by XPS and sem[J].Paper Science & Technology, 2009, 28(1):42-45;56.
[25] 尤纪雪, 王玉秀.漆酶体系酶解马尾松浆表面性能的研究[J].中国造纸学报, 2009, 24(3):37-41.
YOU J X, WANG Y X.Study on surface characteristics of the Masson pine pulp enzymelyzed with three laccase systems[J].Transactions of China Pulp and Paper, 2009, 24(3):37-41.