核桃(Juglans regia L.)是胡桃科核桃属植物,世界四大坚果之一,有补肾、益智、固精强腰、温肺定喘、润肠通便等功效[1]。核桃仁作为一种高油料作物,含有角鲨烯、维生素及多酚等多种活性物质,经济价值较高。核桃种皮约占核桃仁质量的5%~10%,核桃仁中90%以上的多酚类物质都集中于种皮中,主要为酚酸、水解鞣质及少量黄酮类成分[2]。核桃多酚具有多种生物活性,如抗氧化、清除自由基、预防心脏病、改善血液循环、抗动脉粥样硬化、抗炎等[3-4]。然而,种皮中的多酚容易通过氢键、疏水相互作用及离子键等与蛋白结合,影响核桃蛋白的功能特性[5]。且因核桃种皮的苦味和涩味,在食品生产加工过程中常被当作废物处理[6]。核桃乳加工中常用湿碱法去皮,导致企业每生产1 t核桃乳就会产生数吨的碱性废水,在鲜食核桃仁及核桃蛋白粉等食品加工制作过程中也常做脱皮处理,造成了种皮多酚的极大浪费。
目前多酚的纯化方法主要有硅胶柱层析法、葡聚糖凝胶色谱法和大孔吸附树脂法等。大孔树脂因操作简单、可回收再生,具有良好的吸附选择性和稳定性及不易受酸碱和杂质的影响等优点而被国内外学者广泛应用于天然活性物质的分离纯化[7]。GUO等[8]研究表明猕猴桃果皮多酚经NKA-II树脂纯化后纯度由33.2%提高到了55.26%。张旭等[9]采用AB-8树脂对核桃青皮汁多酚进行纯化,使得多酚纯度提高了4.68倍。徐佳[10]用HZ-801型树脂对核桃外果皮多酚提取液进行纯化,多酚含量由纯化前的8.00%提高到了17.68%。国内外对核桃多酚的纯化和抗氧化性等方面研究较多,然而,对核桃种皮多酚大孔吸附树脂富集分离时,其功效组分的保留情况关注较少。
与此同时,国内外有少数关于核桃多酚的鉴定研究,赵聪[11]采用HPLC方法鉴定出核桃种皮多酚中含有表儿茶素、没食子酸和槲皮素等8种酚类物质。LIU等[12]采用超高效液相色谱串联质谱在核桃仁中鉴定出黄酮、单宁和酚酸等27种多酚类物质。REGUEIRO等[2]研究结果表明核桃仁中的主要的酚类物质是鞣花单宁、鞣花酸及其衍生物。ZHANG等[13]在核桃种皮中鉴定出鞣花酸、奎宁酸、香豆酸、对香豆酸、原儿茶酸、咖啡酸、对羟基苯甲酸和丁香酸等32种酚类物质。现有的研究中大多是直接对核桃多酚类物质鉴定,却鲜有关于核桃种皮多酚的纯化及鉴定的综合研究。
本文为提高核桃种皮多酚的纯度,筛选适宜富集核桃种皮多酚的大孔树脂,优化分离工艺条件,并采用液质联用技术对纯化后保留的多酚组分进行鉴定,为进一步开发利用核桃种皮多酚提供参考。
1 材料与方法
1.1 材料
核桃仁,云南省临沧市;没食子酸、无水乙醇、福林酚、无水Na2CO3、浓盐酸等均为分析纯,国药集团;AB-8、D101、NKA-9、HPD 100树脂,天津市光复精细化工研究所。
LE2002E电子天平、DELTA-320型pH计,梅特勒托利多仪器有限公司;M348834旋涡振荡器,德国IKA公司;水浴恒温振荡器,常州诺基仪器有限公司;酶标仪,南京拜尔沃克公司;RV10型旋转蒸发仪,广州仪科实验技术有限公司;冷冻干燥机,北京BMH有限公司;HD-3000紫外检测仪,上海嘉鹏科技有限公司;玻璃层析柱,上海五相仪器仪表有限公司;超高效液相色谱串联四级杆飞行时间质谱联用仪,美国Waters公司。
1.2 实验方法
1.2.1 粗多酚样品的制备及标准曲线的绘制
参照文献[14]制备核桃种皮多酚提取液,旋蒸后冷冻干燥,冻干的粗酚样品贮存于4 ℃冰箱。
多酚含量的测定:精确称取没食子酸标准品,蒸馏水溶解定容配制成100 μg/mL的母液。分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL的标准溶液于比色管中,加水补足至1 mL,加入1 mL质量分数为10%的Na2CO3溶液和0.5 mL福林酚试剂(稀释10倍),混匀后,室温避光反应1.5 h,测定765 nm处的吸光度,以标准溶液浓度为横坐标,吸光值为纵坐标绘制标准曲线。以同样的方法将样品溶液稀释至一定浓度后,测定样品的吸光值。
1.2.2 大孔树脂的预处理
大孔树脂用体积分数95%乙醇溶液浸泡12 h,蒸馏水洗至无醇味,再用质量分数4%NaOH溶液浸泡处理4 h,蒸馏水冲洗至中性;最后用质量分数4%盐酸浸泡4 h,蒸馏水洗树脂至中性,备用。
1.2.3 树脂的选型
分别称取1.00 g预处理的4种湿树脂于100 mL锥形瓶中,加入2 mg/mL核桃种皮多酚溶液20 mL,密封置于25 ℃水浴摇床上,150 r/min持续振荡12 h,使树脂吸附饱和,从上清液中取样测定多酚含量。将吸附饱和的树脂真空抽滤,用蒸馏水润洗至树脂表面无酚液残留,加入20 mL的体积分数为70%乙醇溶液解吸6 h,测定解吸液中多酚含量。依据公式(1)~公式(3)计算树脂吸附量(mg/g)、吸附率(%)和解吸率(%):
吸附量![]()
(1)
吸附率![]()
(2)
解吸率![]()
(3)
式中:ρ0,初始多酚质量浓度,mg/mL;ρ1,吸附后多酚液质量浓度,mg/mL;ρ2,解吸液多酚质量浓度,mg/mL;V1,吸附液体积,mL;V2,解吸液体积,mL;m,湿树脂质量,g。
1.2.4 AB-8树脂静态吸附动力学曲线
处理方法同1.2.3,每隔0.5 h取0.5 mL上清液,按1.2.1测定吸光值,依据标准曲线计算上清液的多酚含量和吸附率,绘制饱和吸附曲线。
1.2.5 上样液浓度对树脂吸附率的影响
称取1.00 g预处理好的AB-8树脂各5份,依次加入20 mL质量浓度分别为1、2、3、4、5 mg/mL的核桃种皮多酚溶液,密封置于25 ℃水浴摇床上,150 r/min持续振荡3 h,测定上清液中的多酚含量,按公式(2)计算吸附率。
1.2.6 pH值对树脂吸附率的影响
称取1.00 g预处理好的AB-8树脂各7份,依次加入20 mL pH值分别为1、2、3、4、5、6、7 的核桃种皮多酚溶液,密封置于25 ℃水浴摇床上,150 r/min持续振荡3 h,测定上清液中的多酚含量,按公式(2)计算吸附率。
1.2.7 乙醇浓度对解吸率的影响
称取1.00 g预处理好的AB-8树脂各6份,依次加入20 mL pH 9.0,质量浓度为2 mg/mL的核桃种皮多酚溶液,密封置于25 ℃水浴摇床上,150 r/min持续振荡吸附3 h后,抽滤后洗涤树脂,分别加入体积分数为50%、60%、70%、80%、90%、100%的乙醇溶液20 mL,瓶口密封,按1.2.3方法解吸并根据公式(3)计算解吸率。
1.2.8 大孔树脂动态吸附及解吸
(1) 泄露曲线:将预处理好的AB-8树脂20.00 g湿法装入Φ1.0 cm×30 cm的层析柱(1 BV=35 mL),用去离子水平衡过夜,将质量浓度为2 mg/mL,pH 3.0的核桃种皮多酚粗提液以1 mL/min流速上柱,10 mL每管收集流出液并测定多酚浓度,直至流出液多酚浓度(Ct)达到上样液的多酚浓度(Co)的10%时停止进样,绘制泄露曲线。
(2) 洗脱曲线:将质量浓度为2 mg/mL、pH 3.0的核桃多酚溶液以1 mL/min的流速上样14 BV,经3 BV去离子水除杂后,用体积分数为70%乙醇溶液洗脱至无紫外吸收,10 mL每管收集洗脱液,测定多酚浓度,绘制洗脱曲线。
将洗脱液用旋转蒸发仪蒸发去除乙醇,冻干后测定多酚纯度。多酚类物质的纯度定义为混合物中多酚类物质质量与混合物总质量的比值,如公式(4)所示:
多酚纯度![]()
(4)
1.2.9 核桃种皮多酚组分鉴定
通过超高效液相色谱串联四级杆飞行时间质谱(ultra-performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spetrometry,UPLC-TOF-MS/MS)对核桃种皮中酚类物质进行鉴定。
色谱条件:Waters Acquity BEH C18 色谱柱(2.1 mm×50 mm,1.7 μm);流动相A为纯乙腈,B为0.1%甲酸(体积分数),梯度洗脱:0~0.1 min,5% A;0.1~5 min,5%~20% A;5~8 min,20%~40% A;8~10 min,40%~80% A;10~15 min,100% A。流速0.3 mL/min,DAD检测波长为200~600 nm,进样量5 μL。
质谱条件:负离子模式,电喷雾离子化源,离子源温度100 ℃,毛细管电压3.0 kV,锥孔气流量50 L/h,脱溶剂温度400 ℃,脱溶剂气体流量500 L/h,扫描范围m/z 50~1 500。
1.2.10 数据分析
所有结果表示均为平均值±标准偏差,所有样品均做3次平行实验,分别用SPSS 22做统计学分析和Origin Pro 8.5软件作图。
2 结果与分析
2.1 四种大孔树脂对核桃种皮多酚的吸附和解吸性能比较分析
大孔树脂的吸附是利用树脂多孔网状结构和高比表面积形成的分子筛作用,也与树脂和目标物之间的范德华力或氢键缔合能力有关[15]。如表1所示,AB-8树脂的吸附量和解吸率显著高于其他几种树脂。一般来说,极性化合物在极性树脂上具有较好的吸附性能,虽然NKA-9树脂为极性树脂,但其吸附量和解吸率却低于AB-8树脂,可见树脂的平均孔径和比表面积等物理特性也能影响多酚类物质的吸附效果。综合考虑,AB-8树脂是最适合纯化核桃种皮多酚的树脂。
表1 大孔吸附树脂的吸附及解吸性能比较
Table 1 Comparison of adsorption and desorption properties of resins

树脂型号极性平均孔径/Å比表面积/(m2·g-1)粒径/mm吸附量/(mg·g-1)吸附率/%解吸率/%D101非极性90~100480~5500.3~1.2511.24±0.10b82.81±0.74c70.43±2.88bAB-8弱极性130~140480~5200.3~1.2512.75±0.11c79.38±0.80a72.35±2.11dHPD100非极性85~90650~7000.3~1.2511.38±0.04b83.82±0.30d68.66±1.94aNKA-9极性 155~165250~2900.3~1.2510.94±0.58a80.59±4.27b71.56±3.34c
注:同一列不同字母表示具有显著性差异(P<0.05)
2.2 大孔树脂的静态吸附动力学曲线
如图1所示,吸附开始的1 h 内核桃种皮多酚快速吸附至树脂内部,多酚的吸附率迅速上升至70%,继续振荡吸附2 h后树脂达到吸附饱和状态,吸附率
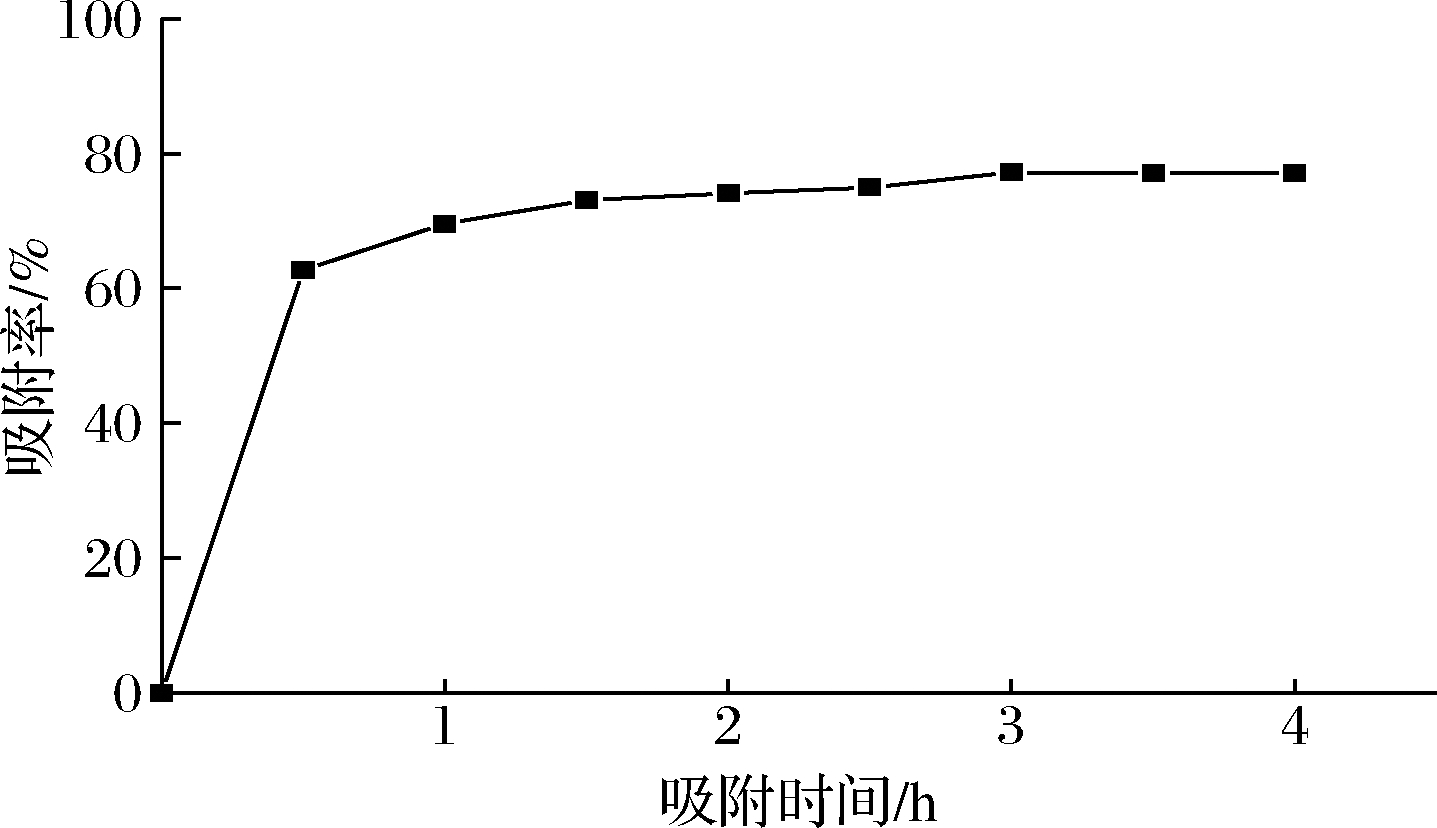
图1 AB-8树脂静态吸附动力学曲线
Fig.1 Adsorption kinetics curve of AB-8 resin
无明显变化。故选择3 h为最佳吸附时间。
2.3 上样液质量浓度对吸附效果的影响
如图2所示,核桃种皮多酚上样液质量浓度为2 mg/mL时,树脂的吸附率最大,可能是核桃种皮多酚上样液在低浓度时,树脂仍有吸附位点剩余,多酚可以迅速扩散至树脂内部;当上样液质量浓度>2 mg/mL时,AB-8树脂的吸附率随浓度升高呈下降趋势,可能是高浓度的上样液会使树脂内多酚类物质的扩散受到抑制,且上样液浓度越高,杂质越多,会阻塞多酚分子进入树脂,增大传质阻力,从而引起树脂吸附率下降。因此,核桃种皮多酚上样液质量浓度选择2 mg/mL为宜。
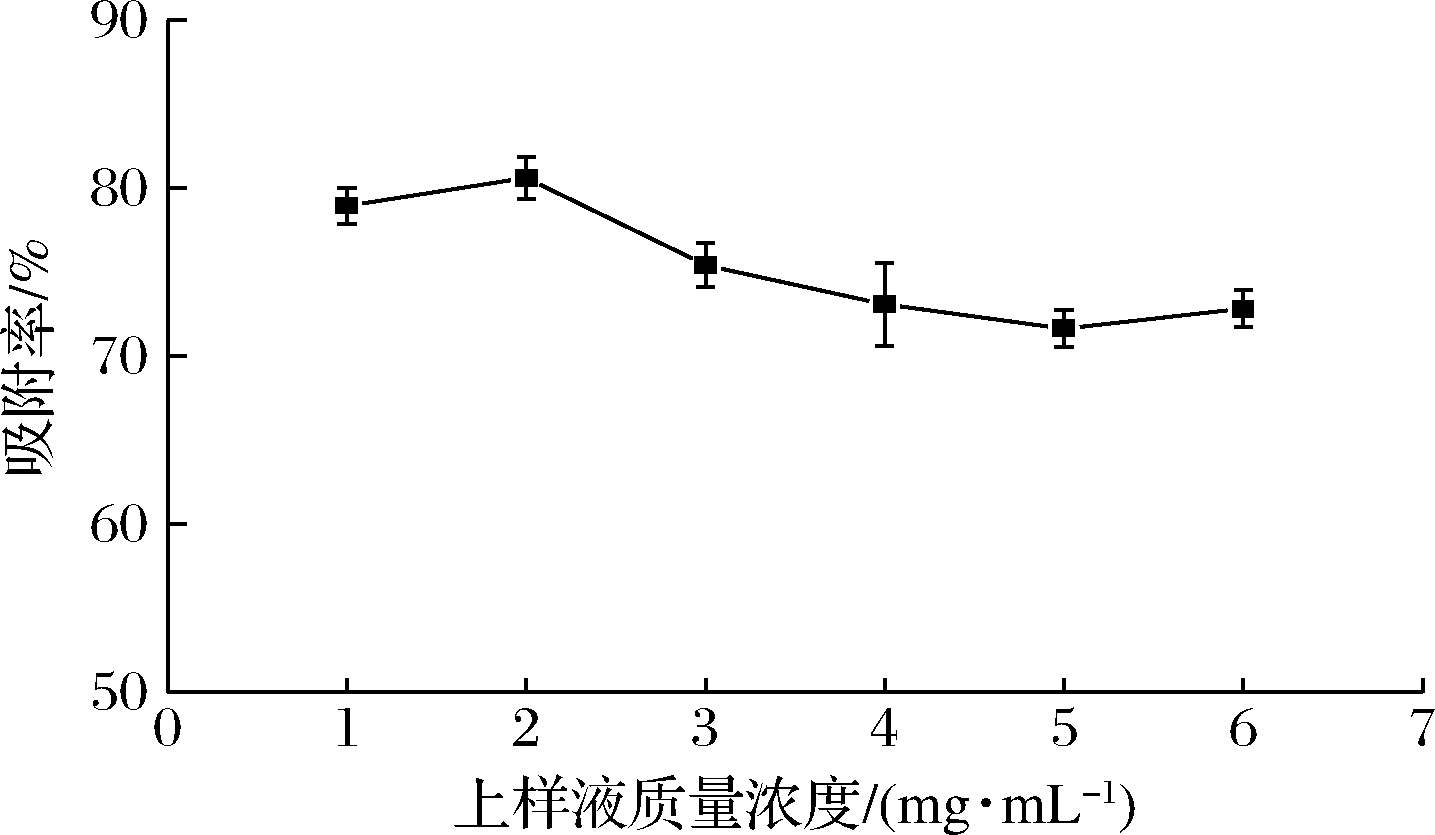
图2 上样液质量浓度对树脂吸附率的影响
Fig.2 Effect of walnut pellicle polyphenols concentration on adsorption rate
2.4 pH值对吸附效果的影响
如图3所示,树脂的吸附率随核桃种皮多酚上样液pH值的升高呈先上升后下降趋势,pH>3.0时,树脂的吸附率降低,表明酸性条件下能保持多酚的酚羟基结构,更有利于AB-8树脂对核桃种皮多酚的吸附。因此,核桃种皮多酚上样液最佳pH值为3.0。

图3 pH值对树脂吸附率的影响
Fig.3 Effect of pH value on the adsorption rate
2.5 乙醇浓度对解吸率的影响
多酚类物质一般具有一定的极性和亲水性,一般使用甲醇、乙醇及丙酮等作为树脂的解吸溶剂,实际加工利用中乙醇的安全性较高且成本低,因而选择乙醇溶液作为AB-8树脂的解吸液。如图4所示,AB-8树脂的解吸率随乙醇浓度的升高呈先上升后下降趋势,当乙醇溶液体积分数为70%时,核桃种皮多酚的解吸率最大。当乙醇体积分数>70%时,树脂解吸率
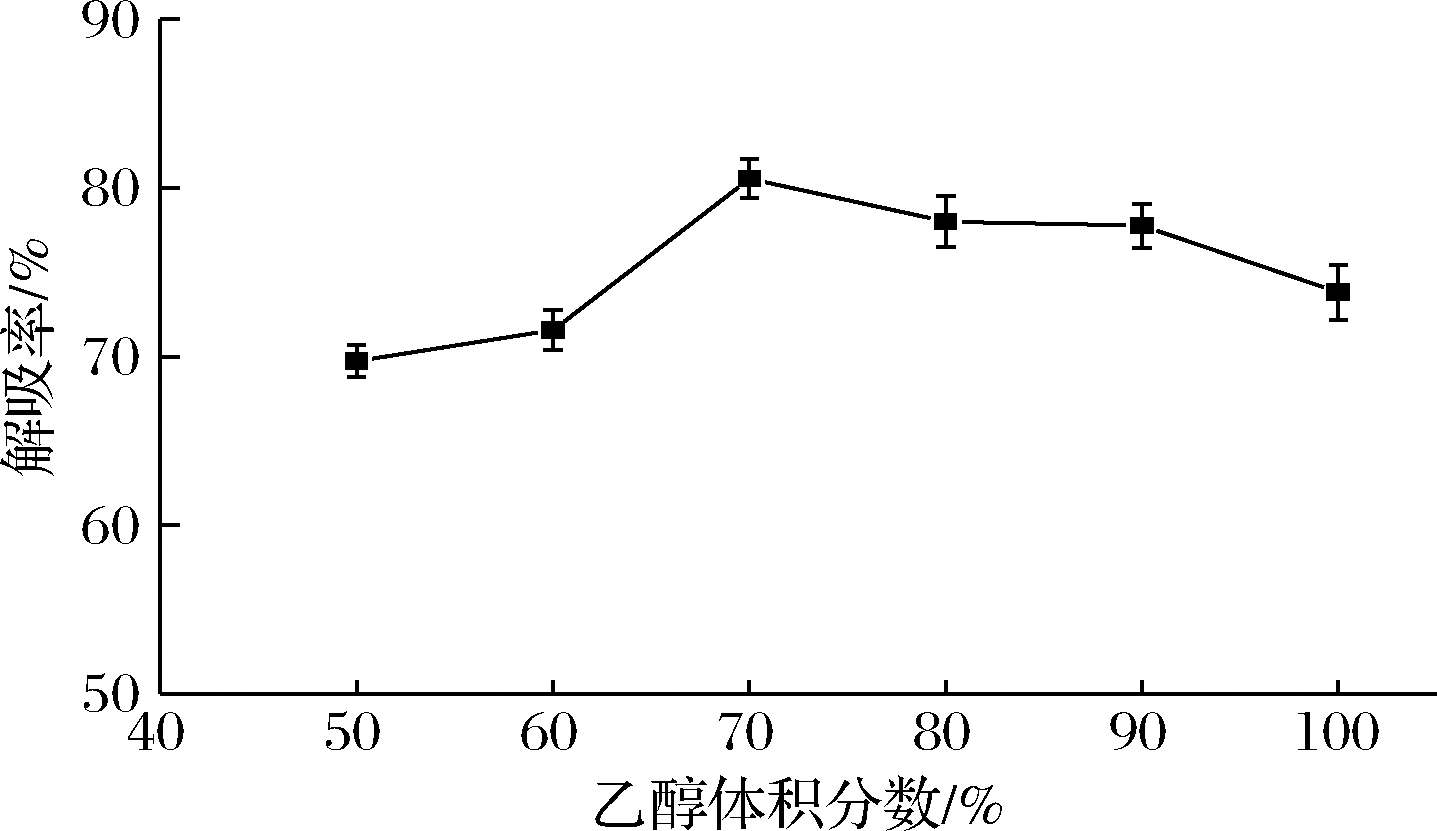
图4 乙醇浓度对树脂解吸率的影响
Fig.4 Effect of ethanol concentration on desorption rate
下降,可能是因为高浓度乙醇溶液的极性与多酚的极性相差较大,核桃种皮多酚在乙醇溶液中的溶解度变低。在工业生产中,乙醇浓度过高容易使其挥发加快,在实际生产中也很难控制,因此选择70%的乙醇溶液作为最适解吸溶液。
2.6 AB-8树脂动态吸附泄露曲线及洗脱曲线
树脂对目标物的吸附能力有限,当树脂吸附的目标物浓度到达一定量时,树脂对目标物的吸附作用会降低,进样液便从树脂柱上泄露。如图5所示,以pH值为3.0,质量浓度为2 mg/mL的核桃种皮多酚溶液进行动态吸附,上样14 BV时,流出液的多酚浓度可达到上样液浓度的10%,继续增加上样体积,流出液的多酚浓度快速升高,树脂的吸附能力降低,因此核桃种皮多酚的最大上样量为14 BV;如图6所示,用70%的乙醇溶液洗脱时,在1.5 BV时洗脱液多酚浓度达到最大,继续洗脱至流出液在280 nm下无紫外吸收,此时洗脱液用量为4 BV。综上可知,AB-8树脂在动态吸附条件下,最大上样量为14 BV,洗脱液用量为4 BV。
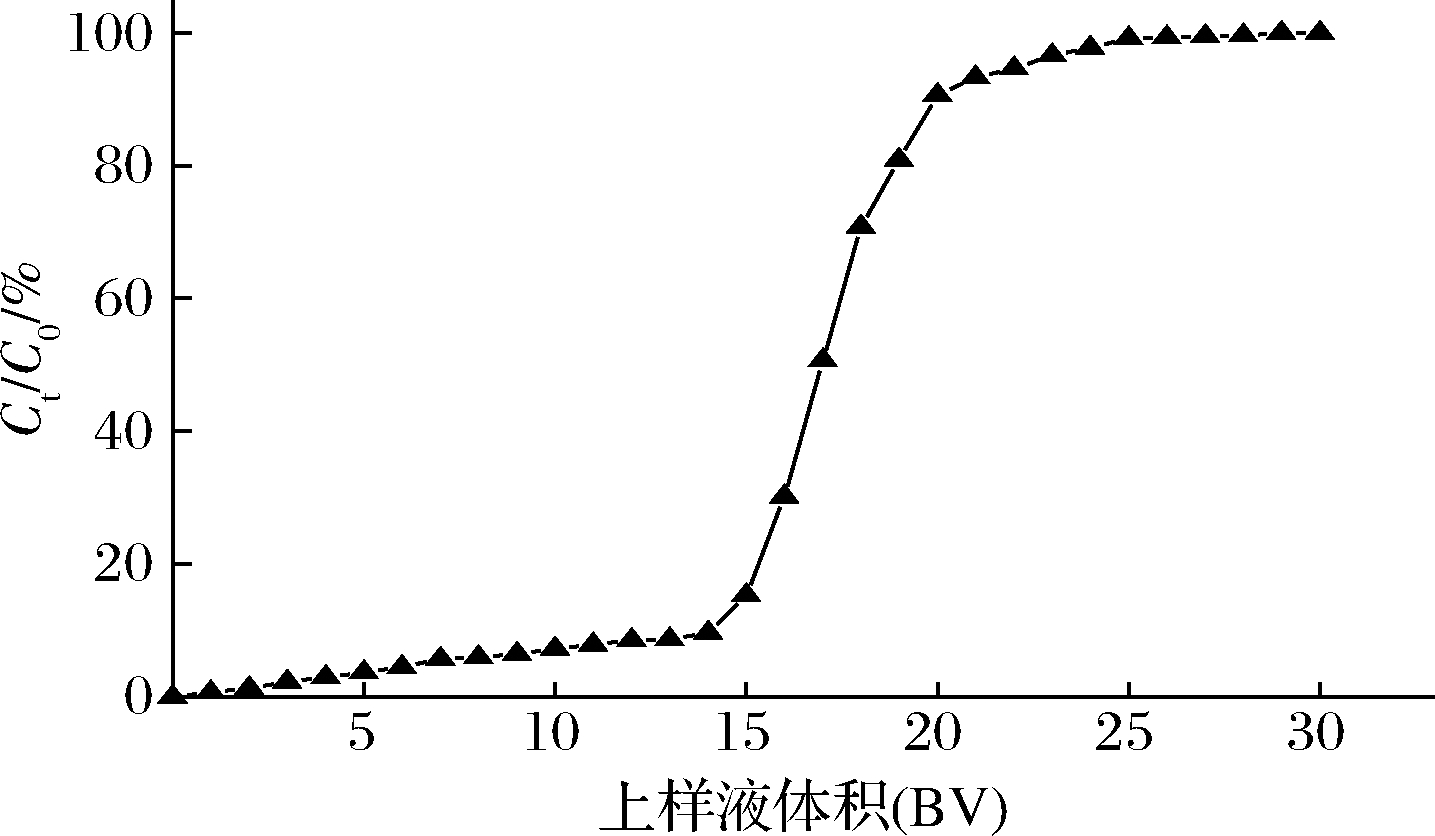
图5 核桃种皮多酚在AB-8树脂上的泄露曲线
Fig.5 Breakthrough curves of walnut pellicle polyphenols on AB-8 resins

图6 核桃种皮多酚在AB-8树脂上的洗脱曲线
Fig.6 Desorption curves of walnut pellicle polyphenols on AB-8 resins
2.7 核桃种皮多酚的组分鉴定
UPLC-TOF-MS/MS的分析表明,二级质谱比一级质谱专属性更强,对物质的鉴定更准确,在含有甲酸的流动相中,有利于核桃种皮中多酚类物质的鉴定。对核桃种皮多酚组分的鉴定结果如表2所示,主要是鞣花酸及其衍生物,其中包括含有六羟基联苯二甲酰基即鞣花酰基(hexahydroxydiphenoyl,HHDP)的鞣花单宁含量最丰富。
表2 核桃种皮多酚组分鉴定表
Table 2 Identification of walnut pellicle polyphenols

编号时间/min[M-H]-(m/z)MS2(m/z)分子式可能物质名称10.93481.07300.99 275.02C20H18O14鞣花酰基葡萄糖异构体21.15481.07300.99 275.02C20H18O14鞣花酰基葡萄糖异构体32.03783.06481.04 301.00 275.03C34H24O22二鞣花酰基葡萄糖42.15951.09907.08 783.07 481.11 301.00 275.02C41H28O27三没食子酰基鞣花酰基葡萄糖52.30951.06907.08 783.07 481.05 300.98 275.02C41H28O27三没食子酰基鞣花酰基葡萄糖62.59951.05907.08 783.07 481.07 300.98 275.01C41H28O27三没食子酰基鞣花酰基葡萄糖72.67951.10907.09 783.04 481.05 301.00 275.02C41H28O27三没食子酰基鞣花酰基葡萄糖82.72783.09481.06 300.99 275.02C34H24O22二鞣花酰基葡萄糖92.95951.12907.07 783.04 481.07 300.99 275.01C41H28O27三没食子酰基鞣花酰基葡萄糖102.97951.12907.09 783.07 300.98 275.02C41H28O27三没食子酰基鞣花酰基葡萄糖113.101 067.13951.07 907.08 783.04 533.06-Unknow123.49935.09783.06 633.07 481.11 301.00 275.01C41H28O26木麻黄素/木麻黄鞣亭异构体133.66951.05907.13 783.11 301.01C41H28O27三没食子酰基鞣花酰基葡萄糖143.79951.08907.07 783.04 300.99 275.01C41H28O27三没食子酰基鞣花酰基葡萄糖153.96951.06907.11 783.07 481.06 301.01 275.01C41H28O27三没食子酰基鞣花酰基葡萄糖164.01951.07907.07 783.04 301.00C41H28O27三没食子酰基鞣花酰基葡萄糖174.26933.07631.08 481.06 450.98 301.01C41H26O26Glansrin C异构体184.32933.08631.08 451.03 301.00C41H26O26Glansrin C 异构体194.42933.07631.07 481.06 301.00C41H26O26Glansrin C异构体204.67785.09301.00 275.03C34H26O22二没食子酰基鞣花酰基葡萄糖214.82933.07630.99 481.07 451.00 301.00C41H26O26Glansrin C 异构体224.85433.04301.03C19H14O12鞣花酸戊糖异构体234.98933.10481.02 451.00 300.99C41H26O26Glansrin C 异构体245.30300.99257.01 229.00 185.00 169.00C14H6O8鞣花酸255.40787.09617.07 169.00125.02C34H28O22四没食子酰基葡萄糖265.53933.08631.02 301.01C41H26O26Glansrin C 异构体275.62933.07631.11 301.01 451.04C41H26O26Glansrin C 异构体285.90933.06451.36 301.00C41H26O26Glansrin C 异构体296.64592.20403.16 343.14 241.09 197.11C28H35NO13Glansreginin A307.01463.08300.98 125.02C20H16O13鞣花酸己糖异构体317.09935.13301.01C41H28O26木麻黄素/木麻黄鞣亭异构体
如图7所示,峰1和峰2给出准分子离子m/z为481[M-H]-和碎片离子m/z 300.99(M-H-180,葡萄糖丢失),m/z 300.99为鞣花酸的分子离子峰与文献[16]报道一致,初步鉴定为鞣花酰基葡萄糖异构体。峰3和峰8给出准分子离子m/z为783,在m/z 481(M-H-302,HHDP丢失)和m/z 301(M-H-481,HHDP-葡萄糖丢失)处产生主要片段离子,这种碎裂方式可能是二鞣花酰基葡萄糖,已被报道为核桃中主要的鞣花单宁之一[17]。在一级质谱中,峰4、峰5、峰6等多个出峰位置均鉴定出m/z为951准分子离子,二级质谱中还检测到m/z 907、783(M-H-168,没食子酸损失)、481(M-H-469,三没食子酰基丢失)、301和275的碎片,该物质可能是三没食子酰基鞣花酰基葡萄糖[2]。峰12给出准分子离子m/z为935和碎片离子m/z 301和275,该物质可能为木麻黄素或木麻黄鞣亭异构体,与文献[18]鉴定结果一致。在m/z为933处的物质被鉴定为Glansrin C异构体,在m/z 631(M-H-301,HHDP丢失)、m/z 481(M-452,三没食子酰基团丢失)、m/z 451(M-482,HHDP-葡萄糖丢失)和m/z 301处可鉴定出主要的MS2片段。

图7 核桃种皮多酚负离子模式总离子流图
Fig.7 Total ion current diagram of walnut pellicle polyphenol in negative ion mode
峰24可能为鞣花酸,因鞣花酸在负离子模式扫描时失去1个H,产生m/z 300.99分子离子峰,在m/z 257(M-44,CO2丢失)、229(M-44-28,CO2和CO丢失)和185(丢失2个CO2和1个CO)处产生碎片离子,与文献[19]报道一致。此外,m/z分别为463和433的物质分别可能为鞣花酸己糖异构体和鞣花酸戊糖异构体,二者均在m/z 300.99处产生离子碎片[13]。
在MS2质谱的基础上,[M-H]-在m/z 592处,MS2片段在403、343、241和197处的化合物可能为Glansreginins A,与文献[19-20]报道一致。峰20给出准分子离子m/z为785,在m/z 301和275处产生主要碎片离子,这种碎裂模式可能是二没食子酰基-鞣花酰基-葡萄糖[19]。峰25给出准分子离子m/z为787,在m/z 617、169和125处产生主要碎片离子,这种碎裂模式可能是四没食子酰基葡萄糖[19]。此外,大量文献报道核桃中还含有绿原酸、丁香酸、没食子酸、咖啡酸、阿魏酸、槲皮素和儿茶素等多种单体酚酸及其衍生物,可能是由于核桃原料的来源和基因存在差异,致使本文鉴定出的核桃种皮多酚种类与相关文献报道存在差异[21]。
3 结论
试验筛选出AB-8树脂是最适合富集核桃种皮多酚的树脂,静态吸附的最佳工艺为:上样液质量浓度2 mg/mL,pH 3.0,吸附时间3 h,解吸液为体积分数70%的乙醇溶液,动态吸附最大上样量为14 BV,洗脱液用量为4 BV,此工艺可使核桃种皮多酚纯度提高至纯化前的2.91倍。UPLC-TOF-MS/MS鉴定出核桃种皮多酚组分主要为鞣花酸、鞣花酰基葡萄糖异构体、二鞣花酰基葡萄糖、三没食子酰基鞣花酰基葡萄糖、四没食子酰基葡萄糖、木麻黄素/木麻黄鞣亭异构体、Glansrin C 异构体、鞣花酸己糖异构体、鞣花酸戊糖异构体及Glansreginin A等30种多酚组分。本文对酸性乙醇超声提取的核桃内种皮多酚进行了大孔吸附树脂富集探索,筛选出能保留鞣花酸及其衍生物等主要功效成分的初步分离方法,可为核桃种皮多酚的开发提供新的指引。
[1] 陈勤, 李磊珂, 吴耀.核桃仁的成分与药理研究进展[J].安徽大学学报(自然科学版), 2005, 29(1):86-89.
CHEN Q, LI L K, WU Y.Progress of research on the chemical components and pharmaceutical action of walnut kernel[J].Journal of Anhui University (Natural Sciences), 2005, 29(1):86-89.
[2] REGUEIRO J, S NCHEZ-GONZ
NCHEZ-GONZ LEZ C, VALLVERD
LEZ C, VALLVERD -QUERALT A, et al.Comprehensive identification of walnut polyphenols by liquid chromatography coupled to linear ion trap-Orbitrap mass spectrometry[J].Food Chemistry, 2014, 152:340-348.
-QUERALT A, et al.Comprehensive identification of walnut polyphenols by liquid chromatography coupled to linear ion trap-Orbitrap mass spectrometry[J].Food Chemistry, 2014, 152:340-348.
[3] LABUCKAS D O, MAESTRI D M, PERELL M, et al.Phenolics from walnut (Juglans regia L.) kernels:Antioxidant activity and interactions with proteins[J].Food Chemistry, 2008, 107(2):607-612.
M, et al.Phenolics from walnut (Juglans regia L.) kernels:Antioxidant activity and interactions with proteins[J].Food Chemistry, 2008, 107(2):607-612.
[4] 王克建, 齐建勋, 胡小松, 等.多酚对核桃仁食用品质影响的初步研究[J].食品科学, 2006, 27(5):95-97.
WANG K J, QI J X, HU X S, et al.Study on effect of polyphenols on astringency quality of walnut kernel[J].Food Science, 2006, 27(5):95-97.
[5] BOULEKBACHE-MAKHLOUF L, MEUDEC E, MAZAURIC J P, et al.Qualitative and semi-quantitative analysis of phenolics in Eucalyptus globulus leaves by high-performance liquid chromatography coupled with diode array detection and electrospray ionisation mass spectrometry[J].Phytochemical Analysis, 2013, 24(2):162-170.
[6] VINSON J A, CAI Y X.Nuts, especially walnuts, have both antioxidant quantity and efficacy and exhibit significant potential health benefits[J].Food & Function, 2012, 3(2):134-140.
[7] 刘旻昊, 齐娜, 邓红, 等.新疆红肉苹果多酚的纯化、组成分析与抗氧化活性[J].食品工业科技, 2019, 40(12):38-44;50.
LIU M H, QI N, DENG H, et al.Purification, composition analysis and its antioxidant activity of polyphenols from red-flesh apple of Xinjiang[J].Science and Technology of Food Industry, 2019, 40(12):38-44;50.
[8] GUO C X, QIAO J P, ZHANG S W, et al.Purification of polyphenols from kiwi fruit peel extracts using macroporous resins and high-performance liquid chromatography analysis[J].International Journal of Food Science & Technology, 2018, 53(6):1 486-1 493.
[9] 张旭, 陈丹, 曹丽娟, 等.5种大孔树脂纯化鲜核桃青皮汁多酚工艺的比较[J].中成药, 2016, 38(8):1 852-1 855.
ZHANG X, CHEN D, CAO L J, et al.Comparison of five kinds of Macroporous resins for purification of polyphenols in walnut green husk peel juice[J].Chinese Traditional Patent Medicine, 2016, 38(8):1 852-1 855.
[10] 徐佳. 核桃外果皮多酚提取纯化及抗氧化活性研究[D].乌鲁木齐:新疆农业大学, 2012.
XU J.Study on the extraction, identification and antioxidant activity of polyphenols from walnut husk[D].Urumqi:Xingjiang Agricultural University, 2012.
[11] 赵聪. 核桃种皮多酚的提纯鉴定及抗氧化活性研究[D].天津:天津科技大学, 2016.
ZHAO C.Purifocation, identification and antioxidant activity of polyphenols from walnut kernel pellicle[D].Tianjin:Tianjin University of Science & Technology, 2016.
[12] LIU P Z, LI L L, SONG L J, et al.Characterisation of phenolics in fruit septum of Juglans regia Linn.by ultra performance liquid chromatography coupled with Orbitrap mass spectrometer[J].Food Chemistry, 2019, 286:669-677.
[13] ZHANG Y G, KAN H, CHEN S X, et al.Comparison of phenolic compounds extracted from Diaphragma juglandis fructus, walnut pellicle, and flowers of Juglans regia using methanol, ultrasonic wave, and enzyme assisted-extraction[J].Food Chemistry, 2020, 321:126672.
[14] 李笑笑. 核桃内种皮多酚的提取及核桃油与核桃蛋白粉的稳定性研究[D].无锡:江南大学, 2017.
LI X X.Study on polyphenol extration from walnut kernel skin and stability of walnut oil and walnut protein powder[D].Wuxi:Jiangnan University, 2017.
[15] 甘芝霖, 倪元颖, 郭悦, 等.大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J].农业工程学报, 2015, 31(24):298-306.
GAN Z L, NI Y Y, GUO Y, et al.Separation and purification of rosehip polyphenols by macroporous resin and its antioxidant activity[J].Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(24):298-306.
[16] 王克建, 杜明, 胡小松, 等.核桃仁中多酚类物质的液相/电喷雾质谱分析[J].分析化学, 2009(6):867-872.
WANG K J, DU M, HU X S, et al.Identification of phenolic compounds in walnut (Juglans regia L) seeds by high performance liquid chromatography electrospray ionization mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2009(6):867-872.
[17] WANG X Q, CONTRERAS M D M, XU D M, et al.New insights into free and bound phenolic compounds as antioxidant cluster in tea seed oil:Distribution and contribution[J].LWT, 2021, 136:110315.
[18] LIU R X, ZHAO Z Y, DAI S J, et al.Identification and quantification of bioactive compounds in Diaphragma juglandis fructus by UHPLC-Q-orbitrap HRMS and UHPLC-MS/MS[J].Journal of Agricultural and Food Chemistry, 2019, 67(13):3 811-3 825.
[19] SLATNAR A, MIKULIC-PETKOVSEK M, STAMPAR F, et al.Identification and quantification of phenolic compounds in kernels, oil and bagasse pellets of common walnut (Juglans regia L.)[J].Food Research International, 2015, 67:255-263.
[20] GRACE M H, YOUSEF G G, GUSTAFSON S J, et al.Phytochemical changes in phenolics, anthocyanins, ascorbic acid, and carotenoids associated with sweetpotato storage and impacts on bioactive properties[J].Food Chemistry, 2014, 145:717-724.
[21] KAFKAS E, ATTAR S H, GUNDESLI M A, et al.Phenolic and fatty acid profile, and protein content of different walnut cultivars and genotypes (Juglans regia L.) grown in the USA[J].International Journal of Fruit Science, 2020, 20(sup3):S1711-S1720.