滇橄榄(Phyllanthus emblica Linn.)又称余甘子、印度醋栗、庵摩勒等,是大戟科叶下珠属的药食同源植物[1];其新鲜果实口感清脆,初尝酸涩但回甘生津,风味独特。滇橄榄具有抗氧化、抗癌、抗菌、抗病毒、降血脂、降胆固醇、降血糖、降血压、改善记忆、延缓衰老等多种功效,这些功效与滇橄榄果肉中丰富的酚类化合物、维生素C、碳水化合物及氨基酸等营养成分有关[2-4]。
即饮功能性还原果汁是热门的饮料产品,滇橄榄果汁含有丰富的抗氧化多酚及维生素C,具有开发为功能性即饮果汁的潜力。工业上浓缩果汁的制作过程是将果实压榨、杀青、浓缩、包装、贮藏、运输,在商店稀释还原成即饮果汁供消费。滇橄榄果汁杀青后在冷冻贮藏过程中相当稳定,但在还原成即饮果汁供应消费的短期贮藏过程中并不稳定,容易发生沉淀及褐变现象,其沉淀现象可能与特定多酚(如单宁)、特定有机酸或蛋白质等组成[5-7]有关;其褐变主要为非酶褐变,在低温或常温贮藏的情况下,主要为多酚化学性的氧化缩合反应[8-9]和维生素C降解反应[10],产生褐色副产物5-羟甲基糠醛或糖类-蛋白质反应的美拉德产物。
控制杀青后的滇橄榄还原果汁的短期贮藏过程中的褐变及沉淀现象是相当重要的研究主题,采取低成本、可行性高且多重工艺组合是必然的策略。对富含多酚的果汁饮料而言,降低褐变或沉淀的工艺单元操作包括:沉淀剂处理、冷沉淀处理、酶(例如果胶酶、蛋白酶和单宁酶)处理等[7,11-12],然而目前尚未见有效控制滇橄榄还原果汁的褐变与沉淀的多重工艺流程的研究报告,更未见完整解析控制其褐变的机理和关键多酚组成的相关文献。
因此,本研究目的在探讨降低褐变程度的复合工艺技术(包括酶、沉淀剂、冷沉淀预处理和冷藏等),以褐变动力学解析去沉淀处理后果汁的褐变速率和半数贮藏时间,并结合高效液相色谱分析法(HPLC)及统计学上主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA),系统性阐明控制该果汁褐变的机理与关键多酚组成分。
1 材料与方法
1.1 材料和设备
材料:滇橄榄果汁浓缩汁(已经杀青不活化多酚氧化酶),云南猫哆哩集团食品有限责任公司;果胶酶(S10007,CAS#9032-75-1,500 U/mg)、单宁酶(S10207,CAS#9025-71-2,200 U/g)、没食子酸、没食子酸甲酯、鞣料云实素,上海源叶生物科技有限公司;木瓜蛋白酶(CAS#9001-73-4,>6 000 U/mg),上海沃凯化学试剂有限公司;CaCl2,国药集团化学试剂有限公司;甲酸,上海化学泰坦有限公司;甲醇,上海安普实验科技股份有限公司。
设备:JXN-26离心机,BECKMAN COULTER公司;752型紫外分光光度计,上海光谱仪器有限公司;CR-400色差仪,KONICA公司;Waters e2695高效液相色谱,沃特世科技(上海)有限公司。
1.2 试验方法
1.2.1 滇橄榄还原果汁的制备
将浓缩果汁稀释3倍制备成还原果汁,将还原果汁分装,进行下列4种工艺流程,如图1所示。

图1 滇橄榄还原果汁的不同前处理工艺与贮藏条件的流程
Fig.1 Flow charts for various treatments and storage conditions of restored juice from Phyllanthus emblica Linn.fruit 注:“+” 表示添加;“-” 表示未添加
流程Ⅰ为空白组,还原果汁加或不加沉淀剂(0.05% CaCl2)3 h后,离心(6 000 r/min,10 min),取上清液进行抽滤(定性滤纸102号),所得滤液装入螺盖玻璃试管中(50 mL/管)密封,分两组在4 ℃冰箱或室温下贮藏。流程Ⅱ为添加单一酶,加或不加沉淀剂处理组,即还原汁每管先加一种酶(0.01% 质量分数;即果胶酶50 U/g、蛋白酶>600 U/g、单宁酶0.02 U/g),而后加或不加沉淀剂处理3小时后,离心、过滤及贮藏(同流程Ⅰ)。流程Ⅲ为添加单一酶,加或不加沉淀剂,均进行冷沉淀处理组,即在流程Ⅱ的基础上,沉淀剂处理之后、离心之前进行冷藏促进沉淀(4 ℃、72 h)并离心去除沉淀物。流程Ⅳ为加复合酶,加维生素C,加或不加沉淀剂,均进行冷沉淀处理组,即在流程Ⅲ的基础上,冷沉淀之前加维生素C(0.01%质量分数,下同),贮藏时采用4 ℃、室温(25 ℃)和37 ℃ 3种;复合酶为果胶酶/蛋白酶、果胶酶/单宁酶、蛋白酶/单宁酶或果胶酶/蛋白酶/单宁酶,各种酶的活性同流程I。各流程的各组均两组平行制备与测定。
1.2.2 褐色指标的测定
将滇橄榄果汁1 mL以去离子水稀释5倍之后,于420 nm处的测定吸光度(A420),A420反映褐变程度,简称为褐色指标[5,13]。
1.2.3 褐变速率的计算
杀青后的果汁和贮藏过程中的多酚产生化学性氧化褐变反应[14]、维生素C的降解与美拉德反应引起的褐变[15-18]皆呈一级反应模型,即褐变产物的生成速率为反应物浓度的一级反应,如方程式(1)[19]所示。
![]() =k·Ct
=k·Ct
(1)
式中:Ct,t时间点的反应物浓度;k,反应速率常数,d-1,与温度有关。因此合理地假设富含多酚、维生素C与糖类的滇橄榄还原果汁在短期保藏下的初期褐变现象为一级反应,褐变中间反应物即为中间产物,而且在适当低浓度下,褐色指标(A420)与褐色物质浓度呈正比[20]。因此可将A420代替浓度代入方程式(1),简化并重整得方程式(2)~(3)[19,21]。将kB代入方程式(4)可求得半褐变时间(t1/2),d。
![]() =kB·At
=kB·At
(2)
(3)
t1/2=ln2/kB
(4)
式中:A0、At,0和t d的褐变值;kB,以褐变值为指标的反应速率常数,d-1,即ln(At/A0)对时间t作图的斜率;t1/2,半褐变时间,d。动力学分析的数据为4次平行测定的结果,以减少操作和环境误差。
1.2.4 色差值的测定
将滇橄榄果汁1 mL以去离子水稀释5倍之后,取样品溶液5 mL于色差仪CR-400中测量CIE色值(L*, a*, b*), 校正白板色度为L=95.22;a=-0.48;b=3.50;测定温度为室温。
1.2.5 多酚组成的分析
采用HPLC进行鉴定,流动相A为体积分数0.4%甲酸水溶液,流动相B为甲醇,色谱柱Waters XSelect CSH C18(4.6 mm×150 mm×3.5 μm),紫外检测波长280 nm,柱温25 ℃,进样量10 μL,流速0.35 mL/min。梯度洗脱条件:0~6 min,0%~7% B;6~26 min,7%~30% B;26~51 min,30%~80% B;51~60 min,80%~90% B。以Empower软件进行图谱处理。滇橄榄原汁取上清液,加体积分数为90%甲醇稀释100倍后进行分析。标准品没食子酸、没食子酸甲酯和鞣料云实素分别配制为10~250、10~18和10~200 μg/mL的标准溶液进行分析。平行测定3次。所得制标准曲线,得回归方程为:没食子酸Y=81 888X-283 060,R2= 0.999;没食子酸甲酯Y=86 756X-124 285,R2=1.000;鞣料云实素Y=56 540X-319 305,R2=0.996,其中X为标准品质量浓度(μg/mL),Y为峰面积。
1.2.6 数据处理与绘图
利用Excel 2019进行数据平均、线性回归分析,求得反应速率常数和级数。SPSS 25中的ANOVA对数据进行方差分析。采用Origin pro 8.0进行绘图和聚类分析。采用SIMCA 14.1进行PCA和OPLS-DA。
2 结果与讨论
2.1 单一酶、沉淀剂、预冷沉淀处理与贮藏温度对滇橄榄还原汁的沉淀与色泽的影响
表1显示工艺流程I、II和III所探讨的工艺因素(酶、沉淀剂、冷沉淀)以及贮藏温度对还原果汁沉淀与色泽的影响,特别观察贮藏8~24 d的现象。在无冷沉淀处理下:4 ℃保藏组(第1~8组)在保藏24 d时仍维持原汁的澄清金黄色,L*值为82.97~86.08、a*为-2.26~-1.37、b*为23.98~29.05、褐色指标(A420)为0.573~0.686;有沉淀剂(0.05% CaCl2)组比无沉淀剂组产生明显较多的沉淀量;且果胶酶和蛋白酶组,加沉淀剂比不加沉淀剂具有较低的b*值与褐色指标。无冷沉淀处理的室温保藏组(第9~16组),保藏24 d后的果汁呈黄铜色,L*值为54.19~77.03、a*值为0.81~5.52、b*值为37.42~44.35,褐色指标高达1.683~≥3.000。果胶酶和蛋白酶处理组(除第12组外)的褐色指标低于空白组;单宁酶处理组比其他组具有明显多的沉淀量、较深的褐色(较低L*值、较高a*和b*值)以及极高的褐色指标。当加上冷沉淀(4 ℃、72 h) 处理并去除沉淀物后的室温保藏组(第17~24组),保藏到第8天的沉淀量大部分都高于没有冷沉淀的室温保藏组(第9~16组,但第20和24组除外),色泽呈金黄色,L*、a*与b*值介于无冷沉淀处理的4 ℃和室温保藏组之间。相较于上述没有冷沉淀处理的室温保藏组,冷沉淀处理可使大部分组(第17、20、22~24组)的褐色指标明显地降低。且对于果胶酶和蛋白酶组,加沉淀剂比不加沉淀剂呈现了较低的b*值与褐色指标。
表1 沉淀剂、酶、冷沉淀以及贮藏温度对滇澉榄还原果汁的沉淀程度、色差值及褐色指标1的影响
Table 1 Effects of precipitants, single enzymes, cold-precipitation, and storage temperature on the precipitation, colorimetric parameters, and browning index of restored juice from P. emblica fruit

编号处理条件酶沉淀剂冷沉淀保藏温度沉淀2色差值3L∗a∗b∗褐色指标4A4201空白无无4 ℃+85.93-1.5627.040.6702空白有无4 ℃++83.01-1.3726.170.6603果胶酶无无4 ℃+85.22-1.7327.930.6864果胶酶有无4 ℃++85.12-2.1124.950.5905蛋白酶无无4 ℃+83.93-2.2626.460.6386蛋白酶有无4 ℃+++85.82-1.4623.980.5737单宁酶无无4 ℃+82.97-1.7827.350.6748单宁酶有无4 ℃+++++86.08-2.1729.050.6849空白无无室温+73.971.5238.131.82410空白有无室温+77.030.8137.421.74511果胶酶无无室温+74.172.1139.11.76912果胶酶有无室温+74.932.5639.012.097
续表1

编号处理条件酶沉淀剂冷沉淀保藏温度沉淀2色差值3L∗a∗b∗褐色指标4A42013蛋白酶无无室温+75.131.2538.921.72114蛋白酶有无室温+75.001.0238.131.68315单宁酶无无室温+++54.195.5244.35≥3.00016单宁酶有无室温+++55.272.7041.47≥3.00017空白无有室温++80.62-1.0031.061.18018空白有有室温++81.23-0.4435.272.30119果胶酶无有室温++80.48-0.0638.22.22220果胶酶有有室温-80.37-0.4937.151.44421蛋白酶无有室温++79.50-0.0736.962.09122蛋白酶有有室温++83.88-0.8432.891.10823单宁酶无有室温++77.140.4940.912.04624单宁酶有有室温-77.410.4540.352.301
注:1 新鲜还原汁的褐变值为1.066;2 第8天观察沉淀量,-无,+ 轻微,++少量,+++ 中量,++++ 大量;3 第17天测定上清液的色差值;4第24天测定还原汁的A420值
将表1结果进行聚类分析,结果如图2所示,其中1~8组可分为一大类,保藏温度均为4 ℃;15、16组为一大类,均添加单宁酶、无冷沉淀且室温保藏,有无添加沉淀剂不影响分类,即沉淀剂的作用不显著;其他组为一大类,保藏温度皆为室温,并可细分为9~14和23~24组小类以及17~22组小类。此聚类分析结果说明,影响滇橄榄汁还原果汁色泽与褐变的工艺操作的重要性是:保藏温度>冷沉淀和单宁酶处理>沉淀剂处理。果胶酶或蛋白酶处理须配合4 ℃保藏才有控制褐变的效果;添加单宁酶反而促进褐变和沉淀,不宜采用。冷沉淀配合离心去沉淀的处理有利于降低褐变。沉淀剂(0.05% CaCl2)的添加只对冷藏时的沉淀作用有促进效果,但对色泽无明显影响。

图2 不同工艺流程处理的滇橄榄还原果汁的聚类分析图
Fig.2 Cluster analysis of various restored juices from P. emblica fruit subjected to various processes
2.2 复合酶、冷沉淀处理与贮藏温度多重条件对滇橄榄还原果汁沉淀与色泽的影响
澄清工艺流程IV综合探讨添加复合酶与维生素C(0.01%)、冷沉淀处理和保藏温度对滇橄榄汁在短期保藏过程中沉淀与褐色指标的影响。表2显示4种复合酶组在没有冷沉淀并离心去沉淀处理时(第C1~C4组),保藏后仍有明显的沉淀现象,褐色指标为0.121~0.125 (4 ℃保藏),0.192~0.245(25 ℃保藏)或0.528~0.576 (37 ℃保藏)。而冷沉淀并离心去沉淀处理时(第C5~C8组),保藏期的沉淀程度明显减少,且25和37 ℃保藏组的褐色指标亦明显低于无冷沉淀处理组。
表2 复合酶与维生素C并冷沉淀处理对滇橄榄还原果汁在14 d保藏后沉淀与褐色指标的影响
Table 2 Effects of multiple enzymes, vitamin C, and cold-precipitation treatments on the precipitation and browning index of restored juice from P. emblica fruit after 14-day storage

编号处理条件4 ℃保藏25 ℃保藏37 ℃保藏冷沉淀复合酶2沉淀3褐色指标沉淀褐色指标沉淀褐色指标C1无果+蛋++0.125±0.008+0.192±0.003++0.528±0.011C2无果+单++0.124±0.009+0.245±0.011++0.549±0.040C3无蛋+单++0.121±0.017+0.241±0.001++0.545±0.018C4无果+蛋+单++0.121±0.007+0.220±0.016+++0.576±0.010C5有果+蛋-0.115±0.026-0.166±0.002+0.317±0.062C6有果+单-0.133±0.002-0.179±0.013+0.388±0.056C7有蛋+单-0.132±0.003-0.184±0.005+0.391±0.065C8有果+蛋+单+0.127±0.005-0.166±0.003+0.359±0.024
注:1还原汁在0 d時初始褐色指标为(0.148±0.011);2果=果胶酶,蛋=蛋白酶,单=单宁酶;3代号:-无,+轻微,++少量,+++中量
表3显示所有4 ℃保藏组的L*,a*和b*值变化范围分别为85.2~88.1,-1.89~-0.90和22.0~25.0;所有25 ℃保藏组的L*,a*和b*值变化范围分别为80.1~86.5,-1.50~0.07和26.1~36.2;而所有37 ℃保藏组的L*,a*和b*值变化范围分别为56.3~74.1, 7.0~22.4和39.8~46.2。4 ℃保藏的样品皆呈澄清金黄色,37 ℃保藏组呈金黄色,25 ℃保藏组介于两者之间。色差值的变化趋势与褐色指标(表2)一致,其褐色指标明显低于表1的试验组,可能因为添加维生素C具有抑制多酚褐变的效果,以及表2试验组的贮藏时间较短。
表3 复合酶与维生素C并冷沉淀处理对滇橄榄还原汁在14天保藏后色差值的影响
Table 3 Effects of multiple enzymes, vitamin C, and cold-precipitation treatments on the colorimetric parameters of restored juice from P. emblica fruit after 14-day storage

编号4 ℃组25 ℃组37 ℃组L∗a∗b∗L∗a∗b∗L∗a∗b∗C187.1±1.8-1.89±0.6225.0±0.483.7±1.6-0.57±0.8530.1±0.857.0±0.421.4±0.143.4±0.1C287.8±1.8-1.56±0.1024.4±0.880.1±3.10.07±0.1933.1±0.756.6±1.221.7±0.545.5±0.2C387.4±0.6-1.62±0.1325.0±0.480.4±0.4-0.19±0.2636.2±3.558.2±1.520.2±0.845.4±0.2C488.1±1.1-1.72±0.324.8±0.481.8±0.3-0.13±1.5835.9±5.456.3±1.222.4±1.146.2±0.5C586.9±2.4-1.49±0.6322.0±3.486.5±2.8-1.50±0.4826.1±4.674.1±2.47.0±2.339.8±4.1C685.2±0.7-0.90±0.0624.2±0.884.6±1.2-1.14±0.4731.1±0.170.0±1.810.4±1.743.6±1.2C785.3±0.5-1.18±0.0424.7±0.184.2±0.9-0.82±0.0730.1±1.270.3±2.310.4±1.943.8±2.7C885.5±0.9-1.27±0.5724.2±0.484.9±0.5-0.68±0.6228.6±0.370.8±0.79.5±0.242.5±0.4
2.3 滇橄榄还原果汁色泽的PCA和OPLS-DA
为了分析不同处理条件对果汁色泽(褐变指标、L*、a*和b*)的重要性,将表2和表3的数据进行PCA和OPLS-DA,预测结果列于图3。图3-a PCA结果显示,4 ℃样品组集中在第二象限,25 ℃组分散在第二、三和四象限,而37 ℃组分两群集中在第一和第四象限,PC1可解释96.7%的数据变化,而PC2只能解释3.2%。由图3-a可知,25和37 ℃组的组内差异较大,PCA的PC1和PC2两主成分不足以对25和37 ℃组作清晰的聚类描述,即未能找出最关键的2个主成分因子,可能因不同条件因素之间有交互作用所致。将上述PCA结果作为基础,进行有监督模式的OPLS-DA,所得结果如图3-b~图3-d所示。图3-b清楚地显示OPLS-DA得分图可将4、25和37 ℃样品组清晰的聚类,4 ℃组集中在第四象限,25 ℃组主要集中在第一象限,37 ℃组集中在第三象限;此OPLS-DA模型可解释97.1%数据变化,其中OPLS-DA1(预测主成分)占95.6%,说明3组之间差异很大;而OPLS-DA2(正交主成分)仅占1.5%,说明组内差异很小。当拟合优度![]() 响应变量方差分数
响应变量方差分数![]() 和预测能力(Q2)的值越接近1时,OPLS-DA模型的有效性越强,
和预测能力(Q2)的值越接近1时,OPLS-DA模型的有效性越强,![]() 和Q2=0.712,因此,该模型具有较强的有效性。
和Q2=0.712,因此,该模型具有较强的有效性。![]() 表示所有组件可以对数据集中97.1%的变化进行建模。主成分1上区分样本贡献比较大的指标为b*,主成分2上为保藏条件4和25 ℃。对OPLS-DA需要进行置换检验对模型进行验证。图3-c为对模型进行置换检验(200次排列实验)分析的结果,横坐标为置换保留度[最右侧的点对应的是原始模型的
表示所有组件可以对数据集中97.1%的变化进行建模。主成分1上区分样本贡献比较大的指标为b*,主成分2上为保藏条件4和25 ℃。对OPLS-DA需要进行置换检验对模型进行验证。图3-c为对模型进行置换检验(200次排列实验)分析的结果,横坐标为置换保留度[最右侧的点对应的是原始模型的![]() 和Q2(0.712)],纵坐标上的2个截距分别代表Y置换后模型的
和Q2(0.712)],纵坐标上的2个截距分别代表Y置换后模型的![]() (0.040 9)和Q2′(-0.356),Q2′<0没有过拟合,说明该OPLS-DA拟合具有有效性。图3-d为所得OPLS-DA模型分析得的果汁色泽变数的投影变量重要性(variable importance in the projection, VIP)值,其中b*的VIP值为1.60,其次a*(0.83),因此,b*(VIP>1)是3种贮藏温度(4、25和37 ℃)样品组之间差异最大的指标。
(0.040 9)和Q2′(-0.356),Q2′<0没有过拟合,说明该OPLS-DA拟合具有有效性。图3-d为所得OPLS-DA模型分析得的果汁色泽变数的投影变量重要性(variable importance in the projection, VIP)值,其中b*的VIP值为1.60,其次a*(0.83),因此,b*(VIP>1)是3种贮藏温度(4、25和37 ℃)样品组之间差异最大的指标。

a-PCA图;b-OPLS-DA图;c-OPLS-DA模型的置信检验结果图;d-OPLS-DA模型的VIP预测值分布图
图3 滇橄榄还原果汁的PCA及OPLS-DA 分析结果
Fig.3 Results for PCA and OPLS-DA of restored juices from P. emblica fruit
2.4 滇橄榄还原果汁的色差值与褐色指标的关系
将表2和表3数据作相关性分析,结果如图4所示,为了比较工艺流程IV中不同操作单元对还原果汁色泽的影响,特地分组比较4、25和37 ℃保藏组(分别为IV04、IV25和IV37组)和加冷沉淀处理组(IV04CP、IV25CP和IV37CP组)。所有样品组的褐色指标与色差值之间具有良好的线性关系:L*=-71.65×A420+96.91(R2=0.989)(图4-a,所有组);a*=61.37×A420-12.74(R2=0.984)(图4-b, 所有25和37 ℃组,不包括4 ℃组);b*=75.89×A420+15.42(R2=0.957)(图4-c, 不包括IV37CP-即37 ℃保藏+冷沉淀组)。大致上,所有4 ℃保藏组的L*,a*及b*无明显差异,无论是无或有冷沉淀处理。随着保藏温度提高到25或37 ℃,褐色指标提高,L*值线性降低,a*和b*值线性提高;且冷沉淀处理组比没有冷沉淀处理组具有明显较高的L*值和较低的a*与b*值。此结果显示在短期保藏(14 d)下褐色指标可以作为估计滇橄榄汁色差值变化的指标。

a-L*值;b-a*值;c-b*值
图4 滇橄榄还原果汁的色差值与褐色指标(A420)的关系
Fig.4 Relationships between colorimetric parameters and browning index (A420) of restored juice from P. emblica fruit
2.5 滇橄榄还原果汁褐变动力学
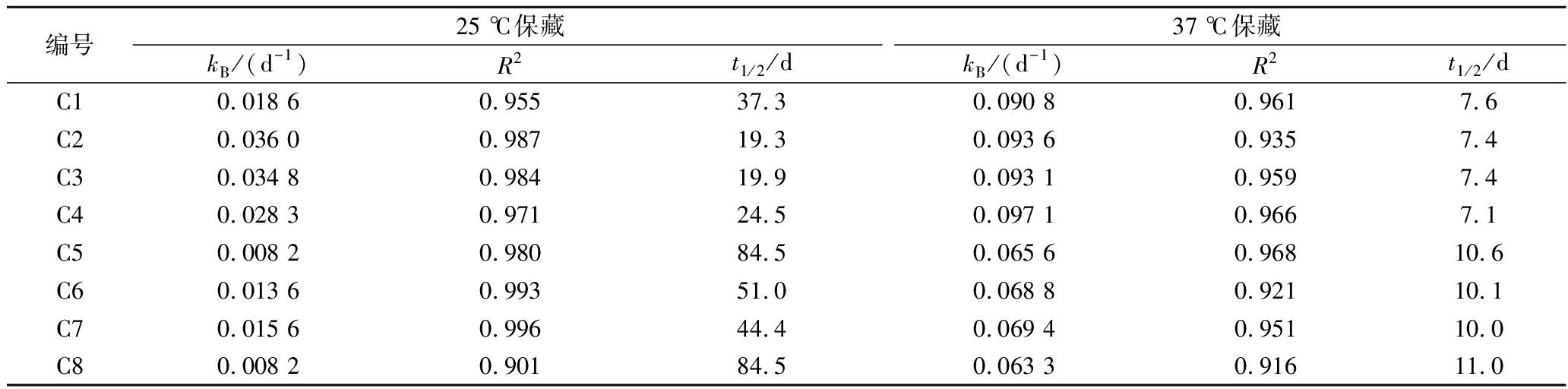
图5为以复合酶处理组C1(添加果胶酶、蛋白酶和维生素C、无冷沉淀处理)为例,阐明滇橄榄还原汁的短期褐色指标随保藏温度而异的一级动力学现象。图5-a显示褐色指标(A420)在4 ℃下不随保藏时间而异,25 ℃下缓慢地线性增加,而37 ℃下呈极明显上升的斜率且线性非常良好。将37 ℃的数据依方程式(3)进行动力学分析,结果如图5-b所示,其斜率(即速率常数kB值)为0.091,相关系数(R2)高达0.961,表明此一级动力学方程式可描述96.1%的数据变化,符合度极高。
比较了4种复合酶组在无冷沉淀(C1~C4)和有冷沉淀(C5~C8)处理下还原果汁的褐变kB值和半褐变时间(t1/2), 结果如表4所示。回归模型的相关系数都非常高(R2=0.901~0.996)。在25 ℃下, C1~C4组的kB值为0.018 6~0.036 0 d-1, 褐变t1/2为19.3~37.3 d;而C5~C8组的kB值为0.008 2~0.015 6 d-1,t1/2为44.4~84.5 d。在37 ℃下, C1~C4组的kB值为0.090 8~0.097 1 d-1,t1/2为7.1~7.6 d;而C5~C8组的kB值为0.063 3~0.069 4 d-1,t1/2为10.0~11.0 d,就kB值而言,37 ℃组是25 ℃组的3~5倍(C1~C4组)或4~8倍(C5~C8组);无冷沉淀组(C1~C4) 是冷沉淀处理组(C5~C8)的2.5(25 ℃下)或1.4(37 ℃下)倍。不同复合酶中,果胶酶/蛋白酶组(C1,C5)在有或无冷沉淀处理下都具有最低的kB值和最大的t1/2值,即最佳的抑制褐变的效果。果胶酶/蛋白酶/单宁酶组加冷沉淀处理(C8)时也有相同的效果,但不建议采用,因成本较高且单宁酶处理会促进长期保藏的褐变程度。

a-褐色指标;b-37 ℃下一级动力学
图5 滇橄榄还原果汁的短期褐变速率和37 ℃ 下的动力学关系(以C1样品组为例)
Fig.5 Short-term browning rates and kinetic relationship at 37 ℃ of restored juice from P. emblica fruit
2.6 不同处理的滇橄榄还原果汁的主要多酚组成
将不同条件处理的滇橄榄果汁4 ℃保藏30 d后解析不同处理条件对滇橄榄还原汁(表5样品D1~D9)主要多酚组成的影响。图6不同处理方式下滇橄榄还原汁中多酚组成的HPLC谱图。D1~D9样品鉴定出的主要成分为粘酸没食子酸酯(尖峰1)、没食子酸O-葡萄糖苷(尖峰2)、没食子酸(尖峰3)、没食子酸甲酯(尖峰6)和鞣料云实素(尖峰7),其化学组分种类不随处理方式而异。经对照标准曲线,计算得各处理前后滇橄榄还原汁的主要成分如表5所示,没食子酸、没食子酸甲酯以及鞣料云实素的含量分別为12.97~14.14、10.64~11.36以及35.40~45.89 μg/mL。统计显著差异分析(P<0.05)结果显示,D1~D9的没食子酸含量无明显差异,不受处理条件所影响;没食子酸甲酯含量为D5,D8,D9>D6,D7>D1~D4,显示大部分酶(尤其是蛋白酶)处理组高于无酶处理组;而鞣料云实素含量是D5>D9>D6,D7,D8>D1~D4,类似没食子酸甲酯的情況。
表4 滇橄榄还原果汁短期保藏过程中一级褐变反应速率和半褐变时间
Table 4 First-order reaction rates for browning and half-browning time during short-term storage of restored juice from P. emblica fruit
编号25 ℃保藏37 ℃保藏kB/(d-1)R2t1/2/dkB /(d-1)R2t1/2/dC10.018 60.95537.30.090 80.9617.6C20.036 00.98719.30.093 60.9357.4C30.034 80.98419.90.093 10.9597.4C40.028 30.97124.50.097 10.9667.1C50.008 20.98084.50.065 60.96810.6C60.013 60.99351.00.068 80.92110.1C70.015 60.99644.40.069 40.95110.0C80.008 20.90184.50.063 30.91611.0
表5 不同处理条件下滇澉榄还原果汁中没食子酸、没食子酸甲酯和鞣料云实素含量的变化
Table 5 Effects of various treatments on the concentrations of gallic acid, methyl gallate ester, and corilagin in restored juice from P. emblica fruit
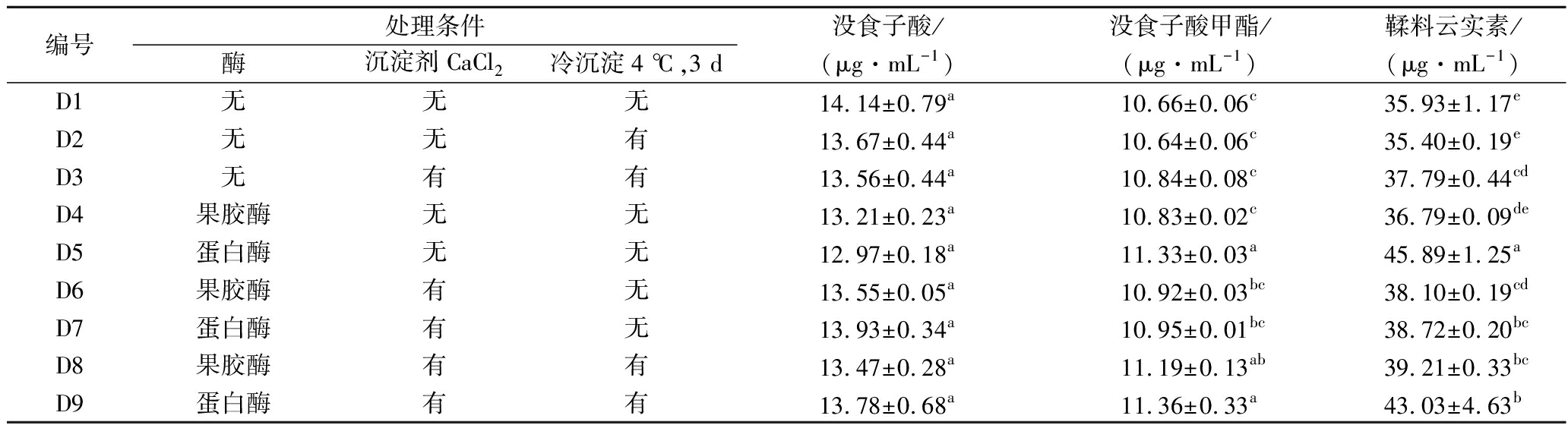
编号处理条件酶沉淀剂CaCl2冷沉淀4 ℃,3 d没食子酸/(μg·mL-1)没食子酸甲酯/(μg·mL-1)鞣料云实素/(μg·mL-1)D1无无无14.14±0.79a10.66±0.06c35.93±1.17eD2无无有13.67±0.44a10.64±0.06c35.40±0.19eD3无有有13.56±0.44a10.84±0.08c37.79±0.44cdD4果胶酶无无13.21±0.23a10.83±0.02c36.79±0.09deD5蛋白酶无无12.97±0.18a11.33±0.03a45.89±1.25aD6果胶酶有无13.55±0.05a10.92±0.03bc38.10±0.19cdD7蛋白酶有无13.93±0.34a10.95±0.01bc38.72±0.20bcD8果胶酶有有13.47±0.28a11.19±0.13ab39.21±0.33bcD9蛋白酶有有13.78±0.68a11.36±0.33a43.03±4.63b
注:同一酚酸的数据标示不同小写字母(a~e),表示有差异显著(P<0.05)

图6 滇橄榄还原果汁的多酚組成的HPLC谱图
Fig.6 HPLC chromatograms for the phenolic profiles of restored juices from P. emblica fruit after different treatments 注:D1~D9样品同表5;1=MG=粘酸没食子酸酯, 2=GG=没食子酸O-葡萄糖苷,3=GA=没食子酸, 6=MGE=甲基没食子酸酯,7=CO=鞣料云实素
图7为滇橄榄汁化学成分及褐变指标的双图,2个主成分累计贡献率为77.5%,PC1贡献率为49.9%,PC2贡献率为28.6%。D4中化学成分粘酸没食子酸酯和化合物4含量较高,D5中没食子酸甲酯和糅料云实素的含量较高。D1和D2的距离较近,D3、D6~D9之间的距离较近,则D1和D2的化学成分含量相似,D3、D6~D9的化学成分含量相似。但是,褐变值对样品的区分不明显。

图7 滇橄榄还原汁的化学成分及褐变指标 (A420)的PCA双图
Fig.7 Biplot of chemical composition and browning value (A420) for restored juice of P. emblica fruit 注:D1~D8为样品;数字和酚化合物为图6 尖峰1~8面积,%
2.7 讨论
本研究主要针对滇橄榄还原果汁保藏过程中总体的非酶褐变反应进行综合评估。总体而言保藏温度对果汁的色差值与褐色指标的作用最为明显,保藏温度越低滇橄榄汁短期保藏后的L*值越高、a*值与b*值越低、褐色指标与kB值均越低。原因在于降低体系温度可以有效减缓美拉德反应、维生素C氧化降解和焦糖化反应的发生[20,22]。25和37 ℃下,冷沉淀处理可减少果汁保藏期沉淀的产生,同时明显增高果汁的L*值、降低a*值与b*值,降低褐色指标与kB值;原因在于预冷沉淀可以事先去除部分影响果汁色泽的物质。沉淀剂对果汁的色差值与褐色指标无明显作用,可促进冷藏时沉淀的生成。果胶酶和蛋白酶可略微降低褐色指标,对沉淀程度无明显影响;而单宁酶可使褐色指标和沉淀程度增加。
添加沉淀剂进行冷沉淀并配合蛋白酶处理后,可使滇橄榄果汁在25 ℃下贮藏24 d后的褐变程度仅为对照组的61%。本研究以褐色指标计算得滇橄榄汁在37 ℃保藏下的kB值为0.063~0.097 d-1,远低于滇橄榄果汁的维生素C在高压加工下的降解速率(2.26~2.90 d-1,即1.57×10-3~2.01×10-3 min-1)[23]。与高温蒸汽处理相比[10],本研究条件下的滇橄榄果汁在4和25 ℃下贮藏14 d内褐变度A420的增加速率较小,而在37 ℃下贮藏14 d内的增加速率则较大。这说明本实验的处理方法可以很好的抑制滇橄榄果汁在4和25 ℃下短期保藏的褐变反应,但在37 ℃下效果有限。有研究表明,没食子酸可减少蔓越莓汁贮藏时的褐变指数[24]。本文进一步研究没食子酸对滇橄榄果汁保藏期间褐变的影响,发现添加沉淀剂(CaCl2)、冷沉淀处理或酶(果胶酶、蛋白酶)处理对滇橄榄果汁的主要成分没食子酸含量无明显影响, 但对没食子酸甲酯和鞣料云实素含量有显著(P<0.05)的影响,酶(尤其是蛋白酶)处理组大都显著高于无酶处理组。VILJANEN等[25]对越橘汁的研究有相似的结论,酶混合物(果胶酶和蛋白酶)处理提高了越橘汁中苯甲酸和槲皮素的含量。
本研究创新结合PCA和OPLS-DA法,系统地总结了多重工艺操作与贮藏温度对滇橄榄还原汁色泽和主要多酚组成分的聚类关系、影响比重及关键因素。发现云南产地的滇橄榄还原汁(75%甲醇提取)中没食子酸O-葡萄糖苷含量最高,不同于广西的滇橄榄果实的纯甲醇提取物(粘酸没食子酸酯与粘酸内酯没食子酸酯含量最高)[26]以及印度的滇橄榄果实的70%乙醇提取物(双没食子酸含量最高)[27]。上述主要多酚组成不同受产地、提取溶剂或色谱分析溶剂所影响,需进一步研究滇橄榄果汁质量指标以及主要多酚组成的功能活性与机理。
3 结论
本研究发现滇橄榄果汁较好的处理工艺为:冷沉淀,果胶酶/蛋白酶处理,4 ℃保藏。此处理条件下的滇橄榄果汁在短时保藏期内的褐色指标较小[14 d后(0.115±0.026)]、色差值较优[L*值(86.9±2.4)、a*值(-1.49±0.63)、b*值(22.0±3.4)]、无沉淀,果汁澄清金黄,成本较低。色差值均与褐色值高度线性相关。动力学分析:37 ℃保藏时,滇橄榄汁的褐色值随保藏时间的变化对一级动力学方程的符合性高。37 ℃保藏组的kB值为0.063~0.097 d-1,25 ℃组的为0.008~0.036 d-1;冷沉淀处理可使滇橄榄果褐变kB值明显减小、半褐变时间t1/2值明显增大,保藏期沉淀明显减少。冷沉淀处理的组中,果胶酶/蛋白酶组的kB值最小、t1/2值最大。上述所采用的工艺条件不会显著影响滇橄榄果汁中的没食子酸含量,但会显著提高没食子酸甲酯和鞣料云实素含量,尤其是蛋白酶处理。本研究提供了解决杀青后滇橄榄还原汁在即饮模式下短期贮藏过程中的褐变与沉淀问题的可行方案,结果可为相关果汁产品的研发提供重要参考。未来还需进一步分析澄清后滇橄榄果汁的功能活性、营养品质与感官评价,为鲜饮果汁的研发提供更完整的功能活性信息。
[1] 中国科学院中国植物志编辑委员会. 中国植物志-第四十四卷[M].北京:科学出版社, 1994.
Chinese Academy of Sciences Flora of China Editorial Committee.Flora of China-Vol.44[M].Beijing:Science Press, 1994.
[2] VARIYA B C, BAKRANIA A K, PATEL S S.Emblica officinalis (Amla):A review for its phytochemistry, ethnomedicinal uses and medicinal potentials with respect to molecular mechanisms[J].Pharmacological Research, 2016, 111:180-200.
[3] YADAV S S, SINGH M K, SINGH P K, et al.Traditional knowledge to clinical trials:A review on therapeutic actions of Emblica officinalis[J].Biomedicine & Pharmacotherapy, 2017, 93:1 292-1 302.
[4] KRISHNAVENI M, MIRUNALINI S.Therapeutic potential of Phyllanthus emblica (Amla):The ayurvedic wonder[J].Journal of Basic and Clinical Physiology and Pharmacology, 2010, 21(1):93-105.
[5] PARAVISINI L, PETERSON D G.Mechanisms non-enzymatic browning in orange juice during storage[J].Food Chemistry, 2019, 289:320-327.
[6] ISMAIL B, MOHAMMED H, NAIR A J.Green Bio-processes:Enzymes in Industrial Food Processing[M].Singapore:Springer, 2019:31-53.
[7] PUTNIK P, KRESOJA Ž, BOSILJKOV T, et al.Comparing the effects of thermal and non-thermal technologies on pomegranate juice quality:A review[J].Food Chemistry, 2019, 279:150-161.
[8] WANG C, ZHANG X L, GAO Y, et al.Path analysis of non-enzymatic browning in Dongbei Suancai during storage caused by different fermentation conditions[J].Food Chemistry, 2021,335:127620
[9] 徐涓, 张雯雯, 李凯, 等.高温蒸汽处理对余甘子果汁贮藏期间的品质影响及褐变行为解析[J].食品科学, 2019, 40(23):246-252.
XU J, ZHANG W W, LI K, et al.Effect of high temperature steaming pretreatment on quality of Phyllanthus emblica L.juice and analysis of browning behavior during storage[J].Food Science, 2019, 40(23):246-252.
[10] HE S D, ZHANG Z Y, SUN H J, et al.Contributions of temperature and L-cysteine on the physicochemical properties and sensory characteristics of rapeseed flavor enhancer obtained from the rapeseed peptide and D-xylose Maillard reaction system[J].Industrial Crops and Products, 2019, 128:455-463.
[11] MOHAMMADI M, REZAEI MOKARRAM R, SHAHVALIZADEH R, et al.Immobilization and stabilization of pectinase on an activated montmorillonite support and its application in pineapple juice clarification[J].Food Bioscience, 2020, 36:100625.
[12] AKHTAR A, SUBBIAH S, MOHANTY K, et al.Sugarcane juice clarification by lanthanum phosphate nanofibril coated ceramic ultrafiltration membrane:PPO removal in absence of lime pre-treatment, fouling and cleaning studies[J].Separation and Purification Technology, 2020, 249:117157.
[13] WEGENER S, KAUFMANN M, KROH L W.Influence of l-pyroglutamic acid on the color formation process of non-enzymatic browning reactions[J].Food Chemistry, 2017, 232:450-454.
[14] 矫馨瑶, 李恩惠, 王月华, 等.蓝莓多酚稳定性及热降解动力学研究[J].中国食品学报, 2018, 18(1):81-87.
JIAO X Y, LI E H, WANG Y H, et al.Studies on the stability and thermal degradation kinetics of blueberry polyphenols[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(1):81-87.
[15] DHAKAL S, BALASUBRAMANIAM V M, AYVAZ H, et al.Kinetic modeling of ascorbic acid degradation of pineapple juice subjected to combined pressure-thermal treatment[J].Journal of Food Engineering, 2018, 224:62-70.
[16] LIU S C, YANG D J, JIN S Y, et al.Kinetics of color development, pH decreasing, and anti-oxidative activity reduction of Maillard reaction in galactose/glycine model systems[J].Food Chemistry, 2008, 108(2):533-541.
[17] 张元元, 张映曈, 胡花丽, 等.草莓汁贮藏期维生素C的降解动力学研究[J].现代食品科技, 2020, 36(1):120-126.
ZHANG Y Y, ZHANG Y T, HU H L, et al.Degradation kinetics of vitamin C in strawberry juice during storage[J].Modern Food Science and Technology, 2020, 36(1):120-126.
[18] OLIVARES-TENORIO M L, VERKERK R, VAN BOEKEL M A J S, et al.Thermal stability of phytochemicals, HMF and antioxidant activity in cape gooseberry (Physalis peruviana L.)[J].Journal of Functional Foods, 2017, 32:46-57.
[19] DAMASCENO L F, FERNANDES F A N, MAGALH ES M M A, et al.Non-enzymatic browning in clarified cashew apple juice during thermal treatment:Kinetics and process control[J].Food Chemistry, 2008, 106(1):172-179.
ES M M A, et al.Non-enzymatic browning in clarified cashew apple juice during thermal treatment:Kinetics and process control[J].Food Chemistry, 2008, 106(1):172-179.
[20] REMINI H, MERTZ C, BELBAHI A, et al.Degradation kinetic modelling of ascorbic acid and colour intensity in pasteurised blood orange juice during storage[J].Food Chemistry, 2015, 173:665-673.
[21] VAIKOUSI H, KOUTSOUMANIS K, BILIADERIS C G.Kinetic modelling of non-enzymatic browning of apple juice concentrates differing in water activity under isothermal and dynamic heating conditions[J].Food Chemistry, 2008, 107(2):785-796.
[22] LEE Y Y, TANG T K, PHUAH E T, et al.New functionalities of Maillard reaction products as emulsifiers and encapsulating agents, and the processing parameters:A brief review[J].Journal of the Science of Food and Agriculture, 2017, 97(5):1 379-1 385.
[23] RAJ A S, CHAKRABORTY S, RAO P S.Thermal assisted high-pressure processing of Indian gooseberry (Embilica officinalis L.) juice-Impact on colour and nutritional attributes[J].LWT, 2019, 99:119-127.
[24] ROIDOUNG S, DOLAN K D, SIDDIQ M.Gallic acid as a protective antioxidant against anthocyanin degradation and color loss in vitamin-C fortified cranberry juice[J].Food Chemistry, 2016, 210:422-427.
[25] VILJANEN K, HEINIÖ R L, JUVONEN R, et al.Relation of sensory perception with chemical composition of bioprocessed.
[26] JHAUMEER LAULLOO S, BHOWON M G, CHUA L S, et al.Phytochemical screening and antioxidant properties of Phyllanthus emblica from Mauritius[J].Chemistry of Natural Compounds, 2018, 54(1):50-55.
[27] BALUSAMY S R, VEERAPPAN K, RANJAN A, et al.Phyllanthus emblica fruit extract attenuates lipid metabolism in 3T3-L1 adipocytes via activating apoptosis mediated cell death[J].Phytomedicine:International Journal of Phytotherapy and Phytopharmacology, 2020, 66:153129.