黑老虎(Kadsura coccinea Lem.)又名冷饭团、布福娜、大叶五味子等,为多年生常绿木质藤本,南五味子属五味子科植物,分布于贵州、广西、云南等地。其根俗称大血藤,有较多药用功效,是一种重要的中药材[1-2],在民间用于治疗胃溃疡、十二指肠溃疡、急性肠胃炎、风湿性关节炎、跌打肿痛、痛经等;其还具有抗肿瘤、抗HIV、抗炎、保肝、抗氧化等活性作用[3-6],从而受到广泛关注。黑老虎果实为集合果,单果重50~580 g,由30~70个小浆果聚合而成,表面似足球,成熟时呈粉红、紫红、红绿和青绿等多种颜色;果肉似荔枝、口味独特;每个小浆果含2~3粒种子,千粒种重(213.01±2.30) g。黑老虎果实在贵州黔东南、湖南通道县等少数民族地区被当作珍稀野生水果,初步研究显示其具有较高营养与保健价值[7-9]。近年来黑老虎果实因果实外观奇特、色泽艳丽,一度供不应求[10],不断被种植。但其可食率较低(30%~52%)、果皮较厚(占果重的32%~50%)、种子多(100~210粒,占7%~15%),果肉和种子不易分离[8,11],不耐贮运等严重制约着更进一步发展。对果实和果实副产物(果皮和种子)进行精深加工利用已成为解决其瓶颈的途径之一[8,10-12]。
前期在黑老虎果肉和果皮中检出20种氨基酸[8-9,13]。籽中含8种饱和脂肪酸(葵酸、月桂酸、豆蔻酸等)和4种不饱和脂肪酸(棕榈油酸、油酸、亚油酸和α-亚麻酸)[14]。果肉中维生素C、粗蛋白质、可溶性糖等常规营养成分及钙、铁、锌、镁等微量元素中多个指标优于龙眼、草莓、荔枝等[9,15]。进一步表明了黑老虎果实是一种极具开发前景的新型水果,基于代谢组学分析营养成分还鲜有报道。代谢组学是生物组学中新发展起来的一门重要学科,是系统生物学的重要组成部分[16-17],其通过高通量化学分析技术对生物样品中代谢产物进行定性和定量分析。以黑老虎果实为材料,利用广泛靶向代谢组学方法,超高效液相色谱串联质谱(ultra performance liquid chromatography-MS/MS,UPLC-MS/MS)技术,高通量、高灵敏、广覆盖检测果肉、果皮和种子中的代谢物,解析其中的营养成分,分析不同部位富集格局,旨在阐明果皮和种子中可能功能与果肉类似或高度富集的营养成分,挖掘其利用价值。
1 材料与方法
1.1 样品的采集和提取方法
试验所用黑老虎果实为人工培育的6年植株所结,栽植于覆盖80%遮阳网的塑料大棚,位于贵州省贵阳市乌当区下坝镇普渡村,定期管理、长势良好。于2020年10月11日,随机采摘数10株成熟果实,选果型端正的大果(质量>250 g)作为样品。果实经自来水洗净后纯净水冲洗3次,将其分开成小浆果,置于小板上、用手术刀剖开剥离出果肉、果皮,用砂布包裹揉搓种子使其干净,分别装入10 mL离心管中。编号为果肉KF1-3,果皮KP1-3和种子KD1-3;然后迅速置于液氮中,随后干冰保存转运至实验室,-80 ℃超低温冰箱中保存备用。
将超低温冷冻保存的3组供试样品放置于冻干机(Scientz-100F)中真空冷冻干燥,用研磨仪(MM 400,Retsch)研磨(30 Hz,1.5 min)至粉末状;准确称取100 mg粉末,溶解于1.2 mL 体积分数为70%甲醇提取液中;每30 min涡旋1次,每次持续30 s,共涡旋6次,样本置于4 ℃冰箱过夜;离心(12 000 r/min,10 min)后,吸取上清液,用微孔滤膜(0.22 μm pore size)过滤样品,并保存于进样瓶中,用于超高效液相色谱(ultra performance liquid chromatography,UPLC)和串联质谱(tandem mass spectrometry,MS/MS)(Applied Biosystems 4500 Q TRAP)分析。
1.2 色谱质谱采集条件
超高效液相色谱(ultra performance liquid chromatography,UPLC)和串联质谱(MS/MS)(QTRAP)。
液相条件:色谱柱:Agilent SB-C18(1.8 μm,2.1 mm×100 mm);流动相:水相,超纯水(加入体积分数0.1%的甲酸),乙腈(加入0.1%的甲酸);洗脱梯度:0.00 min乙腈比例为5%,9.00 min内乙腈比例线性增加到95%,并维持在95% 1 min,10.00~11.10 min,乙腈比例降为5%,并以5%平衡至14 min;流速0.35 mL/min;柱温40 ℃;进样量4 μL。
质谱条件:在三重四极杆线性离子阱质谱仪(quadrupole-linear ion trap mass spectrometer,QTRAP),AB4500 Q TRAP UPLC/MS/MS系统上完成线性离子阱(linear ion trap,LIT)和三重四极杆(triple quadrupole,QQQ)扫描。该系统配备了ESI Turbo离子喷雾接口,可由Analyst 1.6.3软件(AB Sciex)控制运行正负2种离子模式。ESI源操作参数如下:离子源,涡轮喷雾;源温度550 ℃;离子喷雾电压(ion spray,IS)5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体(ion source gas I,GSI),气体II(GSII)和帘气(curtain gas,CUR)分别设置为344.8、413.7和172.4 kPa,碰撞诱导电离参数设置为高。在QQQ和LIT模式下分别用10和100 μmol/L聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用MRM模式,并将碰撞气体(N2)设置为中等。通过进一步的去簇电压(declustering potential,DP)和碰撞能量(collision energy,CE)优化,完成了各个多反应检测模式(multi reaction monitor,MRM)离子对的DP和CE。根据每个时期内洗脱的代谢物,在每个时期监测一组特定的MRM离子对。
1.3 样本质控
质控样本由样本提取物混合制备而成,用于分析样本在相同的处理方法下的重复性。在仪器分析的过程中,每3个检测分析样本中插入一个质控样本,以监测分析过程的重复性。
1.4 数据分析
基于迈维生物公司(武汉)自建数据库MWDB(metware database)和代谢物信息公共数据库,根据二级谱信息进行物质定性(1:样本物质二级质谱、RT与数据库物质核对一致;2:样本物质Q1、Q3、RT、DP、CE与数据库物质核对一致),分析时去除了同位素信号,含![]() 的重复信号,以及本身是其他更大分子质量物质的碎片离子的重复信号。利用三重四级杆质谱的多反应监测模式(MRM)对代谢物定量分析。MRM模式中,四级杆首先筛选目标物质的前体离子(母离子),排除掉其他分子质量物质对应的离子以初步排除干扰;前体离子经碰撞室诱导电离后断裂形成很多碎片离子,碎片离子再通过三重四级杆过滤选择出所需要的一个特征碎片离子,排除非目标离子干扰,使定量更为精确,重复性更好。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正[18]。
的重复信号,以及本身是其他更大分子质量物质的碎片离子的重复信号。利用三重四级杆质谱的多反应监测模式(MRM)对代谢物定量分析。MRM模式中,四级杆首先筛选目标物质的前体离子(母离子),排除掉其他分子质量物质对应的离子以初步排除干扰;前体离子经碰撞室诱导电离后断裂形成很多碎片离子,碎片离子再通过三重四级杆过滤选择出所需要的一个特征碎片离子,排除非目标离子干扰,使定量更为精确,重复性更好。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正[18]。
根据正交偏最小二乘法判别模型(orthogonal partial least squares discriminant analysis,OPLS-DA)分析代谢组数据,绘制各分组的得分图,进一步展示各个样本组之间的差异[19]。评价模型的预测参数有R2X,R2Y和Q2,其中R2X和R2Y分别表示所建模型对X和Y矩阵的解释率,Q2表示模型的预测能力,这3个指标越接近于1时表示模型越稳定可靠,Q2>0.5时可认为是有效的模型,Q2>0.9时为出色的模型。基于OPLS-DA结果,从获得的多变量分析OPLS-DA模型的变量重要性投影(variable importance in projection, VIP),初步筛选出不同组织间有差异的代谢物。同时结合单变量分析的P-value和差异倍数值(fold change)来进一步筛选出差异代谢物(differentially accumulating metabolites, DAMs)。筛选标准:选取fold change≥2和fold change≤0.5的代谢物;选取VIP≥1的代谢物,VIP值表示对应代谢物的组间差异在模型中各组样本分类判别中的影响强度,一般认为VIP≥1的代谢物为差异显著。
2 结果与分析
2.1 样本质控及统计分析
通过对不同质控样本质谱检测分析的MRM代谢物检测多峰图(多物质提取的离子流谱图,XIC)进行重叠展示分析,可以看到重复样本不同物质的离子峰值重叠性比较好(图1),说明实验过程具有稳定性,检测结果可靠。
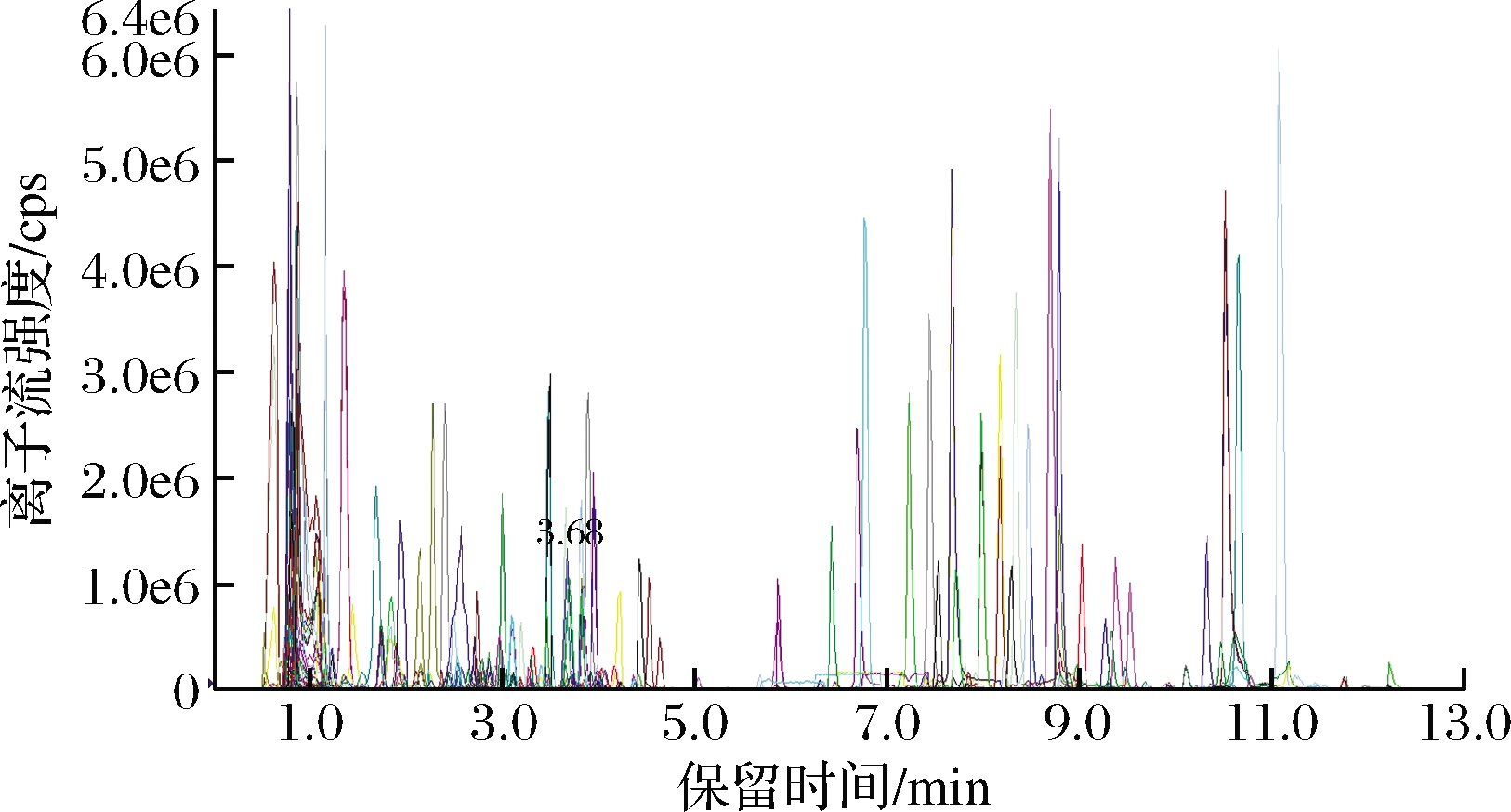
图1 MRM代谢物检测多峰图(XIC图)
Fig.1 MRM detection of multimodal maps
通过对样本(包括质控样品)进行主成分分析,判别黑老虎果皮(KP1-3)、果肉(KF1-3)、种子(KD1-3)各样本组间和组内的变异度大小。全部样本主成分分析(principal component analysis, PCA)得分图(图2)显示UC-MS/MS分析所得原始数据在PC1、PC2两种主成分中得到良好地呈现。在图2中,第一主成分的贡献率为58.58%,第二主成分的贡献率为22.77%,代表2个主成分能够基本反映检测样品的主要特征信息;3组样本在二维图上表现出明显的分离趋势,表明对各样本数据处理结果可信,各样本间存在明显差异。

图2 三组样本及质控样的PCA结果
Fig.2 PCA results of three groups of samples and quality control
为了鉴别出具体有哪些DAMs造成了分离现象,建立黑老虎果皮与果肉(KP vs KF)、果肉与种子(KF vs KD)之间的2组OPLS-DA模型。由2组比较OPLS-DA验证结果显示模型具有很好的预测能力和可靠性,能够很好地表现各组间代谢物的变化趋势。对OPLS-DA模型进行200次排列验证,模型(表1)有意义,可根据VIP值分析筛选取DAMs。
表1 两组比较的OPLS-DA 模型验证值
Table 1 The calculated OPLS-DA model values of the two pairwise groups
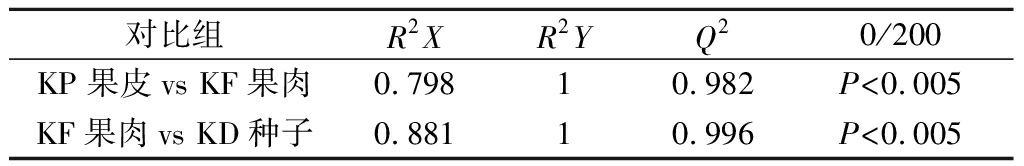
对比组R2XR2YQ20/200KP果皮vs KF果肉0.79810.982P<0.005KF果肉vs KD种子0.88110.996P<0.005
2.2 代谢物分析
基于所鉴定出代谢物的结构配置,将其归属11类(Ⅰ级),以其中氨基酸及其衍生物、核苷酸及其衍生物、有机酸、脂质、其他(糖及醇类、维生素)5类营养成分进行分析。果实共鉴定出营养代谢物429个,其中果皮424个、果肉429个、种子391个,3个部位共有的为389个。进一步对营养物质归类分为12个Ⅱ类,其中氨基酸类数量最多,占总数(429个)的22.6%;有机酸次之,占18.6%;其余依次为游离脂肪酸(13.5%)、糖及醇类(12.8%)、核苷酸类(11.2%)、溶血磷脂酰胆碱(6.8%)、溶血磷脂酰乙醇胺(6.3%)、甘油酯(3.3%)、维生素(2.8%)、其他类(1.6%)、鞘脂(0.2%)、磷脂酰胆碱(0.2%)。果皮与果肉在12类中分布的代谢物数量几乎相当,种子在氨基酸类、有机酸、甘油酯、糖及醇类、其他类分布略少(图3)。

图3 黑老虎果肉、果皮、种子的营养成分数量统计
Fig.3 Number of metabolites detected in each class of compounds in different organs of K. coccinea
2.3 差异代谢物分析
基于OPLS-DA结果,根据DAMs选择标准,KP v KF筛选到124个DAMs,KF vs KD有256个DAMs;2个对照中的DAMs主要集中于氨基酸类、有机酸、核苷酸类。此外,KF vs KD组中来自于甘油酯、游离脂肪酸、溶血磷脂酰胆碱、溶血磷脂酰乙醇胺、糖及醇类的DAMs远多于KP vs KF,这使得该对照组有更多数量的DAMs(表2)。
表2 差异代谢物种类与变化情况
Table 2 Species types and changes of DAMs

序号类别KP果皮 vs KF果肉KF果肉 vs KD种子合计上调下调合计上调下调1氨基酸及其衍生物483996225372核苷酸及其衍生物15105295243有机酸171434614324甘油酯5512125游离脂肪酸10912110116溶血磷脂酰胆碱9722111107溶血磷脂酰乙醇胺77215168磷脂酰胆碱11119糖及醇类6242742310维生素229911其他类44716
DAMs在KP vs KF中以上调模式占主导,而在KF vs KD中则以下调占优;2组对比中同时为DAMs的有81个,其中11个[N-甲酰-L-蛋氨酸、N-乙酰-L-谷氨酰胺、L-赖氨酸丁酸酯、N-(3-吲哚乙酰基)-L-丙氨酸、N-乙酰-L-色氨酸、α-酮戊二酸、2,3-二羟基苯甲酸、夹竹桃苷、巴斯苷、4,7,9,9′-四羟基-3,3′-二甲氧基-8-O-4′-新木质素、白藜芦醇苷]呈连续下调模式,16个[N,N-二甲基甘氨酸、L-赖氨酸、N-α-乙酰基-L-鸟氨酸、N-甘氨酰-L-亮氨酸、L-甘氨酰-L-异亮氨酸、高精氨酸、L-丝氨酰-L-异亮氨酸、L-甘氨酰-L-苯丙氨酸、L-脯氨酰-L-亮氨酸、L-丙氨酰-L-苯丙氨酸、L-异亮氨酰-L-天冬氨酸、γ-氨基丁酸、3-异丙基苹果酸、二十碳二烯酸、溶血磷脂酰胆碱16∶0(2n异构)、溶血磷脂酰胆碱20∶1]连续向上表达。连续向下或向上表达的DAMs中氨基酸类数量最多,都含有机酸,连续下调成分中还含有多个其他类成分。
进一步选出差异倍数排在前20(上调和下调)的DAMs(图4),KF vs KP组中主要由氨基酸类和甘油酯类成分构成,KF vs KD中包含溶血磷脂酰乙醇胺、氨基酸类、糖及醇类。KF vs KD组的差异倍数明显大于KF vs KP,上调和下调倍数最大的物质分别为溶血磷脂酰乙醇胺20∶5和磷酸二羟基丙酮,均来自KF vs KD组;这也表明:黑老虎果皮和果肉与种子比较,营养成分分离现象更为明显,尤其在脂质类成分中更显著。

a-KP果皮vs KF果肉;b-KF果肉vs KD种子
图4 两组对比中差异倍数最大的20种代谢物
Fig.4 Top 20 DAMs between the two pairwise groups
2.4 主要营养成分富集程度
通过值峰积累及聚类热图(图5)分析,果肉、果皮和种子中营养成分丰度分别为73.13×107、55.45×107和56.33×107,含量(以对应部位检出的所有代谢物值峰为基数)分别为73.1%、55.5%和56.3%;在3个部位富集度都较高的是氨基酸类、有机酸、游离脂肪酸、糖及醇类和溶血磷脂酰胆碱。但整体积累格局差异仍然明显,其中氨基酸类和游离脂肪酸丰度果皮<种子<果肉,有机酸、糖及醇类积累量种子<果皮<果肉,种子中磷脂酰胆碱表达量显著高于果肉和果皮。

图5 聚类热图
Fig.5 Heatmap representing the accumulation (ion intensity) of metabolites in three tissues
3个部位含量(同上)≥0.5%的营养成分共55个(表3),其中氨基酸类最多,占41.8%;游离脂肪酸、磷脂酰胆碱和有机酸均占12.7%。果肉、果皮和种子主要代谢物分别有43、25、41个,共有21个,其分别是L-甲硫氨酸亚砜、L-天冬氨酸、L-脯氨酸、2′-脱氧肌苷-5′-单磷酸、溶血磷脂酰胆碱18∶2(2n异构)、溶血磷脂酰胆碱18∶2、溶血磷脂酰乙醇胺16∶0、γ-亚麻酸、α-亚麻酸、硬脂酸(十八烷酸)、亚油酸、肉豆蔻酸、16-甲基十七烷酸、D-果糖、1-癸醇、肌醇半乳糖苷、柠檬酸、3-脱氢-L-苏糖酸、琥珀酸、甲基丙二酸、异柠檬酸。这些成分中很多种被证实具有重要生物活性和作用功能,在食品及药用领域具有较好利用前景。
表3 果肉、果皮、种子含量≥0.5%的营养成分
Table 3 Nutrient components with content≥0.5% in the pulp, peel, and seeds

序号质荷比离子模式物质果肉果皮种子值峰含量/%值峰含量/%值峰含量/%1144.1[M+H]环戊基甘氨酸13 405 0001.46 450 2330.53 772 7000.52166.1[M+H]L-甲硫氨酸亚砜13 018 0001.39 346 3670.78 243 8331.03132.0[M-H]-L-天冬氨酸12 735 3331.36 870 6000.517 524 0002.24116.1[M+H]L-脯氨酸12 187 3331.210 161 7000.724 080 6673.05182.1[M+H]L-酪氨酸11 733 6671.23 431 0670.3355 0700.06166.1[M+H]L-苯丙氨酸9 736 1671.02 658 6000.24 538 6330.67132.1[M+H]L-亮氨酸∗7 518 8670.82 362 8670.25 913 1000.78132.1[M+H]L-异亮氨酸∗7 279 4330.72 377 6000.25 555 2330.79245.1[M-H]-N-乙酰-L-色氨酸6 867 3000.716 354 3331.2289 8430.010104.1[M+H]2-氨基异丁酸5 567 5670.62 616 5670.27 768 5001.011203.1[M-H]-L-色氨酸5 474 3670.6916 3730.1436 9700.112118.1[M+H]L-缬氨酸5 080 5330.51 292 3670.13 551 9330.413106.0[M+H]L-丝氨酸4 130 9670.46 392 5670.57 550 1330.914178.0[M+H]N-甲酰-L-蛋氨酸2 457 0000.218 830 3331.4479 7730.115130.1[M+H]环亮氨酸∗2 317 5670.22 535 0670.26 639 3670.816120.1[M+H]L-苏氨酸1 937 7000.21 576 0000.15 852 8670.717147.1[M+H]L-赖氨酸1 196 2000.1583 1530.04 473 3330.618147.1[M+H]L-谷氨酰胺1 120 6000.1576 9570.04 492 8330.619284.1[M+H]鸟苷8 040 6330.83 665 5330.32 032 4330.320167.1[M+H]6-甲基巯嘌呤7 387 8330.72 096 2000.23 423 1330.421244.1[M+H]胞苷6 674 2330.74 209 4330.3934 0500.122136.1[M+H]腺嘌呤5 786 0330.62 754 2000.24 498 5670.623333.1[M+H]2′-脱氧肌苷-5′-单磷酸4 937 1670.511 768 4000.910 629 3331.324258.1[M+H]甘磷酸胆碱221 5600.0852 7430.111 814 0001.525520.3[M+H]溶血磷脂酰胆碱 18∶2(2n异构)22 068 3332.217 726 0001.325 822 0003.226520.3[M+H]溶血磷脂酰胆碱 18∶213 819 6671.410 855 6000.826 500 0003.327522.4[M+H]溶血磷脂酰胆碱 18∶17 305 5670.76 127 3000.410 527 7331.328496.3[M+H]溶血磷脂酰胆碱 16∶06 138 5330.63 740 0000.39 232 2671.1
续表3

序号质荷比离子模式物质果肉果皮种子值峰含量/%值峰含量/%值峰含量/%29518.3[M+H]溶血磷脂酰胆碱 18∶35 021 0670.52 945 5670.280 2510.030522.4[M+H]溶血磷脂酰胆碱 18∶1(2n异构)1 137 3330.12 913 6000.29 250 7001.131524.4[M+H]溶血磷脂酰胆碱 18∶0510 1900.1332 6330.07 854 8331.032454.3[M+H]溶血磷脂酰乙醇胺 16∶023 504 3332.412 445 6670.95 343 5000.733478.3[M+H]溶血磷脂酰乙醇胺 18∶2(2n异构)7 023 3670.75 310 8000.43 570 9330.434500.3[M+H]溶血磷脂酰乙醇胺 20∶50.00.05 681 5670.735277.2[M-H]-γ-亚麻酸∗32 418 3333.38 921 5000.718 888 3332.336277.2[M-H]-α-亚麻酸∗29 509 3333.08 325 0000.616 894 3332.137283.3[M-H]-硬脂酸(十八烷酸)20 675 0002.116 949 0001.214 945 0001.938279.2[M-H]-亚油酸15 063 6671.510 363 0000.835 965 6674.539227.2[M-H]-肉豆蔻酸10 700 6671.18 763 9000.68 015 7001.040283.3[M-H]-16-甲基十七烷酸9 839 7001.07 370 1670.57 619 5330.941179.1[M-H]-D-果糖∗31 081 6673.124 494 0001.88 736 6671.142157.2[M-H]-1-癸醇12 998 6671.312 747 6670.912 991 3331.643341.1[M-H]-肌醇半乳糖苷9 944 6671.09 388 8000.710 734 5671.344341.1[M-H]-异麦芽酮糖∗7 524 2330.84 456 7330.35 922 5000.745195.1[M-H]-葡萄糖酸7 468 5330.810 705 3330.81 766 8670.246341.1[M-H]-D-麦芽糖∗5 085 5670.53 665 5670.34 704 3000.647341.1[M-H]-D-蔗糖∗4 788 1000.54 599 2000.35 430 8330.748256.2[M+H]+烟酸核糖核苷10 056 3671.04 799 3000.43 393 5000.449191.0[M-H]-柠檬酸33 805 0003.423 386 6671.79 129 3671.150133.0[M-H]-3-脱氢-L-苏糖酸∗24 319 0002.520 694 0001.59 852 5001.251117.0[M-H]-琥珀酸∗23 617 6672.418 000 6671.38 624 2331.152117.0[M-H]-甲基丙二酸∗23 411 0002.418 304 3331.38 104 4331.053191.0[M-H]-异柠檬酸15 101 6671.510 431 3330.87 961 1331.054165.0[M-H]-D-木糖酸11 781 6671.212 958 0000.91 729 3330.255104.1[M+H]+γ-氨基丁酸1 217 2000.1451 9330.04 132 0330.5
注:*表示该物质包括其同分异构体
3 结论与讨论
采用广泛靶向代谢组学分析方法,鉴定黑老虎果实不同部位代谢成分,根据结构配置归属I级类,以其中的氨基酸及其衍生物、核苷酸及其衍生物、有机酸、脂质、其他类(糖及醇类、维生素)5个类别为营养成分进行分析。在黑老虎果实中共鉴定出429个营养成分,果皮424个、果肉429个、种子391个,3个部位共有389个。进一步将营养物质细分为12个Ⅱ类,氨基酸类、有机酸、游离脂肪酸和糖及醇类数量和含量在3个部位中都处于优势地位,种子中营养成分少于果皮和果肉,主要因这些优势成分(氨基酸类、有机酸、糖及醇类)数量较少。3个部位营养成分丰度呈现出明显差异,有机酸、游离脂肪酸、溶血磷脂酰乙醇胺在果肉中显著向上表达,因此,果肉营养成分积累量明显高于果皮和种子;而溶血磷脂酰乙醇胺在种子表达量显著上调。
黑老虎营养成分的鉴定很好地补充和丰富了其营养价值,如氨基酸类多达97种,除包括人体必需的氨基酸外,还含有组氨酸、L-精氨酸、L-胱氨酸等具有独特营养功能和重要生理作用的氨基酸。有机酸也非常丰富,其中柠檬酸、琥珀酸、3-脱氢-L-苏糖酸等积累量较高。研究显示其具有抑菌、利胆、消炎、降血糖、抗氧化以及调节机体免疫等作用,能够增加冠状动脉血流量、抑制脑组织脂质过氧化物生成、软化血管、促进钙、铁元素的吸收;同时帮助胃液消化脂肪,还能够预防疾病和促进新陈代谢等[20]。果实中富含脂质,其中亚油酸丰度居所有代谢物之首,α-亚麻酸、γ-亚麻酸含量也较高;含有磷脂(溶血磷脂酰胆碱和溶血磷脂酰乙醇胺)56种,这些成分不仅有较高的营养价值,同时还具有促进人体新陈代谢、预防疾病、增强免疫力等作用,在医疗及免疫学方面的研究意义重大[21-23]。
目前黑老虎果实以直接食用为主,但可食率较低,果肉(果肉和种子不易分离)被尽可能吸食后,种子和果皮被废弃。从营养成分富集格局看,果皮具有与果肉接近的营养价值,可以连同开发利用;而种子中脂质表达量丰富,人体必需脂肪酸含量较高,还含有多种特有成分[溶血磷脂酰乙醇胺20∶5、溶血磷脂酰乙醇胺20∶4(2n异构)、溶血磷脂酰乙醇胺20∶4],可作为优质植物脂肪酸来源的新兴理想原料。代谢组学在黑老虎果实不同部位鉴定出高度富集和独特的代谢物,将为进一步研究与利用提供重要支持。
[1] 国家中医药管理局《中华本草》编委会. 中华本草-9[M].上海:上海科学技术出版社, 1999.
Chinese Herbal Medicine Editorial Boards of State Administration of Traditional Chinese Medicine.Chinese Herbal Medicine[M].Volume 2.Shanghai:Shanghai Science and Technology Press, 1999.
[2] 舒永志, 成亮, 杨培明.黑老虎的化学成分及药理作用研究进展[J].中草药, 2011, 42(4):805-813.
SHU Y Z, CHENG L, YANG P M.Advances in studies on chemical constituents in Kadsura coccinea and their pharmacological activities[J].Chinese Traditional and Herbal Drugs, 2011, 42(4):805-813.
[3] SUN J, YAO J Y, HUANG S X, et al.Antioxidant activity of polyphenol and anthocyanin extracts from fruits of Kadsura coccinea (Lem.) A.C.Smith[J].Food Chemistry, 2009, 117(2):276-281.
[4] BAN N K, THANH B V, KIEM P V, et al.Dibenzocyclooctadiene lignans and lanostane derivatives from the roots of Kadsura coccinea and their protective effects on primary rat hepatocyte injury induced by t-butyl hydroperoxide[J].Planta Medica, 2009, 75(11):1 253-1 257.
[5] 延在昊, 成亮, 孔令义, 等.黑老虎化学成分及其抗氧化活性研究[J].中草药, 2013, 44(21):2 969-2 973.
YAN Z H, CHENG L, KONG L Y, et al.Chemical constituents and their anti-oxidative activiities of Kɑdsurɑ coccineɑ[J].Chinese Traditional and Herbal Drugs, 2013, 44(21):2 969-2 973.
[6] 杨艳, 高渐飞.冷饭团不同部位挥发性成分及抗氧化活性分析[J].广西植物, 2018, 38(7):943-952.
YANG Y, GAO J F.Volatile components and their antioxidant activities in different parts of Kadsura coccinea[J].Guihaia, 2018, 38(7):943-952.
[7] 李志春, 孙健, 封毅, 等.黑老虎果毒理实验及其对血脂的调节作用[J].食品科学, 2011, 32(1):203-205.
LI Z C, SUN J, FENG Y, et al.An experimental animal investigation on toxicity and blood lipid modulating effect of Kadsura coccinea fruit[J].Food Science, 2011, 32(1):203-205.
[8] 高渐飞, 李苇洁, 龙世林, 等.冷饭团果实营养成分与利用价值研究[J].中国南方果树, 2016, 45(5):84-87.
GAO J F, LI W J, LONG S L, et al.Analysis and evaluation on the nutritional components of of Kadsura coccinea fruit[J].South China Fruits, 2016, 45(5):84-87.
[9] 谢玮. 黔东黑老虎果营养品质评价[J].食品工业科技, 2019, 40(11):249-253.
XIE W.Nutritional quality evaluation of Kadsura coccinea fruit in eastern Guizhou[J].Science and Technology of Food Industry, 2019, 40(11):249-253.
[10] 邹建文, 饶红欣, 罗先权, 等.黑老虎果实的加工特性与营养成分[J].湖南农业大学学报(自然科学版), 2019, 45(6):679-684.
ZOU J W, RAO H X, LUO X Q, et al.Characterization of the processing characteristics and nutritional components of Kadsura coccinea fruit[J].Journal of Hunan Agricultural University (Natural Sciences), 2019, 45(6):679-684.
[11] 邹建文, 饶红欣, 何润华, 等.粉碎粒度对黑老虎果浆理化性质和内含物含量的影响[J].南方农业学报, 2019, 50(11):2 532-2 538.
ZOU J W, RAO H X, HE R H, et al.Effects of crushing mesh number on physicochemical properties and contents of embedded components for Kadsura coccinea fruit pulps[J].Journal of Southern Agriculture, 2019, 50(11):2 532-2 538.
[12] 洪荣艳, 王森, 邵凤侠, 等.黑老虎表型性状相关性及主成分分析[J].森林与环境学报, 2020, 40(5):542-547.
HONG R Y, WANG S, SHAO F X, et al.Correlation and principal component analysis of phenotypic traits of channel Kadsura coccinea[J].Journal of Forest and Environment, 2020, 40(5):542-547.
[13] 毛云玲, 付玉嫔, 祁荣频, 等.云南黑老虎不同种源氨基酸和其他指标的分析与评价[J].氨基酸和生物资源, 2015, 37(2):14-19.
MAO Y L, FU Y P, QI R P, et al.Analysis and evaluation of amino acids and other indicators of Kadsura coccinea from different areas of Yunnan[J].Amino Acids & Biotic Resources, 2015, 37(2):14-19.
[14] 谢玮, 杨涛, 赵雯霖.黑老虎籽功能成分分析及其应用前景展望[J].食品研究与开发, 2016, 37(12):1-5.
XIE W, YANG T, ZHAO W L.The functional components analysis and application prospect of Kadsura coccinea seed[J].Food Research and Development, 2016, 37(12):1-5.
[15] 高渐飞, 杨艳, 周玮.冷饭团果实挥发性成分鉴定与分析[J].中国南方果树, 2017, 46(6):76-80;84.
GAO J F, YANG Y, ZHOU W.Identification and analysis of volatile compounds of Kadsura coccinea fruit[J].South China Fruits, 2017, 46(6):76-80;84.
[16] HOLMES E, NICHOLSON J K, NICHOLLS A W, et al.The identification of novel biomarkers of renal toxicity using automatic data reduction techniques and PCA of proton NMR spectra of urine[J].Chemometrics and Intelligent Laboratory Systems, 1998, 44(1-2):245-255.
[17] 徐旻, 林东海, 刘昌孝.代谢组学研究现状与展望[J].药学学报, 2005, 40(9):769-774.
XU M, LIN D H, LIU C X.Current status and prospect of metabonomics[J].Acta Pharmaceutica Sinica, 2005, 40(9):769-774.
[18] FRAGA C G, CLOWERS B H, MOORE R J, et al.Signature-discovery approach for sample matching of a nerve-agent precursor using liquid chromatography-mass spectrometry, XCMS, and chemometrics[J].Analytical Chemistry, 2010, 82(10):4 165-4 173.
[19] THÉVENOT E A, ROUX A, XU Y, et al.Analysis of the human adult urinary metabolome variations with age, body mass index, and gender by implementing a comprehensive workflow for univariate and OPLS statistical analyses[J].Journal of Proteome Research, 2015, 14(8):3 322-3 335.
[20] 翟巍, 李冰华, 闫臻, 等.有机酸与人体健康[J].医学研究杂志, 2012, 41(7):18-20.
ZHAI W, LI B H, YAN Z, et al.Organic acids and human health[J].Journal of Medical Research, 2012, 41(7):18-20.
[21] 夏海涛, 侯近龙, 刘玉芬.高效液相色谱法分析大豆中磷脂酰胆碱的分子种[J].分析试验室, 2003, 22(1):9-11.
XIA H T, HOU J L, LIU Y F.Analysis of soybean phosphatidylcholine molecular species using high performance liquid chromatography[J].Analytical Laboratory, 2003, 22(1):9-11.
[22] LIMA M S, CARNEIRO A B, SOUTO-PADRON T, et al.Triatoma infestans relies on salivary lysophosphatidylcholine to enhance Trypanosoma cruzi transmission[J].Acta Tropica, 2018, 178:68-72.
[23] FOX L M, COX D G, LOCKRIDGE J L, et al.Recognition of lyso-phospholipids by human natural killer T lymphocytes[J].PLoS Biology, 2009, 7(10):e1000228.