多酚广泛存在于植物中,根据其结构不同可以分为酚酸类、黄酮类、芪类和木酚素等[1],对人体有抗氧化、抗炎症、预防肥胖、糖尿病等功效[2]。食用菌中富含多酚,且多以酚酸化合物存在,包括苯甲酸类和黄烷-3-醇类等。姬松茸(Agaricus brasiliensis)又名巴西蘑菇,是蘑菇属的一种名贵食药用真菌,其菌肉有杏仁味,营养丰富,含有多糖、甾醇和维生素等营养活性成分,具有较高的抗癌活性和增强免疫的功能[3]。双孢蘑菇(Agaricus bisporus)栽培范围广、产量大,肉质肥美、营养价值高,富含多酚、多糖、氨基酸、矿物质等成分,抗过敏、抗肿瘤和抗氧化等作用显著[4]。
姬松茸和双孢蘑菇栽培方式相似,作为2种重要的食用菌,关于其多酚组成已有一些文献报道。如CARVAJAL等[5]从姬松茸子实体和菌丝体中均分离出没食子酸、丁香酸和焦性没食子酸。但现有的文献均是采用高效液相色谱法对其组成进行鉴定,仅可测得所选的酚化合物标准品是否存在于待测样品中,而无法全面测得样品中的酚化合物组成。
本文拟采用超高效液相色谱-电喷雾飞行时间质谱(ultra performance liquid chromatography-electrospray time- of- flight- mass spectrometry,UPLC-ESI-TOF-MS)对实验室栽培获得的姬松茸和双孢蘑菇子实体中的酚化合物组成进行初步分离鉴定,并对其多酚提取液的DPPH自由基清除能力、Fe2+螯合能力和还原力进行测定,综合评价2种食用菌子实体多酚提取液的体外抗氧化活性。
1 材料与方法
1.1 材料与试剂
姬松茸与双孢蘑菇子实体由本实验室采用常规方法栽培获得。采摘子实体后,除去菇脚的泥土等杂质后冷冻干燥,粉碎过80目筛,密封置于冰箱中保存。
没食子酸,上海源叶生物科技有限公司;福林酚、DPPH、啡咯嗪,北京索莱宝科技有限公司;甲醇(色谱纯),天津市康科德科技有限公司;Na2CO3、乙醇、铁氰化钾、三氯乙酸、FeCl2等均为国产分析纯。
1.2 仪器与设备
UV752紫外可见分光光度计,上海赫尔普国际贸易有限公司;UPLC-Triple-TOF/MS系统、AcquityTM ultra型高效液相色谱仪,美国Waters公司;Triple TOF 5600+型飞行时间质谱(配有电喷雾离子源),美国AB SCIEX公司;ZORBAX-SB C18(100 mm×4.6 mm i.d.,1.8 μm)色谱柱,美国安捷伦公司。
1.3 实验方法
1.3.1 多酚的提取
按照CHETHAN等[6]的方法略作改动。分别准确称取2.00 g子实体粉末,用石油醚(30~60 ℃)脱脂,转移至50 mL的锥形瓶中,分别加入20 mL甲醇,超声提取30 min,离心取上清液,将滤渣采用相同方式进行复提,合并2次上清液。将上清液冷冻干燥,用甲醇定容至一定体积,保存至冰箱中待测。
1.3.2 多酚组成的鉴定
液相条件:流动相由0.1%甲酸溶液和0.1%甲酸乙腈组成,流速0.8 mL/min;检测波长280 nm;进样量5 μL;柱温箱30 ℃;梯度洗脱程序为:0~2 min,5%B;2~25 min, 5%~35% B;25~35 min,35%~95% B;35~37 min,95% B;37~40 min,95%~5% B;柱温30 ℃;进样量5 μL;流速0.8 mL/min。
质谱条件:UPLC-Triple-TOF 5600+飞行时间液质联用仪,由于蘑菇中的酚化合物多为酚酸[7],解离为阴离子,因此采用负离子扫描模式;扫描范围:100~1 500 m/z;雾化气(GS1):50 psi;雾化气(GS2):50 psi;气帘气(CUR):35 psi;离子源温度(TEM):550 ℃(负);离子源电压(IS):-4 500 V;一级扫描:去簇电压(DP):100 V,聚焦电压(CE):10 V;二级扫描:使用TOF MS~Product Ion~IDA模式采集质谱数据,CID能量为-20、-40、-60 V,进样前,用CDS泵做质量轴校正,使质量轴误差<2×10-6[8-9]。
1.3.3 多酚提取液体外抗氧化活性的测定
姬松茸和双孢蘑菇多酚提取液中多酚含量的测定:采用福林酚比色法[10]。以没食子酸为标准品进行标准曲线的绘制:Y=7.167 1X-0.003 5(R2=0.999 8,X为没食子酸的浓度,Y为对应浓度下的OD值)。样品中的多酚含量用每克样品(干重)中的没食子酸当量来表示,单位为mg GAE/g DW。
姬松茸和双孢蘑菇多酚提取液DPPH自由基清除能力的测定[11]:在2 mL不同浓度的样液中加入2 mL DPPH溶液(0.2 mmol/L),摇匀,静置30 min,对照用甲醇代替样品,空白管为样品加70%的乙醇(即DPPH的溶剂)。517 nm处测OD值。按公式(1)计算DPPH自由基清除能力:
DPPH自由基清除能力![]()
(1)
式中:A0,对照吸光度值;A1,样品吸光度值;A2,空白吸光度值。
姬松茸和双孢蘑菇多酚提取液还原力的测定[12]:当溶液中存在还原剂时,Fe3+和铁氰化物复合物会接受还原剂给出的电子转化为Fe2+形式的化合物,进而两者反应生成普鲁士蓝(Fe4[Fe(CN)6]3),其在700 nm处有最强吸收峰,溶液颜色由原来的黄色变成不同程度的绿色-蓝色,故测定700 nm处的OD值即可测定Fe2+浓度。OD值越大,表示还原力越强。
测定方法为:在1 mL不同浓度的样液中分别依次加入2.5 mL磷酸缓冲液(50 mmol/L,pH 7.0)和2.5 mL质量分数为1%铁氰化钾溶液,50 ℃保温20 min,然后迅速冷却,加入2.5 mL质量分数为10%三氯乙酸溶液,离心,取上清液。1.25 mL上清液中依次加入1.25 mL蒸馏水和0.25 mL质量分数为0.1%FeCl3溶液,混合均匀,静置10 min,700 nm处测OD值。
姬松茸和双孢蘑菇多酚提取液Fe2+螯合能力的测定[13]:在1.6 mL不同浓度的样液中分别依次加入1.6 mL蒸馏水、0.4 mL 0.5 mmol/L FeCl2、0.4 mL 0.5 mmol/L Ferrozine,然后剧烈摇动1 min,室温放置20 min后,562 nm处测OD值。空白管(A0)用蒸馏水代替样液。按公式(2)计算Fe2+螯合能力:
Fe2+螯合能力![]()
(2)
式中:A1,样品吸光度值,A0,空白吸光度值。
1.4 数据处理
实验设3次重复,数据采用平均值±标准差表示,多个均数间的两两比较用Duncan多重比较法进行。
2 结果与分析
2.1 姬松茸和双孢蘑菇子实体中多酚组成的鉴定
姬松茸子实体甲醇提取液经过UPLC-ESI-TOF-MS分析后,根据其质谱数据并结合Scifinder和Reaxy数据库检索,初步鉴定出以下10种酚类物质,其一级和二级质谱图及结构图和相关信息如电子版本中的附图1和表1所示。
化合物A:[M-H]-为237.089 0,根据高分辨质谱结果拟合的分子式为C11H14N2O4,根据二级质谱m/z 219[M-18-H]和m/z 193[M-44-H]等碎片离子,化合物结构中存在1个羧基,结合Scifinder和Reaxy数据库检索,推测该化合物为甘氨酰-L-酪氨酸。
表1 姬松茸和双孢蘑菇酚化合物的信息表
Table 1 Information of phenolic compounds from A.brasiliensis and A.bisporus

样品保留时间/min分子式分子质量化合物名称姬松茸6.91C11H12N2O3220.085-羟基色氨酸7.65C9H9NO4195.052-乙酰氨基-3-羟基苯甲酸10.03C13H14N2O6294.09acromelic acid E11.90C12H14N2O4250.10邻-丁二酰胺基-苯甲酸甲酯姬松茸和双孢蘑菇1.74C11H14N2O4238.09甘氨酰-L-酪氨酸2.38C12H15N3O4265.11β-N-(γ-谷氨酰)-4-甲酰基苯肼6.11C13H17N3O5295.12甲基戊酸9.99C7H6O2122.044-羟基苯甲醛10.66C11H18N2O4242.13L-焦谷氨酰-L-亮氨酸12.44C14H16N2O4276.11L-焦谷氨酰-L-苯丙氨酸双孢蘑菇1.97C10H14N2O6258.095-羟脯氨酰-L-谷氨酸5.13C7H6O4154.033,4-二羟基苯甲酸6.78C14H16N2O5292.11(2R,4R)-2-[(1H-吲哚-3-基)甲基]-4-氨基-2-羟基戊烷-1,5-二酸8.09C11H13NO4223.08环磷酰胺9.83C11H14N4O3250.11阿朴鸟嘌呤A11.32C10H12N2O3208.08犬尿氨酸
化合物B:[M-H]-为264.099 8,根据高分辨质谱结果拟合的分子式为C12H15N3O4,根据二级质谱m/z 246[M-18-H],m/z 220[M-44-H]和m/z 203[M-44-17-H]等碎片离子,化合物结构中存在羧基和氨基,结合Scifinder和Reaxy数据库检索,推测该化合物为β-N-(γ-谷氨酰)-4-甲酰基苯肼。
化合物C:[M-H]-为294.110 3,根据高分辨质谱结果拟合的分子式为C13H17N3O5,根据二级质谱m/z 276[M-18-H],m/z 250[M-44-H]和m/z 233[M-44-17-H]等碎片离子,化合物结构中存在羧基和氨基,结合Scifinder和Reaxy数据库检索,推测该化合物为甲基戊酸。
化合物D:[M-H]-为219.078 4,根据高分辨质谱结果拟合的分子式为C11H12N2O3,根据二级质谱m/z 201[M-18-H]和m/z 219[M-28-H]等碎片离子,结构中存在羧基,结合Scifinder和Reaxy数据库检索,推测该化合物为5-羟基色氨酸。
化合物E:[M-H]-为194.047 2,根据高分辨质谱结果拟合的分子式为C9H9NO4,根据二级质谱m/z 152[M-42-H]和m/z 108[M-42-44-H]等碎片离子,化合物结构中存在羧基和羰基,结合Scifinder和Reaxy数据库检索,推测该化合物为2-乙酰氨基-3-羟基苯甲酸。
化合物F:[M-H]-为121.031 8,根据高分辨质谱结果拟合的分子式为C7H6O2,根据二级质谱[M-29-H]等碎片离子,以及Scifinder和Reaxy数据库检索,推测该化合物为4-羟基苯甲醛。
化合物G:[M-H]-为293.079 0,根据高分辨质谱结果拟合的分子式为C13H14N2O6,根据二级质谱m/z 249[M-44-H]和m/z 204[M-45-44-H]等碎片离子,化合物结构中存在羧基,结合Scifinder和Reaxy数据库检索,推测该化合物为acromelic acid E。
化合物H:[M-H]-为241.120 5,根据高分辨质谱结果拟合的分子式为C11H18N2O4,根据二级质谱m/z 197[M-44-H]和m/z 168[M-44-29-H]等碎片离子,化合物结构中存在羧基和羰基,结合Scifinder和Reaxy数据库检索及大量文献,推测该化合物为L-焦谷氨酰-L-亮氨酸。
化合物I:[M-H]-为249.089 1,根据高分辨质谱结果拟合的分子式为C12H14N2O4,根据二级质谱m/z 204[M-45-H]和m/z 168[M-58-H]等碎片离子,化合物结构中存在酰胺,结合Scifinder和Reaxy数据库检索,推测该化合物为邻-丁二酰胺基-苯甲酸甲酯。
化合物J:[M-H]-为275.104 7,根据高分辨质谱结果拟合的分子式为C14H16N2O4,根据二级质谱m/z 231[M-44-H]等碎片离子,化合物结构中存在羧基,结合Scifinder和Reaxy数据库检索,推测该化合物为L-焦谷氨酰-L-苯丙氨酸。
双孢蘑菇子实体甲醇提取液经过UPLC-ESI-TOF-MS分析后,根据其质谱数据并结合Scifinder和Reaxy数据库检索,初步鉴定出12种酚类物质,其中有6种与从姬松茸中分离鉴定的酚化合物一样,分别为:甘氨酰-L-酪氨酸、β-N-(γ-谷氨酰)-4-甲酰基苯肼、甲基戊酸、4-羟基苯甲醛、L-焦谷氨酰-L-亮氨酸和L-焦谷氨酰-L-苯丙氨酸。其余6种酚化合物的一级和二级质谱图及结构图和相关信息如附图2和表1所示。
化合物a:[M-H]-为257.078 4,根据高分辨质谱结果拟合的分子式为C10H14N2O6,根据二级质谱m/z 239[M-18-H],m/z 213[M-44-H]和m/z 169[M-44-17-H]等碎片离子,化合物结构中存在羧基,结合Scifinder和Reaxy数据库检索,推测该化合物为5-羟脯氨酰-L-谷氨酸。
化合物b:[M-H]-为153.020 2,根据高分辨质谱结果拟合的分子式为C7H6O4,根据二级质谱m/z 109[M-44-H]和m/z 91[M-44-18-H]等碎片离子,该化合物结构中存在羧基,结合Scifinder和Reaxy数据库检索,推测该化合物为3,4-二羟基苯甲酸。
化合物c:[M-H]-为291.099 1,根据高分辨质谱结果拟合的分子式为C14H16N2O5,根据二级质谱m/z 247[M-44-H]和m/z 230[M-17-44-H]等碎片离子,化合物结构中存在羧基和氨基,结合Scifinder和Reaxy数据库检索,推测该化合物为(2R,4R)-2-[(1H-吲哚-3-基)甲基]-4-氨基-2-羟基戊烷-1,5-二酸。
化合物d:[M-H]-为222.077 9,根据高分辨质谱结果拟合的分子式为C11H13NO4,根据二级质谱[M-30-H]和[M-30-15-H]等碎片离子,结合Scifinder和Reaxy数据库检索,推测该化合物为环磷酰胺。
化合物e:[M-H]-为249.099 5,根据高分辨质谱结果拟合的分子式为C11H14N4O3,根据二级质谱m/z 205[M-44-H]和m/z 163[M-42-44-H]等碎片离子,化合物结构中存在羧基,结合Scifinder和Reaxy数据库检索,推测该化合物为阿朴鸟嘌呤A。
化合物f:[M-H]-为207.078 3,根据高分辨质谱结果拟合的分子式为C10H12N2O3,根据二级质谱m/z 163[M-44-H],m/z 121[M-44-42-H]和m/z 121[M-44-42-17H]等碎片离子,化合物结构中存在羧基和氨基,结合Scifinder和Reaxy数据库检索,推测该化合物为犬尿氨酸。
2.2 姬松茸和双孢蘑菇子实体多酚提取液的体外抗氧化活性
首先测定了姬松茸和双孢蘑菇子实体中的多酚含量(图1-a),结果显示姬松茸中的多酚含量显著高于双孢蘑菇(P<0.05),分别为22.21和19.58 mg GAE/g。之后对2种子实体多酚提取液的体外抗氧化活性(DPPH自由基清除能力、还原力和Fe2+螯合能力)进行了测定。

a-多酚含量;b-DPPH自由基清除能力;c-还原力;d-Fe2+螯合能力
图1 姬松茸和双孢蘑菇多酚提取液的多酚含量和体外抗氧化活性
Fig.1 Polyphenols contents and antioxidant properties in vitro of extracts from A.brasiliensis and A.bisporus
从图1可知,姬松茸和双孢蘑菇多酚提取液的DPPH自由基清除能力、还原力和Fe2+螯合能力均随着提取液浓度的提高而逐渐提高。姬松茸和双孢蘑菇在提取液质量浓度为4.0 mg/mL时对DPPH自由基清除能力达到最强,分别为81.09%和72.98%。2种蘑菇子实体提取液质量浓度为10.0 mg/mL时,其还原力最强,在此浓度下对Fe2+螯合能力也达到最强,分别为93.02%和88.99%。
为了更好地反映2种子实体的体外抗氧化活性,对各抗氧化指标的EC50值进行了计算,结果如表2所示。双孢蘑菇提取液各抗氧化指标的EC50值均显著高于姬松茸,这说明姬松茸子实体提取液的体外抗氧化活性显著强于双孢蘑菇(P<0.05)。
表2 姬松茸和双孢蘑菇多酚提取液抗氧化活性的EC50值
Table 2 EC50values in antioxidant activities of A.brasiliensis and A.bisporus
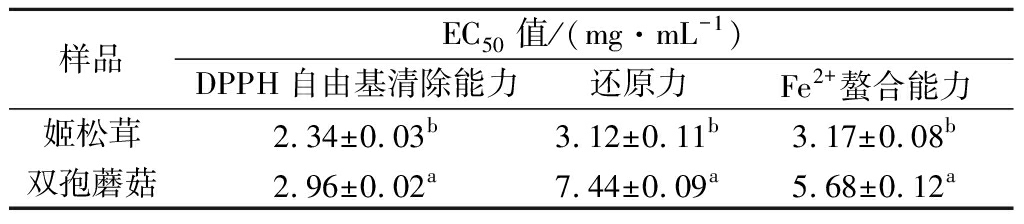
样品EC50值/(mg·mL-1)DPPH自由基清除能力还原力Fe2+螯合能力姬松茸2.34±0.03b3.12±0.11b3.17±0.08b双孢蘑菇2.96±0.02a7.44±0.09a5.68±0.12a
3 结论与讨论
本实验采用UPLC-ESI-TOF-MS对姬松茸和双孢蘑菇子实体中的酚化合物组成进行了初步分离鉴定,分离到了16种酚化合物,分别为:甘氨酰-L-酪氨酸、β-N-(γ-谷氨酰)-4-甲酰基苯肼、甲基戊酸、5-羟基色氨酸、2-乙酰氨基-3-羟基苯甲酸、4-羟基苯甲醛、acromelic acid E、L-焦谷氨酰-L-亮氨酸、邻-丁二酰胺基-苯甲酸甲酯、L-焦谷氨酰-L-苯丙氨酸、5-羟脯氨酰-L-谷氨酸、3,4-二羟基苯甲酸、(2R,4R)-2-[(1H-吲哚-3-基)甲基]-4-氨基-2-羟基戊烷-1,5-二酸、环磷酰胺、阿朴鸟嘌呤A和犬尿氨酸。在这16种酚化合物中,有6种是同时存在于2种食用菌中的。2种蘑菇子实体的多酚含量分别为22.21和19.58 mg GAE/g。并对姬松茸和双孢蘑菇子实体多酚提取液体外抗氧化性进行了测定,得出姬松茸和双孢蘑菇子实体提取液的DPPH自由基清除能力、还原力和Fe2+螯合能力均随着提取液浓度的提高而逐渐提高。且在提取液质量浓度为4.0 mg/mL时对DPPH自由基清除能力达到最强,分别为81.09%和72.98%;在提取液质量浓度为10.0 mg/mL时,其还原力最强,在此浓度下对Fe2+螯合能力也达到最强,分别为93.02%和88.99%。且通过计算EC50值得出,姬松茸子实体提取液的体外抗氧化活性显著强于双孢蘑菇。以上结果说明姬松茸和双孢蘑菇具有被开发为功能食品或添加剂的潜力。
伞菌氨酸(β-N-(γ-谷氨酰)-4-羟甲基苯肼)具有明确的抗肿瘤、治疗糖尿病、诱导白血病细胞凋亡等活性作用[14-16],近年来引起了普遍的关注。本实验从姬松茸和双孢蘑菇子实体中分离到β-N-(γ-谷氨酰)-4-甲酰基苯肼是合成伞菌氨酸的中间体[17]。CHULIA等[18]曾报道从四孢蘑菇(Agaricus campestris)的子实体中分离到β-N-(γ-谷氨酰)-4-甲酰基苯肼,还未发现从姬松茸和双孢蘑菇中分离到β-N-(γ-谷氨酰)-4-甲酰基苯肼的报导。CARVAJAL等[5]报道在姬松茸子实体和菌丝体中均分离到没食子酸、丁香酸和焦性没食子酸,而在本次实验中均没有分离到这3种酚酸化合物。研究报道表明4-羟基苯甲酸存在于双孢蘑菇、糙皮侧耳(Pleurotus ostreatus)、杏鲍菇(Pleurotus eryngi)、香菇(Lentinus edodes)等蘑菇的子实体和菌丝体中[7,19],YAO等[20]在裂褶菌(Schizophyllum commune)的子实体中也分离到4-羟基苯甲酸。本实验从姬松茸中也分离到了4-羟基苯甲酸。REIS等[7]曾报道在双孢蘑菇的菌丝体里发现有4-羟基苯甲酸,这与本文实验结果是一致的。此外,还有文献报道在姬松茸和双孢蘑菇的子实体中存在没食子酸、桂皮酸和焦性没食子酸[5,19,21-23],而在本实验中却没有分离到。导致这些结果差异的原因,可能是由于子实体栽培条件或培养基质不同导致的,也可能是由于检测条件不同所导致的,亦有可能是因为在本次实验中还未鉴定出来。
很多研究表明多酚含量与抗氧化性具有明确的正相关性,那酚类物质的组成与抗氧化性是什么关系?REIS等[7]研究分析了双孢蘑菇、糙皮侧耳、杏鲍菇、香菇的子实体和菌丝体的抗氧化性以及样品中的酚酸化合物,发现样品中的单一酚酸化合物(含量)与抗氧化性之间没有明确的相关性,也就是说,某一种高含量的酚酸不一定能导致高的抗氧化性。PALACIOS等[21]的研究结果也得到了相同的结论。在本实验中由于没有测定分离到酚化合物的绝对含量,所以无法与抗氧化性的相关性进行分析,具体的结论还有待进一步的实验研究。本实验从姬松茸和双孢蘑菇中分离到的多种酚化合物具有各自的活性作用,例如4-羟基苯甲酸的抗神经衰弱功能[20]和抗炎作用[19],β-N-(γ-谷氨酰)-4-甲酰基苯肼[或β-N-(γ-谷氨酰)-4-羟甲基苯肼]的抗肿瘤、治疗糖尿病等活性作用[14-16]。因此,该研究为双孢蘑菇和姬松茸开发成相关的功能食品或产品提供依据。
[1] FRAGA C G, CROFT K D, KENNEDY D O, et al.The effects of polyphenols and other bioactives on human health[J].Food & Function, 2019, 10(2):514-528.
[2] DI LORENZO C, COLOMBO F, BIELLA S, et al.Polyphenols and human health:The role of bioavailability[J].Nutrients, 2021, 13(1):273.
[3] LARGETEAU M L, LLARENA-HERN NDEZ R C, REGNAULT-ROGER C, et al.The medicinal Agaricus mushroom cultivated in Brazil:Biology, cultivation and non-medicinal valorization[J].Applied Microbiology and Biotechnology, 2011, 92(5):897-907.
NDEZ R C, REGNAULT-ROGER C, et al.The medicinal Agaricus mushroom cultivated in Brazil:Biology, cultivation and non-medicinal valorization[J].Applied Microbiology and Biotechnology, 2011, 92(5):897-907.
[4] CREMADES O, DIAZ-HERRERO M M, CARBONERO-AGUILAR P, et al.Preparation and characterisation of selenium-enriched mushroom aqueous enzymatic extracts (MAEE) obtained from the white button mushroom (Agaricus bisporus)[J].Food Chemistry, 2012, 133(4):1 538-1 543.
[5] CARVAJAL A E S S, KOEHNLEIN E A, SOARES A A, et al.Bioactives of fruiting bodies and submerged culture mycelia of Agaricus brasiliensis (A.blazei) and their antioxidant properties[J].LWT-Food Science and Technology, 2012, 46(2):493-499.
[6] CHETHAN S, MALLESHI N G.Finger millet polyphenols:Optimization of extraction and the effect of pH on their stability[J].Food Chemistry, 2007, 105:862-870.
[7] REIS F S, MARTINS A, BARROS L, et al.Antioxidant properties and phenolic profile of the most widely appreciated cultivated mushrooms:A comparative study between in vivo and in vitro samples[J].Food and Chemical Toxicology, 2012, 50(5):1 201-1 207.
[8] 沈清, 楼乐燕, 尹培, 等.5种梅干菜的酚类化合物及抗氧化能力比较分析[J].食品科学, 2018, 39(12):212-218.
SHEN Q, LOU L Y, YIN P, et al.Phenolic compounds and antioxidant capacity of five pickled and dried mustard brands[J].Food Science, 2018, 39(12):212-218.
[9] 陈凯利. 葡萄风信子MYB和bHLH转录因子对花青苷合成的调控研究[D].杨凌:西北农林科技大学, 2017.
CHEN K L.The regulation of anthocyanin biosynthesis by MYB and bHLH transcription factors in grape hyacinth(Muscari armeniacum)[D].Yangling:Northwest A & F University, 2017.
[10] MCDONALD S, PRENZLER P D, ANTOLOVICH M, et al.Phenolic content and antioxidant activity of olive extracts[J].Food Chemistry, 2001, 73(1):73-84.
[11] BLOIS M S.Antioxidant determinations by the use of a stable free radical[J].Nature, 1958, 181:1 199-1 200.
[12] OYAIZU M.Studies on products of browning reaction.Antioxidative activities of products of browning reaction prepared from glucosamine[J].The Japanese Journal of Nutrition and Dietetics, 1986, 44(6):307-315.
[13] TALAZ O, GÜLÇIN  , GÖKSU S, et al.Antioxidant activity of 5, 10-dihydroindeno[1, 2-b]indoles containing substituents on dihydroindeno part[J].Bioorganic & Medicinal Chemistry, 2009, 17(18):6 583-6 589.
, GÖKSU S, et al.Antioxidant activity of 5, 10-dihydroindeno[1, 2-b]indoles containing substituents on dihydroindeno part[J].Bioorganic & Medicinal Chemistry, 2009, 17(18):6 583-6 589.
[14] BAUMGARTNER D, HOESCH L, RAST D M.The biogenesis of β-N-(γ-glutamyl)-4-hydroxymethylphenylhydrazine (agaritine) in Agaricus bisporus[J].Phytochemistry, 1998, 49(1):465-474.
[15] AKIYAMA H, ENDO M, MATSUI T, et al.Agaritine from Agaricus blazei Murrill induces apoptosis in the leukemic cell line U937[J].Biochimica et Biophysica Acta, 2011, 1810(5):519-525.
[16] KAZEEM M I, DAVIES T C.Anti-diabetic functional foods as sources of insulin secreting, insulin sensitizing and insulin mimetic agents[J].Journal of Functional Foods, 2016, 20:122-138.
[17] LE GOFF G, OUAZZANI J.Natural hydrazine-containing compounds:Biosynthesis, isolation, biological activities and synthesis[J].Bioorganic & Medicinal Chemistry, 2014, 22(23):6 529-6 544.
[18] CHULIA A J, BERNILLON J, FAVRE-BONVIN J, et al.Isolation of β-N-(γ-glutamyl)-4-formylphenylhydrazine (agaritinal) from Agaricus campestris[J].Phytochemistry, 1988, 27(3):929-930.
[19] TAOFIQ O, CALHELHA R C, HELENO S, et al.The contribution of phenolic acids to the anti-inflammatory activity of mushrooms:Screening in phenolic extracts, individual parent molecules and synthesized glucuronated and methylated derivatives[J].Food Research International, 2015, 76:821-827.
[20] YAO H M, WANG G, LIU Y P, et al. Phenolic acids isolated from the fungus Schizophyllum commune exert analgesic activity by inhibiting voltage-gated sodium channels[J]. Chinese Journal of Natural Medicines, 2016, 14(9): 661-670.
[21] PALACIOS I, LOZANO M, MORO C, et al.Antioxidant properties of phenolic compounds occurring in edible mushrooms[J].Food Chemistry, 2011, 128(3):674-678.
[22] ISLAM T, YU X M, XU B J.Phenolic profiles, antioxidant capacities and metal chelating ability of edible mushrooms commonly consumed in China[J].LWT - Food Science and Technology, 2016, 72:423-431.
[23] CARNEIRO A A J, FERREIRA I C F R, DUE AS M, et al.Chemical composition and antioxidant activity of dried powder formulations of Agaricus blazei and Lentinus edodes[J].Food Chemistry, 2013, 138(4):2 168-2 173.
AS M, et al.Chemical composition and antioxidant activity of dried powder formulations of Agaricus blazei and Lentinus edodes[J].Food Chemistry, 2013, 138(4):2 168-2 173.