发酵是保存各种时令蔬菜最古老的方法之一[1]。泡菜是利用有益微生物对新鲜蔬菜进行加工的一种方式,其发展历史悠久,且已从传统小型家庭作坊式生产发展为工业化大规模生产,它们的生产工艺分别如图1和图2所示[2-3]。在蔬菜发酵过程中,因原辅料、发酵工艺、地域文化等差异,可分为榨菜、泡菜及酱菜等不同类型[2]。在我国,极具代表性的泡菜首推四川泡菜,其年产量约占我国泡菜年产总量的70%[4]。四川泡菜常以新鲜蔬菜或特殊的动物肉类为主要原料,添加或不添加辅料,经食盐水泡渍发酵而成[1]。

图1 泡菜的传统生产工艺流程
Fig.1 The traditional production process of pickle
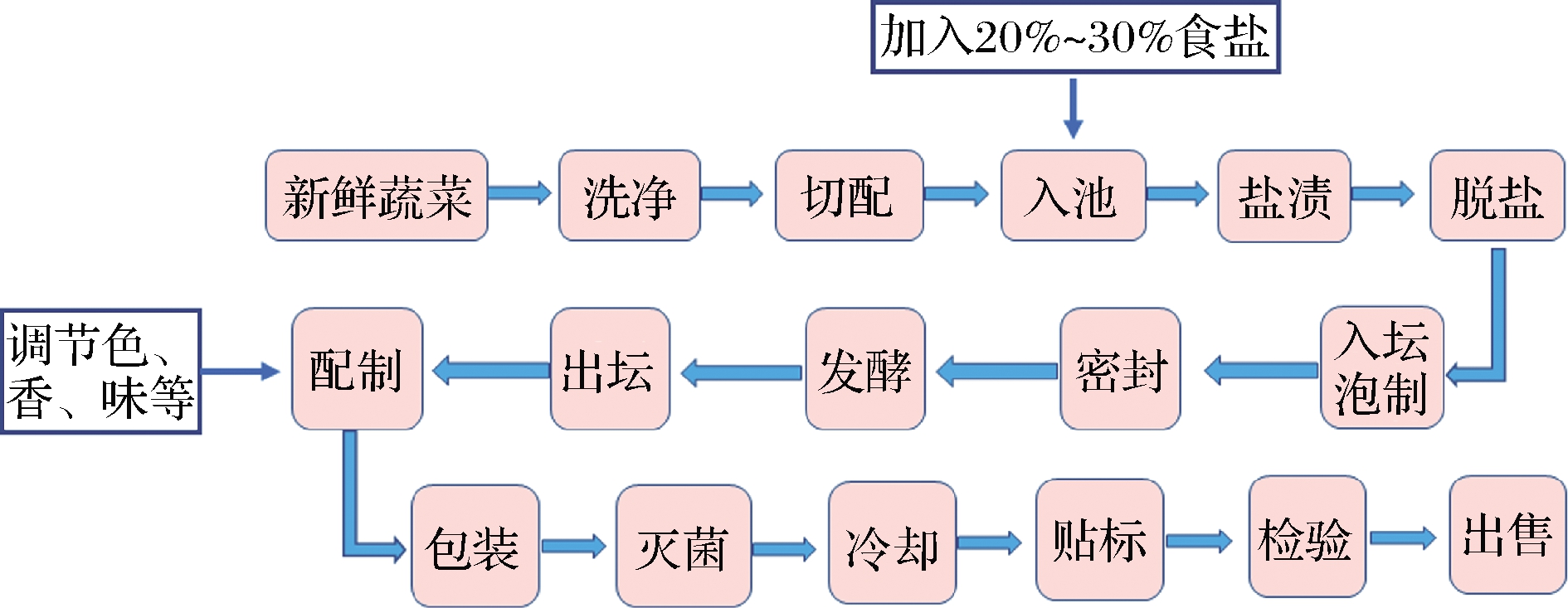
图2 泡菜的工业化生产工艺流程
Fig.2 The industrilized production process of pickle
发酵蔬菜中富含维生素、膳食纤维、有机酸、矿物质、益生菌和氨基酸等多种有益成分,同时,发酵后的蔬菜也更易于消化[5]。相关研究表明,发酵蔬菜具有净肠、预防肠炎、抗动脉硬化、抗氧化、降血压、抗衰老、降低胆固醇、抗过敏和抗癌等多种功效[6-8]。蔬菜经过发酵,还能产生大量对人体矿物质吸收有益的有机酸,如乳酸、醋酸[9]。泡菜中还含有以乳酸菌为代表的多种益生菌,这些微生物可以到达胃肠道并维持胃肠道平衡,它们还可与病原菌发生竞争作用,进而保护肠道健康[6]。在泡菜发酵过程中,某些化合物可被转化为具有生物活性的代谢物。例如,乳酸菌可把不同类型的黄酮糖苷转化成相应的游离型黄酮苷元,这些代谢物可减少体内毒素和抗营养物质的积累[10]。近年来,泡菜因其独特的风味、脆嫩清香的口感,已成为主要的调味料或餐前开胃菜,并越来越受欢迎[11]。
随着人们生活质量的提高,泡菜食品的安全性受到广泛关注。相关研究表明,以传统自然发酵为主的工业化泡菜常出现亚硝酸盐、生物胺等有毒有害物质污染问题[6]。目前,关于泡菜食品中亚硝酸盐的报道较多,而对于生物胺的研究相对较少[9]。蔬菜发酵离不开微生物的作用,研究发现,细菌是参与泡菜发酵的主要微生物,主要包括明串珠菌属(Leuconostoc)、乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、链球菌属(Streptococcus)、肠杆菌属(Enterobacter)和肠球菌属(Enterococcus)等,如:肠膜明串珠菌(Leuconostoc mesenteroides)、布氏乳杆菌(Lactobacillus brucei)、植物乳杆菌(Lactobacillus plantarum)、弯形乳杆菌(Lactobacillus curvatus)、巴伐利亚乳杆菌(Lactobacillus bavaria)、干酪乳杆菌(Lactobacillus casei)、食窦魏斯氏菌(Weissella cibaria)、脆假单胞菌(Pseudomonas fragi)等[12-15]。除细菌外,酵母菌等真菌也较为常见,如假丝酵母(Candida)、汉逊德巴利酵母(Debaryomyces hansenii)、汉逊酵母(Hanseniaspora)和毕赤酵母(Pichia pastoris)等[15-16]。
已有研究发现,在泡菜发酵过程中,一些微生物能够诱导氨基酸脱酸产生生物胺[10]。因此,发酵蔬菜不可避免受到生物胺的污染。在此,本文主要综述了生物胺的类型、产生机理、毒害作用、限量标准以及泡菜中生物胺的污染情况和控制方法,以期为泡菜食品的安全性研究及品质调控提供参考。
1 生物胺概述
1.1 生物胺的种类及产生机理
生物胺是一类具有生物活性的低分子质量碱性含氮有机化合物。根据分子结构特征可将生物胺划分为脂肪族生物胺(腐胺、尸胺、精胺、亚精胺等)、芳香族胺(酪胺、苯乙胺等)、杂环族胺(组胺、色胺等)[7]。食品中生物胺的稳定性很高,不会受到烹饪、熏制、冷冻等加工方式的破坏,因此在自然条件下很难发生降解。
除某些食品加工原料中带有少量生物胺外,食品中生物胺的形成主要有2种途径:一是由氨基酸脱羧产生,即在微生物的氨基酸脱羧酶作用下,使游离氨基酸脱羧,生成相应的生物胺,并伴随CO2的产生。在此情况下,生物胺的产生需要同时满足以下3个条件:(1)生物胺前体物质存在,即游离氨基酸;(2)具有氨基酸脱羧酶活性的微生物;(3)有利于微生物生长的适宜环境,温度、pH等[8]。生物胺由其对应的氨基酸在相应脱羧酶的作用下产生,脱羧酶是以5′-磷酸吡哆醛作为辅酶的磷酸吡哆醛依赖性酶。组氨酸脱羧酶分为两类:一类需要磷酸吡哆醛作为辅因子;另一类使用一个共价结合的丙酮酰基作为辅基。精氨酸通过精氨酸脱羧酶被转化为胍胺并进一步通过胍胺脱亚胺酶系统转化成腐胺,该酶系由3种酶组成:即丁胺脱亚氨酶,腐胺氨基甲酰基转移酶和氨基甲酸酯激酶[8]。二是由醛或酮的转氨作用生成,这类生物胺大多为脂肪族生物胺,例如腐胺和尸胺。由于食品在发酵过程中通常会导致微生物生长和游离氨基酸的产生,这就为生物胺的积累创造了前提条件。国内外研究发现,肠杆菌和假单胞菌主要产生组胺、尸胺和腐胺。乳杆菌,如布氏乳杆菌、植物乳杆菌、弯形乳杆菌和巴伐利亚乳杆菌等主要产生酪胺,也可产生组胺、尸胺、2-苯乙胺和腐胺。此外,酵母菌、芽胞杆菌(Bacillus)、肠杆菌、葡萄球菌(Staphylococcus)等也可产生生物胺[17]。物体内生物胺的产生机理见图3。

图3 生物胺的产生机理
Fig.3 The formation mechanism of biogenic amines
在生物体内,蛋白质在蛋白酶的作用下破坏空间构象,分解为多肽,多肽进一步在内肽酶和外肽酶的作用下分解成为游离的氨基酸,而氨基酸在相应氨基酸脱羧酶的作用下生成对应的生物胺。组胺、酪胺、色胺、尸胺分别由组氨酸、酪氨酸、色氨酸、赖氨酸转化形成,腐胺由鸟氨酸转化而来,而鸟氨酸则需由谷氨酸和精氨酸转化而成。而亚精胺及精胺则是腐胺在对应的合成酶作用下生成[7]。水产品中生物胺是由与其相关的微生物释放的外源脱羧酶将游离氨基酸羧化产生。产胺菌主要有摩氏摩根菌(Morganella morganii)、明亮发光杆菌(Photobacterium luminescens)、克雷伯氏菌(Klebsiella)、变形杆菌(Proteus)、芽胞杆菌、肠杆菌、木糖葡萄球菌(S. xylosus)、弧菌(Vibrio)、假单胞菌等,不同微生物的产胺能力不同[8,18]。
1.2 生物胺的毒害作用
食物中最常见的生物胺是腐胺、组胺、酪胺、色胺、尸胺、2-苯乙胺、亚精胺、精胺和胍丁胺等[10]。研究发现,少量的生物胺对人体或动物体没有较大的风险,但当摄入较高水平的生物胺时可导致毒理学症状,如当人体组胺摄入量高于500 mg/kg时,会引起头疼、恶心、呼吸窘迫、心悸、红疹、高血压、呕吐等过敏性中毒症状,严重的还可导致休克,甚至危及生命;尸胺和腐胺会引起咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐等症状,严重的会造成死亡;摄入过量的酪胺,会发生偏头痛、高血压等症状,甚至会留下心力衰竭、肺水肿等后遗症[2,10]。腐胺、尸胺有时与亚硝酸盐形成致癌物亚硝胺。而生物胺的毒性具有联合效应,尸胺和腐胺能够抑制肠道中二胺氧化酶和组胺-N-甲基转移酶的活性,从而增强了组胺的毒性作用。组胺是毒性最强的生物胺,其次是酪胺。相关研究表明,组胺急性毒性的半数致死量(median lethal dose,LD50)为220 mg/kg(小鼠经口),8~40 mg可引起轻微中毒,40 mg可引发中等中毒,100 mg即造成严重中毒;酪胺急性毒性LD50为229 mg/kg(小鼠经口),100 mg可引起偏头痛。组胺和酪胺是生物体内的抗营养化合物,可干扰营养物质的吸收。尸胺LD50为270 mg/kg(大鼠经口),腐胺LD50为1 600 mg/kg(小鼠经口)[11]。
1.3 食品中生物胺限量
由于生物胺具有较大危害性,有必要对食品中生物胺进行限量。目前,对于发酵蔬菜中组胺、酪胺、2-苯基乙胺和总生物胺的推荐限量值分别为100、100、30以及100~200 mg/kg[4]。此外,各国对水产品中生物胺也进行了限量,美国食品药品监督管理局规定了鲭鱼等相关鱼类中组胺限量为50 mg/kg。欧盟规定鱼类及其他食品中,组胺限量值为100 mg/kg[19]。欧美及我国要求水产品中酪胺含量不得超过100~800 mg/kg,此外,可食用肉制品的腐胺含量一般应控制在10~20 mg/kg,粮农组织设定鱼类中组胺的最大允许水平为200 mg/kg[11,20]。
1.4 食品中生物胺的主要控制方法
目前,在食品中生物胺的控制研究方面,主要采用物理、化学和生物等方法进行干预和调控[17-21]。物理干预方法有辐照、高静水压、调节包装环境气体组成、调节温度等[17,21]。化学干预方法主要是添加一些化学合成或天然的活性物质,如烟酸、甘氨酸、大蒜、丁香、山梨酸钾、苯甲酸钠等[18,21]。生物方法主要是通过接种有益的优势发酵菌种,抑制产生物胺的有害菌的生长,并提升产品质量[21-22]。
2 泡菜中的生物胺
2.1 泡菜中生物胺污染情况
相关研究表明,83%的发酵蔬菜中都存在生物胺[18]。由于泡菜种类繁多,又因其产地、加工工艺等的不同,因此,泡菜中生物胺的污染情况存在差异。表1总结了目前泡菜中的主要生物胺及污染情况。
表1 泡菜中生物胺污染情况
Table 1 Contamination of biogenic amines in pickle

泡菜来源生物胺类型含量/(mg·kg-1)参考文献韩国泡菜组胺腐胺酪胺尸胺精胺亚精胺100±6.7107±9.299.8±8.6111±9.782.5±6.194.3±7.9[23]台湾泡菜(零售店)组胺89[27]台湾泡菜(超市)组胺74[27]川渝市售泡菜腐胺组胺色胺尸胺酪胺(3.56±0.29)~(175.73±1.9)(5.84±0.32)~(77.90±2.57)(7.20±0.11)~(60.24±1.87)(1.69±0.14)~(149.26±7.27)(1.25±0.12)~(103.01±4.19)[24]家庭自制泡菜(中国)酪胺腐胺尸胺组胺203±3 338.2±53.07>150>180[28]四川工业泡菜腐胺尸胺组胺酪胺>210349.43±13.23 >200244.29±41.03 [28]塞尔维亚泡菜腐胺尸胺组胺亚精胺25~503.0~254.0~202.0~8.0[25]德国泡菜腐胺尸胺组胺酪胺亚精胺精胺42.1~12217.1~32.72.87~11.326.5~95.689.0~2769.49~21.6[26]
据表1可知,韩国泡菜中组胺和腐胺含量均大于100 mg/kg,超过目前的推荐限量水平[23]。川渝地区市售泡菜中,腐胺、尸胺和酪胺的最高值均大于100 mg/kg。其中,发现腐胺的最高含量为(175.73±1.9)mg/kg,尸胺的最高含量为(149.26±7.27)mg/kg,酪胺的最高含量为(103.01±4.19)mg/kg[24]。我国家庭自制泡菜中腐胺、尸胺、组胺和酪胺的含量均大于100 mg/kg。其中,腐胺含量为(338.2±53.07)mg/kg,酪胺含量为(203±3)mg/kg,超过其对应限量要求。四川工业泡菜中,尸胺含量最高,为(349.43±13.23)mg/kg,此外,腐胺、组胺和酪胺的含量也大于200 mg/kg。同时,塞尔维亚泡菜和德国泡菜中也出现了不同程度的污染现象。在塞尔维亚泡菜中,尸胺和腐胺污染较为严重;在德国泡菜中,腐胺和亚精胺的含量较高[25-26]。
2.2 生物胺的主要控制方法
2.2.1 泡菜中生物胺形成的主要影响因素
在泡菜发酵过程中,生物胺产生情况主要受到发酵微生物质量,生产原辅料质量,盐浓度、温度、发酵时间、pH等发酵条件以及包装材料等因素影响[29-31]。因此,目前对于泡菜中生物胺的控制研究主要从这些方面入手。
2.2.2 接种优良菌种发酵
新鲜蔬菜的表面附着有大量的微生物,这些微生物包括霉菌、乳酸菌、酵母菌、肠杆菌科细菌及假单胞菌属细菌等,这些微生物会参与蔬菜发酵过程[6]。研究发现,在自然发酵初期,好氧菌和酵母菌占优势。在发酵中后期,具有兼性厌氧特性的乳酸菌成为优势菌群,包括乳酸杆菌属、明串珠菌属、片球菌属,链球菌属等。大量研究表明,蔬菜发酵的中期主要为产生乳酸和醋酸的异型发酵,其中以乳酸球菌为主;而在蔬菜发酵后期,主要为产生大量乳酸的同型发酵,其中以乳酸杆菌为主[29]。已有研究发现,能够产生生物胺的主要微生物是革兰氏阳性细菌[29]。因此,在蔬菜发酵过程中,微生物的类型和质量对于发酵产品的品质影响较大,可以通过接种优良菌种进行发酵,以控制微生物的质量,从而提升发酵食品的品质和安全性。FONG等[30]研究发现,使用鼠李糖乳杆菌GG、干酪乳杆菌Shirota和大肠杆菌Nissle 1917等益生菌发酵的样品中,未检测到酪胺的产生。ZHANG等[31]研究了接种植物乳杆菌LPL-1和自然发酵条件下生物胺的变化情况。结果表明,与对照组相比,酪胺、腐胺、尸胺和总生物胺含量均降低。其中,酪胺含量从80.14降低到66.91 mg/kg;腐胺含量从15.67降低到11.23 mg/kg;尸胺含量从81.34降低到17.03 mg/kg;总生物胺含量从267.65降低到171.84 mg/kg。TABANELLI等[32]研究发现,在发酵蔬菜中接种粪肠球菌 EF37后,酪胺含量显著降低(发酵液中酪胺含量从300降低到 80 mg/L)。同时,乳酸菌 VR84 和 EG46能够降低组胺含量(分别从200降低至75和80 mg/L)。
2.2.3 控制原料质量
为了避免在食品发酵过程中产生生物胺,一般建议使用微生物数量较低的蔬菜原料。同时,原料的清洗处理对于后续生物胺的控制也很重要。CHOI等[33]通过采用120-等离子活化水和60 ℃温和加热的组合方式,对发酵白菜原料进行了清洗。研究发现,与对照组相比,经过该方式处理的白菜原料中,单增李斯特菌(Listeria monocytogenes)和金黄色葡萄球菌(Staphylococcus aureus)数量分别减少了3.4和3.7 lg CFU/g,而白菜的水分含量、还原糖含量和色泽等指标的变化可忽略不计。因此,可采用一定温度(60 ℃)的等离子体活化水对白菜原料进行清洗,以提升原料质量。
2.2.4 添加抗氧化剂或发酵辅料
目前的研究表明,抗氧化剂或发酵辅料主要通过抑制产生生物胺所需酶的活性,从而抑制其形成。目前,除了添加维生素、氨基酸、山梨酸钾、柠檬酸、苯甲酸以及对羟基苯甲酸丙酯等常用的抗氧化成分外,植物天然成分(如肉桂、茴香、和大蒜、生姜、八角、砂仁、丁香、辣椒、月桂叶和肉豆蔻等)及其提取物等发酵辅料也被用于泡菜中生物胺的控制[34-38]。
KANG等[35]研究发现,烟酸能够通过抑制具有高产酪胺能力的屎肠球菌菌株的酪氨酸脱羧酶的活性,从而明显降低酪胺的浓度(从698.67降低到117.27 mg/kg)。MAJCHERCZYK等[36]研究发现,当泡菜在18 ℃条件下发酵时,添加一定量的香菜或洋葱(两者添加量分别为10和350 g/kg泡菜),能够显著降低尸胺和酪胺的浓度。其中,尸胺含量分别从15.34降低至12.00和6.99 mg/kg。酪胺含量分别从29.83降低至16.28和18.26 mg/kg。进一步分析发现,洋葱中的烷基硫代磺酸盐类化合物和香菜中的萜类家族的化合物可通过抑制微生物的酶活性,从而降低总生物胺的浓度[36]。JIA等[37]研究了八角、砂仁、丁香、肉桂、茴香、月桂叶和肉豆蔻等香辛料提取物对生物胺的抑制作用,研究发现,这些物质对色胺、腐胺、亚精胺、2-苯乙胺、酪胺和组胺具有较好的抑制效果,最大抑制率分别为21.8%、19.3%、27.5%、24.6%、18.7%和24.4%,尤以肉桂和茴香的提取物抑制效果最佳。此外,姜提取物可降低腐胺含量(与对照组相比,降低了12.77%),红辣椒提取物可降低尸胺含量(与对照组相比,降低了11.73%)[18]。ZHOU等[38]研究发现,大蒜提取物能够显著降低组胺、腐胺、酪胺和亚精胺等生物胺的含量。与对照组相比,这4种生物胺浓度和总生物胺浓度分别降低30.49%、17.65%、26.03%、37.20%和27.17%。
2.2.5 控制发酵条件
在泡菜发酵过程中,温度、pH、盐浓度和发酵时间等条件对泡菜的品质和安全性影响较大。因此,可通过分析这些因素对泡菜中生物胺的影响,研究泡菜的最适发酵条件[39]。
在泡菜发酵过程中,温度对生物胺的形成有较大影响[39-40]。CVETKOVI 等[25]研究了不同温度条件下(包括16~18 ℃,18~20 ℃,20~22 ℃),发酵白菜中腐胺、尸胺、组胺和酪胺的变化情况。研究发现,18 ℃时,酪胺含量最高,为12.76 mg/kg。20 ℃时,泡菜中腐胺含量最高,为48.02 mg/kg,酪胺含量最低,为2.25 mg/kg。22 ℃时,组胺和尸胺含量最高,分别为19.44和22.35 mg/kg。已有研究表明,尸胺和腐胺的含量随发酵温度的升高而增加。在20 ℃以下,由于大多数产生生物胺的微生物的生长受到抑制,因此产胺能力降低,且低温(<4 ℃)也可抑制尸胺、腐胺和酪胺等生物胺的产生[41]。
等[25]研究了不同温度条件下(包括16~18 ℃,18~20 ℃,20~22 ℃),发酵白菜中腐胺、尸胺、组胺和酪胺的变化情况。研究发现,18 ℃时,酪胺含量最高,为12.76 mg/kg。20 ℃时,泡菜中腐胺含量最高,为48.02 mg/kg,酪胺含量最低,为2.25 mg/kg。22 ℃时,组胺和尸胺含量最高,分别为19.44和22.35 mg/kg。已有研究表明,尸胺和腐胺的含量随发酵温度的升高而增加。在20 ℃以下,由于大多数产生生物胺的微生物的生长受到抑制,因此产胺能力降低,且低温(<4 ℃)也可抑制尸胺、腐胺和酪胺等生物胺的产生[41]。
生物胺的产生受氨基酸脱羧酶和发酵微生物等多种因素影响,而pH是影响氨基酸脱羧酶活性和发酵体系菌群组成的重要因素,因此,pH对生物胺的产生有较大影响[42]。相关研究表明,在泡菜发酵初始阶段,原辅料本身携带的大肠菌群、假单胞菌群等革兰氏阴性菌是产生生物胺的主要菌群。到了后期,乳酸菌代谢产生乳酸,pH降低,抑制了革兰氏阴性菌的生长。此时,乳酸菌成为泡菜发酵后期产生生物胺的主要菌群。当pH<3.5时,酵母菌成为产生生物胺的主要菌群[43]。VAN等[42]研究发现,在pH为5~7时,短乳杆菌产生酪胺的能力较强。在pH为4~6时,粪肠球菌、屎肠球菌、嗜热链球菌产生酪胺和组胺等生物胺的能力强。
现有研究表明,增加盐浓度对革兰氏阴性菌的抑制作用较大。LARANJO等[44]研究发现,当盐含量从6% 减少到 3%时,尸胺、组胺和酪胺等生物胺含量略有增加,但并不会对消费者的健康产生有害影响。由于高盐饮食易导致高血压等慢性疾病,低盐发酵泡菜是当下及未来泡菜产品研制的主要方向之一。
KALA 等[45]研究表明,泡菜在4~12个月的发酵时间内,酪胺的含量从85.8增至274 mg/kg,并超出了限量规定。RABIE等[46]研究发现,在发酵时间为45 d时,组胺和酪胺的含量均超过200 mg/kg。目前的研究表明,随着发酵时间的增加,泡菜中的生物胺会不断累积,并且有较大的超出限量要求的风险。
等[45]研究表明,泡菜在4~12个月的发酵时间内,酪胺的含量从85.8增至274 mg/kg,并超出了限量规定。RABIE等[46]研究发现,在发酵时间为45 d时,组胺和酪胺的含量均超过200 mg/kg。目前的研究表明,随着发酵时间的增加,泡菜中的生物胺会不断累积,并且有较大的超出限量要求的风险。
因此,对于泡菜及其他传统发酵食品,可以通过控制发酵温度、pH、盐浓度和发酵时间等发酵条件,来减少生物胺的含量。
2.2.6 控制包装材料质量和改善包装方式
在泡菜发酵过程中,会直接与包装材料接触,因此,包装材料的质量和包装方式对泡菜品质有较大影响。ZHAO等[47]研究了需氧包装(aerobic package,AP)、NaCl溶液包装(NaCl solution package,NP)和真空包装(vacuum package,VP)这3种包装类型对发酵泡菜生物胺和亚硝酸盐含量的影响。研究表明,VP在抑制泡菜中组胺、酪胺和腐胺等生物胺及其前体产胺类物质的积累方面比AP和NP更有效。此外,还发现VP处理还可以加速酪胺的降解并导致总生物胺含量的降低。SUN等[48]研究了单独使用复合发酵剂(木糖葡萄球菌和植物乳杆菌)和使用复合发酵剂与VP相结合的方式对发酵食品中生物胺的影响。研究发现,发酵45 d后,单独使用发酵剂和发酵剂与VP相结合2种方式下,总生物胺的浓度分别为456.73和372.38 mg/kg,说明采用发酵剂与VP结合的方式能够明显抑制发酵食品中生物胺的产生。相关研究表明,CO2主要抑制产生组胺的微生物的生长,在不同浓度CO2(包括30%、60%、80%和100%)条件下,发酵食品中组胺浓度分别降低了8.5%、70.3%、78.8%和 90.2%。CURIEL等[49]研究表明,VP和氮气包装可以抑制肠杆菌(极易产生腐胺和尸胺)生长。
3 结论与展望
本文主要对泡菜中生物胺的污染情况和控制方法进行了分析阐述,研究发现,泡菜中腐胺、尸胺、组胺和酪胺等生物胺的含量较高。其中,腐胺的最高含量338.2 mg/kg,尸胺的最高含量为349.43 mg/kg,酪胺的最高含量为203 mg/kg,组胺的最高含量为110 mg/kg,这些值均超过对应生物胺的限量标准。泡菜中生物胺含量与原料质量、发酵微生物的种类及质量、温度、pH、盐浓度、发酵时间及包装材料和包装方式等因素有关,生物胺的控制研究也主要从上述几个方面入手。其中,在优势发酵菌种(如乳杆菌属、明串珠菌属乳酸乳球菌、链球菌属等)和外源抑制剂(如肉桂、茴香、姜酚、辣椒、生姜、大蒜、砂仁、丁香、八角等)方面的研究较多,且对泡菜中的生物胺都有一定的抑制作用。通过对泡菜中生物胺的研究分析,笔者认为泡菜中生物胺未来的研究趋势与重点有以下几个方面:
(1)目前,在接种有益发酵剂进行泡菜中生物胺控制研究方面,主要采用市面上现有的菌种发酵,而对于从自然发酵的泡菜中筛选优良菌种并进行生物胺控制的研究较少。因此,后续可利用PCR扩增、高通量测序等现有成熟技术,开展泡菜中优良菌种筛选等相关研究。
(2)由于用于制作泡菜的蔬菜种类繁多,而不同原料在发酵过程中的菌群组成、发酵条件不尽相同,这可能会导致不同原料发酵的泡菜中生物胺的污染情况及控制方法存在差异。因此,后续可开展典型发酵蔬菜原料中生物胺产生和调控规律的研究,从而阐明生物胺产生及降解规律,进一步为泡菜中生物胺的控制研究提供理论支撑。
(3)由于泡菜早已成为人们日常生活中经常食用的佐餐食品之一,而目前专门针对泡菜中生物胺限量研究较少,且未见腐胺和尸胺等常见生物胺的限量标准。因此,希望相关部门加快推进泡菜中生物胺限量标准相关的制修订工作。
[1] XIANG W L, ZHANG N D, LU Y, et al.Effect of Weissella cibaria co-inoculation on the quality of Sichuan pickle fermented by Lactobacillus plantarum[J].LWT, 2020, 121:108975.
[2] 张楠笛, 祝林, 许琴, 等.食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味[J].食品科学, 2020, 41(14):102-108.
ZHANG N D, ZHU L, XU Q, et al.Improvement of the flavor of Sichuan pickle by co-fermentation with Weissella cibaria and Lactobacillus plantarum[J].Food Science, 2020, 41(14):102-108.
[3] PARDALI E, PARAMITHIOTIS S, PAPADELLI M, et al.Lactic acid bacteria population dynamics during spontaneous fermentation of radish (Raphanus sativus L.) roots in brine[J].World Journal of Microbiology & Biotechnology, 2017, 33(6):110.
[4] CHEN A J, LUO W, PENG Y T, et al.Quality and microbial flora changes of radish paocai during multiple fermentation rounds[J].Food Control, 2019, 106:106 733-106 745.
[5] EI SHEIKHA A F, HU D M.Molecular techniques reveal more secrets of fermented foods[J].Critical Reviews in Food Science and Nutrition, 2020, 60(1):11-32.
[6] SANLIER N, GÖKCEN B B, SEZGIN A C.Health benefits of fermented foods[J].Critical Reviews in Food Science and Nutrition, 2019, 59(3):506-527.
[7] DAS G, PARAMITHIOTIS S, SUNDARAM SIVAMARUTHI B, et al.Traditional fermented foods with anti-aging effect:A concentric review[J].Food Research International, 2020, 134:109269.
[8] MUN E G, SOHN H S, KIM M S, et al.Antihypertensive effect of Ganjang (traditional Korean soy sauce) on Sprague-Dawley Rats[J].Nutrition Research and Practice, 2017, 11(5):388-395.
[9] MARKOWIAK P,  LI
LI EWSKA K.Effects of probiotics, prebiotics, and synbiotics on human health[J].Nutrients, 2017, 9(9):1021.
EWSKA K.Effects of probiotics, prebiotics, and synbiotics on human health[J].Nutrients, 2017, 9(9):1021.
[10] LAATIKAINEN R, KOSKENPATO J, HONGISTO S M, et al.Randomised clinical trial:Low-FODMAP rye bread vs.regular rye bread to relieve the symptoms of irritable bowel syndrome[J].Alimentary Pharmacology & Therapeutics, 2016, 44(5):460-470.
[11] PARK Y K, LEE J H, MAH J H.Occurrence and reduction of biogenic amines in kimchi and Korean fermented seafood products[J].Foods (Basel, Switzerland), 2019, 8(11):547-551.
[12] SONG H S, WHON T W, KIM J, et al.Microbial niches in raw ingredients determine microbial community assembly during kimchi fermentation[J].Food Chemistry, 2020, 318:126481.
[13] RAO Y, QIAN Y, TAO Y F, et al.Characterization of the microbial communities and their correlations with chemical profiles in assorted vegetable Sichuan pickles[J].Food Control, 2020, 113:107174.
[14] YANG X Z, HU W Z, XIU Z L, et al.Microbial dynamics and volatilome profiles during the fermentation of Chinese northeast sauerkraut by Leuconostoc mesenteroides ORC 2 and Lactobacillus plantarum HBUAS 51041 under different salt concentrations[J].Food Research International, 2020, 130:108926.
[15] 汪冬冬, 唐垚, 伍亚龙, 等.泡菜细菌多样性和风味成分研究进展[J].食品与发酵工业, 2021, 47(21):296-302.
WANG D D, TANG Y, WU Y L, et al.Advances on bacterial diversity and flavor of Paocai[J].Food and Fermentation Industries, 2021, 47(21):296-302.
[16] GUAN Q Q, ZHENG W D, HUANG T, et al.Comparison of microbial communities and physiochemical characteristics of two traditionally fermented vegetables[J].Food Research International, 2020, 128:108755.
[17] ASHAOLU T J, REALE A.A holistic review on euro-Asian lactic acid bacteria fermented cereals and vegetables[J].Microorganisms, 2020, 8(8):1 176-1 199.
[18] GARDINI F, ÖZOGUL Y, SUZZI G, et al.Technological factors affecting biogenic amine content in foods:A review[J].Frontiers in Microbiology, 2016, 7:1 218-1 227.
[19] XU Y N, ZHU Y L.Complete replacement of nitrite with a Lactobacillus fermentum on the quality and safety of Chinese fermented sausages[J].Frontiers in Microbiology, 2021, 12:704302.
[20] ERCAN S S, SOYSAL Ç, BOZKURT H.Biogenic amine contents of fresh and mature kashar cheeses during refrigerated storage[J].Food and Health, 2019 5(1):19-29.
[21] MAH J H, PARK Y K, JIN Y H, et al.Bacterial production and control of biogenic amines in Asian fermented soybean foods[J].Foods (Basel, Switzerland), 2019, 8(2):85-99.
[22] KIM S Y, KIM H E, KIM Y S.The potentials of Bacillus licheniformis strains for inhibition of B. cereus growth and reduction of biogenic amines in Cheonggukjang (Korean fermented unsalted soybean paste)[J].Food Control, 2017, 79:87-93.
[23] KIM J H, RYU S J, LEE J W, et al.Investigation on biogenic amines in plant-based minor Korean fermented foods[J].Journal of Applied Biological Chemistry, 2013, 56(2):113-117.
[24] 瞿凤梅, 丁晓雯, 王瑜.市售泡菜中生物胺含量的比较分析[J].食品工业科技, 2014, 35(21):316-319; 323.
QU F M, DING X W, WANG Y.Comparative analysis of the content of biogenic amines in merchant Sichuan pickles[J].Science and Technology of Food Industry, 2014, 35(21):316-319;323.
[25] CVETKOVI B R, PEZO L L, TASI
B R, PEZO L L, TASI T, et al.The optimisation of traditional fermentation process of white cabbage (in relation to biogenic amines and polyamines content and microbiological profile)[J].Food Chemistry, 2015, 168:471-477.
T, et al.The optimisation of traditional fermentation process of white cabbage (in relation to biogenic amines and polyamines content and microbiological profile)[J].Food Chemistry, 2015, 168:471-477.
[26] PE AS E, FRIAS J, SIDRO B, et al.Impact of fermentation conditions and refrigerated storage on microbial quality and biogenic amine content of sauerkraut[J].Food Chemistry, 2010, 123(1):143-150.
AS E, FRIAS J, SIDRO B, et al.Impact of fermentation conditions and refrigerated storage on microbial quality and biogenic amine content of sauerkraut[J].Food Chemistry, 2010, 123(1):143-150.
[27] KUNG H F, LEE Y H, TENG D F, et al.Histamine formation by histamine-forming bacteria and yeast in mustard pickle products in Taiwan[J].Food Chemistry, 2006, 99(3):579-585.
[28] 唐垚, 唐小曼, 明建英, 等.四川泡菜产生物胺细菌的筛选及产胺能力验证[J].中国调味品, 2019, 44(7):81-84.
TANG Y, TANG X M, MING J Y, et al.Screening of amine-producing bacteria from Sichuan pickles and verification of amine-producing ability[J].China Condiment, 2019, 44(7):81-84.
[29] 迟雪梅, 张庆芳, 迟乃玉.发酵蔬菜安全性的研究进展[J].中国酿造, 2018, 37(8):5-8.
CHI X M, ZHANG Q F, CHI N Y.Research progress of the safety of fermented vegetables[J].China Brewing, 2018, 37(8):5-8.
[30] FONG F L Y, LAM K Y, SAN LAU C, et al.Reduction in biogenic amines in Douchi fermented by probiotic bacteria[J].PLoS One, 2020, 15(3):e0230916.
[31] ZHANG Y, QIN Y X, WANG Y, et al.Lactobacillus plantarum LPL-1, a bacteriocin producing strain, changed the bacterial community composition and improved the safety of low-salt fermented sausages[J].LWT, 2020, 128:109385.
[32] TABANELLI G, MONTANARI C, BARGOSSI E, et al.Control of tyramine and histamine accumulation by lactic acid bacteria using bacteriocin forming lactococci[J].International Journal of Food Microbiology, 2014, 190:14-23.
[33] CHOI E J, PARK H W, KIM S B, et al.Sequential application of plasma-activated water and mild heating improves microbiological quality of ready-to-use shredded salted kimchi cabbage (Brassica pekinensis L.)[J].Food Control, 2019, 98:501-509.
[34] 曾玉雪, 罗惠波, 余东, 等.浓香型大曲中降解生物胺菌株的筛选及应用[J].食品与发酵工业, 2021, 47(8):145-151.
ZENG Y X, LUO H B, YU D, et al.Screening and application of biogenic amines degrading strain derived from Luzhou-flavor Daqu[J].Food and Fermentation Industries, 2021, 47(8):145-151.
[35] KANG H R, KIM H S, MAH J H, et al.Tyramine reduction by tyrosine decarboxylase inhibitor in Enterococcus faecium for tyramine controlled cheonggukjang[J].Food Science and Biotechnology, 2017, 27(1):87-93.
[36] MAJCHERCZYK J, SUR WKA K.Effects of onion or caraway on the formation of biogenic amines during sauerkraut fermentation and refrigerated storage[J].Food Chemistry, 2019, 298:125083.
WKA K.Effects of onion or caraway on the formation of biogenic amines during sauerkraut fermentation and refrigerated storage[J].Food Chemistry, 2019, 298:125083.
[37] JIA W, ZHANG R, SHI L, et al.Effects of spices on the formation of biogenic amines during the fermentation of dry fermented mutton sausage[J].Food Chemistry, 2020, 321(15):126 723-126732.
[38] ZHOU X X, QIU M T, ZHAO D D, et al.Inhibitory effects of spices on biogenic amine accumulation during fish sauce fermentation[J].Journal of Food Science, 2016, 81(4):913-920.
[39] ZHANG C H, DERRIEN M, LEVENEZ F, et al.Ecological robustness of the gut microbiota in response to ingestion of transient food-borne microbes[J].The ISME Journal, 2016, 10(9):2 235-2 245.
[40] AL-ASOUS A I, AL-HARBI A H.Microbiological and physicochemical quality of salted bluespot mullet (Valamugil seheli) stored at different temperature[J].Journal of Food Safety, 2017, 37(1):e12291.
[41] 白妞妞, 白锴凯, 何建林, 等.鱼露生物胺研究进展[J].食品与发酵工业, 2020, 46(24):271-277.
BAI N N, BAI K K, HE J L, et al.Research progress of biogenic amines in fish sauce[J].Food and Fermentation Industries, 2020, 46(24):271-277.
[42] VAN BA H, SEO H W, KIM J H, et al.The effects of starter culture types on the technological quality, lipid oxidation and biogenic amines in fermented sausages[J].LWT, 2016, 74:191-198.
[43] FERN NDEZ M, LINARES D M, RODR
NDEZ M, LINARES D M, RODR GUEZ A, et al.Factors affecting tyramine production in Enterococcus durans IPLA 655[J].Applied Microbiology and Biotechnology, 2007, 73(6):1 400-1 406.
GUEZ A, et al.Factors affecting tyramine production in Enterococcus durans IPLA 655[J].Applied Microbiology and Biotechnology, 2007, 73(6):1 400-1 406.
[44] LARANJO M, GOMES A, AGULHEIRO-SANTOS A C, et al.Impact of salt reduction on biogenic amines, fatty acids, microbiota, texture and sensory profile in traditional blood dry-cured sausages[J].Food Chemistry, 2017, 218:129-136.
[45] KALA P,
P,  PI
PI KA J, K
KA J, K

 EK M, et al.Changes in biogenic amine concentrations during sauerkraut storage[J].Food Chemistry, 2000, 69(3):309-314.
EK M, et al.Changes in biogenic amine concentrations during sauerkraut storage[J].Food Chemistry, 2000, 69(3):309-314.
[46] RABIE M A, PERES C, MALCATA F X. Evolution of amino acids and biogenic amines throughout storage in sausages made of horse, beef and turkey meats[J]. Meat Science, 2014, 96(1):82-87.
[47] ZHAO N, LAI H M, HE W, et al.Reduction of biogenic amine and nitrite production in low-salt Paocai by controlled package during storage:A study comparing vacuum and aerobic package with conventional salt solution package[J].Food Control, 2021, 123:107 858-107 864.
[48] SUN Q X, SUN F D, ZHENG D M, et al.Complex starter culture combined with vacuum packaging reduces biogenic amine formation and delays the quality deterioration of dry sausage during storage[J].Food Control, 2019, 100:58-66.
[49] CURIEL J A, RUIZ-CAPILLAS C, DE LAS RIVAS B, et al.Production of biogenic amines by lactic acid bacteria and enterobacteria isolated from fresh pork sausages packaged in different atmospheres and kept under refrigeration[J].Meat Science, 2011, 88(3):368-373.