豆豉为我国传统大豆发酵食品,具有调节血脂、改善心血管功能、降低血糖、抗骨质疏松、抗肿瘤等作用[1-2]。大豆在发酵过程中经多种微生物酶的作用,一些成分发生了生物转化,其中报道较多的如大豆异黄酮苷转化为苷元、大豆蛋白转化为小分子肽或氨基酸[3-4],而磷脂类成分的变化鲜见报道。磷脂是组成人体细胞的主要成分,对肝病、高血压、阿尔兹海默症等疾病的防治有一定的效果[5-7]。大豆磷脂是植物型磷脂的主要来源,是多元醇与脂肪酸及其衍生物酯化而形成的弱极性化合物,根据碱基不同分为磷脂酰胆碱(phosphatidylcholine, PC)、磷脂酰肌醇(phosphatidylinositol, PI)和磷脂酰乙醇胺(phosphatidylethanolamine, PE)等。功能性磷脂的合成常采用脂肪酶作为催化剂实现富含特殊功能脂肪酸为底物的酰基供体与磷脂的酯交换反应[8-9]。本研究首次结合常压室温等离子体(atmospheric and room temperature plasma, ARTP)诱变育种技术[10-11]选育高脂肪酶活性的优良菌株,考察其发酵制备豆豉过程中PC、PI和PE功能性成分的含量变化,确定富含功能性磷脂的豆豉制备工艺,提高豆豉的应用价值。
1 材料与方法
1.1 药材与试剂
淡豆豉饮片,北京同仁堂哈尔滨药店;黑豆,黑龙江和粮农业有限公司。
PC对照品(纯度≥ 99%),Sigma; PI对照品(纯度50%); PE对照品(纯度≥ 99%),Aladdin。
维多利亚蓝B, Aladdin;中性红染色剂, Solarbio;马铃薯葡萄糖水培养基、大豆蛋白胨,青岛海博生物技术有限公司;酵母膏, 北京奥博星生物技术有限公司;正己烷、异丙醇,均为色谱级,Simark;冰乙酸(色谱级),天津科密欧化学试剂有限公司;三乙胺(色谱级), 福晨(天津)化学试剂有限公司;对硝基苯酚棕榈酸,Sigma。其他试剂均为分析纯。
1.2 培养基
富集培养基(g/L):大豆蛋白胨10、葡萄糖15、酵母膏5、NaCl 2.5。
中性红油脂平板(g/L):大豆蛋白胨10、酵母膏5、NaCl 5、MgSO4 0.5、琼脂20、橄榄油聚乙烯醇乳化液120 mL、16 g/L中性红溶液1 mL,pH 7.0~7.5。
维多利亚蓝油脂平板(g/L):大豆蛋白胨10、NaCl 2.5、(NH4)2SO4 2、K2HPO4 1、MgSO4 0.5、琼脂20、维多利亚蓝B 0.04,橄榄油聚乙烯醇乳化液120 mL。
发酵培养基(g/L):大豆蛋白胨10 g、NaCl 0.5、(NH4)2SO4 2、K2HPO4 1、MgSO4 0.5、酵母粉5,橄榄油聚乙烯醇乳化液120 mL,pH为7.0~7.5。
1.3 仪器与设备
LM17R冷冻高速离心机,美国赛默飞世尔公司;Biolog自动微生物鉴定系统,美国Biolog公司;ARTP-M诱变育种仪,清华无锡天木生物科技有限公司;XSR205DU电子天平、S40型pH计,瑞士METTLER TOLEDO公司;BSA2245电子天平,德国赛多利斯集团;DL-CJ-2N洁净工作台,北京东联哈尔仪器制造有限公司;HNY-202B摇床培养箱,江苏中和实验仪器制造有限公司;LDZM-60KC高压蒸汽灭菌锅,上海申安医疗器械厂;DHP-9272恒温培养箱,上海一恒科学仪器有限公司;LC-2030C3D高效液相色谱仪、ELSD-LTⅡ蒸发光检测器,日本岛津制作所;CX31光学显微镜,日本OLYMPUS公司;UV-5200紫外分光光度计,上海元析仪器有限公司。
1.4 实验方法
1.4.1 高脂肪酶活性菌株的选育
1.4.1.1 出发菌株筛选
初筛采用中性红油脂平板与维多利亚蓝平板相结合的方法[12]。将淡豆豉饮片粉碎,过二号筛,精密称取1 g溶于10 mL灭菌的蒸馏水中,充分搅拌溶解,静置,吸取上层溶液1 mL置入装有100 mL富集培养基的三角瓶中,于30 ℃、180 r/min摇床培养3 d,梯度稀释至10-4、10-5、10-6,分别吸取100 μL涂布于中性红油脂平板,于30 ℃培养3 d,挑取红色变色圈或透明圈的菌落再转接到维多利亚蓝平板培养基中,于30 ℃继续培养3 d,挑选有深蓝色水解圈或透明圈的菌落,作为初筛目的菌株。
将初筛目的菌株转接入马铃薯葡萄糖水培养基中,于30 ℃、180 r/min摇床培养4 d(107~108孢子数/mL),按照1%的接种量接种至摇瓶发酵培养基中,于30 ℃、180 r/min摇床培养4 d,采用对硝基苯酚法测定上清液脂肪酶活力,确定复筛目的菌株。
1.4.1.2 脂肪酶活力测定
采用对-硝基苯酚法,37 ℃、pH 8.0时,1 μmol/min释放对硝基苯酚所需的酶量为1个酶活力单位[13],按公式(1)计算:
(1)
式中:A,样品酶活力,U/L;A1;样品酶液的吸光度值;A0,灭活酶液的吸光度值;k,对硝基苯酚标准曲线的斜率;k0,对硝基苯酚标准曲线的截距;n,酶液稀释倍数;V1,酶液体积,mL;t,反应时间,min。
底物溶液A:称取90 mg对硝基苯酚棕榈酸,溶于30 mL异丙醇。
底物溶液B:50 mmol/L Tris-HCl,含1%(质量分数,下同)TritonX-100和0.1%阿拉伯树胶(pH 8.0)。
测定方法:将空白对照和样品试管作好标记,每支试管中分别加入0.1 mL底物溶液A和1.8 mL底物溶液B,于37 ℃水浴保温5 min,然后在空白对照管中分别加入0.1 mL酶液和0.1 mL灭活酶液,摇匀,在37 ℃水浴反应10 min后立即加入0.5 mL 10%三氯乙酸溶液终止反应,再加入0.5 mL 100 g/L Na2CO3溶液显色,于410 nm测定吸光度值,每个样品重复3次。
1.4.1.3 ARTP诱变育种
菌悬液的制备:将复筛目的菌株作为出发菌株,用无菌生理盐水将斜面菌丝荡洗并稀释成浓度为107~108孢子数/mL的菌悬液,备用。
ARTP诱变:吸取10 μL菌悬液于载片中央并涂匀,照射距离2 mm,气流量10 SLM,功率120 W下进行诱变处理20、30、40、50、60 s,然后用无菌生理盐水冲洗载片,涂于PDA平板培养基,30 ℃培养3 d,进行菌落计数,3个平行样本,按公式(2)计算致死率并绘出致死率曲线。
致死率![]()
(2)
式中:n,经ARTP处理后平板上平均菌落数;n0,未经ARTP处理平板上菌落数。
脂肪酶活性测定:将诱变后的菌株按照1.4.1.2方法测定脂肪酶活性,并与出发菌株酶活性相比,确定高产脂肪酶活性的突变株,采用PDA试管斜面于4 ℃保存菌株。
1.4.1.4 菌株的鉴定
采用Biolog自动微生物鉴定系统对出发菌株进行鉴定。根据 Biolog FF MicroPlateTM使用说明书,在吐温-40接种液中轻微研磨制成均匀菌悬液,用浊度计比浊成75% T(T为接种浊度),将菌悬液加于FF鉴定板检测孔中,100 μL/孔,于33 ℃ 孵育24~96 h,每24 h读取结果。
1.4.2 豆豉发酵工艺研究
1.4.2.1 样品的制备
将黑豆用清水洗净、浸泡16~18 h,沥干水分,装入灭菌袋,每袋200 g,于121 ℃灭菌30 min,放凉,按照1%的接种量分别接入出发菌株GD12菌液(1.6×105孢子/mL)和诱变菌株GD12-11菌液(5×105孢子/mL),摇匀,于30 ℃恒温培养,分别于0、3、5、7、9、13、15 d取样。
1.4.2.2 豆豉中PC、PI、PE的含量测定
采用HPLC法测定不同样品PC、PI、PE的含量[14]。
色谱条件:Shim-park GIS二醇柱(4.6 mm×250 mm,5μm);流动相A: V(正己烷)∶V(异丙醇)∶V(冰醋酸)∶V(三乙胺)=814∶170∶15∶0.8;流动相B:V(异丙醇)∶V(超纯水)∶V(冰醋酸)∶V(三乙胺)=844∶140∶15∶0.8; 流速0.8 mL/min;柱温38 ℃;进样量10 μL;蒸发光散射检测器温度38 ℃;空气压力350 kPa。
对照品溶液的制备:精密称取PC对照品2.69 mg、PI对照品7.86 mg、PE对照品8.13 mg,加入V(正己烷)∶V(异丙醇)=80∶20溶液溶解并定容至10 mL容量瓶中,摇匀,即得对照品储备液。
供试品溶液的制备:精密称取2.0 g豆豉及市售淡豆豉样品细粉,加入硅胶柱,先用30 mL V(甲醇)∶V(氯仿)=1∶1的溶液洗脱,弃去洗脱液,再用30 mL V(甲醇)∶V(氯仿)=1∶2的溶液洗脱,收集洗脱液,于100 ℃水浴蒸干,用V(正己烷)∶V(异丙醇)=80∶20复溶至5 mL容量瓶,备用。
方法学考察:
(1)线性关系考察。将不同质量浓度的对照品溶液依次进样,以峰面积为纵坐标(Y),溶液质量浓度为横坐标(X),绘制标准曲线,得到3种磷脂的线性回归方程。PC的标准曲线方程:Y=954 814X-8 499.7,R2=0.983(0~0.308 mg/mL);PI的标准曲线方程:Y=3×10-7X+0.026 1,R2=0.999 7(0~6.05 mg/mL);PE的标准曲线:Y= 5×10-7X-5×10-5,R2=0.999 1(0~1.40 mg/mL),在此范围内线性良好。
(2)精密度试验。取对照品溶液重复进样6次,记录峰面积,结果显示PC、PI和PE峰面积的相对标准偏差(relative standard deviation,RSD)分别为1.42%、1.20%和1.13%,表明该方法精密度良好。
(3)重复性试验。取同一批次GD12-11发酵9 d的样品,平行制备供试品溶液6份,分别进样,记录峰面积,PC、PI和PE峰面积的RSD分别为1.75%、1.34%和1.57%,表明该方法重复性良好。
(4)稳定性试验。取同一批次GD12-11发酵9 d的样品,平行制备供试品溶液,分别于0、2、4、8、12、24 h进样测定,记录峰面积,PC、PI和PE峰面积的RSD分别为1.42%、1.21%和1.13%,表明室温下,样品溶液在24 h内稳定。
(5)加样回收率试验。取同一批次GD12-11发酵9 d样品6份,每份精密称取2.0 g,分别精密加入3种对照品溶液各1 mL,相当于PC 0.269 mg、PI 0.786 mg和PE 0.813 mg,平行制备供试品溶液,分别进样,PC、PI、PE加样回收率分别见表1~表3,表明该方法准确性良好。
样品中3种磷脂类成分的含量测定:按供试品溶液的制备方法平行制备各供试品溶液,于相同色谱条件测定并记录峰面积,通过标准曲线计算3种磷脂类成分的含量。
表1 PC加样回收率
Table 1 Recovery rate of phosphatidylcholine

取样量/g样品中含量/mg加入量/mg测得量/mg回收率/%平均值/%RSD/%2.005 80.4230.2690.69199.632.007 80.4240.2690.698101.862.001 20.4140.2690.683100.002.003 90.4210.2690.693101.122.001 30.4320.2690.69698.212.006 80.4250.2690.69399.63100.081.27
表2 PI加样回收率
Table 2 Recovery rate of phosphatidylinositol

取样量/g样品中含量/mg加入量/mg测得量/mg回收率/%平均值/%RSD/%2.005 84.250.7865.041100.642.007 84.210.7865.026103.812.001 24.230.7865.023100.892.003 94.230.7865.034102.292.001 34.260.7865.03298.222.006 84.250.7865.03599.87100.951.93
表3 PE加样回收率
Table 3 Recovery rate of phosphatidylethanolamine
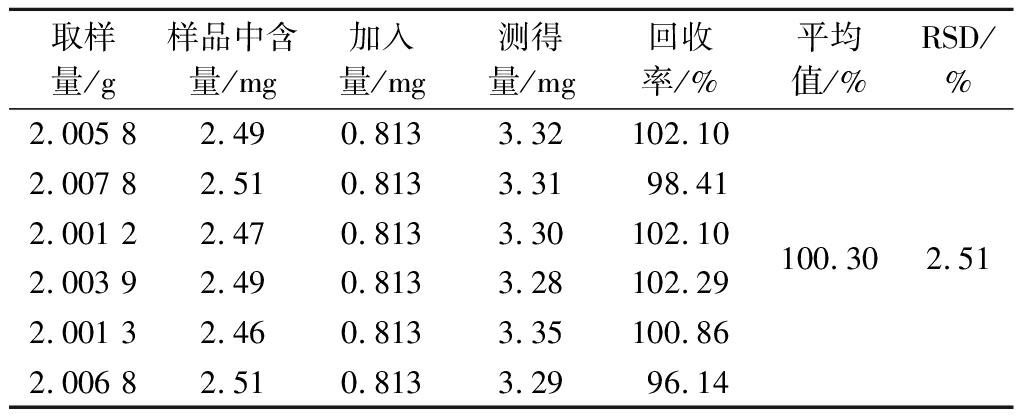
取样量/g样品中含量/mg加入量/mg测得量/mg回收率/%平均值/%RSD/%2.005 82.490.8133.32102.102.007 82.510.8133.3198.412.001 22.470.8133.30102.102.003 92.490.8133.28102.292.001 32.460.8133.35100.862.006 82.510.8133.2996.14100.302.51
2 结果与分析
2.1 出发菌株的筛选及鉴定结果
从淡豆豉饮片中分离筛选出产脂肪酶的菌株5株(表4),其中GD12酶活力最高,为(4 403±108)U/L,作为出发菌株,采用ARTP技术进一步诱变以获得高脂肪酶活性的菌株。出发菌株GD12脂肪酶活性初筛平板如图1,经Biolog微生物鉴定系统鉴定为伞枝梨头霉(Absidia corymbifera)。
表4 产脂肪酶菌株的酶活性 单位:U/L
Table 4 Enzyme activities of lipase-producing strains
菌株编号GD11GD12GD13HB6BJ1酶活性3 183±594 403±1084 017±891 537±1061 386±67

a-中性红;b-维多利亚蓝
图1 GD12脂肪酶活性初筛平板
Fig.1 Preliminary screening plates of lipase activity produced by GD12
2.2 ARTP诱变育种结果
2.2.1 诱变时间的确定
图2为GD12诱变时间-致死率曲线,诱变20 s后该菌的致死率迅速升高,诱变50 s时致死率达到最高为(90±3)%。通常情况下,当致死率>90%,菌株发生突变的概率较高且不易回突,因此,最终采用ARTP诱变处理时间为50 s。

图2 GD12 ARTP致死率曲线
Fig.2 Fatality rate curve of GD12 with the ARTP treatment
2.2.2 高产脂肪酶菌株的选育结果
出发菌株经50 s诱变处理后,将菌液涂于PDA培养基上培养,得到12株突变株,将出发菌株和各突变株通过脂肪酶活性的初筛和复筛,获得4株脂肪酶活性高于出发菌株的突变株,其中GD12-11的活性最高,脂肪酶活性为(5 547±305)U/L,比出发菌株GD12酶活性提高了25.98%。
2.2.3 豆豉发酵过程中PC、PI和PE的含量变化
2.2.3.1 对照品和样品的HPLC图
如图3所示。相同色谱条件下,PC、PI(纯度50%)和PE对照品的保留时间分别为8.7、13.0、7.5 min, 样品在与对照品色谱峰对应处显示相同的色谱峰,且分离度较好。

图3 PC、PI、PE对照品及样品的HPLC图
Fig.3 HPLC diagrams of PC, PI, PE reference substances and the sample
2.2.3.2 豆豉发酵过程中PC、PI和PE的含量变化
图4为GD12和GD12-11发酵制备豆豉不同时间PC、PI和PE的含量变化曲线。黑豆未发酵前(0 h)PC、PI和PE的含量仅为(0.049±0.012)、(0.094±0.011)、(0.031±0.002)mg/g,PC于发酵7 d含量达到最高,突变菌株发酵的豆豉PC含量略高于出发菌株,但差异不明显,7 d分别达到(0.341±0.018)和(0.354±0.012)mg/g,随后含量逐渐下降,发酵15 d时,含量降至接近发酵前(图4-a);PI也于发酵7 d达到峰值,但出发菌株制备的豆豉PI含量高于突变株,含量分别为(3.217±0.011)和(2.395±0.015)mg/g,随着发酵时间的延长其含量逐渐下降,于发酵15 d降至接近发酵前(图4-b);PE在第7天出发菌株发酵样品含量达到最高为(1.332±0.008)mg/g,突变菌株发酵样品于第9天达到峰值为(1.399±0.011) mg/g,高于出发株(图4-c)。对比发酵7 d和9 d豆豉中3种磷脂的总含量,7 d为(3.993±0.034)mg/g,9 d为(3.969±0.021)mg/g,确定7 d为豆豉的最佳发酵时间。

a-PC;b-PI;c-PE
图4 豆豉发酵过程中磷脂类成分含量的变化
Fig.4 Content change of phosphlipid in Douchi during fermentation
2.3 新型豆豉与市售淡豆豉3种磷脂类成分的含量对比
如图5所示,GD12和GD12-11发酵7 d制备的豆豉(新型豆豉)PC含量分别为(0.341±0.016)和(0.354 ±0.012)mg/g,约为市售淡豆豉(0.065±0.008)mg/g的5倍;PI含量分别为(3.217±0.032)和(2.395±0.015)mg/g,约为市售淡豆豉(0.288±0.011)mg/g的为8~11倍;PE含量分别为(1.332±0.021)和(1.244±0.021)mg/g,约为市售淡豆豉(0.042±0.006)mg/g的30倍。新型豆豉3种磷脂类成分的含量均明显高于市售淡豆豉饮片。

图5 新型豆豉与市售淡豆豉3种磷脂类成分的含量对比
Fig.5 Contents of three phospholipids between new-type Douchi and Semen Sojae Praeparatumon
3 结论与讨论
课题组前期从6个产地淡豆豉中分离出14个野生型菌株,包括3株细菌和11株霉菌,其中伞枝犁头霉为优势发酵菌[15]。又以伞枝犁头霉为发酵菌株,考察了淡豆豉和豆豉纯种发酵过程中17种游离氨基酸的含量变化,结果表明,随着发酵时间延长,精氨酸和丝氨酸的含量下降,脯氨酸、组氨酸、谷氨酸和甘氨酸的含量升高,其余氨基酸未发生明显变化[16]。本研究从淡豆豉中筛选出较高脂肪酶活性的菌株经鉴定也是伞枝犁头霉,可用于制备富含功能性磷脂型豆豉,伞枝梨头霉在酿造大曲[17]和豆糁[18]中均有发现,该菌具有很强的耐热、生长能力,能高产蛋白酶、脂肪酶[19]。本研究从淡豆豉饮片中筛选高脂肪酶活性野生菌株并采用ARTP技术诱变处理,使出发菌株的脂肪酶活性提高了25.98%。出发菌和突变菌发酵制备的豆豉中3种磷脂类成分含量均明显高于市售淡豆豉,但出发菌和突变菌之间差异不显著,可进一步采用复合诱变方法以显著提高菌株的脂肪酶活性,以期更大幅度地提高磷脂类成分的含量。不同磷脂由于其组成的基团不同而具有不同的性质和功能,本研究制备的豆豉中PI和PE的含量明显高于PC的含量,表明该豆鼓可能具有更好的降血脂作用。有研究证明,豆豉中富含功能性磷脂,并含有大豆异黄酮、活性肽等成分,有利于保护豆豉中功能性磷脂的稳定性[20-21]。
通过优选的菌株制备豆豉,3种磷脂的含量呈先升高再下降的趋势,可能是由于磷脂在脂肪酶或磷脂酶的作用下进一步水解为甘油磷脂酰胆碱,后续可进一步考察其稳定性。另外,采用优选菌株制备的豆豉中3种磷脂类成分的含量明显高于市售淡豆豉,可能是由于淡豆豉发酵时间过短或过长而导致磷脂类成分含量较低,或市售淡豆豉发酵菌种复杂多样,产生的脂肪酶活性较低而不能保证催化反应充分进行,因此,可采用高脂肪酶活性菌种纯种发酵制备富含功能性磷脂的豆豉。本研究仅考察了高脂肪酶活性菌株发酵制备豆豉中3种磷脂类成分的含量变化,而功能性磷脂通常连接多不饱和脂肪酸,后续还将通过GC分析豆豉发酵过程中多不饱和脂肪酸含量的变化,为新型豆豉的药理活性及作用机制研究提供参考。
[1] 王思齐, 王满元, 关怀, 等.淡豆豉的本草考证[J].中国现代中药, 2018, 20(4):473-477;488.
WANG S Q, WANG M Y, GUAN H, et al.Herbalogical textual research of sojae semen praeparatum[J].Modern Chinese Medicine, 2018, 20(4):473-477;488.
[2] 赵九永. 传统大豆发酵食品的营养价值与保健功能[J].粮食科技与经济, 2017, 42(2):71-73;76.
ZHAO J Y.Nutritional value and health care function of traditional soybean fermented food[J].Grain Science and Technology and Economy, 2017, 42(2):71-73,76.
[3] 曾艳, 朱玥明, 张建刚, 等.大豆发酵食品中的活性肽及其生理功能研究进展[J].大豆科学, 2019, 38(1):159-166.
ZENG Y, ZHU Y M, ZHANG J G, et al.Process in bioactive peptides during soybean fermentation and their potential health benefits[J].Soybean Science, 2019, 38(1):159-166.
[4] 沈畅萱, 王修俊, 黄珊.豆豉纤溶酶等微生物源纤溶酶的研究与应用进展[J].中国酿造, 2017, 36(8):6-10.
SHEN C X, WANG X J, HUANG S.Research and application progress of fibrinolytic enzyme from Douchi and other microbial source[J].China Brewing, 2017, 36(8):6-10.
[5] YEU E, SILVERSTEIN S, GUILLON M, et al.Efficacy and safety of phospholipid nanoemulsion-based ocular lubricant for the management of various subtypes of dry eye disease:A phase IV, multicenter trial[J].Clinical Ophthalmology (Auckland, N.Z.), 2020, 14:2 561-2 570.
[6] LI J, WANG X L, ZHANG T, et al.A review on phospholipids and their main applications in drug delivery systems[J].Asian Journal of Pharmaceutical Sciences, 2015, 10(2):81-98.
[7] KÜLLENBERG D, TAYLOR L A, SCHNEIDER M, et al.Health effects of dietary phospholipids[J].Lipids in Health and Disease, 2012, 11:3.
[8] 肖志刚, 杨国强, 杨舒, 等.功能性磷脂的酶法合成及其生理功能研究进展[J].沈阳师范大学学报(自然科学版), 2020, 38(3):238-244.
XIAO Z G, YANG G Q, YANG S, et al.Research progress of enzymatic synthesis and physiological function[J].Journal of Shenyang Normal University (Natural Science Edition), 2020, 38(3):238-244.
[9] KRETZA E, PAPANEOPHYTOU C P, PAPI R M, et al.Lipase activity in Thermus thermophilus HB8:Purification and characterization of the extracellular enzyme[J].Biotechnology and Bioprocess Engineering, 2012, 17(3):512-525.
[10] 陈雪, 冯莉, 秦义, 等.常压室温等离子体诱变选育低产挥发酸酿酒酵母[J].中国酿造, 2019, 38(11):43-48.
CHEN X, FENG L, QIN Y, et al.Mutation breeding of low-yield volatile acid Saccharomyces cerevisiae by atmospheric and room temperature plasma[J].China Brewing, 2019, 38(11):43-48.
[11] 杨佩斯. ARTP诱变黑曲霉絮凝菌株及应用研究[D].贵阳:贵州大学, 2020.
YANG P S.Screening of microbial flocculant high-producing Aspergillus niger strains by atmospherric and room temperature plasma and its application[D].Guiyang:Guizhou University, 2020.
[12] 贺秋红, 巩志金, 颜梅.产脂肪酶菌株的筛选、鉴定及发酵培养基优化[J].中国酿造, 2019, 38(10):84-88.
HE Q H, GONG Z J, YAN M.Screening and identification of lipase producing strain and optimization of the fermentation medium[J].China Brewing, 2019, 38(10):84-88.
[13] 郑小梅. 脂肪酶产生菌的筛选及其脂肪酶基因的克隆[D].北京:中国农业科学院, 2009.
ZHENG X M.Screening of lipase producing strains and cloning of lipase genes[D].Beijing:Chinese Academy of Agricultural Sciences, 2009.
[14] 姚泽, 李云晶, 马越, 等.高效液相色谱法测定多烯磷脂酰胆碱软胶囊中磷脂酰胆碱和溶血磷脂酰胆碱的含量[J].中南药学, 2017, 15(9):1 304-1 306.
YAO Z, LI Y J, MA Y, et al.Determination of phosphatidyl choline and lysophosphatidyl choline in polyene phosphatidyl choline soft capsules by HPLC[J].Central South Pharmacy, 2017, 15(9):1 304-1 306.
[15] 陈丽艳, 刘青, 孙银玲, 等.不同产地淡豆豉优势发酵菌群的筛选及酶活性分析[J].中国药房, 2017, 28(31):4 359-4 361.
CHEN L Y, LIU Q, SUN Y L, et al.Screening and enzymatic activity analysis of dominant fermentive bacteria of Sojae Semen Praeparatum from different production places[J].China Pharmacy, 2017, 28(31):4 359-4 361.
[16] 宓月光, 王伟明, 孙银玲, 等.淡豆豉和豆豉纯种发酵过程中游离氨基酸的含量变化[J].食品与发酵工业, 2019, 45(23):257-261.
MI Y G, WANG W M, SUN Y L, et al.Dynamic quantity changes of free amino acids during Semen Sojae Praeparatum and black beans fermentation using pure strain[J].Food and Fermentation Industries, 2019, 45(23):257-261.
[17] 刘德海, 郝益民, 岳丹丹, 等.一株产β-葡萄糖苷酶菌株的筛选及酶学性质研究[J].中国酿造, 2013, 32(6):47-51;60.
LIU D H, HAO Y M, YUE D D, et al.Isolation of a strain with β-glucosidase and its enzymatic properties[J].China Brewing, 2013, 32(6):47-51;60.
[18] 王涵欣. 传统豆糁的工艺优化与风味品质特征研究[D].郑州:河南工业大学, 2015.
WANG H X.Research on processing optimization and flavor quality of traditional Doushen[D].Zhengzhou:Henan University of Technology, 2015.
[19] 沈怡方. 白酒生产技术全书[M].北京:中国轻工业出版社, 2013.
SHEN Y F.White spirit production technology book[M].Beijing:China Light Industry Press, 2013.
[20] 陈嘉序, 陈如扬, 连媛, 等.大豆异黄酮的生物转化及功能活性研究进展[J].食品研究与开发, 2021, 42(9):176-182.
CHEN J X, CHEN R Y, LIAN Y, et al.Progress in microbial conversion and functional activity of soy isoflavones[J].Food Research and Development, 2021, 42(9):176-182.
[21] 刘莉, 张金兰, 孙勇, 等.发酵豆制品生物活性肽功能特性研究进展[J].中国酿造, 2017, 36(7):1-4.
LIU L, ZHANG J L, SUN Y, et al.Research progress of functional properties of bioactive peptides from fermented soybean products[J].China Brewing, 2017, 36(7):1-4.