大黄鱼享有“国鱼”之美誉,2020年全国养殖量约25万t,其中福建省产量约占全国总产量的81%[1]。发酵大黄鱼是传统加工产品,具有风味独特、利于保藏和便于运输等特点[2]。红酒糟具有福建省地方特色,含有发酵后未被利用的粗淀粉、粗蛋白及有机酸类等物质,为酿红曲酒的副产物,对人体健康和膳食均衡起到一定的作用[3]。香糟大黄鱼由原料大黄鱼和红酒糟在密闭环境下发酵而成,传统发酵多采用手工操作,存在人工经验依赖性强、发酵周期长、缺乏标准化等问题。目前,工业化生产中将红酒糟与三去(去鳞、去鳃和去内脏)鱼体复合,采用层糟层鱼、真空包装、冷冻加工和冷链销售等方式进行,基本未进行发酵,风味多来自酒糟自身,难以呈现发酵鱼特有风味。因此,筛选优势微生物及分析其发酵能力,进一步采用现代生物和发酵工程等技术,通过强化发酵剂和优化底物等手段,利用微生物间的相互作用使发酵产品更易消化吸收,以满足消费者对产品营养、质地、安全、风味等更高的要求[4-5]。
发酵鱼中优势菌群受产品类型、生产工艺和生态因子等影响,其种群类别和发酵特性均存在差异。ZENG等[6-7]从中国传统发酵酸鱼中分离出2株具有抑菌及高酸化活性的植物乳杆菌,接种至鱼糜进行发酵,产品具有较好的风味;并从酸鱼中分离酵母菌,探究其耐受性、蛋白水解和脂解活性,用其制作发酵剂提高了发酵效能和产品质量。贺林娟等[8]将分离的发酵乳杆菌接种至糟制鳓鱼中,采用接种发酵与传统工艺相结合的方法,缩短了发酵周期的同时形成了优质风味。混合菌种接种发酵效果优于单一菌接种发酵[9],其模拟自然发酵中多种微生物的协调作用,能够更好地还原传统发酵食品的风味特征。
本研究以源自香糟大黄鱼中红酒糟的优势菌株为对象,研究其生理生化、耐受性和碳源利用等基本特征,并以单一菌和复合菌协同红酒糟接种至鱼块中,测定发酵过程中的优势菌动态与品质变化,以期为香糟大黄鱼发酵剂的制备和传统发酵工艺优化提供参考依据。
1 材料与方法
1.1 材料与试剂
红酒糟样品,采集于宁德市,命名为J。取得样品后,贮存于无菌三角瓶中,低温运输至实验室。新鲜大黄鱼购自福建宁德某公司,层冰层鱼,冷链运至上海,备用。
MRS、PDA培养基,北京陆桥技术股份有限公司;体积分数为3%过氧化氢酶溶液、葡萄糖产气生化管、PCA培养基,广东环凯微生物科技有限公司;乳酸(食品级),郑州高研生物科技有限公司;BUG培养基、FF-IF、IF-A接种液、GEN-III、FF、YT板,美国Biolog公司;微孔板,芬兰Bioscreen公司。
1.2 仪器与设备
浊度计,美国BIOLOG公司;Bioscreen C微生物生长曲线分析仪,芬兰Bioscreen公司;MIR-153高精密度低温培养箱,上海一恒科学仪器有限公司;KDN-103F自动定氮仪,上海纤检仪器有限公司;Chroma Meter CR400色差计,日本Minolta公司。
1.3 实验方法
1.3.1 微生物的分离纯化及鉴定
1.3.1.1 微生物分离纯化
取酒糟样本10 g于无菌研钵中,加入90 mL生理盐水,研磨匀浆后进行梯度稀释,选取适宜的稀释梯度进行涂布平板计数。菌落总数、乳酸菌分别采用PCA和MRS培养基,酵母菌和霉菌采用PDA培养基,28 ℃培养2~3 d。按照菌落形态学进行分组计数,3代划线分离,得到纯菌株,4 ℃保藏待用。
1.3.1.2 微生物鉴定
BIOLOG鉴定:将纯化后的菌株分别接种至BUG、MRS和PDA培养基上,培养至可接种状态。校准各接种液透光率为100%;将细菌接种到IF-A中,调节透光率至90%~98%;霉菌接种至FF-IF中,调节透光率至73%~77%;酵母菌接种至无菌生理盐水,调节透光率至45%~49%。将接种液分别加入96孔GEN-III、FF和YT鉴定板中,每孔100 μL,培养48 h后,采用BIOLOG微生物半自动鉴定仪鉴定。
分子鉴定:将占比高的菌株经反复分离纯化后进行鉴定。细菌鉴定:扩增分离菌株16S rDNA,通用引物:27F(5′-AGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′);酵母菌鉴定:扩增分离菌株26S rDNA的D1/D2区域,引物为NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)。PCR反应体系:Template(基因组DNA 20~50 ng/μL)×0.5 μL;10×Buffer(含Mg2+)×2.5 μL;dNTP(各2.5 mmol/L)×1.0 μL;酶×0.2 μL;F(10 μmol/L)×0.5 μL,R(10 μmol/L)×0.5 μL;加双蒸水至25.0 μL;PCR循环条件:预变性(94 ℃,4 min);30 cycle(94 ℃,45 s;55 ℃,45 s;72 ℃,1 min);修复延伸(72 ℃,10 min);终止反应(4 ℃,∞)。
1.3.2 菌株特性测定
1.3.2.1 菌株生理生化特征
使用无菌接种环挑起单菌落至液体培养基中,振荡培养18~24 h,即为新鲜肉汤培养物,备用。
糖发酵产酸产气测定:吸取50~80 μL新鲜肉汤培养物加入葡萄糖产气微量西林瓶中,30 ℃培养18~24 h,并按照其说明书对结果进行判读。过氧化氢酶测定:使用无菌接种环挑取单菌落,使菌体置于体积分数3%H2O2溶液中,于30 s内发生气泡者为阳性,否则为阴性。蛋白酶测定:基础培养基中添加质量分数10%脱脂奶粉,115 ℃灭菌20 min,倒平板凝固后于培养基上打孔,孔内加入新鲜肉汤培养物,静置培养观察是否出现透明圈。脂肪酶测定:基础培养基灭菌后冷却至80 ℃,加入质量分数1%三丁酸甘油酯,倒平板凝固后于培养基上打孔,孔内加入新鲜肉汤培养物,静置培养观察是否出现透明圈。
将短乳杆菌以1%接种量接种至未添加NaCl及添加2%、4% NaCl的MRS液体培养基中,测定24 h的pH以评价产酸能力。NaCl和pH对短乳杆菌和酿酒酵母生长的影响中,NaCl质量分数(2%、4%、6%、8%),pH(3、5、7);乳酸质量分数梯度设置为1%、3%、5%、7%。依照各因子配制相应的MRS和PDA无菌接种液,微孔板中每孔加入180 μL接种液,取约104CFU/mL浓度的菌悬液20 μL接种至孔中,平行实验数为5,以无菌接种液为对照。将微孔板放入微生物生长测定仪中中速振荡,每1 h测定其OD600 nm值,共5 d。
1.3.2.2 碳源利用特征
前处理方法同1.3.1.2中的BIOLOG鉴定,通过微生物对微孔板中的不同碳源利用及氧化情况进行测试,按照使用手册对结果进行判读。
1.3.3 发酵能力测定
1.3.3.1 鱼块制备及接种
鱼块处理:鲜大黄鱼去内脏,去皮后取背脊处鱼肉,分割至规格一致,在超净台内无菌水冲洗,晾干备用;菌悬液制备:菌株活化后分别在平板内划线,30 ℃培养24~48 h得到单菌落,挑取单菌落至100 mL无菌液体培养基中,30 ℃摇床培养18~24 h后,MRS中菌悬液浓度约109 CFU/mL,YPD液体培养基中约108 CFU/mL,经多次离心、洗涤,重悬于无菌生理盐水中,调整浓度约为107 CFU/mL,备用。
接种:取上述鱼块、菌悬液和红酒糟,按鱼块的质量进行菌悬液的接种和红酒糟的添加。实验共分4组,A组:添加红酒糟,层糟层鱼摆放;B组:添加短乳杆菌(2%)及红酒糟;C组:添加酿酒酵母(2%)及红酒糟;D组:添加短乳杆菌(1%)、酿酒酵母(1%)及红酒糟。上述红酒糟的添加量均为m(鱼块)∶m(红酒糟)=1∶1,各组均采用无菌高温蒸煮袋进行包装,密封后20 ℃条件下发酵7 d,每24 h进行测定。
1.3.3.2 感官评定
参照贺林娟等[8]的方法,由具有感官评定经验及专业背景人员组成感官评定小组,在外观、质地和风味3个方面对香糟大黄鱼进行感官评定,其中风味权重为40%,色泽和质地均为30%,评定标准见表1。
表1 香糟大黄鱼感官评定表
Table 1 Standards of sensory evaluation for vinasse large yellow croaker

类别评分标准分值(分)外观(30%)无光泽,组织松散,纹理不清晰<10略有光泽,组织较完整,纹理较清晰10~20颜色红亮,组织完整,纹理清晰20~30质地(30%)软硬度一般,质地不完整,无弹性<10硬度较好,质地较完整,较有弹性10~20硬度适中,质地完整,有弹性20~30风味(40%)发酵味不足,有异味<10发酵味不明显,可接受10~20发酵香气较淡,较协调20~30发酵味浓郁,风味突出且协调30~40
1.3.3.3 菌株生长动力学及模型评价
每组称取10 g鱼肉样品置于无菌生理盐水中,研磨后进行梯度稀释,选择合适的稀释梯度进行涂布,菌落总数、乳酸菌及酵母菌分别采用PCA、MRS和PDA培养基,28 ℃培养2~3 d后计数。
模型构建:采用修正的Gompertz方程拟合菌株生长动力学曲线,见公式(1):

式中:Nt,t时间对应的菌数,CFU/g;N0,初始菌数,CFU/g;Nmax,最大菌数,CFU/g;μmax,最大比生长速率,h-1;t,时间,d;Lag,延滞期,h。
模型评价:采用判定系数(R2)、均方误差(root mean square error,RMSE)、偏差因子(Bf)和准确因子(Af)对模型拟合优度进行评价,其中R2、Af和Bf值越接近于1,RMSE越接近于0,预测效果越好,评价方程如公式(2)(3)(4)所示。

式中:yobs,实测值;ycal,预测值;n,实测值个数。
1.3.3.4 色泽测定
取发酵大黄鱼鱼块,使用色差计进行测定,记录L*值、a*值、b*值。
1.3.3.5 理化指标的测定
pH、总酸(total acid,TA)、氨基态氮(amino acid nitrogen,ANN)、总挥发性盐基氮(total volatile base nitrogen,TVB-N)测定分别按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》、GB/T 12456—2008《食品中总酸的测定》(酸碱滴定法、以乳酸计)、甲醛滴定法、GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》进行测定。
1.4 数据处理
采用Excel 2016进行数据处理及计算,使用Origin 8.0作图,并按照修正Gompertz模型进行拟合。
2 结果与分析
2.1 优势菌鉴定及其生理生化和碳源利用特征
经分离、纯化、BIOLOG鉴定和分子鉴定,研究发现,红酒糟中微生物由乳酸菌、酵母菌、芽胞杆菌等组成,如图1所示。

图1 红酒糟中微生物菌相组成
Fig.1 Microbial phase composition in red vinasse
由图2可知,J4-1与短乳杆菌(Lactobacillus brevis)的相似度为100%, J3-1与酿酒酵母(Saccharomyces cerevisiae)相似度99%, 且二者为红酒糟中的优势菌, 占比分别为55.28%和41.74%。

a-细菌;b-酵母菌
图2 优势菌株系统发育树
Fig.2 Phylogenetic tree of dominant strains
短乳杆菌和酿酒酵母生理生化和碳源利用特征见表2,短乳杆菌发酵葡萄糖产酸不产气,酿酒酵母具有过氧化氢酶活性,可清除发酵过程中过氧化氢造成的酸败。短乳杆菌具有脂肪酶活力,能通过酯的水解、合成、交换形成特殊风味;但也有研究表明应用于发酵肉制品中的乳酸菌无需脂肪酶和蛋白酶活性,否则会产生酸败味[10]。
乳酸菌发酵过程中积累有机酸,降低pH,抑制病原微生物以减少危害[11],一般要求在16~24 h内使发酵体系pH降到5.3以下[12],在本研究中37 ℃培养24 h及NaCl质量分数为2%和4%条件下,pH均能下降到5.0以下。混合发酵中酵母菌通常与乳酸菌复配使用,因此酵母菌必须能够具有低酸耐受性并有较高的活性使发酵继续进行,酿酒酵母在pH 3~7时能生长,对酸性环境有一定的耐受性。在提倡低盐健康生活的当下,通过接种乳酸菌发酵剂,并辅以低氧胁迫,控制有害微生物的生长,使发酵鱼制品的安全性得到保障[13];NaCl质量分数2%~6%满足在发酵制品中乳酸菌发酵剂对6%食盐耐受性的要求;随着NaCl质量分数升高至8%,酵母菌仍能够生长。乳酸质量分数1%~5%时,酿酒酵母均能生长,乳酸质量分数升高至7%,生长受到抑制。已有研究表明乳酸菌和酵母菌之间存在信号分子,能促进或者抑制彼此生长[14],本研究中的酿酒酵母与短乳杆菌在共培养中的相互作用还需进一步的研究。
碳源可供给微生物生命活动所需要的营养物质和能量。由表2可知,2株菌利用的碳源物质种类差异较大,呈互补状,短乳杆菌能利用α-D-葡萄糖,此糖为六碳糖,研究表明乳酸菌利用五碳糖、六碳糖代谢后可产生有机酸,除对滋味的贡献外,还能与酵母菌产生的醇类相互作用生成酯类,增强风味。酿酒酵母可利用多种类型碳源,具有较强的发酵能力,并且在生成物质中,醇类和酯类能使发酵制品更加温和浓郁。
表2 短乳杆菌和酿酒酵母生理生化和碳源利用特征
Table 2 Biochemical characterization and carbon source utilization of Lactobacillus brevis and S. cerevisiae

特性短乳杆菌酿酒酵母糖发酵产酸+/糖发酵产气-/过氧化氢酶-+蛋白酶 --脂肪酶 +-酸化能力 0 h6.43±0.02/24 h4.58±0.04/2% NaCl,24 h4.93±0.04/4% NaCl,24 h5.25±0.02/pH耐受性3++5++7++NaCl耐受性2%++4%++6%++8%-+乳酸耐受性1%/+3%/+5%/+7%/-糖类糊精++菊粉-+麦芽糖-+麦芽三糖-+D-松三糖-+D-蜜二糖-+D-棉子糖-+D-麦芽糖++D-半乳糖-+D-海藻糖-+D-阿洛酮糖-+α-D-葡萄糖+-松二糖+水苏糖-+蔗糖-+水杨苷-+肌苷+-6-O-D-吡喃葡萄糖酰-D-呋喃果糖-+醇类D-山梨醇-+D-阿拉伯醇-+木糖醇-+丙三醇-+羧酸类D-葡萄糖酸+-乙酰乙酸+-甲酸-+丙酸-+琥珀酸-+氨基酸类L-精氨酸+-L-谷氨酸-+D-脯氨酸-+醛酸类D-葡糖醛酸+-D-半乳糖醛酸+-磷酸类D-果糖-6-磷酸+-酯类L-半乳糖醛酸内酯+-吐温80-+吐温40+-
注:“+”表示呈阳性;“-”表示呈阴性;“/”表示该项无对应内容
2.2 发酵能力
2.2.1 感官评定
各组样品感官综合得分见图3,在发酵前3 d,各组样品间的感官评分无明显差异,4 d后差异逐渐显现,接种复合菌株的样品组评分大于接种单一菌的发酵鱼样品。酵母菌和乳酸菌进行混合培养后,其产生的代谢物具有互补机制,能够促进有机酸、游离氨基氮等含量的提高,从而利于增强风味[14]。在实验的过程中发现酿酒酵母的加入促进红酒糟中的刺激气味逐渐变得柔和,提升了发酵大黄鱼的风味品质。
2.2.2 微生物分析
乳酸菌和酵母菌生长动力模型评价参数见表3,该生长模型拟合优度良好。

A-添加红酒糟;B-添加红酒糟及短乳杆菌; C-添加红酒糟及酿酒酵母;D-添加红酒糟、 短乳杆菌及酿酒酵母(下同)
图3 大黄鱼发酵过程中的感官综合得分
Fig.3 Sensory comprehensive score of large yellow croaker during fermentation
表3 乳酸菌和酵母菌生长动力学模型评价
Table 3 Evaluation of lactic acid bacteria and yeast growth kinetic models
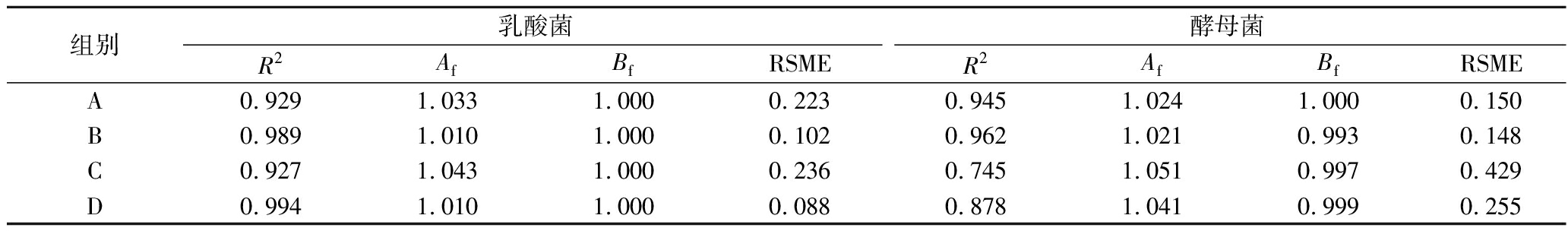
组别乳酸菌酵母菌R2AfBfRSMER2AfBfRSMEA0.9291.0331.0000.2230.9451.0241.0000.150B0.9891.0101.0000.1020.9621.0210.9930.148C0.9271.0431.0000.2360.7451.0510.9970.429D0.9941.0101.0000.0880.8781.0410.9990.255
图4为大黄鱼发酵过程中微生物的变化,在发酵过程中,菌落总数整体处于较低状态,D组样品中菌落总数最低仅为2.70 lg CFU/g,推测由于红酒糟具有较低的pH并含有抑菌物质,进一步抑制了杂菌的生长。发酵鱼中接种短乳杆菌和酿酒酵母后,其相应生长曲线整体呈“S”型。

a-菌落总数;b-乳酸菌总数;c-酵母菌总数
图4 大黄鱼发酵过程中微生物的变化
Fig.4 Microbiological changes in large yellow croaker during fermentation
由表4所示乳酸菌生长动力学参数中可知,由于A和C样品未接种短乳杆菌,乳酸菌均来自于红酒糟,此时两者μmax无明显差别,B和D样品由于接入短乳杆菌,故其μmax显著大于A和C样品的μmax,且B样品的μmax显著大于D,接入复合菌后乳酸菌延滞期变短。酵母菌生长动力学参数中A组和B组中未接入酿酒酵母,酵母菌均来自红酒糟,此时两者μmax无明显差别;C和D中由于接入酿酒酵母,故其μmax大于A和B样品,且接入复合菌后酵母菌延滞期变长。在前期研究中发现纯培养条件下虽然低含量的乳酸能够促进酿酒酵母的生长,但在鱼块中进行短乳杆菌和酿酒酵母的混合发酵,短乳杆菌和酿酒酵母的实际生长情况可能还受其他复杂因素的影响[15]。
2.2.3 色差分析
由于红酒糟中含有红曲霉菌产生的红曲色素,故其在发酵过程中赋予了鱼肉诱人及独特的色泽。由图5可知,在发酵过程中鱼肉L*值逐渐下降,同样在王乃富等[16]研究中鳙鱼肉糜经红曲霉发酵后L*值明显降低。添加红酒糟及接种菌株后a*值、b*值显著提升,鱼肉表现出良好的色泽。样品D在发酵结束时表现出最高的红度值和黄度值,且添加酿酒酵母和短乳杆菌后的B、C和D样品的a*值均大于A样品,说明短乳杆菌和酿酒酵母的加入有助于发酵鱼块中红色色泽的形成。在鱼块发酵过程中b*值波动较a*值大,B组和C组在发酵第2天时b*值达到最大,发酵后期逐渐降低后平稳。总体上,添加红酒糟组a*值总体在25左右波动,b*值在20左右波动,表明红酒糟发酵大黄鱼逐渐呈现了其区别于其他发酵产品的红亮色色泽。综上所述,在添加复合菌株和红酒糟后的发酵大黄鱼块能够形成良好的色泽,提升了发酵大黄鱼的品质。
表4 乳酸菌和酵母菌生长动力学参数
Table 4 Growth kinetic parameters of lactic acid bacteria and yeast

组别乳酸菌酵母菌μmax/d-1Lag/dμmax/d-1Lag/dA0.36±0.101.50±0.470.22±0.051.69±0.63B1.48±0.331.36±0.150.21±0.031.00±1.11C0.35±0.111.83±0.410.71±0.501.39±0.48D0.69±0.070.93±0.140.29±0.132.47±0.49
2.2.4 pH和TA含量变化
大黄鱼发酵过程中pH和总酸含量的变化见图6,由于红酒糟本身具有较低的pH,发酵第1天,pH已下降至较低的状态,在后续发酵中处于波动状态。

a-L*;b-a*;c-b*
图5 大黄鱼发酵过程中色差的变化
Fig.5 The color changes of large yellow croaker during fermentation

a-pH;b-总酸
图6 大黄鱼发酵过程中pH和总酸含量的变化
Fig.6 Total acid changes of large yellow croaker during fermentation
发酵肉制品中前48 h的环境条件对有害病原体的生长和随后的存活率至关重要,此外低pH值引起的蛋白聚集有利于提升发酵产品的稳定性和紧实性,还可以抑制生物胺的形成,提高产品安全性。各样品在发酵过程中总酸含量逐渐增高,在发酵后期趋于稳定;其中短乳杆菌实验组在发酵前期,其总酸含量略高于其他实验组,但在发酵后期接种复合菌实验组总酸含量略高。
2.2.5 ANN含量变化
蛋白质、多肽等含氮化合物在发酵过程中会逐渐降解成小分子肽、游离氨基酸等物质[17],可指示ANN含量的变化,见图7。发酵前期ANN的含量均呈上升趋势,而后未接种菌株和接种酿酒酵母实验组氨基态氮含量逐渐下降,裘迪红等[18]指出氨基态氮为蛋白质的中间降解产物,可进一步代谢为小分子物质,故呈先增加后降低的趋势。短乳杆菌的接入可以明显增加ANN的含量,其蛋白质的降解是内源蛋白酶和微生物酶共同作用的结果,而这2种因素对蛋白水解的贡献还有待研究[19]。

图7 大黄鱼发酵过程中氨基态氮含量的变化
Fig.7 Amino nitrogen changes in large yellow croaker during fermentation
2.2.6 TVB-N含量变化
TVB-N值与蛋白质分解产生的氨以及胺类等含氮物质的含量呈正相关,与水产品品质呈负相关[20]。由图8所示,在各实验组发酵鱼中TVB-N在接种1 d后均已达到较高水平,可能是发酵过程中红酒糟的液态基质渗透到鱼肉组织中,使得所检测的鱼肉中的TVB-N含量处于较高的状态。随着发酵时间的延长TVB-N含量下降,推测酒糟发酵所造成的酸性环境抑制了酶活性和蛋白质分解;另外在BAO等[21]的研究中发现发酵肉制品中乳酸菌可通过其产生的乳酸和细菌素来中和挥发性碱性含氮物质,从而抑制TVB-N的积累。

图8 大黄鱼发酵过程中挥发性盐基氮含量的变化
Fig.8 Total volatile basic nitrogen changes in large yellow croaker during fermentation
3 结论
以源自香糟大黄鱼中红酒糟优势菌短乳杆菌和酿酒酵母为对象,分析了2种菌的生理生化、碳源代谢和发酵能力,表明短乳杆菌具有良好的酸化能力、低pH耐受性和高NaCl耐受性;酿酒酵母具有低pH、高NaCl及乳酸耐受性;2种菌碳源代谢类型差异较大。在接种实验中,接种酿酒酵母能够使红酒糟中的刺激气味逐渐变得柔和;红酒糟可抑制杂菌的增殖,提供良好安全的环境,且发酵大黄鱼逐渐呈现了区别于其他发酵产品的红亮色泽。短乳杆菌的接入可加速发酵,增加氨基态氮的含量;短乳杆菌和酿酒酵母均可抑制大黄鱼中腐败菌的生长,降低发酵中产品的腐败变质,但对其抑制效应和评价有待深入研究。
[1] 中华人民共和国农业部渔业局. 2021中国渔业统计年鉴[M].北京:中国农业出版社, 2021.
The Peoples’s Republic of China Ministry of Agriculture,Fisheries Bureau.2021 China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press, 2021.
[2] LIU S N, HAN Y, ZHOU Z J.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Research International, 2011, 44(3):643-651.
[3] ZANG J H, XU Y S, XIA W S, et al.Quality, functionality, and microbiology of fermented fish:A review[J].Critical Reviews in Food Science and Nutrition, 2020, 60(7):1 228-1 242.
[4] TAMANG J P, SHIN D H, JUNG S J, et al.Functional properties of microorganisms in fermented foods[J].Frontiers in Microbiology, 2016, 7:578.
[5] YANG Z X, LIU S S, LV J, et al.Microbial succession and the changes of flavor and aroma in Chouguiyu, a traditional Chinese fermented fish[J].Food Bioscience, 2020, 37:100725.
[6] ZENG X F, XIA W S, WANG J S, et al.Technological properties of Lactobacillus plantarum strains isolated from Chinese traditional low salt fermented whole fish[J].Food Control, 2014, 40:351-358.
[7] ZENG X F, FAN J, HE L P, et al.Technological properties and probiotic potential of yeasts isolated from traditional low-salt fermented Chinese fish Suan yu[J].Journal of Food Biochemistry, 2019, 43(8):e12865.
[8] 贺林娟, 汤海青, 曹锦轩, 等.糟鱼中乳酸菌的分离鉴定及鳓鱼发酵条件优化[J].核农学报, 2013, 27(4):458-466.
HE L J, TANG H Q, CAO J X, et al.Screening and identification of lactic acid bacteria from traditional vinasse fish and optimization of parameters for preparing fermented Chinese herring[J].Journal of Nuclear Agricultural Sciences, 2013, 27(4):458-466.
[9] 吴燕燕, 钱茜茜, 李来好, 等.鱼类腌制品加工过程微生物群落多样性研究进展[J].生物技术通报, 2015, 31(7):40-44.
WU Y Y, QIAN X X, LI L H, et al.Research progress on diversity of microbial community during the pickled processing of salted fish products[J].Biotechnology Bulletin, 2015, 31(7):40-44.
[10] 王曼, 杨琛, 覃晓玉, 等.鲊肉粉中乳酸菌和葡萄球菌的筛选及鉴定[J].食品与发酵工业, 2021, 47(5):22-27.
WANG M, YANG C, QIN X Y, et al.Screening and identification of lactic acid bacteria and Staphylococcus in fermented meat rice[J].Food and Fermentation Industries, 2021, 47(5):22-27.
[11] AKANJI B, ALAKE A.Evaluation of organic acids, anti-Salmonella activities of lactic acid bacteria isolated from Nigerian grown salad vegetables[J].British Biotechnology Journal, 2016, 11(1):1-10.
[12] 张红城, 闵连吉, 倪晨.发酵肠生产中乳酸菌的选择[J].食品科学, 1996, 17(8):25-29.
ZHANG H C, MIN L J, NI C.Selection of lactic acid bacteria in fermented sausage production[J].Food Science, 1996, 17(8):25-29.
[13] AASLYNG M D, VESTERGAARD C, KOCH A G.The effect of salt reduction on sensory quality and microbial growth in hotdog sausages, bacon, ham and salami[J].Meat Science, 2014, 96(1):47-55.
[14] 段小果, 李博, 贺银凤.乳酸菌与酵母菌共生机理的研究进展[J].微生物学通报, 2017, 44(8):1 988-1 995.
DUAN X G, LI B, HE Y F.Progress in symbiotic mechanism between lactic acid bacteria and yeast[J].Microbiology China, 2017, 44(8):1 988-1 995.
[15] 洪家丽, 陈敏, 周文斌, 等.乳酸菌对红曲黄酒酿造过程酵母菌生长及风味物质形成的影响[J].中国食品学报, 2020, 20(1):91-100.
HONG J L, CHEN M, ZHOU W B, et al.Effects of lactic acid bacteria on the growth of yeast and the formation of flavor compounds in the fermentation of Hongqu glutinous rice wine[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(1):91-100.
[16] 王乃富, 李春阳, 阎征, 等.红曲霉发酵对鳙鱼肉糜品质和生物活性影响研究[J].广西农学报, 2010, 25(2):54-57; 65.
WANG N F, LI C Y, YAN Z, et al, Effects of Monascus fermentation on the quality and bioactivity of bighead carp surimi[J].Journal of Guangxi Agriculture, 2010, 25(2):54-57; 65.
[17] TANG K X, SHI T G, G NZLE M.Effect of starter cultures on taste-active amino acids and survival of pathogenic Escherichia coli in dry fermented beef sausages[J].European Food Research and Technology, 2018, 244(12):2 203-2 212.
NZLE M.Effect of starter cultures on taste-active amino acids and survival of pathogenic Escherichia coli in dry fermented beef sausages[J].European Food Research and Technology, 2018, 244(12):2 203-2 212.
[18] 裘迪红, 李改燕.糟鱼发酵过程中非挥发性物质的变化[J].中国食品学报, 2011, 11(8):183-190.
QIU D H, LI G Y.Variety of the nonvolatile materials in fermentation process of fermentating fish[J].Journal of Chinese Institute of Food Science and Technology, 2011, 11(8):183-190.
[19] 密更, 李婷婷, 仪淑敏, 等.人工接种乳酸菌发酵鱼糜的研究进展[J].中国食品学报, 2019, 19(5):302-312.
MI G, LI T T, YI S M, et al.The research advance of fermented surimi inoculated with lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(5):302-312.
[20] BILGIN B, GENÇCELEP H.Determination of biogenic amines in fish products[J].Food Science and Biotechnology, 2015, 24(5):1 907-1 913.
[21] BAO R Q, LIU S S, JI C F, et al.Shortening fermentation period and quality improvement of fermented fish, Chouguiyu, by co-inoculation of Lactococcus lactis M10 and Weissella cibaria M3[J].Frontiers in Microbiology, 2018,9:3 003.