冷冻干燥菌剂具有活性高、稳定性强以及能有效预防变质和污染细菌等优点[1-2]。为提高冷冻干燥过程中细胞的存活率,通常加入保护剂以提高细胞对外界压力的抵抗力[3]。海藻糖、脱脂牛奶、蔗糖、乳糖、葡聚糖、麦芽糖、甘露醇、麦芽糊精、阿拉伯胶和淀粉等糖和碳水化合物以及蛋白质被广泛应用于细胞的冻干过程[4]。但单一保护剂对细胞的保护作用非常有限,需要其他保护剂的协同作用来提高细胞的存活率[5]。因此,在细胞冻干过程中通常添加复合保护剂,以达到冷冻过程中对细胞更好的保护作用[6-7]。POLOMSKA等[8]研究发现,冻干假丝酵母时,采用脱脂奶粉、海藻糖和谷氨酸钠作保护剂比仅使用脱脂奶粉作为保护剂酵母存活率提高了60%。
美极梅奇酵母(Metschnikowia pulcherrima,Mp)是一种常见的非酿酒酵母,普遍存在于成熟葡萄浆果表面和葡萄酒发酵初级阶段[9]。Mp与酿酒酵母混菌发酵,具有降低葡萄酒酒精含量、增加甘油含量[10]、改善葡萄酒的风味和品质[11-12]、促进红葡萄酒色泽稳定性[13]等良好酿造特性[14-15]。因此,其在果酒酿造中具有非常广泛的应用前景。我国酿造菌剂的研发远落后于国外相关研究,且国内果酒酿造菌剂主要依赖进口。所以,专一性菌剂的缺乏,是导致国内葡萄酒同质化问题严重、口感寡淡缺乏特色的关键。因此,开发高效菌剂是提升果酒风味和品质的关键,也是提升果蔬精加工产品附加值的重要手段。为了促进Mp发酵剂的商业化及推广其广泛应用,有必要开展高稳定性及高存活率Mp菌剂的制备方法和技术等相关研究。目前虽已有文献报道了异常汉逊酵母(Hansenula anormala)和马克斯克鲁维酵母(Kluyveromyces marxianus)等少数非酿酒酵母冷冻干燥保护剂的研究[6,16],并对保护剂的保护机理进行了初步探讨,为非酿酒酵母冷冻干燥菌剂的开发提供了参考。但研究发现,不同物种甚至同一物种的不同菌株在真空冷冻干燥及其储存期间表现出不同的行为[17]。因此,目前有关非酿酒酵母冷冻干燥菌剂及其保护剂的开发还需要开展广泛的研究。同时,有关Mp菌剂的开发及其冷冻复合保护剂的研究还鲜见报道。
本研究采用Plackett-Burman试验设计法筛选出对Mp冷冻干燥具有显著保护作用的保护剂,结合最陡爬坡试验和响应面分析法(response surface method,RSM)进一步优化保护剂复合配方,以期最大限度提高该酵母在冷冻干燥过程中的存活率,为未来实现Mp发酵剂工业化的制备和应用提供参考,也为其他酵母冷冻干燥保护剂的研究和开发提供一定的研究基础和参考。
美极梅奇酵母(Mp 01),由河北科技师范学院酿酒工程实验室保藏。
YPD液体培养基(g/L):酵母浸粉 10、蛋白胨 20、葡萄糖 20,121 ℃灭菌20 min。
YEPD固体培养基(g/L):酵母浸粉 10、蛋白胨 20、葡萄糖 20、琼脂 20,121 ℃灭菌20 min。
葡萄糖、蛋白胨、酵母浸粉、琼脂粉,北京奥博星生物技术有限公司;脱脂乳粉,山东亿宝莱生物科技有限公司;谷氨酸钠和海藻糖,河南万邦实业有限公司;麦芽糖,成都市科龙化工试剂厂;蔗糖,天津市风船化学试剂科技有限公司;乳糖、甘氨酸、维生素C,上海源叶生物科技生物有限公司;吐温-80,阿拉丁。
FDU-1 200 EYELA真空冷冻干燥机,北京五洲东方科技发展有限公司;低温离心机,湖南湘仪实验室仪器开发有限公司;SW-CJ 系列洁净工作台,苏州安泰空气技术有限公司;数显立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;BS-2F数显恒温振荡培养箱,金坛区水北科普实验仪器厂。
1.3.1 美极梅奇酵母生长曲线及菌体收集时间的确定
菌种的活化:适量挑取斜面菌种接种于100 mL YPD液体培养基中,28 ℃、150 r/min振荡培养24 h,得活化种子液,并用血球计数板计数。
将活化的酵母种子液以1.0×106 CFU/mL 的接种量接入150 mL YPD培养基中,28 ℃、150 r/min振荡培养,每隔3 h取样,测定其OD600值。以未接种的培养基为空白对照,以培养时间为横坐标,OD600值为纵坐标绘制Mp 01生长曲线,每个样品设置3个重复。
1.3.2 美极梅奇酵母菌液离心条件的确定
根据1.3.1确定的Mp 01生长曲线,在酵母减速生长末期及平衡期初期收集酵母菌体,通过考察不同离心力(2 184、2 852、3 610、4 457×g)及不同离心时间(3、5、10、15、20 min)对酵母收集率的影响,确定适宜离心转速和离心时间。
1.3.3 酵母活菌计数方法
离心后收集菌泥,加入与离心菌液等体积的生理盐水对菌体进行复溶。取离心前菌液及离心后菌泥用生理盐水复溶后的菌液[17],采用稀释涂布法确定活菌数,存活率计算如公式(1)所示:
存活率![]()
(1)
式中:N1,沉淀复溶液中的活菌数;N2,初始活菌数。
1.3.4 冷冻干燥方法
将离心后的菌泥放入无菌冻存管中,菌泥与保护剂按1∶2的体积比混合,放入-80 ℃冰箱预冻4 h。提前开启冻干机,待冷阱温度达到-40 ℃时,将处理好的MP 01立即放入冻干机,真空冻干24 h。采用稀释涂布法计算冷冻干燥前后的活菌数[18],如公式(2)所示:
存活率![]()
(2)
式中:N3,冻干粉复溶后的活菌数;N4,初始活菌数。
1.3.5 不同保护剂对酵母存活率的影响
单因素试验:选取海藻糖、蔗糖、乳糖、维生素C、谷氨酸钠、甘氨酸、麦芽糖、脱脂乳粉、吐温-80作为单一冷冻干燥保护剂,以上保护剂的浓度参照文献报道[3,5,7-8],分别设定质量分数为3%、5%、7%、9%、11%,以存活率作为检测指标初步筛选冻干存活率积极影响作用比较显著的因素和水平,进行Plackett-Burman(PB)试验设计。试验设计及结果见表1。
1.3.6 Plackett-Burman试验
根据1.3.5的试验结果,确定保护剂种类,每个因素设置高、低2个水平,使用Design-Expert 8.0.6设计n=12的PB测试[19],筛选对Mp 01存活率有显著影响作用的保护剂成分。
1.3.7 最陡爬坡试验
根据DU等[20]的方法,对Plackett-Burman试验结果确定的显著影响因素进行最陡爬坡试验,分析对Mp 01冻干存活率具有显著影响作用的因素,并进一步确定显著影响因素的最佳水平范围。
1.3.8 美极梅奇酵母冻干保护剂复合配方的优化试验及验证
根据1.3.6的实验结果,采用Design-Expert 8.0.6进行Box-Behnken Design(BBD)响应面分析,确定Mp 01最优冻干保护剂的配比[21]。
1.3.9 数据处理与统计分析
实验根据Box-Benhnken模型的中心组合原理,主要采用Design-Expert 8.0.6中Plackett-Burman、RSM进行试验设计、数据分析及模型的建立,差异显著性水平为0.01和0.05。
由Mp 01的生长曲线可知(图1),在接入菌种后的0~6 h为酵母生长的迟滞期,9~18 h为酵母的对数生长期,21 h左右进入稳定期(平衡期),菌体量逐渐达到最大值,综合考虑菌龄和菌体量,本试验在发酵的第24 h进行菌体收集。
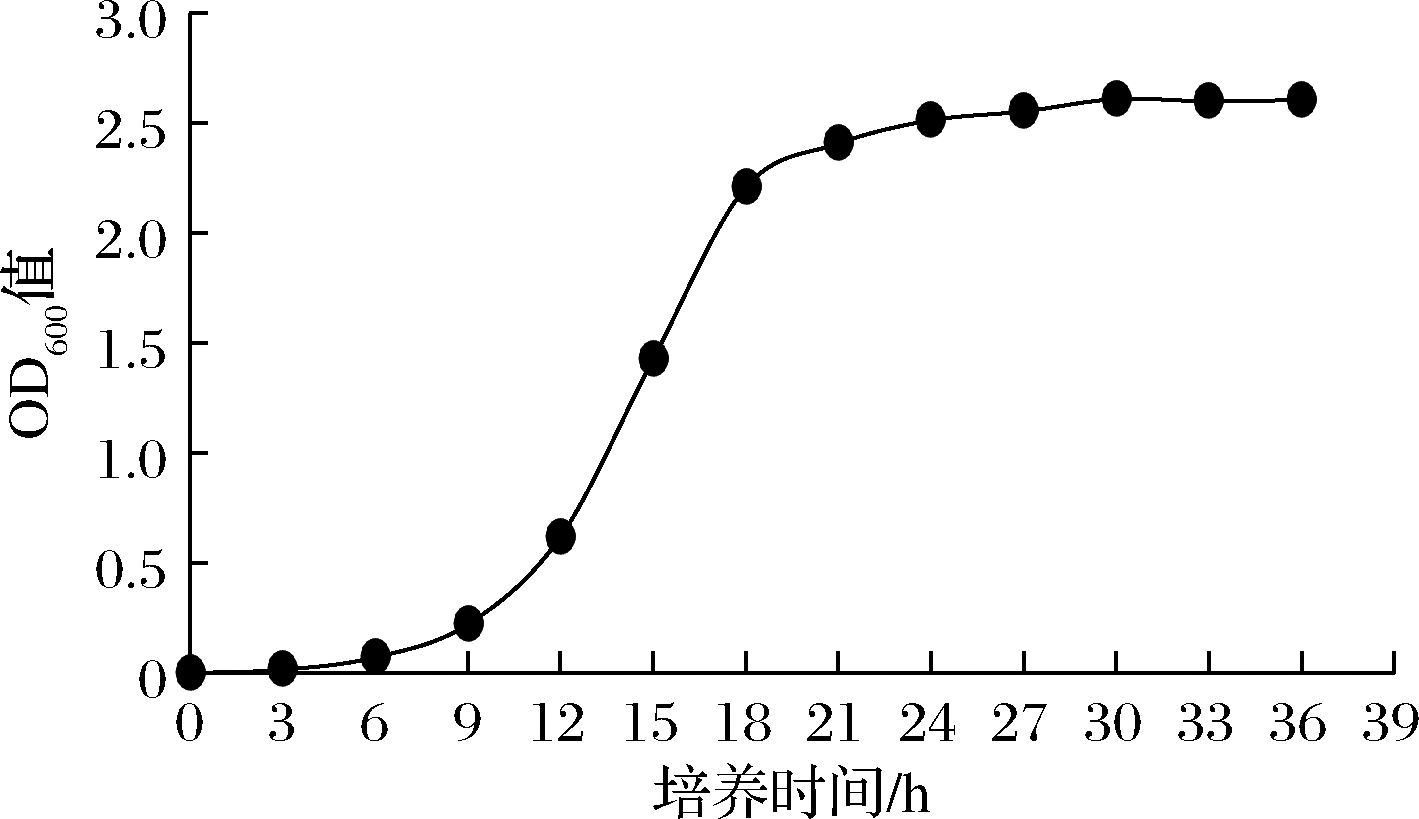
图1 美极梅奇酵母生长曲线
Fig.1 Growth curve of M. pulcherrima
将收集的Mp 01菌体在不同条件下进行离心,并计算Mp 01的收集率,结果如图2所示。离心转速和时间对菌体收集率有明显影响,随着转速和时间的延长,离心收集率先增大再减小,在15 min时,收集率最高;20 min时降低,随着时间的延长,离心力对酵母细胞的破坏影响增大,细胞死亡率增大,导致收集率下降。最终确定,2 852×g离心15 min,Mp 01的收集率最高为93.55%,为本试验最佳离心条件。

图2 美极梅奇酵母在不同离心力及 时间下的离心存活率
Fig.2 Survival rate of M. pulcherrima under different centrifugal force and time
综合文献报道结果,优选9种物质(表1)作为Mp 01冷冻干燥过程中的单一保护剂。由表1数据可知,9种单一保护剂对Mp 01具有不同保护作用。其中脱脂乳粉、麦芽糖、蔗糖、海藻糖、谷氨酸钠和乳糖等6种物质作为单一保护剂时,Mp 01的存活率相对较高,存活率最高分别能达到64.9%,76.88%,77.3%,80.7%,70.92%,70.8%。因此,选择以上6种保护剂进行显著影响因素分析。
表1 不同保护剂种类及浓度对美极梅奇酵母冻干存活率的影响 单位:%
Table 1 Effect of different drying protective and concentration on the survival rate of yeast

保护剂质量分数海藻糖蔗糖乳糖维生素C谷氨酸钠甘氨酸麦芽糖脱脂乳粉吐温-80357.658.726.794.2635.492.2564.786.003.25560.377.360.847.8055.878.9176.889.785.97780.763.666.930.7660.5818.7756.1921.9410.77970.248.770.843.2265.8714.6551.7836.8617.691167.840.368.955.2570.9233.4446.8864.9027.35
根据1.3.6的方法,进行Plackett-Burman(PB)试验因素与水平设计[19,22],考查以上6种冷冻保护剂成分(脱脂乳粉、谷氨酸钠、海藻糖、麦芽糖、蔗糖、乳糖)中,对Mp 01冷冻干燥过程中的存活率具有显著影响作用的因素,PB设计结果见表2,试验结果见表3,各因素效应分析见表4。
对试验结果进行效应分析(表4),发现本次PB试验模型的P值为0.044 0,说明此模型在0.05水平上足以拟合试验数据。表4中麦芽糖、蔗糖和海藻糖的效应值均为正,说明对Mp 01存活率有显著正作用,
表2 Plackett-Burman设计因素与水平
Table 2 Factors and levels of Plackett-Burman design
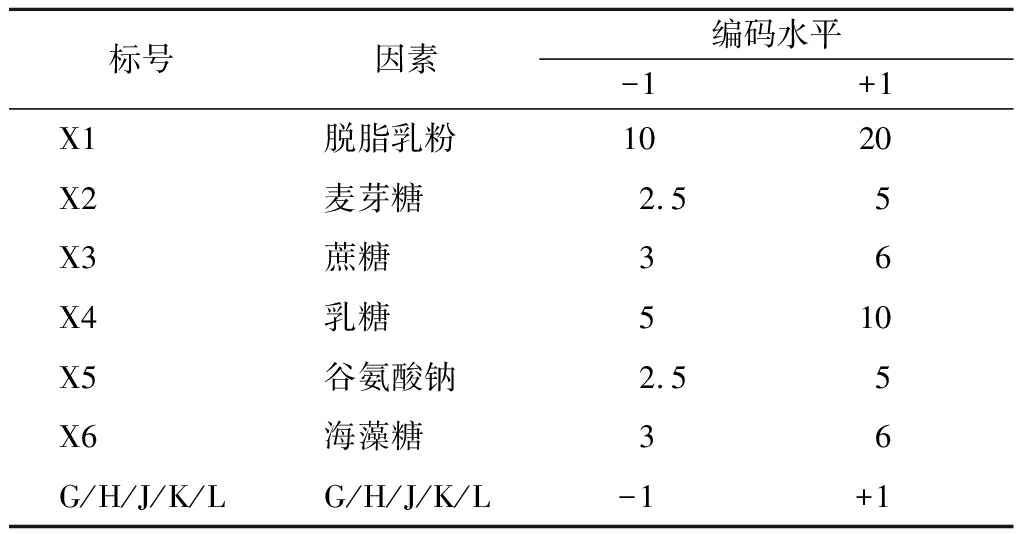
标号因素编码水平-1+1X1脱脂乳粉1020X2麦芽糖2.55X3蔗糖36X4乳糖510X5谷氨酸钠2.55X6海藻糖36G/H/J/K/LG/H/J/K/L-1+1
注:G、H、J、K、L为虚拟项(下同)
表3 Plackett-Burman试验设计及结果 单位:%
Table 3 Design and results of Plackett-Burman experiments

顺序号脱脂乳粉麦芽糖蔗糖乳糖谷氨酸钠海藻糖GHJKL存活率1202.5355311-11158.22210565561-1-1-1188.733202.56102.5611-1-1-176.594102.5352.53-1-1-1-1-162.155205352.56-111-1181.916102.53102.561-111178.68710531053111-1-167.3781056102.56-11-11183.18920531056-1-1-11-185.1510205652.531-111-182.9311202.561056-1-11-1175.1312102.56556-1111-187.06
表4 Plackett-Burman试验设计各因素效应分析
Table 4 Effect analysis of Plackett-Burman experiments design

来源平方和自由度方差F值P值效应模型927.676154.615.290.044 0-脱脂乳粉4.3614.360.150.715 5-1.20麦芽糖220.421220.427.530.040 68.57蔗糖301.301301.3010.300.023 710.02乳糖2.1612.160.0740.796 70.85谷氨酸钠1.1811.180.0400.848 5-0.63海藻糖398.251398.2513.610.014 211.52残差146.27529.25---总回归1 073.9411----
注:P<0.01 表示差异极显著;0.01<P<0.05 表示差异显著;P>0.05 表示差异不显著
而其余因素作用效果不显著(P>0.05)。因此,麦芽糖、蔗糖和海藻糖是对Mp 01冷冻过程中具有显著保护作用的保护剂,需进一步确定这3种显著因素的最佳添加水平和配比。
本试验利用最陡爬坡试验,对显著影响因素麦芽糖、蔗糖和海藻糖的浓度范围和配比进行优化,以对Mp 01冻干过程达到最好的保护作用。最陡爬坡试验设计中,3个因素的变化方向的效应均为正效应(表4),因此最陡爬坡试验设计中以上3因素的水平均为正向变化,从低值往上增加。具体结果见表5。
表5 最陡爬坡试验设计及结果 单位:%
Table 5 Designs and results of the steepest experiments

试验号麦芽糖蔗糖海藻糖存活率156684.82277881.313981065.7741191261.93513101492.76615111688.15
实验结果表明,麦芽糖、蔗糖和海藻糖分别以13%、10%和14%(表5,试验号5)进行配比时,对Mp 01的保护效果最好。因此,进一步将表5中的第5组试验中的3因素及其水平确定为响应面优化研究的试验中心组合。
2.6.1 复合保护剂响应面试验结果
根据最陡爬坡试验结果(表5),使用Design-Expert 8.0.6对麦芽糖、蔗糖和海藻糖进行三因素三水平响应面优化设计。响应面具体设计方案和试验结果如表6所示,方差分析如表7所示。
将表7中数据进行二次多元回归拟合分析,获得Mp 01的菌体存活率对麦芽糖、蔗糖和海藻糖的二元多项式回归方程:
Y/%=93.35+3.71A+2.69B+2.00C-1.16AB-3.50AC-3.07BC-4.27A2-5.38B2-5.17C2
由表7可知,P<0.000 1,说明此模型在α=0.01的水平上回归显著;失拟项P值为0.058 9>0.05,
表6 美极梅奇酵母菌存活条件优化Box-Benhnken 设计方案及结果 单位:%
Table 6 Design and results of Box-Benhnken experiments for survival conditions optimization of M. pulcherrima

顺序号麦芽糖蔗糖海藻糖存活率1-1-1075.5921-1085.13301184.22400092.59501-185.456-11084.5870-1-175.248-10-175.06911089.491000093.921100093.151210-189.671310185.76140-1186.271500093.281600093.7917-10185.14
表7 响应面试验回归方程方差分析
Table 7 Analysis of variance of regression equation

来源平方和自由度均方F值P模型638.96971 79.76<0.000 1A-麦芽糖110.111110.11123.70<0.000 1B-蔗糖57.84157.8464.97<0.000 1C-海藻糖31.88131.8835.810.000 6AB5.3615.366.020.043 9AC48.93148.9354.970.000 1BC37.58137.5842.210.000 3A276.70176.7086.16<0.000 1B2121.891121.89136.94<0.000 1C2112.561112.56126.45<0.000 1残差6.2370.89--失拟项5.0931.705.950.058 9纯误差1.1440.29--总和645.2016---
注:P<0.01表示差异极显著
表明失拟项不显著,由此可知该方程可真实反映Mp 01冷冻过程中存活率的实际情况。响应面试验回归方程的决定系数R2=0.990 3,表明该模型具有很好的相关性。修正后的决定系数![]() 表明该响应面试验模型可以解释97.79%的响应面值的变化。响应面的变异系数为1.09%,表明仅有1.09%的变异不能由该模型解释。因此,可用该模型来预测不同保护剂组合对Mp 01存活率的影响,并且麦芽糖、蔗糖和海藻糖这3个因素对Mp 01菌体存活率影响作用都非常显著。
表明该响应面试验模型可以解释97.79%的响应面值的变化。响应面的变异系数为1.09%,表明仅有1.09%的变异不能由该模型解释。因此,可用该模型来预测不同保护剂组合对Mp 01存活率的影响,并且麦芽糖、蔗糖和海藻糖这3个因素对Mp 01菌体存活率影响作用都非常显著。
2.6.2 冷冻保护剂最优组合配方及验证实验
依据响应面优化设计,通过对回归模型进行数学分析,得到的Mp 01最优冻干保护剂配方:麦芽糖130 g/L、蔗糖100 g/L和海藻糖140 g/L,在此条件下Mp 01存活率预测值为93.34%。将所得最优保护剂配方应用于Mp 01的冷冻干燥,重复3次,Mp 01的平均存活率为92.78%,与预测值相差0.56%。以上结果说明,由响应面试验设计得到的数学模型准确可靠,得到的最佳冻干保护剂组合方案可行,在实际操作中具有指导意义。
2.6.3 美极梅奇酵母发酵剂贮藏条件及稳定性测定
对Mp 01冻干菌剂贮藏条件进行研究,实验结果见表8,确定贮藏条件后,对其稳定性进行持续观察,结果见表9。
表8 美极梅奇酵母贮藏条件结果 单位:%
Table 8 Results of the storage conditions of M. pulcherrima
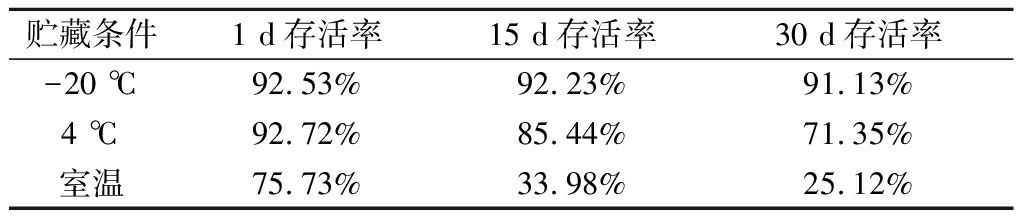
贮藏条件1 d存活率15 d存活率30 d存活率-20 ℃92.53%92.23%91.13%4 ℃92.72%85.44%71.35%室温75.73%33.98%25.12%
表9 美极梅奇酵母发酵剂贮藏稳定性检验结果
Table 9 Result of M. pulcherrima starter storage stability test
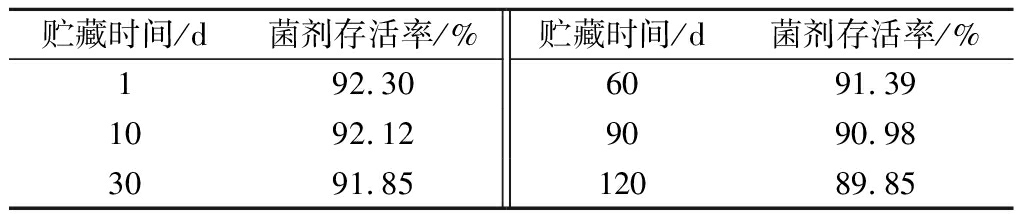
贮藏时间/d菌剂存活率/%贮藏时间/d菌剂存活率/%192.306091.391092.129090.983091.8512089.85
通过对美极梅奇酵母菌剂贮藏条件的研究发现,冻干菌剂在-20 ℃条件下贮藏,其存活率远高于室温和4 ℃条件,对贮藏稳定性的研究发现,在-20 ℃条件下保存4个月仍具有较高的存活率(89.85%),说明在此条件下贮藏冻干菌剂具有较好的稳定性。
酵母的代谢和生理特征存在种间和种内差异,现阶段并没有普遍而有效的方法用于酵母冻干过程的保护。因此,对于不同的酵母,有必要开展针对性的冻干工艺,并优化最佳保护剂的配方,以促进其商业生产和广泛应用。本研究前期筛选出的美极梅奇酵母Mp 01具有纤维素酶、果胶酶和β-葡萄糖苷酶等多种水解酶活性,有利于提高水果果皮花色素苷及果皮中品种香气成分的释放,对果酒酿造过程中果酒的澄清及增香具有非常重要的影响作用。因此本研究开展了Mp 01冷冻干燥保护剂的优化研究,以期为该酵母的广泛应用及Mp商业菌剂的制备提供研究基础和方法学参考。首先通过评估9种单一保护剂对Mp 01冷冻干燥过程的保护作用,发现脱脂乳粉、麦芽糖、蔗糖、海藻糖、谷氨酸钠和乳糖等6种保护剂对Mp 01具有较好保护作用,进一步通过Plackett-Burman试验法,发现麦芽糖、蔗糖和海藻糖对Mp 01的保护作用最为显著,最后通过最陡爬坡试验和响应面法,确定了Mp 01冷冻干燥复合保护剂配方(麦芽糖130 g/L、蔗糖100 g/L和海藻糖140 g/L),结果表明,Mp 01冷冻干燥后的平均存活率达到92.78%,比单一保护剂最高存活率提高了16%左右。
已有研究发现,糖醇类物质是酵母冷冻干燥过程中的有效保护剂[4],本研究也验证了这一结论。在本研究中,对Mp 01具有显著保护作用的保护剂均为糖醇类。对二糖、多元醇、单糖、脱脂乳和其他有机分子提高微生物的稳定性的研究发现,干燥过程中碳水化合物通过形成玻璃态来提高细胞的稳定性[23]。例如:海藻糖由于玻璃态的形成,可以置换水与脂质和蛋白质形成的氢键,从而稳定了微生物的细胞膜,减轻冷冻干燥对细胞的损伤[3]。同时,本研究发现蔗糖是影响Mp 01冻干过程存活率的显著影响因素之一,这与CARVALHO等[24]的研究结果一致,他们发现不能代谢的糖比代谢的糖更有效。N’GUESSAN等[25]也有类似的研究结果,在生产用于啤酒酿造的酵母发酵剂时发现,蔗糖是冻干过程中最好的保护剂。因此,结合本研究结果以及以上分析表明,海藻糖和蔗糖很有可能是非酿酒酵母尤其是Mp通用的效果良好的冷冻保护剂,后续需要开展更广泛和深入的研究,已验证以上推测。
一般来说,单一保护剂的作用是有限的,存在各自的缺点,但这些缺点可通过其他保护剂来弥补[5],因此,复合保护剂的研究和开发,对于提高酵母冻干菌剂的稳定性和活性尤为重要。由于菌种之间存在种间和种内的差异性,同时不同类型的保护剂对不同种类细胞的存活率的影响不同,所以冷冻干燥中保护剂及其配方需要根据菌种进行特定筛选、优化和改善。目前,有关Mp 01贮存期间的存活率以及该菌株的存活动力学及其在果酒酿造中的应用评价试验正在进行中,使用优化后的复合保护剂冻干的Mp 01,-20 ℃保藏30 d后,存活率为91.85%,保留了原存活率的99.51%,贮藏4个月后,仍具有较高的存活率(89.85%),表现出较好的贮藏稳定性,说明此复合保护剂对Mp 01的低温贮藏具有很好的保护作用。此外,该复合保护剂是否适用于其他Mp、酿酒酵母、其他非酿酒酵母及酿酒酵母和Mp混菌发酵菌的开发,需要进一步的研究和验证。
[1] BENUCCI I, LIBURDI K, CERRETI M, et al.Characterization of active dry wine yeast during starter culture (pied de cuve) preparation for sparkling wine production[J].Journal of Food Science, 2016, 81(8):M2015-M2020.
[2] ABBOTT E, VILLEGAS D, ZANDYCKE S, et al.Strain-specific performance of active dry yeast for fermentation of very high gravity wort[J].Brewing Science, 2020, 72(Mach/April):89-93.
[3] SAVEDBOWORN W, KERDWAN N, SAKORN A, et al.Role of protective agents on the viability of probiotic Lactobacillus plantarum during freeze drying and subsequent storage[J].International Food Research Journal, 2017, 24(2):787-794.
[4] NUALKAEKUL S, DEEPIKA G, CHARALAMPOPOULOS D.Survival of freeze dried Lactobacillus plantarum in instant fruit powders and reconstituted fruit juices[J].Food Research International, 2012, 48(2):627-633.
[5] YU J X, ANCHORDOQUY T J.Synergistic effects of surfactants and sugars on lipoplex stability during freeze-drying and rehydration[J].Journal of Pharmaceutical Sciences, 2009, 98(9):3 319-3 328.
[6] GUO W S, YANG X, LI C, et al.Comprehensive optimization of composite cryoprotectant for Saccharomyces boulardii during freeze-drying and evaluation of its storage stability[J].Preparative Biochemistry& Biotechnology, 2019, 49(9):846-857.
[7] SHU G W, WANG Z, CHEN L, et al.Characterization of freeze-dried Lactobacillus acidophilus in goat milk powder and tablet:Optimization of the composite cryoprotectants and evaluation of storage stability at different temperature[J].LWT, 2018, 90(4):70-76.
[8] POLOMSKA X, WOJTATOWICZ M, ZAROWSKA B, et al.Freeze-drying preservation of yeast adjunct cultures for cheese production[J].Polish Journal of Food and Nutrition Sciences, 2012, 62(3):143-150.
[9] MORATA A, LOIRA I, ESCOTT C, et al.Applications of Metschnikowia pulcherrima in wine biotechnology[J].Fermentation, 2019, 5(3):63-71.
[10] COMITINI F, GOBBI M, DOMIZIO P, et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J].Food Microbiology, 2011, 28(5):873-882.
[11] CHEN K, ESCOTT C, LOIRA I, et al.Use of non-Saccharomyces yeasts and oenological tannin in red winemaking:Influence on colour, aroma and sensorial properties of young wines[J].Food Microbiology, 2018, 69(5):51-63.
[12] DUTRAIVE O, BENITO S, FRITSCH S, et al.Effect of sequential inoculation with non-Saccharomyces and Saccharomyces yeasts on Riesling wine chemical composition[J].Fermentation, 2019, 5(3):79.
[13] RUIZ J, BELDA I, BEISERT B, et al.Analytical impact of Metschnikowia pulcherrima in the volatile profile of Verdejo white wines[J].Applied Microbiology and Biotechnology, 2018, 102(19):8 501-8 509.
[14] 孙玉霞, 赵新节.美极梅奇酵母的代谢特性及其在葡萄酒生产中的应用前景[J].食品与发酵工业, 2021, 47(4):305-311.
SUN Y X, ZHAO X J.Metabolic characteristics of Metschnikowia pulcherrima and its application in wine production[J].Food and Fermentation Industries, 2021, 47(4):305-311.
[15] ESCRIBANO-VIANA R, GONZ LEZ-ARENZANA L, PORTU J, et al.Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non- Saccharomyces/Saccharomyces yeasts[J].Food Research International, 2018, 112:17-24.
LEZ-ARENZANA L, PORTU J, et al.Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non- Saccharomyces/Saccharomyces yeasts[J].Food Research International, 2018, 112:17-24.
[16] 郑慧纹, 闫茹, 徐琳琳, 等.东北酸菜发酵酵母菌冻干保护剂的优化研究[J].中国酿造, 2020, 39(3):136-140.
ZHENG H W, YAN R, XU L L, et al.Optimization of freeze-drying protective agent for yeast from fermented Northeast pickle[J].China Brewing, 2020, 39(3):136-140.
[17] JOFRÉ A, AYMERICH T, GARRIGA M.Impact of different cryoprotectants on the survival of freeze-dried Lactobacillus rhamnosus and Lactobacillus casei/paracasei during long-term storage[J].Beneficial Microbes, 2015, 6(3):381-386.
[18] THAKRAL S, SONJE J, MUNJAL B, et al.Stabilizers and their interaction with formulation components in frozen and freeze-dried protein formulations[J].Advanced Drug Delivery Reviews, 2021, 173(3):1-19.
[19] MAULVI F A, PARMAR R J, SHUKLA M R, et al.Plackett-Burman design for screening of critical variables and their effects on the optical transparency and swelling of gatifloxacin-Pluronic-loaded contact lens[J].International Journal of Pharmaceutics, 2019, 566(8):513-519.
[20] DU R P, WANG Y, ZHAO F K, et al.Production, optimization and partial characterization of bacterial cellulose from Gluconacetobacter xylinus TJU-D2[J].Waste and Biomass Valorization, 2020, 11(5):1 681-1 690.
[21] BELLALI S, BOU KHALIL J, FONTANINI A, et al.A new protectant medium preserving bacterial viability after freeze drying[J].Microbiological Research, 2020, 236:126454.
[22] SUN M J, NING X B.Screening and optimization of a nitrate reductase-producing Staphylococcus simulans UV-11 and its application[J].Journal of Food Measurement and Characterization, 2021, 15(3):2 458-2 468.
[23] TANG H W, ABBASILIASI S, MURUGAN P, et al.Influence of freeze-drying and spray-drying preservation methods on survivability rate of different types of protectants encapsulated Lactobacillus acidophilus FTDC 3081[J].Bioscience, Biotechnology, and Biochemistry, 2020, 84(9):1 913-1 920.
[24] CARVALHO A S, SILVA J, HO P, et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy Journal, 2004, 14(10):835-847.
[25] N’GUESSAN F K, COULIBALY H W, ALLOUE-BORAUD M W A, et al.Production of freeze-dried yeast culture for the brewing of traditional Sorghum beer, tchapalo[J].Food Science & Nutrition, 2016, 4(1):34-41.