酱油是我国传统的调味品,据智研咨询发布的《2021—2027年中国酱油行业发展现状及发展趋势预测报告》中报道,2020年中国酱油产量达700.8万t。酱油渣是酱油酿造过程中的副产物,每生产1 kg酱油产生含水约75%的酱油渣0.67 kg[1],即每年产生的酱油渣会超过469万t,而酱油渣中含有20%~30%的粗蛋白,23%左右的粗纤维,10%以上的碳水化合物等,若处理不当是资源的巨大浪费,也会对环境造成一定程度的污染。因此,对酱油渣的处理及利用是酱油工业发展中急需解决的问题之一。近年来,酱油渣的开发和应用较多,如用作动物饲料、制备生物絮凝剂、提取生物活性化合物等,也有通过接种特定微生物,再次发酵酱油渣,以有效降解原料中潜在有害物质,且转化大量基质为有用产品,进而改善酱油渣品质的研究[2]。
副干酪乳杆菌是乳杆菌属中的干酪乳杆菌群,广泛存在于发酵食品和人的口腔及肠道内,在食品、医疗保健领域发挥重要作用,特别是其作为商业发酵剂具有良好的发酵特性和研究价值[3]。如:POVEDA等[4]利用副干酪乳杆菌发酵奶酪,可促使奶酪中游离脂肪酸和醇类物质增加,风味有明显提升。也有研究认为,部分副干酪乳杆菌具有一定致病性,能引起败血症、心内膜炎和局部感染等疾病[5]。由此可见,若副干酪乳杆菌作为发酵剂使用于食品,则对其进行生物安全性评价与研究尤为必要。
本实验室前期从酱油渣中分离鉴定得到6株副干酪乳杆菌,这些菌株具有良好的生长及抗氧化特性[6-7],但尚不了解其生物安全性。因此,本研究拟通过药敏实验、质粒提取实验、吲哚实验、溶血实验、氨基酸脱羧酶实验等,对已分离得到的上述6株菌的体外生物安全性进行分析与评价,以充分挖掘利用酱油渣中的副干酪乳杆菌资源,以期为减少酱油渣资源浪费、再次应用于酱油渣发酵或饲料生产等提供科学依据。
1 材料与方法
1.1 材料与试剂
试验菌株:副干酪乳杆菌HT31、HT90、HT111、HT155、HT159、HT197,均为本实验室前期从酱油渣中分离得到。标准菌株:金黄色葡萄球菌(Staphylococcus aureus) ATCC 25923,南京茂捷微生物科技有限公司,大肠杆菌(Escherichia coli) ATCC 25922,上海鲁傲科技有限公司。
质粒小提试剂盒,天根生化科技有限公司;哥伦比亚血平板、氨基酸脱羧酶对照生化鉴定管、精氨酸脱羧酶、赖氨酸脱羧酶生化管、鸟氨酸脱羧酶生化管、靛基质试剂,广东环凯微生物科技有限公司;药敏纸片(青霉素、头孢唑林、环丙沙星、红霉素、庆大霉素、复方新诺明、氯霉素),杭州微生物试剂有限公司。
1.2 仪器与设备
ME104电子分析天平,梅特勒-托利多精密仪器公司;ALLEGRA-64R台式高速冷冻离心机,美国贝克曼库尔特有限公司;721BR 16103凝胶成像系统,美国 Bio-Rad 公司;GR60DA全自动灭菌锅,致微(厦门)仪器有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;LRH-150恒温培养箱,上海一恒科学仪器有限公司;DYY-7C凝胶电泳仪,北京六一生物科技有限公司;428830数显式游标卡尺,宁波长城精工实业有限公司。
1.3 实验方法
1.3.1 副干酪乳杆菌菌液的制备
将6株副干酪乳杆菌接种于预先配制好并灭菌的MRS液体培养基中,37 ℃恒温培养24 h,活化3代后待用。
1.3.2 药敏试验
根据文献[8]和[9]的方法并进行适当修改。使用药敏纸片琼脂扩散法进行药敏实验。使用的药敏纸片种类为青霉素、头孢唑林、环丙沙星、红霉素、庆大霉素、复方新诺明、氯霉素,共计7种。将活化至3代的副干酪乳杆菌用无菌生理盐水稀释,涂布于MRS培养基,静置5 min后将相应的药敏纸片贴在培养基上,每个培养基贴2种药敏纸片,每种药敏纸片设3组平行,并以S. aureus ATCC 25923作为质控菌株。用游标卡尺测量各药敏纸片的抑菌圈直径,根据《抗微生物药物敏感性试验执行标准》评价菌株对抗生素的敏感度(表1)。
表1 药敏实验判断标准[10]
Table 1 Criteria for drug sensitivity test
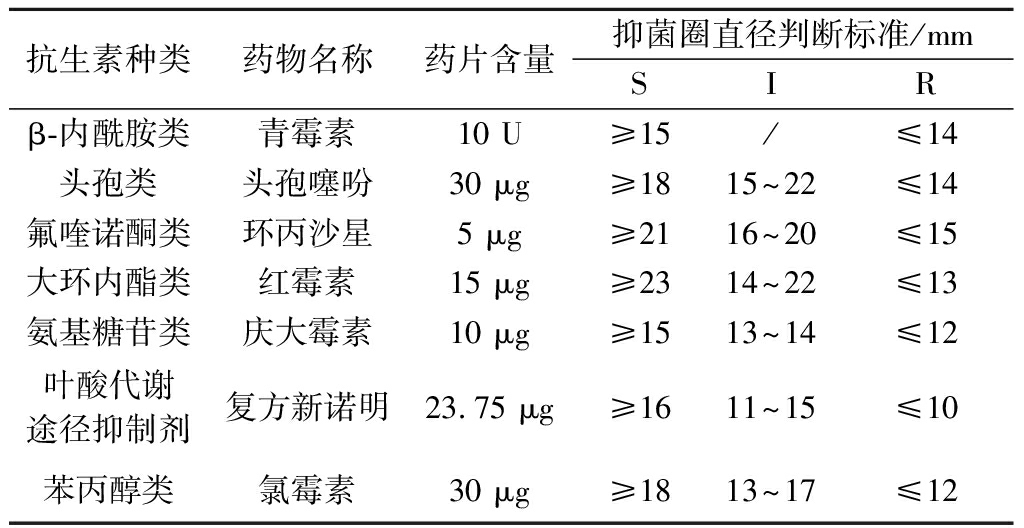
抗生素种类药物名称药片含量抑菌圈直径判断标准/mmSIRβ-内酰胺类青霉素10 U≥15/≤14头孢类头孢噻吩30 μg≥1815~22≤14氟喹诺酮类环丙沙星5 μg≥2116~20≤15大环内酯类红霉素15 μg≥2314~22≤13氨基糖苷类庆大霉素10 μg≥1513~14≤12叶酸代谢途径抑制剂复方新诺明23.75 μg≥1611~15≤10苯丙醇类氯霉素30 μg≥1813~17≤12
注:S-敏感;I-中度敏感;R-耐药
1.3.3 质粒提取实验
根据文献[11]的方法并进行适当修改。取2 mL活化3代后的副干酪乳杆菌菌液,使用质粒小提试剂盒提取质粒。吸取2.5 μL的质粒提取液加入0.5 μL 6×Loading Buffer,吹打均匀,吸取混合物3 μL点样于1%琼脂糖凝胶孔道中进行电泳实验。电泳结束后,用凝胶成像系统对琼脂糖凝胶进行观察和分析,以含有pET28a的质粒作为阳性对照。
1.3.4 溶血实验
根据文献[12]和[13]的方法并进行适当修改。在无菌条件下,将活化3代后的副干酪乳杆菌菌液用灭菌的接种环划线于哥伦比亚血琼脂平板中,培养后观察有无溶血圈出现,同时用S. aureus ATCC 25923作为阳性对照菌株。若菌落周围的琼脂为棕绿色,为α-溶血;若在菌落周围形成透明圈,为β-溶血;若对溶血无作用,为γ-溶血。
1.3.5 吲哚实验
参考文献[11]方法进行。将活化3代后的副干酪乳杆菌接种于蛋白胨水培养基中,37 ℃培养24 h,向培养基中滴加5~8滴靛基质试剂并轻摇试管,观察液面颜色变化。若液面呈现红色,则为阳性,否则为阴性。以E. coli ATCC 25922为阳性对照菌株,未接种的蛋白胨水培养基为空白对照。
1.3.6 氨基酸脱羧酶实验
参考文献[11]方法进行。将活化3代后的副干酪乳杆菌接种于精氨酸、赖氨酸、鸟氨酸脱羧酶实验管和氨基酸脱羧酶对照管中,滴加无菌液体石蜡封口,于37 ℃培养24 h后观察管内颜色。若赖氨酸、鸟氨酸脱羧酶实验管与对照管均呈黄色则为阴性,实验管呈黄绿色且对照管呈黄色则为阳性;若精氨酸脱羧酶实验管与对照管均呈黄色则为阴性,实验管变蓝绿色且对照管变黄为阳性。以E. coli ATCC 25922为阳性对照菌株。
1.4 数据处理
使用SPSS 25.0中一般线性模型的单变量分析,对数据进行统计处理和差异显著性分析,数据的表示方式为:平均值±标准偏差(x±SD;n=3)。
2 结果与分析
2.1 耐药性检测与分析
2.1.1 药敏实验结果与分析
抗生素耐药性检测是乳酸菌安全性评价较为重要的部分。有部分学者认为,乳酸菌具有一定的耐药性会产生积极的影响,表现在当人或动物使用抗生素治疗时可以避免菌体自身被杀灭,同时可帮助宿主恢复肠道菌群平衡[14]。但当乳酸菌具有潜在致病性时,一旦成为致病原,它们所具有的耐药性则会给治疗带来麻烦,这也是微生物抗生素耐药性成为全球化问题的原因之一。
药敏实验的抑菌圈直径及结果如表2所示。根据药敏试验判断标准可知,对照菌株金黄色葡萄球菌对7种抗生素敏感;6株副干酪乳杆菌对青霉素、头孢噻吩、红霉素、氯霉素敏感,对庆大霉素、复方新诺明不敏感;HT111对环丙沙星敏感,其他菌株对环丙沙星中度敏感。董春阳[9]进行的3株副干酪乳杆菌药敏实验显示,所有菌均对青霉素、头孢噻吩、氯霉素、红霉素敏感,对庆大霉素不敏感,综合两项研究,一致的结果是,副干酪乳杆菌对青霉素、头孢噻吩、红霉素、氯霉素敏感,对庆大霉素不敏感,原因可能是青霉素、头孢噻吩可以抑制副干酪乳杆菌细胞壁合成酶的产生,进而破坏细胞壁,引起溶菌,使细菌裂解死亡[15];氯霉素、红霉素则可通过终止50S亚基与肽酰基-tRNA的结合来阻断肽链的延伸,从而抑制细菌内蛋白质的合成[16];大多数乳杆菌普遍对氨基糖苷类抗生素(如庆大霉素)不敏感,可能是因为副干酪乳杆菌可以产生某种酶使抗生素分子灭活或钝化从而抗药,或副干酪乳杆菌能够增加抗生素外排转运体数量和改变细胞膜通透性[17]。
6株副干酪乳杆菌对同一种抗生素敏感性有所差异,如表2所示。6株副干酪乳杆菌对青霉素、头孢噻吩、环丙沙星、庆大霉素、氯霉素的耐药性均呈显著差异(P<0.05),对红霉素、复方新诺明的耐药性则无显著差异(P>0.05)。青霉素对HT31的抑制效果最强,对HT155、HT197的抑制效果最弱,且青霉素对金黄色葡萄球菌的抑制效果与HT155、HT197呈显著性差异(P<0.05);头孢噻吩对HT31的抑制效果最强,对HT155、HT159的抑制效果次之,对HT90、HT111、HT197的抑制效果最弱,且头孢噻吩对金黄色葡萄球菌的抑制效果与HT90、HT111、HT197呈显著性差异(P<0.05);环丙沙星对HT111的抑制效果最强,对HT159的抑制效果次之,对HT31、HT90、HT155、HT197的抑制效果最弱,且环丙沙星对金黄色葡萄球菌的抑制效果与6株菌均呈显著性差异(P<0.05);庆大霉素对HT90的抑制效果最强,对HT31、HT159、HT197的抑制效果次之,对HT111、HT155的抑制效果最弱,且庆大霉素对金黄色葡萄球菌的抑制效果与6株菌均呈显著性差异(P<0.05);氯霉素对HT90、HT111、HT155、HT159、HT197的抑制效果最强,对HT31的抑制效果最弱,且氯霉素对金黄色葡萄球菌的抑制效果与HT31无显著性差异(P>0.05)。
表2 药敏实验判断结果及不同菌株同一抗生素的耐药性分析
Table 2 Results of drug sensitivity test and analysis of drug resistance of different strains to the same antibiotic

菌株编号抑菌圈直径/mm青霉素头孢噻吩环丙沙星红霉素庆大霉素复方新诺明氯霉素HT3129.37±2.18a(S)29.76±1.78a(S)18.38±0.78c(I)31.67±0.43a(S)8.11±0.43bc(R)6.37±0.03b(R)19.79±1.24b(S)HT9025.19±1.21bcd(S)23.63±1.74c(S)18.43±1.91c(I)31.79±0.19a(S)9.41±0.87b(R)6.35±0.00b(R)24.06±0.73a(S)HT11127.65±1.42ab(S)25.89±0.88c(S)22.20±0.54b(S)28.36±2.03a(S)7.13±1.35c(R)6.35±0.00b(R)24.06±0.96a(S)HT15523.88±1.93d(S)26.64±1.07bc(S)18.43±1.25c(I)30.38±1.51a(S)6.35±0.00c(R)6.35±0.00b(R)25.06±1.62a(S)HT15924.66±0.82cd(S)26.32±2.41bc(S)19.46±1.51bc(I)30.14±2.40a(S)7.89±0.74bc(R)6.35±0.00b(R)24.30±2.01a(S)HT19724.08±0.72d(S)25.18±1.58c(S)18.00±0.40c(I)31.69±1.38a(S)8.13±2.27bc(R)6.35±0.00b(R)25.43±0.97a(S)S.aurens27.25±1.23abc(S)29.13±0.65ab(S)26.69±2.20a(S)24.88±2.55b(S)20.91±0.22a(S)30.84±1.99a(S)21.55±0.55b(S)
注:括号内字母为耐药性判断结果,S-敏感;I-中度敏感;R-耐药;药敏纸片直径为6.35 mm
7种抗生素对同一菌株的敏感性亦有不同(表3)。红霉素对6株菌的抑制效果最强,庆大霉素、复方新诺明对6株菌的抑制效果最弱。此外,青霉素、头孢噻吩、红霉素对HT31和青霉素、红霉素对HT111的抑制效果无显著差异(P>0.05),说明青霉素、头孢噻吩、红霉素对HT31和青霉素、红霉素对HT111的抑制效果均为最强的,原因可能是青霉素、头孢噻吩、红霉素影响了HT31、HT111内蛋白类物质的合成[15]。复方新诺明、头孢噻吩对对照菌株的抑制效果最强,氯霉素、庆大霉素对对照菌株的抑制效果最弱。
表3 不同抗生素同一菌株的耐药性分析
Table 3 Analysis of drug resistance of the same strain with different antibiotics
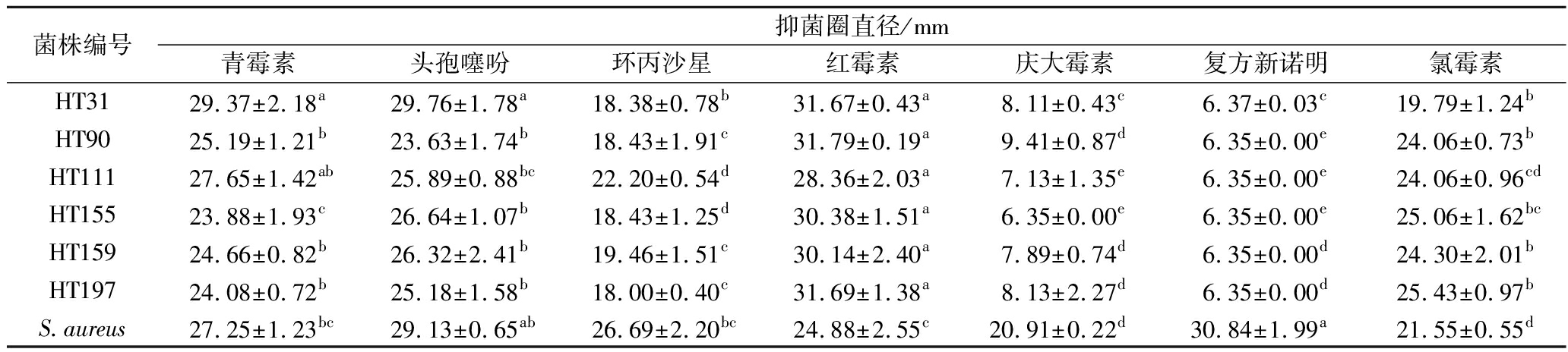
菌株编号抑菌圈直径/mm青霉素头孢噻吩环丙沙星红霉素庆大霉素复方新诺明氯霉素HT3129.37±2.18a29.76±1.78a18.38±0.78b31.67±0.43a8.11±0.43c6.37±0.03c19.79±1.24bHT9025.19±1.21b23.63±1.74b18.43±1.91c31.79±0.19a9.41±0.87d6.35±0.00e24.06±0.73bHT11127.65±1.42ab25.89±0.88bc22.20±0.54d28.36±2.03a7.13±1.35e6.35±0.00e24.06±0.96cdHT15523.88±1.93c26.64±1.07b18.43±1.25d30.38±1.51a6.35±0.00e6.35±0.00e25.06±1.62bcHT15924.66±0.82b26.32±2.41b19.46±1.51c30.14±2.40a7.89±0.74d6.35±0.00d24.30±2.01bHT19724.08±0.72b25.18±1.58b18.00±0.40c31.69±1.38a8.13±2.27d6.35±0.00d25.43±0.97bS.aureus27.25±1.23bc29.13±0.65ab26.69±2.20bc24.88±2.55c20.91±0.22d30.84±1.99a21.55±0.55d
2.1.2 质粒提取实验结果与分析
耐药基因通常由质粒等可移动的遗传元件携带,它们可以不受种属间障碍的影响进行自由交换,从而导致耐药基因水平转移。研究表明,体外培养条件下耐药基因可以在不同种属的乳酸菌菌株中发生转移,当外源性乳酸菌作用于肠道时,其耐药基因能以各种方式在肠道菌群间相互传递,进而使致病菌获得耐药性,危害宿主健康。此外,若乳酸菌的耐药基因存在于可转移的质粒上,会使乳酸菌的耐药基因转移到人体基因组,通过基因表达对人体造成潜在危害[18]。
琼脂糖凝胶电泳实验结果见图1,对照组所在泳道出现荧光条带(泳道2),而6株副干酪乳杆菌的泳道上均无条带出现(泳道3~8),表明这6株菌均没有携带耐药基因的质粒存在,故可初步判断这6株菌是安全菌株。该结果与田原等[19]的副干酪乳杆菌质粒提取实验结果一致。

1-15 K DNA Marker;2-阳性对照;3~8-副干酪乳杆菌 HT31、HT90、HT111、HT155、HT159、HT197
图1 质粒提取电泳图
Fig.1 Plasmid extraction electrophoresis
2.2 有害代谢产物评价
2.2.1 吲哚实验结果与分析
吲哚实验可检测菌株能否产生色氨酸酶,其分解色氨酸后能生成吲哚。色氨酸是人体必需氨基酸,其代谢失调会影响色氨酸的吸收,甚至影响免疫及消化功能,引起神经系统功能障碍等。
吲哚实验结果见表4。6株副干酪乳杆菌的吲哚实验结果均为阴性,而对照菌株大肠杆菌的结果为阳性,说明6株副干酪乳杆菌不能产生色氨酸酶,不会引起吲哚类物质的产生。这与王英等[20]的副干酪乳杆菌的吲哚实验结果一致。
2.2.2 溶血实验结果与分析
溶血是指细菌分泌的溶血素使细胞溶解的现象,与菌株自身致病性相关。许多革兰氏阳性菌和阴性菌都能产生溶血素,作用于细胞膜后造成其结构和功能紊乱,使细胞内成分泄露,从而导致细胞死亡。根据溶血情况可分为3类:α-溶血,是指血平板菌落周围呈现棕绿色,这类菌通常为条件致病菌;β-溶血,是指菌落周围出现无色透明圈,这类菌通常具有强致病性,如金黄色葡萄球菌;γ-溶血,是指菌落周围显示正常血平板颜色,这类菌通常没有致病性[21]。
溶血实验结果见图2和表4。6株副干酪乳杆菌均有溶血性,其中表现为轻微溶血的菌株有2株,分别是HT31和HT111。副干酪乳杆菌HT197为无色透明圈的β-溶血,被摄入人体后可能有产生败血症的风险,因此,不能作为发酵菌株。乳酸菌出现β-溶血的情况较少,此前IBRAHIM等[22]在埃及发酵乳制品中分离的乳酸菌中也发现了1株乳酸菌为β-溶血。副干酪乳杆菌HT31、HT90、HT111、HT155、HT159均为呈棕绿色溶血圈的α-溶血,乳酸菌产生α-溶血的情况比较常见,BIN等[23]从多个发酵乳及牛乳中分离的乳酸菌中有30%的菌株出现了α-溶血,MARAGKOUDAKIS等[24]对干酪乳杆菌和副干酪乳杆菌的溶血实验研究发现小部分菌株会出现α-溶血现象,因其没有出现致病性高的β-溶血,故上述研究者认为这类菌株是相对安全的。由此可以得出,本实验中出现α-溶血的HT31、HT90、HT111、HT155、HT159均相对安全。
表4 实验菌与对照菌的有害代谢产物评价结果
Table 4 Evaluation results of harmful metabolites of experimental and control bacteria

菌株编号吲哚实验溶血性氨基酸脱羧酶溶血程度溶血圈颜色鸟氨酸脱羧酶赖氨酸脱羧酶精氨酸脱羧酶HT31-+棕绿色---HT90-++棕绿色---HT111-+棕绿色---HT155-++棕绿色---HT159-++棕绿色---HT197-++无色---S.aureus ATCC 25923/++无色///E.coli ATCC 25922+//+++
注:--阴性;+-阳性,+的数量表示程度;/-没有进行该实验

a-HT31;b-HT197;c-S.aureus ATCC 25923
图2 溶血实验结果图
Fig.2 The results of hemolysis test
2.2.3 氨基酸脱羧酶实验结果与分析
氨基酸脱羧酶实验可以检测菌株分解氨基酸生成生物胺的能力。精氨酸、赖氨酸和鸟氨酸经过氨基酸脱羧酶作用后分别形成精胺、尸胺和腐胺,过多的生物胺类物质积累会引起许多副作用,如呕吐、恶心、发烧等症状[13]。此外,各生物胺之间还可以通过抑制某些生物胺相关代谢酶的活性,使生物胺数量增加,进而增强人体的不适症状。
氨基酸脱羧酶实验结果见表4。6株副干酪乳杆菌的精氨酸、赖氨酸、鸟氨酸脱羧酶实验均呈阴性,对照菌株大肠杆菌呈阳性,说明这6株菌不产生氨基酸脱羧酶,对人体无害。此结果与徐传标等[25]的干酪乳杆菌的氨基酸脱羧酶实验结果一致。
3 结论与讨论
本研究通过药敏试验、质粒提取实验、溶血实验、吲哚实验和氨基酸脱羧酶实验,从耐药性检测和有害代谢产物研究两个方面对酱油渣中分离的6株副干酪乳杆菌体外安全性进行评价。
对菌株抗生素耐药性的测定,是对现有的和潜在的益生菌菌株体外安全性评估的重要内容之一。本研究采用纸片扩散法探究了6株副干酪乳杆菌对青霉素、头孢噻吩、环丙沙星、红霉素、庆大霉素、复方新诺明、氯霉素的敏感情况,结果表明,6株菌均对庆大霉素、复方新诺明表现为耐药,HT31、HT90、HT155、HT159、HT197对青霉素、头孢噻吩、红霉素、氯霉素敏感,对环丙沙星中度耐药,HT111对青霉素、头孢噻吩、红霉素、氯霉素、环丙沙星敏感,原因可能是副干酪乳杆菌对抑制细胞壁合成酶和蛋白质合成的药物较为敏感[15-16]。抗生素耐药基因可通过质粒在食品和肠道环境中发生转移,通过质粒提取实验探究6株副干酪乳杆菌是否有携带耐药基因的质粒存在,结果表明,6株菌均不存在携带耐药基因的质粒,与之前多篇文献研究结果一致[19-20]。综上,6株副干酪乳杆菌对2种抗生素表现为抗性(庆大霉素、复方新诺明),其中HT31、HT90、HT155、HT159、HT197对4种抗生素敏感(青霉素、头孢噻吩、红霉素、氯霉素),对1种抗生素中度耐药(环丙沙星),HT111对5种抗生素敏感(青霉素、头孢噻吩、红霉素、氯霉素、环丙沙星),且均不携带耐药质粒。
菌株的安全性研究还需对其毒性代谢产物的产生予以重视。本研究通过吲哚实验、氨基酸脱羧酶实验、溶血实验探究了6株副干酪乳杆菌毒性代谢产物的生成情况,结果表明,6株副干酪乳杆菌均不产生色氨酸酶和氨基酸脱羧酶,不会产生吲哚、精胺、尸胺和腐胺等有害物质,与之前副干酪乳杆菌相关有毒代谢产物研究的结果一致[20,25],HT197出现β-溶血现象,此前也有研究发现从发酵食品中分离的乳酸菌会产生β-溶血[22],产生这种溶血现象的菌株安全性较低,有引起败血症等疾病的风险[5],其他5株菌均未出现β-溶血现象。综上,6株副干酪乳杆菌在耐药性检测、产有害代谢物吲哚、精胺、尸胺和腐胺方面相对安全,在溶血方面,HT197为β-溶血,而其余5株菌没有出现β-溶血,因此认为这5株菌具有良好的安全性。
当前,解决酱油渣资源浪费问题的研究主要集中在提取其中附加值较高的物质或用作动物饲料方面,对酱油渣中微生物的开发利用尚不足。酱油渣是酱油发酵的副产物,微生物种类丰富,从中筛选出性能良好并安全的菌株用作发酵剂能很大程度改善酱油渣的品质和安全性,从而减轻资源浪费问题。本研究对从酱油渣中分离得到的6株副干酪乳杆菌的体外安全性进行评价,最终得出HT31、HT90、HT111、HT155、HT159的安全性较高,为实际应用提供了理论基础。在后续实验中将进一步通过毒力基因、动物实验对其安全性进行探究,为其作为发酵剂用于酱油渣等发酵食品中的应用安全性提供更加科学全面的理论依据。
[1] DUAN Y Q, ZHOU A J, WEN K L, et al.Upgrading VFAs bioproduction from waste activated sludge via co-fermentation with soy sauce residue[J].Frontiers of Environmental Science & Engineering, 2018, 13(1):1-10.
[2] 王红涛. 地衣芽孢杆菌和乳酸菌用于发酵酱渣的研究[D].广州:华南理工大学, 2012.
WANG H T.The lactic acid bacteria and Bacillus licheniformis are used to ferment soy sauce residue[D].Guangzhou:South China University of Technology, 2012.
[3] KUMAR M, GHOSH M, GANGULI A.Mitogenic response and probiotic characteristics of lactic acid bacteria isolated from indigenously pickled vegetables and fermented beverages[J].World Journal of Microbiology & Biotechnology, 2012, 28(2):703-711.
[4] POVEDA J M, NIETO-ARRIBAS P, SESE A S, et al.Volatile composition and improvement of the aroma of industrial Manchego cheese by using Lactobacillus paracasei subsp.paracasei as adjunct and other autochthonous strains as starters[J].European Food Research and Technology, 2014,238(3):485-494.
A S, et al.Volatile composition and improvement of the aroma of industrial Manchego cheese by using Lactobacillus paracasei subsp.paracasei as adjunct and other autochthonous strains as starters[J].European Food Research and Technology, 2014,238(3):485-494.
[5] FRANKO B, VAILLANT M, RECULE C, et al.Lactobacillus paracasei endocarditis in a consumer of probiotics[J].Medecine et Maladies Infectieuses, 2013, 43(4):171-173.
[6] 唐素婷, 区锡敏, 黄桂东, 等.酱油渣中副干酪乳杆菌的分离鉴定及抗氧化特性研究[J].食品与机械, 2019, 35(10):11-17;23.
TANG S T, OU X M, HUANG G D, et al.Isolation, identification and antioxidant properties of Lactobacillus paracasei from soy sauce residue[J].Food & Machinery, 2019, 35(10):11-17;23.
[7] 唐素婷, 区锡敏, 孙张乐, 等.酱油渣中乳酸菌的分离鉴定及其生长特性研究[J].食品研究与开发, 2019, 40(20):195-200.
TANG S T, OU X M, SUN Z L, et al.Isolation, identification and growth characteristics of lactic acid bacteria from soy sauce residue[J].Food Research and Development, 2019, 40(20):195-200.
[8] PISANO M B, VIALE S, CONTI S, et al.Preliminary evaluation of probiotic properties of Lactobacillus strains isolated from Sardinian dairy products[J].BioMed Research International, 2014, 2014:286390.
[9] 董春阳. 广州市售酸奶中乳酸菌的药物敏感性分析[D].广州:华南理工大学, 2013.
DONG C Y.Antimicrobial susceptibility testing of lactic acid bacteria isolated from yoghurts in Guangzhou[D].Guangzhou:South China University of Technology, 2013.
[10] Performance Standards for Antimicrobioal Susceptibility Testing;Twentieth Informational Supplement[M].Wayne:Clinical and Laboratory Standards Institute.2010.
[11] 区锡敏, 王阿利, 孙张乐, 等.酱醪源肠球菌的特性研究与安全性评价[J].食品与发酵工业, 2020, 46(9):83-88.
OU X M, WANG A L, SUN Z L, et al.Characteristic and safety assessment of Enterococcus sp.from soy sauce mash[J].Food and Fermentation Industries, 2020, 46(9):83-88.
[12] 王梦姣. 内蒙古牧区马奶及其制品中肠球菌属乳酸菌安全性评价[D].呼和浩特:内蒙古农业大学, 2014.
WANG M J.Safety evaluation of lactic acid bacteria isolated from mare’s milk and its products in pastoral areas of Inner Mongolia[D].Hohhot:Inner Mongolia Agricultural University, 2014.
[13] CARIOLATO D, ANDRIGHETTO C, LOMBARDI A.Occurrence of virulence factors and antibiotic resistances in Enterococcus faecalis and Enterococcus faecium collected from dairy and human samples in North Italy[J].Food Control, 2008, 19(9):886-892.
[14] HEMPEL S, NEWBERRY S J, MAHER A R, et al.Probiotics for the prevention and treatment of antibiotic-associated diarrhea:A systematic review and meta-analysis[J].JAMA, 2012, 307(18):1 959-1 969.
[15] LI L Z, GE H J, GU D, et al.The role of two-component regulatory system in β-lactam antibiotics resistance[J].Microbiological Research, 2018,215:126-129.
[16] KATZ L, ASHLEY G W.Translation and protein synthesis: Macrolides[J].Chemical Reviews, 2005,105(2):499-528.
[17] 张一爽. 副干酪乳杆菌抗生素耐药性分析及蛋白酶活性评价[D].哈尔滨:哈尔滨工业大学, 2020.
ZHANG Y S.Evaluation of antibiotic resistance and proteolytic ability of Lactobacillus paracasei strains[D].Harbin:Harbin Institute of Technology, 2020.
[18] CLEMENTI F, AQUILANTI L.Recent investigations and updated criteria for the assessment of antibiotic resistance in food lactic acid bacteria[J].Anaerobe, 2011,17(6):394-398.
[19] 田原, 季子非, 郭浩南, 等.副干酪乳杆菌L1的安全性及益生性评价[J].食品工业科技, 2019,40(12):120-127.
TIAN Y, JI Z F, GUO H N, et al.Safety and probiotic evaluation of Lactobacillus paracasei L1[J].Science and Technology of Food Industry, 2019,40(12):120-127.
[20] 王英, 范琳琳, 施亚萍, 等.具有抗氧化功能的副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M9-1的安全性初步评价[J].中国乳品工业, 2019, 47(11):4-7;13.
WANG Y, FAN L L, SHI Y P, et al.Safety assessment of Lactobacillus paracasei FM-LP-4 and Lactobacillus casei FM-M9-1 with high anti-oxidative activity[J].China Dairy Industry, 2019, 47(11):4-7;13.
[21] DOMINGOS-LOPES M F P, STANTON C, ROSS P R, et al.Genetic diversity, safety and technological characterization of lactic acid bacteria isolated from artisanal Pico cheese[J].Food Microbiology, 2017, 63:178-190.
[22] IBRAHIM A, KAMAL N M, AWED S, et al.Pre-identification of lactic acid bacteria isolated during fermentation process of Egyptian Kishk[J].Alexandria Science Exchange Journal:An International Quarterly Journal of Science Agricultural Environments, 2015,36:104-121.
[23] BIN MASALAM M S, BAHIELDIN A, ALHARBI M G, et al.Isolation, molecular characterization and probiotic potential of lactic acid bacteria in Saudi raw and fermented milk[J].Evidence-Based Complementary and Alternative Medicine, 2018, 2018:7970463.
[24] MARAGKOUDAKIS P A, ZOUMPOPOULOU G, MIARIS C, et al.Probiotic potential of Lactobacillus strains isolated from dairy products[J].International Dairy Journal, 2006,16(3):189-199.
[25] 徐传标, 霍冬雪, 胡淇淞, 等.海南发酵食品鱼茶中乳杆菌发酵特性的研究[J].食品工业科技, 2017,38(7):117-120.
XU C B, HUO D X, HU Q S, et al.Fermentation characteristics of Lactobacillus isolated in Hainan fermented food Yucha[J].Science and Technology of Food Industry, 2017,38(7):117-120.