细菌胞外多糖(exopolysaccharides, EPS)是由细菌在发酵中产生的胞外多糖,可以低成本大量生产。大多数细菌EPS是高分子质量多糖,通常由多个重复的糖单元组成,这些多糖在食品工业中广泛用作悬浮剂,增稠剂和稳定剂等[1]。EPS是生物膜的重要组成部分,具有多样化的结构特征和生物活性,因此受到了广泛的关注[2-3]。目前,在许多种革兰氏阳性和革兰氏阴性的细菌中都发现了EPS的产生[4]。
芽孢杆菌是一个重要的细菌属,具有耐酸、耐碱、耐高温高压和贮存时间长等特点[5]。目前,有关EPS应用的芽孢杆菌包括解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、巨大芽孢杆菌(Bacillus megaterium)、地衣芽孢杆菌(Bacillus licheniformis)和枯草芽孢杆菌(Bacillus subtilis)等。此外,苏云金芽孢杆菌(Bacillus thuringiensis)产生的伴胞晶体蛋白可以有效杀死多种害虫,但对人、畜类、禽类和水生动物无毒,因此广泛应用于生物农药的开发[6]。然而,对B.thuringiensis产的EPS研究却很少。
大分子的多糖在胃和小肠中不易消化,但可被肠道微生物部分或完全水解[7]。多糖能滋养和调节多种肠道微生物种群,诱导其多样性和丰度的变化[8]。研究表明,肠道微生物对人类健康起着重要作用,包括维持肠道屏障的完整性、调节宿主免疫力、抑制肠道病原体和促进维生素的合成[9]。因此,保持肠道微生物的多样性和保护微生态平衡对调节宿主健康至关重要。肠道微生物可以将多糖发酵形成短链脂肪酸(short chain fatty acids, SCFAs),主要成分是乙酸、丙酸和丁酸,它们在代谢方面具有重要的作用[10]。乙酸是结肠上皮细胞的能量来源,并能调节免疫细胞的活性[11]。丙酸在肝脏中的脂肪酸代谢和增强胰岛素敏感性方面具有关键作用[12]。而丁酸可以通过调节蛋白质来改善肠道屏障功能的完整性[13]。
本文介绍了从郫县豆瓣中分离出的B.thuringiensis IX-01采用高密度发酵法生产EPS,对提纯后的BPS-2进行体外细胞毒性分析,在确认其无细胞毒性的基础上通过10个健康人混合粪便微生物的体外静态发酵探究了其EPS的益生功能。
1 材料与方法
1.1 实验材料
菌种:从中国成都市郫都区市售豆瓣中分离出1株富含EPS的菌株,通过生理生化和16S rRNA分析,鉴定为B.thuringiensis被命名为IX-01,菌株已保藏于中国典型培养物保藏中心(CCTCC M 2020486),16S rRNA基因序列被保存在GenBank(NCBI)中,登录号为OL687443。
人正常结肠上皮细胞(HcoEpiC)从中国科学院上海分院获得。
单糖标准品,Sigma公司;DEAE-Sepharose Fast Flow,索莱宝科技有限公司;Superdex 200,GE Healthcare公司;DMEM培养基,海克隆生物化学制品有限公司;其他试剂均为国产分析纯。
B.thuringiensis IX-01的种子培养基(g/L):葡萄糖 1.0,胰蛋白胨 1.0,K2HPO4 0.025,KH2PO4 0.05,NaCl 0.5,pH 6.5。
B.thuringiensis IX-01的发酵培养基(g/L):葡萄糖 111.24,大豆蛋白胨 9.64,BaSO4 0.24,K2HPO4 0.025,KH2PO4 0.05,NaCl 0.5。
肠道厌氧基础营养培养基(g/L):蛋白胨 2.0,酵母提取物 2.0,NaHCO3 2.0,NaCl 0.1,KH2PO4 0.04,K2HPO4 0.04,L-半胱氨酸盐酸盐 0.5,牛胆盐 0.5,CaCl2 0.01,MgSO4 0.01,血红素 0.025,刃天青0.001,维生素K 0.002,吐温80 2。
1.2 仪器与设备
Bio Flo 115发酵罐,美国New Brunswick Scientific公司;HYQX-Ⅱ厌氧培养箱,上海跃进医疗器械有限公司;Waters 600高效液相色谱仪,美国Waters公司;ICS5000离子色谱仪,美国戴安公司;7890A气相色谱仪,美国Agilent公司;IX53倒置生物显微镜,日本奥林巴斯公司。
1.3 实验方法
1.3.1 EPS的生产
将IX-01的单个菌落接种到含有100 mL种子培养基的500 mL锥形瓶中,在200 r/min和37 ℃下培养12 h,种子培养物接种于7-L发酵罐中。初始发酵培养基体积为4 L,种子接种量为10%(体积分数)。在发酵过程中,温度保持在30 ℃,通过添加2.0 mol/L氨水使pH值保持在6.5。发酵开始前加入111.24 g葡萄糖,在发酵后的3 h内不添加葡萄糖。通过生物传感分析仪监测葡萄糖浓度,并调整相应的葡萄糖进料速度。整个发酵过程共分为3个阶段:0~18 h,搅拌速度250 r/min,通气量为3 L/min;18~56 h,搅拌速度300 r/min,通气量为4 L/min;56~72 h,搅拌速度350 r/min,通气量为5 L/min。
1.3.2 EPS的提取
将发酵液11 000 × g离心20 min,取上清液。先加入5 g/L胰蛋白酶和5 g/L胃蛋白酶在37 ℃下100 r/min反应4 h,再加入5 g/L木瓜蛋白酶在 60 ℃下100 r/min反应2 h。后加入Savage试剂[V(氯仿)∶V(正丁醇) = 4∶1]以体积比3∶1 混匀振荡20 min,以5 000 r/min离心10 min收集上清液,将上清液用此方法重复8次,得到去除蛋白质的上清液。再把上清液与4倍体积的无水乙醇混合,在4 ℃下放置24 h。收集沉淀并溶解在去离子水中,得到粗EPS溶液,在去离子水中透析72 h,冻干。将粗制的EPS(0.5 g)重新溶解在5 mL的去离子水中,注入DEAE-Sepharose快速流动柱(1.6 cm × 50 cm),用去离子水洗脱,然后用NaCl溶液(0.1~1 mol/L)进行洗脱,流速为60 mL/h,收集馏分通过蒽酮-硫酸法测量糖含量。最后,将主要的碳水化合物组分通过Superdex 200柱(3.5 cm×100 cm)纯化,使用去离子水进行洗脱,流速为20 mL/h,得到一种EPS,命名为BPS-2。
1.3.3 BPS-2组成分析
用蒽酮-硫酸法和Bradford法分别测定了BPS-2的总糖和总蛋白含量[14-15]。采用高效凝胶渗透色谱法进行测量多糖的分子质量,通过Waters 600高效液相色谱仪,该仪器配有2410示差折光检测器和Empower 工作站,Ultrahydrogel Linear(300 mm×7.8 mm)凝胶柱,柱温保持在45.0 ℃,流速维持在0.95 mL/min,使用0.1 mol/L NaNO3作为流动相,样品制备为3 mg/mL的溶液。单糖组成测定的具体方法为:取5 mg BPS-2在安培瓶中加入300 μL的三氟乙酸(2 mol/L)在110 ℃中水解10 h。然后,通过氮气除去三氟乙酸,将残余物用甲醇溶解,通过氮气干燥,重复以上操作3次。最后,将残留物溶解在去离子水中,并使用0.22 μm膜过滤后进行分析。通过CarboPac PA20色谱柱在Dionex离子色谱系统(ICS 5000)中检测水解产物和1 g/L单糖标准品(葡萄糖,半乳糖,氨基葡萄糖,岩藻糖,果糖,木糖,甘露糖,鼠李糖和阿拉伯糖)的保留时间和峰面积,最终获得BPS-2的单糖组成及其含量。
1.3.4 细胞毒性分析
HcoEpiC细胞维持在DMEM培养基中,在孵化器中补充10%(体积分数)胎牛血清(fetal bovine serum,FBS),青霉素(100 μg/mL)和链霉素(100 μg/mL),并在37 ℃下,5%CO2的潮湿环境中孵育。通过四唑盐(MTT)法体外评估BPS-2对HcoEpiC细胞的毒性。HcoEpiC细胞经过0.25%(质量分数)胰蛋白酶消化后调整细胞浓度到3×104细胞/孔,在装有0.1 mL培养基的96孔板中于37 ℃,5%CO2的潮湿环境中孵育。使HcoEpiC细胞黏附24 h,形成部分单层。然后甩出上清液,并用100 μL培养基洗涤单层。用培养基分别制备100 μL不同质量浓度(100、75、50、25 μg/mL)的BPS-2溶液,并将其添加到各个孔中。每24 h进行显微镜检查并记录观察结果。培养48 h后,除去含BPS-2溶液的培养基。然后将附着的细胞在含有10 μL MTT溶液的培养基中孵育3 h。除去培养基后,加入200 μL的二甲基亚砜(dimethyl sulfoxide,DMSO),于摇床室温振荡10 min。用Thermo酶标仪测定490 nm处的吸光度。
1.3.5 利用人粪便微生物菌群体外发酵BPS-2
用无菌粪便收集管采集10名健康的志愿者(5男5女,年龄25~30岁)的粪便。将这10份新鲜粪便在厌氧环境下等量混合后,用无菌PBS稀释,得到粪便匀浆10 g/mL。在无菌条件下通过4层纱布过滤去除残渣,将粪便匀浆接种到不同组的肠道厌氧基础营养培养基中。阴性对照组为肠道厌氧基础营养培养基(无碳源),实验组分别以菊粉(阳性对照)和BPS-2为碳源添加到肠道厌氧基础营养培养基中,质量浓度均为5 g/mL。37 ℃孵育48 h。在发酵0、24、48 h分别采集样品进一步分析。
1.3.6 SCFAs的测定
将250 μL HCl溶液和1 mL的无水乙醚添加到1 mL 发酵上层清液液,向体系中加入0.1 mL 2-乙基丁酸内标溶液(0.1 mg/mL)后剧烈摇动溶液5 min来制备样品溶液。取上层有机相用无水硫酸钠脱水,收集上清液,通过0.22 μm微孔滤膜过滤。采用HP-INNOWAX柱的气相色谱仪分析SCFAs。进样器参数设置:烘箱温度为60 ℃,在4 min内升至190 ℃。注入器温度设置为220 ℃,检测器温度设置为250 ℃。每个样品5 μL,流速1.5 mL/min,分流比1∶20。根据每个SCFA与内标的峰面积比绘制校准曲线。根据标定曲线,根据峰面积比计算样品中SCFAs的浓度。
1.3.7 16S rRNA基因测序
采用QIAamp DNA Stool Mini Kit提取细菌基因组DNA。采用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增16S rRNA基因的V3~V4区。通过TruSeq-DNA PCR-Free样品制备试剂盒生成测序文库,并用MiSeq PE250平台进行焦磷酸测序。分别使用FLASH(v1.2.7)和Qiime(v1.9.1)进行配对末端读段的组装和质量控制。利用Uparse算法(Uparse v7.0.1001)对所有样本的全部 Effective Tags进行聚类,默认以97%的一致性(identity)将序列聚类成为操作分类单元(operational taxonomic units,OTUs),同时会选取OTUs的代表性序列,依据其算法原则,筛选的是OTUs中出现频数最高的序列作为OTUs的代表序列。对OTUs序列进行物种注释,用Mothur方法与SILVA138(http://www.arb-silva.de/)的SSUrRNA数据库进行物种注释分析,获得分类学信息并分别在门水平、属水平上统计各样本的群落组成。所有的原始序列都存放在NCBI中,序列号为SAMN23526837-SAMN23526848。
1.3.8 α多样性分析与β多样性分析
使用Qiime软件(v1.9.1)计算Chao1,Shannon,Simpson和ACE指数,使用R软件(v2.15.3)进行α多样性指数组间差异分析,检测方法选用Tukey检验。
用Qiime软件(v1.9.1)计算Unifrac距离,使用R软件(v2.15.3)进行β多样性指数组间差异分析,使用R软件绘制主成分分析(principal component analysis,PCA)图。PCA使用R软件的ade4包和ggplot2软件包,检测方法选用Tukey检验。
1.4 数据分析
实验均进行3次生物学重复,结果表示为平均值±标准偏差。使用Origin 2018软件作图,采用SPSS 19.0软件进行Tukey′s test,P<0.05表示统计学分析中差异显著。
2 结果与分析
2.1 7-L发酵罐分批发酵
通过7-L发酵罐对B.thuringiensis IX-01进行分批发酵,探究了菌种在高密度环境下对EPS生产的影响。众所周知,碳源的加入与EPS产量有很大的关系,为了提高葡萄糖的利用率,在EPS的生产中采用了碳饥渴的调控机制。在发酵到17~21 h时,通过线下监控维持发酵罐中葡萄糖含量在1 g/L以下,此时EPS产量迅速降低,在发酵进行到26 h时,细胞干重(dry cell weight,DCW)达到峰值并在之后的发酵过程中维持在23~26 g/L(图1-A)。结果表明,在细胞浓度处于一个高水平时,会大量消耗周围的一切养分,从而导致了EPS含量降低。因此,通过控制碳源的补加策略在提高细胞浓度的同时降低了细胞整体的碳饥渴程度。
该策略不仅使B.thuringiensis IX-01能达到高密度发酵要求,而且为产生更多EPS创造了有利条件。当碳饥渴时间为4 h,发酵72 h时,IX-01的EPS产量达到最大(16.19±0.55)g/L,同时该组的葡萄糖调控结果是所有试验组中的最佳值(图1-B)。
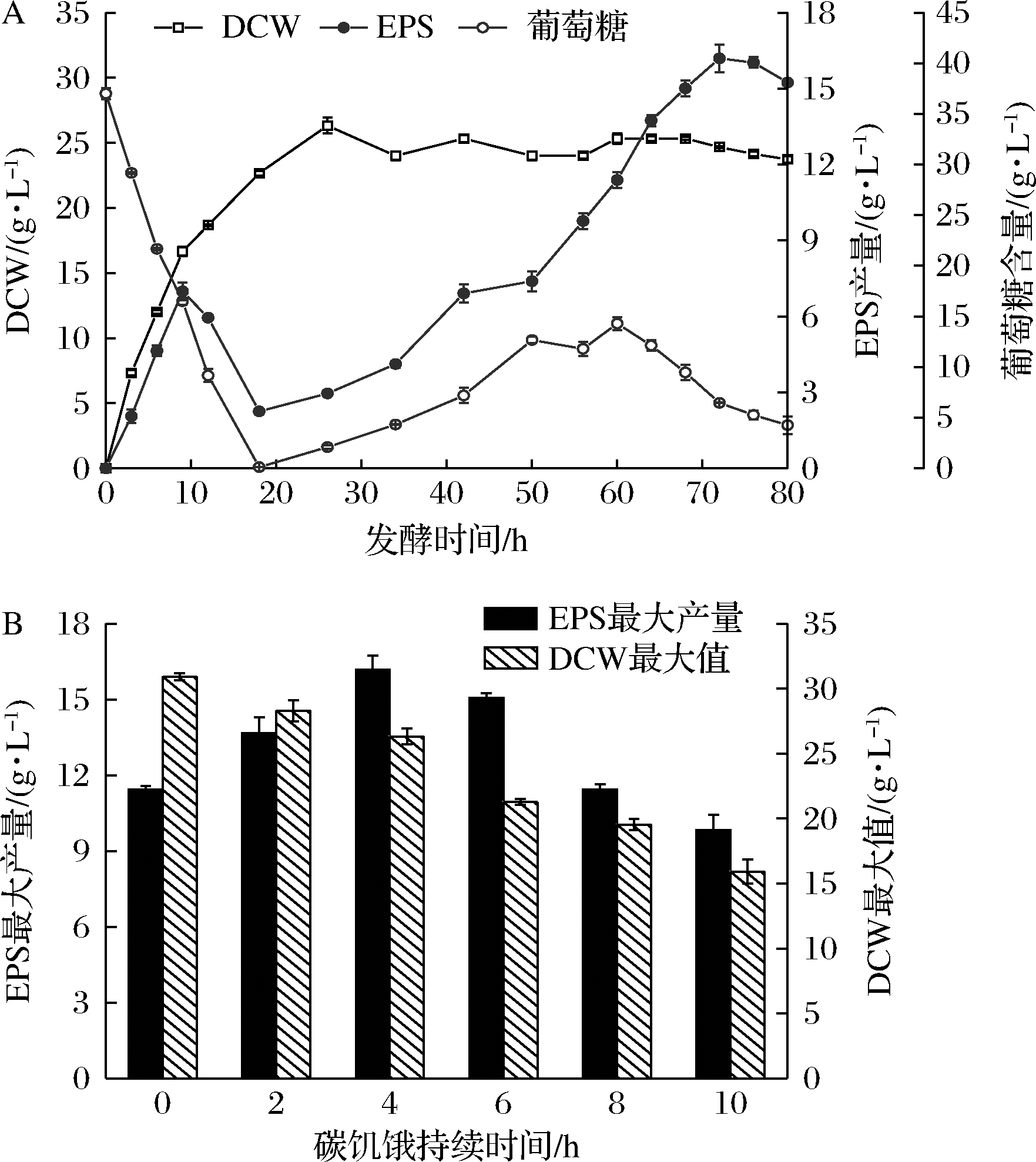
A-维持碳饥饿4 h的情况下的发酵结果;B-不同的碳饥饿 时间对EPS生产的影响
图1 7-L发酵罐水平、葡萄糖调控对EPS生产的影响
Fig.1 The influence of 7-L fermenter level, glucose regulation on EPS production.
2.2 EPS的分离纯化与成分分析
粗制的EPS经DEAE-Sepharose快速流动柱纯化,用纯水和不同浓度NaCl洗脱。如图2-A所示,EPS关键组分在NaCl缓慢增加到0.2 mol/L时被洗脱下来。收集的EPS关键组分再通过Superdex 200色谱柱用水进行洗脱,洗脱曲线见图2-B,洗脱后得到1个吸光度值最大的组分,命名为BPS-2。
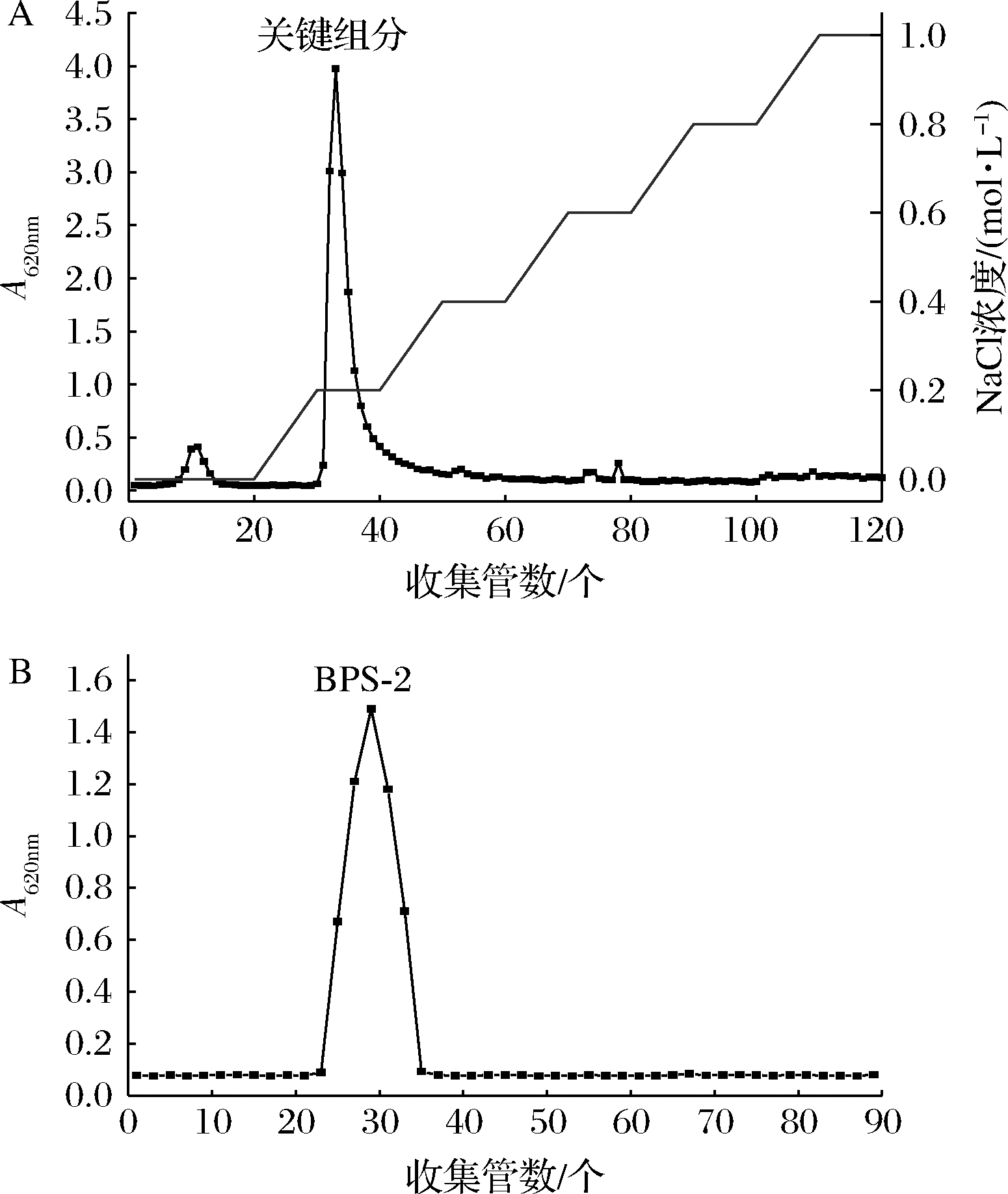
A-DEAE-Sepharose快速流动柱的洗脱曲线;B-Superdex 200 色谱柱的洗脱曲线
图2 BPS-2的纯化洗脱曲线
Fig.2 Purification elution curves of BPS-2
根据蒽酮-硫酸法和考马斯亮蓝法测得的BPS-2总糖和蛋白含量分别为(91.29±3.71)%、(1.31±0.27)%(质量分数)。分子质量与单糖组成结果表明,BPS-2的分子质量为27.96 kDa,主要由氨基半乳糖、阿拉伯糖、氨基葡萄糖、葡萄糖和甘露糖组成,摩尔百分比为5.53∶1.77∶4.74∶3.24∶1。
RAMAMOORTHY等[16]从海洋中筛选得到一株B.thuringiensis RSK CAS4,通过摇瓶发酵后提取得到的EPS由果糖(43.8%),半乳糖(20%),木糖(17.8%),葡萄糖(7.2%),鼠李糖(7.1%)和甘露糖(4.1%)组成。WANG等[17]选用一株B.thuringiensis 4D19通过摇瓶发酵后提取得到了一种EPS,其单糖组成是甘露糖(44.2%)、氨基葡萄糖(35.5%)、氨基半乳糖(8.0%)、葡萄糖(5.5%)、阿拉伯糖(5.1%)、半乳糖(0.9%)、甘露糖醛酸(0.3%)和葡萄糖醛酸(0.2%)。本研究得到的BPS-2分子质量和单糖组成与以往报道均不同,表现出其EPS的特异性,其中氨基糖(氨基葡萄糖与氨基半乳糖)的占比达到63.1%。这可能是由于B.thuringiensis IX-01在高密度发酵过程中通过氨水调控pH诱导的。
2.3 BPS-2的细胞毒性分析
微生物EPS与化学合成分子相比几乎没有副作用,但关于EPS对多种类型细胞的特异性和非特异性细胞毒性仍需要得到重视。EPS和细胞的生物相容性是评估EPS生物活性的一个重要前提条件。由于B.thuringiensis IX-01是从传统发酵食品郫县豆瓣中筛选的,从菌株来源来上分析是安全的。但B.thuringiensis以往的研究报告多用于生物农药方向,其菌株产EPS的安全性评估的研究极少。
考虑到BPS-2作为一种潜在益生元,我们在研究中选用HcoEpiC细胞通过MTT法进行了体外细胞毒性的测试。如图3-A所示,随着BPS-2的反应浓度不断升高,均未表现出对HcoEpiC细胞的显著抑制作用,细胞形态均未表现出形变。同时,随反应时间的增加,也未表现出对HcoEpiC细胞的显著抑制作用,细胞生存率均在98%以上(图3-B、图3-C)。结果表明,B.thuringiensis IX-01产的BPS-2无细胞毒性。

A-BPS-2与HcoEpiC细胞的相互作用(比例尺=100 μm);B-HcoEpiC细胞的生存能力(24 h);C-HcoEpiC细胞的生存能力(48 h)
图3 BPS-2与HcoEpiC细胞的毒性分析
Fig.3 Toxicity analysis of BPS-2 with HcoEpiC cells.
注:相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)(下同)
2.4 BPS-2对SCFAs的影响
SCFAs是肠道微生物群的主要代谢产物,参与宿主的各种生理过程,包括保护肠道屏障,调节肝脏中脂质代谢,以及调节激素释放[18]。本研究中,用健康人的粪便细菌在厌氧管中进行菊粉、BPS-2和空白的体外发酵,在发酵0、24、48 h后测定SCFAs浓度(图4)。
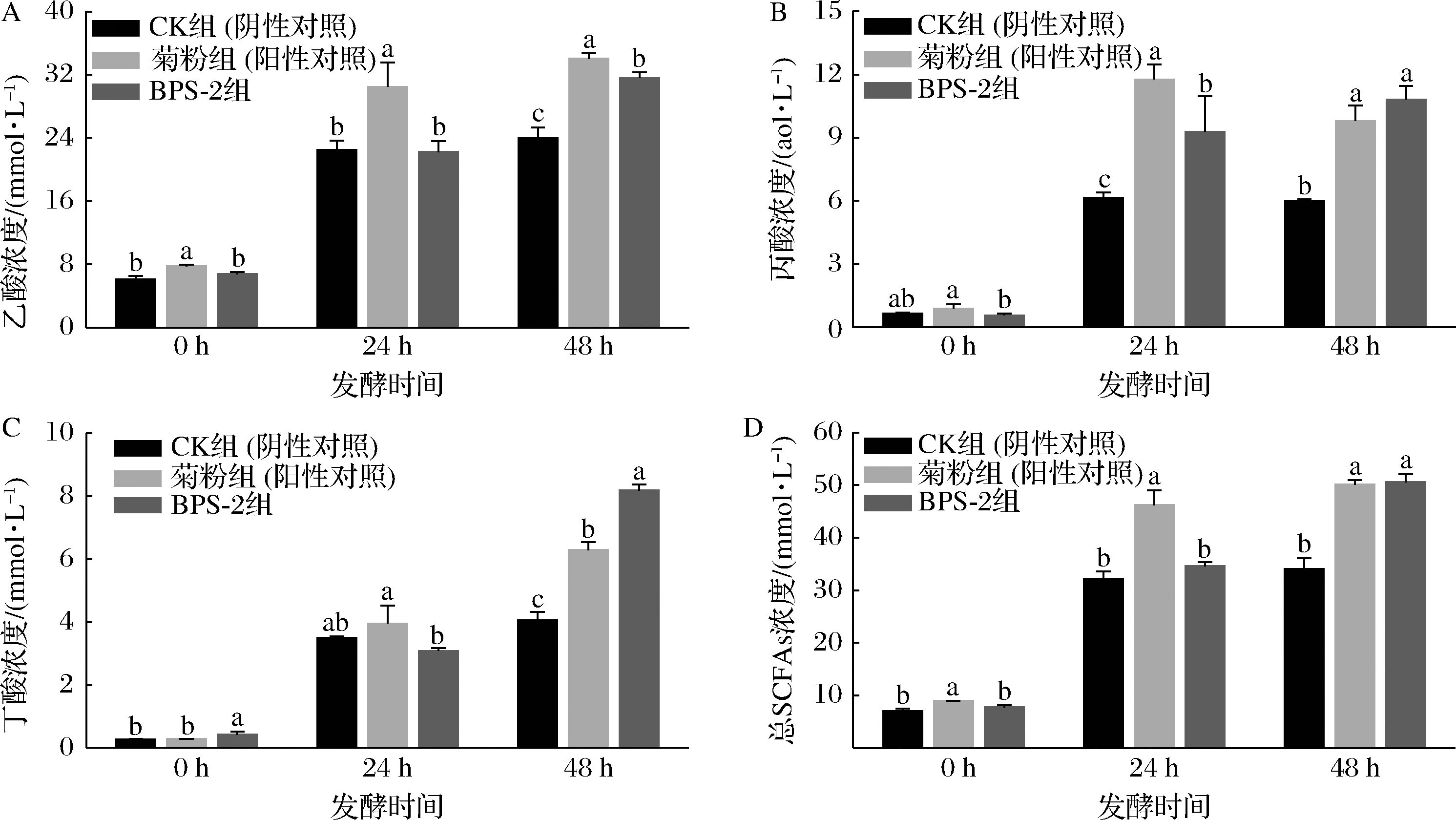
A-乙酸;B-丙酸;C-丁酸;D-总SCFAs
图4 不同碳源与粪菌发酵后SCFAs浓度的变化
Fig.4 Changes in the concentration of SCFAs after fermentation with different carbon sources and fecal bacteria
众所周知,菊粉是天然的益生元,同时是理想的功能性食品配料,因此本研究选用菊粉作为BPS-2的阳性对照。在发酵48 h时,菊粉和BPS-2产生的总SCFAs浓度分别为(50.12±0.85)、(50.59±1.54) mmol/L(图4-D),显著高于0 h时CK(阴性对照)组中的总SCFAs浓度(P<0.05),这一结果表明,BPS-2与菊粉均能显著提高粪菌发酵过程中SCFAs的产量。但在发酵24 h时,菊粉的总SCFAs浓度远高于BPS-2,造成该情况原因可能是由于BPS-2分子质量远高于菊粉,肠道微生物在接触BPS-2初期无法迅速利用。在发酵48 h时,BPS-2产生的乙酸,丙酸和丁酸的含量分别为(31.59±0.73)、(10.82±0.65)、(8.18±0.2) mmol/L(图4-A~图4-C),与CK相比,BPS-2和菊粉组中的乙酸,丙酸和丁酸浓度均显著增加(P<0.05)。乙酸能够保持肠道环境的稳定,控制宿主食欲减少脂肪的产生,并有助于滋养肠道中产丁酸的细菌,促进肠道有益菌群的多样性[9]。在发酵48 h时,BPS-2的丙酸浓度显著高于CK组(P<0.05),同时其含量也明显高于同时间的菊粉。丙酸是SCFAs 的重要组成成分,在宿主体内可以通过调节免疫细胞来达到降低肝脏和血浆中脂肪酸的水平[19]。在发酵48 h时,BPS-2组的丁酸浓度相较于CK组与菊粉组显著升高(P<0.05)。丁酸是结肠细胞的重要供能物质,起到维护肠道上皮屏障的功能稳定,并通过刺激脂肪酸氧化基因的表达,降低肝脏中的总胆固醇[20]。有研究表明,丁酸在结肠上皮细胞增殖和分化时起到了重要的调节作用,同时丁酸具有诱导肠道癌细胞凋亡的作用[21]。
以上结果表明,BPS-2能促进肠道微生物产生SCFAs,尤其是丙酸和丁酸的产生。
2.5 BPS-2对肠道微生物菌群的影响
现在越来越多的多糖被用于调节肠道微生物群,改善人类的健康。LIU等[22]发现,芦荟多糖能显著增强小鼠粪便中SCFAs的产生,主要通过副杆菌属(Parabacteroides)降解芦荟多糖,对肠道微生物菌群产生有益的影响。本研究通过16S rRNA检测肠道微生物菌群的变化。在体外厌氧发酵的情况下,评估了菊粉和BPS-2对粪便微生物菌群组成的影响。
如图5-A所示,BPS(BPS-2)组的Shannon、Simpson和Chao1指数均显著高于CK(空白)组(P<0.05),表明BPS-2发酵相对于CK组而言,明显提高了物种的多样性。而PCA图将CK、菊粉和BPS的发酵分成3个不相近的群组(图5-B),表明各组之间的粪便微生物菌群组成存在明显差异。但肠道微生物在多糖代谢中的作用是复杂的,必须在门和属的水平上进行更加深入的研究。
粪便微生物组成在门水平上的变化如图5-C所示,与CK组相比,BPS组和菊粉组的变形菌门(Proteobacteria)的相对丰度明显降低。在BPS组的发酵过程中,拟杆菌门(Bacteriodetes)的相对丰度明显高于菊粉和CK组。大分子多糖是Bacteriodetes的主要能量来源,参与人类结肠的许多重要代谢活动,其中Bacteriodetes产生的多糖降解酶要比厚壁菌门(Firmicutes)多,可水解不可消化的多糖以促进SCFAs的产生[23]。因此,在有BPS-2的情况下,肠道微生物菌群的组成相对于菊粉来说更有利于多糖的分解。

A-肠道微生物群的α多样性;B-基于加权Unifrac距离的OTU水平的微生物群的PCA;C-门水平的菌群相对丰度; D-属水平的菌群相对丰度
图5 空白组、菊粉组和BPS-2组分别与粪便细菌发酵期间(48 h)的细菌分类概况
Fig.5 Bacterial taxonomic profiles during CK, inulin and BPS-2 fermentations with fecal bacteria at 48 h
而粪便微生物组成在属水平上的变化如图5-D所示,与菊粉组相比,BPS组中巨球形菌属(Megasphaera)、梭杆菌属(Fusobacterium)和巨单胞菌属(Megamonas)的相对丰度明显降低(P<0.05),而Parabacteroides的相对丰度相比于菊粉组与CK组显著增加(P<0.05)。据报道,Megamonas是亚洲人群中的一个典型菌属,但其高丰度与结肠癌的发病率明显相关[24]。相对于菊粉组,BPS组也显著降低了Fusobacterium的相对丰度(P<0.05)。Fusobacterium的高丰度对人类来说是不利的,与胆汁代谢异常和肠道炎症相关[25]。在BPS-2发酵过程中,Parabacteroides成为核心群落。相关研究表明,肠道微生物群中的Parabacteroides可以通过产生乙酸来减少中性粒细胞的浸润,从而达到减轻乙酰肝素酶对急性胰腺炎的不利影响[26]。
以上结果证实BPS-2可以作为一种潜在的益生元,在丰富有益菌Parabacteroides的同时抑制潜在的有害微生物群,如Megamonas和Fusobacterium。
3 结论
本文研究了B.thuringiensis IX-01产生的BPS-2,并对其作为益生元的特性进行评价。以葡萄糖、大豆蛋白胨为主要原料,采用高密度发酵对IX-01进行扩大培养,通过碳调控机制的优化使EPS的产量达到最大(16.19±0.55) g/L。经过纯化后,BPS-2的总糖含量达到91.29%,蛋白质含量为1.31%,其分子质量为27.96 kDa。BPS-2单糖组成为氨基半乳糖、阿拉伯糖、氨基葡萄糖、葡萄糖和甘露糖,摩尔百分比为5.53∶1.77∶4.74∶3.24∶1。用HcoEpiC细胞对BPS-2的细胞毒性进行评价,在确认BPS-2无明显细胞毒性的基础上进行体外健康人的粪便菌群发酵,结果表明BPS-2可以显著增加Parabacteroides的相对丰度,减少有害微生物菌群的丰度,如Megamonas和Fusobacterium,进而参与改善肠道微生物菌群的组成。同时BPS-2在发酵过程中能被粪便菌群有效利用,并显著增加SCFAs中丙酸与丁酸的产生。综上,B.thuringiensis IX-01产生的BPS-2具有一定的益生功能。但离真正推广到食品领域中还有很长距离,接下来应从体内动物实验入手,为BPS-2在食品中应用提供更加充分数据和理论支持。
[1] SUTHERLAND I W. Novel and established applications of microbial polysaccharides[J]. Trends Biotechnol, 1998, 16(1): 41-46.
[2] MALAKA R, ABUSTAM E, BACO S.Antitumor activity (in-vitro) of extracellular polysaccharide produced by ropy Lactobacillus delbrueckii ssp. bulgaicus isolated from traditional fermented milk[J].International Journal of Chemistry and Pharmaceutical Science, 2016, 4:246-249.
[3] SILVA L A, LOPES NETO J H P, CARDARELLI H R, et al.Exopolysaccharides produced by Lactobacillus plantarum:Technological properties, biological activity, and potential application in the food industry[J].Annals of Microbiology, 2019, 69(4):321-328.
[4] ZEIDAN A A, POULSEN V K, JANZEN T, et al.Polysaccharide production by lactic acid bacteria:From genes to industrial applications[J].FEMS Microbiology Reviews, 2017, 41(S1):S168-S200.
[5] CUTTING S M.Bacillus probiotics[J].Food Microbiology, 2011, 28(2):214-220.
[6] CRICKMORE N, ZEIGLER D R, FEITELSON J, et al.Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins[J].Microbiology and Molecular Biology Reviews, 1998, 62(3):807-813.
[7] LIU W, LI X Q, ZHAO Z L, et al.Effect of chitooligosaccharides on human gut microbiota and antiglycation[J].Carbohydrate Polymers, 2020, 242:116413.
[8] DI T, CHEN G J, SUN Y, et al.In vitro digestion by saliva, simulated gastric and small intestinal juices and fermentation by human fecal microbiota of sulfated polysaccharides from gracilaria rubra[J].Journal of Functional Foods, 2018, 40:18-27.
[9] SCHROEDER B O, B CKHED F.Signals from the gut microbiota to distant organs in physiology and disease[J].Nature Medicine, 2016, 22(10):1 079-1 089.
CKHED F.Signals from the gut microbiota to distant organs in physiology and disease[J].Nature Medicine, 2016, 22(10):1 079-1 089.
[10] ZHU Y, MAO Y Q, CHEN H, et al.Apigenin promotes apoptosis, inhibits invasion and induces cell cycle arrest of T24 human bladder cancer cells[J].Cancer Cell International, 2013, 13(1):54.
[11] SCHULTHESS J, PANDEY S, CAPITANI M, et al.The short chain fatty acid butyrate imprints an antimicrobial program in macrophages[J].Immunity, 2019, 50(2):432-445.
[12] AL-LAHHAM S H, PEPPELENBOSCH M P, ROELOFSEN H, et al.Biological effects of propionic acid in humans;metabolism, potential applications and underlying mechanisms[J].Biochimica et Biophysica Acta, 2010, 1 801(11):1 175-1 183.
[13] CRESCI G A, GLUECK B, MCMULLEN M R, et al.Prophylactic tributyrin treatment mitigates chronic-binge ethanol-induced intestinal barrier and liver injury[J].Journal of Gastroenterology and Hepatology, 2017, 32(9):1 587-1 597.
[14] MORRIS D L.Quantitative determination of carbohydrates with dreywood′s anthrone reagent[J].Science (Washington), 1948, 107(2 775):254-255.
[15] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[16] RAMAMOORTHY S, GNANAKAN A,LAKSHMANA S S, et al.Structural characterization and anticancer activity of extracellular polysaccharides from ascidian symbiotic bacterium Bacillus thuringiensis[J].Carbohydrate Polymers, 2018, 190:113-120.
[17] WANG M L, GENG L L, XUE B, et al.Structure characteristics and function of a novel extracellular polysaccharide from Bacillus thuringiensis strain 4D19[J].International Journal of Biological Macromolecules, 2021, 189:956-964.
[18] CARLSON J L, ERICKSON J M, HESS J M, et al.Prebiotic dietary fiber and gut health:Comparing the in vitro fermentations of beta-glucan, inulin and xylooligosaccharide[J].Nutrients, 2017, 9(12):1 361.
[19] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al.From dietary fiber to host physiology:Short-chain fatty acids as key bacterial metabolites[J].Cell, 2016, 165(6):1 332-1 345.
[20] WANG R X, LEE J S, CAMPBELL E L, et al.Microbiota-derived butyrate dynamically regulates intestinal homeostasis through regulation of actin-associated protein synaptopodin[J].Proceedings of the National Academy of Sciences, 2020, 117(21):11 648-11 657.
[21] LAPARRA J M, SANZ Y.Interactions of gut microbiota with functional food components and nutraceuticals[J].Pharmacological Research, 2010, 61(3):219-225.
[22] LIU C, DU P, GUO Y H, et al.Extraction, characterization of aloe polysaccharides and the in-depth analysis of its prebiotic effects on mice gut microbiota[J].Carbohydrate Polymers, 2021, 261(11):117874.
[23] JOHNSON E L, HEAVER S L, WALTERS W A, et al.Microbiome and metabolic disease:Revisiting the bacterial phylum Bacteroidetes[J].Journal of Molecular Medicine, 2017, 95(1):1-8.
[24] YACHIDA S, MIZUTANI S, SHIROMA H, et al.Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer[J].Nature Medicine, 2019, 25(6):968-976.
[25] MULLISH B H, MCDONALD J A K, PECHLIVANIS A, et al.Microbial bile salt hydrolases mediate the efficacy of faecal microbiota transplant in the treatment of recurrent Clostridioides difficile infection[J].Gut, 2019, 68(10):1 791-1 800.
[26] LEI Y Y, TANG L, LIU S, et al.Parabacteroides produces acetate to alleviate heparanase-exacerbated acute pancreatitis through reducing neutrophil infiltration[J].Microbiome, 2021, 9(1):115.