4-羟基异亮氨酸(4-hydroxyisoleucine,4-HIL)是一种天然的非蛋白质氨基酸,被首次发现于葫芦巴种子中[1]。4-HIL具有降低胰岛素抵抗、治疗高血脂和代谢紊乱等非传染性疾病,是一种治疗Ⅱ型糖尿病[2]及其并发症的潜在药物,具有非常广阔的应用前景[3-4]。4-HIL具有8种立体异构体,研究表明,其中具有治疗糖尿病作用的结构仅为(2S, 3R, 4S)-4-HIL一种构型[5]。
最早期生产4-HIL的方法主要采用胡芦巴种子提取法,但是该生产方法存在原料需求量大、杂质多导致分离纯化较为困难、最终收率较低和成本昂贵等缺点[1]。利用化学-酶合成法可以较大的提升产品的最终得率[6],但也存在操作繁琐、耗时较长以及产品纯度较低等缺点,不利于工业化的大规模生产。2009年,KODERA等[7]在Bacillus thuringiensis 2e2中发现了异亮氨酸双加氧酶(isoleucine dioxygenase,IDO)。IDO可以直接特异性催化异亮氨酸(isoleucine,Ile)的C4发生羟基化,从而生成(2S, 3R, 4S)-4-HIL。IDO的催化生产不会产生4-HIL的其他构型,自身也具备易获取、催化过程简单和生产成本少等特点,最适合用来工业化生产4-HIL[8]。
本实验室前期通过在Ile生产菌株C. glutamicum ssp. lactofermentum SN01(以下简称为SN01)中表达ido基因,构建了重组菌株SN02,利用自身合成的Ile催化合成得到(65.44±2.27) mmol/L的4-HIL,实现了4-HIL的从头生物合成[9]。为了增加Ile的供应,过表达天冬氨酸激酶编码基因lysC;为了增强ido表达,过表达韦氏芽孢杆菌中的ido3基因,构建了质粒pJYW4-ido-lysC-ido3[10]。
在很早之前,抗生素的过度使用而引起的抗生素抗性基因扩散便引发了人们的广泛关注。抗生素抗性基因的扩散会引起大量具有抗性的微生物产生,在疫苗和医药卫生领域,这种抗生素耐药菌株的扩散可能会引起更大的危害[11-12]。谷氨酸棒杆菌的表达质粒中携带有抗生素抗性基因作为筛选标记。通常在发酵过程中,为了维持菌株中质粒的稳定性和活性,需要在培养基中添加一定浓度的抗生素。这不仅增加了抗生素抗性基因扩散的风险,还增加了生产成本[13]。alr基因编码丙氨酸消旋酶,参与催化将L-丙氨酸转化为D-丙氨酸的反应,D-丙氨酸为谷氨酸棒杆菌中细胞壁肽聚糖交联及前体合成的必需物质[14-15]。在谷氨酸棒杆菌中敲除alr后,菌株自身没有其他途径进行回补,所以在培养基上表现为稳定的营养缺陷型菌株。随后通过在表达质粒中表达alr基因对敲除菌株进行回补,就能使质粒在不添加抗生素的情况下仍能稳定地维持在细胞中。
为了提高4-HIL的产量以及减少抗生素在发酵过程中的使用,首先在谷氨酸棒杆菌SN01中敲除丙氨酸消旋酶基因alr,并使用质粒pJYW4-ido来回补alr基因并表达异亮氨酸双加氧酶IDO,该方法有效地减少了发酵过程中抗生素的使用,成功地使谷氨酸棒杆菌菌株正常生长并且生产4-HIL。在SN01Δalr菌株中转入pJYW4-ido-lysC-ido3质粒后,从接种时的种子活力、溶氧水平的调整和补料等方面进行上罐水平的优化,从而提高4-HIL的上罐产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本课题所构建的菌株如表1所示。
表1 本课题所用菌株
Table 1 Strains used in this study

菌株描述来源SN01产L-异亮氨酸的C.glutamicum ssp.lactofermentumCCTCCSN02SN01携带pJYW4-ido本实验室SN01ΔalrSN01敲除alr本研究Δalr/p4-idoSN01Δalr携带pJYW4-ido本研究Δalr-ILI3SN01Δalr携带pJYW4-ido-lysC-ido3本研究
1.1.2 实验试剂
七水合硫酸亚铁、氯化钠、氨水、硫酸铵,中国医药集团有限公司;酵母浸粉、蛋白胨,英国OXOID公司;发酵培养基所使用的阿拉丁玉米浆,上海阿拉丁生化科技股份有限公司;磷酸吡哆醛、甜菜碱,美国TEDIA公司。
1.1.3 培养基配方和培养条件
谷氨酸棒杆菌发酵过程中种子培养基(g/L):固体玉米浆40、磷酸二氢钾1、硫酸氨0.5、尿素1.25、葡萄糖25、硫酸镁0.5。固体玉米浆使用前搅拌混匀,培养基定容后,pH约为3.8,用氢氧化钾调节至pH 7.2。121 ℃,15 min条件灭菌。
上罐发酵培养基(g/L):葡萄糖100,硫酸氨20,玉米浆15,磷酸二氢钾1,无水硫酸镁0.75,酵母粉3,维生素B1 1.0×10-3,甜菜碱1.5×10-3,七水合硫酸亚铁1.1。用氢氧化钾调节至pH 7.2,灭菌条件115 ℃,15 min。
培养谷氨酸棒杆菌抗生素添加量:氯霉素10 μg/mL,卡那霉素30 μg/mL。
谷氨酸棒杆菌培养条件:自动往复式摇床30 ℃,200 r/min。
敲除alr基因的重组菌株在发酵过程中无需向培养基中添加抗生素。
1.2 实验方法
1.2.1 alr基因敲除菌株及发酵菌株的构建
alr基因的敲除按照胡瑾瑜[16]所构建的谷氨酸棒杆菌基因敲除方法进行。随后在SN01Δalr中使用电转的方法分别转入pJYW4-ido以及pJYW4-ido-lysC-ido3质粒,构建出了Δalr/p4-ido和Δalr-ILI3菌株。这两个质粒所用的载体pJYW-4上携带有alr基因表达框[17]。
1.2.2 谷氨酸棒杆菌上罐发酵
谷氨酸棒杆菌上罐发酵具体步骤如下,使用迪必尔生物公司2 L四连罐:
(1)活化菌株:将保存于-80 ℃冰箱中的菌株涂布于LBB固体培养基平板上活化48 h。
(2)种子培养;将平板上已经活化好菌苔接种于含有50 mL种子培养基的500 mL发酵摇瓶中,在往复式摇床中30 ℃,200 r/min培养至上罐所需要的种子浓度。
(3)发酵罐培养:将生长至对数期的种子液接种于灭菌完成的发酵罐中,进行发酵罐上的菌株培养,一个发酵周期为96 h。
发酵过程中pH调节试剂:体积分数为25%的氨水。
发酵过程补料试剂:800 g/L葡萄糖。当发酵罐内葡萄糖质量浓度低于20 g/L时,将葡萄糖补加到30 g/L。
1.2.3 发酵参数测定
发酵过程中每4 h取1次样,测量OD562值、残糖和氨基酸含量。
OD562值:将样品稀释一定倍数,用紫外分光光度计在562 nm处进行OD值的测量。
残糖:将发酵样品用离心机12 000 r/min,15 min离心,减少大分子物质对还原糖测定仪的损伤,取10 μL 的发酵上清液用ddH2O稀释100倍后,再使用生物传感仪SBA40测定残留葡萄糖数值浓度。
氨基酸含量测定:将发酵液样品进行预处理并稀释一定倍数后使用高效液相色谱测定样品中的氨基酸含量。首先进行各个氨基酸标样的液相测定,确定各个氨基酸的出峰时间和峰面积,然后进行发酵样品的液相测定,将某种氨基酸样品的峰面积和标样中该氨基酸的峰面积进行比值再乘以稀释倍数,从而计算出该种氨基酸在样品中的含量。
2 结果与分析
2.1 敲除alr对4-HIL发酵的影响
alr作为一种替代抗生素的选择标记,其实用性已在其他谷氨酸棒杆菌中得到验证[17-18]。从实验严谨性以及敲除alr之后的发酵效果考虑,有必要验证在SN01中敲除alr后菌株受到的影响,以及质粒所携带的alr能否回补alr敲除菌体的D-丙氨酸营养缺陷。
2.1.1 alr敲除对菌株生长的影响
在alr基因敲除菌株基础上过表达ido基因,得到重组菌株Δalr/p4-ido,该菌株的质粒上同时携带了alr基因表达框。在不添加卡那霉素的情况下,经过摇瓶发酵144 h后,菌株Δalr/p4-ido的生长和糖耗情况如图1所示。以携带pJYW4-ido质粒的野生菌SN02在添加卡那霉素时的发酵作为对照。
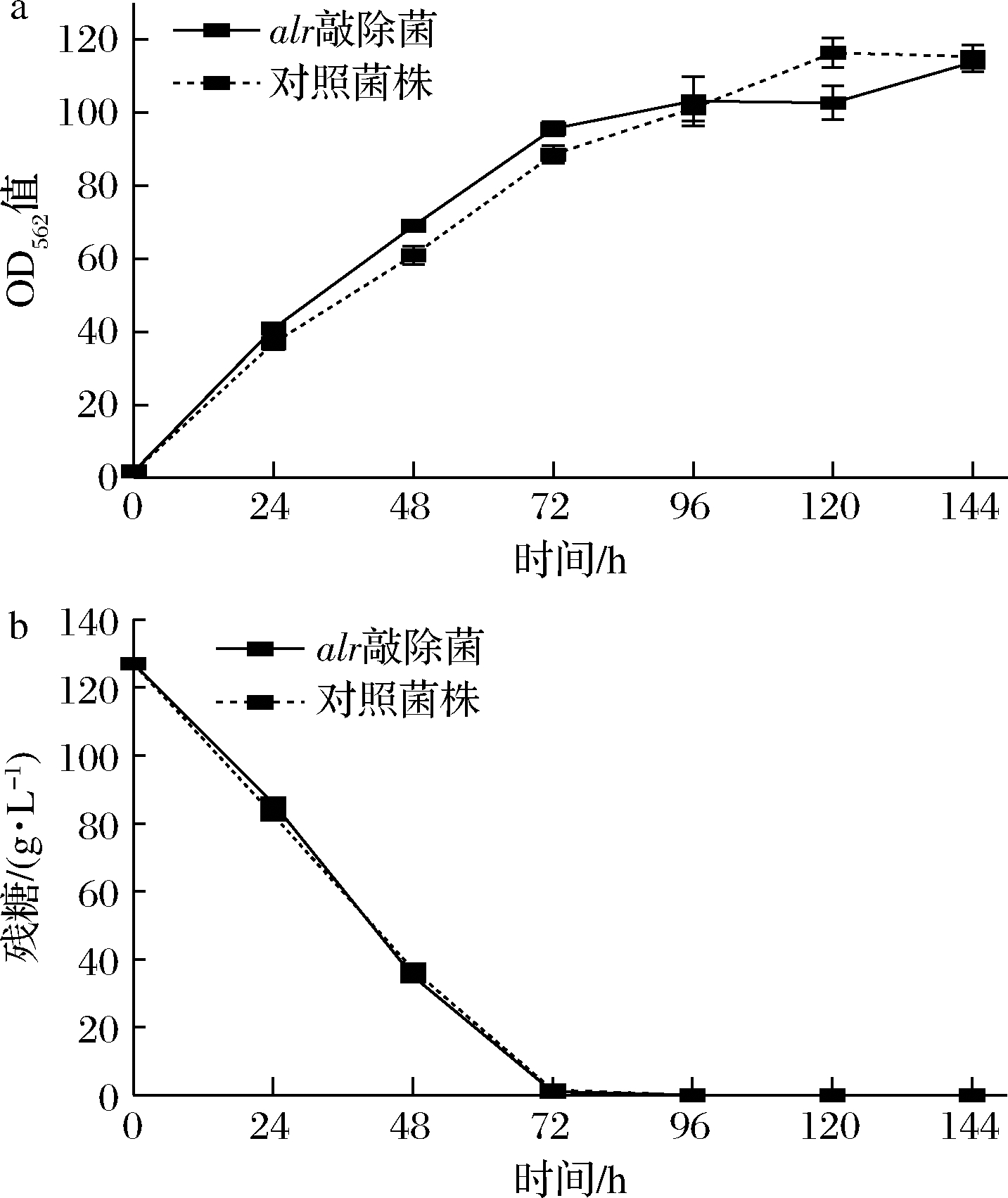
a-生长变化;b-残糖变化
图1 SN02和alr敲除菌株Δalr/p4-ido发酵过程中 生长和残糖变化
Fig.1 Cell growth and residual glucose of SN02 and alr-deleting strain Δalr/p4-ido during the fermentation
在整个发酵周期中,菌株Δalr/p4-ido与对照菌株SN02保持相似的生长趋势。而且在96 h之前,Δalr/p4-ido 菌株的生长速率略微高于对照菌株,最终两者的生物量几乎相同,OD562值都在115左右。生长速率的变化说明敲除alr基因并没有影响菌株的生长。在耗糖能力方面,SN02和Δalr/p4-ido在0~72 h耗糖速率几乎相同,在72 h时都能将葡萄糖耗尽,该结果说明,敲除了alr基因后,通过质粒pJYW4-ido回补alr基因并没有阻碍菌株的生长状况,菌株的耗糖能力也没有减弱。在产量方面,菌株Δalr/p4-ido发酵144 h后的4-HIL产量为152.59 mmol/L,对照菌株SN02的4-HIL产量为147.79 mmol/L,产量无明显波动,说明该方法对4-HIL的生产无明显不良影响。
2.1.2 alr回补替代抗生素使用的效果
随后验证alr敲除之后,通过转入携带alr基因的质粒pJYW4-ido进行回补是否能够不用添加卡那霉素就保持质粒稳定存在,从而有效地替代发酵过程中抗生素的使用。取正常发酵144 h后菌株Δalr/p4-ido先稀释至OD562值为1,然后再稀释一定倍数后分别涂布于含有或不含有卡那霉素的平板,观察两种平板上菌落生长的情况,结果如表2所示。
表2 alr敲除菌的质粒稳定性
Table 2 Plasmid stability of alr knockout bacteria

菌株抗生素菌落数质粒保持率/%Δalr/p4-ido不添加抗生素271±696.7±0.1Δalr/p4-ido添加30 μg/mL卡那霉素 262±11100
从表2中可以看出,alr敲除后的回补菌株Δalr/p4-ido在含有抗生素的平板上长出的菌落数(这些菌株中质粒存在)几乎接近于在不含有抗生素的平板上长出的菌落数(包括质粒存在的菌株和质粒丢失的菌株),说明在谷氨酸棒杆菌的144 h的发酵周期内,alr敲除回补菌中的质粒能够稳定存在,可以使用alr敲除菌株并使用携带alr基因的质粒进行回补,以此代替抗生素的使用来维持质粒稳定存在。
2.2 上罐水平上的发酵条件优化
在构建SN01Δalr的基础上使用电转的方法转入pJYW4-ido-lysC-ido3质粒,构建出了Δalr-ILI3菌株。对该菌株进行上罐条件的优化。
2.2.1 菌株Δalr-ILI3种子生长时间对发酵生产4-HIL的影响
针对种子活力,主要通过选择不同的种子生长时间进行接种。以Δalr-ILI3为发酵菌株,分别选16、18、18.5、19.5、21 h的种子生长时间进行接种,上罐发酵的结果如图2和图3所示。
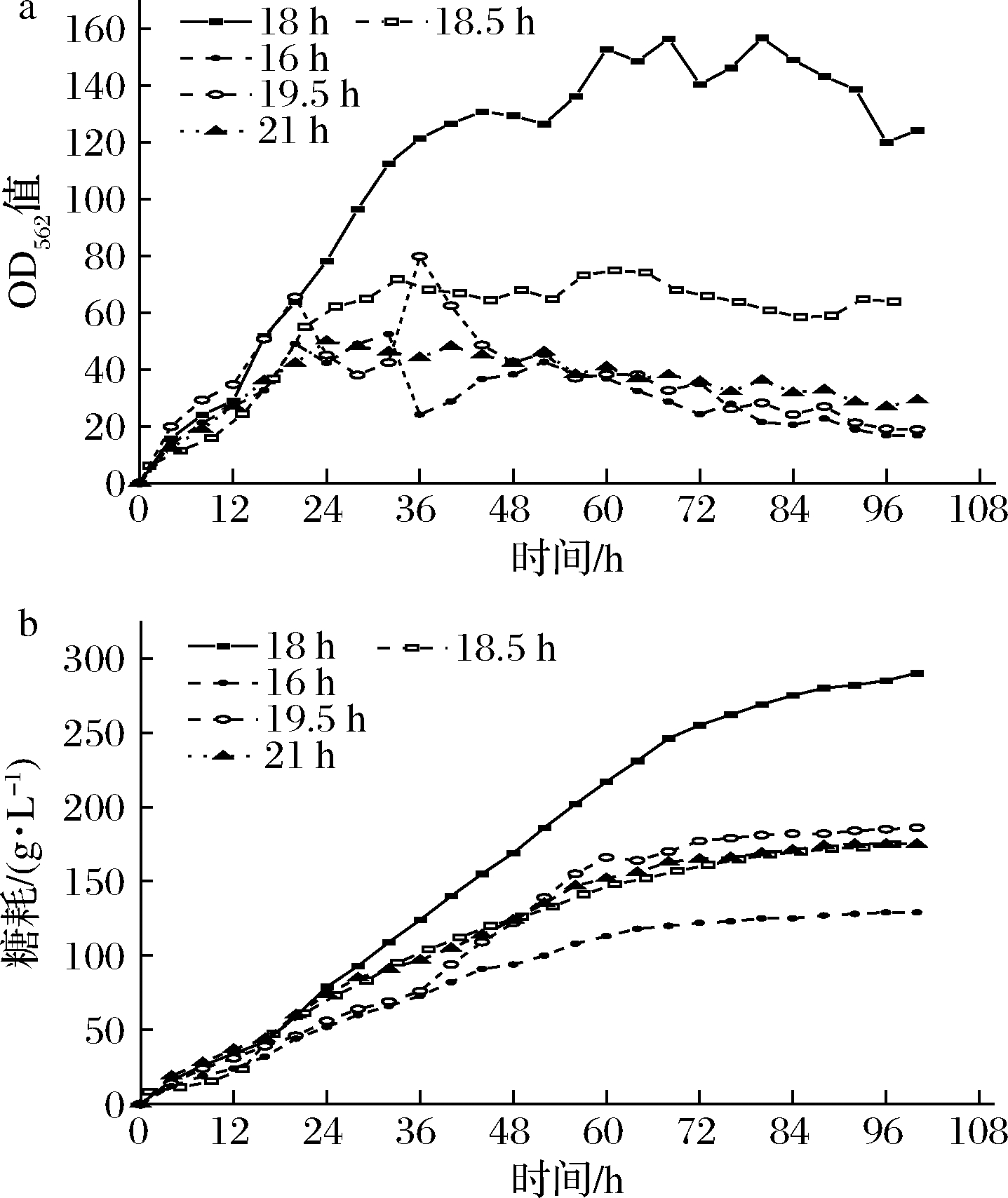
a-生长情况;b-耗糖情况
图2 菌株Δalr-ILI3不同种子活力时上罐发酵的生长和耗糖
Fig.2 Fermentation of strain Δalr-ILI3 with different seed cultivation time in 2 L fermenters
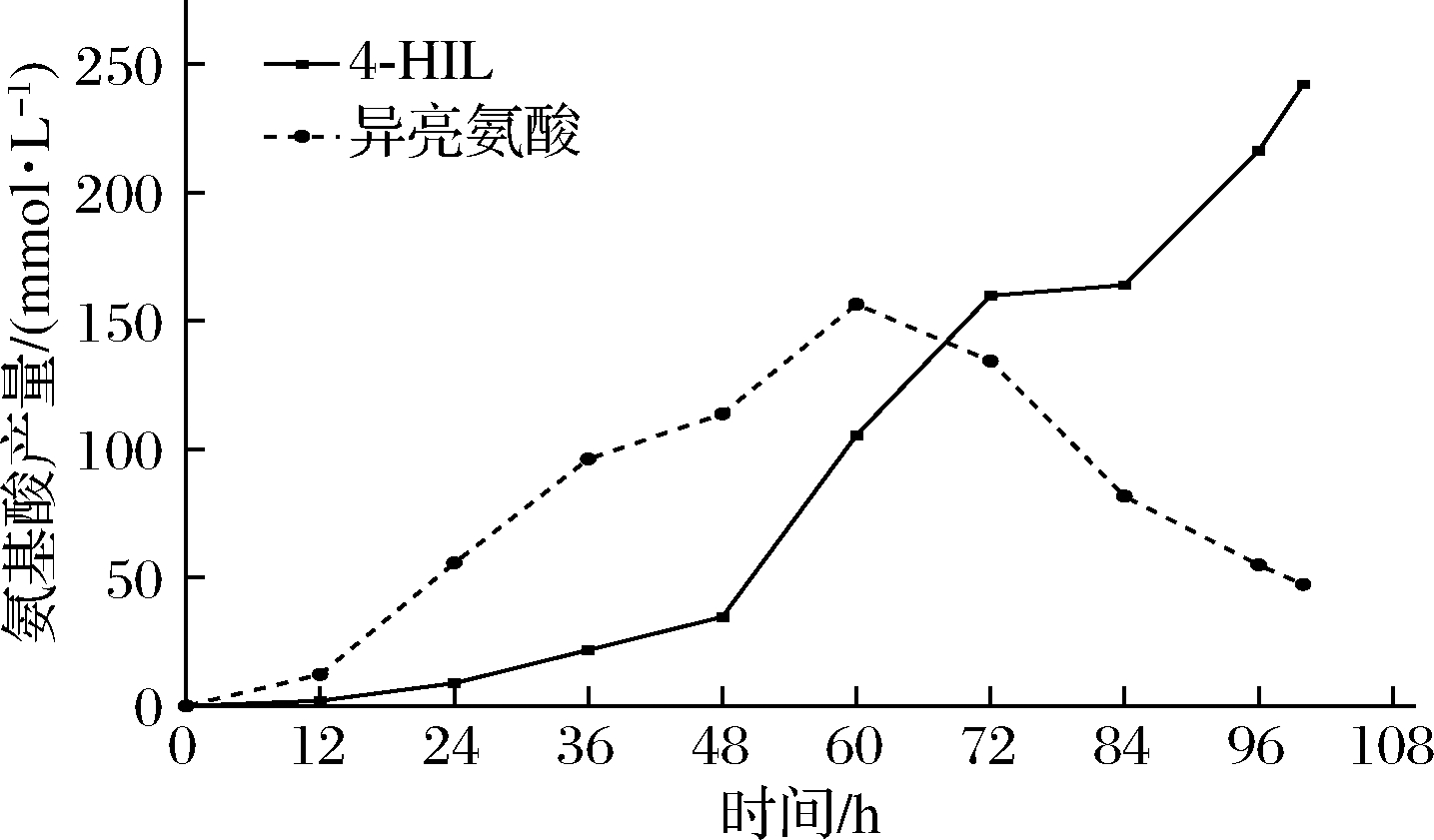
图3 种子培养18 h上罐发酵的氨基酸产量
Fig.3 The amino acid production of strain Δalr-ILI3 with 18 h seed cultivation time in a 2 L fermenter
从图2可以看出,在只变动种子生长时间的条件下,生长状况和4-HIL产量显著不同。当种子生长时间为18 h时菌株在发酵罐上的生长最好。种子生长时间为16 h的菌株延滞期过长,生长速率缓慢,最终没有完全生长起来。而种子生长时间为18.5、19.5、21 h的种子液活力完全不足,在菌株还没有生长起来的时候就进入了衰亡期,最终也没有4-HIL产量。在测定菌株Δalr-ILI3的生长曲线时发现:种子液培养18 h已经是对数期后期了,过早接种会使菌株的延滞期变长,超过18 h接种也会降低菌株的活力。从图3中可以看出,正常生长起来的菌株发酵16 h之后,当菌株的OD562值超过50之后,开始积累4-HIL。在48 h进入稳定期,OD562值在145左右进行波动。在48 h之前,4-HIL的产量只是在缓缓积累,主要能量还是提供给菌株的生长和Ile的积累,在48 h时4-HIL和Ile的产量分别34.69、113.74 mmol/L。当菌株进入稳定期之后,4-HIL的积累速度加快,分别在48~72 h以及84~96 h,4-HIL积累的速度最快。最终4-HIL的产量为242.18 mmol/L,Ile剩余47.33 mmol/L。L-异亮氨酸在发酵进行至96 h还有剩余,说明在发酵过程中IDO的活性不足以在短时间内将全部的Ile转化为4-HIL,所以后续将以增加IDO活性为目的进行研究实验。
2.2.2 菌株Δalr-ILI3溶氧水平改变对发酵生产4-HIL的影响
为了提高菌株Δalr-ILI3的生产效率,需要加强其IDO的活性。IDO是一种双加氧酶,它催化的反应会消耗O2并产生CO2,有研究表明进行两阶段溶氧的调节有助于4-HIL生产水平的提高[19]。在发酵进入到中期时,菌株在合成4-HIL时,需要消耗大量的O2,为了使反应正常进行,需要在4-HIL积累过程中提高发酵罐中的O2供给量,使反应能够顺利进行。针对Δalr-ILI3菌株的发酵情况:在发酵早期,较低的溶氧值会使菌株的生长变得缓慢,不利于Ile的积累和4-HIL的生产,而过高的溶氧值会使得菌株随着气泡附着在液面之上的发酵罐壁上,严重影响菌株的生长。所以在发酵初期选择20%溶氧,以便使菌株能够正常生长并且不会使大量菌株附着在发酵罐壁上。在发酵中期,随着菌株生物量生长至OD562值超过50以后,逐渐开始积累4-HIL,这时产生大量气泡。此时如果溶氧值不够会阻碍4-HIL的积累,溶氧值过高会发生喷罐。当溶氧值上升至35%时,气泡已经升至发酵罐顶层,所以为了提高试验的成功率和4-HIL产量,选择30%为提升后的溶氧值。综上所述,实验以Δalr-ILI3为发酵菌株,在菌株OD562值达到50以上时,将设定的溶氧值由20%提高至30%,发酵结果如图4所示。
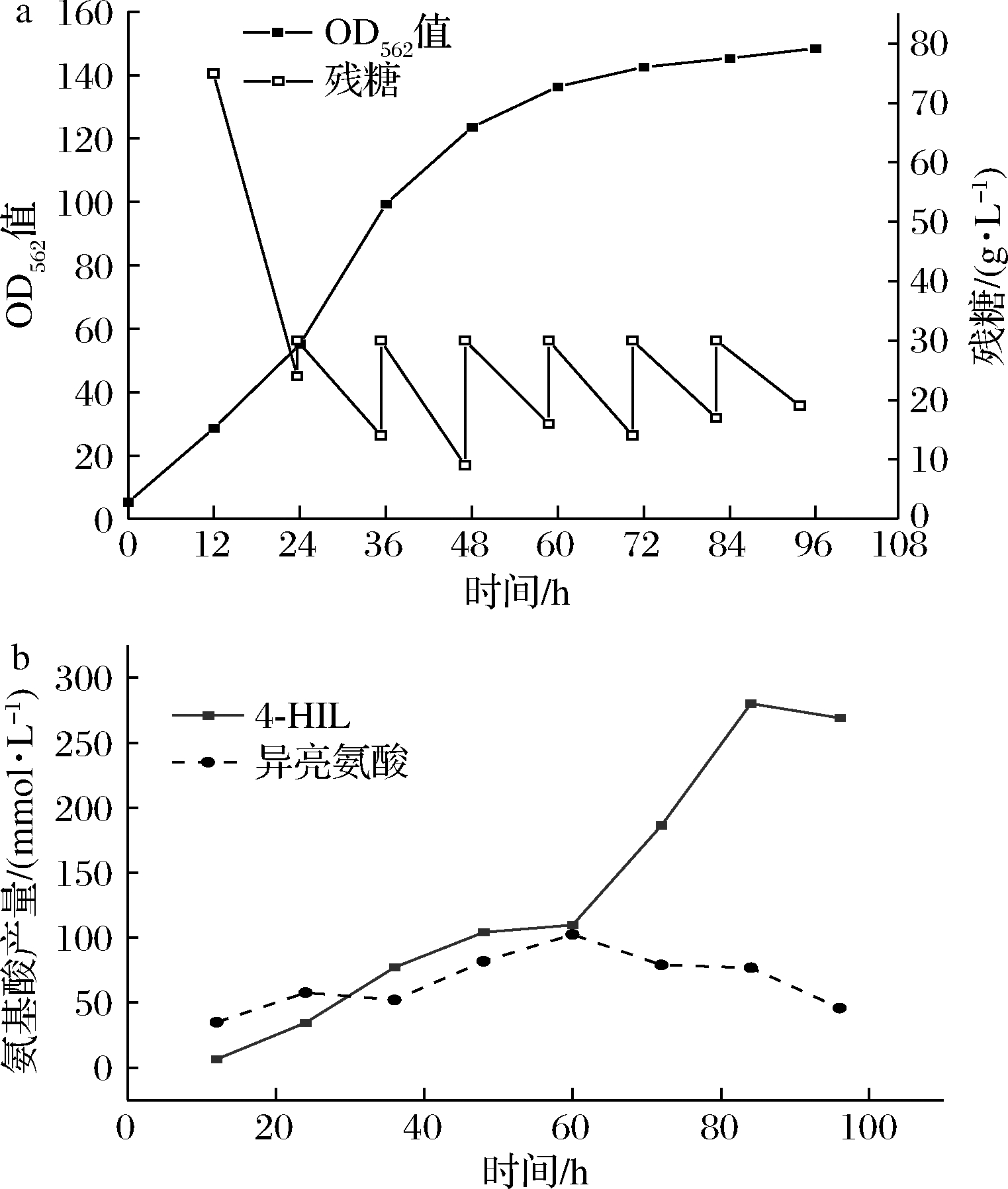
a-菌株生长和残糖情况;b-菌株氨基酸产量
图4 菌株Δalr-ILI3溶氧调节时上罐发酵的 生长和残糖以及氨基酸产量
Fig.4 Fermentation of strain Δalr-ILI3 with adjusted dissolved oxygen in 2 L fermenters
从图4可以看出,在溶氧改变之后,菌株的生长速率相较于图2的溶氧值恒定的菌株基本没有变化,发酵结束时,OD562值为148.45,最终生物量也没有提高。发酵96 h时,4-HIL产量达到269.20 mmol/L,相较于未优化前,4-HIL产量提高了11.2%。Ile产量在发酵终点有42.18 mmol/L,虽然还是有较多的Ile没有转化成4-HIL,但是根据4-HIL产量可以说明,溶氧值的提高有助于Ile向4-HIL的转化。
2.2.3 菌株Δalr-ILI3补料改变对发酵生产4-HIL的影响
在上罐发酵过程中,之前的补料都是添加单一的葡萄糖浓缩液,为了进一步增加上罐发酵过程中菌株的活力,使用初始培养基中的葡萄糖、硫酸铵、玉米浆、磷酸二氢钾、无水硫酸镁、酵母粉、维生素B1、甜菜碱组成混合溶液,配成8倍浓缩液进行补料。发酵结果如图5所示。

a-生长和残糖;b-氨基酸产量
图5 菌株Δalr-ILI3补料调节时上罐发酵的生长和 残糖以及氨基酸产量
Fig.5 Fermentation of strain Δalr-ILI3 when changing feed supplement in 2 L fermenters
从图5可以看出,在改变补料后,菌株的生物量总量有了增长,最大OD562值可达到167.3。发酵96 h时,4-HIL的产量可达到324.72 mmol/L,相较于未用该方法优化前,产量又提高了20.6%,相比于2.2.1产量则提高了34.1%,并且Ile的产量也有了提高。这也是目前报道的由葡萄糖从头合成4-HIL的最高产量。根据4-HIL产量可以说明,在谷氨酸棒杆菌生产4-HIL的上罐过程中不仅仅补加葡萄糖溶液,也补加微生物发酵所需的其他成分可以增加4-HIL的产量,延长菌株的活力。
3 结论
本研究为了提高谷氨酸棒杆菌生产4-HIL的应用能力和发酵水平,首先在菌株SN01中敲除丙氨酸消旋酶编码基因alr,并向敲除菌中转入表达alr基因和ido基因的质粒进行回补,回补菌株Δalr/p4-ido在生长速率和糖耗方面和未敲除菌株基本相同,且在发酵时无需添加抗生素就可以维持质粒稳定存在和4-HIL合成,因此能够代替抗生素作为筛选标记。其次结合菌株发酵特点,进行发酵罐上的发酵条件优化。当种子在种子培养基中生长到18 h,进行接种,这时种子活力最高,能够生产4-HIL 242.18 mmol/L,Ile 47.33 mmol/L;在菌株OD562值超过50时将发酵罐的溶氧值由20%调节为30%,这时4-HIL的产量可以达到269.20 mmol/L。最后调整了补料方法,进行初始培养基浓缩液补料之后,4-HIL的产量达到了324.72 mmol/L,相比未优化前提高了34.1%。此前,实验室TAN等通过对L-异亮氨酸生物传感器Lrp-PbrnFE中的PbrnFE启动子进行改造和筛选,利用不同的PbrnFE启动子动态调控ido的表达,同时动态调节α-酮戊二酸(α-ketoglutarate,α-KG)和氧气的供应,摇瓶上4-HIL产量达到最高,为(135.34±12.55) mmol/L[20]。张成林等[21]通过代谢工程改造增加了4-HIL原料的供应,同时通过动态调控来实现α-KG的动态供应,成功地改善了4-HIL的合成。最终菌株HIL18摇瓶水平4-HIL产量为42.13 mmol/L,7.5 L罐发酵4-HIL产量达到232.38 mmol/L。之后通过发酵优化使4-HIL的产量达到了263.27 mmol/L[19]。所以,本文章结果也是目前报道的谷氨酸棒杆菌发酵生产4-HIL的最高产量。该方法为提高4-HIL的合成效率提供了参考。
[1] FOWDEN L, PRATT H M, SMITH A.4-Hydroxyisoleucine from seed of Trigonella foenum-graecum[J].Phytochemistry, 1973, 12(7):1 707-1 711.
[2] LI Y Z, TENG D, SHI X G, et al.Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association:National cross sectional study[J].British Medical Journal, 2020, 369:m997.
[3] ZAFAR M I, GAO F.4-Hydroxyisoleucine:A potential new treatment for Type 2 diabetes mellitus[J].BioDrugs, 2016, 30(4):255-262.
[4] 高峰, 蔡琴, 蔡伦, 等.4-羟基异亮氨酸的研究现状[J].医药导报, 2014, 33(10):1 261-1 264.
GAO F, CAI Q, CAI L, et al.Research update on 4-hydroxyisoleucine[J].Herald of Medicine, 2014, 33(10):1 261-1 264.
[5] BROCA C, MANTEGHETTI M, GROSS R, et al.4-Hydroxyisoleucine:Effects of synthetic and natural analogues on insulin secretion[J].European Journal of Pharmacology, 2000, 390(3):339-345.
[6] WANG Q, OUAZZANI J, SASAKI N A, et al.A practical synthesis of (2S, 3R, 4S)-4-hydroxyisoleucine, a potent insulinotropic α-amino acid from fenugreek[J].European Journal of Organic Chemistry, 2002, 2002(5):834-839.
[7] KODERA T, SMIRNOV S V, SAMSONOVA N N, et al.A novel l-isoleucine hydroxylating enzyme, l-isoleucine dioxygenase from Bacillus thuringiensis, produces (2S, 3R, 4S)-4-hydroxyisoleucine[J].Biochemical and Biophysical Research Communications, 2009, 390(3):506-510.
[8] OGAWA J, KODERA T, SMIRNOV S V, et al.A novel L-isoleucine metabolism in Bacillus thuringiensis generating (2S, 3R, 4S)-4-hydroxyisoleucine, a potential insulinotropic and anti-obesity amino acid[J].Applied Microbiology and Biotechnology, 2011, 89(6):1 929-1 938.
[9] SHI F, NIU T F, FANG H M.4-Hydroxyisoleucine production of recombinant Corynebacterium glutamicum ssp.lactofermentum under optimal corn steep liquor limitation[J].Applied Microbiology and Biotechnology, 2015, 99(9):3 851-3 863.
[10] 张舒萍. 增强谷氨酸棒杆菌中底物供应及ido表达提高4-羟基异亮氨酸产量[D].无锡:江南大学, 2019.
ZHANG S P.Enhancement of substrates supply and ido expression in Corynebacterium glutamicum ssp.lactofermentum to improve the production of 4-hydroxyisoleucine[D].Wuxi:Jiangnan University, 2019.
[11] GOH S, GOOD L.Plasmid selection in Escherichia coli using an endogenous essential gene marker[J].BMC Biotechnology, 2008, 8(1):61.
[12] DAVISON J.Genetic exchange between bacteria in the environment[J].Plasmid, 1999, 42(2):73-91.
[13] BANEYX F.Recombinant protein expression in Escherichia coli[J].Current Opinion in Biotechnology, 1999, 10(5):411-421.
[14] STRYCH U, PENLAND R L, JIMENEZ M, et al.Characterization of the alanine racemases from two Mycobacteria[J].FEMS Microbiology Letters 2001, 196(2):93-98.
[15] ALEXANDER F W, SANDMEIER E, MEHTA P K, et al.Evolutionary relationships among pyridoxal-5'-phosphate-dependent enzymes-regio-spcific alpha-family, beta-family, and gamma-family[J].European Journal of Biochemistry, 1994, 219(3):953-960.
[16] 胡瑾瑜. 谷氨酸棒状杆菌基因敲除和表达系统的构建及其应用[D].无锡:江南大学, 2015.
HU J Y.Construction of the gene deletion and expression system in Corynebacterium glutamicum and their application[D].Wuxi:Jiangnan University, 2015.
[17] HU J, LI Y, ZHANG H, et al.Construction of a novel expression system for use in Corynebacterium glutamicum[J].Plasmid, 2014, 75:18-26.
[18] ZHANG Y C, LIU Y D, ZHANG S Y, et al.Metabolic engineering of Corynebacterium glutamicum WM001 to improve L-isoleucine production[J].Biochemistry and Molecular Biology, 2021, 3:568-584.
[19] 孟静, 芦楠, 朱福周, 等.两阶段溶氧控制及FeSO4添加对谷氨酸棒杆菌合成4-羟基异亮氨酸的影响[J].食品与发酵工业, 2019, 45, 1-6.
MENG J, LU N, ZHU F Z, et al.Effects of two-stage DO control and FeSO4 addition on 4-hydroxyisoleucine production by Corynebacterium glutamicum[J].Food and Fermentation Industries, 2019, 45(12):1-6.
[20] TAN S Y, SHI F, LIU H Y, et al.Dynamic control of 4?hydroxyisoleucine biosynthesis by modified L-isoleucine biosensor in recombinant Corynebacterium glutamicum [J].ACS Synthetic Biology, 2020, 9(9):2 378-2 389.
[21] ZHANG C L, LI Y, MA J, et al.High production of 4-hydroxyisoleucine in Corynebacterium glutamicum by multistep metabolic engineering[J].Metabolic Engineering, 2018, 49(5):287-298.