大多数食品是多组分共存的复杂体系,食品结构化所必需的蛋白质、脂质和碳水化合物等生物大分子是食品复杂体系重要组成成分,对食品加工有重要影响[1]。富含蛋白质、碳水化合物等营养基质的食品在生产加工和流通等环节极易受到致病或腐败微生物污染,既影响营养价值,还可能产生潜在生物毒素[2]。传统热处理杀菌可对热敏性营养成分、生物活性物质及食品色香味等产生不利影响,使用人工合成防腐剂常存在潜在“三致”危害。因此,在保证食品安全的前提下,使用安全、高效和新颖的抗菌保鲜剂尽可能保留食品原有风味和新鲜度是食品抗菌保鲜领域的研究焦点。食源性致病菌和腐败菌是指在食品加工和流通过程被污染的致病和腐败微生物总称,以大肠菌群和金黄色葡萄球菌为主[3]。抗菌肽因具有抗菌谱广、稳定性好、特异性强、毒副作用少且不易产生耐药性等优点,可作为食源性致病菌和腐败菌的新型抗菌剂和食品保鲜剂[4]。前期研究发现,金属抗菌肽SIF4对大肠杆菌和金黄色葡萄球菌有较好的抑菌活性[5-6],在食品内外部因素变化过程中有较好的稳定性,具有较好的生物相容性[7],但SIF4在复杂食品体系中的抑菌稳定性(antimicrobial stability,AMS)尚不明确。以金黄色葡萄球菌为指示菌,本试验系统研究SIF4在模拟单/多组分食品体系中抑菌活性变化规律,以期为SIF4在复杂食品体系抗菌保鲜中的应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌(Staphylococcus aureus),菌种保藏中心;金属抗菌肽SIF4,课题组制备[5],对S.aureus最小抑菌浓度(minimum inhibitory concentration, MIC)为0.2×10-3 g/L;牛乳清蛋白[(bovine whey protein,BWP,蛋白质含量为(91.34±1.17)%],新西兰恒天然公司;大豆分离蛋白[(soy protein isolate,SPI,蛋白质含量为(92.25±0.96)%],山东御馨生物科技;花生分离蛋白[(peanut protein isolate,PPI,蛋白质含量为(40.68±1.26)%],课题组用碱溶酸沉法从脱脂冷榨花生粕中提取[8];菜籽油(rapeseed oil, RO),道道全;花生油(peanut oil, PO),山东鲁花;大豆油(soybean oil, SO),益海嘉里;大米淀粉(rice starch, RS),Sigma-Aldrich;马铃薯淀粉(potato starch, PS)、玉米淀粉(corn starch, CS),上海源叶生物科技;食品级Tween-80,江苏茂亨化工有限公司;其他试剂为国产分析纯。
1.2 实验方法
1.2.1 相对抑菌活性测定
取活化的S.aureus接种至牛肉膏蛋白胨液体培养中,37 ℃、120 r/min振荡培养至对数生长期。准确吸取0.1 mL菌液(约6×108 CFU/mL)均匀涂布于牛肉膏蛋白胨培养基表面,将灭菌牛津杯置于培养皿中并加入供试品0.1 mL,4 ℃放置2 h使试液充分扩散至琼脂层,37 ℃静置培养24 h,测定抑菌圈直径(cm)并计算相对抑菌活性[7],抑菌稳定性用相对抑菌活性表示。相对抑菌活性的计算如公式(1)所示:
相对抑菌活性![]()
(1)
1.2.2 在模拟单组分食品体系中抑菌稳定性
1.2.2.1 在模拟蛋白质体系中的抑菌稳定性
准确称取BWP、SPI和PPI于水溶液中,室温下500 r/min磁力搅1 h,配制0%~5%(质量分数)的模拟蛋白质体系。取SIF4加入到模拟蛋白质体系中(终浓度为2×MIC),混匀后静置60 min,5 000 r/min离心2 min,取上清液与S.aureus等体积混合并测定相对抑菌活性。
1.2.2.2 在模拟脂质体系中的抑菌稳定性
准确移取适量RO、PO和SO于水溶液中,加入1%(体积分数)的Tween-80,10 000 r/min乳化均质3次(均质30 s间隔1 min)制备0%~5%(体积分数)的模拟脂质体系。取SIF4加入到模拟脂质体系中(终浓度为2×MIC),混匀后静置60 min,5 000 r/min离心2 min,取上清液与S.aureus等体积混合并测定相对抑菌活性。
1.2.2.3 在模拟淀粉体系中的抑菌稳定性
准确称取RS、PS和CS于0.5%的NaCl溶液中并搅匀,用0.1 mol/L NaOH调节pH至8.0[9],煮沸2 min使溶液澄清,制备0%~5%(质量分数)的模拟淀粉体系。取SIF4加入到模拟淀粉体系中(终浓度为2×MIC),混匀后静置60 min,5 000 r/min离心2 min,取上清液与S.aureus等体积混合并测定相对抑菌活性。
1.2.3 在模拟双组分食品体系中抑菌稳定性
1.2.3.1 在模拟蛋白质-脂质体系中抑菌稳定性
参考仝面换[10]和ALZAGTAT[11]的方法并进行修改。分别配制3%(质量分数)BWP、SPI和PPI溶液,以蛋白质质量为基准,按油脂和蛋白质质量比为0.5∶1、1∶1和2∶1 分别加入RO、PO和SO,并加入1% Tween-80作乳化稳定剂,10 000 r/min乳化均质3次制备蛋白质-脂质体系;取SIF4加入到模拟蛋白质-脂质体系中(终浓度为2×MIC),混匀后静置60 min,5 000 r/min 离心2 min,取上清液与S.aureus等体积混合并测定相对抑菌活性。
1.2.3.2 在模拟淀粉-蛋白质体系中抑菌稳定性
参考王玥[12]和COLOMBO等[13]方法并进行修改。分别配制3%(质量分数)的RS、PS和CS溶液(含0.5% NaCl),用0.1 mol/L NaOH调节pH为8.0,煮沸2 min,冷却至室温后添加1.5、3、6 g的BWP、SPI和PPI,搅匀制成淀粉和蛋白质质量比为2∶1、1∶1和1∶2的淀粉-蛋白质体系;取SIF4加入到模拟淀粉-蛋白质体系中(终浓度为2×MIC),混匀后静置60 min,5 000 r/min离心2 min,取上清液与S.aureus等体积混合并测定相对抑菌活性。
1.2.3.3 在模拟淀粉-脂质体系中抑菌稳定性
参考LU等[14]和QIN等[15]方法并修改。分别配制3%(质量分数)的RS、PS和CS溶液(含0.5% NaCl),用0.1 mol/L NaOH调节pH为8.0,煮沸2 min并冷却至室温;以淀粉质量(g)为基准,按油脂和淀粉质量比为0.5∶1、1∶1和2∶1分别加入RO、PO和SO并加入1% Tween-80作乳化稳定剂,10 000 r/min乳化均质3次制得淀粉-脂质体系;取SIF4加入到模拟淀粉-脂质体系中(终浓度为2×MIC),混匀后静置60 min,5 000 r/min离心2 min,取上清液与S.aureus等体积混合并测定相对抑菌活性。
1.2.4 在模拟3组分食品体系中抑菌稳定性
参考WANG等[16]方法并修改。分别配制3%(质量分数)RS、PS和CS溶液(含0.5% NaCl),用0.1 mol/L NaOH调节pH为8.0,煮沸2 min并冷却至室温;按油脂和淀粉质量比为1∶1分别加入RO、PO和SO并加入1% Tween-80作乳化稳定剂,10 000 r/min乳化均质3次(均质30 s间隔1 min)制得淀粉-脂质体系;按蛋白质、淀粉、脂质质量比为1∶1∶1分别加入SPI、PPI和BWP,搅匀后得到蛋白质-淀粉-脂质体系。取SIF4加入到蛋白质-淀粉-脂质体系中使终浓度为2×MIC,混匀后静置60 min,5 000 r/min离心2 min,取上清液与S.aureus等体积混合并测定相对抑菌活性。
1.2.5 试验数据处理
试验结果以平均值±标准偏差![]() 表示,仅进行试验组与对照组均数差异多重比较,显著性水平α=0.05。采用SPSS 25.0进行组内均数差异多重比较,方差齐性时采用最小显著性差异法,非齐性时使用塔姆黑尼T2方法。
表示,仅进行试验组与对照组均数差异多重比较,显著性水平α=0.05。采用SPSS 25.0进行组内均数差异多重比较,方差齐性时采用最小显著性差异法,非齐性时使用塔姆黑尼T2方法。
2 结果与分析
2.1 在模拟单组分食品体系中的抑菌稳定性
2.1.1 在模拟蛋白质体系中的抑菌稳定性
蛋白质是食品重要的结构化分子和营养基质,SIF4在模拟蛋白质体系中抑菌稳定性如图1所示。
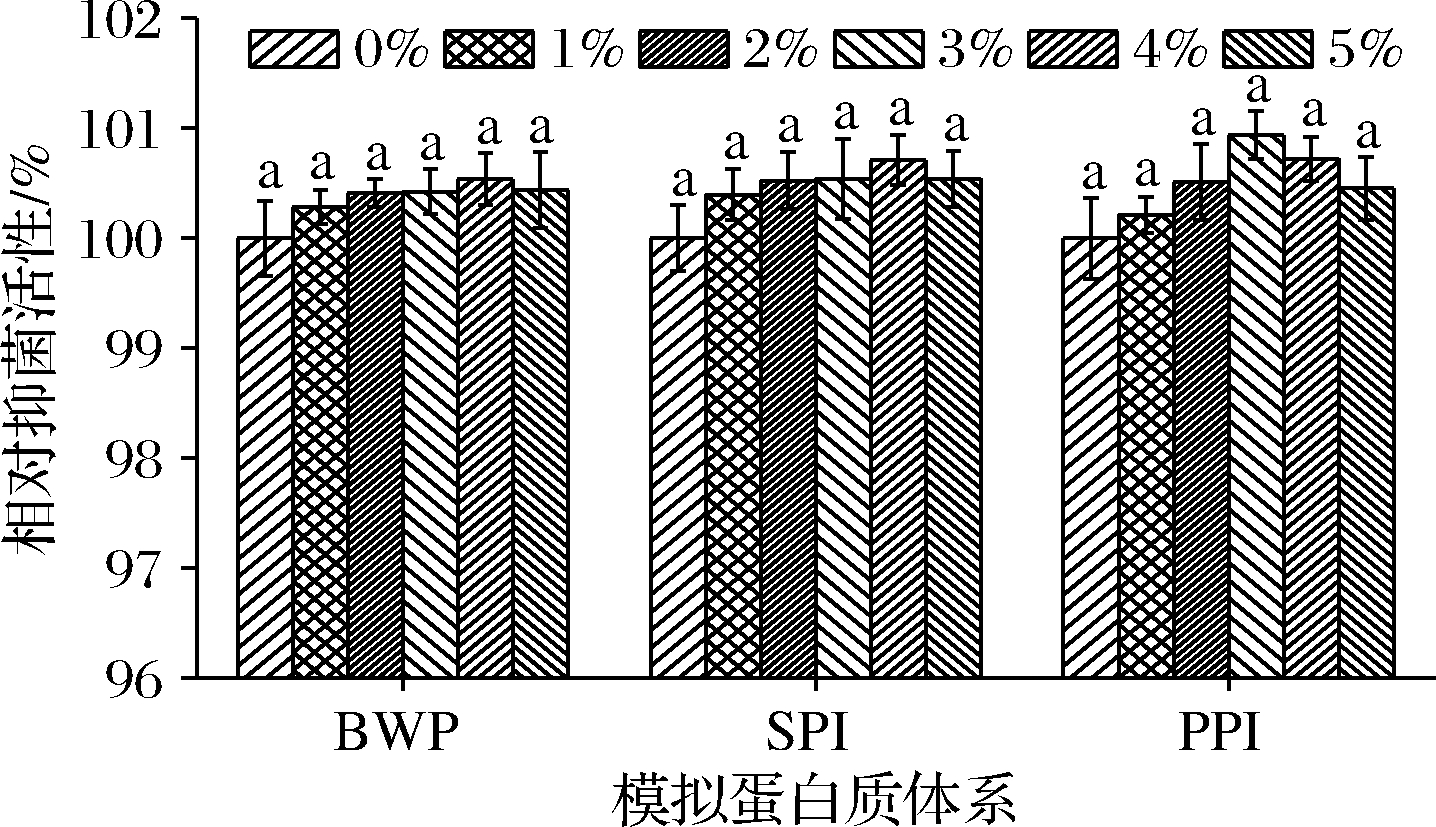
图1 在模拟蛋白质体系中的抑菌稳定性
Fig.1 AMS in simulated protein system
注:相同小写字母表示差异不显著(P>0.05)(下同)
由图1可知,金属抗菌肽SIF4在模拟BWP、SPI、PPI体系中具有较好的抑菌稳定性,试验组与对照组均无显著差异(P>0.05),由此可见,金属抗菌肽SIF4可用于BWP、SPI、PPI等为基质的蛋白质食品体系的抗菌保鲜。
2.1.2 在模拟脂质食品体系中的抑菌稳定性
脂质是食品重要的结构化分子,与食品物性、风味和稳定性有重要关系,SIF4在模拟脂质体系中的抑菌稳定性如图2所示。
由图2可知,在1%模拟RO体系中,SIF4相对抑菌活性与对照组无显著差异(P>0.05),在2%~5%模拟RO体系中,试验组抑菌活性显著增强(P<0.05),可能与RO本身有一定抗菌活性有关[17],SIF4与菜籽油在抗菌活性发挥过程中有协同增强作用,一定范围内,抗菌活性与剂量呈正相关关系。在模拟PO和SO体系中,试验组抑菌活性均显著高于对照组(P<0.05)。由此可见,模拟脂质体系可增强SIF4抑菌活性。在脂质体系中能保持较好抑菌活性,可能与脂质本身对致病与腐败微生物具有一定抑制活性有关[18],SIF4与脂质协同作用更加增强了其在食品体系中的抑菌活性和稳定性,可应用于含脂质乳化食品(如蛋糕、冰淇淋等)的抗菌保鲜。
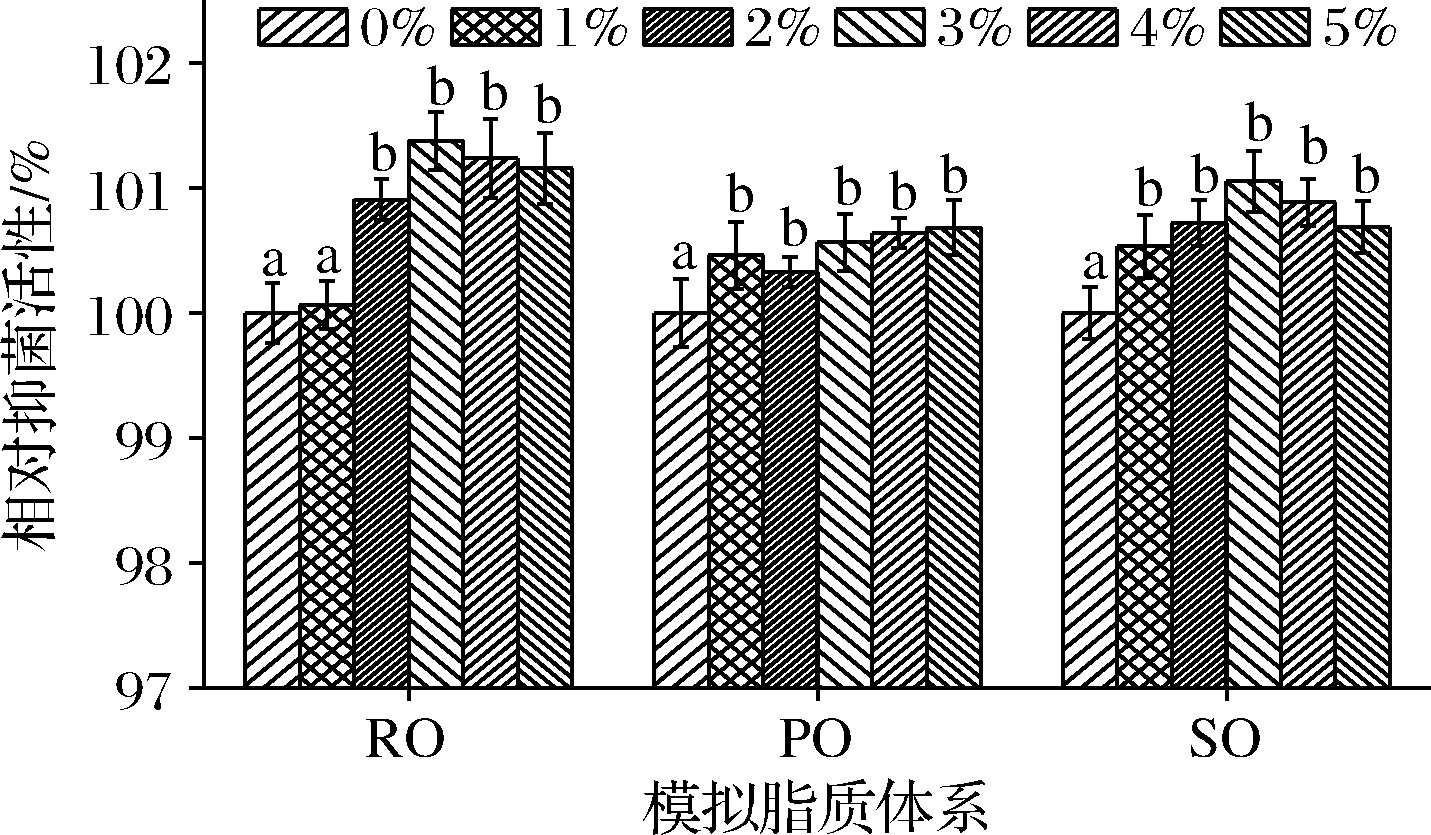
图2 在模拟脂质体系中的抑菌稳定性
Fig.2 AMS in simulated lipid system
注:不同小写字母表示差异显著(P<0.05)(下同)
2.1.3 在模拟淀粉食品体系中的抑菌稳定性
淀粉是食品加工重要的原料和结构化分子,SIF4在模拟淀粉体系中抑菌稳定性如图3所示。
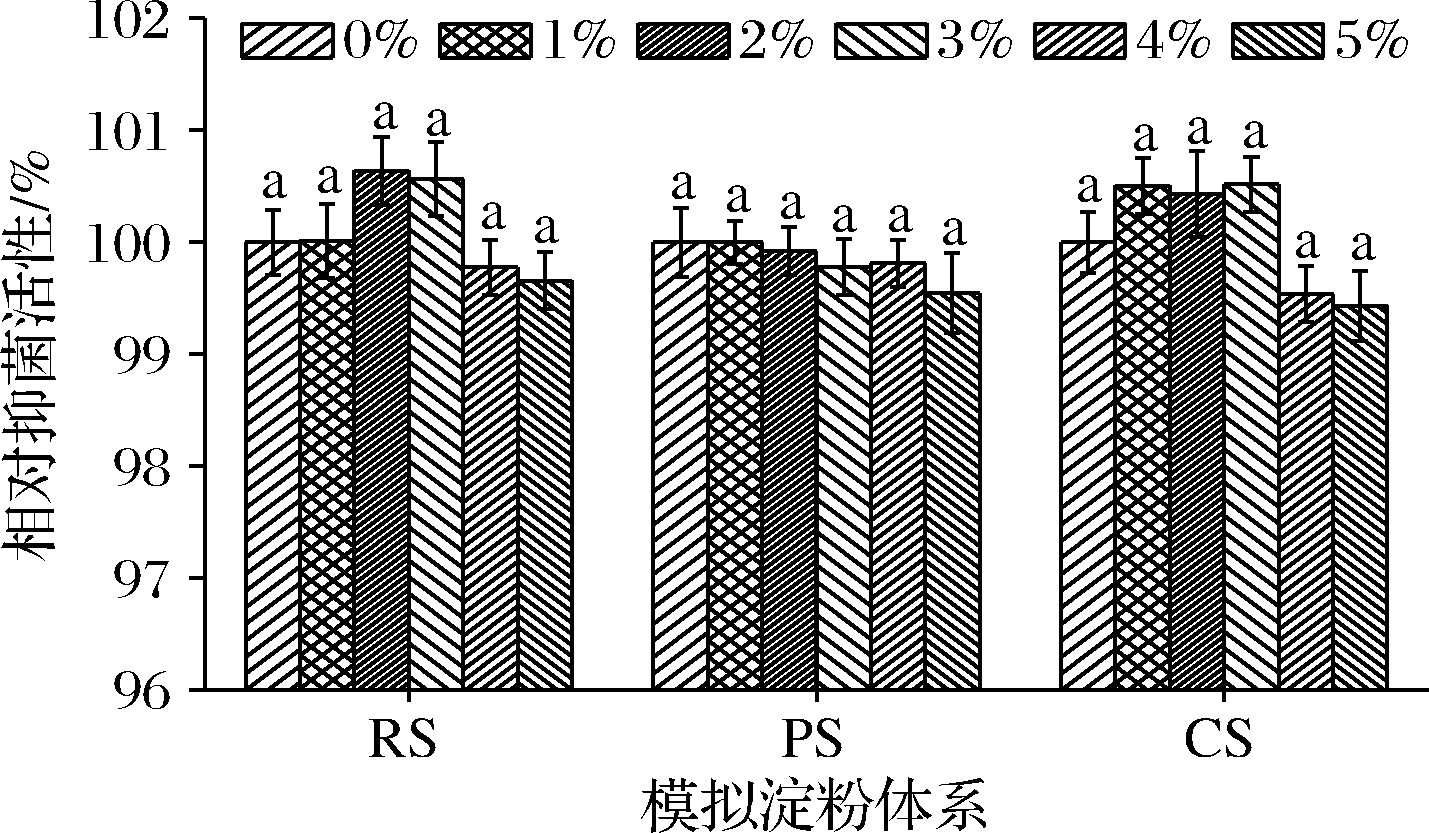
图3 在模拟淀粉体系中的抑菌稳定性
Fig.3 AMS in simulated starch system
由图3可知,在RS、PS和CS模拟体系中,各试验组与对照组抑菌稳定性均无显著差异(P>0.05),表明各模拟淀粉体系对SIF4抑菌活性无明显影响,SIF4可用于含大米淀粉、马铃薯淀粉和玉米淀粉等淀粉的各类食品的抗菌与保鲜。
2.2 在模拟双组分食品体系中的抑菌稳定性
2.2.1 在模拟蛋白质-脂质体系中的抑菌稳定性
蛋白质-脂质体系是食品常见且重要的加工体系,SIF4在该模拟体系中抑菌稳定性如图4所示。
由图4可知,在以BWP为基质的BWP-RO体系中,SIF4抑菌活性在BWP和RO质量比为 0.5∶1和1∶1的体系中得到显著增强(P<0.05),可能与该体系中RO比例相对较高以及RO本身具备一定抑菌活性有关,SIF4和RO协助作用增强了抑菌效果[17];在BWP-SO体系中,试验组抑菌活性与对照组无显著差异(P>0.05),而在BWP-PO体系中,试验组抑菌稳定性显著增强于对照组(P<0.05);在以SPI为基质的SPI-RO体系中,SPI与RO质量比为0.5∶1和1∶1时,试验组相对抑菌活性显著高于对照组(P<0.05),SPI-SO和SPI-PO体系试验组抑菌活性均显著高于对照组(P<0.05);在以PPI为基质的PPI-RO体系中,PPI与RO质量比为0.5∶1和1∶1时,试验组相对抑菌活性显著高于对照组(P<0.05),当PPI和O质量为比2∶1时,试验组相对抑菌活性与对照组无显著差异(P>0.05),表明该体系中脂质过低时,对SIF4抑菌活性的增强作用减弱;对PPI-SO和PPI-PO体系来说,当两者质量比为0.5∶1时,试验组相对抑菌活性与对照组均无显著差异(P>0.05),当两者质量比为1∶1或2∶1时,试验组相对抑菌活性与对照组相比得到显著增强(P<0.05)。由此可见,SIF4在不同蛋白质-脂质体系中可维持较好的抑菌稳定性或得到不同程度强化,表明SIF4可用于蛋白质-脂质构成的如蛋糕、冰淇淋等食品体系[11]的抗菌与保鲜。

图4 在蛋白质-脂质中的抑菌稳定性
Fig.4 AMS in simulated protein-lipid system
2.2.2 在模拟淀粉-蛋白质体系中的稳定性
淀粉-蛋白质复合物是一种重要的食品体系,常通过静电、范德华力、氢键、疏水作用等形成混合体系,主要为静电作用力和疏水作用力。SIF4在该模拟体系中抑菌稳定性如图5所示。
由图5可知,在以RS为基质的RS-BWP体系中,试验组相对抑菌活性与对照组无显著差异(P>0.05),在RS-SPI和RS-PPI体系中,两者质量比为1∶1 或1∶2时,试验组相对抑菌活性与对照组均有显著差异(P<0.05),说明该体系中蛋白质组分相对较多时,相对抑菌活性可得到不同程度增强[19];在以PS为基质的PS-BWP、PS-SPI和PS-PPI体系中,试验组相对抑菌活性与对照组相比稍有降低,但没有达到显著性差异(P>0.05),试验组相对抑菌活性稍有降低,可能是由于马铃薯淀粉富含磷酸基团,减弱阳离子抗菌肽SIF4与细胞壁带负电荷脂多糖结合或与细胞壁某特定负电荷区域结合力[6];在以CS为基质的CS-BWP、CS-SPI和CS-PPI体系中,试验组相对抑菌活性与对照组均无显著差异(P>0.05)。试验结果表明,SIF4可用于大米淀粉、马铃薯淀粉和玉米淀粉等为基质的淀粉-蛋白质体系食品的抗菌保鲜。
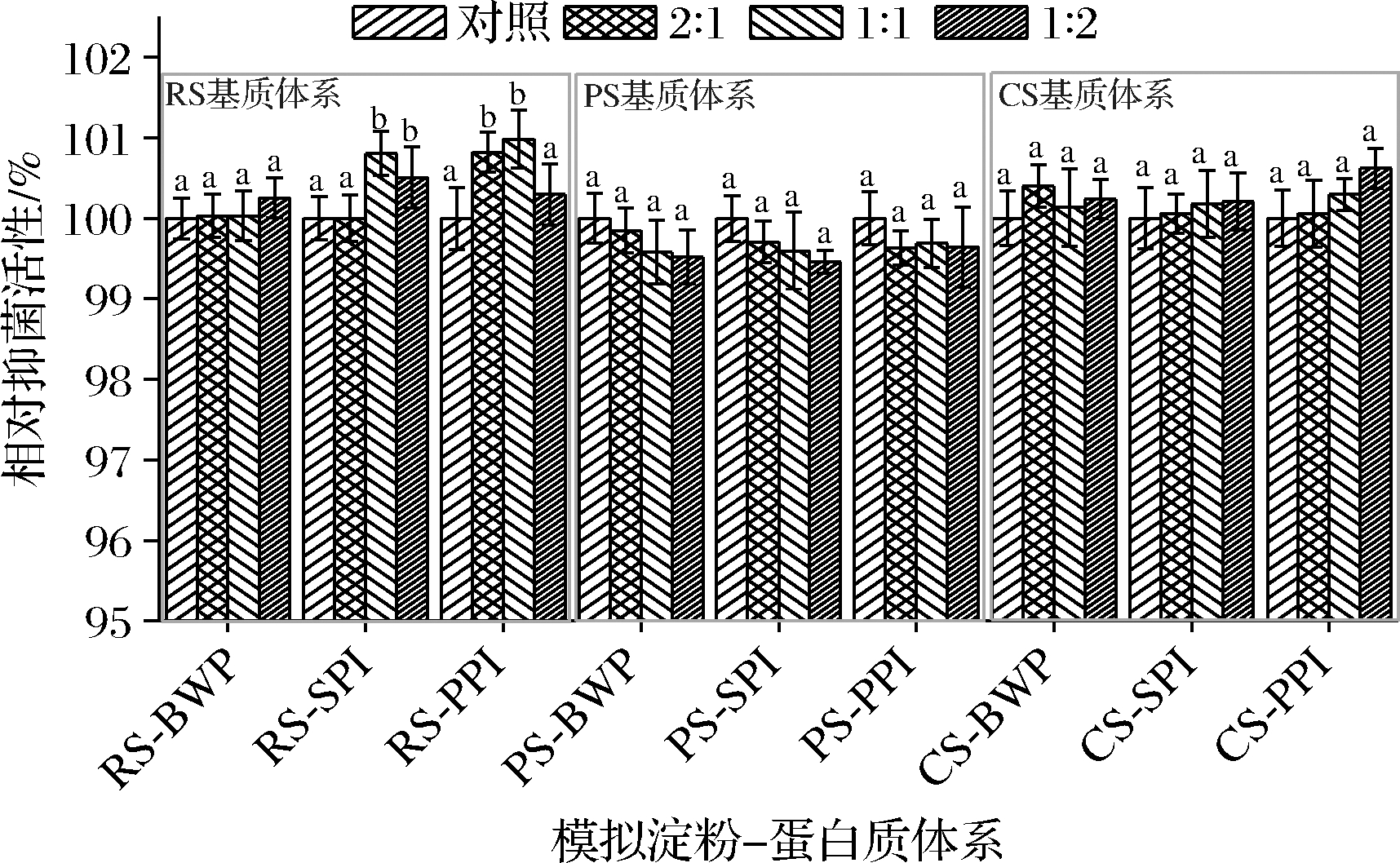
图5 在淀粉-蛋白质中的抑菌稳定性
Fig.5 AMS in simulated starch-protein system
2.2.3 在模拟淀粉-脂质体系中的稳定性
淀粉-脂质复合物常存在于天然淀粉或形成于食品加工过程,SIF4在该模拟体系中的抑菌活性变化如图6所示。
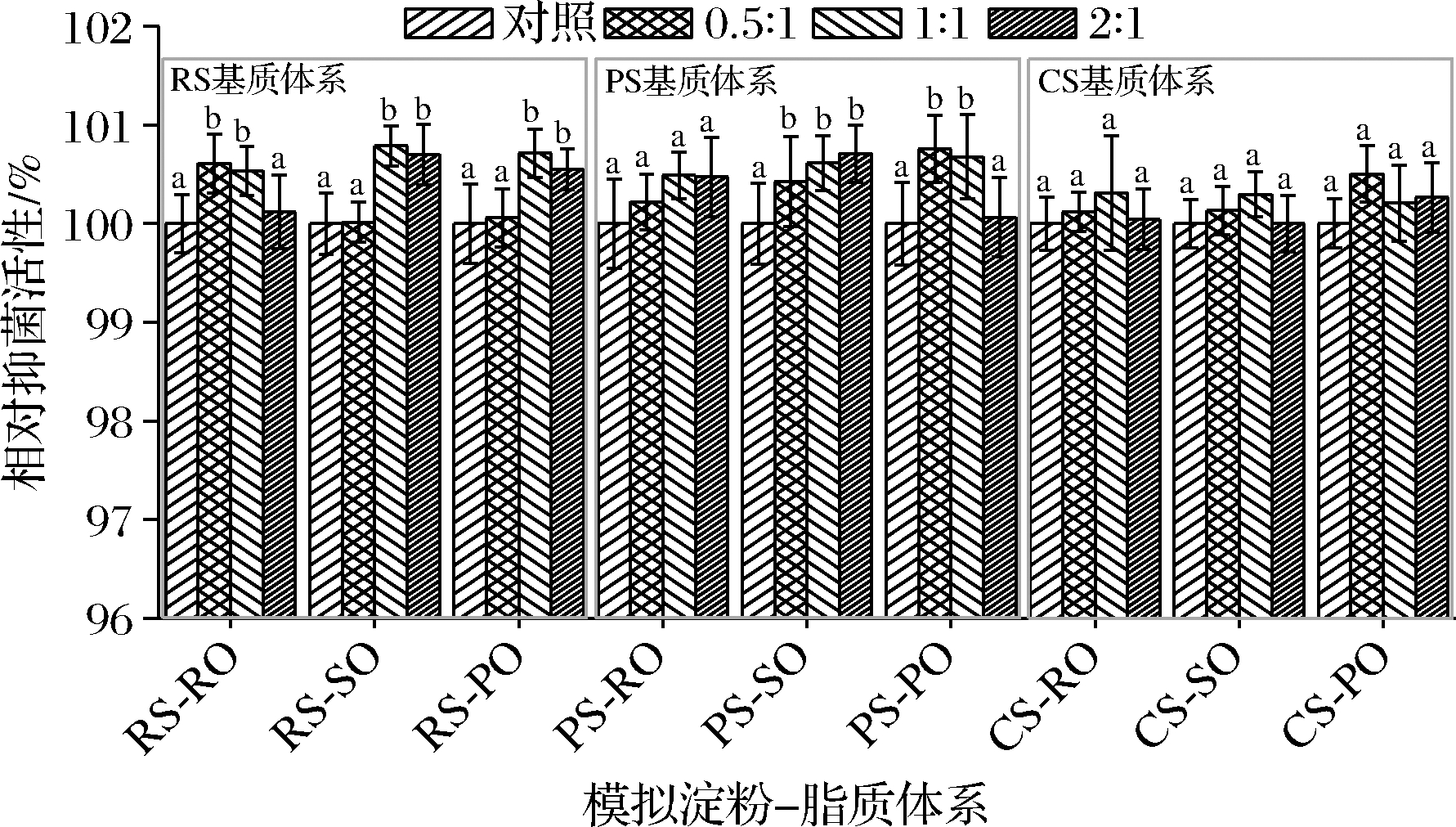
图6 在淀粉-脂质中的抑菌稳定性
Fig.6 AMS in simulated starch-lipid system
由图6可知,在以RS为基质的RS-RO体系中,两者质量比为0.5∶1和1∶1时,试验组相对抑菌活性显著高于对照组(P<0.05),在RS-SO和RS-PO体系中,两者质量比为1∶1或2∶1时,试验组相对抑菌活性显著高于对照组(P<0.05);在以PS为基质的PS-RO体系中,试验组与对照组均无显著差异(P>0.05),在PS-SO体系中,试验组相对抑菌活性均显著高于对照组(P<0.05),而在PS-PO体系中,两者质量比为0.5∶1和1∶1时,试验组相对抑菌活性显著高于对照组(P<0.05);在以CS为基质的CS-RO、CS-SO和CS-PO体系中,试验组与对照组均无显著差异(P>0.05)。由此可见,SIF4在不同淀粉-脂质体系中可维持较好的抑菌稳定性或得到不同程度强化,具备在淀粉-脂质食品体系抗菌保鲜中应用的潜在可行性。脂质主要与淀粉中直链淀粉络合[15],NAVARRO等[20]研究发现,葵花籽油可促进玉米直链淀粉溶出且有助于淀粉-脂质复合物形成。通常脂类脂肪链插入直链淀粉螺旋内部空腔,脂肪酸羧基或甘油的甘油基部分仍暴露在螺旋外部[19],在脂质或脂肪酸等配体存在下,发生构象变化形成具有亲水性表面和疏水性内螺旋孔道的左手单螺旋结构的淀粉-脂质复合物[21],温和碱性条件有助于淀粉-脂质复合体形成[22]。
2.3 在模拟3组分食品体系中的抑菌稳定性
SIF4在构建的模拟3组分食品体系中的相对抑菌活性变化如图7所示。

a-BWP基质;b-SPI基质;c-PPI基质
图7 模拟3组分体系中的抑菌稳定性
Fig.7 AMS in simulated triple-component system
由图7可知,各蛋白质为基质构成的3组分模拟食品体系中,试验组与对照组相对抑菌活性均无显著差异(P>0.05),由此可以说明,SIF4可广泛应用于各类蛋白质-淀粉-脂质体系中,在复杂食品体系中具有较好的应用基础[19]。
3 结论
食品是典型的复杂软物质体系,食品中蛋白质、淀粉和脂质等结构化分子或分子间互作对食品物性、风味及食品安全等可产生重要影响[19]。SIF4作为一种新型金属抗菌肽,对大肠杆菌和金黄色葡萄球菌等典型致病与腐败细菌有较好抑菌活性[5-6],但其在复杂食品体系中的抑菌稳定性这一科学问题仍需解决。本试验构建了以蛋白质、脂质和淀粉为基质的模拟食品单/多组分体系,研究了SIF4在这些模拟食品体系中的抑菌活性的变化规律,研究发现,在模拟蛋白质和淀粉单组分食品体系中,SIF4抑菌活性与对照组无显著性变化(P>0.05),模拟PO和SO脂质体系处理对SIF4抑菌活性无显著影响(P>0.05),而模拟RO体系可对SIF4抑菌活性可起到不同程序的强化,2%~5%模拟RO体系可显著增强抑菌活性(P<0.05);在模拟蛋白质-脂质双组分食品体系中,SIF4可维持较好的抑菌稳定性或被不同程度增强;在模拟淀粉-蛋白质双组分食品体系中,PS基质体系和CS基质体系对抑菌活性无显著性影响(P>0.05),而在RS淀粉基质体系中,SIF4可保持较好抑菌稳定性或得到增强;在模拟淀粉-脂质双组分食品体系中,CS基质体系对抑菌活性无显著性影响(P>0.05),而RS基质和PS基质体系则表现为对抑菌活性无显著性影响(P>0.05)或不同程度增强(P<0.05);在构建的蛋白质-脂质-淀粉3组分体系中,试验组与对照组均无显著性差异(P>0.05),表明SIF4在构建的模拟3组分食品体系中具有较好的抑菌稳定性。
[1] PARADA J, SANTOS J L.Interactions between starch, lipids, and proteins in foods:Microstructure control for glycemic response modulation[J].Critical Reviews in Food Science and Nutrition, 2016, 56(14):2 362-2 369.
[2] JAMALI S N, ASSADPOUR E, FENG J G, et al.Natural antimicrobial-loaded nanoemulsions for the control of food spoilage/pathogenic microorganisms[J].Advances in Colloid and Interface Science, 2021, 295:102504.
[3] MENG D M, SUN S N, SHI L Y, et al.Application of antimicrobial peptide mytichitin-CB in pork preservation during cold storage[J].Food Control, 2021, 125:108041.
[4] BETEMARIAM K.The preservative efficacy of antimicrobial proteins and metabolites from microorganisms, animals and plants as potential alternative to chemical food preservation:A review[J].Food Science and Quality Management, 2019, 187:34-54.
[5] 肖怀秋, 李玉珍, 林亲录, 等.花生肽亚铁胃肠仿生消化产物对金黄色葡萄球菌的抑菌机理[J].食品与发酵工业, 2020, 46(18):111-116.
XIAO H Q, LI Y Z, LIN Q L, et al.Antibacterial mechanism of gastrointestinal biomimetic digestants from peanut peptide-ferrous on Staphylococcus aureus[J].Food and Fermentation Industries, 2020,46(18):111-116.
[6] 肖怀秋, 李玉珍, 林亲录, 等.金属抗菌肽SIF4对大肠杆菌的抑菌机制研究[J].食品与发酵工业, 2022, 48(1):111-116.
XIAO H Q, LI Y Z, LIN Q L,et al.Antimicrobial mechanism of metal antimicrobial peptide SIF4 against Escherichia coli[J].Food and Fermentation Industries, 2022,48(1):111-116.
[7] 肖怀秋, 李玉珍, 林亲录, 等.食品内外部因素对金属抗菌肽SIF4抑菌活性影响及生物相容性分析[J/OL].食品与发酵工业, 2022.DOI:10.13995/ j.cnki.13911-11802/ts.029965.
XIAO H Q, LI Y Z, LIN Q L, et al.Effects of food internal and external factors on antimicrobial activity of metal antimicrobial peptide SIF4 and its biocompatibility[J/OL].Food and Fermentation Industries, 2022.DOI:10.13995/ j.cnki.13911-11802/ts.029965.
[8] 肖怀秋, 李玉珍, 林亲录, 等.响应面优化冷榨花生粕酶法制备多肽工艺的研究[J].中国粮油学报, 2013, 28(9):50-55.
XIAO H Q, LI Y Z, LIN Q L, et al.Response surface methodology optimization for peptide preparation from cold pressed peanut meal by enzymatic hydrolysis[J].Journal of the Chinese Cereals and Oils Association, 2013, 28(9):50-55.
[9] REDDY C K, CHOI S M, LEE D J, et al.Complex formation between starch and stearic acid:Effect of enzymatic debranching for starch[J].Food Chemistry, 2018, 244:136-142.
[10] 仝面换. 乳源蛋白质-植物油乳化体系的特性及在乳化肠中的应用研究[D].南京:南京农业大学, 2014.
TONG M H.Milk source of protein and vegetable oil and its application in emulsified sausages[D].Nanjing:Nanjing Agricultural university, 2014.
[11] ALZAGTAT A A.Effects of protein-lipid interactions on physiochemical and functional properties of food proteins[D].Montreal:McGill University, 2002.
[12] 王玥. 豌豆淀粉与酪蛋白复合物在水相体系中的相互作用及稳定性研究[D].哈尔滨:东北农业大学, 2017.
WANG Y.Studies on the interaction and stability of pea starch and casein complex in water system[D].Harbin:Northeast Agricultural University, 2017.
[13] COLOMBO A, LE N A E, RIBOTTA P D.Rheological and calorimetric properties of corn-, wheat-, and cassava- starches and soybean protein concentrate composites[J].Starch-Stärke, 2011, 63(2):83-95.
N A E, RIBOTTA P D.Rheological and calorimetric properties of corn-, wheat-, and cassava- starches and soybean protein concentrate composites[J].Starch-Stärke, 2011, 63(2):83-95.
[14] LU H, YANG Z, YU M T, et al.Characterization of complexes formed between debranched starch and fatty acids having different carbon chain lengths[J].International Journal of Biological Macromolecules, 2021, 167:595-604.
[15] QIN R B, YU J L, LI Y F, et al.Structural changes of starch-lipid complexes during postprocessing and their effect on in vitro enzymatic digestibility[J].Journal of Agricultural and Food Chemistry, 2019, 67(5):1 530-1 536.
[16] WANG S J, ZHENG M G,YU J L, et al.Insights into the formation and structures of starch-protein-lipid complexes[J].Journal of Agricultural and Food Chemistry, 2017,65(9):1 960-1 966.
[17] Al-AWADI S J, Al-AZAWE A I, GHREEB A M.Extraction and characterization of rapeseed oil (Brassca campestris) and it′s effected on microorganisms[J].Baghdad Science Journal, 2010, 7(3):1 105-1 112.
[18] BARBOSA L N, RALL V L M, FERNANDES A A H, et al.Essential oils against foodborne pathogens and spoilage bacteria in minced meat[J].Foodborne Pathogens and Disease, 2009, 6(6):725-728.
[19] WANG S J, CHAO C, CAI J J, et al.Starch-lipid and starch-lipid-protein complexes:A comprehensive review[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(3):1 056-1 079.
[20] NAVARRO A S, MARTINO M N, ZARITZKY N E.Modelling of rheological behaviour in starch-lipid systems[J].LWT, 1996, 29(7):632-639.
[21] CHENG W W, LUO Z G, LI L, et al.Preparation and characterization of debranched-starch/phosphatidylcholine inclusion complexes[J].Journal of Agricultural and Food Chemistry, 2015, 63(2):634-641.
[22] NIU B, CHAO C, CAI J J, et al.The effect of NaCl on the formation of starch-lipid complexes[J].Food Chemistry, 2019, 299:125133.