磷脂酰丝氨酸(phosphatidylserine, PS)是一种新资源食品[1],具有保护脑神经、修复脑损伤[2]、增强记忆力、改善阿尔茨海默病和儿童多动症[3-4]等功效。磷脂酶D(phospholipase D, PLD)可催化制备功能良好的单体磷脂及磷脂衍生物,通过其磷酸二酯酶活性使特定磷脂发生转酯反应生成PS等稀有物质,在食品及医药行业的应用中起着重要作用[5-6]。在食品工业中,PLD可对来源广泛的粗品磷脂(如大豆卵磷脂)进行转化和改性,提高其营养价值和使用性能;在医药行业中,PLD是脂质体药剂最为重要的辅料,一定程度决定着脂质体技术的发展水平。因此PLD具有极高的技术研究价值和广阔的市场应用前景。
PLD广泛存在于细菌、真菌、植物和脊椎动物中,链霉菌来源的PLD因比其他来源具有更高的转磷脂酰活力和更宽泛的底物专一性而成为近年来研究的热点[7-8]。链霉菌较高的酶分泌能力和较少的异源蛋白表达限制使其被广泛用于生产重要的工业酶和重组蛋白。作为PLD的天然宿主,链霉菌不仅在蛋白表达及活性保持方面存在优势,其产生的PLD能在水相中发生催化反应,可减少有机试剂的使用,开发工程菌株发酵原液生产体系。但从环境中筛选的野生链霉菌制备的PLD往往催化活性较低,分泌量远低于工业生产标准,同时分离提纯工艺复杂,成品纯度低、价格高,限制了PLD的应用[9-10]。因此获得高产PLD的菌株并提高其发酵产酶能力是解决这些问题的关键。实验室前期借助基因工程手段对链霉菌进行改造,筛选得到了1株高产PLD的重组菌株S-pMS02[11],对其进行了高产导向、活性保持等方向的研究,初步建立了一种基因工程霉菌制备PLD的方法。
为进一步提高该菌株发酵产酶的效率从而快速应用于工业生产,本研究从培养基成分、发酵条件、制备工艺3个方面对其进行了研究与优化,力图解决菌株在发酵制备PLD酶过程中的关键技术问题,降低工业化生产成本,推动PLD在新型功能性食品方面的创制和精准营养食品行业的发展。
1 材料与方法
1.1 材料与试剂
葡萄糖、果糖、麦芽糖、甘露醇、可溶性淀粉、牛肉膏、琼脂粉、硫酸铵、CaCl2、MgSO4·7H2O,国药集团化学试剂有限公司;胰蛋白胨、酵母提取物、酪蛋白氨基酸,OXOID公司;重组链霉菌S-pMS02,实验室保藏。
苯酚(分析纯)、TritonX-100(分析纯)、蛋黄卵磷脂,生工生物工程股份有限公司;胆碱氧化酶、BCA试剂盒,上海碧云天生物技术有限公司;过氧化氢酶,源叶生物。
1.2 仪器与设备
SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;FE20型pH计、ME104E电子天平,梅特勒-托利多仪器(上海)有限公司;ZQZY-78CN振荡培养箱,上海知楚仪器有限责任公司;CT15RE台式离心机,日本日立公司;Infine 200pro多功能微孔板检测仪,瑞士迪肯公司;NanoDrop One微量核酸蛋白浓度测定仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 培养基的配制
MS固体培养基:豆粕15 g,豆壳20 g,加水3 L煮3 h,纱布过滤,添加琼脂粉20 g,甘露醇20 g,pH自然。基础发酵培养基(g/L):葡萄糖10,(NH4)2SO4 3,K2HPO4·3H2O 3.4,NaH2PO4·2H2O 2.34,MgSO4·7H2O 0.6,酪蛋白氨基酸5。微量金属离子ZnSO4·7H2O、FeSO4·7H2O、MnCl2·4H2O、CaCl2均为0.001 g/L,pH自然。上述培养基均在115 ℃灭菌20 min。
1.3.2 菌株的发酵培养
取新鲜的孢子悬浮液接种于基础发酵培养基中,加入终质量浓度为50 μg/mL的安普霉素,用带凹槽的锥形瓶30 ℃,200 r/min培养7 d。
1.3.3 PLD的制备
将发酵液于4 ℃、6 500 r/min离心10 min,所得上清液即为粗酶液。将粗酶液于6 000 r/min、4 ℃离心30 min,取上清液用0.45 μm滤膜抽滤,边搅拌边缓慢加入硫酸铵粉末(65%,430 g/L),4 ℃静置过夜沉淀蛋白。待蛋白沉淀完全后,16 000 r/min、4 ℃离心30 min,取蛋白沉淀完全复溶于PBS中。12 000 r/min离心5 min去除复溶物中的固体杂质,取上清液备用。将上清液进一步超滤浓缩,6 000 r/min离心15 min,PBS洗脱,重复离心直至蛋白溶液接近无色透明。
1.3.4 菌体浓度测定
将发酵液于10 000 r/min离心10 min,取菌体用蒸馏水冲洗,重复上述离心2次,最终将菌体置于60 ℃ 烘箱烘至恒重,计算菌体质量浓度。
1.3.5 PLD酶活力测定
取卵磷脂0.1 g,加无水乙醇和蒸馏水各5 mL,冰浴振荡至乳液状。吸取200 μL于5 mL离心管中,加入0.04 mol/L Tris-HCl(pH 5.5)、0.01 mol/L CaCl2、1 g/L TritonX-100,37 ℃预热5 min,加入100 μL 待测酶液,立即置摇床中37 ℃,200 r/min反应10 min。加入200 μL 10 mmol EDTA、10 g/L 16-烷基-3-甲基氯化铵、0.1 mol/L Tris-HCl(pH 8.0)的反应终止液,置沸水浴5 min终止反应,冷却至室温。加入0.1 mol/L Tris-HCl(pH 8.0)3 mL(含有2 U胆碱氧化酶、2 U过氧化氢酶、4-氨基安替吡啉0.3 mg、苯酚1 mg),置摇床37 ℃,200 r/min反应20 min。反应后的混合液于500 nm处测吸光度,以氯化胆碱做标准曲线计算酶活力[12]。
1.3.6 发酵培养基成分优化
用基础发酵培养基进行培养,采用单因素对照试验,对发酵培养基各成分进行优化[13]。
碳源的优化:分别选取葡萄糖、果糖、麦芽糖、蔗糖、甘露醇和可溶性淀粉6种物质作为碳源配制发酵培养基,发酵培养后检测PLD酶活力和菌体质量浓度。
氮源的优化:分别选取牛肉膏、蛋白胨、硫酸铵、酪蛋白氨基酸、牛肉膏混合蛋白胨、硫酸铵混合酪蛋白氨基酸作为氮源配制发酵培养基,发酵培养后检测PLD酶活力和菌体质量浓度。
金属离子浓度的优化:设置不同质量浓度(0、0.5、1.0、1.5、2.0、2.5、3.0 g/L)的Mg2+、Ca2+,配制发酵培养基,发酵培养后检测PLD酶活力和菌体质量浓度。
1.3.7 菌株最佳发酵条件的确定
用改良后的培养基对菌株进行发酵培养,采用单因素对照试验依次对接种量、温度、时间及溶氧量进行优化实验,确定最佳发酵条件。
最佳接种量:将孢子按浓度为103、104、105、106、107个/mL的接种量分别接种至培养基中发酵培养,检测PLD酶活力和菌体质量浓度。
最佳培养温度:分别在26、28、30、32、34、36 ℃的温度下进行发酵培养,检测PLD酶活力和菌体质量浓度。
最佳发酵时间:分别在发酵培养的第3、4、5、6、7、8天取发酵液检测PLD酶活力和菌体质量浓度。
最佳溶氧量:分别设置使装液量为20、40、60、80、100 mL,透气型封口膜密封后发酵培养,检测PLD酶活力和菌体质量浓度。
1.3.8 发酵制备工艺优化
发酵过程中加入实验室自行设计的搅散工具,PLD制备过程中使用低温底座盛装样品管保持温度稳定[14]。随机选取16组不同发酵条件的样品,检测发酵制备工艺优化前后的PLD酶活力。
1.3.9 数据统计分析
所有实验均重复3次,计算标准偏差。实验数据采用GraghPad Prism 8软件进行绘图,制备工具采用AutoCAD软件进行绘图,采用SPSS软件进行统计学分析。图中以各组最高酶活力为100%,计算相对酶活力。
2 结果与分析
2.1 发酵培养基营养成分的研究
2.1.1 发酵培养基碳源、氮源的优化
不同微生物利用不同的营养成分,其种类对微生物发酵产酶存在一定的影响[15]。碳源在微生物生长过程中提供能源,氮源是组成核酸和蛋白质的重要元素,两者都是细胞合成的主要成分。按1.3.2所述方法发酵制备PLD时测得酶活力为16.2 U/mL,为提高菌株的发酵产酶效率,对培养基中碳、氮源进行优化,以各组最高酶活力为100%,计算相对酶活力,同时分析菌体浓度与酶活力的关系。碳源优化结果如图1-a所示,与原始碳源葡萄糖相比,甘露醇和可溶性淀粉发酵效果更好,酶活力最高为20.16 U/mL,增长了约27%。其中甘露醇产生的菌体量少,可减轻工业废料的处理,可溶性淀粉廉价易得,能在工业生产中降低成本,从经济适用角度考虑,选择可溶性淀粉为碳源进行后续实验。
氮源优化结果如图1-b所示,硫酸铵复合酪蛋白氨基酸作为氮源时酶活力最高,为20.28 U/mL,酪蛋白氨基酸作为单一氮源时相对酶活力为64%,高于牛肉膏、蛋白胨和硫酸铵。牛肉膏复合蛋白胨相对酶活力为71%,高于酪蛋白氨基酸,表明复合氮源中氨基酸、生长因子等成分配比更适合菌体生长产酶[16]。菌体浓度与酶活力呈同样趋势,因此采用硫酸铵复合酪蛋白氨基酸为氮源进行后续实验。
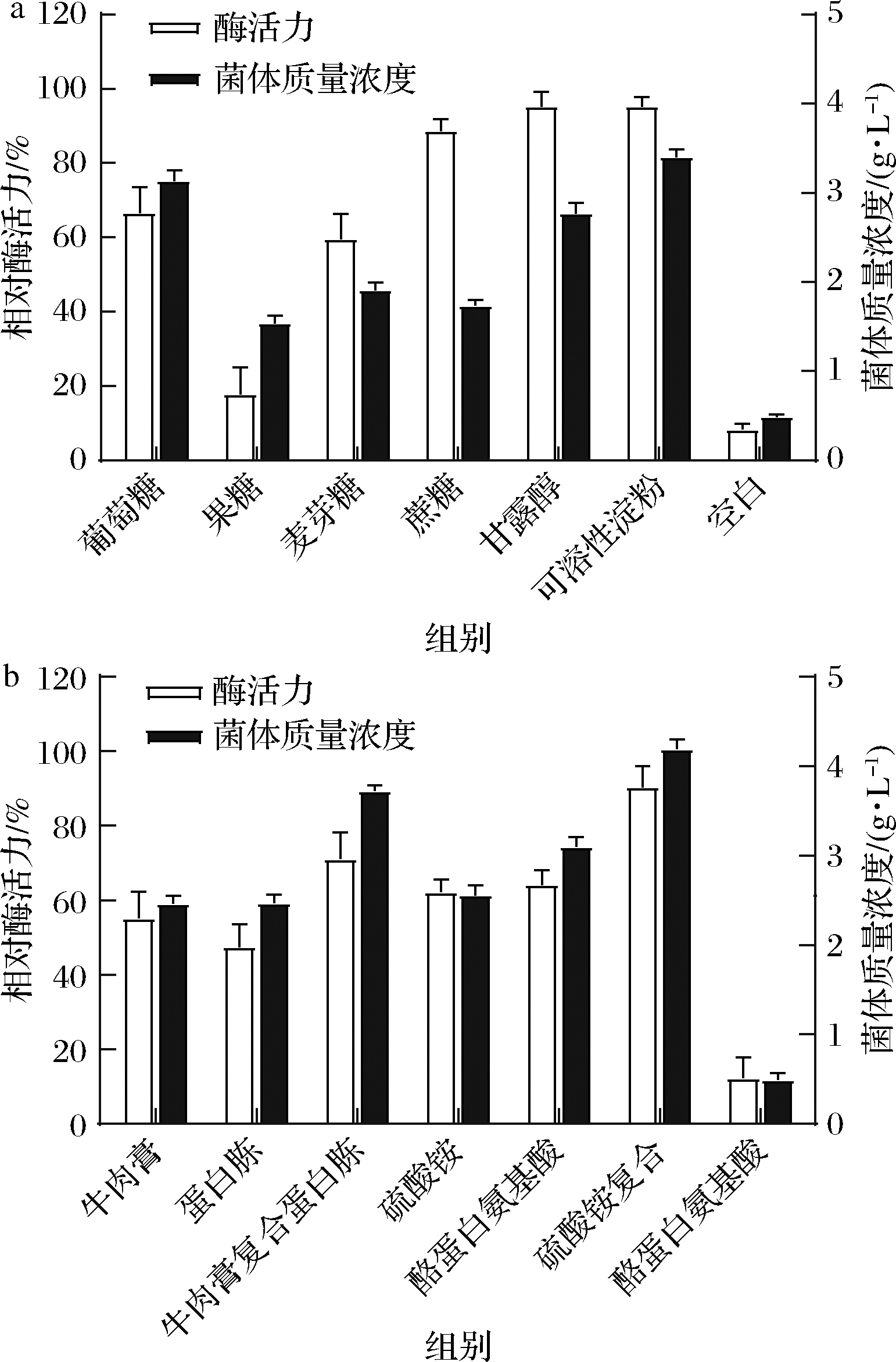
a-不同碳源;b-不同氮源
图1 培养基不同碳源、氮源对酶活力及菌体质量浓度的影响
Fig.1 Effects of different carbon and nitrogen sources on enzyme activity and cell concentration
2.1.2 金属离子含量对菌株发酵产PLD的影响
作为微生物生理活性物质的重要组成成分,金属离子在一定浓度下对微生物的生长和目的产物合成有促进作用。K+、Na+可维持细胞渗透压和胞内物质的稳定性,是培养基中不可缺少的[16]。在大肠杆菌和链霉菌结合转移实验中发现,Mg2+对实验结果影响较大,可能与链霉菌的代谢关系密切。另有研究表明Ca2+可作为一些酶的辅因子,对蛋白的产生、活力大小和稳定性都有一定的影响[17]。在前期PLD的酶学性质分析中发现Ca2+浓度为10 mmol/L时有助于酶活性的提高,一般作为金属离子助剂参与酶活力检测。但Ca2+对链霉菌发酵生长的影响仍未可知,通过改变发酵培养基中Mg2+和Ca2+的含量,探究金属离子对链霉菌发酵产PLD的影响。
Mg2+对菌株发酵产酶的影响如图2-a所示,发酵液中PLD的酶活力随着培养基中Mg2+浓度的增加而逐渐升高,Mg2+质量浓度1.5 g/L时PLD酶活力达到最高,较优化前(Mg2+质量浓度0.6 g/L)PLD产酶活力提高了约40%。可见Mg2+对菌株发酵培养有促进作用,适当的添加有助于提高产酶效率。Ca2+对菌株发酵产酶的影响如图2-b所示,当Ca2+含量为0时酶活力最高,随着浓度增加酶活力水平逐渐下降。含量为0.5~1.5 g/L时,相对酶活力约为85%,质量浓度超过1.5 g/L后,酶活力发生剧烈下降,当添加量为3 g/L时,相对酶活力仅为11%。观察发现Ca2+质量浓度为1.5 g/L时发酵培养基中开始产生钙盐沉淀,从而影响了后续发酵。可见Ca2+对菌株发酵培养呈抑制作用,在发酵过程中应避免添加。
2.2 菌株发酵条件研究
2.2.1 接种量对菌株发酵产PLD的影响
采用不同浓度的孢子接种,结果如图3所示,孢子浓度在105个/mL时,PLD活力到达临界点,此时酶活力水平最高,在临界点之前,酶活力随孢子浓度的增加而上升,在临界点之后,酶活力水平保持恒定不再增高。因此在发酵接种时,孢子浓度应≥105个/mL。

a-Mg2+;b-Ca2+
图2 培养基中Mg2+、Ca2+含量对酶活力的影响
Fig.2 Effect of Mg2+and Ca2+content in culture medium on enzyme activity
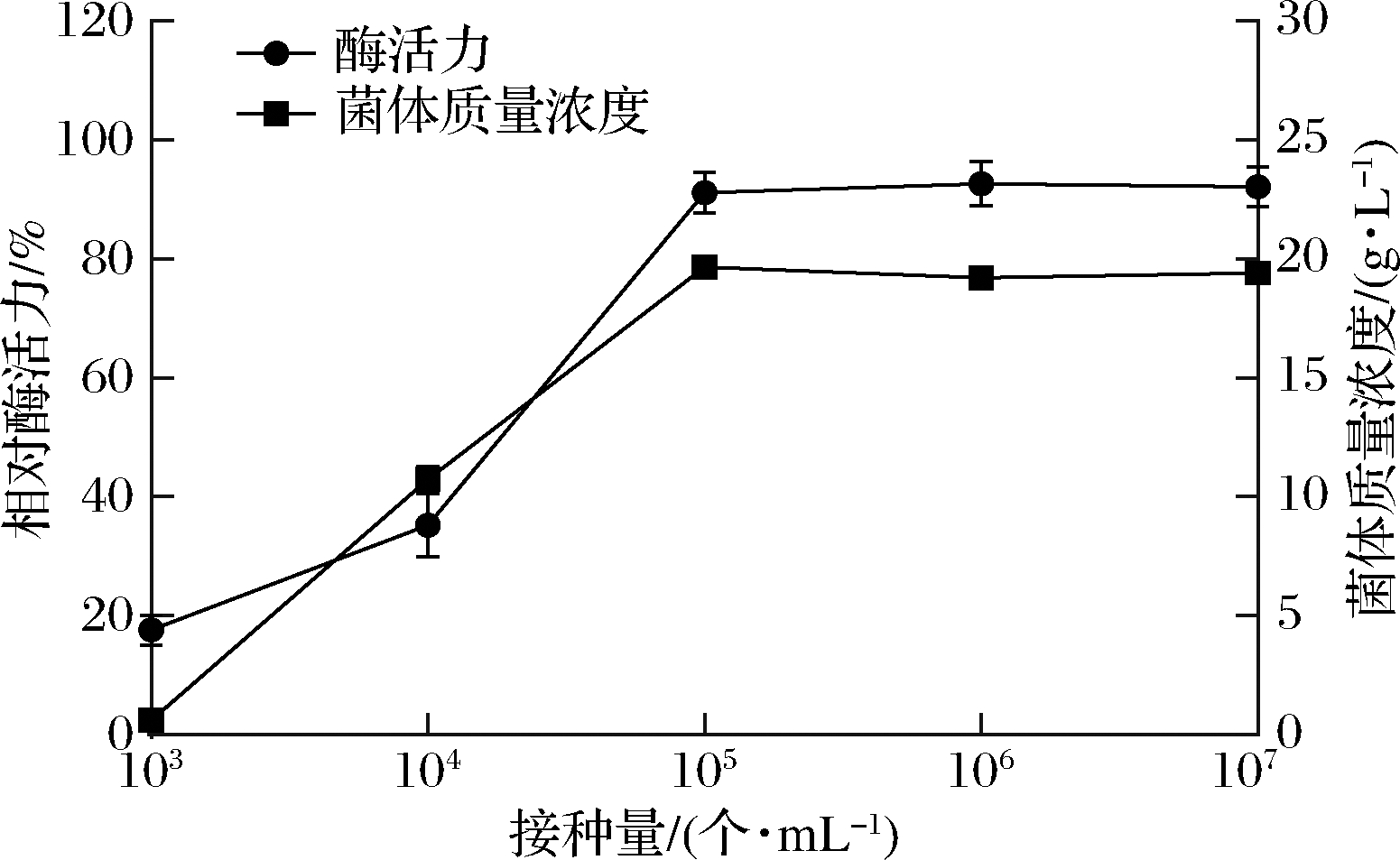
图3 接种孢子浓度对酶活力及菌体浓度的影响
Fig.3 Effect of inoculated spore concentration on enzyme activity and cell concentration
2.2.2 培养温度对菌株发酵产PLD的影响
不同发酵温度下,接种新鲜孢子发酵培养7 d检测酶活力和菌体浓度。实验结果如图4所示,发酵温度为32 ℃时,酶活力最高22.68 U/mL,此时的菌体浓度也最大。与原始发酵条件中30 ℃的培养温度相比,酶活力水平提高了20%以上。因此,菌株发酵产PLD的最佳培养温度为32 ℃。
2.2.3 发酵时间对菌株发酵产PLD的影响
发酵时间的优化对于工业化生产成本控制较为关键,基于产业化考虑,缩短发酵时间可节约生产成本,带来更大的经济效益。接种新鲜孢子至发酵培养基中32 ℃培养,检测不同发酵时间的酶活力水平和菌体浓度,结果如图5所示,在第6天时发酵液的PLD活力达到最高25.56 U/mL,之后逐渐下降。菌体浓度也呈现类似的变化趋势。因此,可缩短发酵时间为6 d。
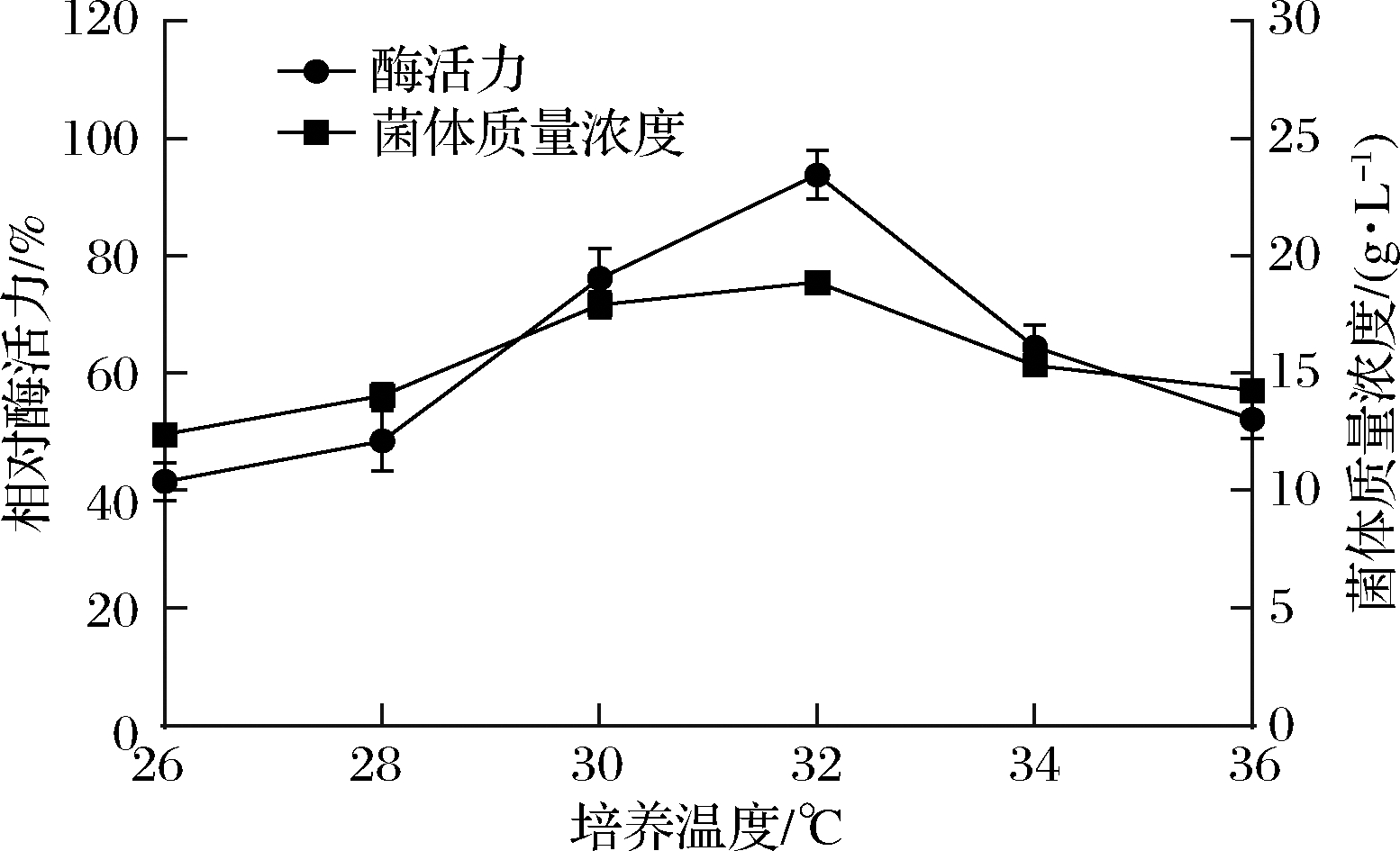
图4 发酵温度对酶活力及菌体浓度的影响
Fig.4 Effect of fermentation temperature on enzyme activity and cell concentration
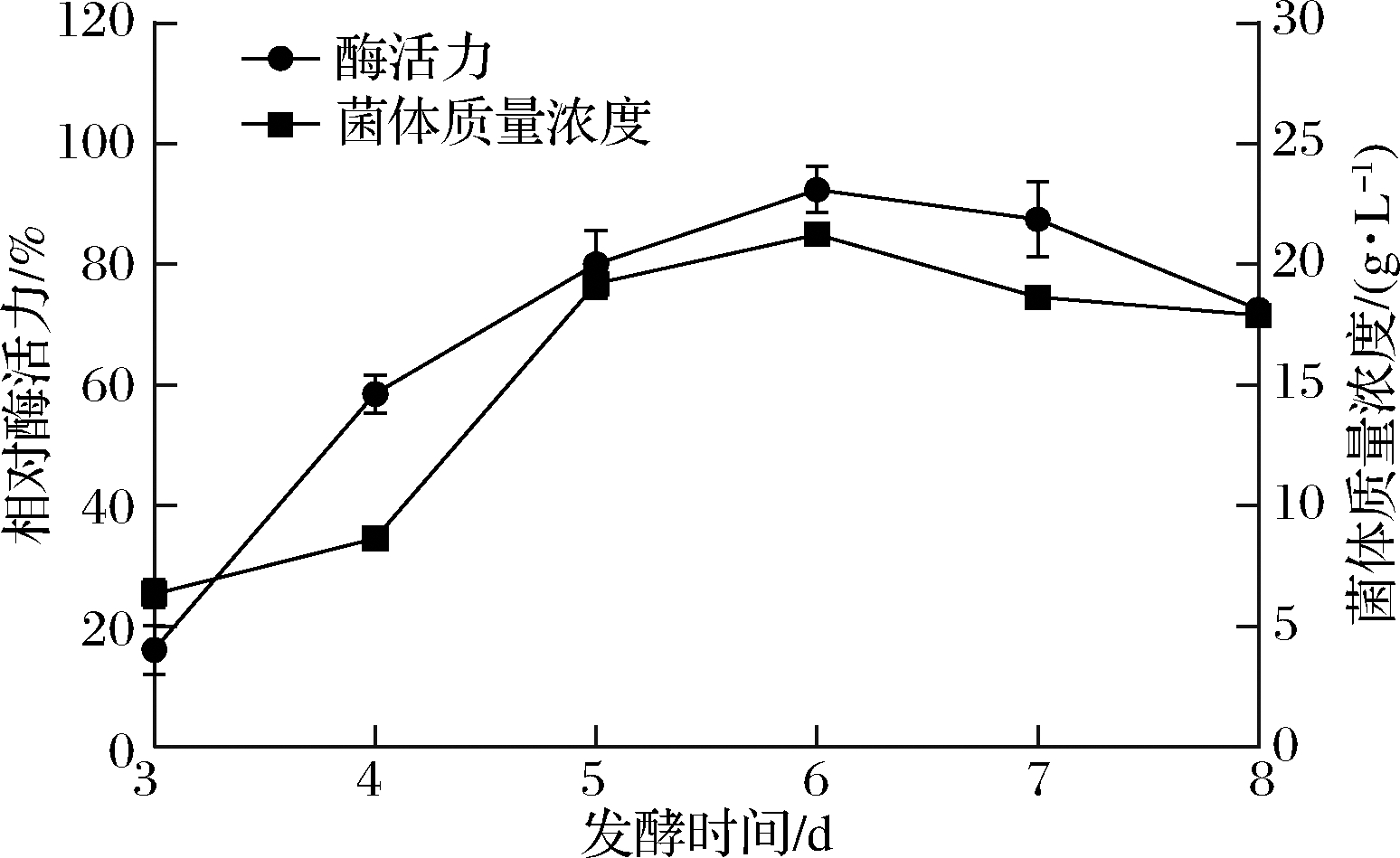
图5 发酵时间对酶活及菌体浓度的影响
Fig.5 Effect of fermentation time on enzyme activity and cell concentration
2.2.4 溶氧量对菌株发酵产PLD的影响
在发酵培养过程中,250 mL的凹槽摇瓶在正常情况下的装液量为100 mL。为进一步放大发酵工艺提供研究基础,设计实验使装液量在100 mL的基础上一次递减,并使用透气型封口膜密封。图6显示在菌溶氧量增大的情况下,酶活力也相应增高。装液量为20 mL时,可能因可利用的营养物质过少而导致酶活力减小。因此,当使用250 mL的凹槽摇瓶进行发酵培养时,装液量设置40 mL较为合适。
2.3 发酵制备工艺对PLD活力的影响
2.3.1 菌株发酵过程中加入剪切工具对酶活力的影响
链霉菌基内菌丝分枝较多且不断裂,在发酵时会产生链状的菌丝体并与菌核交织缠绕成菌丝球[18]。菌丝球的包裹性严重影响目的蛋白的分泌,因此发酵过程中对菌丝球的充分搅散和物理剪切至关重要。除了使用凹槽摇瓶外,另加入自制的剪切工具。如图7-a所示,该工具为三角镖结构,3个镖腿为等长移液器枪头,中心部分为圆形凸起。可进行高温高压灭菌,在发酵第3天时加入能有效进行菌丝体的搅散剪切。

图6 培养基装液量对酶活力及菌体浓度的影响
Fig.6 Effect of medium volume on enzyme activity and cell concentration
2.3.2 PLD制备过程中使用冰冻保温装置对酶活力的影响
PLD制备过程中,多次离心和蛋白沉淀操作会使酶活力逐渐降低。为减少最终的酶活力损失,使用自制的冰冻保温装置进行样品处理。如图7-b所示,该装置包括隔温托盘和冰盒两部分,冰盒为金属材质的立方体结构,从顶面向底面凹陷形成若干个离心管放置孔,隔温托盘为隔热泡沫材质,可套在金属放置架底部。分离纯化过程中,将样品管放入冰冻保温座中保持低温,较传统的冰浴保温时间更长且避免冰水混合物对样品的污染。
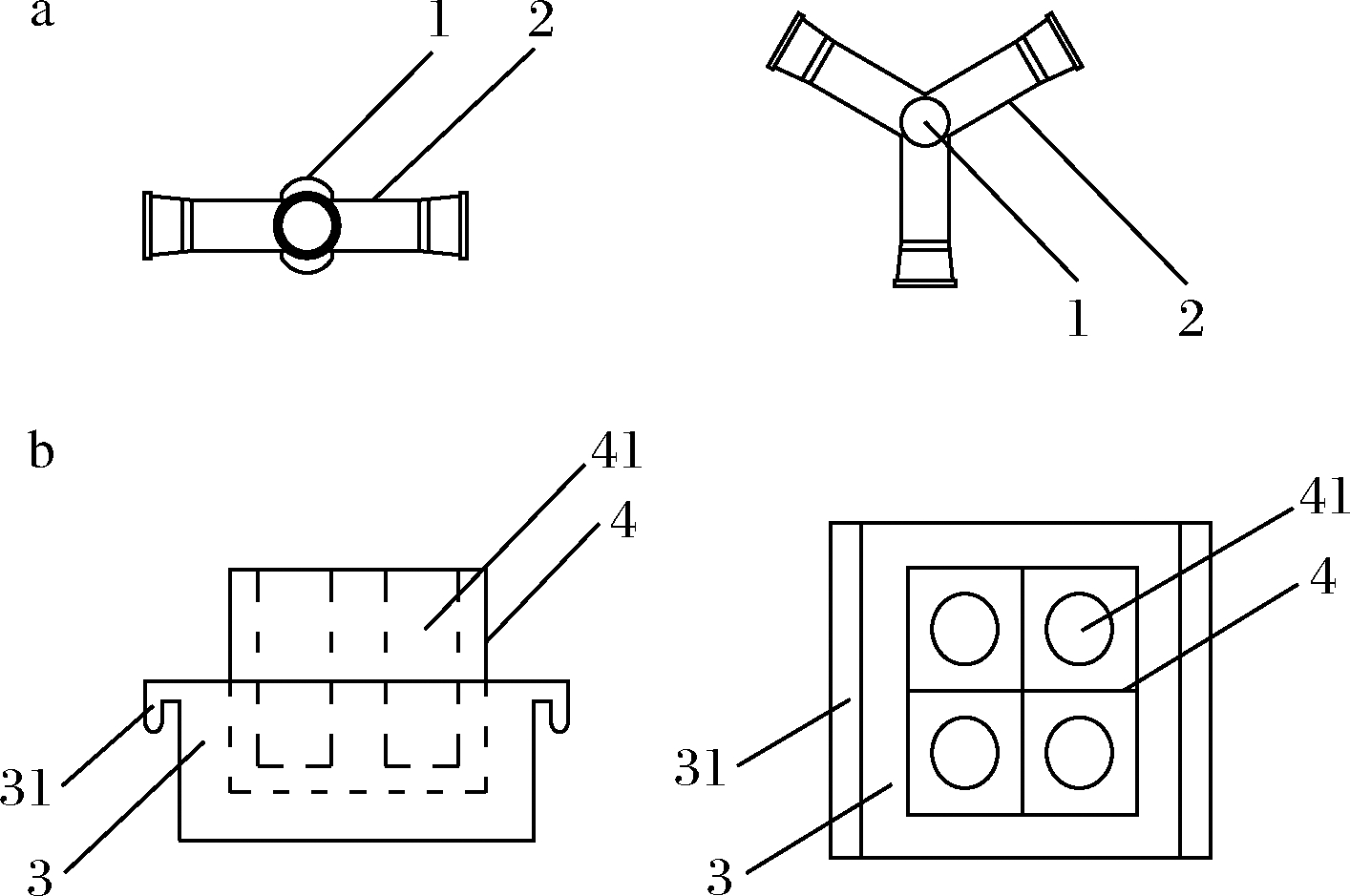
a-剪切工具;b-冰冻保温装置
图7 剪切工具、冰冻保温装置的结构正视及俯视示意图
Fig.7 Schematic diagram of shear tool and freeze insulation device structure
图8为16组不同发酵条件的样品分别使用原始方法和优化后方法操作时的酶活力水平。结果显示,同时使用剪切工具和冰冻保温装置,酶活力总体提高了约47%,大大减少了最终酶活的损失。其中测得最高酶活力为33 U/mL,约为最初酶活力(16.2 U/mL)的2倍。
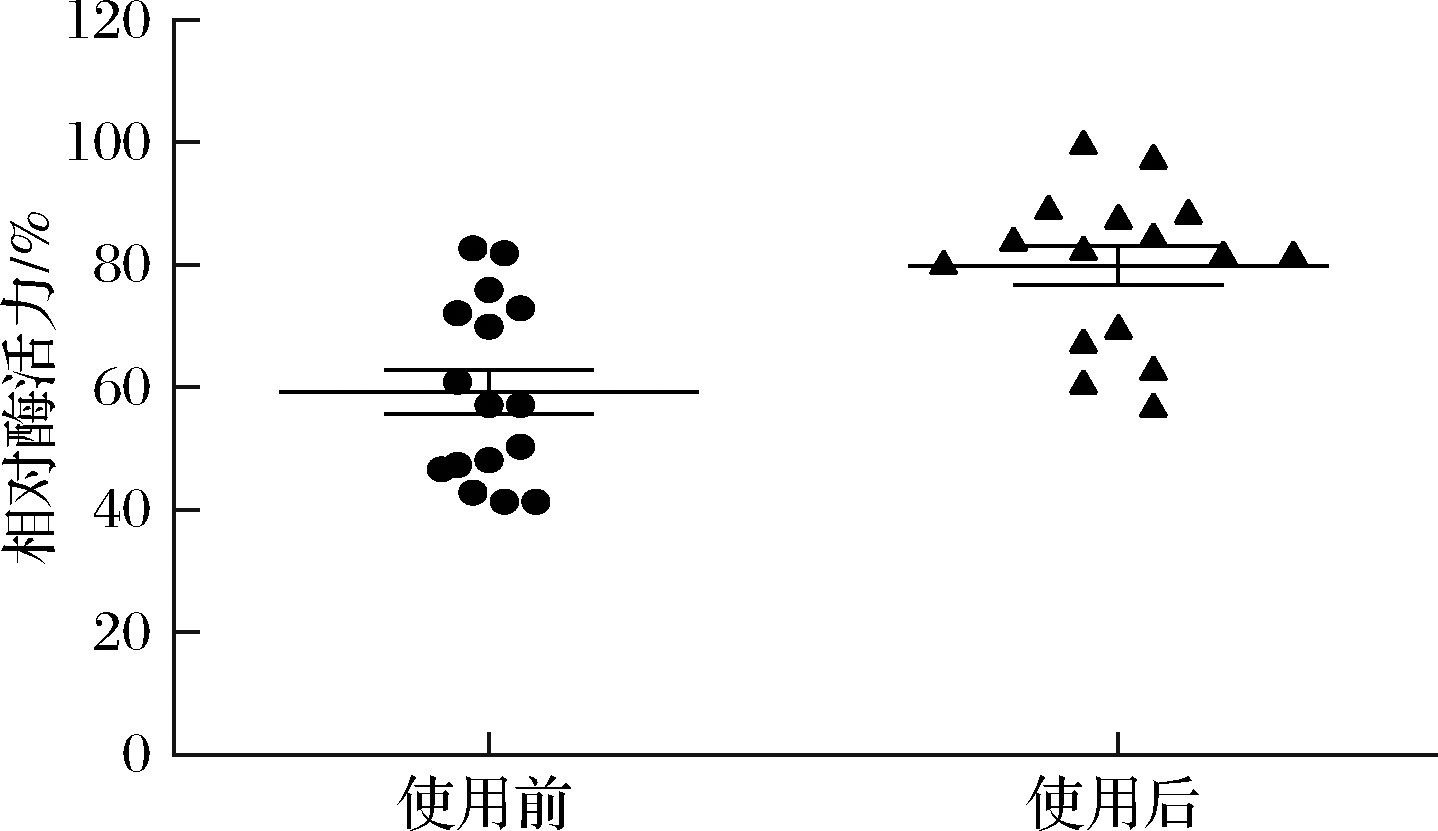
图8 剪切保温对酶活力的影响
Fig.8 Effect of shear heat preservation on enzyme activity
3 结论
宿主的选择对PLD的成功表达至关重要。在国内外学者对PLD的异源表达研究中发现,以大肠杆菌为宿主时,PLD大部分以不溶形式表达[19],或直接对宿主生长有抑制作用[20]。以毕赤酵母或枯草芽孢杆菌[21]为宿主时,检测到的胞外酶活力分别为1、1.5 U/mL,无法满足生产需求。链霉菌是PLD的天然宿主,蛋白可在胞内进行正确折叠和有效的翻译后修饰,不会形成包涵体影响酶活性。同时链霉菌较高的酶分泌能力也使其成为工程化菌株的首选。本研究选用重组链霉菌S-pMS02作为宿主高效表达PLD,并利用酶工程对其进行生产制备。
为提高菌株S-pMS02发酵产酶的效率,从培养基成分、发酵条件、制备工艺3个方面对其进行了深入研究与优化。通过对发酵培养基各营养组分的优化,最终确定可溶性淀粉为碳源,硫酸铵复合酪蛋白氨基酸为氮源,同时金属离子的添加对菌株发酵也存在一定影响,添加适当的Mg2+有助于菌株的生长和产酶,而Ca2+对菌株的发酵生长有抑制作用,可能因其与发酵体系中的其他物质反应形成了钙盐沉淀,从而影响菌株生长。发酵条件的优化可有效提高PLD的产酶活性和产酶量,其中时间的控制对产酶影响较大,在对时间的优化过程中,PLD活力呈现1~5 d逐渐升高,第6天达到顶点又逐渐下降的趋势,说明蛋白从合成到分泌至胞外需要一定的时间,有活性的PLD蛋白如果未能及时从发酵液中制备出来,可能会随着继续培养变为养分被分解。因此,在适当的时间制备PLD可降低生产耗能、减少酶活力损失。在发酵工艺上,利用自行设计的剪切工具解决了链霉菌菌丝缠绕成团不利于蛋白释放的难题,同时在PLD制备过程中使用保温工具降低了酶活力损失,为PLD生产的中试试验和工业化研究奠定了基础。
[1] PARK J J, CHOI Y, JUNG E, et al.Microglial MERTK eliminates phosphatidylserine-displaying inhibitory post-synapses[J].The EMBO Journal, 2021, 40(15):e107121.
[2] BRUTON A, NAUMAN J, HANES D, et al.Phosphatidylserine for the treatment of pediatric attention-deficit/hyperactivity disorder:A systematic review and meta-analysis[J].The Journal of Alternative and Complementary Medicine, 2021, 27(4):312-322.
[3] MOZZI R, BURATTA S, GORACCI G.Metabolism and functions of phosphatidylserine in mammalian brain[J].Neurochemical Research, 2003, 28(2):195-214.
[4] BIRGE R B, BOELTZ S, KUMAR S, et al.Phosphatidylserine is a global immunosuppressive signal in efferocytosis, infectious disease, and cancer[J].Cell Death and Differentiation, 2016, 23(6):962-978.
[5] HIRAYAMA S, TERASAWA K, RABELER R, et al.The effect of phosphatidylserine administration on memory and symptoms of attention-deficit hyperactivity disorder:A randomised, double-blind, placebo-controlled clinical trial[J].Journal of Human Nutrition and Dietetics, 2013, 27:284-291.
[6] HUANG T T, LYU X Q, LI J H, et al.Combinatorial fine-tuning of phospholipase D expression by Bacillus subtilis WB600 for the production of phosphatidylserine[J].Journal of Microbiology and Biotechnology, 2018, 28(12):2 046-2 056.
[7] 徐银凤, 赵雨, 孙迪, 等.蜡状芽孢杆菌磷脂酶D的活性形式及HKD活性区域的分子改造对其活性的影响[J].中国生物化学与分子生物学报, 2017, 33(11):1 161-1 167.
XU Y F, ZHAO Y, SUN D, et al.The active form of phospholipase D from Bacillus cereus and the effect of molecular modification of HKD active region on its activity[J].Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(11):1 161-1 167.
[8] LIU Y H, HUANG L, FU Y, et al.A novel process for phosphatidylserine production using a Pichia pastoris whole-cell biocatalyst with overexpression of phospholipase D from Streptomyces halstedii in a purely aqueous system[J].Food Chemistry, 2019, 274:535-542.
[9] CHEN S, XU L, LI Y, et al.Bioconversion of phosphatidylserine by phospholipase D from Streptomyces racemochromogenes in a microaqueous water-immiscible organic solvent[J].Bioscience, Biotechnology, and Biochemistry, 2013,77(9):1 939-1 941.
[10] 代书玲, 张江, 商军.磷脂酶D高效产生菌的筛选及鉴定[J].江苏农业科学, 2013, 41(3):309-311.
DAI S L, ZHANG J, SHANG J.Screening and identification of the high phospholipase D-producing strains[J].Jiangsu Agricultural Sciences, 2013, 41(3):309-311.
[11] 朱海华, 王鋆坦, 王小瑞, 等.一种在链霉菌中高效表达磷脂酶D的方法及重组链霉菌:中国, CN112575023A[P].2021-03-30.
ZHU H H, WANG J T, WANG X R, et al.Method for high expression of phospholipase D in Streptomyces and recombinant Streptomyces:China, CN112575023A[P].2021-03-30.
[12] 黄琳, 马杰莹, 王爽, 等.Streptomyces septatus磷脂酶D在毕赤酵母中的重组表达及酶学性质分析[J].食品科学, 2020, 41(8):100-107.
HUANG L, MA J Y, WANG S, et al.Recombinant expression of phospholipase D from Streptomyces septatus in Pichia pastoris and analysis of its enzymatic properties[J].Food Science, 2020, 41(8):100-107.
[13] 梁丽敏, 刘春凤, 杜阳吉.链霉菌产磷脂酶D发酵培养基的优化[J].中国食品添加剂, 2014(9):114-120.
LIANG L M, LIU C F, DU Y J.Optimization of cultural medium for phospholipase D production by Streptomyces sp.[J].China Food Additives, 2014(9):114-120.
[14] 朱海华, 王鋆坦, 刘红伟, 等.一种利用基因工程链霉菌发酵获取磷脂酶D的制备方法:中国, CN112831446A[P].2021-05-25.
ZHU H H, WANG J T, LIU H W, et al.A preparation method for obtaining phospholipase D by fermentation of genetically engineered Streptomyces:China, CN112831446A[P].2021-05-25.
[15] 赵紫薇, 杨天奎, 牟英.色褐链霉菌产磷脂酶D的发酵条件研究[J].中国油脂, 2010, 35(11):52-57.
ZHAO Z W, YANG T K, MU Y.Fermentation conditions of phospholipase D production by Streptomyces chromofuscus[J].China Oils and Fats, 2010, 35(11):52-57.
[16] 韩海霞, 曹栋, 史苏佳, 等.链霉菌CA-1产磷脂酶D发酵条件的优化[J].食品工业科技, 2014, 35(13):176-180.
HAN H X, CAO D, SHI S J, et al.Optimization of fermentation conditions of phospholipase D from Streptomyces sp.CA-1[J].Science and Technology of Food Industry, 2014, 35(13):176-180.
[17] 相启森, 岳田利, 袁亚宏, 等.金属离子对褐黄孢链霉菌生长和纳他霉素生物合成的影响[J].西北农林科技大学学报(自然科学版), 2010, 38(1):209-215.
XIANG Q S, YUE T L, YUAN Y H, et al.Effects of metal ions on growth of Streptomyces gilvosporeus and biosynthesis of natamycin [J].Journal of Northwest A & F University (Natural Science Edition), 2010, 38(1):209-215.
[18] 钱娟, 庞洋, 王昕.磷脂酶D的制备及催化磷脂酰胆碱合成磷脂酰丝氨酸[J].中国油脂, 2017, 42(9):66-71.
QIAN J, PANG Y, WANG X.Preparation of phospholipase D and catalytic synthesis of phosphatidylserine from phosphatidylcholine[J].China Oils and Fats, 2017, 42(9):66-71.
[19] OGINO C, YASUDA Y, KONDO A, et al.Improvement of transphosphatidylation reaction model of phospholipase D from Streptovericilium cinnamoneum [J].Biochemical Engineering Journal, 2002, 10(2):115-121.
[20] 张莹. 在不同宿主中表达链霉菌磷脂酶D的研究[D].上海:华东理工大学, 2013.
ZHANG Y.Phospholipase D safe and efficient expression in different hosts[D].Shanghai:East China University of Science and Technology, 2013.
[21] 张业尼, 路福平, 李玉, 等.磷脂酰丝氨酸合成酶基因的克隆及在枯草芽孢杆菌中的表达[J].中国生物工程杂志, 2008,28(9):56-60.
ZHANG Y N, LU F P, LI Y, et al.Cloning of the phosphatidylserine synthase gene and its secretive expression in Bacillus subtilis[J].China Biotechnology, 2008, 28(9):56-60.