大豆富含蛋白质、脂质、碳水化合物、膳食纤维及人体必需的维生素、矿物质等营养物质,具有极高的营养价值和广阔的应用范围。然而,大豆中存在的植酸、胰蛋白酶抑制剂和单宁等抗营养因子大大降低了其营养物质的生物利用率。植酸是植物种子中存在的一种天然化合物,通过与蛋白质、氨基酸和矿物质结合,形成不溶性化合物,从而阻碍营养物质的消化释放[1];单宁为水溶性的酚类化合物,也可通过与营养物质络合、降低细胞膜的通透性从而使营养物质难以被溶出利用[2];胰蛋白酶抑制剂则通过对胰腺丝氨酸蛋白酶的抑制影响蛋白质的消化,降低大豆的营养价值[3]。
前期的有关研究均已表明包括挤压、发芽、发酵、浸泡、酶处理、辐照和热处理等加工方式可部分提高豆类的蛋白质、淀粉的消化率及其综合营养利用率。例如,发芽是提高蛋白质体外消化率和矿物质保留率的有效方法[4],但也会导致脂肪、碳水化合物、赖氨酸、色氨酸、苏氨酸和含硫氨基酸的显著减少[3];虽然热处理能够提高豆类的体外蛋白质消化率[5],但由于大部分营养物质热稳定性较差,热处理也会导致其发生不良的物理、化学变化,降低食品的营养价值。此外,上述加工方式都改变了食品本来的形态、质构和特性,对其风味及可加工性产生了不同程度的不利影响。
超高压处理(high hydrostatic pressure,HHP)是目前应用较广的一类高效非热加工技术,广泛应用于食品的杀菌、钝酶、改变理化特性等方面。HHP只破坏食品大分子结构(淀粉、蛋白质等)中的非共价键,但对维生素和氨基酸等小分子没有影响[6]。已经有研究表明[7],在HHP作用下,蛋白质分子的氢键、离子键、水合作用和疏水相互作用发生改变,破坏了蛋白质的三级和四级结构,提高了蛋白质的体外消化率。赵贵川[8]认为,这是由于高压处理后的蛋白质结构变得松散,暴露出更多的酶切位点,提高了酶对蛋白质的催化效率,从而提高了蛋白质的可消化性。LINSBERGER-MARTIN等[9]发现在60 ℃条件下施加600 MPa的压力,豌豆和大豆中的蛋白质消化率显著增加,但是过高的压力反而会降低蛋白质的体外消化率[10]。HHP处理还可能会通过破坏非共价键和二硫键等结构,降低胰蛋白酶抑制剂的活性[11],从而提高蛋白质的消化率。此外,适当的压力处理可提高蛋白质的溶解性,使蛋白质更易被消化吸收[12]。HHP还可以破坏淀粉的结构与功能,降低淀粉的消化率,有益于人体健康[13]。
HHP处理还可以通过减少抗营养因子的含量或作用从而减少与氨基酸、矿物质等营养物质与其结合,使更多的氨基酸和矿物质释放以提高营养物质的生理功能和生物利用率[14]。如大豆中的内源性植酸酶有可能被HHP激活,从而将植酸水解为磷酸盐和肌醇衍生物,减少其与蛋白质、淀粉和矿物质等营养物质的结合,提高营养物质的生理活性和消化率。适当的HHP处理可以使蛋白质的结构更加松散、反应位点暴露,与单宁结合、凝集进而降低单宁的含量[15]。
虽然已有文献报道了对不同豆科植物中发芽和HHP处理可能提高营养物质的生物利用率,但未直接比较发芽和HHP处理对大豆中蛋白、淀粉、游离氨基酸、矿物质消化率及其与抗营养因子植酸和单宁相关性的报道,对相关性质仍缺乏全面系统的研究。因此,本研究通过综合比较发芽和不同HHP处理条件下大豆营养物质的体外消化率的影响,并分析其与植酸和单宁含量的相关性,为开发高品质大豆产品,促进HHP在大豆加工方面的应用提供了理论依据。
1 材料与方法
1.1 材料与试剂
大豆(原产地:中国黑龙江)牛血清白蛋白(bovine serum albumin,BSA)、α-淀粉酶、尿酸、葡萄糖醛酸、猪胆盐、黏蛋白、氨基葡萄糖盐酸盐、胰淀粉酶、脂肪酶、胃蛋白酶、氨基酸(组氨酸His、苯丙氨酸Phe、赖氨酸Lys、苏氨酸Thr、谷氨酰胺Gln、亮氨酸Leu、色氨酸Trp、羟脯氨酸Hpro、甘氨酸Gly、天冬氨酸Asp、天冬酰胺Asn、丝氨酸Ser、γ-氨基丁酸GABA、异亮氨酸Ile、谷氨酸Glu、缬氨酸Val、丙氨酸Ala、脯氨酸Pro、蛋氨酸Met、酪氨酸Tyr、精氨酸Arg、瓜氨酸Cit)标准品(≥98%)、Ca、Fe和Zn 标准元素储备液(1 000 mg/L),美国Sigma-Aldrich公司;K-PHYT检测试剂盒,爱尔兰Megazyme公司;其他试剂均为分析纯。
1.2 仪器与设备
CQC-2L-600 MPa HHP设备,北京速原中天科技股份有限公司;Sorvall ST 16R高速冷冻离心机,赛默飞世尔有限公司;SCIENTZ-18 N 冷冻干燥机,宁波生物科技股份有限公司;氨基酸分析仪、UV-1750紫外可见分光光度计,日本岛津公司;ETHOS UP微波消解系统,意大利迈尔斯通公司;7700 X ICP-MS电感耦合等离子体质谱仪,Agilent Technologies公司;采用Milli-Q水净化系统纯化分析用水。
1.3 实验方法
1.3.1 大豆预处理
大豆用蒸馏水浸泡16 h后分别进行发芽和HHP处理并保存部分未浸泡的原料大豆。
发芽处理:发芽3 d;HHP处理:分为6组,大豆在浸泡完成后沥水,采用密封袋真空密封,分别用300、450、600 MPa压力处理5、10 min。以上所有处理均于常温条件下进行。
全部处理完成后将处理后的样品及原料大豆冷冻干燥2 d并研磨成粉末,于4 ℃冷藏保存待测。
1.3.2 大豆样品体外消化
采用WANG等[16]的方法进行消化,消化液配方如表1所示。图1为体外消化的具体步骤。完成口腔、胃、肠消化后,取上清液冷冻待测。
对用于测定矿物质体外利用率的样品处理时,为了减少消化液中Ca的干扰,对消化液配方进行了调整。胃液:2.5 g/L胃蛋白酶溶液,pH 2.0;十二指肠液:9.0 g/L胰酶溶液,pH 7.5;胆汁:30.0 g/L猪胆盐溶液,pH 6.5;用同样的方法进行体外模拟消化处理。
表1 消化液配比
Table 1 Chemical composite of digestive juice

口腔液胃液十二指肠液胆汁0.3 g NaCl2.75 g NaCl7.01 g NaCl5.26 g NaCl0.2 g KSCN0.27 g NaH2PO43.39 g NaHCO35.79 g NaHCO30.9 g NaH2PO40.82 g KCl0.08 g KH2PO40.38 g KCl0.57 g Na2SO40.4 g CaCl2·2H2O0.56 g KCl0.22 g CaCl2·2H2O0.9 g KCl0.31 g NH4Cl0.05 g MgCl20.25 g尿素1.7 g NaHCO36.5 mL HCl(37%)0.18 mL HCl (37%)0.15 mL HCl(37%)0.2 g尿素0.65 g葡萄糖0.1 g尿素1.8 g BSA290 mg α-淀粉酶0.02 g葡萄糖醛酸0.2 g CaCl2·2H2O30 g猪胆盐15 mg尿酸0.085 g尿素1 g牛血清白蛋白pH=6.525 mg黏蛋白0.33 g氨基葡萄糖盐酸盐9 g胰酶pH 6.51 g牛血清白蛋白1.5 g脂肪酶2.5 g胃蛋白酶pH 7.53 g黏蛋白pH 2.0
注:表中数据均为1 L消化液中的加量
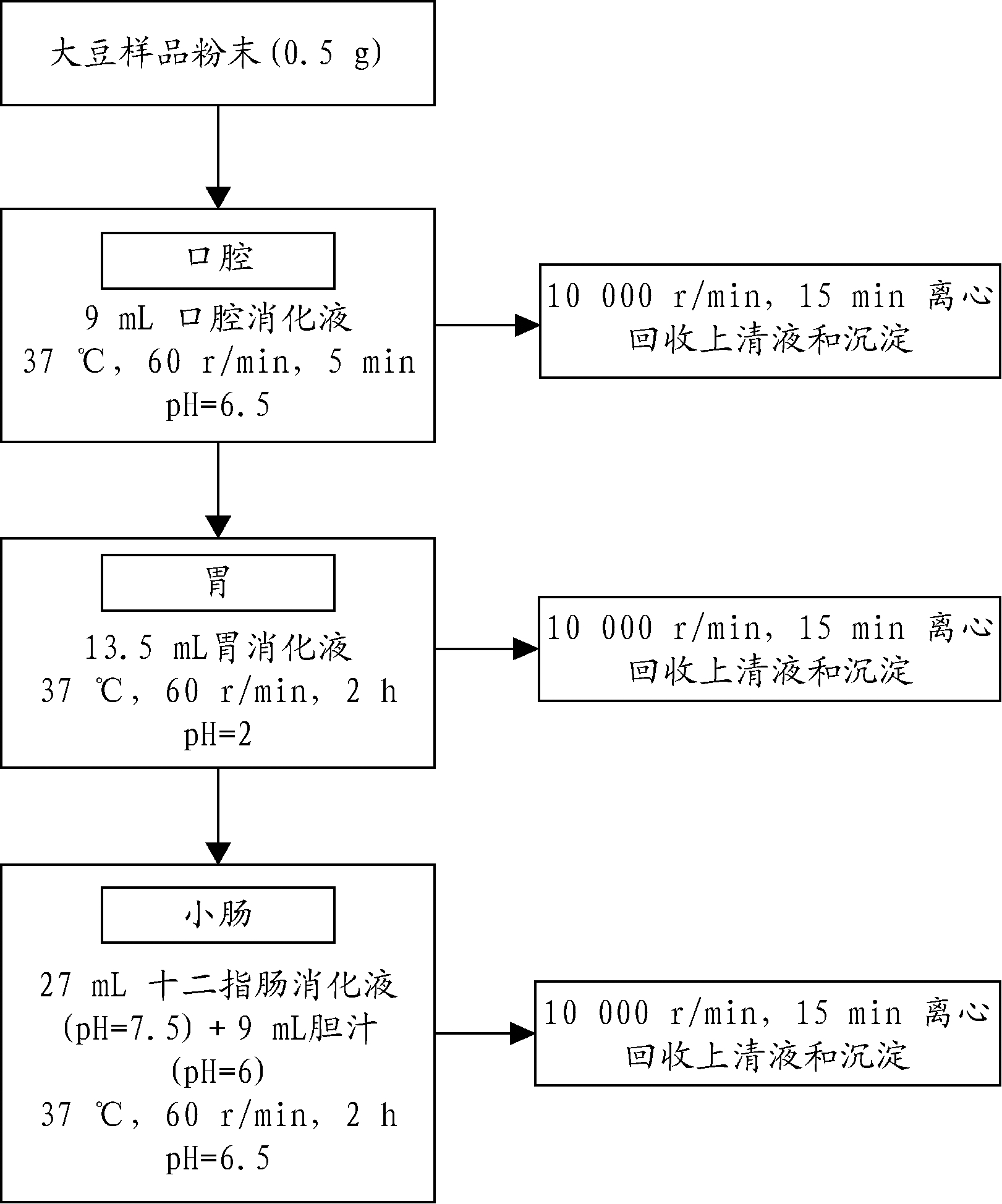
图1 体外消化流程图
Fig.1 Flow diagram of the in vitro digestive procedure
1.3.3 游离氨基酸(free amino acids,FAAs)含量的测定
采用GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》的方法,利用氨基酸分析仪进行测定。
配制混合氨基酸标准储备液(1 mol/mL),用柠檬酸钠缓冲溶液(pH=2.2)稀释为混合氨基酸标准工作液(100 nmol/mL)。取0.2 mL消化后上清液与2 mL 0.1%(体积分数)甲酸溶液混合,经0.45 μm滤膜过滤后,得样品测定液。将混合氨基酸标准工作液和样品测定液分别以相同体积注入氨基酸分析仪,以外标法通过峰面积计算样品测定液中氨基酸的浓度。
色谱条件:进样量20 μL,每个样品分析时间约53 min。色谱柱:磺酸型阳离子树脂分离柱;泵1流速:0.40 mL/min;泵2流速:0.35 mL/min;检测器温度:137 ℃;柱温:57 ℃;检测波长:第一通道570 nm,第二通道440 nm。
1.3.4 淀粉消化量(in vitro starch digestibility,IVSD)的测定
用胰淀粉酶(2 500 U/mg)混悬液(0.2 mol/L磷酸盐缓冲液,pH=6.9)酶解淀粉后测定不同处理的大豆粉(50 mg/mL)的IVSD。按照修改后SINGH等[17]的方法,将消化后上清液和酶悬浮液按3∶1的体积比在37 ℃水浴酶解2 h后,加入3 mL 3,5-二硝基水杨酸试剂。溶液于100 ℃水浴9 min后立即冷却,静置显色20 min。以试剂空白(即不加样品)做参比,在550 nm处测量过滤后溶液的吸光度[18],根据葡萄糖标准溶液绘制的标准曲线,得出消化前后葡萄糖含量差值并换算为淀粉的消化量。
1.3.5 Fe、Zn、Ca体外消化率(in vitro protein digestibility,IVPD)的测定
根据GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》的方法,采用电感耦合等离子质谱仪测定。
测定前用密闭微波消解系统(最大压力1 450 psi,最高温度300 ℃)进行微波消解。取0.2 g消化后上清液放入聚四氟乙烯容器中,加入10 mL浓HNO3在微波消解系统中消解,待冷却至室温后用双去离子水稀释至50 mL,并设置空白对照组。然后用电感耦合等离子体质谱仪测定Fe、Zn、Ca的含量。通过各元素特定的分子质量进行定量,测定待测元素和内标元素的信号响应值,根据标准曲线得到消解液中待测元素的浓度。
1.3.6 植酸含量的测定
使用Megazyme检测试剂盒K-PHYT进行植酸含量的测定[19]。
取1 g不同处理的豆粉样品加入20 mL盐酸(0.66 mol/L)中,振荡16 h后离心。在11 000 r/min条件下离心10 min,中和后得磷提取液。分别进行总磷和游离磷的脱磷酸化,加入植酸酶和碱性磷酸酶,植酸即水解为肌醇和无机磷酸盐。取离心所得上清,加入显色剂显色,磷酸基团(Pi)将钼酸铵还原成钼蓝,在655 nm处测定所得溶液的吸光度即与Pi的含量成正比。同时绘制标准曲线,用样品和标准曲线的吸光度值计算总磷和植酸。
1.3.7 单宁含量的测定
采用GB/T 27985—2011《饲料中单宁的测定》的方法,通过分光光度法测定消化后上清液中的单宁含量(以单宁酸计)。
取样品消化后上清液1.00 mL,置盛有约30 mL水的50 mL容量瓶中,加钨酸钠-磷钼酸混合溶液2.5 mL、碳酸钠溶液5.0 mL,用水定容至50 mL,摇匀。放置30 min显色后,以0.00 mg/L单宁酸标准溶液为空白,同样测定试样溶液的吸光度,根据标准曲线计算试液中单宁酸的浓度。
1.4 数据统计分析
所有实验均进行3次平行,结果用平均数±方差表示。采用Microsoft Excel进行数据统计,并用IBM SPSS Statistics 24、STATA14软件进行ANOVA方差分析与多重比较(P<0.05),用Origin 2018进行柱形图的绘制,用R3.4.0进行热图聚类分析和偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)图的绘制。
2 结果与分析
2.1 不同处理对大豆体外消化后FAAs含量的影响
蛋白质消化率低是导致豆科植物营养价值下降的主要原因之一[20],由FAAs含量的测定结果可以直接反映不同处理组之间蛋白质的IVPD差异。对不同处理组的各FAAs体外消化后的含量归一化处理后绘制聚类热图(图2)。结果表明,相对于原料大豆,300 MPa以及发芽处理未能提高FAAs含量,而450 MPa和600 MPa处理后FAAs含量有明显提升,其中经600 MPa/5 min处理的样品各氨基酸体外消化率最高,说明较高压力HPP处理能促进FAAs的体外释放和IVPD。有报道指出[21],发芽使绿豆IVPD从15%增加到25%,鹰嘴豆由6%增加到17%,豇豆由6%增加到17%;XIA等[22]报道了经不同HHP条件处理的红豆粉FAAs均有明显提升,ZHONG等[23]则发现在600 MPa和60 ℃处理30 min的条件下,黑豆的IVPD显著提高了约2.8%。这可能是因为适当的压力处理可以使蛋白质的结构松散,水分子进入内部,同时酶促位点暴露从而加速酶促反应,促进FAAs的释放从而使含量提高。同时,HHP处理改变了蛋白质及酶抑制剂的结构,使蛋白质更易被水解,从而提高了大豆的IVPD[24]。

图2 不同处理的FAAs含量热图
Fig.2 Heatmap of different treatments on the FAAs content
就氨基酸种类而言,各处理组前后变化差别不大。比较值得注意的是,精氨酸(Arg)和瓜氨酸(Cit)发芽与原料大豆的FAAs含量几乎没有差别;而游离酪氨酸含量(Tyr)除原料大豆外,其他所有处理组的稍有提高;此外,样品经过300 MPa/10 min处理后,蛋氨酸(Met)含量有较为明显的提高,与蛋氨酸相对含量最高的600 MPa/5 min处理组相近。
利用PLS-DA法对不同处理组总氨基酸含量进行分析(图3)。PLS-DA相较于主成分分析(principal component analysis,PCA)有监督功能,具有更加客观的优势,适合用于进行特征选择。图中每个点代表一个含量值,各处理组的相关性与距离有关,距离越近,相关性越高。从图3中可以看出,部分处理组有较明显的区分。其中发芽组在分析图的中部偏左下方;450 MPa/10 min与600 MPa/10 min处理组的结果有较强的相关性,位于分析图的中部偏右上方;450 MPa/5 min 位于中部偏上方;300 MPa/5 min处理组与未处理组相关性较强,聚在分析图上部偏左侧;300 MPa/10 min处理组聚在上部;600 MPa/5 min在右下方。该结果与热图分析大致相同,表明模型稳定可靠。
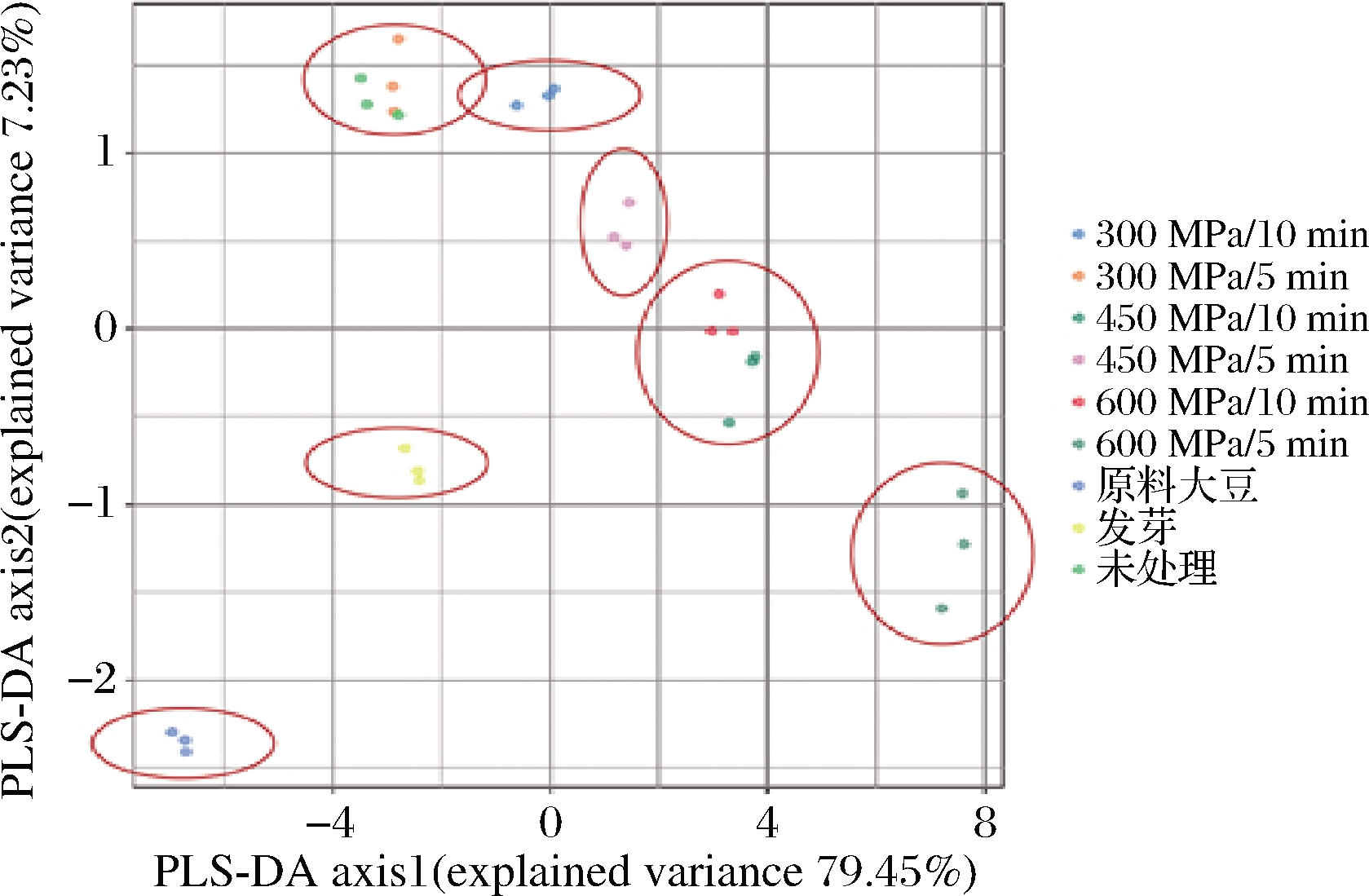
图3 不同处理对FAAs含量影响的分析(PLS-DA)
Fig.3 Effects of different treatments on the content of FAAs (PLS-DA)
2.2 不同处理对大豆体外IVSD的影响
将不同处理对体外消化后IVSD的影响以含量(%)形式表示(图4)。发芽显著提高大豆的体外IVSD,提高到未处理组的2.42倍(P<0.05)。而HHP处理中,600 MPa/10 min的大豆体外IVSD显著比未处理组降低了38%(P<0.05),其余HHP处理条件的影响则不明显(P>0.05)。高压处理可能使得淀粉晶体结构和其他层次结构改变,导致淀粉的吸收消化减少,消化率降低[25]。LIU等[26]发现HHP处理高粱淀粉会使得其快速消化淀粉含量减少,慢性消化淀粉和抗性淀粉含量增加。故将HHP技术应用到进行以大豆为原料食品的开发中,可以用于生产抗性淀粉含量高、升糖指数低的功能性食品。但也有报道认为,HHP的处理会使得淀粉消化率升高[27],这与其他食物成分(如蛋白质、脂类、抗营养因子)、含量和加工技术的影响有关[28]。
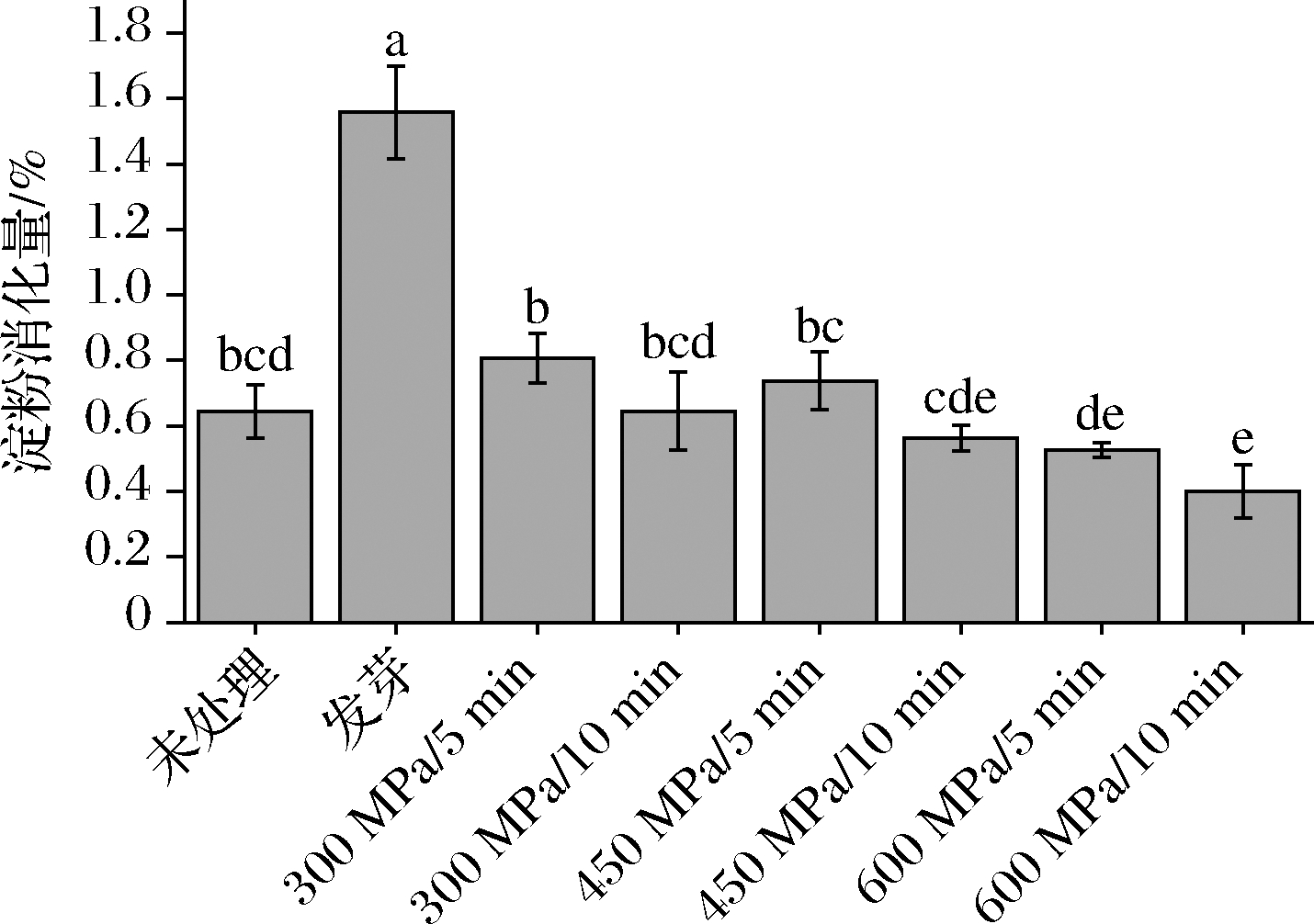
图4 不同处理对体外IVSD的影响
Fig.4 Effects of different treatments on IVSD
注:不同小写字母表示有显著性差异(P<0.05)(下同)
2.3 不同处理对大豆中Fe、Zn、Ca的IVPD的影响
未处理组大豆的Fe、Zn、Ca的初始含量分别为94.19、32.1、1 950 mg/kg,不同处理的大豆在体外消化后Ca、Fe、Zn的消化率如图5~图7所示。发芽处理能显著提高Fe和Zn的消化率(P<0.05),分别提高到2.07、3.50倍,但对Ca消化率没有影响。450 MPa/10 min 和600 MPa/10 min的HHP处理也能显著提高Fe的消化率,分别提高到2.06和1.63倍,此外600 MPa/5 min处理也能将Fe的消化率提高12%(P<0.05)。HHP所有处理对Zn的消化率提高都达到了显著水平,其中300 MPa/10 min达到了未处理组的3.51倍。对于Ca,300 MPa/10 min后消化率提升了1.91倍,其次是600 MPa/5 min、450 MPa/5 min和450 MPa/5 min,分别提高了1.38、1.37和1.35倍(P<0.05)。矿物质消化率的提高可能是大豆在发芽和HHP处理过程中更多地将与大分子螯合的金属释放从而游离出来。此外,食物中的抗营养因子(植酸、单宁等)也会影响到Ca、Fe的吸收。也有研究表明,食品中不同矿物质, 如Na与K、Ca与Mg、Mn与Fe、Fe与Cu、Zn与Cu同时存在时,会产生一定程度的抑制吸收作用[29]。

图5 不同处理对体外消化过程中Fe的消化率的影响
Fig.5 Effects of different treatments on the digestibility of Fe

图6 不同处理对体外消化过程中Zn的消化率的影响
Fig.6 Effects of different treatments on the digestibility of Zn
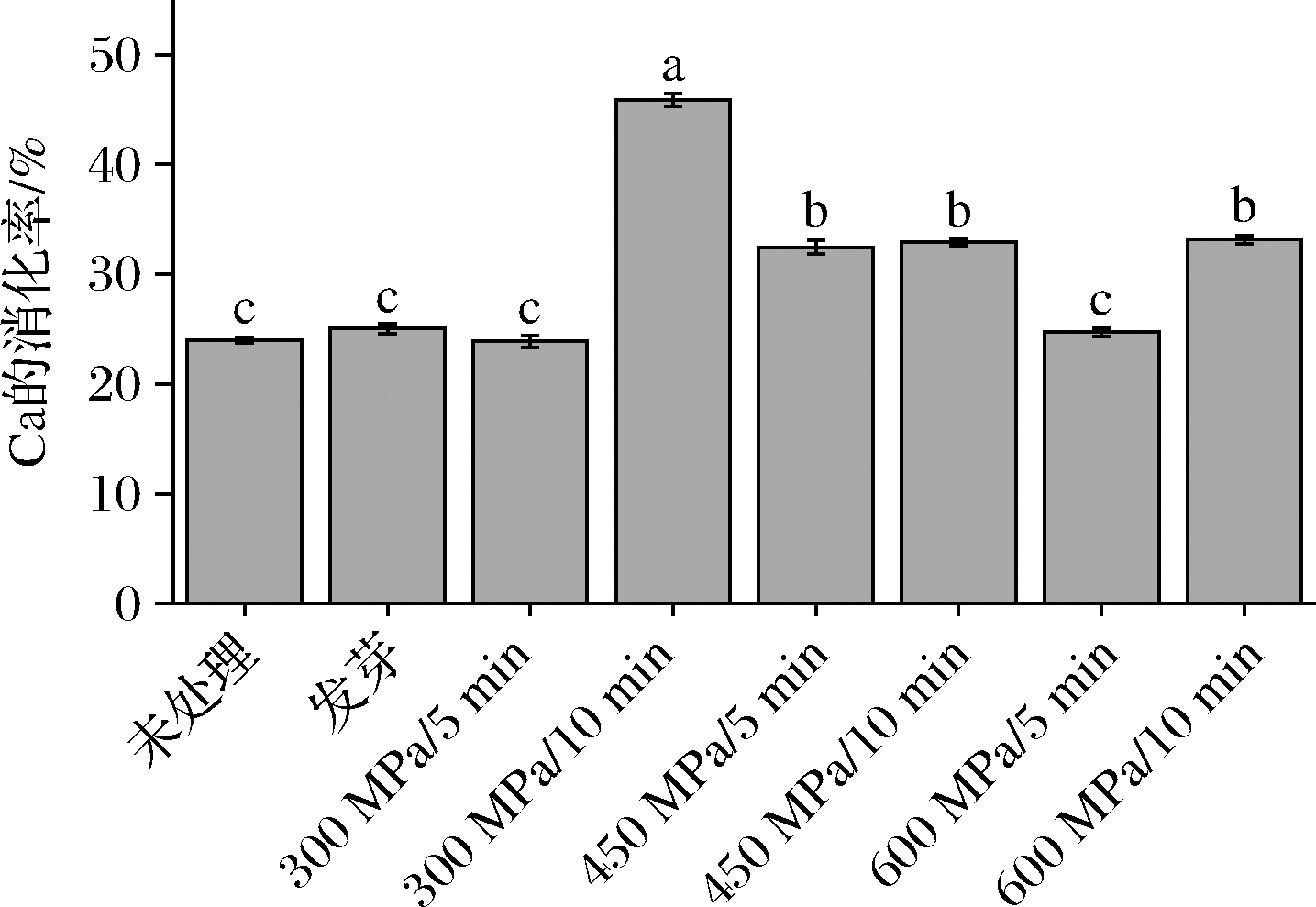
图7 不同处理对体外消化过程中Ca的消化率影响
Fig.7 Effects of different treatments on the digestibility of Ca
2.4 不同处理对大豆植酸含量的影响
植酸含量结果如图8所示。与未处理组相比,除发芽、300 MPa HHP处理组的植酸含量显著下降外(P<0.05),其他处理组的植酸含量均无显著变化(P>0.05)。这与LINSBERGER-MARTIN等[9]的HHP处理豆类结果相似,植酸含量未见显著变化。然而,LEE等[20]报道了400、500及600 MPa可以显著降低红豆粉中的植酸含量(P<0.05),任顺成等[30]也发现麦麸在400 MPa/20 min的处理后,植酸含量出现了显著降低(P<0.05)。这些研究结果的差异可能与不同研究对象及处理条件有关。另有报道发现,羽扇豆的植酸含量随发芽过程中植酸酶活性的提高而显著下降[31](P<0.05),结论与本研究相符。
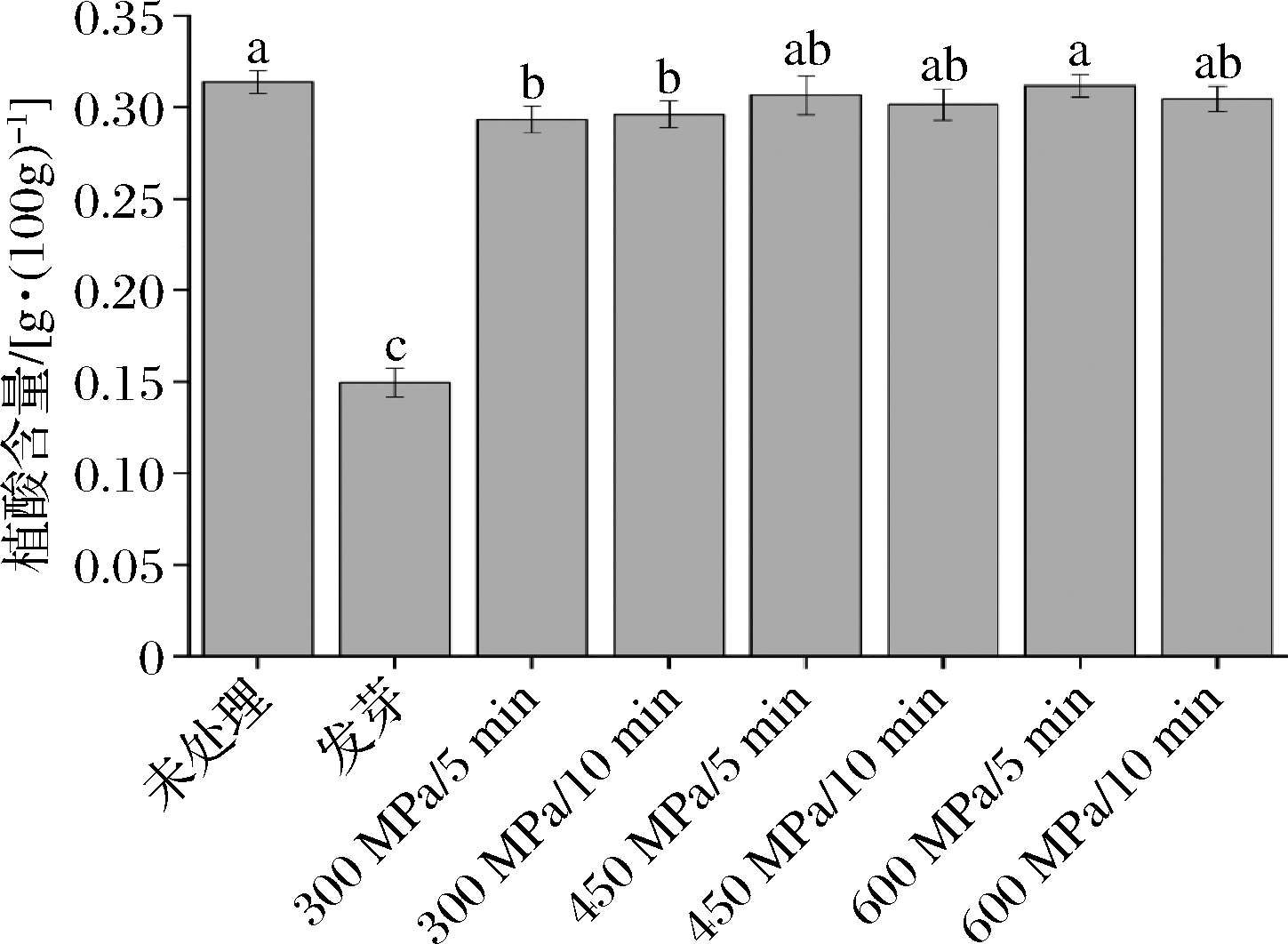
图8 不同处理对植酸含量的影响
Fig.8 Effects of different treatments on phytic acid content
2.5 不同处理对大豆单宁含量的影响
单宁含量结果如图9所示。与未处理组相比,发芽处理组的单宁含量显著提高;HHP处理中只有450 MPa/10 min组的单宁含量有显著下降(P<0.05),其余无显著变化(P>0.05),且不同HHP处理条件之间并无显著性差异。BELMIRO等[32]的研究结果表明,50 MPa/1 min、50 MPa/10 min和600 MPa/1 min的处理降低了豆类30%~40%的单宁含量;ZHONG等[23]也发现黑豆经600 MPa和60 ℃处理30 min后,单宁含量显著降低(P<0.05)。因此,可以通过HHP预处理降低大豆中的可溶性单宁含量,减少其对营养物质的抑制吸收作用,并增强以大豆为原料的产品适口性。

图9 不同处理对单宁含量的影响
Fig.9 Effects of different treatments on Tannin content
3 结论
结果表明,较高压力(450、600 MPa)的HHP处理能提高大豆各FAAs含量和IVPD,但未影响氨基酸种类的分布。发芽提高了大豆的IVSD至2.42倍而600 MPa/10 min则降低了38%。Fe的消化率经发芽、450 MPa/10 min和600 MPa/10 min处理后分别提高至2.07、2.06和1.63倍,经600 MPa/5 min处理后则提高了12%(P<0.05)。发芽和各超高压处理组均能显著提高Zn的消化率(P<0.05),最高为3.51倍(300 MPa/10 min)。发芽未对Ca的消化率产生影响,而HPP处理中最高提高到1.91倍(300 MPa/10 min)。发芽、300 MPa处理组的植酸含量显著降低(P<0.05),450 MPa/10 min的HHP处理可以显著降低单宁含量(P<0.05)。综上,一定压强和时间的HHP处理能够显著提高大豆中主要营养物质的消化率并且降低植酸、单宁的含量,但是对每种营养物质影响的HHP处理条件不同;发芽可以提升大多数营养物质的利用率并且有效降低植酸含量,但不能降低单宁的含量,也不能提高Ca的体外消化率。本研究为开发新的大豆非热加工工艺提供了理论依据。
[1] 王新坤. 钙处理改善大豆芽菜营养与功能品质的机制[D].南京:南京农业大学,2016.
WANG X K.The improved nutritional and functional quality of soybean sprouts by calcium[D].Nanjing:Nanjing Agricultural University,2016.
[2] 吕远平,姚开,贾冬英.饲料中植物单宁的抗营养性及其生物降解[J].中国畜牧杂志,2003,39(2):42-43.
LYU Y P, YAO K, JIA D Y.Antinutrition and biodegradation of vegetable tannins in forage[J].Chinese Journal of Animal Science,2003,39(2):42-43.
[3] MUBARAK A E.Nutritional composition and antinutritional factors of mung bean seeds (Phaseolus aureus) as affected by some home traditional processes[J].Food Chemistry,2004,89(4):489-495.
[4] 姜宇婷. 绿豆发芽过程中组分及营养变化研究进展[J].现代农业科技,2020(14):209;214.
JIANG Y T.Research progress on composition and nutrient changes of mung bean during germination[J].Modern Agricultural Science and Technology,2020(14):209;214.
[5] VAGADIA B H, VANGA S K, SINGH A, et al.Comparison of conventional and microwave treatment on soymilk for inactivation of trypsin inhibitors and in vitro protein digestibility[J].Foods,2018,7(1):7010006.
[6] HERN NDEZ-CARRI
NDEZ-CARRI N M, T
N M, T RREGA A, HERNANDO I, et al.High hydrostatic pressure treatment provides persimmon good characteristics to formulate milk-based beverages with enhanced functionality[J].Food & Function,2014,5(6):1 250-1 260.
RREGA A, HERNANDO I, et al.High hydrostatic pressure treatment provides persimmon good characteristics to formulate milk-based beverages with enhanced functionality[J].Food & Function,2014,5(6):1 250-1 260.
[7] 李仁杰, 廖小军, 胡小松, 等.超高压对蛋白质的影响[J].高压物理学报,2014,28(4):498-506.
LI R J, LIAO X J, HU X S, et al.Effects of high hydrostatic pressure on proteins[J].Chinese Journal of High Pressure Physics,2014,28(4):498-506.
[8] 赵贵川. 超高压处理对米渣蛋白水解物抗氧化活性的影响[D].长沙:中南林业科技大学,2016.
ZHAO G C.The research of UHP treatment on rice residue protein hydrolyzate antioxidant activity[D].Changsha:Central South University of Forestry and Technology,2016.
[9] LINSBERGER-MARTIN G, WEIGLHOFER K, THAO P T P, et al.High hydrostatic pressure influences antinutritional factors and in vitro protein digestibility of split peas and whole white beans[J].LWT - Food Science and Technology,2013,51(1):331-336.
[10] 郭蔚波, 赵燕, 徐明生, 等.不同处理方式下蛋白质结构变化与体外消化性关系研究进展[J].食品科学,2019,40(1):327-333.
GUO W B, ZHAO Y, XU M S, et al.Recent progress in understanding the relationship between protein structure change and in vitro digestibility after different treatments[J].Food Science,2019,40(1):327-333.
[11] GUERRERO-BELTR N J A, ESTRADA-GIR
N J A, ESTRADA-GIR N Y, SWANSON B G, et al.Pressure and temperature combination for inactivation of soymilk trypsin inhibitors[J].Food Chemistry,2009,116(3):676-679.
N Y, SWANSON B G, et al.Pressure and temperature combination for inactivation of soymilk trypsin inhibitors[J].Food Chemistry,2009,116(3):676-679.
[12] 于勇, 潘芳, 苏光明, 等.超高压技术在粮食产品加工中的应用[J].农业机械学报,2015,46(10):247-256;297.
YU Y, PAN F, SU G M, et al.Application of ultra high pressure on crop produces processing[J].Transactions of the Chinese Society for Agricultural Machinery,2015,46(10):247-256;297.
[13] LI W H, BAI Y F, MOUSAA S A S, et al.Effect of high hydrostatic pressure on physicochemical and structural properties of rice starch[J].Food and Bioprocess Technology,2012,5(6):1-9.
[14] RAM REZ-C
REZ-C RDENAS L, LEONEL A J, COSTA N M B.Efeito do processamento doméstico sobre o teor de nutrientes e de fatores antinutricionais de diferentes cultivares de feijão comum[J].Ciência e Tecnologia de Alimentos, 2008,28(1):200-213.
RDENAS L, LEONEL A J, COSTA N M B.Efeito do processamento doméstico sobre o teor de nutrientes e de fatores antinutricionais de diferentes cultivares de feijão comum[J].Ciência e Tecnologia de Alimentos, 2008,28(1):200-213.
[15] SANTOS M C, NUNES C, FERREIRA A S, et al.Comparison of high pressure treatment with conventional red wine aging processes:Impact on phenolic composition[J].Food Research International, 2018, 116.DOI:10.1016/j.foodres.2018.08.018
[16] WANG C, DUAN H Y, TENG J W.Assessment of microwave cooking on the bioaccessibility of cadmium from various food matrices using an in vitro digestion model[J].Biological Trace Element Research, 2014, 160(2):276-284.
[17] SINGH U, JAMBUNATHAN R.Changes in starch, oligosaccharides and soluble sugars in developing pod wall and seed of chickpea[J].Pergamon,1982,21(2):297-299.
[18] 杨宁, 王伟明, 姚琳, 等.3,5-二硝基水杨酸法测定发酵型果露酒中总糖含量[J].中国酿造,2018,37(1):181-184.
YANG N, WANG W M, YAO L, et al.Determination of total sugar content in fermented fruit wine by 3, 5-dinitrosalicylic acid method[J].China Brewing,2018,37(1):181-184.
[19] MCKIE V, MCCLEARY B V.A novel and rapid colorimetric method for measuring total phosphorus and phytic acid in foods and animal feeds[J].Journal of AOAC International,2016,99(3):738-743.
[20] LEE H, HA M J, SHAHBAZ H M, et al.High hydrostatic pressure treatment for manufacturing of red bean powder:A comparison with the thermal treatment[J].Journal of Food Engineering,2018,238:141-147.
[21] VENY U, KIRAN B.Effect of germination periods and hydrothermal treatments on in vitro protein and starch digestibility of germinated legumes[J].Journal of Food Science and Ttechnology,2012,49(2):184-191.
[22] XIA Q, WANG L P, XU C C, et al.Effects of germination and high hydrostatic pressure processing on mineral elements, amino acids and antioxidants in vitro bioaccessibility, as well as starch digestibility in brown rice (Oryza sativa L.)[J].Food Chemistry,2017,214:533-542.
[23] ZHONG Y, WANG Z Y, ZHAO Y Y.Impact of radio frequency, microwaving, and high hydrostatic pressure at elevated temperature on the nutritional and antinutritional components in black soybeans[J].Journal of Food Science,2015,80(12):2 732-2 739.
[24] MESSENS W, VAN CAMP J, HUYGHEBAERT A.The use of high pressure to modify the functionality of food proteins[J].Trends in Food Science & Technology,1997,8(4):107-112.
[25] 卞科,李雅楠,关二旗.甘薯抗性淀粉的制备工艺及应用研究进展[J].河南工业大学学报(自然科学版),2017,38(2):122-128.
BIAN K, LI Y N, GUAN E Q.Preparation and application of sweet potato resistant starches[J].Journal of Henan University of Technology(Natural Science Edition),2017,38(2):122-128.
[26] LIU H, FAN H H, CAO R, et al.Physicochemical properties and in vitro digestibility of sorghum starch altered by high hydrostatic pressure[J].International Journal of Biological Macromolecules, 2016, 92:753-760.
[27] DENG Y, JIN Y F, LUO Y L, et al.Impact of continuous or cycle high hydrostatic pressure on the ultrastructure and digestibility of rice starch granules[J].Journal of Cereal Science, 2014, 60(2):302-310.
[28] SINGH J, DARTOIS A, KAUR L.Starch digestibility in food matrix:A review[J].Trends in Food Science & Technology,2009,21(4):168-180.
[29] O′DELL B L.Mineral interactions relevant to nutrient requirements[J].Journal of Nutrition,1989,119(12):1 832-1 838.
[30] 任顺成, 万毅, 李丹.超高压对麦麸及其植酸含量变化的影响[J].食品研究与开发,2019,40(7):29-33.
REN S C, WAN Y, LI D.Effect of ultra-high pressure on wheat bran and its phytic acid content[J].Food Research and Development,2019,40(7):29-33.
[31] MOHAMMED M A, MOHAMED E A, YAGOUB A E A, et al.Effect of processing methods on alkaloids, phytate, phenolics, antioxidants activity and minerals of newly developed lupin (Lupinus albus L.) cultivar[J].Journal of Food Processing and Preservation,2017,41(1):e12960.1-e12960.9.
[32] BELMIRO R H, TRIBST A A L, CRISTIANINI M.Effects of high pressure processing on common beans (Phaseolus vulgaris L.):Cotyledon structure, starch characteristics, and phytates and tannins contents[J].Starch-Stärke,2020,72(3-4).DOI:10.1002/star.201900212.