自2000年以来,老龄化已成为中国的主要公共卫生问题,预计到2050年老龄人口将占总人口的35%[1]。通过改善饮食来探索延缓衰老的方法,从而提高老龄化人口的寿命和生活质量逐渐成为研究热点。
为了解决基于饮食调节改善衰老状态的问题,首先需要明确人体组织随着年龄增长会出现的变化。从心理层面来说,老年人由于自身存在感的降低,易产生心理负担,导致抑郁、失落、狐独感[2]。从生理层面看,老年人体内肌肉含量下降,骨骼逐渐变得脆弱,易发生骨质疏松等问题[3]。口腔牙齿脱落,吞咽食物能力受损。研究发现健康的老年人与年轻人相比,胃蛋白酶以及十二指肠液中的脂肪酶,胰凝乳蛋白酶和淀粉酶的含量显著降低[4],影响了蛋白质的消化吸收。结肠运转时间会随着年龄的增长而延长,导致肠道疾病的发生,例如便秘和粪便失禁[5]。这些变化可能会影响老年人对食物的选择和消化,因此,直接或间接地导致老年人肠道中微生物群的改变。老年人肠道菌群最大的特点是碳水化合物发酵菌群丢失,而蛋白质水解菌群增加[6]。因此,一些与不健康衰老相关的兼性厌氧菌,如肠杆菌,链球菌,肠球菌富集[4],而有益菌如双歧杆菌的丰度减少[7]。
结合菌群及衰老机体的变化,我们发现膳食蛋白质对于维持老年人的健康来说至关重要。动物蛋白和植物蛋白中氨基酸含量不一致,消化率也不同。乳清蛋白和大豆蛋白被认为是动植物蛋白中的“完全蛋白质”。研究表明,相比于其他蛋白来说,乳清蛋白是老年人最易消化的蛋白质[8],但也有研究表明增加植物蛋白的摄入可以延缓不健康衰老[9]。因此本研究选用乳清蛋白和大豆蛋白,以及二者混合的蛋白,探究长期摄入不同来源蛋白对自然衰老小鼠骨骼和肌肉等衰弱情况及胃肠道的影响,明确何种蛋白质更适合逐渐衰老小鼠的机体,为膳食干预改善健康衰老的研究提供依据。
1 材料与方法
1.1 试剂与仪器
PB3002-N电子天平,梅特勒托利多公司;DWS Multiskan GO多功能酶标仪,赛默飞公司;Pannormic MIDI数字切片扫描仪,3DHISTCH公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;抓力仪,济南益延科技有限公司;Quantum GX Micro-CT,珀金埃尔默企业管理(上海)有限公司。
环保型GD固定液,赛维尔生物科技有限公司;血清P物质(substance P,SP)、胃泌素(gastrin,GAS)、胃动素(motilin,MTL)、血管活性肠肽(vasoactive intestinal peptide,VIP)、生长抑素(somatostatin,SS)ELISA试剂盒,南京森贝伽生物科技有限公司;乳清蛋白、大豆蛋白,上海创赛有限公司;饲料配方见表1,由江苏省协同医药生物工程有限责任公司提供。
表1 不同饲料中主要营养元素和供能比 单位:%
Table 1 Main nutrient elements and energy supply ratio in different feeds
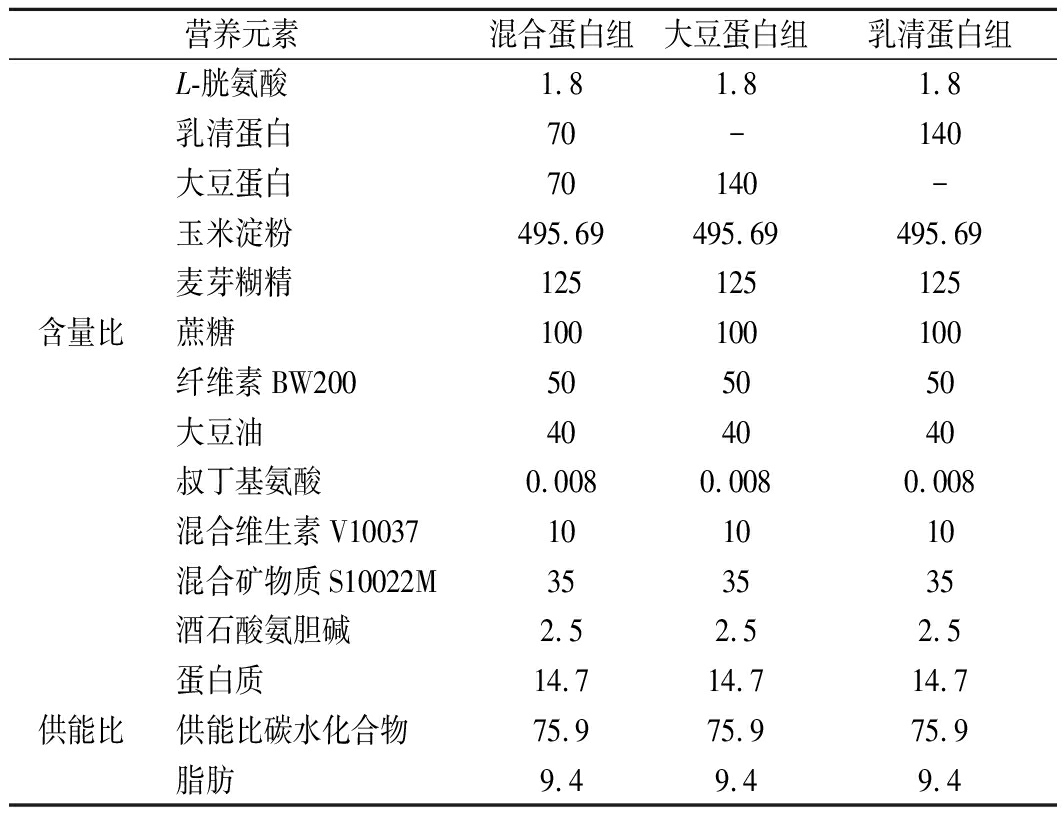
营养元素混合蛋白组大豆蛋白组乳清蛋白组L-胱氨酸1.81.81.8乳清蛋白70-140大豆蛋白70140-玉米淀粉495.69495.69495.69麦芽糊精125125125含量比蔗糖100100100纤维素BW200505050大豆油404040叔丁基氨酸0.0080.0080.008混合维生素V10037101010混合矿物质S10022M353535酒石酸氨胆碱2.52.52.5蛋白质14.714.714.7供能比供能比碳水化合物75.975.975.9脂肪9.49.49.4
注:-表示无
1.2 动物实验设计
动物实验方案及实验操作均由江南大学动物伦理委员会批准(JN.No20200430c0500220[17])。本实验将18只C57BL/6J小鼠[雌性,17月龄,体重30 g左右,SPF级,斯贝福(北京)生物技术有限公司]饲养在江南大学动物实验中心的屏障内(无特定病原体,20~26 ℃,40%~70%湿度,12 h明暗循环)。
适应1周后,将小鼠随机分为3组(n=6),饲喂供能比相同的混合蛋白或单一蛋白饲料24周,饲料按美国AIN-93M标准添加其他营养元素,所有饲料的热量和脂肪水平相同,详细分组见表2。
表2 实验分组情况
Table 2 Experimental groups

组别蛋白质供能比/%蛋白质组成混合蛋白组14.7m(乳清蛋白)∶m(大豆蛋白)=1∶1大豆蛋白组14.7大豆蛋白乳清蛋白组14.7乳清蛋白
实验期间每周测定小鼠体重,统计摄食量。实验结束前,于上午收集每只小鼠粪便于无菌离心管中,统计8∶00~13∶00这一时间段内的排便量。收集的粪便部分用于含水量的测定,部分于-80 ℃条件下贮存,用于肠道菌群分析。
1.3 衰老评分
处死小鼠前,参考FERIDOONI等[10]的方法略作修改,对每只衰老小鼠的脆弱程度进行评分,共包括对27个变量的评估(表3)。根据这些变量计算虚弱指数(frailty index,FI)分数:对于每个参数,0分代表无缺陷,0.5分代表轻度缺陷,1分代表严重缺陷。
表3 C57BL/6J小鼠衰老的临床体征
Table 3 Clinical signs in aging C57BL/6J mice
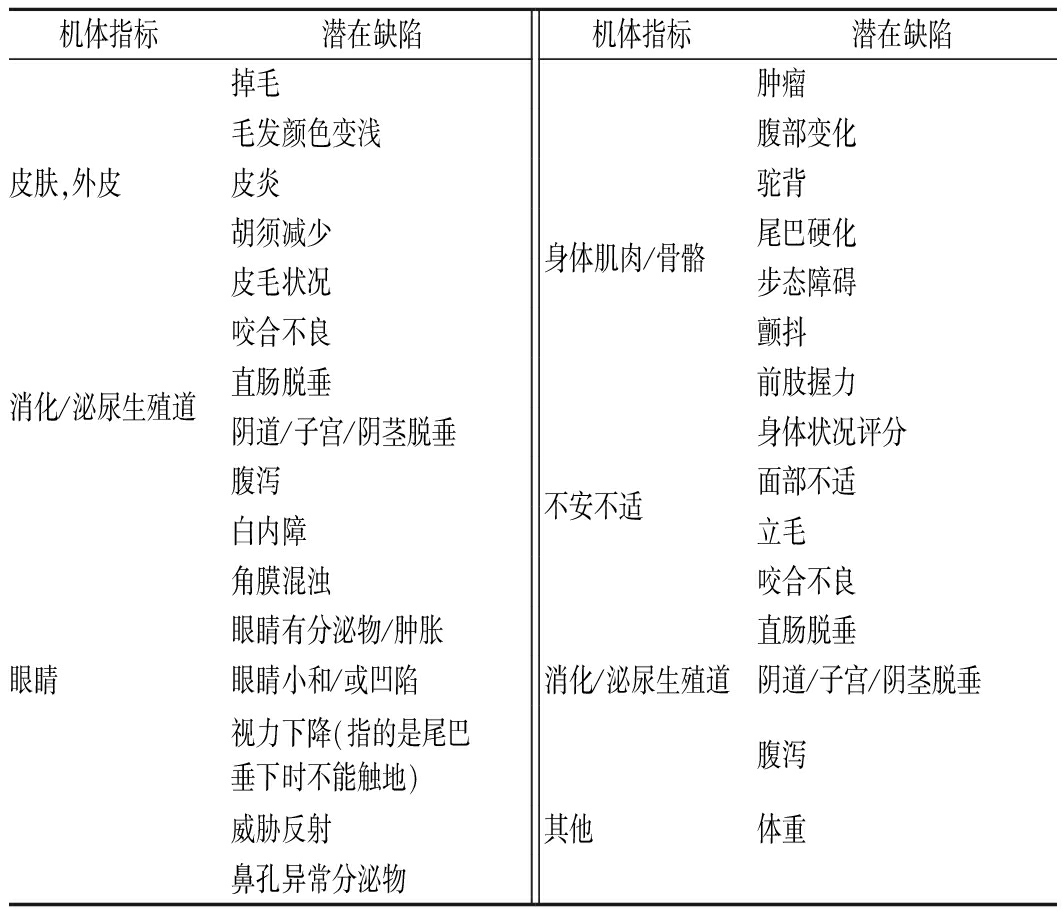
机体指标潜在缺陷机体指标潜在缺陷掉毛肿瘤毛发颜色变浅腹部变化皮肤,外皮皮炎驼背胡须减少身体肌肉/骨骼尾巴硬化皮毛状况步态障碍咬合不良颤抖消化/泌尿生殖道直肠脱垂前肢握力阴道/子宫/阴茎脱垂身体状况评分腹泻不安不适面部不适白内障立毛角膜混浊咬合不良眼睛有分泌物/肿胀直肠脱垂眼睛眼睛小和/或凹陷消化/泌尿生殖道阴道/子宫/阴茎脱垂视力下降(指的是尾巴垂下时不能触地)腹泻威胁反射其他体重鼻孔异常分泌物
注:将27个参数中每个参数的得分相加,再除以测量的参数总数,得出每只动物的FI分数在0~1
1.4 抓力、步态速度和绳索实验
处死小鼠前,参考SELDEEN等[11]的方法进行小鼠抓力测试,使用抓力仪重复5次实验并记录最大值。
步态速度分析是在一个8 cm(宽)×12 cm(高)×1 m(长)的通道上进行的,通道通向一个黑暗的“安全屋”盒子[12]。重复3次实验,记录小鼠从通道一端走进盒子中最快的1次所需要的时间。
绳索实验参考INGRAM等[13]的方法,简而言之,将小鼠放在长60 cm,直径1.5 cm的绳子上,如果在连续5次实验中至少有1次实验,该小鼠在60 s的时间内没有掉下或走到了绳子的任何一端,对这只小鼠来说该实验是成功的。
1.5 肌肉含量及其组织学形态和股骨密度及其成像
取小鼠右小腿腓肠肌、比目鱼肌和胫骨前肌称重。取其中的胫骨前肌固定在环保型GD固定液中,石蜡包埋,5 μm厚切片,苏木精伊红(hematoxylin eosin,HE)染色。使用病理切片扫描仪观察染色切片,随机采集图像。
同时取小鼠右大腿股骨固定在4%多聚甲醛溶液中,骨显微成像(micro-CT)前取出,用生理盐水冲洗3遍,同时测量骨密度。
1.6 小肠推进率及血清胃肠调节肽测定
小肠推进率实验采用LEE等[14]的方法,稍作修改。给每只小鼠灌胃墨汁0.2 mL,20 min后处死小鼠。解剖取出小肠,测量墨汁推进的长度和整个小肠的长度,计算小肠推进率。
血清中的SP,GAS,MTL,VIP,SS利用ELISA试剂盒进行测定。
1.7 基于16S rRNA扩增测序分析肠道菌群的变化
粪便中的DNA利用FastDNA Spin Kit for Feaces进行提取,然后使用V3~V4区特异性引物进行PCR扩增,最后利用BIOMIGA纯化试剂盒进行纯化。将扩增子文库以等摩尔量混合,然后在Illumina MiSeq高通量测序平台(Illumina,San Diego,CA,USA)上进行测序。测序数据经过质控,基于QIIME 2(开源,https://view.qiime2.org/)分析16S rRNA序列数据[15]。菌群的β多样性分析通过非度量多维尺度分析(non-metric multidimensional scaling,NMDS)的方法进行[16]。通过线性判别分析(liner discriminant analysis effect size,LEfSe)的方法对组间差异菌群进行分析[17]。
1.8 数据分析
本文中数据统计学分析采用LSD和Duncan′s多变量检验对各组平均值的差异进行了分析。
2 结果与分析
2.1 不同来源蛋白质对体重、食物摄入量和衰老评分的影响
为监测小鼠衰老过程中的基本健康状况,每周采集体重和摄食量的数据。随着年龄增大,每组小鼠体重都有不同程度的降低,其中大豆蛋白组降低幅度较小(图1-a)。从每周食物摄入情况来看,混合蛋白组小鼠摄食量相对高,乳清蛋白组次之,大豆蛋白组最小(图1-b)。小鼠的衰老程度通过脆弱指数进行表征,得分越高代表虚弱程度越高,机体衰老情况越严重。3组中大豆蛋白组得分最低,混合蛋白组最高(图1-c),因此,大豆蛋白组小鼠的衰老程度最低。
长期摄入大豆蛋白对衰老时期小鼠的体重具有维持作用,并且在整体衰老情况上有一定的改善。在一项长期的人群实验中也发现增加植物蛋白的摄入可以降低衰老后的累积健康缺陷指数(代表老年人的衰弱情况),并且植物蛋白质的摄入量与该指数呈负相关[9]。这可能是由于动植物蛋白质中的氨基酸组成不一致所导致。相比于乳清蛋白来说,大豆蛋白中蛋氨酸和支链氨基酸含量较低,研究表明长期限制蛋氨酸或者终身限制支链氨基酸的饮食或能改善代谢、延长寿命和延缓衰老相关疾病的发生[18-19]。

a-体重变化情况;b-摄食量比较;c-衰老评分比较
图1 不同来源蛋白对小鼠衰老表征的影响
Fig.1 Effects of proteins from different sources on the aging characteristics in mice
2.2 大豆蛋白对老龄小鼠的肌肉和骨骼健康有益
衰老时机体会面临肌肉含量下降,力量丧失;骨骼密度持续下降,易出现骨折等与肌肉和骨骼健康相关的问题。为探究不同来源蛋白对老年小鼠肌肉功能的影响,基于3个行为学实验的结果,并结合肌肉在体内的比例以及切片进行判断。绳索实验结果显示混合蛋白组、大豆蛋白组和乳清蛋白组小鼠成功的只数除上整组的数量得到绳索实验的成功率,分别为40%、83.3%和83.3%。从行走速度上看各组之间无显著性差异(图2-a),混合蛋白组小鼠抓力弱,大豆和乳清蛋白组的小鼠抓力则无显著性差异(图2-b)。为进一步解析衰老后小鼠肌肉的含量以及结构,通过肌肉含量及切片发现,大豆蛋白组小鼠肌肉含量高,乳清蛋白组次之,混合蛋白组最低(图2-c)。大豆蛋白组小鼠肌纤维排列明显比其他两组紧密,但是3组小鼠的肌肉组织中都有不同程度的脂肪异常堆积,其中混合蛋白组较为严重(图2中黑色方框),并且其部分肌纤维变形严重,被拉长而失去正常形态,另外两组在部分肌纤维中出现脂滴堆积(图2中黑色箭头),乳清蛋白组小鼠肌纤维还出现了粘连的情况(图中黑色椭圆)(图2-f)。
为探究不同来源蛋白对老年小鼠骨骼的影响,我们对小鼠大腿股骨进行显微成像(图2-e)。需要明确的是,老年小鼠骨头中骨小梁数目降低,结构不完整。3组相比,在关节处没有明显差异,但大豆蛋白组小鼠股骨的皮质骨厚度更为均匀,并且骨密度也相对高(图2-d)。
3组蛋白的摄入均不能改善衰老后肌肉组织中出现的部分肌纤维萎缩、形变以及脂肪异常堆积的现象。本研究表明,长期摄入大豆蛋白的小鼠肌肉组织相对较为健康,肌纤维排列依旧紧密,但这与文献报道的结果不一致,文献中的结果均集中在乳清蛋白或者乳清蛋白和大豆蛋白的混合物比其他蛋白质在更大程度上刺激肌肉蛋白质的合成[20-22]。但这些文献大多集中在运动之后或者短时期的干预,缺乏对宿主的长时间膳食干预影响的结果。乳清蛋白因其更高的消化率,在短期内反应更加迅速,不能长期并有效地促进肌肉蛋白合成,而大豆蛋白是一种中间消化速率蛋白,这可能是导致本实验的结果与文献不一致的原因。本实验从长远影响的角度出发,更加契合自然衰老的实际情况。BLUM等[23]的研究表明膳食大豆蛋白对老年大鼠雌激素缺乏性骨丢失的骨骼有一定的保护作用,是通过增加或维持较高的骨形成率的方式发挥作用的。在长期的热量限制饮食中,相比于酪蛋白,摄入大豆蛋白的大鼠有更好的骨质量和更高的骨形成水平[24]。本研究所用动物为老年雌性小鼠,故摄入大豆蛋白有助于改善骨骼健康。

a-步态速度;b-抓力测试;c-肌肉含量[以小腿肌肉质量(g)/体重(kg)表示];d-骨密度;e-股骨显微成像(micro-CT);f-肌肉组织形态 (HE染色,10×),黑色方框显示脂肪异常堆积,右下角为局部放大图片(40×),黑色箭头指向肌纤维中的脂滴堆积,黑色椭圆显示肌纤维粘连
图2 不同来源蛋白对衰老小鼠肌肉和骨骼的影响
Fig.2 Effects of proteins from different sources on muscles and bones of aging mice
注:*表示具有显著性差异(P<0.05)(下同)
2.3 不同来源蛋白对胃肠道转运功能无显著影响
衰老时,由于机体消化系统的不良变化,对蛋白质的消化吸收能力下降,并且植物蛋白与动物蛋白的消化率也不一致。因此,探索何种蛋白质更适合衰老的机体时,则需要考虑它们对胃肠道功能的影响,胃肠道疾病如便秘是老年人容易出现的问题之一。基于便秘的指标,我们测定了小鼠粪便含水量、一段时间排便量和小肠墨汁推进率。结果显示,混合蛋白和大豆蛋白组小鼠粪便含水量相对较高(图3-a),且相对来说大豆蛋白组排便量多(图3-b),小肠推进速度也相对较快,尽管各组之间并无统计学差异(图3-c)。由于血清中胃肠调节肽的含量可影响肠道的运输功能,其中SP,MTL和GAS分泌可以促进肠道蠕动,而VIP和SS分泌则会抑制肠道蠕动,因此测定了小鼠血清中胃肠调节肽的水平。大豆蛋白组小鼠血清中MTL含量显著高于混合蛋白组,其他指标则无显著性差异(表4)。整体结果显示不同来源的蛋白质对衰老的胃肠道转运功能无显著的影响。
蛋白质含量的高低会影响肠道蠕动速度,高蛋白饮食减慢了肠道运输功能[25],但不同种类蛋白质或氨基酸对肠道运输功能的影响未知。本研究中的饲料蛋白质含量正常,不同组别之间的蛋白质仅氨基酸组成有差异,且大豆蛋白和乳清蛋白均易于吸收,因此,这可能是3组蛋白饮食对小鼠肠道转运功能影响无显著性差异的原因。

a-粪便含水量;b-排便量;c-小肠推进率
图3 不同来源蛋白对衰老小鼠胃肠道功能的影响
Fig.3 Effects of proteins from different sources on gastrointestinal function in aging mice
表4 血清中胃肠调节肽的变化 单位:ng/L
Table 4 Alterations of regulatory peptides of the gut in serum
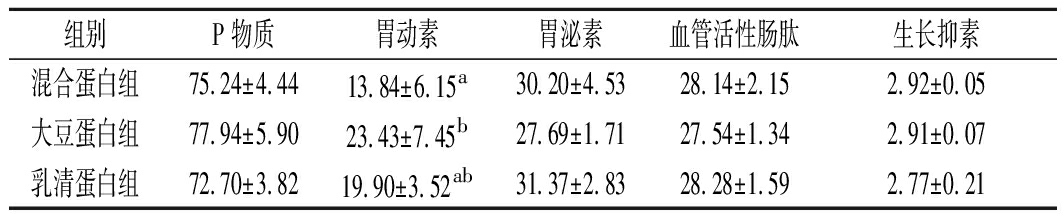
组别P物质胃动素胃泌素血管活性肠肽生长抑素混合蛋白组75.24±4.4413.84±6.15a30.20±4.5328.14±2.152.92±0.05大豆蛋白组77.94±5.9023.43±7.45b27.69±1.7127.54±1.342.91±0.07乳清蛋白组72.70±3.8219.90±3.52ab31.37±2.8328.28±1.592.77±0.21
注:实验结果以“均值±标准偏差”表示;同一列中注不同字母的组别表示具有显著性差异(P<0.05),标注相同字母及未标注字母的组别之间不具备显著性差异(P>0.05)
2.4 大豆蛋白可调节老化肠道微生物组成
肠道衰老的另一个重要变化是肠道菌群紊乱。衰老肠道菌群的特点是有益菌减少,有害菌和条件致病菌富集。为了研究不同来源蛋白质对衰老肠道微生物结构和组成的影响,我们利用16S rRNA扩增测序技术分析肠道菌群的变化。老年时期,肠道中Firmicutes的相对丰度增加,而Bacteroidetes的相对丰度降低,导致F/B值升高,在大豆蛋白组中尤为明显。另外,大豆蛋白组Actinobacteria的相对丰度较高,而其他两组Verrucomicrobia的相对丰度较高(图4-a)。基于α多样性中的Observed 操作分类单元(operational taxonomic unit ,OUT)和Shannon指数,分别从OTU数量以及物种的丰度衡量组内菌群的α多样性。结果发现,不同来源的蛋白质对肠道菌群的α多样性无显著的影响(图4-c)。基于Bray-Curtis指数的NMDS方法分析组间菌群的β多样性,发现3组小鼠的菌群结构存在显著差异(P<0.05,图4-d)。通过LEfSe对大豆蛋白与其他两个组别间差异菌属进行比较分析。结果发现,大豆蛋白组小鼠肠道菌群中Fournierella、Bifidobacterium和Alloprevotella较混合蛋白组高,而Marvinbryantia、Bifidobacterium、Fournierella、Romboutsia较乳清蛋白组高;混合蛋白组小鼠的优势菌属则是Akkermansia,而Parabacteroides、Bacteroides、Rikenellaceze RC9 gut group是乳清蛋白组小鼠的优势菌属(图4-b)。通过单独比较Bifidobacterium、Fournierella和Akkermansia的相对丰度,发现大豆蛋白组小鼠肠道中Bifidobacterium和Fournierella的相对丰度最高,而Akkermansia的相对丰度较低(图4-e)。
根据研究显示,通过灌胃大鼠低聚半乳糖,对钙、镁的吸收和滞留、骨强度和骨密度均有一定的促进作用,而这些影响直接或间接归因于盲肠pH值、盲肠内容物、壁重和双歧杆菌数量的变化,与肠道菌群的变化密切相关[26]。一项关于青少年女性的人群实验表明,摄入低聚半乳糖能够增加体内钙的吸收,有助于其骨骼健康,同时提高双歧杆菌的比例[27]。因此推测长期食用大豆蛋白促进衰老小鼠中Bifidobacterium增加,是其骨量增加的原因之一。另外Fournierellah和Alloprevotella在大豆蛋白组小鼠的肠道菌群中富集,这些菌属被认为有利于肠道菌群代谢物短链脂肪酸的产生[28]。短链脂肪酸在一定程度上可以调节体内脂肪和骨骼肌,当乙酸进入血液循环后会直接影响外周脂肪组织、肝脏和肌肉基质;而乙酸和丙酸则可能会减少骨骼肌中异位脂肪的贮存[29]。因此推测长期食用大豆蛋白促进衰老小鼠中调节短链脂肪酸菌群的增加,是其肌肉可以维持健康的原因之一。此外,Akkermansia被认为可以延缓衰老,延长寿命,实验表明Akkermansia移植能够显著延长早衰小鼠的寿命,在不同模型中寿命延长均超过了10%[30],表明摄入乳清蛋白对菌群的调控还是有一定益处的,但综合来看,大豆蛋白对衰老的机体调节作用更为明显和全面。
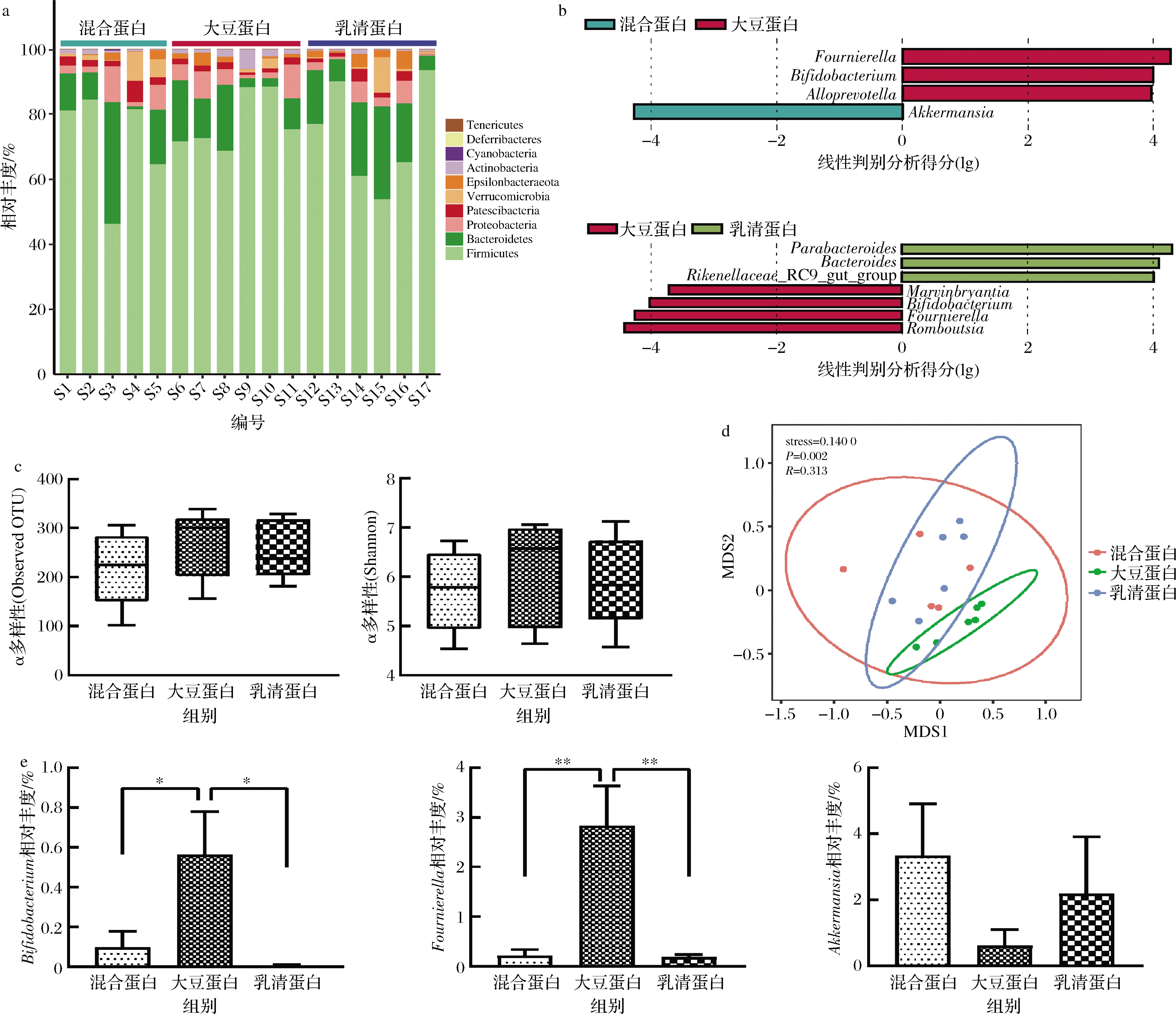
a-肠道菌群门水平的变化;b-差异菌属比较(红色、蓝色、绿色分别代表大豆蛋白组、混合蛋白组和乳清蛋白组);c-菌群的α多样性; d-菌群β多样性;e-Bifidobacterium、Fournierella和Akkermansia相对丰度的变化
图4 不同来源的蛋白对小鼠肠道菌群的影响
Fig.4 Effects of proteins from different sources on gut microbiota in mice
注:**表示具有显著性差异(P<0.01)
3 结论
综合来看,大豆蛋白可以维持衰老小鼠体重、肌肉和骨骼健康,调节衰老小鼠的肠道菌群结构和组成,同时增加肠道中Bifidobacterium和Fournierella有益菌的丰度,这些有益菌丰度的增加可能与肌肉骨骼健康密切相关。大豆蛋白的摄入更有利于改善衰老,同时结合肠道菌群的变化,可以为老年人的食品开发中选择蛋白质的种类提供参考依据。
[1] 翟振武, 刘雯莉.人口老龄化:现状、趋势与应对[J].河南教育学院学报(哲学社会科学版), 2019, 38(6):15-22.
ZHAI Z W, LIU W L.Population aging:Current situation, trend and countermeasures[J].Journal of Henan Institute of Education (Philosophy and Social Sciences Edition), 2019, 38(6):15-22.
[2] CORNWELL E Y, WAITE L J.Social disconnectedness, perceived isolation, and health among older adults[J].Journal of Health and Social Behavior, 2009, 50(1):31-48.
[3] NOWSON C, O′CONNELL S.Protein requirements and recommendations for older people:A review[J].Nutrients, 2015, 7(8):6 874-6 899.
[4] RÉMOND D, SHAHAR D R, GILLE D, et al.Understanding the gastrointestinal tract of the elderly to develop dietary solutions that prevent malnutrition[J].Oncotarget, 2015, 6(16):13 858-13 898.
[5] 郑芳, 陈长香, 崔兆一.不同年龄阶段高龄老年人排便异常状况分析[J].华北理工大学学报(医学版), 2021, 23(2):143-147.
ZHENG F, CHEN C X, CUI Z Y.Analysis of abnormal defecation in the elderly at different ages[J].Journal of North China University of Science and Technology (Health Sciences Edition), 2021, 23(2):143-147.
[6] BUFORD T W.(Dis)Trust your gut:The gut microbiome in age-related inflammation, health, and disease[J].Microbiome, 2017, 5(1):80.
[7] ARBOLEYA S, WATKINS C, STANTON C, et al.Gut bifidobacteria populations in human health and aging[J].Frontiers in Microbiology, 2016, 7:1 204.
[8] 韩婷, 蔡东联.乳清蛋白的营养特点和作用[J].肠外与肠内营养, 2005, 12(4):243-246.
HAN T, CAI D L.The nutrition behavior and function of whey protein[J].Parenteral & Enteral Nutrition, 2005, 12(4):243-246.
[9] ORTOL R, STRUIJK E A, GARC
R, STRUIJK E A, GARC A-ESQUINAS E, et al.Changes in dietary intake of animal and vegetable protein and unhealthy aging[J].The American Journal of Medicine, 2020, 133(2):231-239.
A-ESQUINAS E, et al.Changes in dietary intake of animal and vegetable protein and unhealthy aging[J].The American Journal of Medicine, 2020, 133(2):231-239.
[10] FERIDOONI H A, KANE A, AYAZ O, et al.The impact of age and frailty on ventricular structure and function in C57BL/6 J mice[J].The Journal of Physiology, 2017, 595(12):3 721-3 742.
[11] SELDEEN K L, LASKY G, LEIKER M M, et al.High intensity interval training improves physical performance and frailty in aged mice[J].The Journals of Gerontology.Series A, Biological Sciences and Medical Sciences, 2017, 73(4):429-437.
[12] JUSTICE J N, CARTER C S, BECK H J, et al.Battery of behavioral tests in mice that models age-associated changes in human motor function[J].AGE, 2014, 36(2):583-595.
[13] INGRAM D K, REYNOLDS M A.Assessing the predictive validity of psychomotor tests as measures of biological age in mice[J].Experimental Aging Research, 1986, 12(3):155-162.
[14] LEE H Y, KIM J H, JEUNG H W et al.Effects of Ficus carica paste on loperamide-induced constipation in rats[J].Food and Chemical Toxicology, 2012, 50(3-4):895-902.
[15] BOLYEN E, RIDEOUT J R, DILLON M R, et al.Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J].Nature Biotechnology, 2019, 37(8):852-857.
[16] NOVAL RIVAS M, BURTON O T, WISE P, et al.A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis[J].Journal of Allergy and Clinical Immunology, 2013, 131(1):201-212.
[17] SEGATA N, IZARD J, WALDRON L, et al.Metagenomic biomarker discovery and explanation[J].Genome Biology, 2011, 12(6):R60.
[18] REN B, WANG L F, SHI L, et al.Methionine restriction alleviates age-associated cognitive decline via fibroblast growth factor 21[J].Redox Biology, 2021, 41:101940.
[19] RICHARDSON N E, KONON E N, SCHUSTER H S, et al.Lifelong restriction of dietary branched-chain amino acids has sex-specific benefits for frailty and life span in mice[J].Nature Aging, 2021, 1(1):73-86.
[20] REIDY P T, WALKER D K, DICKINSON J M, et al.Soy-dairy protein blend and whey protein ingestion after resistance exercise increases amino acid transport and transporter expression in human skeletal muscle[J].Journal of Applied Physiology, 2014, 116(11):1 353-1 364.
[21] WITARD O C, JACKMAN S R, BREEN L, et al.Myofibrillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise[J].The American Journal of Clinical Nutrition, 2013, 99(1):86-95.
[22] BEASLEY J M, SHIKANY J M, THOMSON C A.The role of dietary protein intake in the prevention of sarcopenia of aging[J].Nutrition in Clinical Practice, 2013, 28(6):684-690.
[23] BLUM S C, HEATON S N, BOWMAN B M, et al.Dietary soy protein maintains some indices of bone mineral density and bone formation in aged ovariectomized rats[J].The Journal of Nutrition, 2003, 133(5):1 244-1 249.
[24] DUQUE G, AL SAEDI A, RIVAS D, et al.Differential effects of long-term caloric restriction and dietary protein source on bone and marrow fat of the aging rat[J].The Journals of Gerontology.Series A, Biological Sciences and Medical Sciences, 2020, 75(11):2 031-2 036.
[25] QU C, YANG G H, ZHENG R B, et al.The immune-regulating effect of Xiao′er Qixingcha in constipated mice induced by high-heat and high-protein diet[J].BMC Complementary and Alternative Medicine, 2017, 17(1):185.
[26] WEAVER C M, MARTIN B R, NAKATSU C H, et al.Galactooligosaccharides improve mineral absorption and bone properties in growing rats through gut fermentation[J].Journal of Agricultural and Food Chemistry, 2011, 59(12):6 501-6 510.
[27] WHISNER C M, MARTIN B R, SCHOTERMAN M H C, et al.Galacto-oligosaccharides increase calcium absorption and gut bifidobacteria in young girls:A double-blind cross-over trial[J].The British Journal of Nutrition, 2013, 110(7):1 292-1 303.
[28] LIU Y J, TANG B, WANG F C, et al.Parthenolide ameliorates colon inflammation through regulating Treg/Th17 balance in a gut microbiota-dependent manner[J].Theranostics, 2020, 10(12):5 225-5 241.
[29] CANFORA E E, JOCKEN J W, BLAAK E E.Short-chain fatty acids in control of body weight and insulin sensitivity[J].Nature Reviews Endocrinology, 2015, 11(10):577-591.
[30] B RCENA C, VALDÉS-MAS R, MAYORAL P, et al.Healthspan and lifespan extension by fecal microbiota transplantation into progeroid mice[J].Nature Medicine, 2019, 25(8):1 234-1 242.
RCENA C, VALDÉS-MAS R, MAYORAL P, et al.Healthspan and lifespan extension by fecal microbiota transplantation into progeroid mice[J].Nature Medicine, 2019, 25(8):1 234-1 242.