酚类物质是广泛地存在于自然界植物体中的次生代谢物之一。葡萄中酚类物质通过生化合成反应生成,并在浆果发育的过程中进行积累和贮存[1]。葡萄果实的酚类物质组成及含量和成熟度有极大的相关性,葡萄采收时的成熟度也影响葡萄酒的品质[2]。目前,酿酒企业通常将葡萄的糖酸含量作为成熟度的判断依据,而现在果实酚类物质的积累程度在成熟度的判断中也越发重要。
葡萄酒中的酚类物质对人体产生的自由基有较强的清除作用,且葡萄酒的抗氧化能力可达到维生素E的20倍,甚至是维生素C的50倍[3]。现有研究表明,由于酚类物质含有供氢基团,有较强提供氢质子的能力,可通过电子转移使活跃自由基形成稳定自由基,从而阻止新自由基的产生[4]。葡萄酒中酚类物质组成和含量的不同以及它们之间的协同作用会造成酒体抗氧化能力的差异[5]。花色苷的共轭结构使其具有抗氧化的功能,酰基和糖苷键的数量以及羟基化和甲基化程度的不同,会影响花色苷抗氧化能力的稳定性[6]。黄酮醇和黄烷-3-醇类物质的抗氧化能力受到物质结构的影响,其中B环发挥着重要作用,C环起次要作用,而A环的能力最弱,并且不同羟基所在位置的不同,清除自由基的能力也会不同[7]。
新疆天山北麓产区位于北纬43°~ 45°的区域,处于天山北麓中段,准葛尔盆地南缘,是种植酿酒葡萄的“黄金地带”,而石河子产区是其中的优质酿酒葡萄种植产区[8]。本实验使用新疆天山北麓石河子产区不同成熟度‘赤霞珠’葡萄酒为原料,利用超液相色谱-串联质谱(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)检测葡萄酒的酚类物质,并测定葡萄酒的抗氧化能力,使用主成分分析(principal component analysis,PCA)和相关性分析寻找两者之间的关联性,从而确定不同成熟度葡萄酒之间酚类物质和抗氧化能力的特征性和差异性,为新疆天山北麓石河子产区改善葡萄酒的品质提供理论参考。
1 材料与方法
1.1 材料与试剂
选取石河子市张裕巴保男爵酒庄2019年‘赤霞珠’酿酒葡萄为试材。当葡萄可溶性固形物含量 (total souble solids,TSS) 达到21、23、25、27 °Brix时采摘,并进行酿酒实验。酒样为B21、B23、B25、B27 (B21:葡萄TSS达到21 °Brix所酿葡萄酒;B23:葡萄TSS达到23 °Brix所酿葡萄酒;B25:葡萄TSS达到25 °Brix所酿葡萄酒;B27:葡萄TSS达到27 °Brix所酿葡萄酒,下同)。
果胶酶、F15酵母,法国Laffort公司;DPPH,上海麦克林生化科技公司;无水乙醇、甲醇、铁氰化钾、磷酸二氢钾、磷酸氢二钾、三氯化铁、三氯乙酸、过硫酸钾、过氧化氢等均为国产分析纯。
1.2 仪器与设备
T6紫外可见分光光度计,北京普析通用仪器有限责任公司;SF-TGL-20R高速离心机,上海安亭科学仪器厂;WineScan flex检测仪,丹麦福斯公司;FD-1A-50台式真空冷冻干燥机,上海比郎仪器制造公司;HZSH型水浴振荡器,上海思蘭达科学仪器有限公司;RE-52AA型旋转蒸发器,上海星宋科学仪器公司;PAL-2手持糖度计,日本ATAGO公司;ACQUITY UPLC H-Class超高效液相色谱仪,美国Waters公司。
1.3 实验方法
1.3.1 葡萄酒的酿造
葡萄采收后剔除叶片、霉烂及生青果,除梗破碎置于3 L不锈钢罐 (装填体积约为80%),添加60 mg/L SO2,40 min后加果胶酶200 mg/L,在5 ℃条件冷浸渍24 h,接种F15酵母200 mg/L启动酒精发酵,发酵温度保持在24~26 ℃;酒精发酵结束接入乳酸菌,启动苹乳发酵;苹乳发酵结束后皮渣分离,添加60 mg/L SO2后装瓶。酿造过程使用相同工艺,酒样符合GB/T 15037—2006《葡萄酒》对干红葡萄酒的要求。每个处理设置3个生物平行,在苹乳发酵结束后取样,取样量为250 mL×3,并置于-20 ℃冰箱保存。
1.3.2 葡萄与葡萄酒基本理化指标
测定葡萄可溶性固形物 (手持折光仪);总酸 (以酒石酸计);葡萄酒基本理化指标参照GB/T 15038—2006测定,每个样品做3组技术平行。
1.3.3 单体酚的测定
1.3.3.1 花色苷酚
色谱条件:色谱柱ACQUITY UPLC BEH C18 (100 mm×2.1 mm,1.7 μm,Waters);流动相:A相(乙腈),B相(0.2%甲酸);流速0.3 mL/min;进样量5 μL;柱温45 ℃;检测波长520 nm;洗脱梯度:0~15 min,4%~16% A;15~20 min,16%~30% A;20~25 min,30%~40% A;25~27 min,40%~80% A;27~27.1 min,80%~4% A。
质谱条件:电喷雾离子源(electron spray ionization,ESI),正离子模式,离子扫描范围50~1 500 m/z;雾化器压力30 psi;干燥气温度为325 ℃。
1.3.3.2 非花色苷酚
色谱条件:色谱柱ACQUITY UPLC BEH C18 (100 mm×2.1 mm,1.7 μm,Waters);流动相:A相(乙腈),B相(0.2%甲酸);流速0.3 mL/min;进样量1 μL;柱温45 ℃;检测波长280 nm和320 nm;洗脱梯度:洗脱梯度:0~8 min,5%~10% A;8~15 min,10%~20% A;15~20 min,20%~30% A;20~22 min,30%~60% A;22~25 min,60%~80% A;25~27 min,80%~100% A;27~27.1 min,100%~5% A。
质谱条件:ESI,正离子模式,离子扫描范围50~1 200 m/z;雾化器压力20 psi;干燥气温度为325 ℃。
1.3.4 葡萄酒抗氧化能力测定
1.3.4.1 DPPH自由基清除能力测定
DPPH自由基清除能力参照王晓宇[9]的方法。0.1 mL酒样加入3.9 mL DPPH 甲醇溶液,避光反应30 min后在517 nm测定吸光值,记为A样品。对照以相同体积15%乙醇代替酒样,吸光值记为A空白。DPPH 自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
1.3.4.2 铁离子还原力测定
铁离子还原力(ferric ion reducing antioxidant power,FRAP)测定参照王晓宇[9]的方法稍作改动。试管中加入1 mL酒样、2.5 mL缓冲液、2.5 mL 1% K3Fe(CN)6溶液,50 ℃水浴20 min后快速冷却,加入2.5 mL 10%三氯乙酸溶液,在3 000 r/min下离心10 min,吸取5 mL上清液,加入0.1%的三氯化铁溶液0.5 mL和5 mL蒸馏水,静置30 min后在700 nm测定吸光度,表示铁离子还原能力。
1.4 数据分析
数据重复3次取平均值,利用SPSS 20.0统计软件对数据进行统计分析;通过绘图软件Origin Pro 2019b进行绘图。
2 结果与分析
2.1 葡萄果实与葡萄酒基本理化指标
供试葡萄果实的基本理化指标和农艺性状如表1所示。随着采收日期的推移,葡萄的可溶性固形物得到积累。葡萄果实中的pH值未有明显变化,可滴定酸含量从8.86 g/L降至7.01 g/L,造成这种变化是由于可滴定酸在葡萄果实成熟过程中被降解导致含量的下降[10]。葡萄百粒重随着成熟度上升而逐渐降低且差异显著(P<0.05),这与葡萄成熟后期的水分散失有关[11]。果皮质量、种子质量和种子数的差异性(P<0.05)较为明显,主要是葡萄生长环境的平均气温、有效积温、日照时数、年均降雨量等因素所造成[12]。
表2为葡萄酒的基本理化指标,采收日期的推迟使葡萄醪的可溶性固形物含量上升,进而导致酒体酒精度明显增加(P<0.05),这是酿酒实验中的普遍现象[10]。还原糖含量未有明显变化,但是总酸含量下降且差异显著(P<0.05),这种变化的原因是果实成熟过程中的酸分解代谢增强,酸类物质转化为其他物质[13]。
表1 葡萄果实基础理化和农艺性状
Table 1 Physical and chemical criterion and agronomic traits of grape
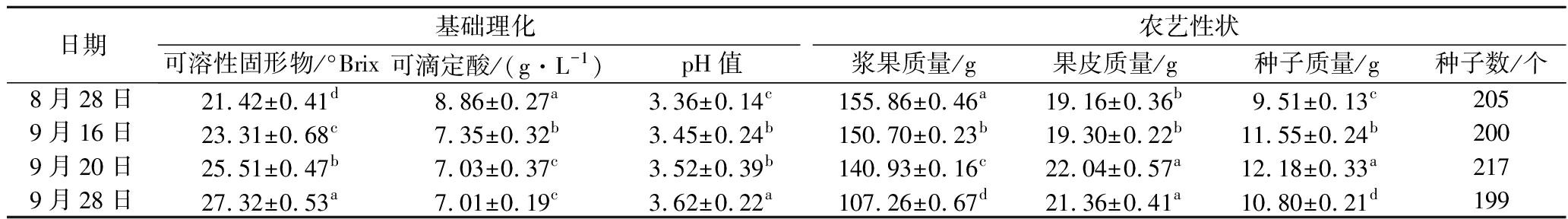
日期基础理化农艺性状可溶性固形物/°Brix可滴定酸/(g·L-1)pH值浆果质量/g果皮质量/g种子质量/g种子数/个8月28日21.42±0.41d8.86±0.27a3.36±0.14c155.86±0.46a19.16±0.36b9.51±0.13c2059月16日23.31±0.68c7.35±0.32b3.45±0.24b150.70±0.23b19.30±0.22b11.55±0.24b2009月20日25.51±0.47b7.03±0.37c3.52±0.39b140.93±0.16c22.04±0.57a12.18±0.33a2179月28日27.32±0.53a7.01±0.19c3.62±0.22a107.26±0.67d21.36±0.41a10.80±0.21d199
注:同一指标不同样品间字母不同代表差异显著(P<0.05)(下同)
表2 葡萄酒基本理化指标
Table 2 Physical and chemical criterion of red wines
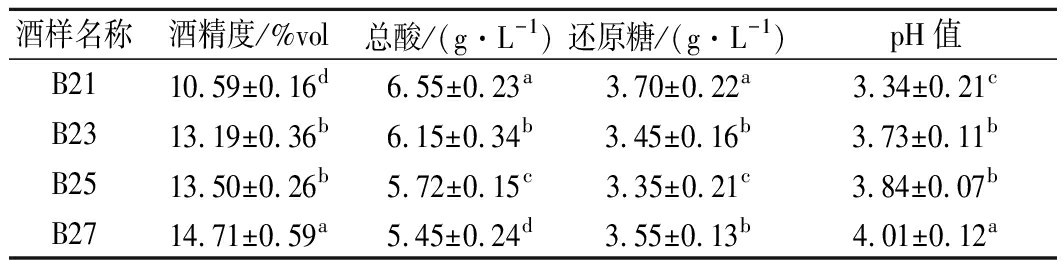
酒样名称酒精度/%vol总酸/(g·L-1)还原糖/(g·L-1)pH值B2110.59±0.16d6.55±0.23a3.70±0.22a3.34±0.21cB2313.19±0.36b6.15±0.34b3.45±0.16b3.73±0.11bB2513.50±0.26b5.72±0.15c3.35±0.21c3.84±0.07bB2714.71±0.59a5.45±0.24d3.55±0.13b4.01±0.12a
2.2 葡萄成熟度对葡萄酒中酚类物质的影响
2.2.1 花色苷物质
花色苷是葡萄酒中酚类物质的重要组成,也是赋予酒体色泽的呈色物质。由表3可知,共检出12种花色苷物质,其中花青素类3种、花翠素类2种、甲基花青素类3种、甲基花翠素类2种、二甲花翠素类2种。酒体的总花色苷含量如表3所示,随着葡萄成熟度的上升显著提升(P<0.05),4个酒样中总花色苷含量最低是B21 (1 636.53 mg/L),含量最高为B27 (3 824.86 mg/L),B23 (2 421.07 mg/L)和B25(2 425.49 mg/L)的含量相近,且差异不显著(P<0.05)。高成熟度葡萄酒展现出高于低成熟度酒体的总花色苷含量,随着葡萄果实生长发育以及花色苷的积累,导致在较高成熟度葡萄酒中含量的增加[14]。同时葡萄过熟时的水分散失导致的浓缩效应也会产生同样的结果[15]。花青素类和花翠素类物质含量呈现下降趋势,二甲花翠素类物质则表现上升趋势,而甲基花青素类则为先降后升的趋势。花翠素、甲基花青素、花青素乙酰化和花青素香豆酰化在B21中含量较高;而B27中甲基花翠素、甲基花翠素乙酰化、二甲基花翠素、二甲花翠素乙酰化、甲基花青素乙酰化和甲基花青素香豆酰化的物质含量显著高于其他样品(P<0.05)。图1-a显示葡萄酒中不同修饰组分花色苷的含量,3类不同修饰组分花色苷含量均有显著差异(P<0.05),含量大小为:乙酰化>未酰化>香豆酰化。香豆酰化花色苷在酒中含量随着葡萄成熟度上升而缓慢降低,乙酰化和未酰化花色苷含量则与之相反,并在B27的酒体中表现为最高含量。不同修饰组分花色苷在酒体中的积累会随着果实的逐渐成熟而增加,这与CADOT等[16]研究不同采收期酿造葡萄酒中不同修饰组分的变化趋势一致。
2.2.2 黄酮醇物质
黄酮醇是葡萄及葡萄酒中重要的酚类组成,主要包括槲皮素、山奈酚、杨梅酮及其相应衍生物。表3显示,酒中总黄酮醇含量随着成熟度的上升含量降低,可能是新疆地区光照强度高,黄酮醇在受到强光照射时分解,导致黄酮醇在成熟后期的含量降低[17]。黄酮醇含量在B21 (659.31 mg/L)达到最高,之后在B27 (287.51 mg/L)达到最低。共检测到黄酮醇物质10种,杨梅酮类2种,槲皮素类4种,山奈酚类4种。黄酮醇单体物质中杨梅酮-3-O-葡萄糖苷和槲皮素-3-O-半乳糖苷的含量在B21达到最高;B23酒体中槲皮素-3-O-葡萄糖苷酸和丁香亭的含量显著增加(P<0.05);B25中槲皮素-3-O-葡萄糖苷、槲皮素、山奈酚-3-O-葡萄糖苷和山奈酚-3-O-半乳糖苷的含量高于其他酒样;而在B27中,除了山奈酚-3-O-葡萄糖苷显著增加,其他黄酮醇类物质含量都显著低于(P<0.05)前三者。图1-b显示由于葡萄成熟度的增加,槲皮素类物质在酒中含量显著降低(P<0.05),从642.79 mg/L下降到269.26 mg/L;山奈酚类物质含量则呈现先上升后下降的变化,在B25中物质含量上升到最高18.19 mg/L;杨梅酮类物质未有显著的含量变化。槲皮素类物质占主要成分,并且在高成熟度葡萄酒中含量较低。主要是葡萄果实中的槲皮素在转色期和成熟期之间达到峰值后含量会不断下降,因此在果实成熟后期槲皮素类表现为低含量的情况[18]。
2.2.3 黄烷-3-醇物质
黄烷-3-醇类化合物是葡萄酒中重要的类黄酮化合物,为葡萄酒提供苦味和收敛性。由表3可知检测出5种黄烷-3-醇物质,酒体中的总黄烷-3-醇含量随着果实成熟度上升而降低,在B21总量达到最高1 624.89 mg/L,而B25则含量最低,为1 075.28 mg/L,且差异显著(P<0.05)。总黄烷-3-醇含量的下降主要是果实成熟后期黄烷-3-醇中的单体物质通过聚合作用生成聚合物,导致从葡萄果实进入葡萄酒中黄烷-3-醇含量的减少[19]。图1-c显示,随着葡萄成熟度的上升,儿茶素和原花青素B2表现为先降低后上升的趋势,而原花青素B1则是先升后降,没食子儿茶素和表没食子儿茶素呈现出逐渐升高的变化。儿茶素在B21 (1 434.67 mg/L)含量最高,并显著高于其他酒样(P<0.05);B23与B25的没食子儿茶素和原花青素B1的含量相近;B27中没食子儿茶素和原花青素B2的含量为最高,分别达到了4.96 mg/L和7.69 mg/L。
表3 葡萄酒的酚类物质含量 单位:mg/L
Table 3 Phenolic contents in wine
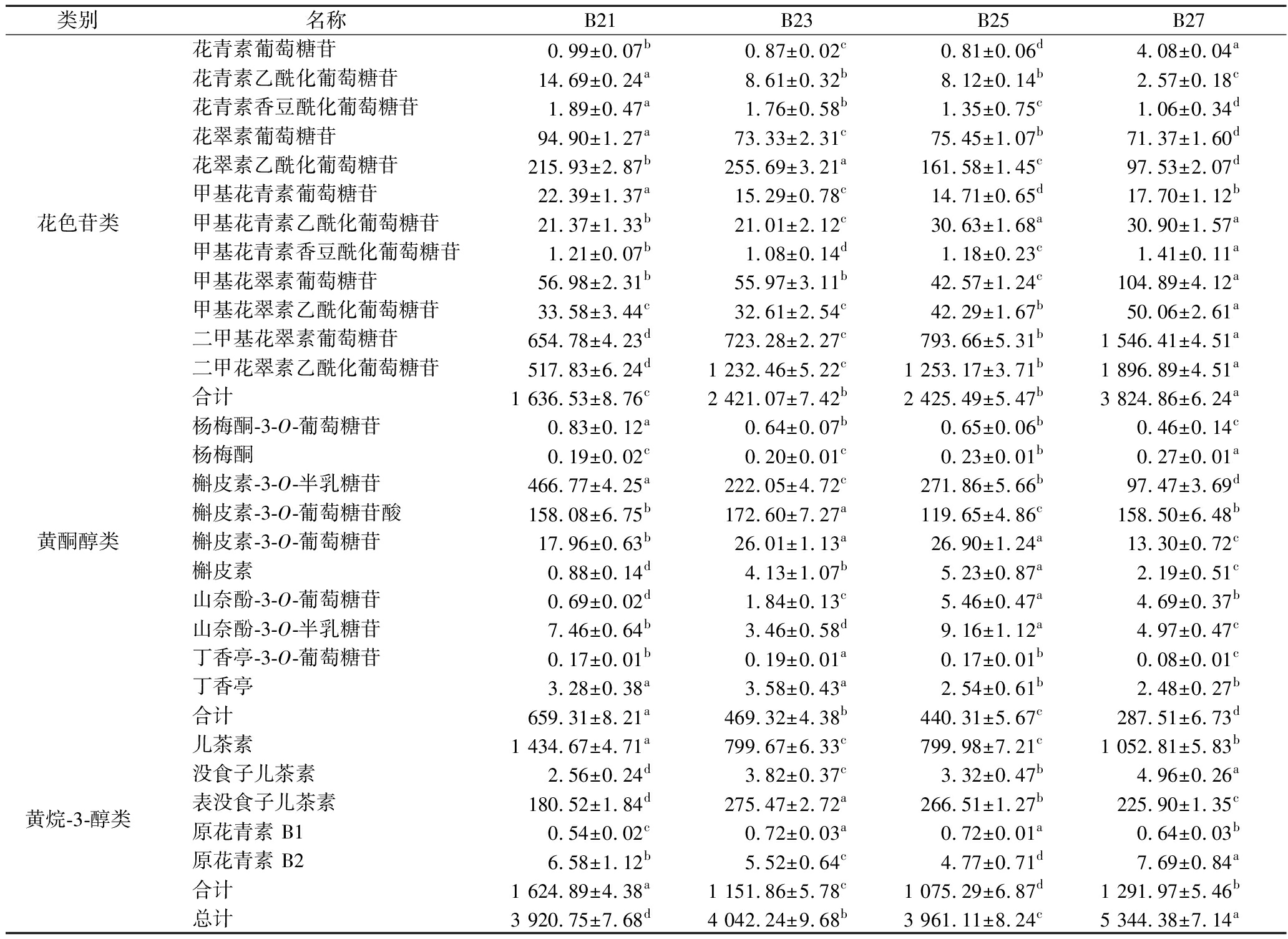
类别名称B21B23B25B27花青素葡萄糖苷0.99±0.07b0.87±0.02c0.81±0.06d4.08±0.04a花青素乙酰化葡萄糖苷14.69±0.24a8.61±0.32b8.12±0.14b2.57±0.18c花青素香豆酰化葡萄糖苷1.89±0.47a1.76±0.58b1.35±0.75c1.06±0.34d花翠素葡萄糖苷94.90±1.27a73.33±2.31c75.45±1.07b71.37±1.60d花翠素乙酰化葡萄糖苷215.93±2.87b255.69±3.21a161.58±1.45c97.53±2.07d甲基花青素葡萄糖苷22.39±1.37a15.29±0.78c14.71±0.65d17.70±1.12b花色苷类甲基花青素乙酰化葡萄糖苷21.37±1.33b21.01±2.12c30.63±1.68a30.90±1.57a甲基花青素香豆酰化葡萄糖苷1.21±0.07b1.08±0.14d1.18±0.23c1.41±0.11a甲基花翠素葡萄糖苷56.98±2.31b55.97±3.11b42.57±1.24c104.89±4.12a甲基花翠素乙酰化葡萄糖苷33.58±3.44c32.61±2.54c42.29±1.67b50.06±2.61a二甲基花翠素葡萄糖苷654.78±4.23d723.28±2.27c793.66±5.31b1 546.41±4.51a二甲花翠素乙酰化葡萄糖苷517.83±6.24d1 232.46±5.22c1 253.17±3.71b1 896.89±4.51a合计1 636.53±8.76c2 421.07±7.42b2 425.49±5.47b3 824.86±6.24a杨梅酮-3-O-葡萄糖苷0.83±0.12a0.64±0.07b0.65±0.06b0.46±0.14c杨梅酮0.19±0.02c0.20±0.01c0.23±0.01b0.27±0.01a槲皮素-3-O-半乳糖苷466.77±4.25a222.05±4.72c271.86±5.66b97.47±3.69d槲皮素-3-O-葡萄糖苷酸158.08±6.75b172.60±7.27a119.65±4.86c158.50±6.48b黄酮醇类槲皮素-3-O-葡萄糖苷17.96±0.63b26.01±1.13a26.90±1.24a13.30±0.72c槲皮素0.88±0.14d4.13±1.07b5.23±0.87a2.19±0.51c山奈酚-3-O-葡萄糖苷0.69±0.02d1.84±0.13c5.46±0.47a4.69±0.37b山奈酚-3-O-半乳糖苷7.46±0.64b3.46±0.58d9.16±1.12a4.97±0.47c丁香亭-3-O-葡萄糖苷0.17±0.01b0.19±0.01a0.17±0.01b0.08±0.01c丁香亭3.28±0.38a3.58±0.43a2.54±0.61b2.48±0.27b合计659.31±8.21a469.32±4.38b440.31±5.67c287.51±6.73d儿茶素1 434.67±4.71a799.67±6.33c799.98±7.21c1 052.81±5.83b没食子儿茶素2.56±0.24d3.82±0.37c3.32±0.47b4.96±0.26a黄烷-3-醇类表没食子儿茶素180.52±1.84d275.47±2.72a266.51±1.27b225.90±1.35c原花青素 B10.54±0.02c0.72±0.03a0.72±0.01a0.64±0.03b原花青素 B26.58±1.12b5.52±0.64c4.77±0.71d7.69±0.84a合计1 624.89±4.38a1 151.86±5.78c1 075.29±6.87d1 291.97±5.46b总计3 920.75±7.68d4 042.24±9.68b3 961.11±8.24c5 344.38±7.14a
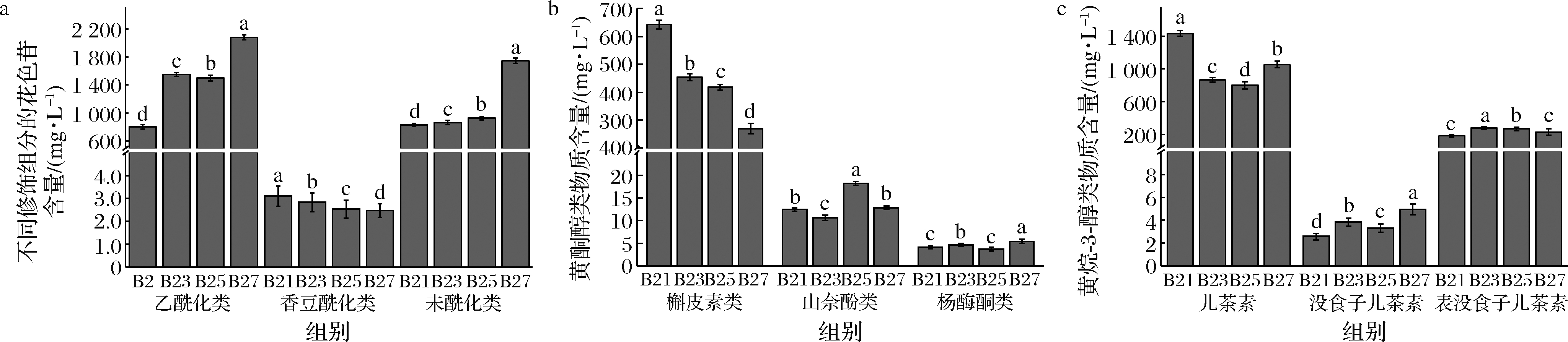
a-花色苷类;b-黄酮醇类;c-黄烷-3-醇类
图1 葡萄酒的酚类物质组成及含量
Fig.1 Composition and content of phenolic in wine
注:同一指标不同样品间字母不同则代表差异显著(P<0.05)(下同)
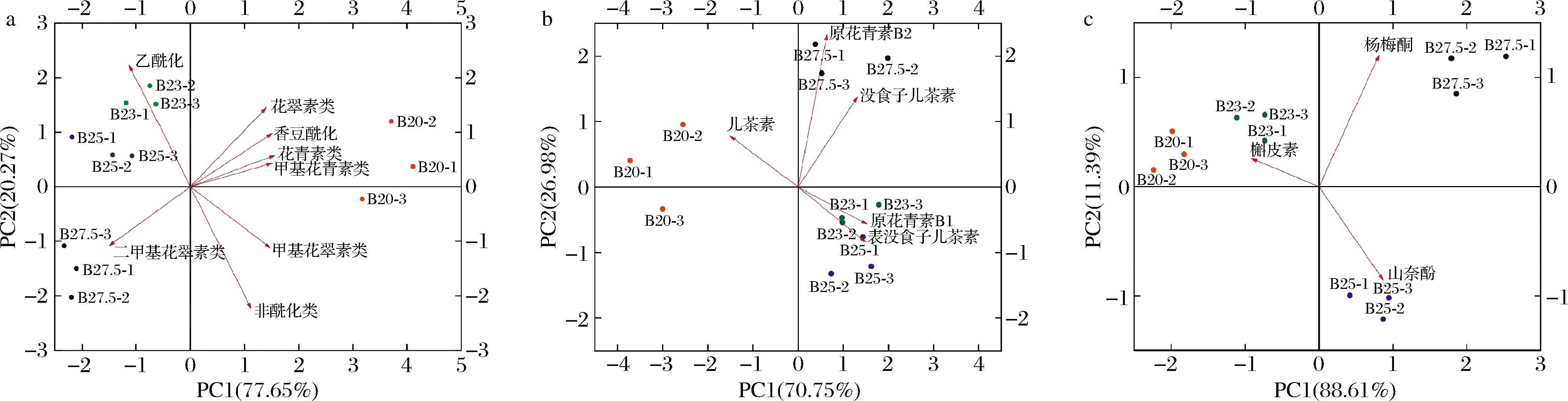
2.2.4 酚类物质PCA
为更好的分析不同成熟度葡萄酒与酚类物质的关系,对不同的酚类物质进行PCA。
花色苷PCA如图2-a所示,主成分1 (PC1)和主成分2 (PC2)共同解释总方差97.92%,可解释变量的变化情况。PC1和PC2将酒样区分在3个象限内,B23和B25在第2象限,B27则在第3象限,第4象限是B21。B21的相对含量较高的物质是未酰化花色苷,其中花青素、花翠素、甲基花青素和甲基花翠素的相对含量较高;B23和B25酒体中乙酰化花色苷相对含量较高;B27中二甲花翠素类物质是相对含量较高。
黄酮醇PCA如图2-b所示,PC1和PC2共同解释总方差 97.84%,可以说明总体情况。PC1和PC2基本能将4种葡萄酒区分。槲皮素位于x轴负半轴,山奈酚和杨梅酮则位于x轴正半轴。槲皮素类物质在B21和B23的相对含量丰富;在B25酒体中的山奈酚类相对含量丰富;杨梅酮类物质则在B27中表现相对含量较丰富。
黄烷-3-醇的PCA如图2-c所示,反应不同成熟度葡萄酒与各类黄酮醇物质的对应关系,PC1和PC2解释总方差97.73%,可解释整体变化。PC1和PC2基本能将不同成熟度葡萄酒区分。儿茶素处于x轴负半轴,没食子儿茶素、原花青素B1和原花青素B2处于x轴正半轴。B21中儿茶素的相对含量高;原花青素B1和表没食子儿茶素对B23和B25的相对含量高;酒体中原花青素B2和没食子儿茶素在B27的相对含量高。
a-花色苷类;b-黄酮醇类;c-黄烷-3-醇类
图2 葡萄酒的酚类物质PCA
Fig.2 Principal component analysis of wine phenolics
2.3 葡萄成熟度对葡萄酒抗氧化能力的影响
本实验通过DPPH自由基清除能力和FRAP来评估不同成熟度酒样的抗氧化能力。DPPH自由基的醇溶液呈紫色并含单电子自由基,可与抗氧化物质产生褪色反应,使用紫外分光光度计进行测定[20]。FRAP是检测葡萄酒是否为良好的电子供应者,抗氧化物质通过自身还原作用提供电子达到清除自由基的目的,还原能力越强抗氧化能力越强[21]。由于不同的抗氧化能力测定方法的原理不同,所以会造成结果上的差异。
由图3可知随着成熟度的增加,DPPH自由基清除率呈现下降趋势,FRAP却为上升趋势。B23和B25的测定结果相近,而B21和B27则差异明显。对于DPPH自由基清除率而言,B21、B23和B25的DPPH自由基清除率均达到75 %以上,B27的清除率最低为55%,主要是B27中花色苷含量较高,花色苷物质的酰基和糖苷键的形成可提升分子结构稳定性,从而降低清除DPPH自由基的活性[22]。FRAP的数据显示,B21表现接近于B25的还原能力,B21的黄酮醇和黄烷-3-醇的含量高于其他酒样,并且黄酮类化合物螯合Fe3+最有效位点为C6—OH、C7—OH结构,C3—OH、C5—OH与C—4位置羰基能会在一定程度上增强螯合能力[23],这是导致B21展现出B25相似的还原能力。
抗氧化能力测定表明,不同成熟度葡萄酒的抗氧化能力存在显著差异,而这种差异是抗氧化活性物质的含量和组成的不同所导致。有研究人员发现花色苷含量的增加会使DPPH自由基清除率降低,同时DPPH自由基清除能力与酒体中黄酮醇有较高相关性。儿茶素和槲皮素对DPPH自由基清除活性最高,表现较强的抗氧化活性[24-25]。本研究中B20的DPPH自由基清除率最高,而B27为最低。B27酒体中黄酮醇和黄烷-3-醇的含量低于其他酒样,但是花色苷物质含量则较高于其他酒样。因此推测,酒体中黄酮醇和黄烷-3-醇含量对DPPH自由基清除率的有较大影响,而花色苷的影响则较小。章萍萍[26]在对花色苷抗氧化作用的研究中证实酰基的存在可以一定程度上提升花色苷的抗氧化能力,酰基可以提高其自身的FRAP。本研究中相关性分析表明FRAP与酒体中花色苷乙酰化有显著相关性,B23、B25和B27酒样中的花色苷乙酰化含量均高于B20,因此影响不同成熟度葡萄酒的FRAP的主要物质是花色苷乙酰化类物质。
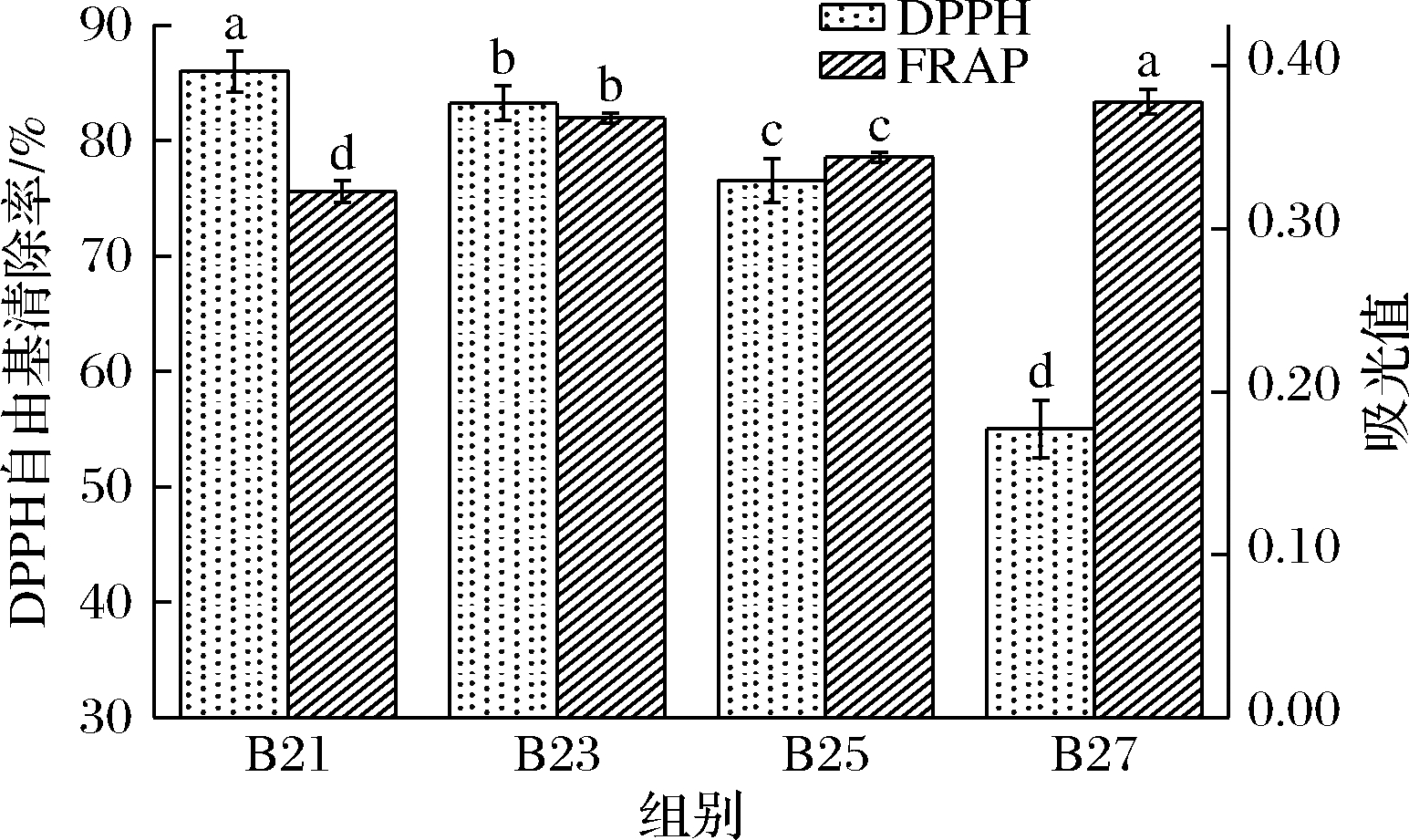
图3 葡萄酒的抗氧化能力
Fig.3 Antioxidant activity of wine
2.4 葡萄酒酚类物质含量与抗氧化能力相关性分析
为了解葡萄酒酚类物质与其抗氧化能力的内在联系,分别对葡萄酒中酚类物质含量与抗氧化结果进行Pearson相关性分析。相关性结果如图4所示(https://kns.cnki.net/kcms/detail/11.1802.TS.20211117.1017.001.html),花青素、甲基花翠素、花青素香豆酰化、杨梅酮、原花青素B2与DPPH自由基清除率呈现显著负相关(P<0.05),但是同FRAP则呈现显著正相关(P<0.05)。二甲花翠素、甲基花翠素乙酰化、甲基花青素乙酰化、二甲花翠素乙酰化、没食子儿茶素与DPPH自由基清除率呈现极显著负相关(P<0.01),同FRAP还原能力呈现极显著正相关(P<0.01)。花翠素、花翠素乙酰化、花青素乙酰化、槲皮素、儿茶素、黄酮醇和黄烷-3-醇与DPPH自由基清除能力呈现极显著正相关(P<0.01),但是同FRAP呈现极显著负相关(P<0.01)。关于2种抗氧化能力测定方法,DPPH自由基清除能力与FRAP的相关性最高,相关系数为-0.657 (P<0.05),这与2种检测方法的原理不同有较大关联。
3 结论
本研究以新疆天山北麓石河子产区不同成熟度‘赤霞珠’葡萄酒为原料,测定其酚类物质组成及抗氧化能力,分析两者之间的关联性,从而探究不同成熟度葡萄酒之间酚类物质和抗氧化能力的特征性和差异性。通过分析发现不同成熟度的‘赤霞珠’葡萄酒中,花色苷含量随着葡萄成熟度的上升而增加,黄酮醇和黄烷-3-醇含量呈现含量则呈现下降趋势。酚类物质的PCA显示,未酰化花色苷、乙酰化花色苷、槲皮素、儿茶素、原花青素B1和表没食子儿茶素在较低成熟度葡萄酒中相对含量较高;二甲花翠素、山奈酚、杨梅酮、原花青素B2和没食子儿茶素在较高成熟度葡萄酒相对含量较高。不同成熟度葡萄酒的抗氧化能力不同,B21的DPPH自由基清除能力最高,但是B27的FRAP最强。通过相关性分析表明,中黄酮醇和黄烷-3-醇类物质对DPPH自由基清除能力贡献较大;与花色苷乙酰化类、黄酮醇和黄烷-3-醇对FRAP测定贡献较大。本研究探究葡萄成熟度对葡萄酒酚类物质和抗氧化能力的影响,不仅为深入研究不同成熟度葡萄酒的酚类物质和抗氧化能力之间的内在联系提供理论基础,而且对新疆天山北麓石河子产区葡萄采收期的选择也具有良好的实践意义。

图4 葡萄酒中酚类物质与抗氧化活性相关性分析热图
Fig.4 Correlation of phenolic and antioxidant activity in wine heat map
注:**表示P<0.01,*表示P<0.05
[1] 朱美蓉, 房玉林.葡萄多酚研究进展及其开发利用[J].中国酿造, 2015, 34(12):1-4.
ZHU M R, FANG Y L.Research progress and application of grape polyphenol[J].China Brewing, 2015, 34(12):1-4.
[2] 刘怡萱, 袁春龙, 常远, 等.新疆吐鲁番产区‘美乐’葡萄成熟度指标体系研究[J].西北农业学报, 2020, 29(10):1 566-1 575.
LIU Y X, YUAN C L, CHANG Y, et al.Maturity index system of ‘Merlot’ grape in turpan region of Xinjiang[J].Acta Agriculturae Boreali-occidentalis Sinica, 2020, 29(10):1 566-1 575.
[3] DANI C, OLIBONI L S, AGOSTINI F, et al.Phenolic content of grapevine leaves (Vitis labrusca var.Bordo) and its neuroprotective effect against peroxide damage[J].Toxicology in Vitro, 2010, 24(1):148-153.
[4] 刘文忠, 奚德智, 刘欠欠, 等.葡萄多酚的保健作用及其在酿酒葡萄成熟度判定中的应用[J].中国酿造, 2008,27(21):1-6.
LIU W Z, XI D Z, LIU Q Q, et al.Health-care function of grape polyphenols and their application in judging the maturity of wine grapes[J].China Brewing, 2008,27(21):1-6.
[5] HUBNER A, SOBREIRA F, NETO A V, et al.The synergistic behavior of antioxidant phenolic compounds obtained from winemaking waste′s valorization, increased the efficacy of a sunscreen system[J].Antioxidants (Basel, Switzerland), 2019, 8(11):530-538.
[6] ALI H M, ALMAGRIBI W, AL-RASHIDI M N.Antiradical and reductant activities of anthocyanidins and anthocyanins, structure-activity relationship and synthesis[J].Food Chemistry, 2016, 194:1 275-1 282.
[7] 任红, 郑少杰, 张小利, 等.基于不同抗氧化机制的黄酮类化合物构效关系研究进展[J].食品工业科技, 2016, 37(2):384-388.
REN H,ZHENG S J,ZHANG X L,et al.Research progress on the structure-activity relationship of flavonoid compounds based on different antioxidant mechanism[J].Science and Technology of Food Industry, 2016, 37(2):384-388.
[8] 汪慧. 新疆酿酒葡萄气候区划与品种区域化研究[D].杨凌:西北农林科技大学, 2010.
WANG H.Study on the climatic zoning of viticulture and grapevine variety zoning of Xinjiang[D].Yangling:Northwest A&F University, 2010.
[9] 王晓宇. 葡萄酒抗氧化活性及其检测方法的研究[D].杨凌:西北农林科技大学, 2008.
WANG X Y.Study on the antioxidant activity and methods of detection in wine[D].Yangling:Northwest A&F University, 2008.
[10] 苏鹏飞. 宁夏青铜峡产区主栽红色酿酒葡萄成熟度控制指标的研究[D].杨凌:西北农林科技大学, 2016.
SU P F.Study of maturity control indexes of major red wine grapes from Qingtongxia city in Ningxia[D].Yangling:Northwest A&F University, 2016.
[11] 李华. 葡萄酒工艺学[M].北京:科学出版社, 2007.
LI H.Wine Technology[M].Beijing:Science Press, 2007.
[12] 杨成涛, 孙丽平, 孙云, 等.云南省4个主产区无核白鸡心葡萄果皮组成成分及抗氧化能力分析[J].食品科学, 2015, 36(22):85-89.
YANG C T, SUN L P, SUN Y, et al.Chemical composition and antioxidant capacity of centennial seedless grape skins from four main producing areas in Yunnan[J].Food Science, 2015, 36(22):85-89.
[13] 王晶, 万智博, 许超丽, 等.新疆产区酿酒葡萄果实中有机酸的比较分析[J].现代食品科技, 2020, 36(2):249-254;69.
WANG J, WAN Z B, XU C L, et al.Comparative analysis of organic acids in wine grape fruits from Xinjiang[J].Modern Food Science and Technology, 2020, 36(2):249-254;69.
[14] ROUSSERIE P, LACAMPAGNE S, VANBRABANT S, et al.Influence of berry ripeness on seed tannins extraction in wine[J].Food Chemistry, 2020, 315:126307.
[15] OBENLAND D, FELIZIANI E, ZHU S, et al.Potassium application to table grape clusters after veraison increases soluble solids by enhancing berry water loss[J].Scientia Horticulturae, 2015,187:58-64.
[16] CADOT Y, CAILLÉ S, SAMSON A, et al.Sensory representation of typicality of Cabernet franc wines related to phenolic composition:Impact of ripening stage and maceration time[J].Analytica Chimica Acta, 2012, 732:91-99.
[17] BENBOUGUERRA N, RICHARD T, SAUCIER C, et al.Voltammetric behavior, flavanol and anthocyanin contents, and antioxidant capacity of grape skins and seeds during ripening (Vitis vinifera var.merlot, tannat, and syrah)[J].Antioxidants, 2020, 9(9):800.
[18] BARBAR J, SILVA É, BIASOTO A C T, et al.Maturation and maceration effects on tropical red wines assessed by chromatography and analysis of variance-principal component analysis[J].Journal of the Brazilian Chemical Society, 2019, 30(7):1 357-1 377.
J, SILVA É, BIASOTO A C T, et al.Maturation and maceration effects on tropical red wines assessed by chromatography and analysis of variance-principal component analysis[J].Journal of the Brazilian Chemical Society, 2019, 30(7):1 357-1 377.
[19] MONAGAS M, G MEZ-CORDOVÉS C, BARTOLOMÉ B, et al.Monomeric, oligomeric, and polymeric flavan-3-ol composition of wines and grapes from Vitis vinifera L.Cv.Graciano, Tempranillo, and Cabernet Sauvignon[J].Journal of Agricultural and Food Chemistry, 2003, 51(22):6 475-6 481.
MEZ-CORDOVÉS C, BARTOLOMÉ B, et al.Monomeric, oligomeric, and polymeric flavan-3-ol composition of wines and grapes from Vitis vinifera L.Cv.Graciano, Tempranillo, and Cabernet Sauvignon[J].Journal of Agricultural and Food Chemistry, 2003, 51(22):6 475-6 481.
[20] LI X C.Comparative Study of 1,1-diphenyl-2-picryl-hydrazyl radical (DPPH center dot) scavenging capacity of the antioxidant xanthones family[J].Chemistry Select, 2018, 3(46):13 081-13 086.
[21] 毛建利, 李艳.赤霞珠葡萄皮渣酚类物质提取及抗氧化性研究[J].食品研究与开发, 2019, 40(1):118-124.
MAO J L, LI Y.Study on extraction and antioxidation of phenolic compounds from cabernet sauvignon grape pomace[J].Food Research and Development, 2019, 40(1):118-124.
[22] OLIVEIRA J, DA SILVA M A, PAROLA A J, et al.Structural characterization of a a-type linked trimeric anthocyanin derived pigment occurring in a young port wine[J].Food Chemistry, 2013, 141(3):1 987-1 996.
[23] OLENNIKOV D N, KASHCHENKO N I, CHIRIKOVA N K.A novel HPLC-assisted method for investigation of the Fe2+-chelating activity of flavonoids and plant extracts[J].Molecules, 2014, 19(11):18 296-18 316.
[24] SUN B S, SPRANGER I, YANG J Y, et al.Red wine phenolic complexes and their in vitro antioxidant activity[J].Journal of Agricultural & Food Chemistry, 2009, 57(18):8 623-8 627.
[25] LINGUA M S, FABANI M P, WUNDERLIN D A, et al.From grape to wine:Changes in phenolic composition and its influence on antioxidant activity[J].Food Chemistry, 2016, 208:228-238.
[26] 章萍萍. 紫薯花青素的提取、纯化及其抗氧化和益生元活性研究[D].合肥:合肥工业大学, 2017.
ZHANG P P.Study on extraction, purification and activity of antioxidant and prebiotics of purple sweet potato anthocyanins[D].Hefei:Hefei University of Technology, 2017.