短乳杆菌(Lactobacillus brevis)是乳杆菌属的成员之一,是一种专性异型发酵乳酸的乳酸菌,产生乳酸、二氧化碳、乙醇和乙酸,最适生长温度为30 ℃,pH为4~6[1]。短乳杆菌的菌株被证实具有良好的益生特性,具有促进肠道菌群健康和用作益生菌的潜力[2-4]。在食品发酵生产方面,由于其生长迅速,产酸性能好,且具有分泌细菌素等抑菌成分的能力[5],常被用作发酵食品的发酵菌株或辅助发酵剂。在果蔬发酵中,短乳杆菌是起始发酵和主发酵阶段主要的优势菌,对于发酵果蔬的品质形成发挥着多重作用,如改善食品风味、增进营养价值、产生风味物质、抑制杂菌生长等[6-7]。在发酵乳品的生产中,短乳杆菌对干酪成熟的过程有一定的影响,能促进产品风味的形成[8]。在酸面团的发酵中,能促进面团的酸化和风味的形成,常与传统面包酵母混合作为酸面团的发酵剂[9-10]。
噬菌体是专性以细菌为宿主的病毒,分为烈性噬菌体和温和噬菌体。烈性噬菌体是指能在短时间内完成吸附、侵入、增殖、成熟和裂解过程而实现增殖的噬菌体。乳酸菌发酵食品和益生菌菌剂生产中时常发生噬菌体污染,导致发酵产酸变慢,发酵周期延长,污染严重时会造成发酵菌株快速死亡,致使发酵失败。烈性噬菌体的污染和增殖是导致发酵食品生产失败的主要因素之一。如何防止噬菌体的污染是食品发酵生产过程需解决的一个重要问题。目前,发酵食品中乳酸菌噬菌体的研究主要集中在乳酸乳球菌(Lactococcus lactis)噬菌体[11]、植物乳杆菌(Lactococcus plantaraum)噬菌体[12]、干酪乳杆菌(Lactococcus casei)噬菌体[13]等,而短乳杆菌噬菌体的研究较少,只有少数的文献报道了相关的研究。DEASY等[14]从发酵的蔬菜中分离出短乳杆菌噬菌体,并研究了其在控制导致啤酒腐败的短乳杆菌菌株方面的应用,结果表明其在啤酒中具有稳定作用,能控制宿主菌的生长。
鉴于短乳杆菌噬菌体对食品发酵的危害和目前短乳杆菌噬菌体的研究仍较缺乏,本实验从发酵泡菜水环境中分离纯化短乳杆菌烈性噬菌体,通过电镜形态和核酸类型进行鉴定,并且研究了生物学特性,实验结果为生产中防治相关噬菌体的污染和进一步筛选抗噬菌体菌株奠定了基础。
1 材料与方法
1.1 材料与试剂
MRS培养基,广东环凯生物技术有限公司;柱法病毒DNA抽提试剂盒,广州美基生物科技有限公司;Marker Q、RNase A、DNase I和T4连接酶,上海生工生物有限公司;DNA限制酶和DL 15 000 DNA marker,日本Takara公司;其余试剂为均为分析纯。
1.2 菌种和培养基
1.2.1 菌种
短乳杆菌CICC 6239,来源于中国工业微生物菌种保藏中心,用作于分离噬菌体的宿主菌。
1.2.2 培养基
MRS培养基:用于宿主菌的活化与培养。
MRS-Ca培养基:MRS培养基中添加CaCl2至终浓度为10 mmol/L,用于噬菌体的分离、纯化与增殖。采用双层平板法分离纯化噬菌体时,下层平板采用1.5%(质量分数)琼脂的MRS-Ca培养基,上层平板采用0.6%(质量分数)琼脂的MRS-Ca培养基。
1.3 仪器与设备
UV-2550紫外可见分光光度计,日本岛津公司;4-16K高速冷冻离心机,德国SIGMA公司;PowerPac Basic电泳仪、Gel Doc XR+凝胶成像系统,美国Bio-Rad公司;EM-1200透射电子显微镜,日本Jeol公司。
1.4 实验方法
1.4.1 噬菌体的分离与纯化
按1%的接种量将宿主菌接种到MRS液体培养基中,30 ℃培养至对数期前期(OD600nm约为0.3)得到宿主菌液。分离样品于5 000×g离心5 min后,取上清液经0.22 μm无菌微孔滤膜过滤后,取5 mL加入到含有5 mL两倍浓度的MRS-Ca培养基中,然后加入宿主菌液100 μL;用5 mL无菌蒸馏水替代样品滤液作为空白对照。30 ℃培养12~16 h,观察样品管是否澄清。将已澄清的增殖液离心后,上清液过0.22 μm无菌微孔滤膜过滤。取0.5 mL上述滤液加入到5 mL MRS-Ca液体培养基中,然后加入宿主菌液100 μL,30 ℃培养至完全澄清,采用0.22 μm无菌微孔滤膜过滤,得到增殖液。采用双层平板法分离噬菌体,增殖液用MRS-Ca培养基作10倍梯度稀释,取合适稀释度的稀释液0.5 mL与8 mL上层培养基(加热融化后预冷至45 ℃)混合,再加入0.2 mL的对数期前期的宿主菌液,混合后倾倒于预先倒好底层培养基的平板上,凝固后于30 ℃培养24 h,观察上层平板中形成的噬菌斑。用无菌牙签挑取上层平板中含有清晰单个噬菌斑的小琼脂块,转移到0.5 mL MRS-Ca培养基中,涡旋振荡后,加入0.2 mL宿主菌液,然后与8 mL上层培养基混合后,倾倒于底层平板上,30 ℃培养24 h形成噬菌斑。将双层平板分离,挑取噬菌斑纯化和增殖重复操作5次,得到纯化后的噬菌体。
1.4.2 噬菌体效价的测定
采用双层平板法测定噬菌体效价,待测增殖液用MRS-Ca培养基作10倍梯度稀释,取合适稀释度的稀释液100 μL与等体积的宿主菌液混合后,加入到8 mL加热融化后预冷至45 ℃的上层培养基中,混合均匀倾倒于下层平板上,凝固后于30 ℃培养24 h,通过平板上形成的噬菌斑数量计算噬菌体效价(pfu/mL)。
1.4.3 透射电镜观察
参考文献[15]的方法并稍作修改后用于透射电镜的观察:纯化后的噬菌体负染色后采用透射电子显微镜观察毒粒形态。高效价(>1010 pfu/mL)的增殖液20 μL滴加到覆盖有聚醋酸甲基乙烯脂膜的铜网上,静置20 min后,用2%的醋酸铀酰染色10 min,待干燥后用透射电子显微镜在120 V下观察并拍照。
1.4.4 DNA提取与限制性酶切[16]
高效价(>1010 pfu/mL)的增殖液5 mL中加入RNase A和DNase I至终质量浓度分别为1 μg/mL,于37 ℃保温30 min,8 000×g离心5 min后,取上清液采用病毒DNA抽提试剂盒提取噬菌体DNA。噬菌体基因组采用RNase A、Mung Bean Nuclease、DNase I和限制酶EcoR I和BamH I进行酶切,酶切产物于65 ℃水浴中保温10 min,然后用0.8%琼脂糖电泳,GelRed染色后,凝胶成像系统拍照,采用Quantitiy One软件分析和估算酶切条带的分子质量大小。噬菌体DNA用T4连接酶处理后置于4 ℃冰箱12 h,连接产物用EcoR I和BamH I进行酶切,酶切产物琼脂糖凝胶电泳,分析噬菌体基因组的包装机制。
1.4.5 最佳感染复数的测定
宿主菌接种到MRS-Ca中培养至对数中期(OD600nm=0.5),采用平板菌落计数法测定活菌数。噬菌体新鲜增殖液经稀释后,与宿主菌液按不同比例混合,使感染复数(multiplicity of infection,MOI)为10、1、0.1、0.01、0.001,30 ℃ 100 r/min摇床上培养6 h后,8 000×g离心5 min后,取上清液测定效价。
1.4.6 一步生长曲线的测定
取培养至对数中期(OD600nm=0.5)的宿主菌液10 mL,8 000×g离心5 min弃上清液,用1 mL MRS-Ca培养基重悬菌体,按感染复数0.5加入相应效价的噬菌体增殖液1 mL,于30 ℃吸附30 min,8 000×g离心5 min收集菌体细胞,重悬于100 mL MRS-Ca培养基中,于30 ℃静置培养,每隔0.5 h取样测定上清液中的效价。一步生长曲线以时间为横坐标,噬菌体效价的对数值为纵坐标绘制。
1.4.7 物理与化学因素对噬菌体的影响
1.4.7.1 温度对噬菌体存活的影响
噬菌体增殖液(108 pfu/mL)各取2 mL装入到离心管中,分别在不同温度条件下处理,在0.5、1、2、5、10、20、30 min时取样测定效价,结果以效价随时间变化的曲线表示。
1.4.7.2 pH对噬菌体存活的影响
用1 mol/L的HCl和NaOH调整噬菌体增殖液(108pfu/mL)的pH至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,30 ℃静置30 min后,取样测定效价,结果以效价随pH变化的曲线表示。
1.4.7.3 化学消毒剂对噬菌体存活的影响
噬菌体增殖液(108 pfu/mL)中分别加入无水乙醇至终体积分数为30%、50%、75%,分别加入1%的次氯酸钠溶液至终质量浓度为100、250、500 mg/L,在不同时间点取样测定效价,结果以效价随时间变化的曲线表示。
1.4.8 数据处理与分析
实验测定重复3次,结果采用平均值±标准差的形式表示。数据的统计学分析采用SPSS 20进行,不同处理件的数据采用单因素方差分析(one-way ANOVA)进行,P<0.05表示有显著性差异。采用OriginPro 8.5.1进行绘图。
2 结果与分析
2.1 噬菌体的分离与鉴定
将经0.22 μm滤膜过滤后的发酵泡菜水样品与对数期的宿主菌菌液混合后,培养至澄清,培养液以10倍比例稀释后,采用双层平板法检测,可见噬菌斑的形成。挑取单个噬菌斑经过双层平板反复纯化5次后,可在双层平板上观察到清晰透明的圆形噬菌斑,直径约为1~2 mm。该纯化后的噬菌体命名为φB23。经负染色后的φB23在透射电镜下观察其形态,如图1所示。噬菌体φB23无包膜,由头部和尾部组成,全长(380.2±2.3) nm。头部可观察到典型的多面体结构,头部直径(106.7±8.1) nm;尾部观察到可弯曲的长尾,尾部长(216.7±2.7) nm,宽(24.7±1.2) nm,未观察到尾部的长度可收缩。根据以上形态特征,按照国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)的分类标准[17],噬菌体φB23属于尾噬菌体目(Caudovirales)、长尾噬菌体科(Siphoviridae)。
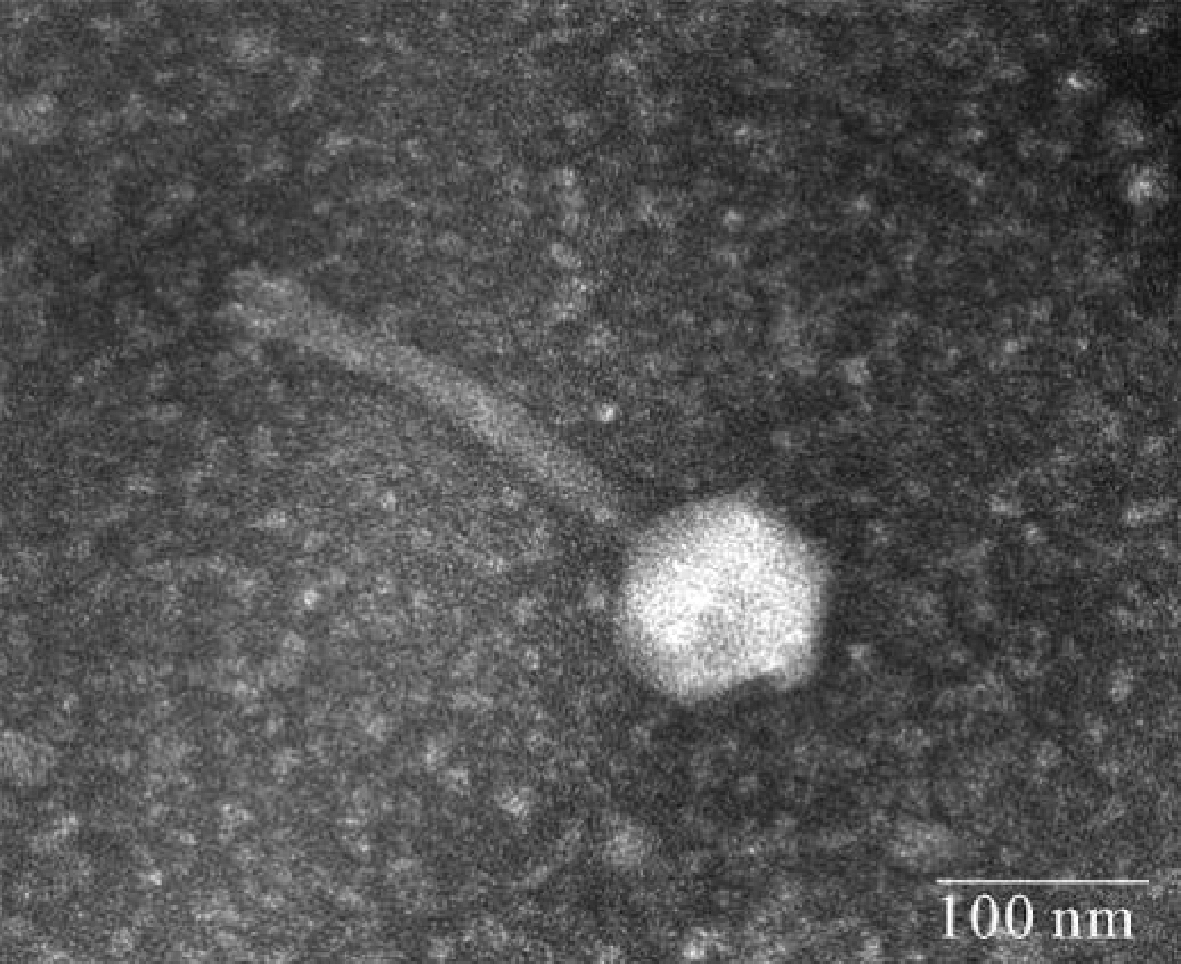
图1 噬菌体φB23的负染色透射电镜形态
Fig.1 Transmission electron micrograph of phage φB23 with negative staining
2.2 噬菌体基因组的核酸类型与限制性酶切
如图2-a所示,噬菌体φB23的基因组经RNase A处理后琼脂糖电泳未发现有明显的降解,而φB23基因组可以被DNase降解,表明噬菌体φB23基因组的核酸类型是DNA而不是RNA,φB23基因组不能被Mung Bean nuclease降解,表明不是单链核酸。综合以上结果可知其基因组为双链DNA。噬菌体φB23的基因组和经T4连接酶过夜处理后的基因组用BamH I和EcoR I酶切后的琼脂糖电泳图谱如图2-b所示。噬菌体φB23的基因组能被限制性内切酶切开,经BamH I酶切可产生8条条带,EcoR I酶切可产生10条条带,根据酶切片段大小估算噬菌体φB23的基因组大小约为52.4 kb(图2-c)。基因组经T4连接酶处理后,BamH I酶切后的条带数比未连接基因组的酶切条带有减少,表明噬菌体φB23基因组的包装机制是黏末端连接。
2.3 最佳感染复数的测定
将噬菌体φB23和宿主菌按不同的比例混合后,用双层平板法检测上清液中子代噬菌体的效价,结果如表1所示。当感染复数从10降至0.001时,子代噬菌体的效价逐渐增加,到0.001时达到最大,为(8.97±0.13) lgpfu/mL;而感染复数从0.001到0.000 1 变化时,效价出现降低的趋势。因此,噬菌体φB23的最佳感染复数为0.001。
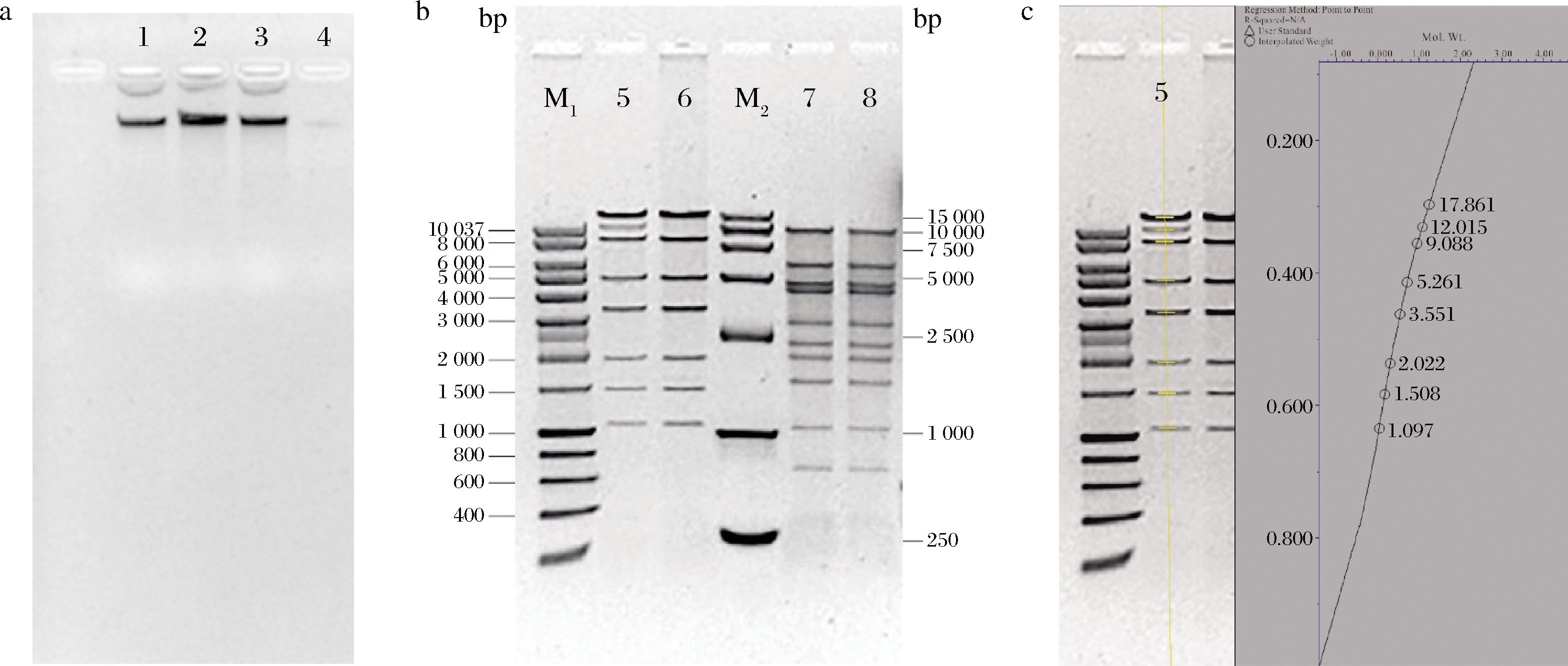
a-RNase A、Mung Bean nuclease和DNase I酶切后的电泳图(1-噬菌体φB23基因组;2-基因组经RNase A酶切;3-基因组经Mung Bean nuclease酶切; 4-基因组经DNase I酶切);b-限制性酶切后的电泳图(M1-marker Q;5-基因组BamH I 酶切;6-基因组经T4连接酶处理后再用BamH I酶切; M2-DL 15 000 DNA marker;7-基因组EcoR I 酶切;8-基因组经T4连接酶处理后再用EcoR I 酶切);c-基因组分子质量大小分析
图2 噬菌体基因组的酶切电泳图及分子质量分析
Fig.2 Agarose gel electrophoresis of phage φB23 genome and analysis of its molecular weight
表1 噬菌体φB23最佳感染复数的测定
Table 1 Determination of multiplicity of infection
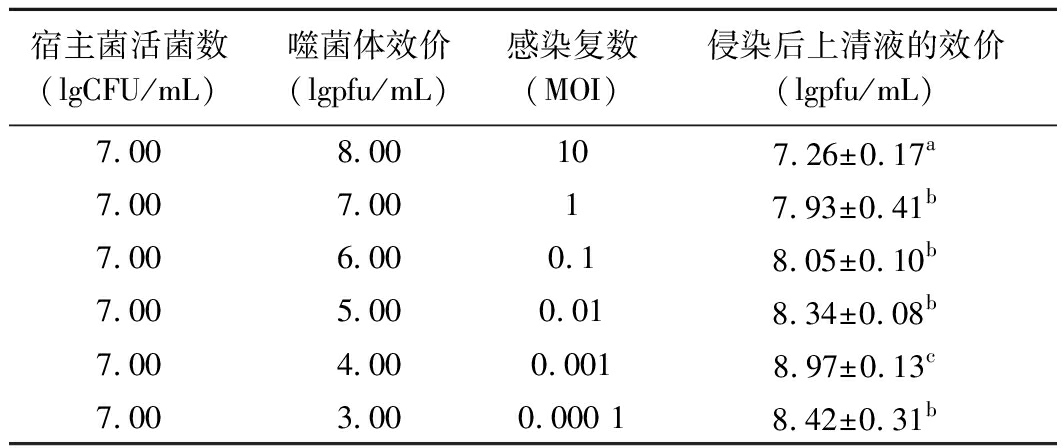
宿主菌活菌数(lgCFU/mL)噬菌体效价(lgpfu/mL)感染复数(MOI)侵染后上清液的效价(lgpfu/mL)7.008.00107.26±0.17a7.007.0017.93±0.41b7.006.000.18.05±0.10b7.005.000.018.34±0.08b7.004.000.0018.97±0.13c7.003.000.000 18.42±0.31b
注:小写字母表示不同MOI得到的效价有显著性差异(P<0.05)
2.4 一步生长曲线
噬菌体φB23的一步生长曲线如图3所示。从0~0.5 h时,噬菌体效价无明显的变化,而从0.5~2 h时,噬菌体效价迅速增加,2 h以后效价基本不出现较大的变化进入平台期。从以上的效价随时间的变化趋势可知,噬菌体φB23的潜伏期为30 min,裂解期为90 min,每个宿主细胞产生的子代噬菌体,即裂解量为(103.2±9.0) pfu/cell。
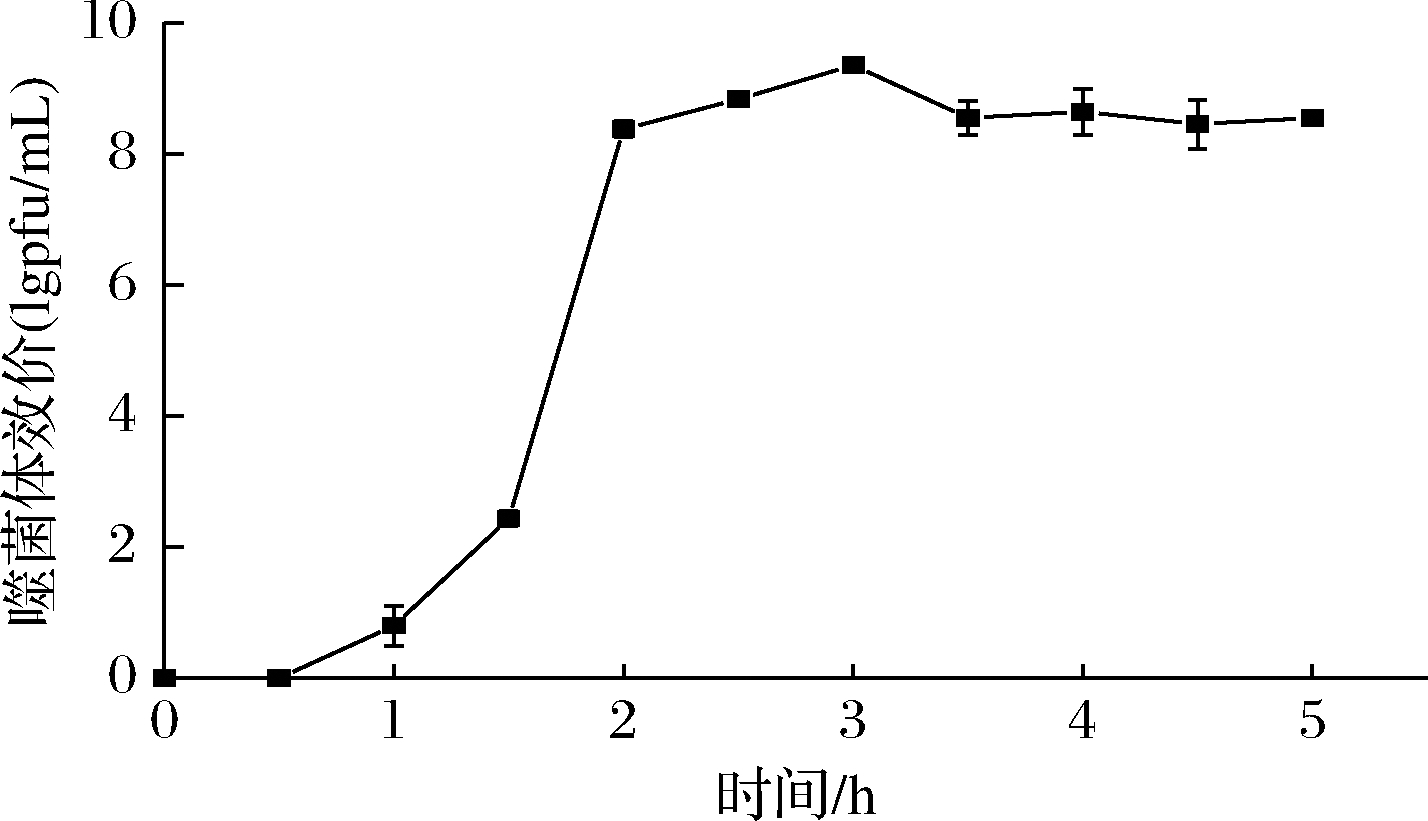
图3 噬菌体φB23的一步生长曲线
Fig.3 One-step growth curve of phage φB23
2.5 物理与化学因素对噬菌体的影响
温度对噬菌体存活的影响如图4所示,试验选择了巴氏灭菌常用的63 ℃和72 ℃,以及50 ℃条件下,检测噬菌体效价随时间的变化。当温度为72 ℃时,噬菌体效价下降很快,处理1 min后,效价损失了将近60%,2 min后,存活率为未处理时的14.6%,5 min 后效价接近于0,活性基本丧失。当温度为63 ℃时,效价随时间的下降过程较72 ℃平缓,2 min后效价下降至5.48 lgpfu/mL,5 min后为3.12 lgpfu/mL,10 min后的处理上清液在双层平板上培养后观察不到有噬菌斑的出现。当温度为50 ℃时,噬菌体灭活的速度较慢,处理10 min后,效价下降至5.62 lgpfu/mL,30 min 后效价接近为0,表明噬菌体被灭活。
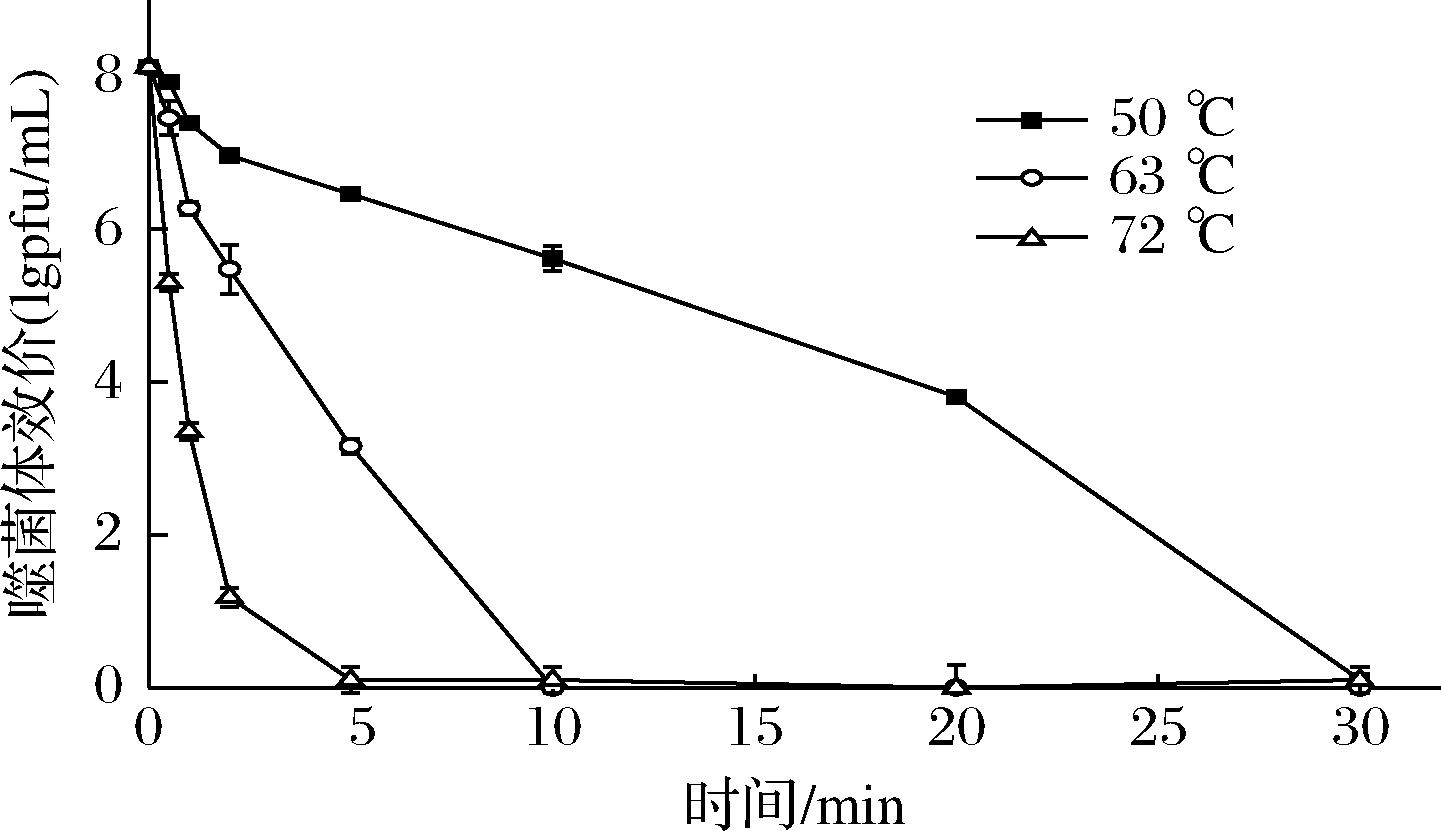
图4 温度对噬菌体φB23存活的影响
Fig.4 Effect of temperature on viability of phage φB23
图5显示了pH值对噬菌体存活的影响。在pH 3.0~8.0,噬菌体效价稳定,与初始效价相比无显著性差异,表明噬菌体φB23的耐酸性较好,在酸性和中性环境中维持了良好的裂解活性,符合其宿主短乳杆菌的生境特点。当pH高于8.0时,噬菌体的效价下降明显,pH 10.0时效价仅为初始效价的一半,表明噬菌体的耐碱性环境能力较弱。
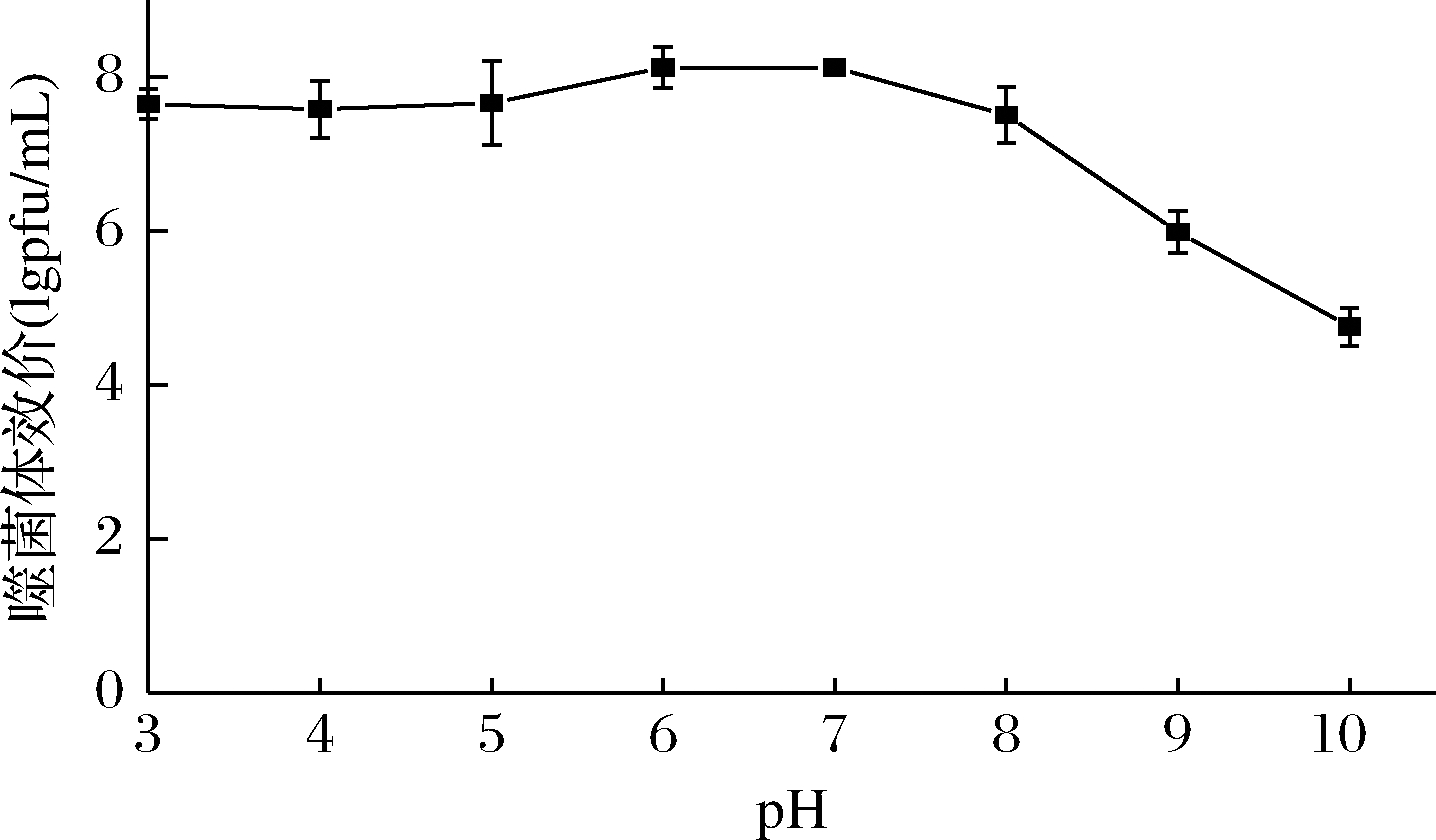
图5 pH对噬菌体φB23存活的影响
Fig.5 Effect of pH on viability of phage φB23
常用消毒剂乙醇和次氯酸钠对噬菌体φB23的灭活作用如图6所示。用75%的乙醇处理,噬菌体活性迅速下降,作用5 min,噬菌体效价跌至0.46 lgpfu/mL,10 min时完全丧失活性。当乙醇体积分数为50%时,噬菌体效价下降较慢,处理5 min效价为5.11 lgpfu/mL,10 min时为2.17 lgpfu/mL,20 min后完全灭活。而当采用30%的乙醇处理,在测定的30 min范围内,噬菌体效价下降程度有限,处理30 min后,效价还能维持在4.54 lgpfu/mL,表明噬菌体能耐受该浓度的乙醇。采用次氯酸钠作为消毒剂的试验中,500 mg/L的次氯酸钠能迅速灭活,处理2 min 效价降至0.68 lgpfu/mL,5 min后完全灭活。采用250 mg/L也有较好的灭活效果,处理5 min效价为1.58 lgpfu/mL,10 min后完全灭活。当次氯酸钠质量浓度为100 mg/L 时仍能有一定的灭活作用,处理20 min效价为3.24 lgpfu/mL,30 min后,残存的效价为0.82 lgpfu/mL,表明实现了基本灭活。
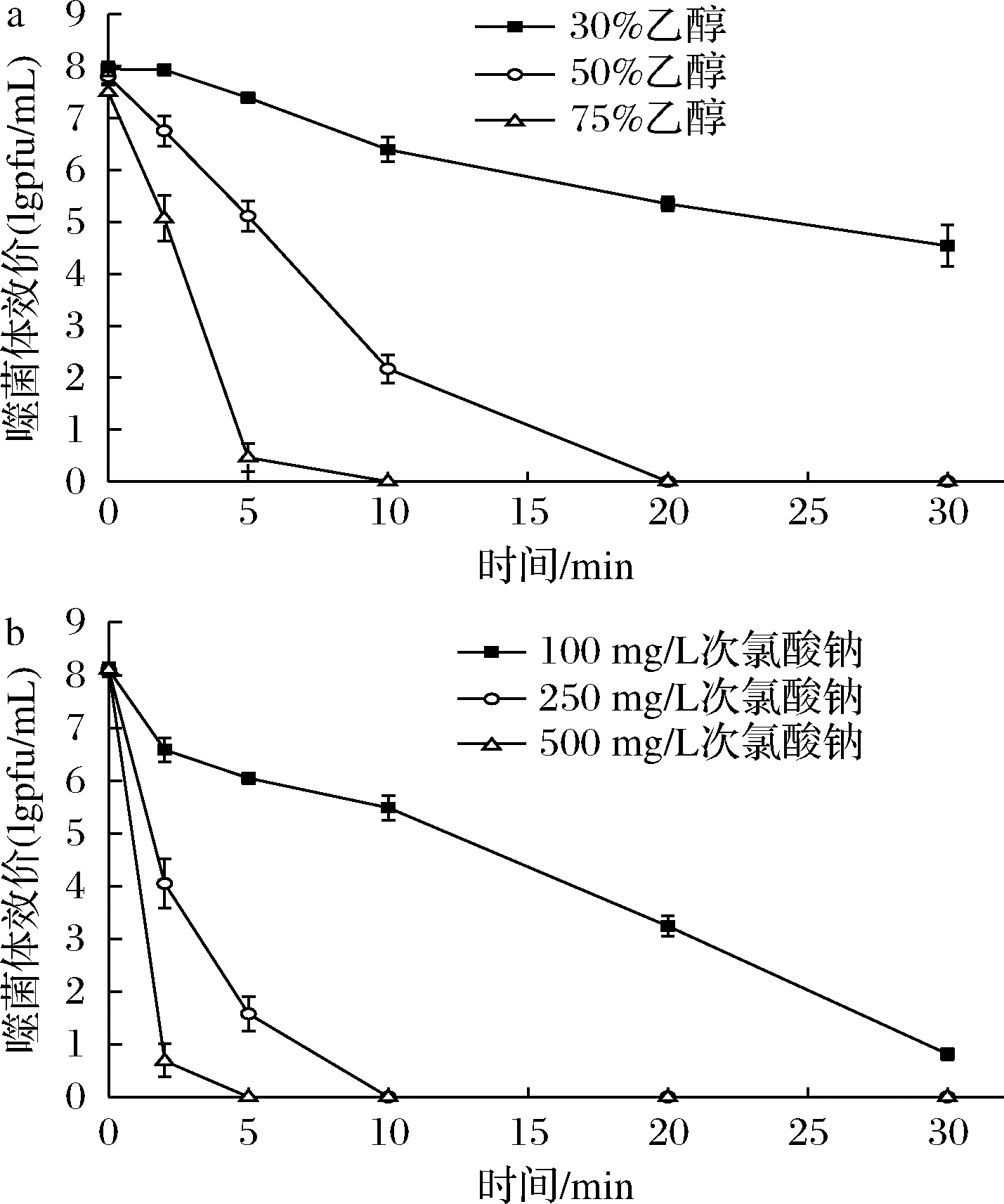
a-乙醇;b-洗氯酸钠
图6 消毒剂对噬菌体φB23的灭活作用
Fig.6 Inactivation of phage φB23 by disinfectant
3 讨论
噬菌体广泛存在于食品发酵生产过程的环境中,噬菌体污染是导致发酵失败的重要原因之一。与温和噬菌体相比,烈性噬菌体由于能快速裂解发酵菌株细胞,造成菌株在短时间内大量死亡,使得发酵变慢甚至停滞,对发酵的危害更大。本研究以短乳杆菌为宿主菌,从发酵泡菜水中分离和纯化烈性噬菌体。由于样品中天然存在的噬菌体浓度很低,如果对样品直接采用双层平板法分离,培养后常常无法观察到清晰的噬菌斑,造成分离失败。本实验采用生长至对数期中前期的宿主菌与过滤后的样品共培养,与不加样品的空白对照相比,通过观察培养液是否变澄清,来判定样品中是否有该宿主菌的噬菌体,同时也对样品中的目标噬菌体进行了富集,提高了分离的成功率。本文对短乳杆菌烈性的分离和生物学特性研究,为筛选抗噬菌体发酵菌株,建立防御噬菌体的方法和手段,开展相关研究奠定基础。
噬菌体的分类鉴定一般按照ICTV制定的方案[17-18],依据为噬菌体的电镜形态和核酸类型。目前已报道的短乳杆菌噬菌体[14,19-20]分属于尾病毒目(Caudovirales)下的两个不同的科,分别是肌尾噬菌体科(Myoviridae)和长尾噬菌体科(Siphoviridae),其中属于肌尾噬菌体科(Myoviridae)的短乳杆菌噬菌体较为多见。本研究中分离纯化的噬菌体φB23电镜形态无包膜,由多面体结构的头部和可弯曲的长尾构成,φB23的核酸为双链DNA,以上特征符合尾病毒目(Caudovirales)的描述。此外,由于在电镜形态中未观察到尾部的长度可收缩,表明其属于长尾噬菌体科(Siphoviridae)。具有双链DNA的噬菌体其染色体呈线状,在DNA复制过程中先形成多连体,然后在DNA包装过程中切成所需要的长度,切出的末端可能为平末端,也可能为黏性末端[21]。黏性末端经连接酶处理后,碱基通过互补配对原则连接在一起,加热处理后仍保持稳定,再经过限制性酶切,会导致条带数目减少;如末端为平末端,经连接酶处理后不稳定,在较高温度下连接会被加热破坏而断开,经限制酶切后条带数与未连接时没有变化[22]。本实验分离的噬菌体φB23的基因组经T4连接酶处理后,BamH I酶切后的条带数减少,表明其包装机制为黏末端连接。
噬菌体侵染宿主细胞后,先经历一段潜伏期,然后再进入裂解期。潜伏期长短和裂解量是衡量烈性噬菌体裂解能力的指标之一。目前关于短乳杆菌烈性噬菌体裂解性质的报道较少,尚缺乏可比较的数据。与已报道的其他乳杆菌噬菌体相比:类干酪乳杆菌(L.paracasei)噬菌体潜伏期30~85 min,裂解量28~69 pfu/cell[23];干酪乳杆菌(L.casei)噬菌体潜伏期140~220 min,裂解量6~150 pfu/cell[13,24];植物乳杆菌(L.plantarum)噬菌体潜伏期19~100 min,裂解量74~200 pfu/cell[24-25]。噬菌体φB23潜伏期和裂解期在这些乳杆菌噬菌体的范围内,属于裂解性较强的噬菌体。噬菌体φB23具有较宽的pH适应范围,在pH 3.0~8.0的酸性和中性条件下能保持稳定。φB23对温度的耐受性较差,在巴氏灭菌条件下处理一段时间即可灭活。表明在日常生产中防止φB23污染可利用碱性溶液清洗环境和设备器皿,采用巴氏灭菌条件加热处理物料和配料。此外,本实验结果表明φB23对高浓度的乙醇敏感,次氯酸钠对其有很好的杀灭作用,采取上述消毒剂对环境定期消毒,能有效地去除发酵系统中可能存在的噬菌体。
4 结论
本研究从发酵泡菜水中分离到1株短乳杆菌烈性噬菌体φB23,采用双层平板检测时,该噬菌体能形成直径1~2 mm、清晰透明的圆形噬菌斑。负染色后采用投射电镜观察,噬菌体由典型多面体结构的头部和可弯曲的长尾组成,鉴定属于尾噬菌体目(Caudovirales)长尾噬菌体科(Siphoviridae)。噬菌体φB23基因组由双链DNA构成,大小约为52.4 kb,包装机制为黏末端连接。最佳感染复数为0.001,潜伏期为30 min,裂解期为90 min,裂解量为(103.2±9.0) pfu/cell。常用的巴氏灭菌温度63 ℃和72 ℃,分别处理10 min和5 min能较好地灭活。噬菌体φB23在pH 3.0~8.0保持稳定,pH>8.0时稳定性受到较大的影响。φB23对体积分数>50%的乙醇较敏感,75%乙醇处理10 min即丧失活性,次氯酸钠能有效杀灭该噬菌体,500 mg/L处理5 min即能完全灭活。
[1] FELIS G E, DELLAGLIO F.Taxonomy of Lactobacilli and Bifidobacteria[J].Current Issues in Intestinal Microbiology, 2007, 8(2):44-61.
[2] SALVETTI E, TORRIANI S, FELIS G E.The genus Lactobacillus:A taxonomic update[J].Probiotics and Antimicrobial Proteins, 2012, 4(4):217-226.
[3] RÖNK E, MALINEN E, SAARELA M, et al.Probiotic and milk technological properties of Lactobacillus brevis[J].International Journal of Food Microbiology, 2003, 83(1):63-74.
E, MALINEN E, SAARELA M, et al.Probiotic and milk technological properties of Lactobacillus brevis[J].International Journal of Food Microbiology, 2003, 83(1):63-74.
[4] NOBUTA Y, INOUE T, SUZUKI S, et al.The efficacy and the safety of Lactobacillus brevis KB290 as a human probiotics[J].International Journal of Probiotics and Prebiotics, 2009, 4(4):263-270.
[5] KIM N N, KIM W J, KANG S S.Anti-biofilm effect of crude bacteriocin derived from Lactobacillus brevis DF01 on Escherichia coli and Salmonella Typhimurium[J].Food Control, 2019, 98:274-280.
[6] 叶陵, 李勇, 王蓉蓉, 等.我国传统发酵蔬菜中乳酸菌多样性的研究进展[J].食品科学, 2018, 39(15):296-301.
YE L, LI Y, WANG R R, et al.Progress in research on the diversity of lactic acid bacteria in traditional Chinese fermented vegetables [J].Food Science, 2018, 39(15):296-301.
[7] 胡晓清, 潘露, 王汝毅.发酵蔬菜中乳酸菌的功能性与安全性研究进展[J].现代食品科技, 2012, 28(11):1 606-1 611.
HU X Q, PAN L, WANG R Y, et al.Advances in the functionality and safety of lactic acid bacteria from fermented vegetable[J].Modern Food Science and Technology, 2012, 28(11):1 606-1 611.
[8] BERESFORD T P, FITZSIMONS N A, BRENNAN N L, et al.Recent advances in cheese microbiology[J].International Dairy Journal, 2001, 11(4-7):259-274.
[9] PLESSAS S, ALEXOPOULOS A, MANTZOURANI I, et al.Application of novel starter cultures for sourdough bread production[J].Anaerobe, 2011, 17(6):486-489.
[10] SIEPMANN F B, SOUSA DE ALMEIDA B, WASZCZYNSKYJ N, et al.Influence of temperature and of starter culture on biochemical characteristics and the aromatic compounds evolution on type II sourdough and wheat bread[J].LWT, 2019, 108:199-206.
[11] SADIQ F A, HE G Q, SAKANDAR H A, et al.Lactococcus lactis phages from the perspective of their diversity, thermal and biocidal resistance[J].International Dairy Journal, 2019, 90:28-38.
[12] BRIGGILER MARC M, REINHEIMER J, QUIBERONI A.Phage adsorption and lytic propagation in Lactobacillus plantarum:Could host cell starvation affect them?[J].BMC Microbiology, 2015, 15:273.
M, REINHEIMER J, QUIBERONI A.Phage adsorption and lytic propagation in Lactobacillus plantarum:Could host cell starvation affect them?[J].BMC Microbiology, 2015, 15:273.
[13] ZHANG X, LAN Y, JIAO W C, et al.Isolation and characterization of a novel virulent phage of Lactobacillus casei ATCC 393[J].Food & Environmental Virology, 2015, 7(4):333-341.
[14] DEASY T, MAHONY J, NEVE H, et al.Isolation of a virulent Lactobacillus brevis phage and its application in the control of beer spoilage[J].Journal of Food Protection, 2011, 74(12):2 157-2 161.
[15] BRIGGILER MARC M, GARNEAU J E, TREMBLAY D, et al.Characterization of two virulent phages of Lactobacillus plantarum[J].Applied and Environmental Microbiology, 2012, 78(24):8 719-8 734.
M, GARNEAU J E, TREMBLAY D, et al.Characterization of two virulent phages of Lactobacillus plantarum[J].Applied and Environmental Microbiology, 2012, 78(24):8 719-8 734.
[16] CAPRA M L, QUIBERONI A D L, ACKERMANN H W, et al.Characterization of a new virulent phage (MLC-A) of Lactobacillus paracasei[J].Journal of Dairy Science, 2006, 89(7):2 414-2 423.
[17] MAHONY J, VAN SINDEREN D.Current taxonomy of phages infecting lactic acid bacteria[J].Frontiers in Microbiology, 2014,5:7.
[18] ACKERMANN H W, PRANGISHVILI D.Prokaryote viruses studied by electron microscopy[J].Archives of Virology, 2012,157(10):1 843-1 849.
[19] FEYEREISEN M, MAHONY J, LUGLI G A, et al.Isolation and characterization of Lactobacillus brevis phages[J].Viruses, 2019, 11(5):393.
[20] FEYEREISEN M, MAHONY J, KELLEHER P, et al.Comparative genome analysis of the Lactobacillus brevis species[J].BMC Genomics, 2019, 20(1):416.
[21] HARVEY S C.The scrunchworm hypothesis:Transitions between A-DNA and B-DNA provide the driving force for genome packaging in double-stranded DNA bacteriophages[J].Journal of Structural Biology, 2015,189(1):1-8.
[22] 王绍花. 乳杆菌噬菌体的分离、功能基因表达及抗噬菌体菌株的选育[D].济南:山东大学, 2010.
WANG S H.Studies on the isolation, functional gene expression of Lactobacillus phages and mutation breeding of phage-resistance strains[D].Jinan:Shandong University, 2010.
[23] SUNTHORNTHUMMAS S, DOI K, RANGSIRUJI A, et al.Isolation and characterization of Lactobacillus paracasei LPC and phage φT25 from fermented milk[J].Food Control, 2017, 73:1 353-1 361.
[24] VILLION M.Bacteriophages of Lactobacillus[J].Frontiers in Bioscience, 2009(14):1 661.
[25] CHEN X, GUO J, LIU Y, et al.Characterization and adsorption of a Lactobacillus plantarum virulent phage[J].Journal of Dairy Science, 2019, 102(5):3 879-3 886.