生育酚是一类重要的脂溶性维生素,包括α-生育酚、β-生育酚、γ-生育酚、δ-生育酚,其体内的抗氧化活性为:α-生育酚>β-生育酚>γ-生育酚>δ-生育酚。生育酚广泛存在于植物油、豆类、坚果等食品中,具有改善脂质代谢、预防动脉粥样硬化、抗衰老和抗癌等功能。中国营养学会推荐居民维生素E的膳食参考摄入量成年人为14 mg/d。人体缺乏生育酚会引发生育功能和免疫力下降、代谢失常、机体衰老等症状。ALSHIEK等[1]的研究表明生育酚可改善糖尿病患者的血管功能,RENGARAJ等[2]研究了维生素E对家禽繁殖能力的影响,结果表明家禽饮食中适量的维生素E可以显著保护雄性禽类的精子质量和雌性家禽产蛋质量。HE等[3]研究发现膳食中补充50~100 mg/kg的维生素E能显著改善动物的生长和肠道性能。此外,补充维生素E还能显著增加肠道褶皱的高度和黏膜的厚度。LEESON等[4]研究了青壮年血浆中维生素E,总抗氧化状态和血管功能的关系,结果显示年轻时通过饮食摄入达到的维生素E浓度和总抗氧化状态都与血管内皮功能或动脉扩张性有关[4]。
食用植物油是居民摄入生育酚的重要来源。油料和食用油中生育酚的分析方法主要包括高效液相色谱法、气相色谱法、薄层色谱法、比色法、电化学测定法、色谱质谱联用法等。彭祖茂等[5]建立了超高效液相色谱-串联质谱同时检测植物油中生育酚、生育三烯酚、植物甾醇、β-胡萝卜素和角鲨烯等14种营养成分的方法,样品需要经过皂化处理,采用石油醚提取浓缩和梯度洗脱。ZHANG等[6]采用超声辅助皂化、液液萃取,液相色谱-串联质谱联用技术,建立了同时测定食用油中叶黄素、生育酚、豆甾醇、β-谷甾醇、β-胡萝卜素及番茄红素等8种生物活性物质的方法。FENG等[7]报告了一种表面增强拉曼光谱生物传感器用于检测和定量植物油中的α-生育酚。在以上方法中,液相色谱法作为国家标准方法应用范围最广,主要包括正向液相色谱法和反向液相色谱法。其中,正相液相色谱法操作简单,仅需提取油脂后正己烷溶解过膜后即可上机检测;反相液相色谱法普适性更广,但样品处理复杂,需皂化、提取、洗涤和浓缩,且方法稳定性差、有机试剂用量大[8-11]。因此,建立前处理简单高效的反相高效液相色谱法以测定油料油脂中生育酚含量对提高检测效率和结果准确度具有重要意义。
1 材料与方法
1.1 材料与试剂
甲醇,赛默飞世尔科技有限公司;异丙醇,德国默克两合有限公司;BHT2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT),上海阿拉丁生化科技股份有限公司。
生育酚标准品:α-生育酚(纯度≥96%)、β-生育酚(1.0 mg/mL)、γ-生育酚(纯度≥96%)、δ-生育酚(纯度≥90%),Sigma aldrich。所有溶剂均为HPLC级。
1.2 仪器与设备
高效液相色谱仪1200(微盘自动进样器、Agilent1200柱温箱 SL、Agilent1200二极管阵列检测器 SL、Agilent1200二元泵 SL、Agilent1200高性能自动进样器 SL、Poroshell 120 SB-C18液相色谱柱),美国安捷伦公司;AUY 220电子天平,日本岛津公司;RephiLe PURIST UV超纯水机,上海乐枫生物科技有限公司;DTC-15 J超声波清洗机,鼎泰生化科技设备制造有限公司;L550台式低速大容量离心机,长沙高新技术产业开发区湘仪离心机仪器有限公司;Kylin-bell 旋涡混合器 VORTEX-5,其林贝尔仪器制造有限公司;15 mL具塞离心管,50 mL具塞离心管,美国Corning公司;Transferpette® S微量移液器,德国BRAND公司;1 mL无菌注射器,武汉市王冠医疗器械有限责任公司;0.22 μm有机系滤膜,美国Millipore公司。
1.3 实验方法
1.3.1 样品处理
1.3.1.1 植物油料样品处理
称取0.5 g(精确到0.000 1 g)油料样品,于15 mL离心管中,加5 mL异丙醇,加入0.1 g BHT,涡旋混合器涡旋10 min,50 ℃超声提取30 min,再一次用涡旋混合器涡旋10 min,4 500 r/min离心5 min,过0.22 μm 有机系滤膜,待测。
1.3.1.2 植物油样品处理
称取0.5 g(精确到0.000 1 g)植物油样品于15 mL离心管中,异丙醇定容至5 mL,加入0.1 g BHT,涡旋混合器涡旋10 min,0.22 μm的有机系滤膜,待测。
1.3.2 标准溶液的配制
配制5 mg/mL的α-生育酚、5 mg/mL的β-生育酚、5 mg/mL的γ-生育酚和5 mg/mL的δ-生育酚的异丙醇标准溶液,再用异丙醇稀释并配制成1 mg/mL的4种化合物的混合标准溶液,依次稀释至为0.50、1.00、2.00、5.00、10.00、20.00、50.00、100.00 μg/mL的系列标准溶液,于棕色瓶中避光低温保存。
1.3.3 色谱条件
Poroshell 120 SB-C18液相色谱柱(安捷伦公司):柱温30 ℃,流动相为V(甲醇)∶V(水)=90∶10,等度洗脱,流速0.75 mL/min,紫外检测波长294 nm,进样量10 μL。
2 结果与分析
2.1 前处理方法的优化
2.1.1 料液比的优化
采用传统方法测定食品中的生育酚的反相液相色谱法,一般要经过皂化、提取、洗涤、浓缩等步骤,过程繁琐、耗时久。正相液相色谱方法直接正己烷提取即可检测[12],但正相液相色谱系统不如反相液相色谱系统使用普遍。如反相液相色谱法,也能将样品提取溶剂溶解后直接检测,样品处理过程简单快速。
常见的提取生育酚的有机溶剂包括甲醇、乙醇、正己烷、正庚烷、丙酮、甲醇-丙酮、叔丁基甲基醚等,考虑到提取效率高、绿色环保、不易挥发稳定等因素。异丙醇可以与植物油互溶,提高提取效率,避免损失[13]。对于固体物料,先进行涡旋超声提取,再离心处理,最后取上清液上机。甲醇和乙醇虽然也可以作为生育酚的提取溶剂,但是甲醇与乙醇和植物油不互溶,造成提取效率低下,而且与甲醇、乙醇相比,异丙醇较稳定不易挥发。因此,选取异丙醇作为提取溶剂。
异丙醇溶液可以溶解食用油,也常用作油脂行业中棉籽油的萃取剂。称取0.5 g样品于离心管内,用异丙醇溶解,定容至1、2、5、8、10 mL。结果如图1所示,当提取剂定容体积小于5 mL时,稀释体积不足,提取效率低,4种生育酚的回收率均低于80%。当定容体积为5 mL 时,4种生育酚的回收率最高。继续加大稀释倍数,提取剂定容体积增大到8 mL和10 mL时,4种生育酚的回收率下降。因此,选择异丙醇定容至5 mL。

图1 料液比对生育酚提取效率的影响
Fig.1 Effect of solid-liquid ratio on extraction efficiency of tocopherol
2.1.2 超声温度
由于提取速率快、溶剂消耗低,超声辅助提取已广泛应用于生物活性物质的提取[14]。利用超声振动的方法,打破植物细胞壁,使溶剂快速地进入固体物质中,将其物质所含有的有机成分尽可能地完全溶于有机溶剂中,得到多成分混合提取液,超声波已被用于从包括食品中抗氧化剂的提取。本研究对超声温度进行优化,设置了20、30、40、50、60 ℃ 5个温度梯度进行条件优化,结果如图2所示。结果表明,超声有利于固体油料中生育酚的提取,当温度达到40、50、60 ℃时,4种生育酚的提取率较高,当超声温度为50 ℃时,4种生育酚的回收率最大。因此,选择超声温度为50 ℃。

图2 超声温度对生育酚提取效率的影响
Fig.2 Effect of ultrasonic temperature on extraction efficiency of tocopherol
2.1.2 抗氧化剂用量
维生素E油料油脂中主要的抗氧化剂之一,在空气中易氧化。为了避免在提取过程中生育酚的氧化损失,参考国家标准GB/T 26635—2011加入抗氧化剂BHT。BHT是食品工业常用的合成抗氧化剂,用作食品添加剂、制药、石油产品、橡胶工业。大量研究表明,含有二叔丁基苯酚基团的化合物具有抗氧化、抗炎、抗癌等多种活性。通过将过氧自由基转化为过氧化氢来进行自动氧化反应[15-19]。本研究对BHT用量进行了优化,结果如图3所示。实验结果表明,加入BHT可提高检测方法的回收率,且抗氧化剂BHT用量为0.1 g时4种生育酚的回收率最高。因此,选择BHT加入量为0.1 g。
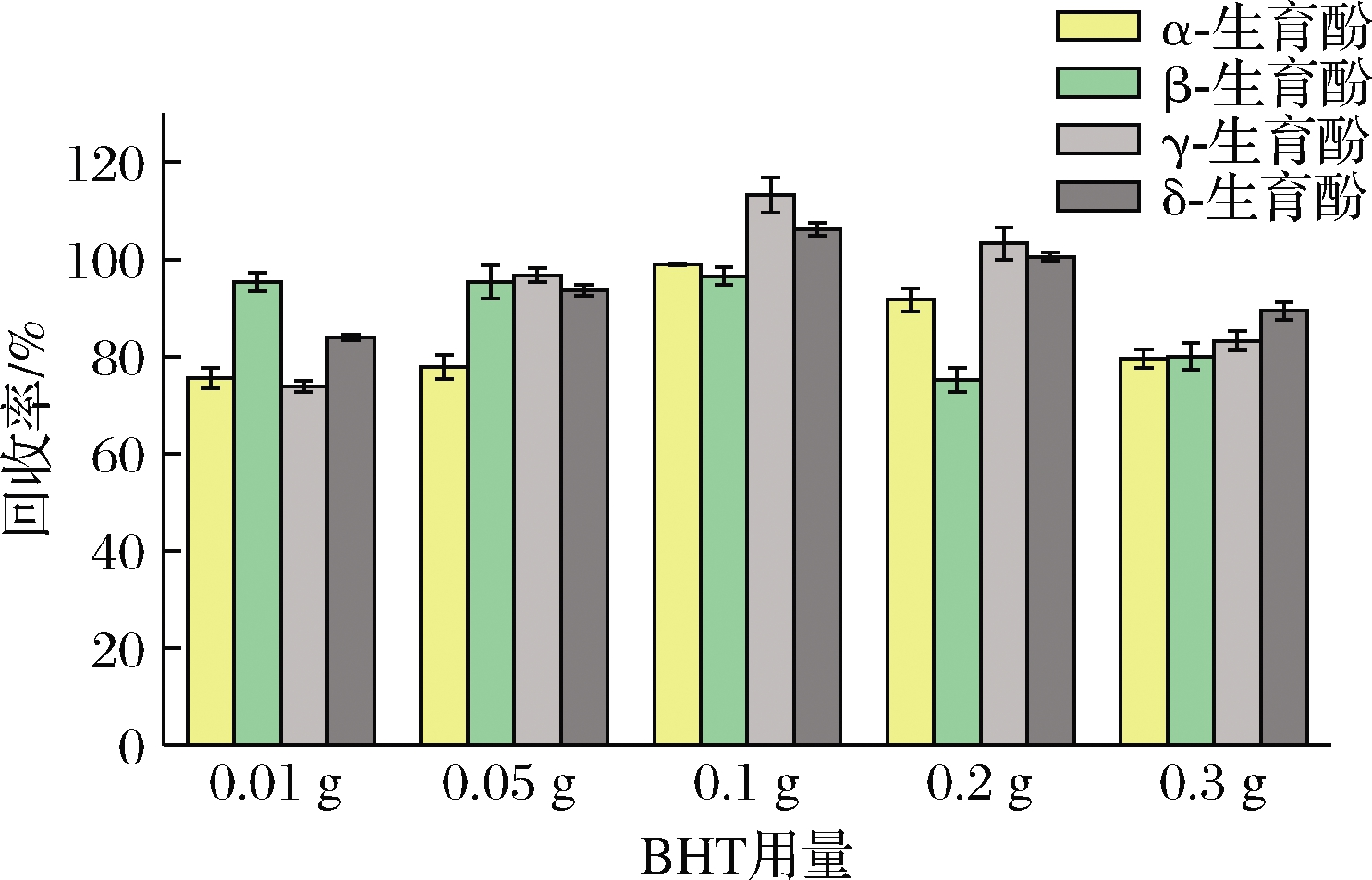
图3 抗氧化剂的用量对生育酚提取效率的影响
Fig.3 Effect of antioxidant quality on tocopherol extraction efficiency
2.2 色谱条件的优化
2.2.1 色谱柱的选择
在高效液相色谱分析中,分离效果很大程度上取决于色谱柱的填料。4种生育酚结构相似、极性接近,传统的C18色谱柱难以实现β-生育酚和γ-生育酚基线分离。Poroshell 120色谱柱具有高柱效、高分离度的特点,对复杂基质的样品具有稳定的高性能。本研究采用的Poroshell 120色谱柱粒径为2.7 μm,由1.7 μm直径的实心核和0.5 μm厚的多孔外层构成。这种多孔层和实心核限制了扩散距离,提高了分离速度,窄粒径分布提高了柱效和分离度,可有效分开β-生育酚和γ-生育酚。
2.2.2 流动相优化
本研究采用检测最常用的反相高效液相色谱系统,分别用V(甲醇)∶V(乙腈)=50∶50、V(甲醇)∶V(水)=95∶5、V甲(醇)∶V(水)=90∶10、V(甲醇)∶V(水)=85∶15、V(甲醇)∶V(水)=80∶20做流动相进行标准溶液的上机检测。甲醇是强洗脱剂,其含量越高,流动相的极性越小,洗脱能力越强,可缩短检测时间,但甲醇相比例高会导致β-生育酚与γ-生育酚或γ-生育酚与α-生育酚无法基线分离。实验结果表明,在流动相为V甲(醇)∶V(水)=90∶10,流速0.75 mL/min,柱温30 ℃,进样量10 μL,等度洗脱10 min,紫外检测波长294 nm条件下,4种生育酚能够得到基线分离,4种生育酚标准品的峰图如图4所示,α-生育酚、β-生育酚、γ-生育酚、δ-生育酚的质量浓度都是20 μg/mL。

图4 四种生育酚标准品色谱图
Fig.4 Chromatogram of four tocopherols
2.3 线性关系与方法检出限
精确配制5、10、20、50、100 μg/g 5个浓度梯度的4种生育酚混标标准溶液,根据前面优化好的液相方法,在流动相为V甲(醇)∶V(水)=90∶10,流速为0.75 mL/min,柱温30 ℃,进样量10 μL,等度洗脱10 min,紫外检测波长294 nm条件下将配制好的标准溶液上机分析。4种生育酚的回归方程、线性范围、相关系数、检出限和定量限见表1。根据3倍和10倍信噪比确定4种生育酚化合物的检测限和定量限。α-生育酚、β-生育酚、γ-生育酚和δ-生育酚的检出限分别是0.16、0.21、0.20、0.22 μg/g。α-生育酚、β-生育酚、γ-生育酚和δ-生育酚的定量限分别是0.53、0.68、0.66、0.72 μg/g,均低于国家标准方法(GB/T 5009.82—2016)。分析结果表明这4种生育酚化合物的相关系数(R2)分别为0.999 2、0.999 4、0.999 3和0.999 8,说明这4种化合物在线性范围内线性关系好。
表1 线性方程、相关系数、检出限和定量限
Table 1 Linear equation,linear ranges,correlation coefficients (R2), limit of detections (LODs) and limit of quantifications (LOQs) of target compounds
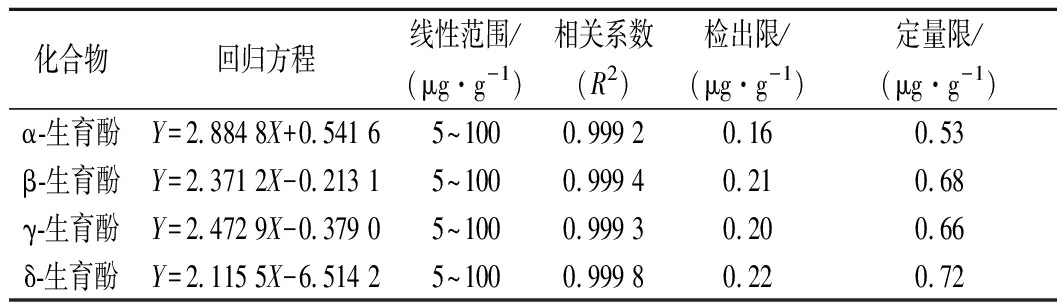
化合物回归方程线性范围/(μg·g-1)相关系数(R2)检出限/(μg·g-1)定量限/(μg·g-1)α-生育酚Y=2.884 8X+0.541 65~1000.999 20.160.53β-生育酚Y=2.371 2X-0.213 15~1000.999 40.210.68γ-生育酚Y=2.472 9X-0.379 05~1000.999 30.200.66δ-生育酚Y=2.115 5X-6.514 25~1000.999 80.220.72
2.4 方法重现性、回收率与精密度
本研究分别在菜籽油样品中加入1、10、100 μg/g 3种不同浓度水平的标准溶液,算得的浓度减去空白样品中生育酚的浓度计算方法的回收率。α-生育酚的回收率为92%~95%,β-生育酚的回收率为87%~101%,γ-生育酚的回收率为99%~109%,δ-生育酚的回收率为95%~98%。进而,对方法精密度进行考察,包括日内精密度和日间精密度。精密度是对同一个菜籽油提取和测定3次,并连续做3 d,计算结果的相对标准偏差(relative standard deviation,RSD)值,结果如表2所示。结果表明,日内和日间检测结果方法RSD均小于15%,本方法具有较好的准确性与精密度。
2.5 方法应用
将该方法应用于大豆油、菜籽油、花生油、玉米油、棕榈油、葵花籽油、芝麻油、橄榄油、亚麻籽油、山茶油等10种主要植物油和油菜籽、芝麻、紫苏等油料中的生育酚含量测定。结果如表3所示,结果表明,大豆油的总生育酚含量最高,为971.86 mg/kg,葵花籽油中α-生育酚含量最高;而棕榈油、橄榄油、葡萄籽油中生育酚的含量较低。以上结果与文献中报道植物油中生育酚含量相符[7,20-21]。YANG等[22]综述了不同形式的生育酚在营养和药理水平上的人类和实验室防癌活性的最新研究结果,α-生育酚是动物体内维生素E的主要形式, 在实现维生素E的基本抗氧化功能方面具有最高的活性, 由于氧化应激参与肿瘤的发生, α-生育酚的防癌活性已被广泛研究。
表2 方法的回收率和精密度(n=3)
Table 2 Recoveries and precision of the method(n=3)

化合物回收率/%日内精密度/%日间精密度/%1 μg/g10 μg/g100 μg/g1 μg/g10 μg/g100 μg/g1 μg/g10 μg/g100 μg/gα-生育酚93 92 95 4.41 2.91 3.11 6.30 5.22 5.10 β-生育酚101 92 87 5.59 3.04 3.28 6.02 9.89 5.75 γ-生育酚102 109 99 2.28 4.25 3.81 2.55 1.88 4.18 δ-生育酚98 97 95 3.52 4.19 4.09 2.16 3.03 5.90
表3 实际样品中生育酚的含量及组成 单位:mg/kg
Table 3 Content and composition of tocopherol in actual samples
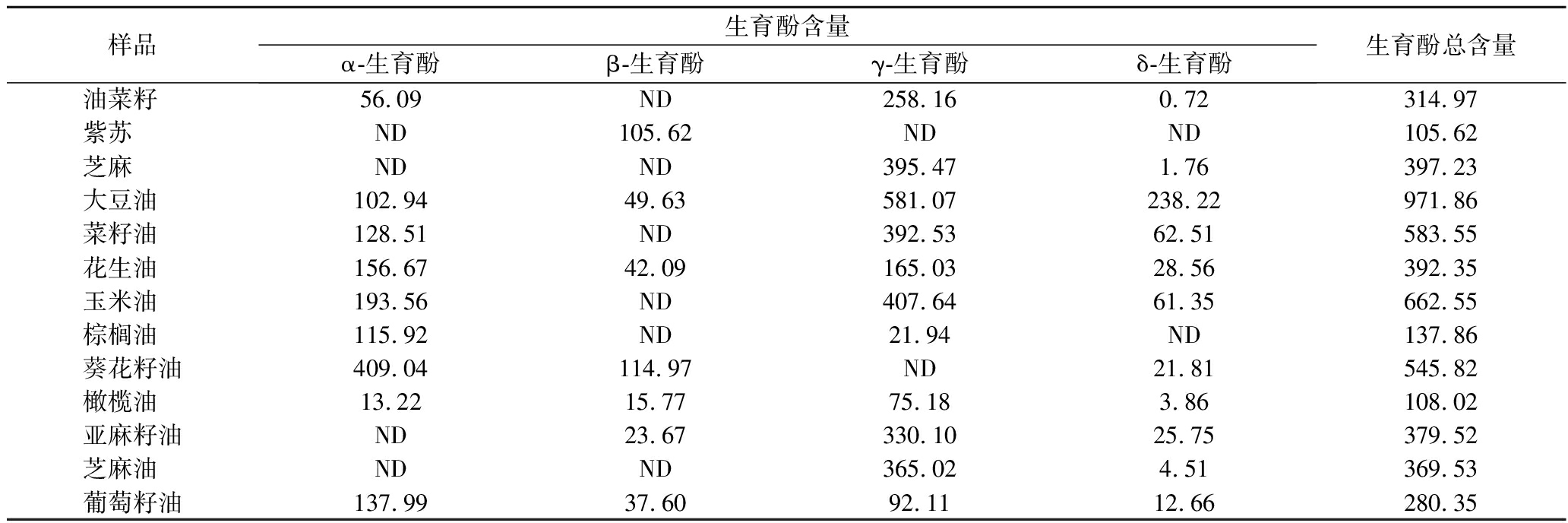
样品生育酚含量α-生育酚β-生育酚γ-生育酚δ-生育酚生育酚总含量油菜籽56.09ND258.160.72314.97紫苏ND105.62NDND105.62芝麻NDND395.471.76397.23大豆油102.9449.63581.07238.22971.86菜籽油128.51ND392.5362.51583.55花生油156.6742.09165.0328.56392.35玉米油193.56ND407.6461.35662.55棕榈油115.92ND21.94ND137.86葵花籽油409.04114.97ND21.81545.82橄榄油13.2215.7775.183.86108.02亚麻籽油ND23.67330.1025.75379.52芝麻油NDND365.024.51369.53葡萄籽油137.9937.6092.1112.66280.35
注:ND代表未检出
3 结论
本文建立了油料中生育酚的反相高效液相色谱的检测方法。用异丙醇做提取溶剂直接溶解植物油或油料样品,采用超声方法提高油料中生育酚,与国标方法比较,减少了皂化、提取、洗涤和浓度等步骤,方法操作简单;相比正己烷、甲醇、乙醇、丙酮等溶剂相比,本方法采用异丙醇提取效率更高,提高了提取效率和回收率。同时,减少了有机试剂的用量,更加绿色环保。方法学考察发现,本方法可在10 min之内实现4种生育酚的完全基线分离,α-生育酚、β-生育酚、γ-生育酚、δ-生育酚的检出限分别是0.16、0.21、0.20、0.22 μg/g,定量限分别是0.53、0.68、0.66、0.72 μg/g,相关系数均大于0.999 2,回收率为87%~109%,精密度为1.88%~9.89%。该方法操作简单、检测时间短,结果准确,为油料油脂中生育酚检测提供重要技术支撑。
[1] ALSHIEK J A, DAYAN L, ASLEH R, et al.Anti-oxidative treatment with vitamin E improves peripheral vascular function in patients with diabetes mellitus and Haptoglobin 2-2 genotype:A double-blinded cross-over study[J].Diabetes Research and Clinical Practice, 2017,131:200-207.
[2] RENGARAJ D, HONG Y H.Effects of dietary vitamin E on fertility functions in poultry species[J].International Journal of Molecular Sciences, 2015, 16(5):9 910-9 921.
[3] HE M, WANG K Y, LIANG X X, et al.Effects of dietary vitamin E on growth performance as well as intestinal structure and function of channel catfish (Ictalurus punctatus, Rafinesque 1818)[J].Experimental and Therapeutic Medicine, 2017, 14(6):5 703-5 710.
[4] LEESON C P M, MANN A, KATTENHORN M,et al.Plasma vitamin E, total antioxidant status and vascular function in young adults[J].European Journal of Clinical Investigation, 2002, 32(12):889-894.
[5] 彭祖茂,朱丽,邓梦雅,等.超高效液相色谱-串联质谱同时测定植物油中14种营养成分[J].色谱,2018,36(11):1 140-1 146.
PENG Z M, ZHU L, DENG M Y, et al.Simultaneous determination of 14 nutrients in vegetable oils by ultra high performance liquid chromatography tandem mass spectrometry[J].Chinese Journal of Chromatography, 2018,36(11):1 140-1 146.
[6] ZHANG L X, WANG S J, YANG R N, et al.Simultaneous determination of tocopherols, carotenoids and phytosterols in edible vegetable oil by ultrasound-assisted saponification, LLE and LC-MS/MS[J].Food Chemistry, 2019,289:313-319.
[7] FENG S L, GAO F, CHEN Z W, et al.Determination of α-tocopherol in vegetable oils using a molecularly imprinted polymers-surface-enhanced Raman spectroscopic biosensor[J].Journal of Agricultural and Food Chemistry, 2013,61(44):10 467-10 475.
[8] ABIDI S L.Chromatographic analysis of plant sterols in foods and vegetable oils[J].Journal of Chromatography A,2001,935(1-2):173-201.
[9] WARNER K.HPLC结合蒸发光散射检测法分析植物油中的维生素E和植物甾醇[J].国外分析仪器, 1990,67(11):827-831.
WARNER K.Analysis of tocopherols and phytosterols in vegetable oils by HPLC with evaporative light—Scattering detection [J].Foreign Analytical Instruments, 1990,67(11):827-831.
[10] CHEN Y Z, KAO S Y, JIAN H C, et al.Determination of cholesterol and four phytosterols in foods without derivatization by gas chromatography-tandem mass spectrometry[J].Journal of Food and Drug Analysis, 2015, 23(4):636-644.
[11] OROZCO-SOLANO M, RUIZ-JIMÉNEZ J, LUQUE DE CASTRO M D.Ultrasound-assisted extraction and derivatization of sterols and fatty alcohols from olive leaves and drupes prior to determination by gas chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2010,1 217(8):1 227-1 235.
[12] POCKLINGTON W D, DIEFFENBACHER A.Determination of tocopherols and tocotrienols in vegetable oils and fats by high performance liquid chromatography:Results of a collaborative study and the standardised method[J].Pure and Applied Chemistry, 1988, 60(6):877-892.
![]() A, SIKORSKA E.Simple reversed-phase liquid chromatography method for determination of tocopherols in edible plant oils[J].Journal of Chromatography A, 2004,1 048 (2):195-198.
A, SIKORSKA E.Simple reversed-phase liquid chromatography method for determination of tocopherols in edible plant oils[J].Journal of Chromatography A, 2004,1 048 (2):195-198.
[14] WANG F, ZHANG Y Z, XU L, et al.An efficient ultrasound-assisted extraction method of pea protein and its effect on protein functional properties and biological activities[J].LWT, 2020, 127:109348.
[15] BOULEBD H.Comparative study of the radical scavenging behavior of ascorbic acid, BHT, BHA and Trolox:Experimental and theoretical study[J].Journal of Molecular Structure, 2020, 1 201:127210.
[16] CAI P, FANG S Q, YANG H L, et al.Donepezil-butylated hydroxytoluene (BHT) hybrids as Anti-Alzheimer′s disease agents with cholinergic, antioxidant, and neuroprotective properties[J].European Journal of Medicinal Chemistry, 2018, 157:161-176.
[17] NAIJIAN H R, KOHRAM H, SHAHNEH A Z, et al.Effects of different concentrations of BHT on microscopic and oxidative parameters of Mahabadi goat semen following the freeze-thaw process[J].Cryobiology, 2013, 66(2):151-155.
[18] ![]() B E.Effect of butylated hydroxytoluene (BHT) on the cryopreservation of common carp (Cyprinus carpio) spermatozoa[J].Animal Reproduction Science, 2014, 151 (3-4):269-274.
B E.Effect of butylated hydroxytoluene (BHT) on the cryopreservation of common carp (Cyprinus carpio) spermatozoa[J].Animal Reproduction Science, 2014, 151 (3-4):269-274.
[19] YEHYE W A, RAHMAN N A, ARIFFIN A, et al.Understanding the chemistry behind the antioxidant activities of butylated hydroxytoluene (BHT):A review[J].European Journal of Medicinal Chemistry, 2015, 101:295-312.
[20] CERRETANI L, LERMA-GARC A M J, HERRERO-MART
A M J, HERRERO-MART NEZ J M, et al.Determination of tocopherols and tocotrienols in vegetable oils by nanoliquid chromatography with ultraviolet-visible detection using a silica monolithic column[J].Journal of Agricultural and Food Chemistry, 2010, 58(2):757-761.
NEZ J M, et al.Determination of tocopherols and tocotrienols in vegetable oils by nanoliquid chromatography with ultraviolet-visible detection using a silica monolithic column[J].Journal of Agricultural and Food Chemistry, 2010, 58(2):757-761.
[21] SILVA S D, ROSA N F, FERREIRA A E, et al.Rapid determination of α-tocopherol in vegetable oils by fourier transform infrared spectroscopy[J].Food Analytical Methods, 2008,2(2):120-127.
[22] YANG C S, LUO P, ZENG Z S, et al.Vitamin E and cancer prevention:Studies with different forms of tocopherols and tocotrienols[J].Molecular Carcinogenesis, 2020, 59(4):365-389.