蜂蜜渗透压高、pH低且含有大量酚类抑菌物质,除耐高渗酵母外的大多数微生物均难以在其中生存[1]。耐高渗酵母污染早期较难发现,在污染中后期会引起蜂蜜风味及营养价值改变,导致产品严重腐败,因此其污染不但会对企业造成经济损失,也会严重影响进出口贸易[2-3]。国际食品法典委员会(Codex Alimentarius Commission, CAC)标准规定蜂蜜在贮存、销售及运输中不得发酵及发生风味改变,因此耐高渗酵母被列为需要控制的重要腐败菌之一,近年来已被各国列为蜂蜜进出口检验的重要检测指标[4-5]。
顶空气相色谱-离子迁移谱联用技术(headspace-gas chromatography-ion migration spectroscopy, HS-GC-IMS)根据气相离子迁移速率差异对挥发性物质分离,并通过IMS检测器进行组分分析[6]。该方法将气相色谱的简单便捷与离子迁移谱的高分辨率、高准确度有效结合[7]。目前国内外耐高渗酵母常用检测方法中GC-MS、固相微萃取-气质联用及HPLC-MS法准确度高,但检测对象主要为酵母发酵的次级代谢产物,往往检出时产品已严重腐败,气相色谱-嗅闻-质谱(gas chromatography-olfactometry-mass spectrometry,GC-O-MS)联用电子传感器较上述方法更加灵敏,但仪器对空气湿度温度敏感,检测环境要求较高[4, 8]。HS-GC-IMS可以克服上述方法耗时长,成本高、检测环境及人员要求高等缺点,以其准确、灵敏、快速、易操作等特点,在食品品质及安全快速检测领域中显示出巨大的发展潜力[9]。
本研究对采样自2013—2017年3个省份的35个蜂蜜样品耐高渗酵母污染进行分离纯化,通过PCR序列分析及耐糖性生长曲线测定确定分离株种属及特性。结合HS-GC-IMS技术探究耐高渗酵母在污染蜂蜜过程的气味指纹图谱变化,为拓宽HS-GC-IMS在食品加工过程中污染检测应用提供一定的理论依据。同时为及时发现蜂蜜在贮存过程中耐高渗酵母潜在污染,控制蜂蜜腐败变质,降低产业经济损失具有重要意义。
1 材料与方法
1.1 材料与试剂
蜂蜜样品信息见表1;洋槐蜜、枣花蜜购自老蜂农;葡萄糖、蛋白胨、琼脂粉、酵母浸粉,北京奥博星;rTaq酶,宝日医生物技术(北京)有限公司;酵母DNA抽提试剂盒,Thermo Fisher Scientific公司;引物,奥科鼎盛生物公司。
1.2 仪器与设备
Infinite M200Pro酶标仪,瑞士TECAN;FlavourSpec®气相离子迁移谱联用仪,德国G.S.A公司;凝胶成像仪、电泳仪,美国Bio-Rad;SW-CJ-2FD超净工作台,苏州净化设备有限公司;DHP-9162恒温培养箱,上海齐欣科学仪器有限公司。
1.3 实验方法
1.3.1 蜂蜜样品理化指标
蜂蜜样品理化指标:pH、水分含量、葡萄糖含量、果糖含量、蔗糖含量测定依照SN/T 0852—2012《进出口蜂蜜检验规程》进行。
1.3.2 蜂蜜中耐高渗酵母分离纯化
称取2.0 g蜂蜜样品,加入2 mL灭菌蒸馏水稀释后涂布于YPD平板,重复3次,28 ℃培养2~4 d。
挑取疑似菌落划线转接于YPD平板,28 ℃培养2~4 d。重复2次,最后一次将菌落刮下与1.5 mL V(YPD)∶V(甘油)=1∶1混匀,冻存至-80 ℃备用。
1.3.3 26S rDNA鉴定
酵母菌转接至YPD液体培养基中,30 ℃,150 r/min培养24 h。采用Yeast DNA Extraction Kit提取模板DNA。
采用酵母菌26S rDNA通用引物(NL1:5′-GCATATCAATAAGCGGAGGAAAAG-3′;NL4:5′-GGTCCGTGTTTCAAGACGG-3′)。反应体系:引物各1 μL,Taq酶1 μL,dNTP 4 μL,10×Buffer 5 μL,模板5 μL,超纯水补足50 μL。扩增条件:94 ℃预变性5 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,36循环;72 ℃延伸5 min。扩增产物送至生工生物工程(上海)股份有限公司测序。通过NCBI数据库进行BLAST比对,确定种属类型。
1.3.4 耐高渗酵母耐糖性测定
取50 μL菌液(OD600=0.2)分别接入150 μL的YPD对照培养基及400、500、600、700、800 g/L的YPD高糖液体培养基中,每组3个平行。28 ℃培养7 d,每隔24 h测定1次OD600值,数据以平均值±标准差计,并绘制生长曲线。
1.3.5 蜂蜜中耐高渗酵母人工污染及培养
以筛选2号菌株人工污染枣花蜜及洋槐蜜。菌株活化后收集菌体,用灭菌蒸馏水清洗2次,调整菌液终浓度约为1 000 CFU/mL。在12份20 mL枣花蜜及12份20 mL洋槐蜜样品中各加入100 μL菌悬液,28 ℃培养,在3、7、15 d时各取出1组(3只)样品冻存至-80 ℃待测。15 d后以未接种酵母的枣花蜜及洋槐蜜为对照,测定其挥发性物质指纹图谱。
1.3.6 HS-GC-IMS测定
将1 mL待测样品置于顶空瓶。顶空孵化温度:80 ℃;孵化时间:15 min;孵化转速:500 r/min;顶空进样针温度:85 ℃;进样量:500 μL。色谱柱:FC-SE-54;色谱柱温度:40 ℃;载气:高纯N2(纯度>99.999%);设置程序流速2.00 mL/min保持2 min,在20 min内线性增至100 mL/min。IMS条件:漂移管温度:45 ℃;漂移气:N2(纯度>99.999%);漂移气流速:150 mL/min。
1.3.7 数据处理
采用Origin Pro 2021b软件对蜂蜜采样条件、理化性质及耐高渗酵母检出率进行Pearson关联分析[10];耐糖性数据以平均值±标准偏差表示,采用Graph Pad Prism 8.0软件进行数据处理及绘图;挥发性成分采用GC-IMS Library Search 1.0.3软件进行分析,通过LAV中Gallery插件构建气味指纹图谱。
2 结果与分析
2.1 蜂蜜理化指标及耐高渗酵母污染
35个蜂蜜样品水分含量为(16.91±0.09)%~(20.82±0.20)%,中蜂百花蜜、苹果蜜平均水分含量低于油菜蜜、荆条蜜和椴树蜜。含糖量为62.01%~76.54%,其中油菜蜜、荆条蜜平均含糖量显著高于其他4种蜂蜜。pH为3.45~4.48,椴树蜜平均pH最高,中蜂百花蜜最低。共有7个样品检出耐高渗酵母(7/35),平均污染率为20.0%。其中油菜蜜(4/12)、荆条蜜(1/3)、椴树蜜(1/3)检出率较高均为33.3%,中蜂百花蜜(0/15)和苹果蜜(0/1)均未检出,山枣蜜(1/1)检出率为100%(表1)。
如图1所示,关联分析表明,耐高渗酵母检出率与蜂蜜含水量呈极显著正相关(P<0.01),其次与蜂蜜种类和采样年份显著相关(P<0.05),受采样省份、总糖含量及pH影响较小。GAGLIO等[11]研究发现蜂蜜中水分含量增加会促进蜂蜜中耐高渗酵母的繁殖。虽然本研究中耐高渗酵母检出率与蜂蜜品种也呈现显著相关性,但进一步分析发现耐高渗酵母主要存在于水分含量相对较高的油菜蜜、荆条蜜和椴树蜜中,在水分含量相对较低的苹果蜜与中蜂百花蜜均未检出,由此推测耐高渗酵母与蜂蜜种类的相关性主要还是受不同蜂蜜间水分含量差异影响。ECHEVERRIGARAY等[12]研究发现,虽然蜂种不同、蜜源植物不同会显著影响蜂蜜中酵母污染率,但根本影响因素是不同蜂蜜含水量差异,这一结论与本研究结果一致。
表1 蜂蜜理化指标及耐高渗酵母污染
Table 1 Physicochemical indexes and osmotolerant yeast detection in honeys

蜂蜜品种采样地采样年份水分含量/%总糖含量/%pH值耐高渗酵母检出油菜蜜陕西汉中201419.52±0.0774.834.22+油菜蜜陕西汉中201419.22±0.0573.773.87-油菜蜜陕西汉中201419.37±0.1173.513.77-油菜蜜陕西汉中201419.44±0.0772.243.63+油菜蜜陕西汉中201418.93±0.1275.413.88+油菜蜜陕西汉中201418.30±0.0675.513.72-油菜蜜陕西安康201419.21±0.0774.323.79-油菜蜜陕西安康201419.10±0.0473.323.97-油菜蜜陕西安康201418.60±0.0176.153.88-油菜蜜四川江油201319.52±0.0974.864.16+油菜蜜四川绵阳201319.23±0.0973.633.77-油菜蜜四川江油201318.33±0.0275.014.14-荆条蜜辽宁鞍山201320.82±0.2075.813.82+荆条蜜辽宁鞍山201319.10±0.0572.823.45-荆条蜜河北赞皇201319.87±0.2076.543.80-椴树蜜黑龙江哈尔滨201419.20±0.0271.304.48+椴树蜜黑龙江伊春201417.10±0.0669.704.47-椴树蜜黑龙江虎林201419.44±0.0370.214.46-山枣蜜陕西咸阳201518.97±0.0669.744.16+苹果蜜陕西咸阳201517.60±0.0471.124.00-中蜂百花蜜陕西汉中201718.98±0.0266.664.11-中蜂百花蜜陕西汉中201717.82±0.0069.783.56-中蜂百花蜜陕西汉中201717.74±0.0865.013.72-中蜂百花蜜陕西汉中201718.59±0.0271.083.90-中蜂百花蜜陕西汉中201718.33±0.0372.483.88-中蜂百花蜜陕西汉中201717.59±0.0374.844.02-中蜂百花蜜陕西宝鸡201717.03±0.0265.533.87-中蜂百花蜜陕西宝鸡201717.86±0.0670.403.79-中蜂百花蜜陕西宝鸡201719.02±0.0468.193.88-中蜂百花蜜陕西延安201718.44±0.0672.803.64-中蜂百花蜜陕西延安201718.84±0.0970.643.93-中蜂百花蜜陕西商洛201719.85±0.0662.013.90-中蜂百花蜜陕西商洛201718.28±0.0574.393.77-中蜂百花蜜陕西汉中201716.91±0.0967.824.10-中蜂百花蜜陕西黄陵201718.97±0.0271.313.62-
注:“+”为检出,“-”为未检出(下同)
2.2 蜂蜜中耐高渗酵母分离及26S rDNA鉴定
本研究共分离出7株耐高渗酵母(表2),均为接合酵母属(Zygosaccharomyces),其中鲁氏接合酵母(Zygosaccharomyces rouxii)及蜂蜜接合酵母(Zygosaccharomyces mellis)各2株。蜂蜜中微生物主要来自蜜源植物、土壤、蜜蜂肠道、蜂巢等,可污染蜂蜜的酵母菌主要有接合酵母属、汉逊酵母属、酿酒酵母属、假丝酵母属、裂殖酵母属和毕赤酵母属等耐旱性酵母,其中最容易污染蜂蜜的为接合酵母属[1]。ECHEVERRIGARAY等[12]发现巴西无刺蜂蜂蜜中接合酵母属为主要污染物,这与本研究结果一致。
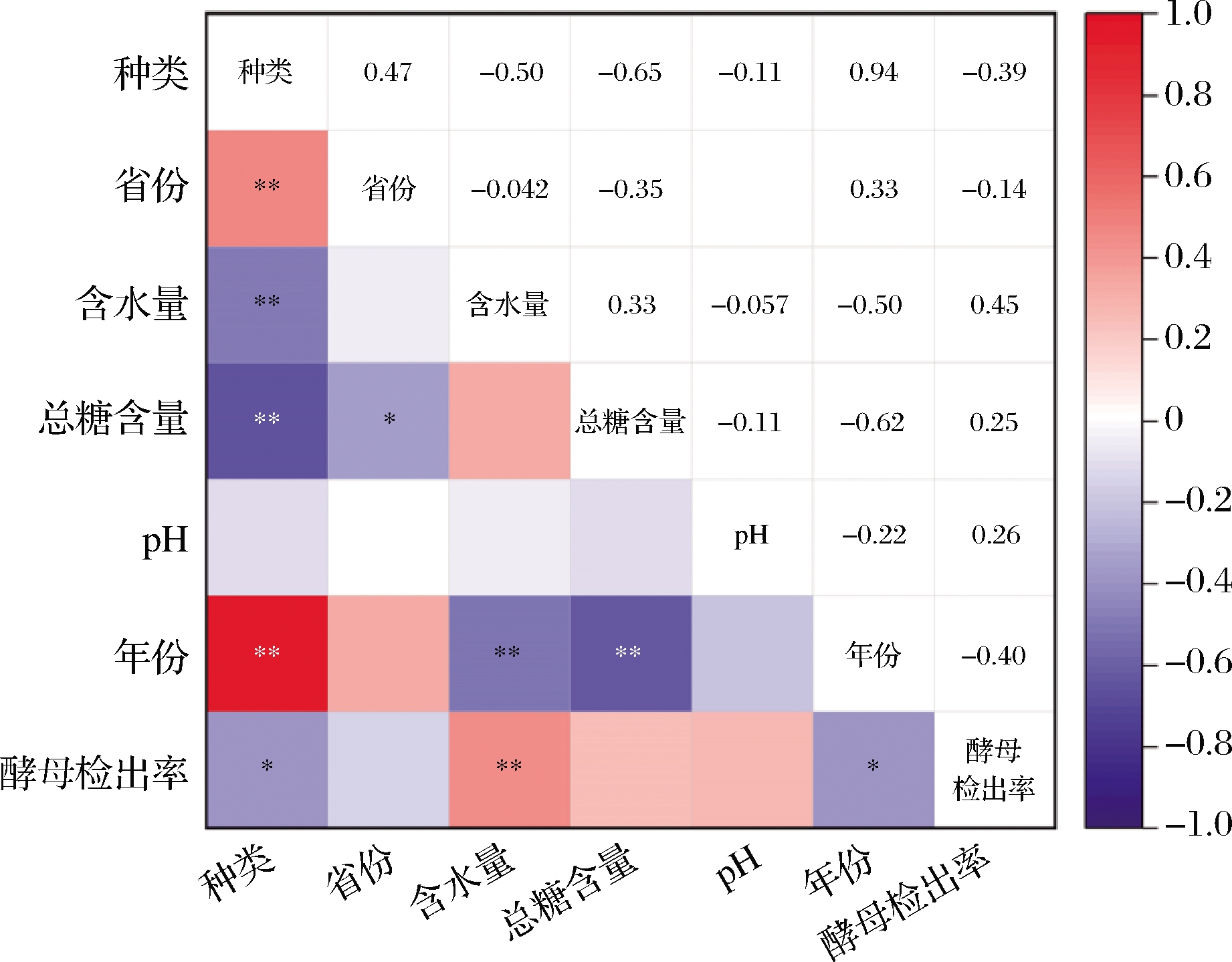
图1 耐高渗酵母污染与蜂蜜特性关联分析
Fig.1 Correlation analysis among the osmotolerant yeasts detection and physicochemical indexes in honeys
表2 耐高渗酵母26S rDNA分型
Table 2 26S rDNA identification of osmotolerant yeasts

菌株编号种属1Zygosaccharomyces rouxii2Zygosaccharomyces rouxii3Zygosaccharomyces sp. NBRC4Zygosaccharomyces sp.41 SL-2015 partial5Zygosaccharomyces mellis strain ML5346Zygosaccharomyces mellis partial7Zygosaccharomyces sp.NBRC 10669 partial
2.3 耐高渗酵母耐糖性及生长曲线测定
如图2所示,7株耐高渗酵母虽然在高糖作用下生长受到部分抑制,但均表现出较强的糖耐受性,在800 g/L糖质量浓度下均可生长繁殖。高于LIU等[13]从蜂蜜中分离出的蜂蜜接合酵母LGL-1的700 g/L糖耐量,大多数耐高渗酵母耐糖量在300~650 g/L,而蜂蜜中天然的高糖环境更适宜耐高渗酵母的自然筛选[14]。接合酵母属可通过调节繁殖模式,合成甘油、海藻糖及相关氧化酶等方式提高对高糖环境的适应性[13]。本研究中鲁氏结合酵母1、2对高糖培养基适应性最好,无高糖胁迫时,培养24 h进入对数期增长,48 h进入稳定期,随着糖浓度增加,对数期略有延长,稳定期推后至72 h。菌株3、4同为接合酵母属,适应性较1、2弱,培养48 h进入对数期,96 h进入稳定期,随着糖浓度增高稳定期推后,部分菌株生长被显著抑制。蜂蜜接合酵母5、6适应性较弱,适应期在2~3 d左右,对数期增长缓慢,随着糖浓度增高生长速度变慢,高糖浓度下7 d培养仍未达到稳定期。由图2可以看出,大部分菌株生长随着糖浓度升高被逐步抑制,但菌株2、3在糖质量浓度达到600 g/L后,其生长速度随着浓度提高反而逐渐提升。类似研究中也发现在某特定浓度下酵母会有生长速率大于低浓度组的情况[15],但其机理仍需进一步探讨。

a-菌株1;b-菌株2;c-菌株3;d-菌株4;e-菌株5;f-菌株6;g-菌株7
图2 耐高渗酵母在不同糖浓度下生长曲线
Fig.2 Growth curves of osmotolerant yeasts in different glucose concentrations
2.4 蜂蜜耐高渗酵母污染的HS-GC-IMS早期检测
结合HS-GC-IMS内置NIST数据库,根据保留时间、保留指数以及漂移时间对枣花蜜及洋槐蜜在耐高渗酵母污染前后不同时间段的挥发性成分进行定性分析(表3)。枣花蜜中共定性出54种风味物质,其中醛类15种,醇类11种,酮类10种,酯类8种,酸类5种,杂环类5种,有5种化合物在未污染蜂蜜中并未检出[环己酮(36)、糠醛单体(22)、糠醛二聚体(32)、苯甲醛二聚体(35)、乙酸丁酯二聚体(23)],其相对丰度在耐高渗酵母污染3 d后逐渐增加。洋槐蜜中共定性出35种风味物质,其中醛类10种,酮类8种,醇类6种,酯类7种,杂环类3种,酸类1种,仅环己酮(36)在未污染的洋槐蜜中未检出,其相对丰度在耐高渗酵母污染3 d后逐渐增加。研究表明,蜂蜜中挥发性风味物质以醛、酮类为主,其次为醇类和酯类,其中枣花蜜风味物质种类较洋槐蜜更为丰富,研究结果与GU等[9]一致。
利用Gallery Plot插件构建枣花蜜和洋槐蜜在耐高渗酵母污染后随时间推移的挥发性香气物质指纹图谱,比较挥发性组分在酵母污染早期的相对丰度差异(图3)。在洋槐蜜和枣花蜜中,环己酮(36)、糠醛单体(22)、糠醛二聚体(32)、苯甲醛单体(33)、苯甲醛二聚体(35)及乙酸丁酯二聚体(23)的相对丰度均随耐高渗酵母污染时间的延长而增加,其中环己酮(36)在2种蜂蜜对照组均未检出,在培养3 d后开始出现,其相对丰度随时间延长逐渐增高。环己酮是中蜂蜂蜜代表香气成分之一[16]。意蜂蜂蜜发酵后会产生环己酮,因此耐高渗酵母污染会影响基于气味指纹图谱对蜂蜜分型的准确性。2种蜂蜜中苯甲醛单体(33)及苯甲醛二聚体(35)的相对丰度在耐高渗酵母污染3 d后显著增加(图3-b)。GAGLIO等[11]发现蜂蜜副产物经耐高渗酵母发酵后,苯甲醛及糠醛含量均显著升高,这与本研究结果一致,推测苯甲醛可能为酵母发酵特征产物之一。枣花蜜中糠醛单体在耐高渗酵母污染后3 d检出,糠醛二聚体在培养15 d后检出(图3-b)。洋槐蜜中糠醛单体及糠醛二聚体相对丰度也在酵母污染15 d时显著增加(图3-a)。糠醛为酵母发酵的重要代谢产物,也是衡量蜂蜜加工及贮藏品质的重要指标之一。蜂蜜中糠醛的来源有2种:(1)蜂蜜在热加工中焦糖化反应生成;(2)与微生物对蜂蜜中抗坏血酸的降解和对C6~C9小分子醛的转化有关。本研究中2种蜂蜜在被酵母菌污染后,均为糠醛单体相对丰度先增加,随后糠醛二聚体再逐渐生成并增加,因此推测本研究中糠醛及其二聚体相对丰度的变化主要与耐高渗酵母发酵有关。除此之外,枣花蜜在耐高渗酵母污染后,乙酸丁酯(单体及二聚体)、苯乙醛、反式-2-辛烯醛、反式-2-己烯醇及2,3,5-三甲基吡嗪等呈香物质相对丰度也略有增加。
表3 枣花蜜洋槐蜜挥发性成分
Table 3 Volatile components of jujube honey and acacia honey
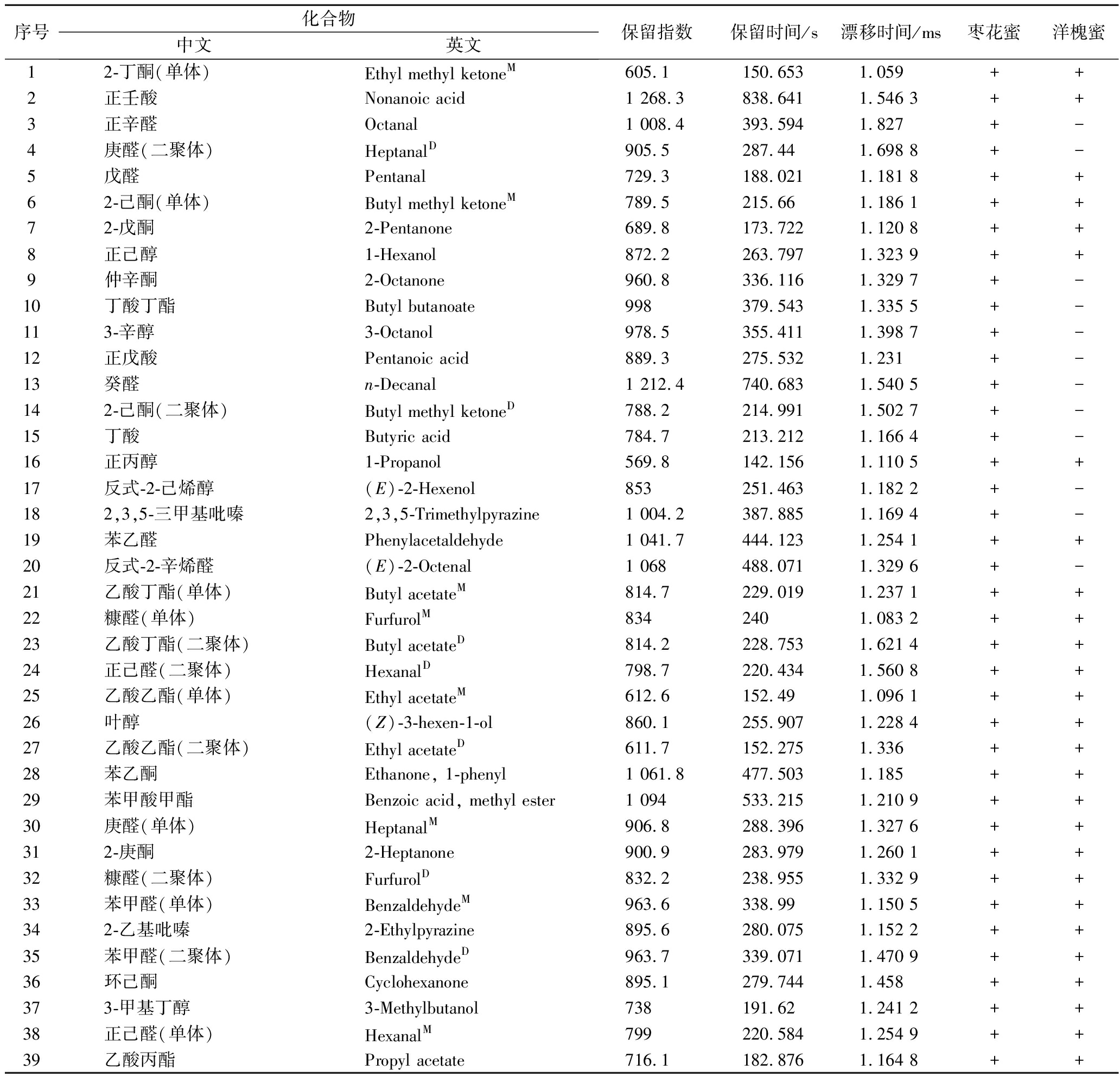
序号化合物中文英文保留指数保留时间/s漂移时间/ms枣花蜜洋槐蜜12-丁酮(单体)Ethyl methyl ketoneM605.1150.6531.059++2正壬酸Nonanoic acid1 268.3838.6411.546 3++3正辛醛Octanal1 008.4393.5941.827+-4庚醛(二聚体)HeptanalD905.5287.441.698 8+-5戊醛Pentanal729.3188.0211.181 8++62-己酮(单体)Butyl methyl ketoneM789.5215.661.186 1++72-戊酮2-Pentanone689.8173.7221.120 8++8正己醇1-Hexanol872.2263.7971.323 9++9仲辛酮2-Octanone960.8336.1161.329 7+-10丁酸丁酯Butyl butanoate998379.5431.335 5+-113-辛醇3-Octanol978.5355.4111.398 7+-12正戊酸Pentanoic acid889.3275.5321.231+-13癸醛n-Decanal1 212.4740.6831.540 5+-142-己酮(二聚体)Butyl methyl ketoneD788.2214.9911.502 7+-15丁酸Butyric acid784.7213.2121.166 4+-16正丙醇1-Propanol569.8142.1561.110 5++17反式-2-己烯醇(E)-2-Hexenol853251.4631.182 2+-182,3,5-三甲基吡嗪2,3,5-Trimethylpyrazine1 004.2387.8851.169 4+-19苯乙醛Phenylacetaldehyde1 041.7444.1231.254 1++20反式-2-辛烯醛(E)-2-Octenal1 068488.0711.329 6+-21乙酸丁酯(单体)Butyl acetateM814.7229.0191.237 1++22糠醛(单体)FurfurolM8342401.083 2++23乙酸丁酯(二聚体)Butyl acetateD814.2228.7531.621 4++24正己醛(二聚体)HexanalD798.7220.4341.560 8++25乙酸乙酯(单体)Ethyl acetateM612.6152.491.096 1++26叶醇(Z)-3-hexen-1-ol860.1255.9071.228 4++27乙酸乙酯(二聚体)Ethyl acetateD611.7152.2751.336++28苯乙酮Ethanone, 1-phenyl1 061.8477.5031.185++29苯甲酸甲酯Benzoic acid, methyl ester1 094533.2151.210 9++30庚醛(单体)HeptanalM906.8288.3961.327 6++312-庚酮2-Heptanone900.9283.9791.260 1++32糠醛(二聚体)FurfurolD832.2238.9551.332 9++33苯甲醛(单体)BenzaldehydeM963.6338.991.150 5++342-乙基吡嗪2-Ethylpyrazine895.6280.0751.152 2++35苯甲醛(二聚体)BenzaldehydeD963.7339.0711.470 9++36环己酮Cyclohexanone895.1279.7441.458++373-甲基丁醇3-Methylbutanol738191.621.241 2++38正己醛(单体)HexanalM799220.5841.254 9++39乙酸丙酯Propyl acetate716.1182.8761.164 8++
续表3
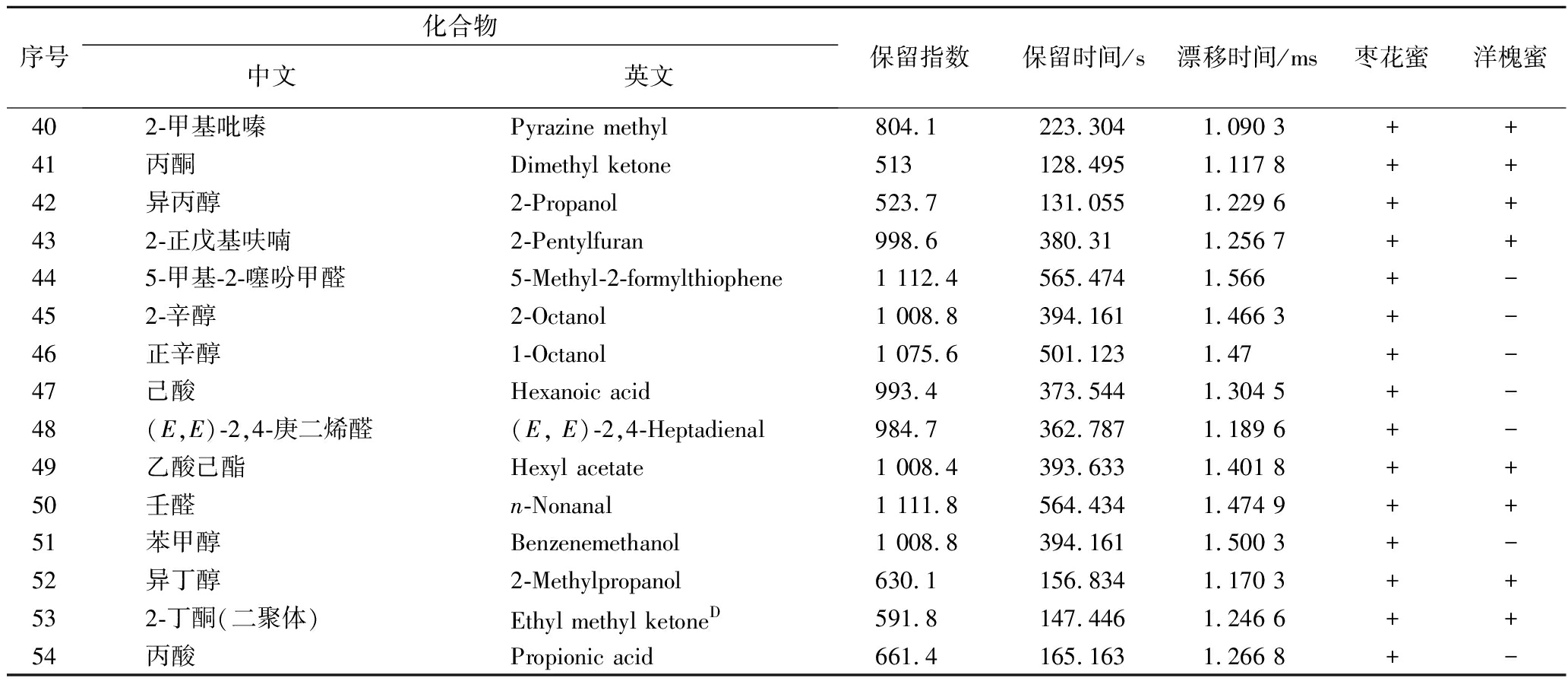
序号化合物中文英文保留指数保留时间/s漂移时间/ms枣花蜜洋槐蜜402-甲基吡嗪Pyrazine methyl804.1223.3041.090 3++41丙酮Dimethyl ketone513128.4951.117 8++42异丙醇2-Propanol523.7131.0551.229 6++432-正戊基呋喃2-Pentylfuran998.6380.311.256 7++445-甲基-2-噻吩甲醛5-Methyl-2-formylthiophene1 112.4565.4741.566+-452-辛醇2-Octanol1 008.8394.1611.466 3+-46正辛醇1-Octanol1 075.6501.1231.47+-47己酸Hexanoic acid993.4373.5441.304 5+-48(E,E)-2,4-庚二烯醛(E, E)-2,4-Heptadienal984.7362.7871.189 6+-49乙酸己酯Hexyl acetate1 008.4393.6331.401 8++50壬醛n-Nonanal1 111.8564.4341.474 9++51苯甲醇Benzenemethanol1 008.8394.1611.500 3+-52异丁醇2-Methylpropanol630.1156.8341.170 3++532-丁酮(二聚体)Ethyl methyl ketoneD591.8147.4461.246 6++54丙酸Propionic acid661.4165.1631.266 8+-
注:M代表单体,D代表二聚体

a-洋槐蜜;b-枣花蜜
图3 洋槐蜜及枣花蜜在耐高渗酵母污染3、7、15 d的气相离子迁移指纹谱图
Fig.3 GC-IMS fingerprint maps of acacia honey and jujube honey contaminated by osmotolerant yeast in 3, 7, 15 days
注:红色框标注为相对丰度上升的化合物,绿色框标注为相对丰度降低的化合物;Y1~Y3、Y13~Y15为对照组,Y4~Y6、Y16~Y18为污染3 d组, Y7~Y9、Y19~Y21为污染7 d组,Y10~Y12、Y22~Y24为污染15 d组
洋槐蜜共有6种挥发性香气成分相对丰度随污染时间增加而降低,除苯甲酸甲酯(29)在第3天就有明显降低外,苯乙酮(28)、乙酸乙酯单体(25)、乙酸乙酯二聚体(27)、叶醇(26)及2-庚酮(31)在污染初期相对丰度变化均较为缓慢,第7天开始显著下降(图3-a)。乙酸乙酯单体及乙酸乙酯二聚体具有明显的花果香气,是蜂蜜中较为常见的香气成分,其主要来自于蜜源植物及蜂蜜加工过程中的焦糖化反应,洋槐蜜在酵母污染后该香气成分相对丰度明显降低,但枣花蜜中该成分略有上升,该差异可能由不同蜂蜜间香气前体成分差异有关。枣花蜜中12种挥发性香气成分的相对丰度从污染第3天起开始降低,其中2-己酮二聚体(14)、癸醛(13)、正戊酸(12)、3-辛醇(11)、丁酸丁酯(10)、仲辛酮(9)、正己醇(8)及庚醛二聚体(4)、正辛醛(3)为枣花蜜特有香气成分(图3-b)。2-戊酮(7)具有明显的苹果及花香气味,赋予枣花蜜良好的香气品质,庚醛二聚体(4)具有脂类香气,是意蜂蜂蜜区别于中蜂蜂蜜的特征香气组分[16-17]。2-庚酮(31)是唯一1种同时存在于枣花蜜和洋槐蜜中,且相对丰度随污染时间增加而显著降低的香气成分,具有明显的苹果及花香气味,是新鲜蜂蜜中最常见的挥发性香气成分之一[6,18]。本研究中2-庚酮相对丰度在酵母污染后第3天显著降低,15 d后在2种蜂蜜中均无检出。有研究表明,2-庚酮的含量与氨基酸变化呈明显的负相关[19],酵母菌可将蜂蜜中的蛋白质分解为氨基酸作为氮源使用,发酵过程中氨基酸含量呈现先增加后降低的趋势。因此在酵母菌发酵早期,随着氨基酸含量迅速增加,其含量则会减少,这与本研究结果一致。由此推测2-庚酮相对丰度降低是由耐高渗酵母发酵引起,并可将其作为判断蜂蜜中耐高渗酵母早期污染潜在代表组分之一。
3 结论
本研究对35份蜂蜜样品中的耐高渗酵母进行分离纯化、26S rDNA、耐糖性及生长曲线测定。理化性质关联分析表明,耐高渗酵母污染率与蜂蜜含水量呈极显著正相关(P<0.01)。共分离出7株耐高渗酵母菌,均为接合酵母属,且具有较强的糖耐受性,在800 g/L糖质量浓度下均可生长繁殖。通过HS-GC-IMS对枣花蜜和洋槐蜜分别定性出54及35种挥发性香气组分,以醛、酮类为主,其次为醇类和酯类,其中枣花蜜挥发性香气组分种类较洋槐蜜更为丰富。HS-GC-IMS对耐高渗酵母污染后蜂蜜中挥发性香气组分变化具有灵敏的检测特性,糠醛单体、糠醛二聚体、苯甲醛单体、苯甲醛二聚体、环己酮及2-庚酮相对丰度变化可作为判断枣花蜜及洋槐蜜在耐高渗酵母早期污染(3~7 d)的潜在特征香气组分,但不同酵母菌发酵是否有差异仍需进一步探究。该研究为基于HS-GC-IMS技术对蜂蜜产业中耐高渗酵母污染的早期、快速、便捷检测新方法的探索提供了理论依据。
[1] CHEN L, WEI X, LIU G L, et al.Glycerol, trehalose and vacuoles had relations to pullulan synthesis and osmotic tolerance by the whole genome duplicated strain Aureobasidium melanogenum TN3-1 isolated from natural honey[J].International Journal of Biological Macromolecules, 2020, 165:131-140.
[2] MATRAXIA M, ALFONZO A, PRESTIANNI R, et al.Non-conventional yeasts from fermented honey by-products:Focus on Hanseniaspora uvarum strains for craft beer production[J].Food Microbiology, 2021, 99:103806.
[3] CAI R, HU M M, ZHANG Y J, et al.Antifungal activity and mechanism of citral, limonene and eugenol against Zygosaccharomyces rouxii[J].LWT, 2019, 106:50-56.
[4] WANG H X, SUN H M.Potential use of electronic tongue coupled with chemometrics analysis for early detection of the spoilage of Zygosaccharomyces rouxii in apple juice[J].Food Chemistry, 2019, 290:152-158.
[5] KAST C, ROETSCHI A.Evaluation of baker′s yeast in honey using a real-time PCR assay[J].Food Microbiology, 2017, 62:282-288.
[6] XIA A N, TANG X J, DONG G Z, et al.Quality assessment of fermented rose jams based on physicochemical properties, HS-GC-MS and HS-GC-IMS[J].LWT, 2021, 151:112153.
[7] 金文刚, 刘俊霞, 赵萍, 等.气相-离子迁移色谱分析洋县不同色泽糙米蒸煮后挥发性气味物质差异[J/OL].食品科学, 2022.https://kns.cnki.net/kcms/detail/11.2206.TS.20220112.1620.003.html.
JIN W G, LIU J X, ZHAO P, et al.Analysis of volatile odor components of cooked brown rice with different colors from Yang County based on gas chromatography-ion mobility spectroscopy[J/OL].Food Science, 2022.https://kns.cnki.net/kcms/detail/11.2206.TS.20220112.1620.003.html.
[8] FENG X Y, WANG H W, WANG Z R, et al.Discrimination and characterization of the volatile organic compounds in eight kinds of huajiao with geographical indication of China using electronic nose, HS-GC-IMS and HS-SPME-GC-MS[J].Food Chemistry, 2022, 375:131671.
[9] GU S, ZHANG J, WANG J, et al.Recent development of HS-GC-IMS technology in rapid and non-destructive detection of quality and contamination in agri-food products[J].TrAC Trends in Analytical Chemistry, 2021, 144:116435.
[10] 刘俊霞, 赵萍, 金晶 等.基于GC-IMS结合化学计量学分析大鲵肉冷藏期间挥发性成分[J/OL].食品与发酵工业, 2022.DOI:10.13995/j.cnki.11-1802/ts.030169.
LIU J X, ZHAO P, JIN J, et al.Analysis of volatile components in giant salamander meat during cold storage based on gas chromatography-ion mobility spectrometer and chemometrics[J/OL].Food and Fermentation Industries, 2022.DOI:10.13995/j.cnki.11-1802/ts.030169.
[11] GAGLIO R, ALFONZO A, FRANCESCA N, et al.Production of the Sicilian distillate “Spiritu re fascitrari” from honey by-products:An interesting source of yeast diversity[J].International Journal of Food Microbiology, 2017, 261:62-72.
[12] ECHEVERRIGARAY S, SCARIOT F J, FORESTI L, et al.Yeast biodiversity in honey produced by stingless bees raised in the Highlands of southern Brazil[J].International Journal of Food Microbiology, 2021, 347:109200.
[13] LIU G L, BI X Y, TAO C L, et al.Comparative transcriptomics analysis of Zygosaccharomyces mellis under high-glucose stress[J].Food Science and Human Wellness, 2021, 10(1):54-62.
[14] JIANG H, XUE S J, LI Y F, et al.Efficient transformation of sucrose into high pullulan concentrations by Aureobasidium melanogenum TN1-2 isolated from a natural honey[J].Food Chemistry, 2018, 257:29-35.
[15] 李玉洁, 陈鑫超, 徐晓兰, 等.高糖对蜂蜜中鲁氏接合酵母生理特性的影响[J].中国蜂业, 2019, 70(12):69-73.
LI Y J, CHEN X C, XU X L, et al.Effects of high sugar on physiological characteristics of Zygosaccharomyces rouxii in honey[J].Apiculture of China, 2019, 70(12):69-73.
[16] WANG X R, ROGERS K M, LI Y, et al.Untargeted and targeted discrimination of honey collected by Apis cerana and Apis mellifera based on volatiles using HS-GC-IMS and HS-SPME-GC-MS[J].Journal of Agricultural and Food Chemistry, 2019, 67(43):12 144-12 152.
[17] XIA A N, MENG X S, TANG X J, et al.Probiotic and related properties of a novel lactic acid bacteria strain isolated from fermented rose jam[J].LWT, 2021, 136:110327.
[18] WANG X R, YANG S P, HE J N, et al.A green triple-locked strategy based on volatile-compound imaging, chemometrics, and markers to discriminate winter honey and sapium honey using headspace gas chromatography-ion mobility spectrometry[J].Food Research International, 2019, 119:960-967.
[19] 刘红微. 牧区醪糟菌分离、发酵燕麦醪糟工艺及关键特征香气的研究[D].呼和浩特:内蒙古农业大学, 2021.
LIU H W.Study on fermentation technology and key aroma of oat Laozao by bacteria isolation from pastoral area Laozao[D].Hohhot:Inner Mongolia Agricultural University, 2021.