葡萄酒酿造中,非酿酒酵母(non-Saccharomyces cerevisiae)是有别于酿酒酵母(Saccharomyces cerevisiae)的一大类酵母菌,它们广泛存在于葡萄园土壤、果实表皮和酿酒过程中,主要包括有孢汉逊酵母属(Hanseniaspora)、有孢圆酵母属(Torulaspora)、毕赤酵母属(Pichia)、梅奇酵母属(Metschnikowia)、假丝酵母属(Candida)和伊萨酵母属(Issatchenkia)等[1-3]。其中,一些非酿酒酵母具有独特的代谢通路和较强的酶活力,可以降低酒精的生成,增加甘油、萜烯和酯类含量,释放甘露糖蛋白或多糖改善口感,增强颜色稳定性[4]。利用一些非酿酒酵母的优势使其在受控的条件下参与或辅助葡萄酒酿造,能够对葡萄酒的风味产生积极影响[4]。
与酿酒酵母相比,一些非酿酒酵母能够代谢产生大量的β-葡萄糖苷酶[5]。β-葡萄糖苷酶作为一种纤维素类水解酶能够水解糖苷结合态物质中的糖苷键释放香气物质,促进一些萜烯类和C13-降异戊二烯类物质的产生,从而增加葡萄酒的花香、果香和坚果香,对于改善或增强葡萄酒的风味复杂性有重要作用[6-7]。JOLLY等[8]报道了毕赤酵母属(Pichia)酵母菌株具有代谢产生高β-葡萄糖苷酶活力的潜力;KONG等[9]将具有高β-葡萄糖苷酶活力的发酵毕赤酵母(Pichia fermentans)和胶红酵母(Rhodotorula mucilaginosa)胞外酶添加到黑比诺葡萄酒中,明显增加了酒体的花果香气。然而,传统的酿酒条件(如高浓度糖、高酒精度、高浓度SO2和低pH值)可能会抑制发酵体系中β-葡萄糖苷酶活力,导致其无法充分水解糖苷键[9]。研究表明,酵母菌的分布与地理位置和气候条件等密切相关[10]。目前,世界上许多著名葡萄酒产地的本土酵母菌已被广泛研究。我国酵母资源丰富,为改善葡萄酒的香气,促进产区葡萄酒风土表达,特别是对于一些特色酒庄,应用高产β-葡萄糖苷酶的本土酵母来生产具有独特风格的葡萄酒是一条重要途径。因此,筛选来自本土高产β-葡萄糖苷酶且耐受性优良的非酿酒酵母菌株对提高葡萄酒香气具有重要的意义。
本文以452株本土非酿酒酵母菌为实验材料,根据其发酵能力、产β-葡萄糖苷酶能力、耐受性等进行了筛选研究,并进一步分析了上述菌株的β-葡萄糖苷酶酶学性质,旨在得到具有高产酸性β-葡萄糖苷酶及对葡萄酒生境耐受性优良的非酿酒酵母菌株,并为其进一步开发应用奠定基础。
1 材料与方法
1.1 材料试剂与仪器
1.1.1 实验材料
商业酿酒酵母活性干粉(Vintage Red,SC-VR),意大利Enartis公司;452株本土非酿酒酵母,分离自贺兰山东麓和河西走廊葡萄酒产区,保藏于甘肃省葡萄与葡萄酒工程学重点实验室,菌株编号分别为GS1~GS65、GC66~GC209、GC301~GC335、NM210~NM240、ZC241~ZC300、ZX336~ZX344、BF345~BF361。
YPD液体培养基(g/L):无水葡萄糖20,蛋白胨20,酵母浸粉10。
YPD固体培养基:在YPD液体培养基基础上加入20 g/L琼脂。
初筛培养基(g/L):七叶苷3,柠檬酸铁0.5,NaCl 2,MgSO4·7H2O 0.5,KH2PO4 1,琼脂20。
发酵培养基(g/L):葡萄糖20,蛋白胨20,酵母粉10,NH4 NO3 3,KH2PO4 4,MgSO4·7H2O 0.5,吐温-80 10。
所有培养基均于121 ℃灭菌20 min。
1.1.2 主要试剂
偏重亚硫酸钠、酒石酸、无水乙醇、无水葡萄糖、果糖、蔗糖、对硝基苯基-β-D-葡萄糖苷(4-nitrophenyl β-D-glucopyranoside,p-NPG),上海源叶生物科技有限公司;ZnSO4·7H2O、MgSO4·7H2O、MnSO4·H2O、FeSO4·7H2O、FeCl3、CuSO4·5H2O、CaCl2、CoSO4·5H2O、Ni2SO4、木糖、半乳糖、甘露糖、阿拉伯糖、麦芽糖,上海中秦化学试剂有限公司;酵母基因组DNA提取试剂盒AD1900,北京索莱宝科技有限公司;PEG 20000透析袋,上海源叶生物科技有限公司。
1.1.3 仪器与设备
SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;SPX-150-II生化培养箱,上海跃进医疗器械有限公司;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;H2050R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;Genesis 10s紫外-可见分光光度计,美国Thermo Scientific公司;1510酶标仪,美国Thermo Fisher公司。
1.2 实验方法
1.2.1 菌株活化
保藏菌种分别活化,挑取单菌落于YPD液体培养基,28 ℃培养48 h后,以2%的接种量于YPD液体培养基中连续培养2次后进行试验。
1.2.2 发酵能力试验
参考CAPECE等[11]的方法,采用CO2失重法进行菌株发酵能力的测定,并略做修改。将供试菌株菌悬液按2%的接种量接种于装有YPD液体培养基(8 mL)的无菌样品瓶(12 mL)中,用无菌橡胶塞密封,并插入一次性无菌针头进行排气,于28 ℃恒温培养箱中培养72 h,每隔12 h使用电子天平(可精确称量至0.000 1 g)进行称重并记录数据,以SC-VR作为对照。
1.2.3 高产β-葡萄糖苷酶菌株的初筛
参考马得草等[12]的方法,取180 μL已灭菌的β-葡萄糖苷酶初筛培养基加入到96孔培养板中,接入供试菌株菌悬液20 μL,于28 ℃培养48 h。根据颜色等级初步判定酶活力大小,深棕色表示高产、浅棕色表示中产、灰绿色表示低产、无色表示不产。
1.2.4 耐受性试验
参照吴健等[13]的方法进行测定。以YPD液体培养基为基础,分别将葡萄糖质量浓度梯度设为150、200、250、300、350 g/L;SO2质量浓度(以偏重亚硫酸钠的形式添加)梯度设为50、100、150、200、250 g/L;酒精体积分数梯度设为3%、6%、9%、12%、15%;pH值梯度设为2.5、3.5、4.5、5.5、6.5;均以2%接种量接种供试菌株菌悬液,28 ℃静置培养24 h,于600 nm处用酶标仪测定吸光值。
1.2.5 高产β-葡萄糖苷酶菌株的复筛
将优选出的非酿酒酵母菌株于YPD培养基中传代培养2次后,挑取单菌落接种于YPD液体培养基,28 ℃培养48 h后,以10%的接种量接种于发酵培养基中,150 r/min,28 ℃的摇床条件下培养72 h。
参照李爱华等[14]的方法制备粗酶液,略做修改。取发酵液于转速为8 000 r/min、温度为4 ℃的条件下离心15 min,收集上清液,用80%饱和度的硫酸铵盐析,4 ℃下静置过夜,离心(4 ℃,10 000 r/min,10 min)收集沉淀,用等体积乙酸-乙酸钠缓冲液(pH=5.0)溶解,再用PEG 20000进行透析,得到粗酶液并测定粗酶液酶活力大小,筛选出较高酶活力的菌株。
酶活力测定参照马得草等[12]的方法进行。β-葡萄糖苷酶活力单位(U)定义为:40 ℃下1 min内催化生成1 μmol 对硝基苯酚所需要的酶量。
1.2.6 优选菌株酶学性质分析
最适反应温度的测定:参照孔利华等[15]的方法,并略做修改。以p-NPG为底物,按照酶活力测定方法分别于10、20、30、40、50、60、70 ℃反应30 min,测定酶活力,确定β-葡萄糖苷酶的最适反应温度。
最适反应pH值的测定:参照孔利华等[15]的方法,并略做修改。以p-NPG为底物,按照酶活力测定方法将粗酶液用柠檬酸-磷酸缓冲液调节pH为2.0、3.0、4.0、5.0、6.0、7.0于最适反应温度下反应30 min,测定酶活力,确定β-葡萄糖苷酶的最适pH值。
金属离子和酶抑制剂对酶活力的影响:参照刘洋等[16]的方法测定。按照酶活力测定方法,在反应体系中添加5 mmol/L的金属离子(Zn2+、Mg2+、Mn2+、Fe2+、Fe3+、Cu2+、Ca2+、Co2+、Ni2+)和体积分数为1%的酶抑制剂[EDTA、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、巯基乙醇和二甲基亚砜)],在最适温度和最适pH值下测定酶活力,以不添加金属离子和酶抑制剂的反应酶液活力为100%,测定相对酶活力。
底物对酶活力的影响:参照刘洋等[16]的方法测定。按照酶活力测定方法,在反应体系中添加0.1 mol/L 的底物(葡萄糖、木糖、半乳糖、甘露糖、麦芽糖、果糖、蔗糖、阿拉伯糖和纤维二糖),在最适温度和最适pH值下测定酶活力,以不添加任何糖的反应酶液活力为100%,测定相对酶活力。
1.2.7 优选菌株的菌属鉴定
使用酵母基因组DNA提取试剂盒AD1900提取上述筛选获得的菌株DNA,由北京擎科生物科技有限公司进行26S rDNA D1/D2区域序列测序。测序结果利用NCBI数据库与目的酵母属序列进行Blast同源性比对,从而鉴定筛选菌株种属。
1.3 数据分析
每个试验数据均独立进行3次,取平均值。采用Excel 2010和Origin 9.0进行数据处理和图形绘制。
2 结果与分析
2.1 菌株的发酵能力分析
酵母酒精发酵过程伴随着CO2的产生,因此利用CO2失重法即可评价菌株的酒精发酵能力[11]。图1显示了452株试验菌株CO2失重量的分布情况,其中商业酿酒酵母SC-VR的CO2失重量(72 h)可达0.63 g/100mL,而供试的非酿酒酵母菌株CO2失重量>0.63 g/100mL的有83株,通常酿酒酵母的发酵力明显高于非酿酒酵母,结合酿酒酵母发酵能力为0.63 g/100mL,本试验将CO2失重量大于酿酒酵母发酵能力的80%即0.51 g/100mL的菌株视为具有较好的发酵能力,共有221株,对其进行后续试验。
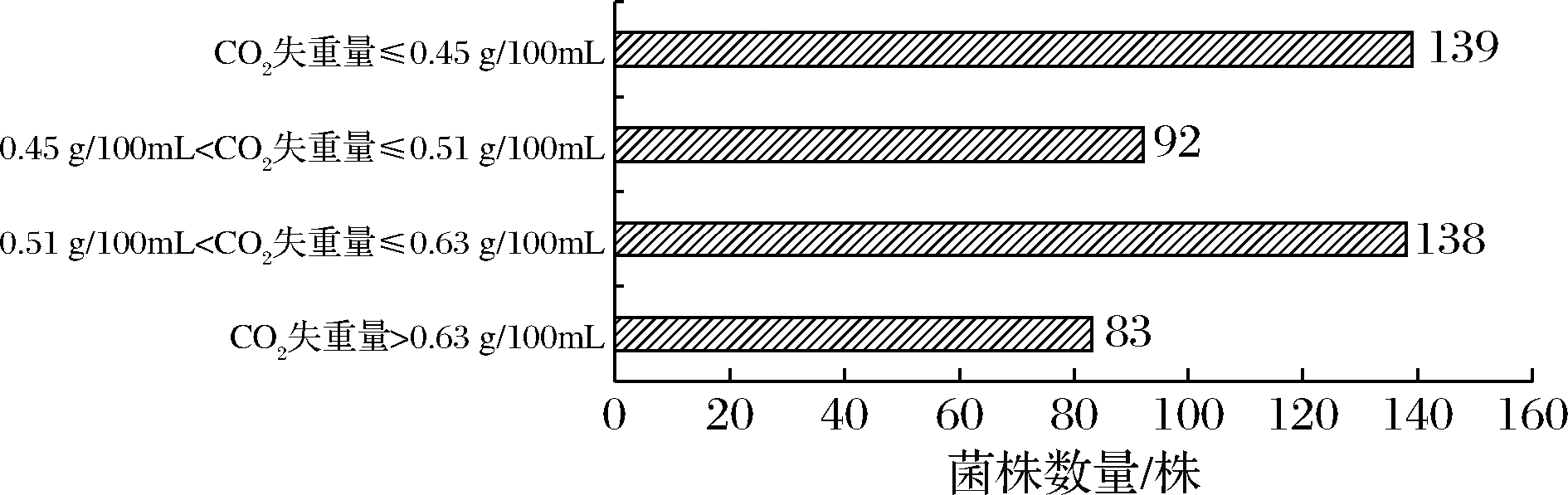
图1 试验菌株发酵能力分布
Fig.1 Distribution of fermentation capacity of test strains
2.2 高产β-葡萄糖苷酶菌株的初筛
七叶苷显色反应是判断酵母菌株产生β-葡萄糖苷酶活力高低的重要指标之一。如图2所示,不同颜色等级代表了产生β-葡萄糖苷酶活力的高低,通过对供试菌株进行显色判定发现,不产β-葡萄糖苷酶的菌株有78株(共221株),低产β-葡萄糖苷酶的菌株有72株,中产β-葡萄糖苷酶的菌株有37株,高产β-葡萄糖苷酶的菌株有34株。

图2 试验菌株在七叶苷培养基上的显色图片及产酶等级分布
Fig.2 Distribution of color pictures and enzyme-producing grades of test strains on esculin medium
2.3 菌株的耐受性分析
发酵过程中,非酿酒酵母的生长受到诸多因素的影响,如葡萄汁含糖量、发酵温度、酒精体积分数和SO2添加量等均会影响其生长。通过观察菌株在YPD液体培养基中的生长情况和OD600的关系,可将其分为5种类型,其中OD600≥1.0时,菌株大量生长;0.5≤OD600<1.0时,菌株明显生长;0.3≤OD600<0.5时,菌株生长;0.1≤OD600<0.3时,菌株微量生长;OD600<0.1时,菌株不生长。根据34株试验菌株在YPD液体培养基中的生长情况显示,菌株GC204、NM218、ZC278、ZC287、BF345、BF370在不同条件下均表现出较高的耐受性,表明这6株菌株在葡萄酒酿造中具有一定的应用潜力。
由图3-A可知,菌株GC204、NM218、ZC278、ZC287、BF345、BF370在葡萄糖质量浓度为200 g/L时,其生长活性达到最大值。一般酿酒葡萄汁糖的最高质量浓度在300 g/L左右(以葡萄糖计)[17],而试验菌株能在350 g/L的高糖质量浓度下明显生长,说明菌株具有良好的高糖耐受性。由图3-B可知,随着SO2质量浓度的增加,6株试验菌株的细胞浓度均呈下降趋势,但能够在250 mg/L SO2的条件下明显生长。由图3-C可知,6株试验菌株能够在酒精体积分数为3%~6%的条件下明显生长,当酒精体积分数超过9%时,仅有菌株NM218、BF370能够明显生长。由图3-D可知,菌株GC204、NM218、ZC278呈现上升的生长趋势,而菌株ZC287、BF345、BF370呈现先上升后下降的生长趋势,说明前者可能为中性菌株,后者为弱酸性菌株。6株试验菌株均能够在pH值为2.5的条件下明显生长,几乎不受低pH值的影响,说明这6株试验菌株具有良好的低pH耐受性。

A-葡萄糖浓度;B-SO2浓度;C-酒精体积分数;D-pH值
图3 试验菌株在不同条件下的耐受性分析
Fig.3 Tolerance analysis of the test strains under different conditions
2.4 高产β-葡萄糖苷酶菌株的复筛
通过测定6株供试菌株的β-葡萄糖苷酶活力(图4)。结果表明,菌株GC204、NM218、BF345的酶活力显著高于菌株ZC278、ZC287、BF370,分别为54.34、49.5、46.42 mU/mL。
2.5 β-葡萄糖苷酶酶学性质分析
温度会影响酶催化反应的速度以及酶蛋白的稳定性。由图5-A可知,温度为10~70 ℃时,菌株GC204、NM218、BF345的β-葡萄糖苷酶活力均呈现先上升后下降的趋势;反应温度为40 ℃时,3株菌酶活力达到最大值,GC204为47.95 mU/mL,NM218为47.08 mU/mL,BF345为49.42 mU/mL;当温度为70 ℃时,3株菌酶活降低了34.58%~39.11%。
pH值会影响酶的构象,还会影响酶与底物的解离状态,从而影响酶的活性和稳定性。由图5-B可知,菌株NM218和BF345的β-葡萄糖苷酶最适pH值为4.0,是弱酸性酶,其酶活力分别为49.70、50.78 mU/mL;而菌株GC204的β-葡萄糖苷酶在pH值为7.0时的酶活力达到最大,为54.40 mU/mL,是中性酶。
金属离子和酶抑制剂对菌株GC204、NM218、BF345的β-葡萄糖苷酶影响如图5-C所示,浓度为5 mmol/L的Zn2+、Mn2+、Fe2+、Fe3+对3株菌的酶活力具有明显的激活作用,促使酶活力上升了23.72%~70.72%,而Cu2+对酶活力具有明显的抑制作用,酶活力下降了14.87%~32.89%。4种酶抑制剂对菌株GC204的β-葡萄糖苷酶表现出明显的抑制作用,酶活力下降了33.93%~45.41%,而4种酶制剂对NM218和BF345的β-葡萄糖苷酶的抑制效果不明显,酶活力仅下降了2.71%~7.66%。
不同糖底物(葡萄糖、木糖、半乳糖、甘露糖、麦芽糖、果糖、蔗糖、阿拉伯糖和纤维二糖)对菌株GC204、NM218、BF345酶活力的影响如图5-D所示,9种糖底物对β-葡萄糖苷酶均表现出激活作用,其中纤维二糖对3株菌株的酶活力激活作用尤为明显,将酶活力提高了25.67%~40.80%;葡萄糖、麦芽糖和蔗糖将菌株GC204的酶活力提高了10.43%~18.52%;而除纤维二糖以外的其他不同糖底物对NM218和BF345的酶活力激活效果不明显。

图4 试验菌株β-葡萄糖苷酶活力
Fig.4 β-glucosidase activity of the test strain
注:不同小写字母代表差异显著(P<0.05)
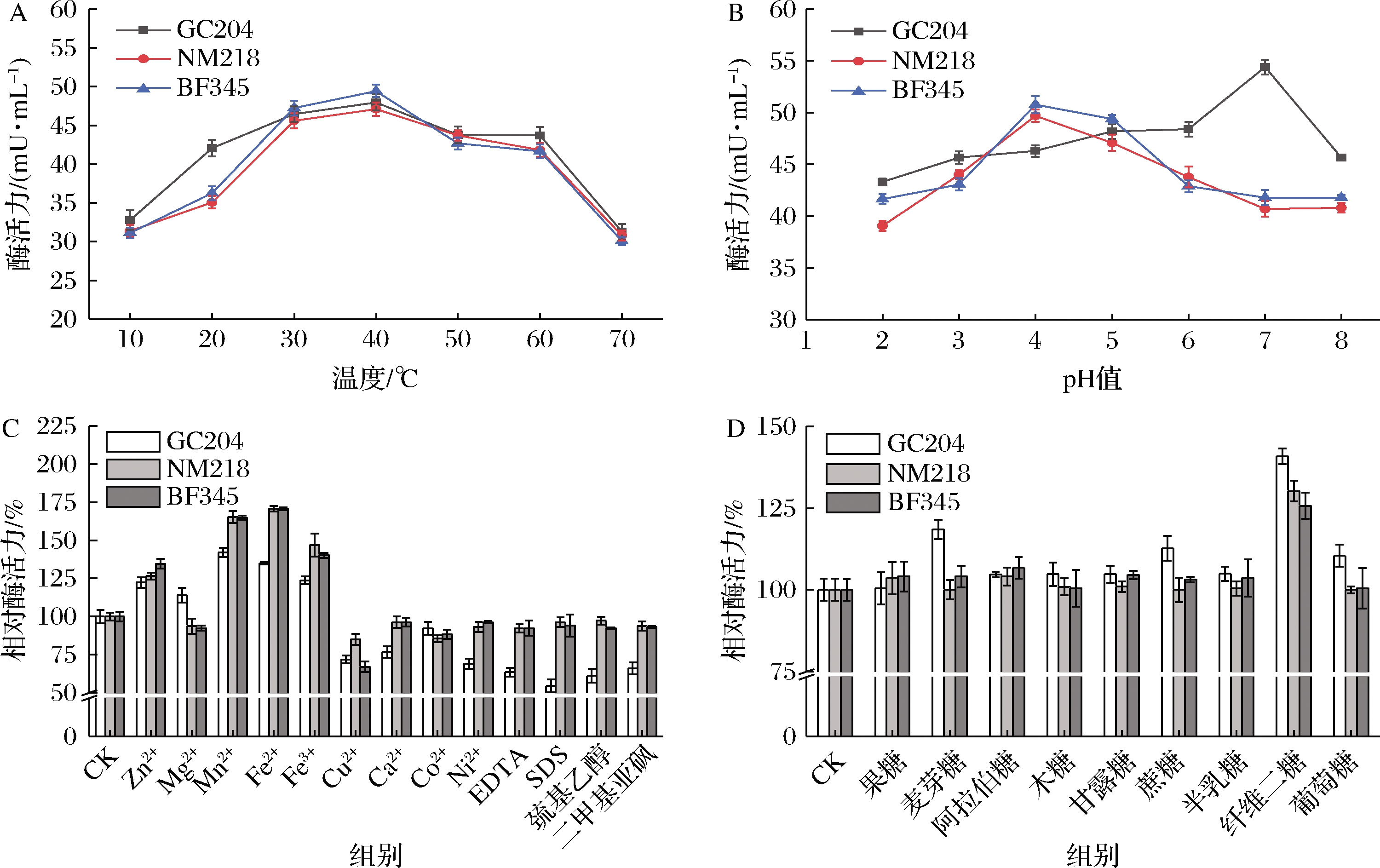
A-温度;B-pH值;C-不同金属离子及酶抑制剂;D-糖底物
图5 温度、pH值、不同金属离子及酶抑制剂和糖底物对酶活力的影响
Fig.5 Effects of temperature, pH, different metal ions and enzyme inhibitors and sugar substrates on enzyme activity
2.6 优选菌株的菌属鉴定
葡萄酒发酵过程中发酵液的pH值一般在3.5~4.5,所以选取具有弱酸性酶活力的菌株NM218和BF345进行下一步试验。通过对其进行26S rDNA D1/D2测序,如表1所示。
表1 试验菌株26S rDNA D1/D2区域序列测序结果
Table 1 Sequencing results of the 26S rDNA D1/D2 region of the test strain
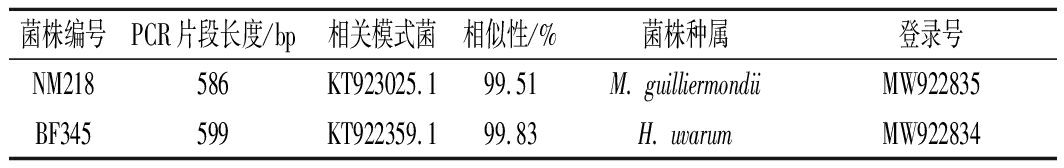
菌株编号PCR片段长度/bp相关模式菌相似性/%菌株种属登录号NM218586KT923025.199.51M. guilliermondiiMW922835BF345599KT922359.199.83H. uvarumMW922834
并利用NCBI数据库对菌株NM218与Meyerozyma guilliermondii菌株进行Blast同源序列比对,其相似性为99.51%,因此,菌株NM218被鉴定为季也蒙毕赤酵母(M.guilliermondii)。同时,比对菌株BF345与Hanseniaspora uvarum菌株序列,相似性为99.83%,因此,菌株BF345被鉴定为葡萄汁有孢汉逊酵母(H.uvarum)。
3 讨论
酵母菌在葡萄酒酿造中具有重要作用,优质葡萄酒的酿造依赖于优良微生物菌种的开发利用。葡萄酒发酵初期的低pH、高糖、高SO2以及逐渐增高的乙醇体积分数这些环境因子能够影响酵母菌群的生长动态,从而影响酒精发酵,因此酵母菌株对葡萄酒生境下的耐受性是决定其能否应用于葡萄酒酿造的重要前提条件。本研究通过筛选获得1株季也蒙毕赤酵母(M.guilliermondii)菌株NM218和1株葡萄汁有孢汉逊酵母(H. uvarum)菌株BF345,这2株菌均能够在350 g/L葡萄糖、250 mg/L SO2、pH值2.5和6%乙醇体积分数的条件下生长,具有较好的耐受性。PERRUSQU A-LUEVANO等[18]研究发现的1株H.uvarum菌株能够耐受350 g/L葡萄糖和100 mg/L SO2,刘晓柱等[19]发现的1株H.uvarum F119菌株能够耐受300 mg/L的SO2质量浓度、pH值2.0和8%乙醇;这些结果虽然与本研究结果有一定的差异,但也说明H.uvarum菌株具有在葡萄酒生境下正常生长的潜力,但考虑其能够耐受6%乙醇这一特性,在应用方面适合在酿酒前期使用。
A-LUEVANO等[18]研究发现的1株H.uvarum菌株能够耐受350 g/L葡萄糖和100 mg/L SO2,刘晓柱等[19]发现的1株H.uvarum F119菌株能够耐受300 mg/L的SO2质量浓度、pH值2.0和8%乙醇;这些结果虽然与本研究结果有一定的差异,但也说明H.uvarum菌株具有在葡萄酒生境下正常生长的潜力,但考虑其能够耐受6%乙醇这一特性,在应用方面适合在酿酒前期使用。
高产β-葡萄糖苷酶的非酿酒酵母能够增加挥发性化合物含量,从而提高葡萄酒的感官复杂性和某些发酵参数[20-21]。本研究中筛选得到的菌株NM218和BF345的β-葡萄糖苷酶活力可达49.5、46.42 mU/mL。尹荐等[22]发现胶红酵母和发酵毕赤酵母有较高的β-葡萄糖苷酶活力,分别为41.81、30.42 mU/mL。因此,本文筛选得到的菌株NM218和BF345具有较高的β-葡萄糖苷酶活力。
微生物源β-葡萄糖苷酶的酶学性质因菌种、菌株不同而有较大差异,其适用范围也随之不同。已报道的微生物源β-葡萄糖苷酶最适反应pH值为3.5~7.0,以pH值4.0~6.0常见;最适反应温度在40~70 ℃,常为55 ℃,部分为65~70 ℃[23-24]。工业葡萄酒发酵过程中原料葡萄汁的pH值多在3.5~4.5,酒精发酵过程的温度控制在30~35 ℃[25],因此,要充分利用酵母产生的β-葡萄糖苷酶,则对其最适反应温度和pH值提出了要求。DA SILVA等[23]研究发现Pichia guilliermondii G1.2产生的β-葡萄糖苷酶pH3.5~5.5及温度55 ℃时活性最高;王彩肖[26]研究发现3株自选酵母和5株商用酵母中β-葡萄糖苷酶的最适反应温度为50 ℃;来自吐鲁番盆地的5株高产β-葡萄糖苷酶的酵母菌株在pH 5.0时表现出高活性[27]。这些菌株产生的β-葡萄糖苷酶尚无法满足实际葡萄酒酿造的需求。本研究中菌株NM218和BF345的酶活力最适反应温度为40 ℃,最适pH值为4.0,能基本满足在酿酒期间的温度和低pH值条件,说明菌株具有在葡萄酒发酵过程发挥作用的潜力。
4 结论
本研究从452株本土非酿酒酵母菌株中初步筛选获得了34株发酵能力较好且高产β-葡萄糖苷酶的菌株。经耐受性试验发现,菌株GC204、NM218、ZC278、ZC287、BF345、BF370对葡萄糖、SO2、酒精度和pH值均具有较好的耐受性。同时,复筛及酶学性质分析表明,菌株NM218和BF345具有较高的β-葡萄糖苷酶活力,分别为49.5和46.42 mU/mL,酶促反应最适温度为40 ℃,最适pH值为4.0;浓度为5 mmol/L的Zn2+、Mn2+、Fe2+、Fe3+对2种菌株的β-葡萄糖苷酶活力均具有明显的激活作用;Cu2+具有明显的抑制作用;纤维二糖对2种菌株的β-葡萄糖苷酶激活效果明显,使酶活力提高30.18%~40.80%。通过26S rDNA D1/D2测序比对,鉴定菌株NM218和BF345分别为季也蒙毕赤酵母(M.guilliermondii)和葡萄汁有孢汉逊酵母(H.uvarum)。
[1] LEE S B, PARK H D.Isolation and investigation of potential non-Saccharomyces yeasts to improve the volatile terpene compounds in Korean Muscat Bailey a wine[J].Microorganisms, 2020, 8(10):1 552.
[2] CIANI M, COMITINI F MANNAZZU I, et al.Controlled mixed culture fermentation:A new perspective on the use of non-Saccharomyces yeasts in winemaking[J].FEMS Yeast Research, 2010, 10(2):123-133.
[3] 张阳, 江璐, 郭志君, 等.利用β-葡萄糖苷酶提高葡萄酒香气的研究进展[J].现代食品科技, 2020, 36(4):316-324.
ZHANG Y, JIANG L, GUO Z J, et al.Improving wine aroma by using β-glucosidase:A review[J].Modern Food Science and Technology, 2020, 36(4):316-324.
[4] 战吉宬, 曹梦竹, 游义琳, 等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学, 2020, 53(19):4 057-4 069.
ZHAN J C, CAO M Z, YOU Y L, et al.Research advance on the application of non- Saccharomyces in winemaking[J].Scientia Agricultura Sinica, 2020, 53(19):4 057-4 069.
[5] 覃秋杏, 韩小雨, 黄卫东, 等.非酿酒酵母产生的β-葡萄糖苷酶在发酵酒中的应用[J].食品科学, 2022,43(3):306-314.
QIN Q X, HAN X Y, HUANG W D, et al.Application of β- glucosidase produced by non-Saccharomyces cerevisiae in fermented wine[J].Food Science, 2022,43(3):306-314.
[6] WOJTUSIK M, YEPES C M, VILLAR J C, et al.Kinetic modeling of cellobiose by a β-glucosidase from Aspergillus fumigatus[J].Chemical Engineering Research and Design, 2018, 136:502-512.
[7] ZHANG W X, ZHUO X H, HU L L, et al.Effects of crude β-glucosidases from Issatchenkia terricola, Pichia kudriavzevii, Metschnikowia pulcherrima on the flavor complexity and characteristics of wines[J].Microorganisms, 2020, 8(6):953.
[8] JOLLY N P, VARELA C, PRETORIUS I S.Not your ordinary yeast:Non-Saccharomyces yeasts in wine production uncovered[J].FEMS Yeast Research, 2014, 14(2):215-237.
[9] KONG C L, LI A H, JIN G J, et al.Evolution of volatile compounds treated with selected non-Saccharomyces extracellular extract during Pinot noir winemaking in monsoon climate[J].Food Research International, 2019, 119:177-186.
[10] LOPES C A, RODR GUEZ M E, SANGORR
GUEZ M E, SANGORR N M, et al.Patagonian wines:The selection of an indigenous yeast starter[J].Journal of Industrial Microbiology and Biotechnology, 2007, 34(8):539-546.
N M, et al.Patagonian wines:The selection of an indigenous yeast starter[J].Journal of Industrial Microbiology and Biotechnology, 2007, 34(8):539-546.
[11] CAPECE A, GRANCHI L, GUERRINI S, et al.Diversity of Saccharomyces cerevisiae strains isolated from two Italian wine-producing regions[J].Frontiers in Microbiology, 2016, 7:1 018.
[12] 马得草, 游灵, 李爱华, 等.高产β-葡萄糖苷酶野生酵母的快速筛选及其糖苷酶酿造适应性研究[J].西北农林科技大学学报(自然科学版), 2018, 46(1):129-135.
MA D C, YOU L, LI A H, et al.Rapid screen of wild yeast with high β-glucosidase activity and evaluation of its glycosidase in winemaking[J].Journal of Northwest A & F University (Natural Science Edition), 2018, 46(1):129-135.
[13] 吴健, 何伟, 王建成, 等.酿酒酵母与产香酵母发酵特性及其相互作用规律[J].食品与发酵工业, 2020, 46(20):78-87.
WU J, HE W, WANG J C, et al.Fermentation characteristics and interaction of Saccharomyces cerevisiae and aroma-producing yeast[J].Food and Fermentation Industries, 2020, 46(20):78-87.
[14] 李爱华, 孙玮璇, 李萍, 等.葡萄汁有孢汉逊酵母β-葡萄糖苷酶的提取与纯化[J].中国食品学报, 2019, 19(6):150-156.
LI A H, SUN W X, LI P, et al.The extraction and purification of β-glucosidase from Hanseniaspora uvarum strain[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(6):150-156.
[15] 孔利华, 高书锋, 雷平, 等.产β-葡萄糖醛酸苷酶菌株胃肠道耐受性与酶学特性研究[J].家畜生态学报, 2020, 41(9):59-64;96.
KONG L H, GAO S F, LEI P, et al.Gastrointestinal tolerance and enzymatic characteristics of a strain producing β-glucosidase[J].Journal of Domestic Animal Ecology, 2020, 41(9):59-64;96.
[16] 刘洋, 彭惠, 张汆, 等.嗜热淀粉芽孢杆菌来源β-葡萄糖苷酶的重组表达与酶学性质[J].微生物学通报, 2020, 47(7):2 050-2 059.
LIU Y, PENG H, ZHANG C, et al.Recombinant expression and characterization of β-glucosidase from Bacillus thermoamylovorans[J].Microbiology, 2020, 47(7):2 050-2 059.
[17] 高晓航, 李雪雁, 孙春丽.贺兰山东麓葡萄酒产区酿酒酵母的分离及其主要特性研究[J].食品与发酵工业, 2016, 42(6):62-66.
GAO X H, LI X Y, SUN C L.The isolation and main characteristics of Saccharomyces cerevisiae in East Helan mountain wine-producing regions[J].Food and Fermentation Industries, 2016, 42(6):62-66.
[18] PERRUSQU A-LUÉVANO S,CANO-HERRERA M S,GUIG
A-LUÉVANO S,CANO-HERRERA M S,GUIG N-L
N-L PEZ C, et al.Microbiology of high-sugar must fermentation by novel yeasts from the Chihuahuan desert[J].FEMS Yeast Research, 2018, 19(1):foy099.
PEZ C, et al.Microbiology of high-sugar must fermentation by novel yeasts from the Chihuahuan desert[J].FEMS Yeast Research, 2018, 19(1):foy099.
[19] 刘晓柱, 赵湖冰, 李银凤, 等.一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析[J].食品与发酵工业, 2020, 46(8):97-104.
LIU X Z, ZHAO H B, LI Y F, et al.Identification and oenological properties analysis of a strain of Hanseniaspora uvarum from Rosa roxburghii[J].Food and Fermentation Industries, 2020, 46(8):97-104.
[20] MARTIN V, VALERA M, MEDINA K, et al.Oenological impact of the Hanseniaspora/Kloeckera yeast genus on wines-a review[J].Fermentation, 2018, 4(3):76.
[21] GUARAGNELLA N, CHIARA M, CAPECE A, et al.Corrigendum:Genome sequencing and comparative analysis of three Hanseniaspora uvarum indigenous wine strains reveal remarkable biotechnological potential[J].Frontiers in Microbiology, 2020,10:3 133.
[22] 尹荐, 陶永胜, 孙玮璇, 等.优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果[J].农业工程学报, 2020, 36(4):278-286.
YIN J, TAO Y S, SUN W X, et al.Effect of aroma enhancement for dry white wine by selected non-Saccharomyces extracellular enzymes[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(4):278-286.
[23] DA SILVA R R D, DA CONCEIÇ O P J P D, DE MENEZES C L A D, et al.Biochemical characteristics and potential application of a novel ethanol and glucose-tolerant β-glucosidase secreted by Pichia guilliermondii G1.2[J].Journal of Biotechnology, 2019, 294:73-80.
O P J P D, DE MENEZES C L A D, et al.Biochemical characteristics and potential application of a novel ethanol and glucose-tolerant β-glucosidase secreted by Pichia guilliermondii G1.2[J].Journal of Biotechnology, 2019, 294:73-80.
[24] 陈今朝, 王剑锋, 王慧超, 等.热稳定酸性β-葡萄糖苷酶的分离纯化及其酶学性质[J].食品科学, 2012, 33(11):205-209.
CHEN J Z, WANG J F, WANG H C, et al.Purification and characterization of thermostable acidic β-glucosidase from Aspergillus niger L.[J].Food Science, 2012, 33(11):205-209.
[25] 李华, 邵建辉.干红葡萄酒酿造过程中“关键质量控制点”的确定与控制[J].西北农林科技大学学报(自然科学版), 2004, 32(10):38-42.
LI H, SHAO J H.Establishment and control of critical quality control point for dry red winemaking[J].Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2004, 32(10):38-42.
[26] 王彩肖. 高产β-葡萄糖苷酶酵母菌株的筛选及酶学性质研究[D].石家庄:河北科技大学, 2014.
WANG C X.Selection and characterization of β-glucosidase producing yeast strains[D].Shijiazhuang:Hebei University of Science and Technology, 2014.
[27] 徐建坤. 产β-葡萄糖苷酶酵母菌的分离鉴定及特性研究[D].石河子:石河子大学, 2019.
XU J K, Isolation, identification and charaterization of β-glucosidase producing yeast[D].Shihezi:Shihezi University, 2019.