莲(Nelumbo nucifera Gaertn.)也被称为中国睡莲、圣莲或印度莲,是一种睡莲科(Nelumbonaceae)莲属(Nelumbo Adans)多年生水生草本植物(图1),根据形态和利用部位,分为子莲、花莲和藕莲3种类型。我国是莲的主要起源地之一,莲种植历史悠久,种质资源丰富。近年来,我国莲产业规模稳步发展,种植区域面积逐步增大,其中藕莲、子莲种植面积分别达到4.0×105、1.0×105 hm2 [1-2]。莲的各个部位可食用或药用,其根状茎即莲藕或藕带可作蔬菜食用,鲜莲子可作水果食用,花可供观赏或药食,莲叶、莲房、莲子、莲心、莲须与藕节等皆可入药,由于富含生物碱类、黄酮类等活性物质成分[3],赋予其多种药理活性,如良好的预防心血管疾病、抗氧化、抗炎症、抗癌、抗菌、抗病毒、降血糖、调脂减肥等作用[4],其中原花青素是一类天然多酚黄酮类化合物,以其强大的抗氧化性能而闻名,已被证实是莲发挥药理作用的重要活性物质之一[5]。近年来国内外众多学者对莲中原花青素开展了研究工作,主要集中在其提取分离、抗氧化活性、药理作用等方面[6-8],但相关研究还不充分,尚无针对莲中原花青素的检测标准体系,其产品开发利用仍较少,提取分离工艺、毒理学等方面的研究有待深入。本文对莲中原花青素的组分构成、提取分离、检测分析及在食品中的应用等方面研究进行综述,以期为后续深入研究莲中原花青素及其开发利用提供参考。
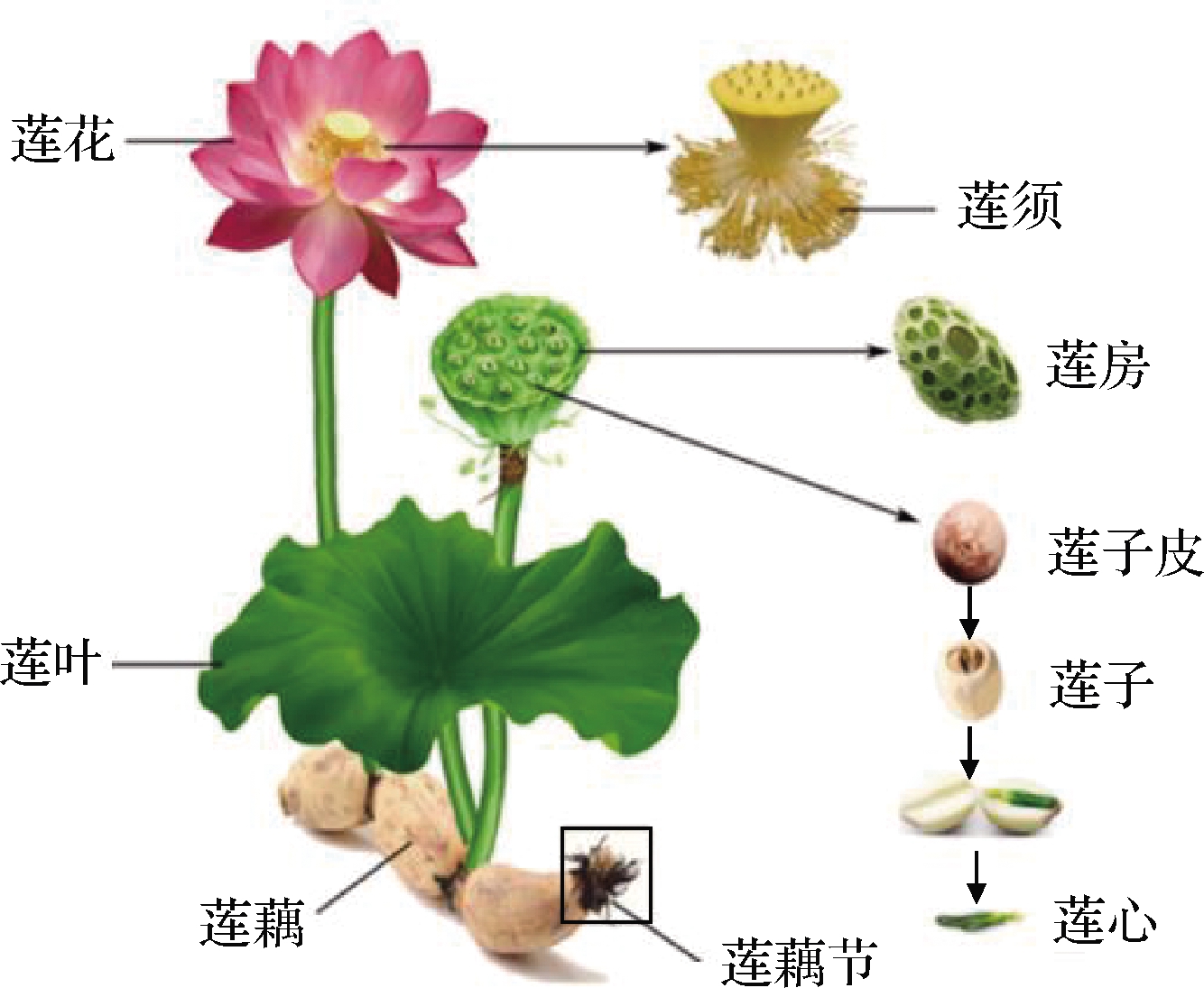
图1 莲全株示意图[9]
Fig.1 Schematic diagram of the whole lotus plant
1 莲中原花青素的组分构成
原花青素(proanthocyanidins, PCs)又称缩合单宁,是一类由黄烷-3-醇结构单元通过C—C键缩合形成的不同聚合度的混合物[10],因在热酸性溶液中可转化成花青素而得名,是广泛存在于植物中的天然多酚化合物,在葡萄籽(232.1 mg/g)[11]、花生衣(144.1~170.3 mg/g)[12]等植物组织中含量较高。按照黄烷-3-醇之间连接方式的不同,分为A型和B型,前者由1个碳键C4→C8或C4→C6和1个醚键C2→O→C7连接形成,后者通过1个碳键C4→C8或C4→C6连接形成,其中A型结构更细长、更坚固,性质更稳定[13];按照其聚合度的不同,分为低聚体(聚合度≤4)和高聚体(聚合度>4),其中低聚体抗氧化活性更强,生物利用度更高[14]。
以往研究表明,不同品种及产地莲中PCs含量存在差异[15-16],莲不同部位中PCs含量也不相同,从高到低依次为:莲房>藕节>莲叶>荷梗,以莲房中含量最高(7.8%, 干重)[16],且众多研究显示,莲中PCs以B型为主,构成单元包括(+)-儿茶素(catechin, C)、(-)-表儿茶素(epicatechin, EC)、(+)-没食子儿茶素(gallocatechin, GC)和(-)-表没食子儿茶素(epigallocatechin, EGC)(图2),并且主要由单体、二聚体及三聚体组成,其中二聚体含量最高(占比为43.5%),其次为三聚体(占比为37.4%)和单体(占比为3.25%)[17-20]。目前莲中已知的PCs的类型如表1所示。
表1 莲中的原花青素类型[5, 17-25]
Table 1 Proanthocyanidins isolated from lotus

种类名称(+)-C(-)-EC单体(+)-GC(-)-EGC(-)-ECGEC-(4β→8)-CEC-(4β→8)-CC-(4α→8)-ECEC-(4β→8)-EC(EGC/GC)-(EGC/GC)B2-gallateB型二聚体B2/B3B1/B4(B1/B4)-(EC/C)(B2/B3)-(EGC/GC)(B2/B3)-(EC/C)B1/B2/B3/B4(B1/B2/B3/B4)-OH(B1/B2/B3/B4)-(EC/C)(B1/B2/B3/B4)-(EC/C)-OHB型三聚体(EC/C)-(EC/C)-(EGC/GC)A型二聚体A1/A2(EC/C)-O-(EGC/GC)A型三聚体(EGC/GC)-O-(EGC/GC)-O-(EGC/GC)
注:A1,原花青素A1;A2,原花青素A2;B1,原花青素B1;B2,原花青素B2;B3,原花青素B3;B4,原花青素B4;ECG, 表儿茶素没食子酸酯(epicatechin gallate)(下同)
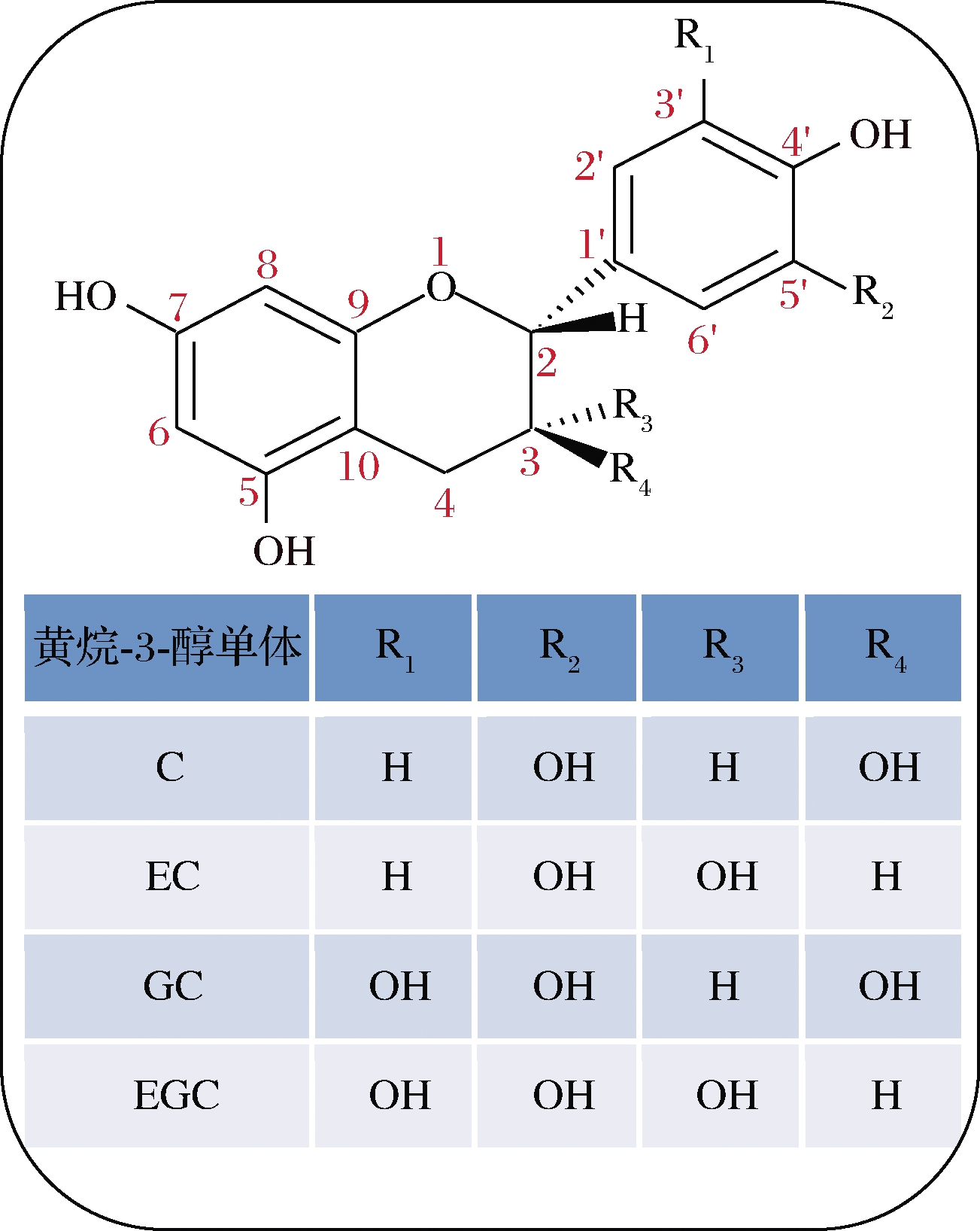
图2 莲原花青素中黄烷-3-醇主要结构单元
Fig.2 Structures of the flavan-3-ol units in proanthocyanidins from lotus
2 莲中原花青素的提取分离
2.1 样品预处理
样品预处理是莲中PCs提取分离的重要环节之一,适当的预处理方式是保证PCs提取效率的重要前提。样品的粒度和水分含量是影响植物样品中PCs提取效率的2个重要因素。理论上,样品越细与溶剂接触面积越大,提取效率越高,但样品过细大量细胞破裂,造成不溶性杂质溶出,给后续分离提纯带来困难。样品中水分含量的增加会引起多酚氧化酶等一些酶促反应,从而降低样品的稳定性[10]。然而,干燥过程中失水会导致细胞收缩,从而降低细胞中PCs的提取效率。由于PCs是热不稳定型色素,对温度、光及pH敏感[26],为防止其氧化和降解,应存放在避光、低温及弱酸性条件下。根据现有的研究报道,新鲜的莲样(莲房、莲叶、莲藕等)采集回来后,用水洗净[24-25,27],然后在-20 ℃冷冻保存[24],或热风干燥(≤50 ℃)至恒重(含水量<10%)[16,22-23,25,27],粉碎,过40~100目筛[5,22-23,25,27-28],置于干燥器内,在-20 ℃保存备用。不同的干燥方法对莲中PCs提取得率具有显著的影响。以莲房为例,采用不同干燥方法获得的PCs含量由高到低顺序为:50 ℃恒温烘干>通风避光处阴干>日光下直接晒干[15],而采用-20 ℃ 冷冻48 h后自然风干的干燥方法比直接晒干的方法,PCs提取得率提高了47.6%[20]。
2.2 提取方法
PCs分子中含有多个酚羟基官能团,属强极性物质,易溶于甲醇、乙醇、丙酮等极性溶剂,由于在不同溶剂中溶解度有差异,可采用适当浓度(50%~75%,体积分数)的有机溶液进行提取。LI等[5]采用丙酮溶液提取莲子皮中PCs,按照料液比1∶54(g∶mL),丙酮体积分数为67%、pH为2.7,温度37 ℃,时间90 min的条件进行提取,再用乙酸乙酯提取3~4次,经分离后得到莲子皮原花青素纯化物。表2列举了近年来有关莲中PCs主要的提取方法,包括有机溶剂提取法[17-21,25,27]、酶辅助提取法[28-30]、超声辅助提取法[31-32]、微波辅助提取法[33]和脉冲超声辅助提取法[34],以及各提取方法的原理、应用实例和优缺点。其中以乙醇溶液为提取剂的溶剂提取法使用最普遍,辅以酶、微波和超声波等手段协同使用,有效利用各提取方法的优势,能够快速并有效地提高莲中PCs的提取效率和得率,并且操作简单易行,被广泛应用于莲中PCs的提取,不同提取手段的协同使用以达到优异的提取效果将是今后莲中PCs提取的发展方向。
表2 莲中原花青素的提取工艺方法
Table 2 The extraction methods of proanthocyanidins in lotus

方法原理应用实例优点缺点有机溶剂提取法PCs易溶于甲醇、乙醇、丙酮等有机溶剂,根据相似相容原理,可用一定浓度的有机溶剂为浸提剂从莲中提取PCs。在不同的溶剂体系中,乙醇因价廉环保,应用最广泛。采用甲醇溶液提取莲房中PCs,在甲醇体积分数为60%、pH为2.0,提取温度为60 ℃,提取1 h,提取率为7.65%[18]。设备要求不高、操作简单,成本低。提取过程耗时长,需多次提取,溶剂消耗大。酶辅助提取法在提取过程中加入特异性的生物酶,如纤维素酶、果胶酶等,破坏植物细胞壁和脂质体,使胞内PCs充分溶出。采用纤维素酶辅助闪式法提取莲蓬中PCs,纤维素酶加入量为2%,得率为8.12%[28]。用果胶酶和纤维素酶提取莲房中PCs,2种酶的添加量分别为0.1%和0.7%,相比直接用乙醇提取,提取率提高约48%[30]。操作简便,效率高,提取条件温和,耗能低,绿色环保。酶活性受反应体系温度、pH等因素影响大,易失活,使用成本高。超声辅助提取法利用超声波的空化作用、机械振动破壁效应破坏植物细胞壁,使细胞内的PCs在短时间内快速释放至溶液内。采用超声辅助丙酮溶液提取莲子壳中PCs,超声功率为720 W,超声提取21 min,得率为43.96 mg/g[31]。用该方法辅助乙醇溶液提取莲房中PCs,在250 W超声功率下提取30 min,提取率为6.45%[32]。设备简单,操作容易,处理量大,速度快,提取率较高。超声波发生器噪声大,超声过程可能导致产物降解,或粗提物中杂质含量增加。微波辅助提取法利用高频率的电磁波迅速加热和破裂植物细胞壁,使PCs充分溶出并渗透至溶液中。采用微波辅助丙酮溶液提取莲房中PCs,微波功率为700 W,提取时间90 s,提取率为5.58%,是丙酮直接提取法的2.6倍[33]。操作简单,提取体系受热均匀,快速,节能省时。设备价格贵,使用成本高。脉冲超声辅助提取法利用脉冲超声场对莲不同组织细胞壁的强力破坏作用,使胞内PCs快速溶出。采用脉冲超声辅助丙酮溶液提取莲房中PCs,超声功率1 000 W,55 ℃提取35 min,得率为6.6%,与丙酮提取法相比得率提高了2.9倍[34]。快速高效,提取率较高。对提取设备要求高,能耗大。
2.3 分离纯化方法
从莲的不同部位提取的PCs粗提物中往往含有脂类、叶绿素、鞣质及其他酚类化合物等杂质成分,需进一步分离纯化得到较高纯度的产品,才能用于结构鉴定、功能研究、产品开发等方面。目前莲中PCs粗提物的分离与纯化沿袭了传统的分离纯化方法,主要包括溶剂萃取法[5,20-21]、大孔树脂吸附法[17-19,23-24,27]、凝胶色谱法[16,19-20]、高速逆流色谱法[25]及膜过滤法[35]等。
表3列举了各分离纯化方法的原理、应用实例和优缺点。其中大孔树脂吸附法对PCs具有良好的分离纯化效果,由于操作简单、绿色环保,适合产业化等优势,目前在莲中PCs分离纯化中应用最广。通过对树脂静态吸附和解吸能力的考察,AB-8、HPD-400、HPD-100、DA-201等商品大孔树脂,由于对莲中PCs吸附选择性强、吸附容量高、解吸条件温和、再生简便等特点而得到广泛应用。Sephadex LH-20葡聚糖凝胶色谱柱可以有效去除糖、叶绿素等色素和大多数酚类干扰物质,应用也很普遍。由表3可知,各方法在分离纯化莲中PCs应用上各有优劣,由于粗提物成分复杂,因此综合利用多种纯化手段,最大程度地发挥各方法的优势进行多级纯化是今后莲中PCs分离纯化的发展方向。LIU等[21]从莲房中提取PCs,利用AB-8大孔树脂(Φ 1.5 cm×35 cm)初步纯化,以蒸馏水、50%乙醇洗脱得到大孔树脂纯化物,再经Sephadex LH-20凝胶柱(Φ 3.2 cm×40 cm)纯化,依次用蒸馏水、25%甲醇、50%甲醇、70%丙酮洗脱,获得了较显著纯化效果,纯度可达98%以上。张娣等[36]采用膜过滤法结合大孔树脂吸附法对莲房中PCs进行分离纯化。利用PAN超滤膜获得透过液,再经HZ-806大孔树脂纯化,得到PCs收率在85%以上,纯度达81%,是单独使用HZ-806树脂吸附法纯度的1.3倍。由于膜分离能耗低,大孔树脂反应条件温和,该方法工业化应用前景广阔。
表3 莲中原花青素的分离纯化方法
Table 3 The separation and purification methods of procyanidins in lotus
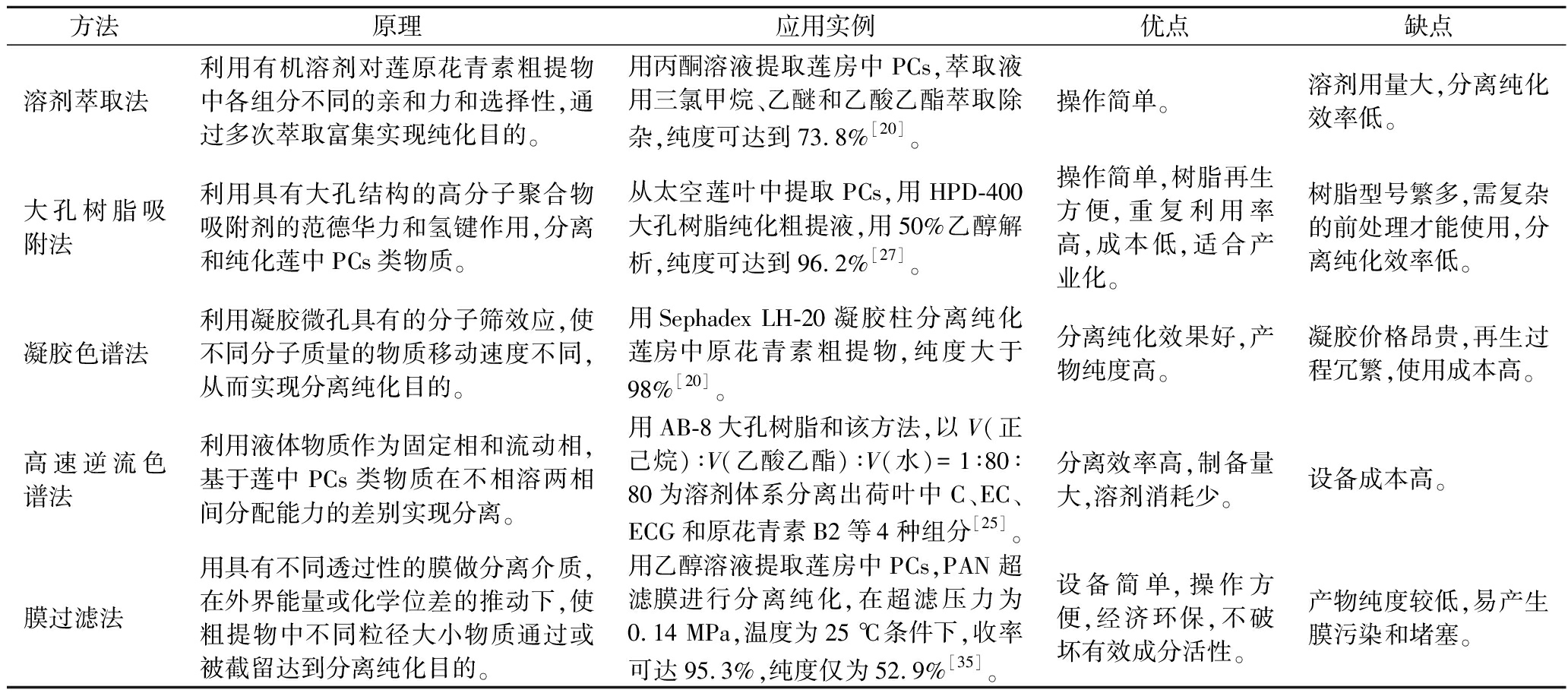
方法原理应用实例优点缺点溶剂萃取法利用有机溶剂对莲原花青素粗提物中各组分不同的亲和力和选择性,通过多次萃取富集实现纯化目的。用丙酮溶液提取莲房中PCs,萃取液用三氯甲烷、乙醚和乙酸乙酯萃取除杂,纯度可达到73.8%[20]。操作简单。溶剂用量大,分离纯化效率低。大孔树脂吸附法利用具有大孔结构的高分子聚合物吸附剂的范德华力和氢键作用,分离和纯化莲中PCs类物质。从太空莲叶中提取PCs,用HPD-400大孔树脂纯化粗提液,用50%乙醇解析,纯度可达到96.2%[27]。操作简单,树脂再生方便,重复利用率高,成本低,适合产业化。树脂型号繁多,需复杂的前处理才能使用,分离纯化效率低。凝胶色谱法利用凝胶微孔具有的分子筛效应,使不同分子质量的物质移动速度不同,从而实现分离纯化目的。用Sephadex LH-20凝胶柱分离纯化莲房中原花青素粗提物,纯度大于98%[20]。分离纯化效果好,产物纯度高。凝胶价格昂贵,再生过程冗繁,使用成本高。高速逆流色谱法利用液体物质作为固定相和流动相,基于莲中PCs类物质在不相溶两相间分配能力的差别实现分离。用AB-8大孔树脂和该方法,以V(正己烷)∶V(乙酸乙酯)∶V(水)=1∶80∶80为溶剂体系分离出荷叶中C、EC、ECG和原花青素B2等4种组分[25]。分离效率高,制备量大,溶剂消耗少。设备成本高。膜过滤法用具有不同透过性的膜做分离介质,在外界能量或化学位差的推动下,使粗提物中不同粒径大小物质通过或被截留达到分离纯化目的。用乙醇溶液提取莲房中PCs,PAN超滤膜进行分离纯化,在超滤压力为0.14 MPa,温度为25 ℃条件下,收率可达95.3%,纯度仅为52.9%[35]。设备简单,操作方便,经济环保,不破坏有效成分活性。产物纯度较低,易产生膜污染和堵塞。
3 莲中原花青素的检测分析
3.1 含量检测技术
目前对于莲中PCs含量的测定还没有统一的检测标准方法,分光光度法、HPLC等是常用的莲中PCs含量的测定技术,其中以分光光度法应用最为普遍,包括紫外可见分光光度法(ultraviolet-visible spectrophotometry, UV-Vis)和近红外分光光度法(near infrared spectrophotometry, NIR)。
UV-Vis法主要用于测定莲中PCs的总量,一般以香草醛为显色剂,利用原花青素A环上的间苯二酚或间苯三酚结构在强酸介质中与香草醛加合,生成有色的化合物,在500 nm下有最大吸收峰,且在一定浓度范围内,PCs浓度与吸光值之间存在良好的线性关系。通常以甲醇作为溶剂,以儿茶素作为标准品,酸介质一般采用硫酸或盐酸。该方法简单快速,但特异性不强,易受到样品中相同光谱特征的共存杂质成分的影响。CAO等[17]采用香草醛-硫酸法测定莲子壳和莲房中PCs的含量。取0.5 mL样液,分别加入2.5 mL的30 mg/mL香草醛溶液及30%硫酸溶液,室温避光反应20 min,测得莲子壳和莲房中PCs含量分别为44.40、91.50 mg/g干重。高亮等[25]采用香草醛-盐酸法测定荷叶中PCs含量,其最佳测定条件为:取1.0 mL样液,加入5 mL体积比1∶1混合的1%香草醛甲醇溶液与8%盐酸甲醇溶液,避光条件下,30 ℃水浴加热30 min后测定。在实际定量分析中,以1.0 mL不同浓度的儿茶素为标准品代替样液,测定吸光度值并绘制标准曲线,计算样品中PCs含量。香草醛-盐酸法测定PCs含量时单体和低聚体均参加反应,测得结果比真实值偏高,而香草醛-硫酸法中,在加入硫酸时产生很高的热量,会使PCs氧化发生分解,造成测定结果偏低。
NIR法利用PCs结构中的基团在近红外光谱区特定的吸收光谱,通过建立校正模型实现对样品的定量分析。该技术用于测定莲房中PCs含量,建模所需样品数量多,将莲房样品通过30目筛,以紫外-可见分光光度法为对照方法,通过二阶导数和Savitzky-Golay平滑滤波处理,选取7 500~6 900 cm-1波段,运用偏最小二乘法建立莲房中PCs含量与NIR法光谱之间的多元校正模型,实现对PCs含量的快速测定[37]。NIR法具有样品预处理简单,快速、无损的优点,但准确度不如经典分析方法,应用较少。
HPLC适用于极性强、不易挥发、热不稳定组分分析,根据PCs不同组分在固定相和流动相中吸附或分配系数的差异达到分离的目的。该方法可串联多种检测器,包括二极管阵列检测器(diode array detector, DAD)、紫外检测器(UV detector, UVD)、四极杆质谱检测器(MS)、三重四极杆质谱检测器(MS/MS)等,可用于莲中PCs单体组成及含量的检测[5,9,21],具有高效、精准等特点,是未来含量测定的理想方法,常采用C18色谱柱对PCs进行分离。童锡迪等[38]采用HPLC-DAD法测定莲子壳提取物中PCs含量,样品采用甲醇超声提取后,进行水解反应,用Diamonsil C18柱分离,以V(甲醇)∶V(水)∶V(甲酸)∶V(异丙醇)=13∶73∶8∶6为流动相洗脱分离,在525 nm下测定,该方法的线性范围为37.6~300.8 μg/mL,加标回收率为99.2%,相对标准偏差为0.30%,检出限和定量限分别可达16.6、50.5 μg/mL。由于PCs是一类性质极为相近的聚合物组成的混合物,受标准品的种类以及色谱分离能力的限制,HPLC只能分离PCs中十分有限的主要成分,很难对全部的PCs单体组成及含量进行测定。
3.2 结构分析技术
PCs的结构分析方法很多,包括电喷雾电离质谱(electrospray ionization mass spectrometry, ESI-MS),HPLC-三重四杆串联质谱(HPLC triple quadrupole tandem mass spectrometry, HPLC-MS/MS),HPLC-四极杆飞行时间质谱(HPLC quadrupole time-of-flight mass spectrometry, HPLC-QTOF-MS),傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR),核磁共振波谱(nuclear magnetic resonance spectroscopy, NMR)等方法[5,17-19,21,23-24],由于PCs结构组分复杂,需借助多种手段才能解析其结构。在PCs结构分析中,对已分离纯化的PCs可用MS的准分子离子、碎片离子和多种加合电荷离子等确定分子质量和分子式,利用FTIR确定特征官能团结构,利用NMR提供组成分子的碳氢骨架信息。LIU等[21]利用HPLC-DAD和HPLC-QTOF-MS分析莲房中PCs组分构成,鉴定出11种PCs成分,均以C、EC、GC、EGC为组成单元,分别为EC/C、EGC/GC、B2/B3异构体、B1/B4异构体、A1/A2、(EC/C)-O-(EGC/GC)、(B1/B4)-(EC/C)、(EGC/GC)-(EGC/GC)、(B2/B3)-(EGC/GC)异构体、(B2/B3)-(EC/C)异构体和(EGC/GC)-O-(EGC/GC)-O-(EGC/GC)。此外,余修亮[23]利用FTIR技术在4 000~500 cm-1波段对莲房和莲壳提取物中PCs结构进行分析,图谱显示,3 423.5 cm-1处有吸收,判断存在酚羟基,而1 616.2、1 447.5 cm-1处有吸收表明存在苯环骨架,此外,1 294.8、902.2 cm-1有吸收峰,表明有吡喃环构型。李绮丽等[39]采用大孔树脂AB-8和聚酰胺柱对红莲外皮中PCs粗提取物进行纯化,用IR、ESI-MS和HPLC-MS/MS进行成分分析,确认纯化物中含有9种PCs单体和低聚体,其中包括C、EC(m/z 289)、GC(m/z 305)3种单体,4种原花青定二聚体同分异构体(m/z 577)和2种原花青定四聚体同分异构体(m/z 1 153)。
表4总结了莲中PCs常用结构分析技术的原理及优缺点。在对PCs进行分结构分析时,应针对不同的目的选择恰当的分析方法。
表4 莲中PCs常用结构分析技术比较
Table 4 The comparison of commonly used structural analysis techniques of PCs in lotus

方法原理优点缺点液质联用法将HPLC对样品的高分离能力和质谱的高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来实现定性和结构分析。灵敏度高,选择性强,分析速度快。仪器较贵,操作要求高。红外光谱法根据PCs结构中的基团能够呈现特异的红外吸收光谱实现结构分析。样品状态不受限制,特征性强,不破坏样品,无需消耗实际,预处理过程简单。灵敏度和精度不高。核磁共振波谱法利用磁场作用检测分子中原子核性质及其与周围化学环境的相互作用而实现结构分析,主要包括1H-NMR和13C-NMR。不需要标准品,不破坏样品,可进行无损分析。仪器昂贵,普及性差。
4 莲原花青素在食品中的应用
4.1 抑制食品油脂氧化
油脂是食品中主要的化学成分之一,在贮藏过程中油脂容易发生氧化,不仅影响食物感官,降低营养价值,还会产生一些过氧化物、醛类、酮类等有毒有害物质导致人体衰老、癌症以及多种慢性疾病的发生。添加抗氧化剂是目前采取的抑制食品油脂氧化的主要手段。研究显示,莲原花青素可以很好地抑制脂肪氧合酶(lipoxygenase, LOX)的活性[40],当与金属离子螯合后,对LOX活性的抑制能力更高[41],从而有效抑制油脂的自动氧化,是一种优良的油脂天然抗氧化剂。李肖朋等[42]发现莲原花青素低聚体(lotus oligomeric proantho cyanidins, LSOPC)可以延缓菜籽油的氧化,在添加量为0.05%的条件下,其抗氧化效果与合成抗氧化剂二叔丁基羟基甲苯相当,但是LSOPC酚羟基较多脂溶性较差,在油脂体系中的应用一定程度上受到限制。石嘉怿等[43]对LSOPC进行硬脂酰氯改性修饰,并对其在油脂储藏及冷却肉保鲜中的应用进行了研究。结果表明,经过硬脂酰氯改性,LSOPC脂溶性得到提高,更容易分散于油脂体系中,抗油脂氧化能力显著增强,对冷却猪肉的保鲜效果更佳,但在一定程度上会造成冷却猪肉失色。李欣等[44]发现莲房原花青素(lotus seedpod procyanidins, LSPC)能够延缓冷鲜牛肉亮度值、红度值、氧合肌红蛋白含量的降低,抑制高铁肌红蛋白含量、酸价及硫代巴比妥酸值升高,显著改善冷鲜牛肉色泽,抑制脂肪氧化,且当含量为0.08%时,护色和抗脂肪氧化效果最佳。此外,向面包中添加少量莲原花青素,可以显著增加面包清除1,1-二苯基-2-三硝基苯肼自由基的能力,提高面包的抗氧化活性,延缓淀粉在体内的消化速率,但会在一定程度上降低面包的比容,增加面包的硬度,使面包的食用品质受到影响[45]。
4.2 控制食品中有害物质生成
亚硝酸盐(nitrite, NIT)是强致癌物N-亚硝胺前体,作为食品、尤其是腌制食品中人们高度关注的有害物质之一,控制其在食品中产生和含量是保证食品安全的重要环节。肖珍等[46]研究了LSPC对紫甘蓝泡菜中NIT的抑制作用。他们在模拟发酵条件下测定了LSPC对NIT的清除率和对亚硝胺合成的阻断率,发现LSPC对NIT清除率可达81.15%,对亚硝胺合成阻断率可达80.29%。在发酵液中添加0.01% LSPC后,泡菜中NIT含量降低45.5%,表明LSPC通过阻断亚硝胺合成,可显著降低泡菜中NIT含量,同时发现添加LSPC能提高泡菜的抗氧化能力,保持紫甘蓝泡菜中的还原糖和色泽,但会延长泡菜的发酵时间,降低泡菜的总酸含量。
食品在热加工过程中不可避免地发生Maillard反应,即非酶促条件下羰基化合物和氨基化合物之间发生反应生成棕色甚至黑色物质,它在赋予食品诱人的色泽与风味的同时,也产生了丙烯酰胺(acrylamide, AM)、晚期糖基化终末产物(advanced glycation end products, AGEs)等有毒有害物质。研究显示,LSOPC是AGEs天然抑制剂,在乳糖-赖氨酸体系中,LSOPC对AGEs生成具有抑制作用,而且受加热温度和时间影响显著,其抑制机理可能为消除自由基、抗氧化、封闭活性羰基[47]。LSPC也被证明在抗AM生成方面具有显著的效果。陈媛媛等[48]研究发现LSPC能有效抑制薯条、油条等油炸食品中AM的形成,当薯条和油条浸渍时间分别为90 s和60 s,LSPC添加量分别为0.5%(质量分数)和0.1%(质量分数)时,对AM的抑制率分别达到57.59%和67.38%,此时感官上与对照组并无显著差别。LSPC对AM的抑制可能是因为其抗氧化性,通过抑制AM形成过程中主要的前体物质N-葡基胺的转化,从而抑制AM的产生。而且LSPC对AM的抑制作用主要表现在抑制AM的形成过程,对生成后的AM并无抑制作用表现[49]。
4 总结与展望
经过多年的研究与探索,国内外关于莲中PCs的组分构成、提取分离、检测分析及在食品中应用等方面的研究取得了一定进展。从本文综述可见,莲中含有较丰富的PCs,以在莲房中含量最高,且以B型二聚体为主。在提取分离莲中PCs时,当前主要采用以乙醇溶液为提取剂的溶剂提取法和大孔树脂吸附法,通过将不同方法适当组合结合能够达到更理想的提取分离效果。在莲中PCs含量测定方法中,以香草醛-盐酸法和香草醛-硫酸法最为常用,但它们只能用于总量测定,无法有效测定PCs各单体含量,HPLC串联不同检测器可用于检测PCs不同单体含量,且具有高效、精准等特点,是未来理想的含量测定方法,在结构分析方法中,很难通过单一方法实现PCs结构解析,需借助液相色谱质谱联用、FTIR、NMR等多种方法才能解析得到可靠结果。此外,莲原花青素具有天然抗氧化活性功能,能有效抑制食品油脂氧化,并对食品中NIT、AM、AGEs等有害物质形成具有抑制作用,在食品安全控制中展现出良好的应用前景。然而,目前对莲中PCs的研究还存一些问题,主要表现在:莲中PCs种类多、结构复杂,不易于结构表征,空间构型研究还不充分,不同组分间的活性差异研究亟待深入;提取分离纯化工艺及含量测定研究尚不足,缺乏统一的技术标准;实际应用缺乏广度和深度,产品开发仍处于初级阶段;潜在的毒性危害仍然未知,需通过长时间的急性、慢性毒理学实验进行评价。针对上述问题,未来应进一步加强对莲中PCs提取分离工艺方面的研究,简化生产工艺并提升得率水平,形成科学标准的检测体系,探索并优化结构分析手段,明确莲中更多PCs的空间构型,并对莲原花青素进行系统开发和综合利用,拓展应用广度,提高应用深度,同时重视对莲中PCs的毒理学研究,加强安全性方面的评价,确保其在实际应用中的安全性。此外,莲中PCs含量有限,高原花青素的莲种质资源的发掘也具有重要的研究意义和价值。因此,未来对于莲中PCs的研究仍有大量的工作要做。
[1] 吴曼, 宗义湘, 赵帮宏, 等.中国水生蔬菜产业发展现状、存在问题及发展思路[J].长江蔬菜, 2019 (2):35-41.
WU M, ZONG Y X, ZHAO B H, et al.Development status, problems and development ideas of aquatic vegetables industry in China[J].Journal of Changjiang Vegetables, 2019(2):35-41.
[2] 刘正位, 郭丹丹, 彭静, 等.莲子产量相关性状的QTL定位[J].园艺学报, 2020, 47 (8):1 565-1 576.
LIU Z W, GUO D D, PENG J, et al.QTL mapping of six seed yield related traits in lotus[J].Acta Horticulturae Sinica, 2020, 47 (8):1 565-1 576.
[3] 黄秀琼, 卿志星, 曾建国.莲不同部位化学成分及药理作用研究进展[J].中草药, 2019, 50(24):255-273.
HUANG X Q, QING Z X, ZENG J G.Research advances on chemical constituents and pharmacological effects of various parts of Nelumbo nucifera[J].Chinese Traditional and Herbal Drugs, 2019, 50(24):255-273.
[4] ZAIDI A, SRIVASTAVA A K, AHMAD S.Nutritionaland therapeutic importance of Nelumbo nucifera (sacred lotus)[J].Era′s Journal of Medical Research, 2019, 6(2):98-102.
[5] LI T, LI Q L, WU W G, et al.Lotus seed skin proanthocyanidin extract exhibits potent antioxidant property via activation of the Nrf2-ARE pathway[J].Acta Biochimica et Biophysica Sinica, 2018, 51(1):31-40.
[6] CAO J L, YU X L, DENG Z Y, et al.Chemical compositions, antiobesity and antioxidant effects of proanthocyanidins from lotus seed epicarp and lotus seed pot[J].Journal of Agricultural and Food Chemistry, 2018, 66(51):13 492-13 502.
[7] 陈超群, 吴春艳, 刘霞, 等.莲房中原花青素的药理作用研究进展[J].中成药, 2014, 36(8):1 734-1 738.
CHEN C Q, WU C Y, LIU X, et al.Research progress on pharmacological action of proanthocyanidins in lotus seedpod[J].Chinese Traditional Patent Medicine, 2014, 36(8):1 734-1 738.
[8] 王满生, 王发祥, 杨晶, 等.莲房原花青素提取方法、生理功能及其在食品工业中应用的研究进展[J].食品工业科技, 2021, 42(5):349-356.
WANG M S, WANG F X, YANG J, et al.Research progress in extraction physiological function of lotus seed pod procyanidins and their application in food industry[J].Science and Technology of Food Industry, 2021, 42(5):349-356.
[9] PEI H T, SU W Y, GUI M, et al.Comparative analysis of chemical constituents in different parts of lotus by UPLC and QToF-MS[J].Molecules, 2021, 26(7):1 855.
[10] ZENG Y X, WANG S, WEI L, et al.Proanthocyanidins:Components, pharmacokinetics and biomedical properties[J].The American Journal of Chinese Medicine, 2020, 48(4):813-869.
[11] 谢倩, 汪婷, 李佳楠.几种常见品种葡萄籽及葡萄皮中原花青素含量测定[J].科教导刊, 2017(34):170-171.
XIE Q, WANG T, LI J N.Determination of PCs content in grape seeds and skins of several common varieties[J].The Guide of Science & Education, 2017(34):170-171.
[12] 裴云逸, 陆星星, 武翠芳, 等.花生衣中原花青素及多酚物质含量分析研究[J].食品研究与开发, 2017, 38(17):143-147.
PEI Y Y, LU X X, WU C F, et al.Analysis of proanthocyanidins and polyphenols in peanut skins[J].Food Research and Development, 2017, 38(17):143-147.
[13] 任佳琦, 李福香, 雷琳, 等.原花青素与果胶相互作用对果蔬加工特性的影响[J].食品与发酵工业, 2019, 45(12):83-88.
REN J Q, LI F X, LEI L, et al.Effects of interactions between procyanidins and pectins on processing properties of fruits and vegetables:A review[J].Food and Fermentation Industries, 2019, 45(12):83-88.
[14] QI Y J, ZHANG H, AWIKA J M, et al.Depolymerization of Sorghum procyanidin polymers into oligomers using HCl and epicatechin:Reaction kinetics and optimization[J].Journal of Cereal Science, 2016, 70:170-176.
[15] 袁宙新, 刘忠达, 孙晓勇, 等.产地及采收期对莲房中原花青素量的影响[J].中草药, 2015, 46(4):576-579.
YUAN Z X, LIU Z D, SUN X Y, et al.Influence of Nelumbinis Receptaculum from different regions and picking times on content of proanthocyanidins[J].Chinese Traditional and Herbal Drugs, 2015, 46(4):576-579.
[16] 凌智群. 莲房原花青素及其生物、药理活性研究[D].武汉:华中农业大学, 2001.
LING Z Q.Study on procyanidins and its biological, pharmacological activities form the seedpod of Nelumbo nucifera Gaertn[D].Wuhan:Huazhong Agricultural University, 2001.
[17] CAO J L, YU X L, DENG Z Y, et al.Chemical compositions, antiobesity, and antioxidant effects of proanthocyanidins from lotus seed epicarp and lotus seed pot[J].Journal of Agricultural and Food Chemistry, 2018, 66(51):13 492-13 502.
[18] XIAO J S, XIE B J, CAO Y P, et al.Characterization of oligomeric procyanidins and identification of quercetin glucuronide from lotus (Nelumbo nucifera Gaertn.) seedpod[J].Journal of Agricultural and Food Chemistry, 2012, 60(11):2 825-2 829.
[19] QIN Y, SUN Y, LI J Q, et al.Characterization and antioxidant activities of procyanidins from lotus seedpod, mangosteen pericarp, and Camellia flower[J].International Journal of Food Properties, 2017, 20(7):1 621-1 632.
[20] 谢汝朋. 莲子采后保鲜过程中酚酸的变化及莲房原花青素的研究[D].南昌:南昌大学, 2013.
XIE R P.Change of phenolic acids in post-harvested lotus seeds during fresh-keeping and research of proanthocyanidins from lotus seedpod[D].Nanchang:Nanchang University, 2013.
[21] LIU X R, XIE R P, FAN Y W, et al.Polymerization of proanthocyanidins catalyzed by polyphenol oxidase from lotus seedpod[J].European Food Research and Technology, 2014, 238(5):727-739.
[22] 李绮丽. 莲子皮低聚原花青素分级分离、组分鉴定与抗氧化机理研究[D].长沙:湖南农业大学, 2013.
LI Q L.Studies on isolation, identification and antioxidant activity of oligomeric proanthocyanidins from lotus seed peel[D].Changsha:Hunan Agricultural University, 2013.
[23] 余修亮. 莲副产物中原花青素的结构、抗氧化活性及降脂作用的研究[D].南昌:南昌大学, 2017.
YU X L.The procyanidin structure, antioxidant activity and lipid-lowering effect of lotus by- product[D].Nanchang:Nanchang University, 2017.
[24] 钟照恬. 莲藕多酚和多糖的纯化鉴定及其复合脂质体制备[D].武汉:武汉轻工大学, 2018.
ZHONG Z T.Isolating and charactering polyphenols and polysaccharides from lotus root for the preparation of blended liposomes[D].Wuhan:Wuhan Polytechnic University, 2018.
[25] 高亮, 蔡为荣, 张孟雪, 等.HSCCC分离荷叶原花青素及其抗氧化活性研究[J].安徽工程大学学报, 2019, 34(4):1-7.
GAO L, CAI W R, ZHANG M X, et al.Separation of proanthocyanidins from lotus leaf by HSCCC and its antioxidative activity[J].Journal of Anhui Polytechnic University, 2019, 34(4):1-7.
[26] ASKAR K A, ALSAWAD Z H, KHALAF M N.Evaluation of the pH and thermal stabilities of rosella anthocyanin extracts under solar light[J].Beni-Suef University Journal of Basic and Applied Sciences, 2015, 4(3):262-268.
[27] 唐伯辰. 太空莲叶中荷叶碱、原花青素提取及分离[D].南昌:东华理工大学, 2013.
TANG B C.The technology for the separation and extraction of nuciferine and proanthocyanidins in space lotus leaves[D].Nanchang:East China Institute of Technology, 2013.
[28] 王建美, 高红, 徐巧娜, 等.酶辅助闪式法提取莲蓬中原花青素的工艺研究[J].中国医药导报, 2018, 15(25):25-28.
WANG J M, GAO H, XU Q N, et al.Study on the technology of enzyme -assisted homogenate extraction method for the extraction of procyanidins from seedpod of lotus[J].China Medical Herald, 2018, 15(25):25-28.
[29] 黄爱妮, 李丽, 文卓琼, 等.双酶辅助提取莲房原花青素的工艺及其抗氧化性研究[J].粮食与油脂, 2020, 33(10):104-108.
HUANG A N, LI L, WEN Z Q, et al.Study on the extraction of procyanidins from receptaculum nelumbinis by double enzymes and antioxidant properties[J].Cereals & Oils, 2020, 33(10):104-108.
[30] 禹华娟, 孙智达, 谢笔钧.酶辅助提取莲房原花青素工艺及其抗氧化活性研究[J].天然产物研究与开发, 2010, 22(1):154-158.
YU H J, SUN Z D, XIE B J.Enzyme assistant extraction of procyanidins from seedpod of lotus and the comparison of antioxidant activity[J].Natural Product Research and Development, 2010, 22(1):154-158.
[31] 余修亮, 朱志平, 李佳桥, 等.莲子壳原花青素超声提取工艺优化及其抗氧化活性[J].中国食品学报, 2018, 18(12):99-109.
YU X L, ZHU Z P, LI J Q, et al.Optimization of the extraction process of proanthocyanidins from lotus (Nelumbo nucifera Gaertn.) seed epicarp and their antioxidant activities[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):99-109.
[32] 黄爱妮, 余萃, 赵昕, 等.莲房原花青素的超声波辅助提取及其稳定性研究[J].食品研究与开发, 2021, 42(7):114-119.
HUANG A N, YU C, ZHAO X, et al.Study on ultrasonic assisted extraction and stability of procyanidins from lotus seed pot[J].Food Research and Development, 2021, 42(7):114-119.
[33] 段玉清, 闫永胜, 张海晖, 等.莲房多酚的微波辅助提取技术[J].江苏大学学报(自然科学版), 2009, 30(5):437-440.
DUAN Y Q, YAN Y S, ZHANG H H, et al.Microwave-assisted extraction technology for extracting polyphenols from lotus seedpod[J].Journal of Jiangsu University (Natural Science Edition), 2009, 30(5):437-440.
[34] 段玉清, 张海晖, 李金凤, 等.脉冲超声辅助提取莲房多酚的工艺[J].农业工程学报, 2009, 25(S1):193-197.
DUAN Y Q, ZHANG H H, LI J F, et al.Technology for extracting polyphenols from lotus seedpod by pulsed ultrasonic assisted method[J].Transactions of the Chinese Society of Agricultural Engineering, 2009, 25(S1):193-197.
[35] 冯彬彬. 莲房原花青素提纯分离工艺条件及优化研究[D].郑州:郑州大学, 2014.
FENG B B.Study on the conditions and optimization of separation technology of procyanidins from lotus seed pot[D].Zhengzhou:Zhenzhou University, 2014.
[36] 张娣, 刘浩东, 张慧, 等.PAN膜-大孔树脂分离纯化莲房原花青素[J].化学工程与装备, 2017(8):4-6.
ZHANG D, LIU H D, ZHANG H, et al.Separation and purification of proanthocyanidins from lotus seedpod by PAN membrane-macroporous resin[J].Chemical Engineering & Equipment, 2017(8):4-6.
[37] 周芸, 张晓玲, 吴永江, 等.近红外漫反射光谱法快速测定莲房原花青素及多酚含量[J].中国药学杂志, 2013, 48(3):220-224.
ZHOU Y, ZHANG X L, WU Y J, et al.Determination of proanthocyanidins and total phenolics in the seedpod of Nelumbo nucifera Gaertn by near infrared diffuse reflectance spectroscopy[J].Chinese Pharmaceutical Journal, 2013, 48(3):220-224.
[38] 童锡迪, 彭红, 王琼, 等.HPLC法测定莲子壳提取物中原花青素的含量[J].食品科学, 2015, 36(2):145-148.
TONG X D, PENG H, WANG Q, et al.Determination of proanthocyanidins in lotus seed shell extract by HPLC[J].Food Science, 2015, 36(2):145-148.
[39] 李绮丽, 彭芳刚, 刘德明, 等.红莲外皮原花青素的纯化与分析[J].食品科学, 2014, 35(3):106-110.
LI Q L,PENG F G, LIU D M, et al.Purification and analysis of proanthocyanidins from red peel of lotus seeds[J].Food Science, 2014, 35(3):106-110.
[40] 禹华娟, 孙智达, 谢笔钧.莲原花青素在油脂体系中的抗氧化作用[J].中国农业科学, 2010, 43(10):2 132-2 140.
YU H J, SUN Z D, XIE B J.Antioxidation role of procyanidins from lotus seedpod in oils[J].Scientia Agricultura Sinica, 2010, 43(10):2 132-2 140.
[41] 李琴, 周梦舟, 汪超, 等.莲原花青素与金属离子相互作用对抗氧化的影响[J].中国食品学报, 2019, 19(2):37-46.
LI Q, ZHOU M Z, WANG C, et al.Effects of interaction between proanthocynidins and metal ions on antioxidation[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(2):37-46.
[42] 李肖朋, 隋勇, 关亚飞, 等.莲原花青素低聚体对菜籽油抗氧化性的影响[J].华中农业大学学报, 2015, 34(1):115-122.
LI X P, SUI Y, GUAN Y F, et al.Oligomeric procyanidins from lotus seedpod protecting the characters of rapeseed oil and its changes during oxidation[J].Journal of Huazhong Agricultural University, 2015, 34(1):115-122.
[43] 石嘉怿, 邓乾春, 张亚楠, 等.硬脂酰氯改性莲原花青素低聚体的稳定性与抗氧化作用研究[J].中国油脂, 2020, 45(12):60-65.
SHI J Y, DENG Q C, ZHANG Y N, et al.Stability and antioxidant effect of stearyl chloride modified procyanidins oligomers from lotus seedpod[J].China Oils and Fats, 2020, 45(12):60-65.
[44] 李欣, 段秋虹, 张晶晶, 等.莲房原花青素对冷鲜牛肉脂肪氧化及色泽的影响[J].黑龙江畜牧兽医, 2020(1):67-71.
LI X, DUAN Q H, ZHANG J J, et al.Effects of proanthocyanidins from lotus seedpod on fat oxidation and color of chilled beef[J].Heilongjiang Animal Science and Veterinary Medicine, 2020(1):67-71.
[45] 郑妍, 张馨匀, 隋勇.莲原花青素对面包品质及功能特性的影响[J].食品科学, 2020, 41(8):62-68.
ZHENG Y, ZHANG X Y, SUI Y.Effect of lotus seedpod procyanidins on bread quality and functional properties[J].Food Science, 2020, 41(8):62-68.
[46] 肖珍, 谢笔钧, 孙智达.莲房原花青素对紫甘蓝泡菜亚硝酸盐的抑制作用[J].食品工业科技, 2018, 39(11):67-73;79.
XIAO Z, XIE B J, SUN Z D.Inhibitory effect of LSPC on nitrite in pickled cabbage[J].Science and Technology of Food Industry, 2018, 39(11):67-73;79.
[47] WU Q, LI S Y, YANG T, et al.Inhibitory effect of lotus seedpod oligomeric procyanidins on advanced glycation end product formation in a lactose- lysine model system[J].Electronic Journal of Biotechnology, 2015, 18(2):68-76.
[48] 陈媛媛, 丁城, 关亚飞, 等.原花青素对食品中丙烯酰胺的抑制作用研究[J].食品科技, 2017, 42(8):257-261.
CHEN Y Y, DING C, GUAN Y F, et al.Effect of the procyanidins on acrylamide inhibition in food[J].Food Science and Technology, 2017, 42(8):257-261.
[49] 周梦舟, 丁城, 关亚飞, 等.原花青素抑制丙烯酰胺的动力学[J].食品科学, 2018, 39(3):123-128.
ZHOU M Z, DING C, GUAN Y F, et al.Inhibitory kinetics of acrylamide by procyanidins[J].Food Science, 2018, 39(3):123-128.