食品安全关系到每个人的发展和生存,早期快速的检测食源性致病菌可避免病原微生物感染所引起的爆发性食源性疾病[1]。现有的培养鉴定法、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)及聚合酶链式反应等检测方法需要专业人士及设备,既昂贵又费时。因此,急需寻求一种简单、快速及高灵敏度的病原微生物检测方法[2]。
微流控芯片提供了一种经济省时的检测方式,可在极低浓度对食源性致病菌进行快速检测[3]。微流控是一种在微米级尺度下进行样品输送、反应及检测的一种技术,具有检测速度快、灵敏度高、高通量、集成度及自动化高的优点[4-5]。目前,微流控检测芯片按照检测原理主要分为基于分子生物学的微流控检测芯片、基于电化学的微流控检测芯片及基于免疫学的微流控检测芯片3大类。其中,基于免疫学的微流控检测芯片以抗原抗体特异性结合为基础原理,具有检测条件宽松、灵敏度高及速度快的特点。免疫微流控检测芯片结合比色法避免了使用外部设备,可对食源性致病菌[6]、疾病标志物[7]、毒素[8]及激素[9]等多种生物分子进行检测,已广泛应用于食品检测、环境保护及临床诊断等领域[10]。
本课题组致力于将免疫检测技术集成于微流控芯片上进行食源性致病菌的快速检测,已开发出可检测大肠杆菌及鲍氏志贺氏菌的免疫微流控检测芯片并在进行后续优化。研究表明,芯片基底均需不同程度的表面改性处理才可固定抗体用于免疫分析。如聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)的微通道需进行超声清洗及等离子氧化等处理以减少非特异性吸附,避免出现假阳性;纸基衬底由于其多孔亲水等特性,可通过干燥固定免疫分析所用试剂,但当通过表面修饰偶联抗体时才能对食源性致病菌有较好的捕获效率。其次,基底的光学性能及生物相容性等对芯片的应用场景有着基础性影响,同时决定着芯片的成本、加工及组装工艺。基于此,本文综述了近年来免疫微流控检测芯片在病原微生物即时检测中的研究进展,主要集中在硅基免疫微流控检测芯片、高分子聚合物免疫微流控检测芯片及纸基免疫微流控检测芯片3部分。最后,讨论了免疫微流控检测芯片目前面临的挑战和发展机遇。
1 硅基免疫微流控检测芯片
硅基免疫微流控检测芯片是以免疫学检测为基础,以硅片、玻璃或石英等为基础制备的免疫微流控检测芯片。20世纪90年代,MANZ等[11]以硅片为基底首次制备出微流控芯片。由于微流控技术源于微机电技术,成熟的微细加工技术使硅成为早期免疫微流控检测芯片的常用基底。
硅基片具有良好的生物相容性、化学惰性、导热性和热稳定性[12],对其表面改性可用于固定抗体进行免疫检测[13]。KIM等[14]开发了一种用于检测沙门氏菌的硅基免疫微流控检测芯片(图1-A)。该微流控检测芯片含有1个蛇形通道(400 μm×50 μm,长×宽),1个检测区、3个进样孔及1个出样孔。结合沙门氏菌抗体的量子点预装在一个进样孔,磁球与样品的混合溶液装入另一进样孔。两种溶液在负压下进入蛇形槽中混合和孵育,改性后的硅表面可配合固定抗体微球复合物不被轻易冲走,从而进行病原微生物的富集与分离。最后,形成的复合物在永磁体的作用下进入检测区进行荧光信号检测。该芯片对10份样品进行了特异性检测,灵敏度达到103 CFU/mL。LI等[15]开发了一种用于检测金黄色葡萄球菌的硅基免疫微流控检测芯片(图1-B)。硅基片在银辅助化学刻蚀下形成了3D纳米线基板,经表面化学修饰后用于检测病原微生物(图1-C)。相对于扁平化修饰的硅基片,三维立体硅基板经表面修饰后对金黄色葡萄球菌的捕获率增大了10倍,未修饰的硅基片几乎没有非特异性吸附。研究人员在使用3种不同的培养基进行金黄色葡萄球菌的检测时,捕获率均在90%左右,灵敏度达到10 CFU/mL。

A-沙门氏菌硅基微流控检测芯片[14];B-金黄色葡萄球菌硅基免疫微流控检测芯片制备原理[15]; C-金黄色葡萄球菌硅基免疫微流控芯片制备及检测原理[15]
图1 硅基免疫免疫微流检测芯片
Fig.1 Silicon-based immunoimmunity microfluidic detection chip
除表面改性外,硅也可通过加工形成多孔状态(即多孔硅)来提高病原微生物的捕获率。这是因为多孔硅具有更高的比表面积来固定抗体进行免疫检测[16]。然而,多孔硅具有易碎、不透明、弹性模量高(130~180 GPa)及昂贵等缺点。高弹性模量使其难以开发微阀等微器件,不透明性则导致其难以进行可视化结果输出,这导致其较少用于免疫微流控检测芯片的开发应用中。
与硅基片相比,玻璃更便宜且拥有不错的光学透明性。在加工方面,玻璃可通过蚀刻和光刻工艺形成微通道。组装时,玻璃芯片常通过热键合贴合密封通道。但热键合容易造成玻璃微通道的变形,使得该组装方式下的玻璃免疫微流控检测芯片成品率较低[17]。因此,有研究人员将玻璃与聚合物贴合组装免疫微流控检测芯片。例如,ABDULLAH等[18]开发了一种玻璃基免疫微流控芯片,用于大肠杆菌及沙门氏菌的快速检测(图2-A)。该芯片通过湿法刻蚀等微加工工艺在玻璃基底上制备出微通道、富集区,检测区及4个进出样口。通过弹性聚合物聚二甲基硅氧烷(polydimethylsiloxane,PDMS)密封通道不会损坏微通道,也不会对后续的抗体固定化及免疫分析造成影响(图2-B)。捕获抗体事先通过共价结合在修饰后的玻璃表面,检测抗体通过非特异性吸附固定在检测电极上。检测时,先注入检测抗体将其固定。洗涤后,通入含有病原菌的样品溶液并调节电极参数富集病原菌。最后,芯片内斜向下的电极将富集的病原菌推向检测区。检测区电极上检测抗体与病原菌结合,通过检测电极的阻抗变化来确定样品中的病原菌含量,大肠杆菌和沙门氏菌的检测限分别达到了10、13 cell/mL。
此外,玻璃也可用于开发数字免疫微流控检测芯片。玻璃数字免疫微流控检测芯片以液滴为对象,在玻璃基底上形成图案并固定电极,通过电极上适宜的电位序列精确操控液滴,完成混合、分离及反应等实验操作[19]。与通道型免疫微流控芯片相比,数字免疫微流控芯片能够保证磁球等微固体流动时不发生堵塞通道的风险。COUDRON等[20]研制的数字免疫微流控系统集抗体固定、抗原检测、磁分离及信号输出等操作于一体,实现了病原微生物的全自动化免疫检测(图2-C)。运行时依次将捕获抗体包被的磁珠、抗原及检测抗体通入芯片,并使用通用平行板配置运行。该平行板可将1.5~3 μL的液滴夹在传动板和导电接地盖板的疏水表面之间,从而完成磁珠的提取、再悬浮及混合等操作。与基于流动的微流体相比,该芯片可在没有高剪应力的情况下快速改变磁珠浓度以完成抗原的富集和检测。化学发光输出检测结果,发光强度取决于抗原捕获量。为验证其性能,该芯片以大肠杆菌、芽孢杆菌及噬菌体病毒为靶标进行了全自动检测,检测限分别为2×107 CFU/mL、4×104 CFU/mL及106 PFU/mL。该芯片采用全自动化磁分离,将检测时间缩短至6~10 min,解决了传统免疫学检测的的劳动密集型缺点。目前,玻璃基数字免疫微流控检测芯片已广泛应用于免疫分析及细胞研究等领域[21]。
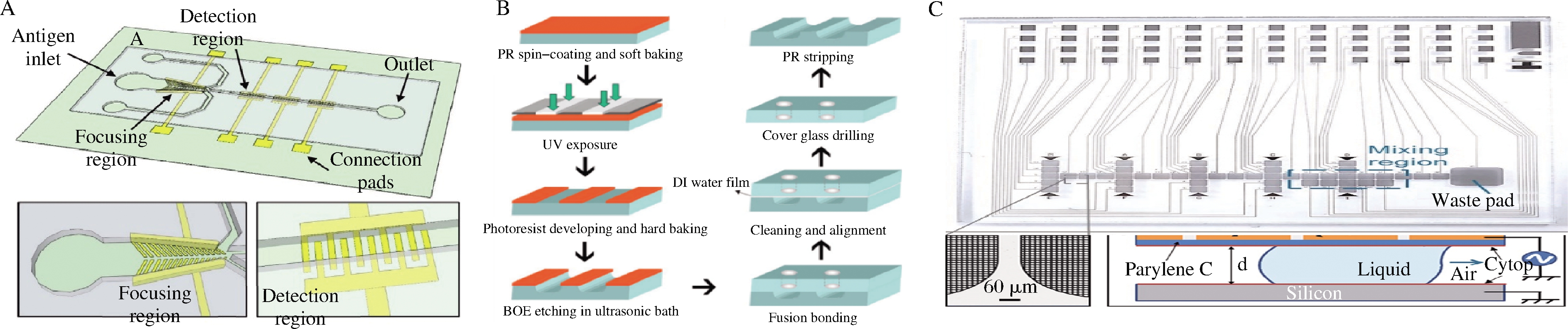
A-玻璃免疫微流控检测芯片[18];B-湿法刻蚀和熔融黏合制造微芯片[18];C-数字微流控芯片设计概览及运行中的数字微流控芯片[20]
图2 硅基免疫微流控检测芯片
Fig.2 Silicon-based immunomicrofluidic detection chip
除硅片和玻璃免疫微流控外,石英基免疫微流控检测芯片也被开发出来用于食源性致病菌的快速检测。石英同样具有良好的化学惰性、生物相容性及耐有机溶剂等优点,且拥有最优秀的光学特性[22]。然而,石英需经过复杂的表面处理才可用于固定抗体。此外,石英免疫微流控检测芯片的加工工艺复杂,费用昂贵。这导致石英大多用于单分子检测等特殊检测领域,较少的用于食源性致病菌检测。
综上所述,硅基免疫微流控检测芯片具有加工精度及检测灵敏度较高的特点,但复杂的加工工艺及高成本导致硅基免疫微流控检测芯片多用于实验室科研[23]。虽然硅基底可与聚合物结合用于制备微泵、微阀等微器件以适应免疫微流控检测芯片高集成的要求,但这却削弱了玻璃和石英良好的光学性能等优势[24]。
2 聚合物免疫微流控检测芯片
聚合物免疫微流控检测芯片指的是以高分子聚合物为基底,以免疫学检测为基础开发的微流控检测芯片[25]。聚合物免疫微流控检测芯片具有价格低、品类多、弹性优良、生物相容性及光学透明性好等优点[26],是硅基免疫微流控检测芯片的替代品。常见的聚合物免疫微流控检测芯片主要有PDMS、PMMA、聚碳酸酯(polycarbonate,PC)及聚苯乙烯(polystyrene,PS)免疫微流控检测芯片。其中,PDMS可跟PDMS、玻璃、石英或其他聚合物通过键合等方式结合在一起制备免疫微流控芯片,具有加工简便、成本低和可大规模制备等特点。EFFENHAUSER等[27]于20世纪90年代末首次开发出PDMS微流控芯片,软光刻技术的出现则推动了PDMS免疫微流控检测芯片的快速发展,是目前应用最为广泛的聚合物免疫微流控检测芯片之一[28]。
值得注意的是,PDMS的弹性模量低(300~500 kPa),可用于制造微泵、微阀、微混合器及微检测器等微器件[29]。CAI等[30]开发了一种一次性视觉免疫微流控检测芯片,采用免疫磁分离、酶催化和距离指示技术检测食源性致病菌(图3-A)。该微流控检测芯片主体为PDMS,含有1个动力驱动孔、3个进出样孔、2个储液室、微混合区及距离指示通道。芯片内微混合器固定有抗体修饰的磁球,用于富集样品中的鼠伤寒沙门氏菌。富集后的复合物与抗体和过氧化氢酶共同修饰的聚苯乙烯微球偶联,形成免疫磁球-细菌-聚苯乙烯酶夹心复合物。复合物上的过氧化氢酶通过微型混合器后催化过氧化氢分解生成氧气,产生的氧气增加了芯片中的压力,并推动指示红色染料溶液沿着通道向未密封的出口移动,通过移动距离反映样品中鼠伤寒沙门氏菌的数量。该免疫微流控芯片内制备的微混合器通过富集病原微生物使其检测灵敏度达到了150 CFU/mL,基于视觉输出检测结果而不需要外部设备。
然而,PDMS等表面疏水的聚合物易导致疏水分子的非特异性吸附和渗透,影响检测结果的可靠性。因此,研究人员通过聚合物表面改性或使用聚合物微球来固定抗体以适应免疫微流控检测芯片的开发。
ALTINTAS等[31]设计并制造了一种用于大肠杆菌全自动检测的免疫微流控检测芯片,研究了聚合物表面改性后修饰纳米颗粒对抗体固定的影响(图3-C)。一方面,芯片基底经表面改性后直接固定抗体,采用抗体-细菌-抗体的标准夹心法检测大肠杆菌。另一方面,芯片基底表面改性后引入纳米颗粒固定抗体。辣根过氧化物酶(horseradish peroxidase, HRP)标记另一抗体作为检测抗体,在细菌被捕获后形成固定化的纳米颗粒抗体-细菌-酶标抗体夹心体,HRP催化3,3′,5,5′-四甲基联苯胺(tetramethylbenzidine,TMB)产生氧化还原信号输出。结果表明,引入纳米颗粒后的微流控免疫检测芯片对大肠杆菌的检出限为50 CFU/mL,与未引入纳米颗粒的标准夹心法相比,灵敏度提高了近400倍。王岭[32]开发了一种PS免疫微流控检测芯片,用于玉米萎蔫病菌的快速检测(图3-D)。该芯片通过热压键合黏合基板,中间夹层的PS薄膜微阀可控制流体进出。检测时样品被干燥在芯片内部,通过微阀依次泵入HRP标记的抗体及洗液,最后加入显色底物显色完成检测。该芯片在程序软件及PS薄膜微阀的配合下实现了致病菌的全自动免疫检测。该芯片与传统ELISA法的检测灵敏度相当,但试剂消耗量减少了25倍,时间降低了10倍。CHOI等[33]开发了一种自动化快速检测疟原虫的免疫微流控芯片(图3-E)。该芯片的PC薄膜基底经表面改性后用于捕获抗体的固定化,荧光标记的检测抗体则被喷射在反应室中。样品中的目标抗原注入芯片后首先与检测抗体结合,之后流向检测室与捕获抗体结合形成抗体-抗原-荧光标记抗体复合物,通过荧光信号输出检测结果。通过改性后的PC薄膜固定抗体使其灵敏度达到了50 ng/mL,高于商用试剂盒的灵敏度(200 ng/mL)。虽然聚合物免疫微流控检测芯片经表面处理或集成微器件提高了检测灵敏度,降低了检测时间,但离不开复杂的加工及组装设备。同时,在抗体固定化方面前处理步骤过多,或许纸基免疫微流控检测芯片能更好的处理该问题[34]。

A-视觉免疫微流控检测芯片实物图及其概念图[30];B-视觉免疫微流控芯片检测原理[30];C-免疫微流控芯片设计图及其检测原理[31]; D-PS免疫微流控芯片结构图[32];E-PC薄膜免疫微流控芯片结构图及检测流程[33]
图3 聚合物免疫微流控检测芯片
Fig.3 Polymer immunomicrofluidic detection chip
3 纸基免疫微流控检测芯片
纸基免疫微流控芯片又称“纸芯片”,是一种利用纸(如滤纸和硝酸纤维素膜等)替代传统的硅基底或聚合物基底进行免疫检测的微流控芯片。纸是由纤维素组成的高度多孔基质,与硅、玻璃、石英及高分子聚合物等微流控检测芯片基底相比具有以下优点:(1)原料丰富,成本低;(2)环保无害,可通过焚烧、生物降解等方式处理;(3)使用灵活,纸的多孔性结构允许进行流体的流动、过滤及分离等操作;(4)良好的亲水性;(5)可一次性使用和大规模生产[35-37]。因此,纸基免疫微流控检测芯片已广泛应用于食品安全、环境检测及临床诊断等领域。
在加工工艺方面,纸基免疫微流控检测芯片可通过喷墨印刷、柔性版印刷及蜡印刷等印刷技术或光刻、冲压、剪切和压印等其他加工技术来制备[38]。其中,蜡网印刷是纸基免疫微流控芯片制应用较为普遍的一种加工方式。蜡印可在纸基表面建造疏水屏障和亲水通道,具有制备简便、成本低且无需密封通道的特点[39]。由于亲水通道和疏水屏障的毛细效应,纸基免疫微流控检测芯片在进行免疫分析时无需外部设备,实现了免疫检测的低成本和便携性。纸的高比表面积微孔结构和易于表面改性等优势使其可用于抗体固定、抗原抗体的孵育结合及化学发光反应等实验,更有利于制备免疫微流控检测芯片[40]。
一般情况下,纸基免疫微流控检测芯片由一层纸制成,仅限于二维通道网络。当将两层或多层纸基底叠加在一起时,会产生基于纸衬底的三维纸基免疫微流控检测芯片,允许流体在三维空间进行流动。由于纸张很薄,将多张纸堆叠在一起可增加通道密度,而不会改变设备大小。这使得三维纸基免疫微流控检测芯片能够在更短的时间内完成更复杂的流体处理。如图4所示,

A-三维纸基芯片制备原理[41];B-三维纸基芯片检测沙门氏菌原理图(a-纸芯片检测原理,b-纸芯片折叠原理)[41]; C-纸基免疫微流控芯片结合智能手机检测病原菌(a-入射光角度,b-检测光角度)[41];D-纸基免疫微流控芯片结合旋转框架结构图及实物图[41]
图4 纸基免疫微流控检测芯片
Fig.4 Paper-based immunomicrofluidic detection chip
CHEN等[41]开发了一种三维折纸免疫微流控检测芯片(图4-A)。该芯片通过蜡印制备疏水区域,分别通过表面干燥和表面改性固定免疫分析所用试剂。折叠滑动芯片可使分析物在各纸层间进行垂直扩散,轻松执行免疫分析所需步骤,极大的提高了检测效率。在实际应用性能方面,该芯片成功检测到样品中的金黄色葡萄球菌。在以人免疫蛋白作为模型对三维折纸免疫微流控检测芯片进行优化后,检测时间最短缩短至7 min,检测限达到了0.01 ng/mL。相比传统的ELISA、荧光免疫检测、免疫荧光法及斑点ELISA等免疫检测方式,上述三维折纸免疫微流控检测芯片的检测效率更高,在食源性致病菌的快速检测上具有极大的应用潜力。
比色法作为一种简单的检测策略,常与纸基免疫微流控检测芯片结合使用,降低了纸基免疫微流控检测芯片的成本并提高了其便携性[42]。然而,传统的比色法仅能进行定性分析,低灵敏度和高检测限制了纸基免疫微流控检测芯片的更大规模应用。因此,有研究人员通过改变纸基免疫微流控芯片的信号输出模式来定量检测病原微生物。例如,PARK等[43]开发了一种与智能手机相结合检测沙门氏菌的纸基免疫微流体检测芯片(图4-C)。纸基底经光刻蚀刻形成微通道,在通道内预装抗鼠伤寒沙门氏菌的抗体标记的微粒形成检测区。检测时将纸质微流控装置浸入含有鼠伤寒沙门氏菌的溶液中,预装在芯片内的抗体微粒与菌结合形成微粒-细菌复合物。检测区的光散射强度与样品中病原微生物数量呈反比,通过简单的图像处理和算法计算后得出细菌浓度,实现了纸基免疫微流控芯片对沙门氏菌的定量检测。该纸基免疫微流控芯片的检测下限为100 CFU/mL,总检测时间<1 min,远低于ELISA等传统方法定量检测食源性致病菌所需1 h或过夜的检测时间。
相对于单一纸基底的免疫微流控检测芯片来说,引入3D打印结合聚合物制备的纸基免疫微流控检测芯片能够使两者优势互补,更有利于食源性致病菌的快速检测[44]。例如,CARRELL等[45]开发了一种纸与3D打印旋转框架相结合可重复使用的免疫微流控芯片,用以沙门氏菌的快速检测(图4-D)。该免疫微流控检测芯片通过纸基衬底快速而准确的固定显色底物修用以检测结果的信号输出,而不需要复杂的表面修饰。3D旋转聚合物框架则用于放置纸基芯片,在离心力的作用下驱动溶液的流动进行洗涤,实现了试剂的输送、洗涤和检测自动化。检测时从样品孔注入含有病原菌的样品溶液,修饰后的纸基芯片结合外部永磁体固定免疫磁球对病原菌进行富集。洗涤后加入生物素标记的检测抗体,形成免疫磁球-细菌-检测抗体复合物。该复合物表面含生物素,可与带有链霉亲和素的半乳糖苷酶相结合。最终,半乳糖苷酶与固定好的显色底物发生反应,芯片由黄变红即表明样品中含有病原菌。该免疫微流控检测芯片以沙门氏菌为目标病原菌,分别在培养基和牛奶中进行培养,检出限分别达到了4.4×102、6.4×102 CFU/mL。该纸基微流控芯片与传统的纸基分析设备相比,避免了洗涤步骤而没有影响其检测性能,为商业化提供了一种实用的产品。
4 总结与展望
综上所述,本文讨论了基于免疫学的微流控芯片在食源性致病菌快速检测方面的应用与进展,介绍了各免疫微流控检测芯片特性(表1)及其相应的免疫微流控检测芯片在病原微生物上的检测性能(表2)。免疫微流控检测芯片在病原微生物的快速检测上具有传统检测方法无法比拟的显著优点,例如试剂和样品的低消耗量、成本低、检测环境要求低、检测速度快、高通量、高度集成及操作自动化等。此外,由于免疫微流控检测芯片具有高比表面及抗体固定化等优势,检测时间大大缩短,检测灵敏度也得到了提高。
表1 常见3种免疫微流控检测芯片的特性
Table 1 Performance comparison of 3 common immune microfluidic chips
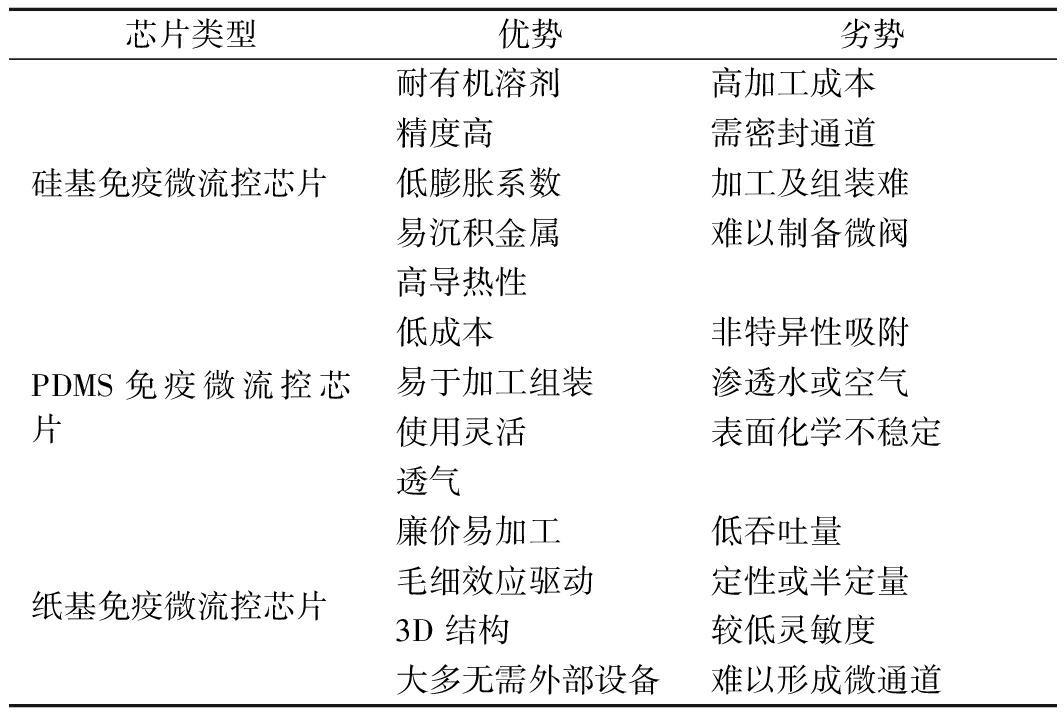
芯片类型优势劣势硅基免疫微流控芯片耐有机溶剂高加工成本精度高需密封通道低膨胀系数加工及组装难易沉积金属难以制备微阀高导热性PDMS免疫微流控芯片低成本非特异性吸附易于加工组装渗透水或空气使用灵活表面化学不稳定透气纸基免疫微流控芯片廉价易加工低吞吐量毛细效应驱动定性或半定量3D 结构较低灵敏度大多无需外部设备难以形成微通道
表2 免疫微流控检测芯片的性能比较
Table 2 Comparison of commonly used immune microfluidic detection chips

芯片基底加工工艺靶标样品多靶标耗时检测限参考文献硅基片标准光刻沙门氏菌标准样品否10 min103 CFU/mL[14]鸡肉提取物化学刻蚀金黄色葡萄球菌标准样品是≤30 min10 CFU/mL[15]玻璃标准光刻沙门氏菌鸡肉否1 h10 cell/mL[18]大肠杆菌标准样品13 cell/mL数控表面加工大肠杆菌标准样品2×107 CFU/ mL[20]芽孢杆菌标准样品4×104 CFU/ mL噬菌体病毒标准样品106 PFU/ mLPDMS3D打印及软光刻沙门氏菌标准样品否≤ 2 h150 CFU/mL[30]鸡肉PMMA表面微加工自组装大肠杆菌标准样品否35 min50 CFU/mL[31]PS铣刻玉米萎蔫病菌标准样品是2.5 h106 CFU/mL[32]纸蜡印人免疫球蛋白人体滑液否7 min0.01 g/mL[41]光刻、蚀刻沙门氏菌标准样品否≤ 1 min100 CFU/mL[43]纸、树脂3D打印、纸融合沙门氏菌标准样品是4.4×102 CFU/mL[45]牛奶6.4×102 CFU/mL
值得注意的是,虽然免疫微流控检测技术发展潜力巨大,但仍有一些挑战阻碍其大规模应用。首先,制备并组装芯片并没有设计时看上去那么简单,需用光刻机和真空热压键合机等专业机器及严格的加工工艺。其次,芯片内可能出现的死体积使得检测结果存在不稳定性,长期的低温存储也会对预装载试剂造成损害,用于结果输出的外部设备也使其检测的便携性受到影响。目前,大多数免疫微流控检测芯片仅用于病原体的快速定性检测,在区分活菌和死菌方面仍有待研究。因此,免疫微流控检测芯片在开发时应简化制备方法,去除死体积的影响来增加结果的可靠性。在输出结果时减少使用外部设备或开发小型化外部设备,将微流控芯片的便携性最大化。同时,探索能够区分活菌与死菌的免疫微流控芯片研究方案,进一步提高其应用性能。在免疫微流控检测芯片开发时若能考虑并解决上述问题,那么最终开发的免疫微流控检测芯片将有更广泛的应用并对基础科学研究产生重大影响。
[1] 张明娟,王娟,袁磊,等.多重聚合酶链式反应技术在食源性致病菌检测上的应用研究进展[J].食品与发酵工业,2021,47(2):305-310.
ZHANG M J,WANG J,YUAN L,et al.Application of multiplex polymerase chain reaction in detection of foodborne pathogens[J].Food and Fermentation Industries, 2021, 47(2):305-310.
[2] 魏春豪,迟海,杨光昕,等.副溶血性弧菌多克隆抗体制备及应用[J].食品与发酵工业,2020,46(8):157-161;166.
WEI C H,CHI H,YANG G X,et al.Preparation and application of polyclonal antibody against Vibrio parahaemolyticus[J].Food and Fermentation Industries, 2020,46(8):157-161;166.
[3] HAN H, SOHN B, CHOI J, et al.Recent advances in magnetic nanoparticle-based microfluidic devices for the pretreatment of pathogenic bacteria[J].Biomedical Engineering Letters, 2021,11(4):297-307.
[4] 马新秀,胡文忠,冯可,等.生物芯片在微生物检测中的应用[J].食品与发酵工业,2018,44(2):273-277.
MA X X,HU W Z,FENG K,et al.Application of biochip in microbial detection[J].Food and Fermentation Industries, 2018, 44(2):273-277.
[5] HU B F, LI J J, MOU L, et al.An automated and portable microfluidic chemiluminescence immunoassay for quantitative detection of biomarkers[J].Lab on a Chip, 2017,17(13):2 225-2 234.
[6] DUAN M L, XIAO X Y, HUANG Y M, et al.Immuno-HCR based on contact quenching and fluorescence resonance energy transfer for sensitive and low background detection of Escherichia coli O157:H7[J].Food Chemistry, 2021,334:127568.
[7] SHABANI E, ABDEKHODAIE M J, MOUSAVI S A, et al.ZnO nanoparticle/nanorod-based label-free electrochemical immunoassay for rapid detection of MMP-9 biomarker[J].Biochemical Engineering Journal, 2020,164:107772.
[8] LING S M, LI X L,ZHANG D P, et al.Detection of okadaic acid (OA) and tetrodotoxin (TTX) simultaneously in seafood samples using colloidal gold immunoassay[J].Toxicon, 2019,165:103-109.
[9] MUSILE G, WANG L, BOTTOMS J, et al.The development of paper microfluidic devices for presumptive drug detection[J].Analytical Methods, 2015, 7(19):8 025-8 033.
[10] MA H,  ′F
′F G
G IN C, O′KENNEDY R.Antibody stability:A key to performance-Analysis, influences and improvement[J].Biochimie, 2020,177:213-225.
IN C, O′KENNEDY R.Antibody stability:A key to performance-Analysis, influences and improvement[J].Biochimie, 2020,177:213-225.
[11] MANZ A, HARRISON D J, VERPOORTE E M J, et al.Planar chips technology for miniaturization and integration of separation techniques into monitoring systems:Capillary electrophoresis on a chip[J].Journal of Chromatography A, 1992,593(1-2):253-258.
[12] KAO L T H, SHANKAR L, KANG T G, et al.Multiplexed detection and differentiation of the DNA strains for influenza A (H1 N1 2009) using a silicon-based microfluidic system[J].Biosensors and Bioelectronics, 2011,26(5):2 006-2 011.
[13] HWANG J, CHO Y H, PARK M S, et al.Microchannel fabrication on glass materials for microfluidic devices[J].International Journal of Precision Engineering and Manufacturing, 2019,20(3):479-495.
[14] KIM G, MOON J H, MOH C Y, et al.A microfluidic nano-biosensor for the detection of pathogenic Salmonella[J].Biosensors and Bioelectronics, 2015,67:243-247.
[15] LI Y Q, ZHU B W, LI Y G, et al.A synergistic capture strategy for enhanced detection and elimination of bacteria[J].Angewandte Chemie International Edition,2014,53(23):5 837-5 841.
[16] HARB N H, MUTLAK F A H.Production and characterization of porous silicon via laser-assisted etching:Effect of gamma irradiation[J].Optik, 2021,246:167800.
[17] FUNANO S I, OTA N, TANAKA Y.A simple and reversible glass-glass bonding method to construct a microfluidic device and its application for cell recovery[J].Lab on a Chip, 2021,21(11):2 244-2 254.
[18] ABDULLAH A, DASTIDER S G, JASIM I, et al.Microfluidic based impedance biosensor for pathogens detection in food products.[J].Electrophoresis, 2019,40(4):508-520.
[19] GUAN Y, TU J Y, LI B Y, et al.Stripped electrode based electrowetting-on-dielectric digital microfluidics for precise and controllable parallel microdrop generation.[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2020,36(32):9 540-9 550.
[20] COUDRON L, MCDONNELL M B, MUNRO I, et al.Fully integrated digital microfluidics platform for automated immunoassay;A versatile tool for rapid, specific detection of a wide range of pathogens[J].Biosensors and Bioelectronics, 2019,128:52-60.
[21] SAMIEI E, TABRIZIAN M, HOORFAR M.A review of digital microfluidics as portable platforms for lab-on a-chip applications.[J].Lab on a Chip, 2016,16(13):2 376-2 396.
[22] GOLOZAR M, CHU W K, CASTO L D, et al.Fabrication of high-quality glass microfluidic devices for bioanalytical and space flight applications[J].MethodsX, 2020,7:101043.
[23] FORNELL A, SÖDERB CK P, LIU Z H, et al.Fabrication of silicon microfluidic chips for acoustic particle focusing using direct laser writing[J].Micromachines, 2020,11(2):113.
CK P, LIU Z H, et al.Fabrication of silicon microfluidic chips for acoustic particle focusing using direct laser writing[J].Micromachines, 2020,11(2):113.
[24] MOU L, JIANG X Y.Materials for microfluidic immunoassays:A review[J].Advanced Healthcare Materials, 2017,6(15):1601403.
[25] MA H L, URBACZEK A C, ZEFERINO RIBEIRO DE SOUZA F, et al.Rapid fabrication of microfluidic devices for biological mimicking:A survey of materials and biocompatibility.[J].Micromachines, 2021,12(3):346.
[26] SHAKERI A, KHAN S, DIDAR T F.Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices.[J].Lab on a Chip, 2021,21(16):3 053-3 075.
[27] EFFENHAUSER C S, BRUIN G J M, PAULUS A, et al.Integrated capillary electrophoresis on flexible silicone microdevices:Analysis of DNA restriction fragments and detection of single DNA molecules on microchips[J].Analytical Chemistry (Washington), 1997,69(17):3 451-3 457.
[28] SAADAT M, TAYLOR M, HUGHES A, et al.Rapid prototyping method for 3D PDMS microfluidic devices using a red femtosecond laser[J].Advances in Mechanical Engineering, 2020,12(12).DOI:10.1177/1687814020982713.
[29] ARACI I E, QUAKE S R.Microfluidic very large scale integration (mVLSI) with integrated micromechanical valves[J].Lab on a Chip, 2012,12(16):2 803-2 806.
[30] CAI G Z, ZHENG L Y, LIAO M, et al.A microfluidic immunosensor for visual detection of foodborne bacteria using immunomagnetic separation, enzymatic catalysis and distance indication[J].Mikrochimica Acta, 2019,186(12):757.
[31] ALTINTAS Z, AKGUN M, KOKTURK G, et al.A fully automated microfluidic-based electrochemical sensor for real-time bacteria detection[J].Biosensors and Bioelectronics, 2018,100:541-548.
[32] 王岭. 玉米萎蔫病菌抗体制备及微流控芯片免疫检测方法研究[D].保定:河北大学,2008.
WANG L.Preparation of polyclonal antibodies of Clavibacter michiganense subsp.nebraskense and development of microfluidic chip immunoassay[D].Baoding:Hebei University,2008.
[33] CHOI J, CHO S J, KIM Y T, et al.Development of a film-based immunochromatographic microfluidic device for malaria diagnosis[J].Biomedical Microdevices, 2019, 21(4):86.
[34] ZHANG X F, CHEN Y Q, HU J M.Robust superhydrophobic SiO2/polydimethylsiloxane films coated on mild steel for corrosion protection[J].Corrosion Science, 2020,166:108452.
[35] FU X R, SUN J D, LIANG R, et al.Application progress of microfluidics-integrated biosensing platforms in the detection of foodborne pathogens[J].Trends in Food Science & Technology, 2021,116:115-129.
[36] CHOOPARA I, SUEA-NGAM A, TEETHAISONG Y, et al.Fluorometric paper-based, loop-mediated isothermal amplification devices for quantitative point-of-care detection of methicillin-resistant Staphylococcus aureus (MRSA).[J].ACS sensors, 2021,6(3):742-751.
[37] LUO K, RYU J, SEOL I H, et al.Paper-based radial chromatographic immunoassay for the detection of pathogenic bacteria in milk.[J].ACS applied materials & interfaces, 2019,11(50):46 472-46 478.
[38] ABE K, KOTERA K, SUZUKI K, et al.Inkjet-printed paperfluidic immuno-chemical sensing device[J].Analytical and Bioanalytical Chemistry, 2010,398(2):885-893.
[39] CINCOTTO F H, FAVA E L, MORAES F C, et al.A new disposable microfluidic electrochemical paper-based device for the simultaneous determination of clinical biomarkers[J].Talanta, 2019,195:62-68.
[40] PUIU M, BALA C.Microfluidics-integrated biosensing platforms as emergency tools for on-site field detection of foodborne pathogens[J].TrAC Trends in Analytical Chemistry, 2020,125:115831.
[41] CHEN C G, YEH W S, TSAI T T, et al.Three-dimensional origami paper-based device for portable immunoassay applications.[J].Lab on a Chip, 2019,19(4):598-607.
[42] HOU C Y, FU L M, JU W J, et al.Microfluidic colorimetric system for nitrite detection in foods[J].Chemical Engineering Journal, 2020,398:125573.
[43] PARK T S, LI W Y, MCCRACKEN K E, et al.Smartphone quantifies Salmonella from paper microfluidics.[J].Lab on a Chip, 2013,13(24);4 832-4 840.
[44] ZHOU W, DOU M W, TIMILSINA S S, et al.Recent innovations in cost-effective polymer and paper hybrid microfluidic devices.[J].Lab on a Chip, 2021,21(14):2 658-2 683.
[45] CARRELL C S, WYDALLIS R M, BONTHA M, et al.Rotary manifold for automating a paper-based Salmonella immunoassay[J].RSC Advances, 2019,9(50):29 078-29 086.