熊果酸是一种存在于天然植物中的代表性的五环三萜类小分子化合物[1]。熊果酸具有广泛的生物学活性,如保肝、抗炎、抗氧化、美白、抗菌和抗糖尿病等作用[2-3]。此外,熊果酸还具有毒性低,易从自然界获取的特点[4]。尽管熊果酸具有各种生物活性和安全性,但由于其水溶性差且生物利用度低,因此尚未广泛应用于保健产品和化妆品等产品中[5-6]。因此,有必要探索克服上述问题的合适方法,扩大熊果酸的应用范围,进一步发挥熊果酸的生物活性。
为了提高熊果酸的溶解度和生物利用度,目前已经开发了多种类型的熊果酸递送系统,如固体包合物,脂质体,纳米乳剂和水凝胶。与其他递送系统相比,天然聚合物纳米粒子由于具有无毒、尺寸小、靶向性强、有效的渗透能力及提高生物利用度等多重优势而成为研究热点[7-8]。壳聚糖是线性且由天然阳离子几丁质部分脱乙酰而获得的聚合物,具有生物相容性、无毒性和可生物降解性[9]。基于壳聚糖的纳米颗粒作为纳米载体用于递送活性成分,可以增强活性成分的稳定性、促进其吸收和生物利用度的增加[10]。HERNANDEZ-PATLAN等[11]制备的姜黄素壳聚糖纳米粒可以有效提高姜黄素的稳定性和渗透性。WU等[12]制备的负载白藜芦醇的壳聚糖纳米颗粒可以显著提高白藜芦醇的溶解度和稳定性。THANDADANI等[13]研究表明壳聚糖纳米颗粒具有很好的生物降解性、生物相容性、抗氧化活性且无毒。因此,壳聚糖纳米颗粒是用于改善活性成分的稳定性和溶解性的有效载体。与其他合成壳聚糖纳米颗粒的方法相比,离子凝胶法具有反应条件简单温和、方便、无毒的优点[14]。然而,目前国内外关于采用离子凝胶法以三聚磷酸钠为交联剂制备负载熊果酸的壳聚糖纳米颗粒的研究鲜有报道。
本研究以壳聚糖和三聚磷酸钠为载体,采用离子凝胶法制备负载熊果酸的壳聚糖纳米颗粒,运用单因素试验和正交试验方法以熊果酸包埋率为指标筛选最佳制备条件,以期提高熊果酸的溶解度,扩大其在保健产品和化妆品行业中的应用。
1 材料与方法
1.1 材料与试剂
熊果酸(纯度98.0%),上海源叶生物科技有限公司;壳聚糖(脱乙酰化≥90.0%),上海蓝季科技发展有限公司;三聚磷酸钠(分析纯),天津市风船化学试剂科技有限公司;吐温-80(分析纯),天津市德恩化学试剂有限公司;乙酸(分析纯),江苏强盛功能化学股份有限公司。
1.2 仪器与设备
UV-2600紫外可见分光光度计,龙尼柯(上海)仪器有限公司;HJ-6A数显磁力加热搅拌器,常州普天仪器制造有限公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;TM3030Plus扫描电子显微镜,日本日立高新技术公司;Nano ZS90马尔文激光粒度仪,上海普迪生物技术有限公司。
1.3 实验方法
1.3.1 熊果酸壳聚糖纳米颗粒的制备工艺
参考文献[15-16]的方法制备负载熊果酸的壳聚糖纳米颗粒。在室温下,将壳聚糖加入体积分数为1%的乙酸溶液中,磁力搅拌8 h,得到澄清溶液,将其用0.45 μm 微孔膜过滤,得到壳聚糖溶液。用质量浓度0.1 g/mL的氢氧化钠溶液将壳聚糖溶液的pH调节至5.0,然后加入质量分数为1%的吐温-80,并在室温下磁力搅拌20 min。然后,按照熊果酸与壳聚糖的质量比3∶1将溶解于乙醇的熊果酸溶液滴加至上述溶液中,并在磁力搅拌下30 min。按照壳聚糖与三聚磷酸钠的质量比5∶1将质量浓度为2.0 mg/mL的三聚磷酸钠溶液缓慢滴加到混合溶液中,并磁力搅拌45 min以获得熊果酸壳聚糖纳米颗粒悬浮液。将纳米颗粒悬浮液以12 000 r/min离心20 min,并用蒸馏水洗涤沉淀物以除去未结合的熊果酸,然后喷雾干燥,将获得的负载熊果酸的壳聚糖纳米颗粒粉末存储在干燥器中直至分析。
1.3.2 标准曲线绘制
配制成1 mg/mL的熊果酸储备液,分别称取1.0、1.5、2.0、2.5、3.0 mL储备液,用乙醇定容至10 mL 容量瓶中,得到不同浓度的标准溶液。以乙醇作空白对照,在210 nm波长下测定溶液吸光度。得到标准曲线方程为:Y=8.097 1X-0.015 1, R2=0.999 3。其中Y为吸光度,X为熊果酸质量浓度。
1.3.3 熊果酸壳聚糖纳米颗粒包埋率的测定
参考文献[17]的方法,取熊果酸壳聚糖纳米粒悬液于10 000 r/min转速下离心20 min,分离上清液,将沉淀物用蒸馏水洗涤3次。向沉淀物中加入乙醇,超声处理15 min,然后用高速离心机以10 000 r/min离心15 min,适当稀释,用紫外可见分光光度计测定离心后的上清液在210 nm波长处的吸光度,并通过熊果酸标准曲线计算熊果酸含量。包埋率根据公式(1)计算:
包埋率![]()
(1)
式中:M总为添加的熊果酸总量,mg;M为壳聚糖纳米颗粒负载的熊果酸质量,mg。
1.3.4 熊果酸壳聚糖纳米颗粒的工艺优化
1.3.4.1 单因素试验
(1)壳聚糖质量浓度对熊果酸壳聚糖纳米颗粒包埋率的影响
分别选取1.0、2.0、3.0、4.0和5.0 mg/mL的壳聚糖质量浓度,按照壳聚糖与熊果酸3∶1的质量比添加熊果酸,按照壳聚糖与三聚磷酸钠5∶1的质量比,添加2.0 mg/mL的三聚磷酸钠溶液,制备熊果酸壳聚糖纳米颗粒,研究不同质量浓度的壳聚糖对熊果酸壳聚糖纳米颗粒包埋率的影响。
(2)壳聚糖与熊果酸质量比对熊果酸壳聚糖纳米颗粒包埋率的影响
采用3.0 mg/mL的壳聚糖质量浓度,按照壳聚糖与熊果酸的质量比为1∶1、2∶1、3∶1、4∶1和5∶1添加熊果酸,按照壳聚糖与三聚磷酸钠的质量比5∶1添加2.0 mg/mL的三聚磷酸钠溶液,制备熊果酸壳聚糖纳米颗粒,研究壳聚糖与熊果酸的不同质量比对熊果酸壳聚糖纳米颗粒包埋率的影响。
(3)壳聚糖与三聚磷酸钠质量比对熊果酸壳聚糖纳米颗粒包埋率的影响
采用3.0 mg/mL的壳聚糖质量浓度,按照壳聚糖与熊果酸质量比为3∶1添加熊果酸,分别按照壳聚糖与三聚磷酸钠的质量比为1∶1、2∶1、3∶1、4∶1和5∶1,添加2.0 mg/mL的三聚磷酸钠溶液,制备熊果酸壳聚糖纳米颗粒,研究壳聚糖与三聚磷酸钠的不同质量比对熊果酸壳聚糖纳米颗粒包埋率的影响。
1.3.4.2 正交试验
在上述单因素试验基础上,选择壳聚糖溶液质量浓度、壳聚糖与三聚磷酸钠质量比和壳聚糖与熊果酸质量比3个因素为试验因素进行L9(34)正交试验设计,考察因素与水平如表1所示,以熊果酸包埋率为指标确定最佳制备条件。
表1 正交试验因素与水平
Table 1 Factors and levels in the orthogonal design
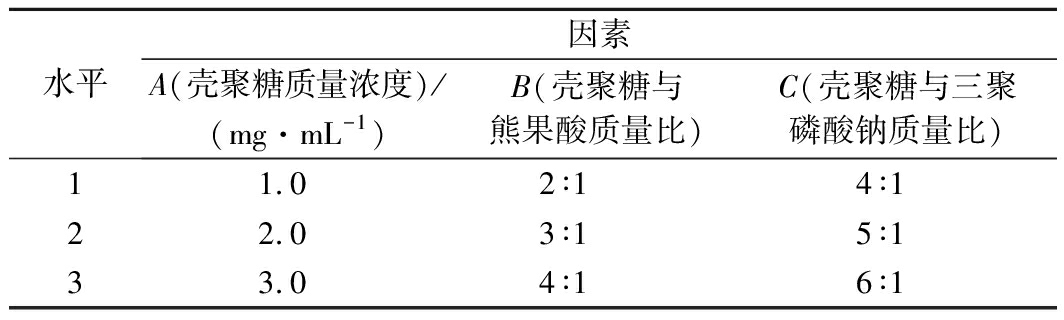
水平因素A(壳聚糖质量浓度)/(mg·mL-1)B(壳聚糖与熊果酸质量比)C(壳聚糖与三聚磷酸钠质量比)11.02∶14∶122.03∶15∶133.04∶16∶1
1.3.5 熊果酸壳聚糖纳米颗粒表征及溶出度测定
1.3.5.1 扫描电子显微镜分析
将通过喷雾干燥得到的熊果酸壳聚糖纳米颗粒粉末粘在导电胶上,用扫描电子显微镜观察负载熊果酸壳聚糖纳米颗粒的微观结构和表面形态[18]。
1.3.5.2 粒径测定
通过马尔文激光粒度仪测量负载熊果酸壳聚糖纳米颗粒的粒径。称取适量的壳聚糖纳米颗粒粉末,用超纯水适当稀释后放于样品池,于室温下测定[19]。
1.3.5.3 体外溶出度测定
将负载熊果酸壳聚糖纳米颗粒添加到装有模拟胃液(pH=2.0, 0.01 mol/L HCI和0.09 mol/L NaCl)和模拟肠液(pH=6.9, 0.07 mol/L KH2PO4和0.2 mol/L NaOH)的烧杯中,在37 ℃恒温培养箱中以120 r/min的转速搅拌,在适当的时间间隔对悬浮液进行采样,并用等体积的新鲜溶出介质代替,取出的样品用紫外可见分光光度计分析[20-21]。
1.4 数据统计及分析
每组试验平行进行3次,使用Origin 2017软件对试验数据进行分析,使用DPS 7.05软件进行方差分析,为了确定组样本之间的显着差异,置信区间选择为95%(P<0.05)。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 壳聚糖质量浓度对包埋率的影响
由图1可知,随着壳聚糖质量浓度的增大,负载熊果酸的壳聚糖纳米颗粒的包埋率呈现先上升后下降的趋势,当壳聚糖溶液质量浓度为2.0 mg/mL时,带正电荷的壳聚糖氨基基团通过离子凝胶法与带负电荷的三聚磷酸钠的磷酸基团相互作用最强,因此负载熊果酸的壳聚糖纳米颗粒的包埋率较高。壳聚糖分子在酸性溶液中会电离出带正电荷的氨基基团,随着壳聚糖溶液浓度质量增加,壳聚糖分子表面会带更多的正电荷,熊果酸分子被包埋的机会增大。但壳聚糖溶液浓度过高,溶液体系黏度增大,会阻碍熊果酸分子在壳聚糖分子周围运动,导致高壳聚糖质量浓度时熊果酸的包埋率下降。
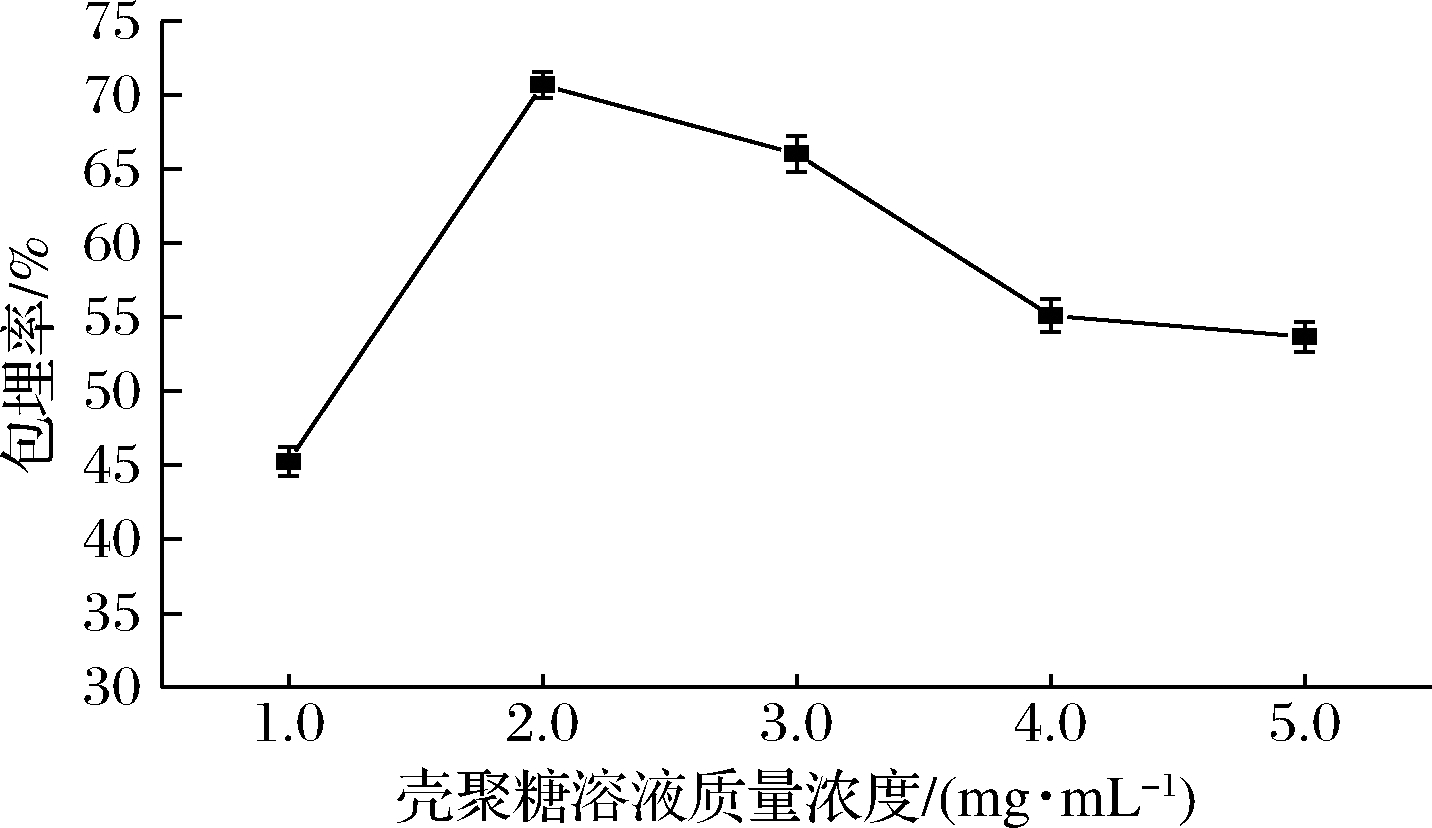
图1 壳聚糖浓度对熊果酸包埋率的影响
Fig.1 Effect of chitosan solution concentration on encapsulation efficiency of ursolic acid
2.1.2 壳聚糖与熊果酸的质量比对包埋率的影响
芯材与壁材的质量比例对壳聚糖纳米颗粒的包埋率有直接影响[22]。芯壁比对负载熊果酸的壳聚糖纳米颗粒包埋率的影响见图2。如图2所示,包埋率随着壳聚糖与熊果酸质量比的增大而呈现先上升后下降的趋势,在壳聚糖与熊果酸质量比为3∶1时包埋率达到最佳。这是由于随着芯壁比的增大,包裹在熊果酸周围的壁材的量逐渐减少,导致壳聚糖纳米颗粒的机械性能降低,囊壁的厚度逐渐变薄,熊果酸泄露,因此包埋率降低[23]。
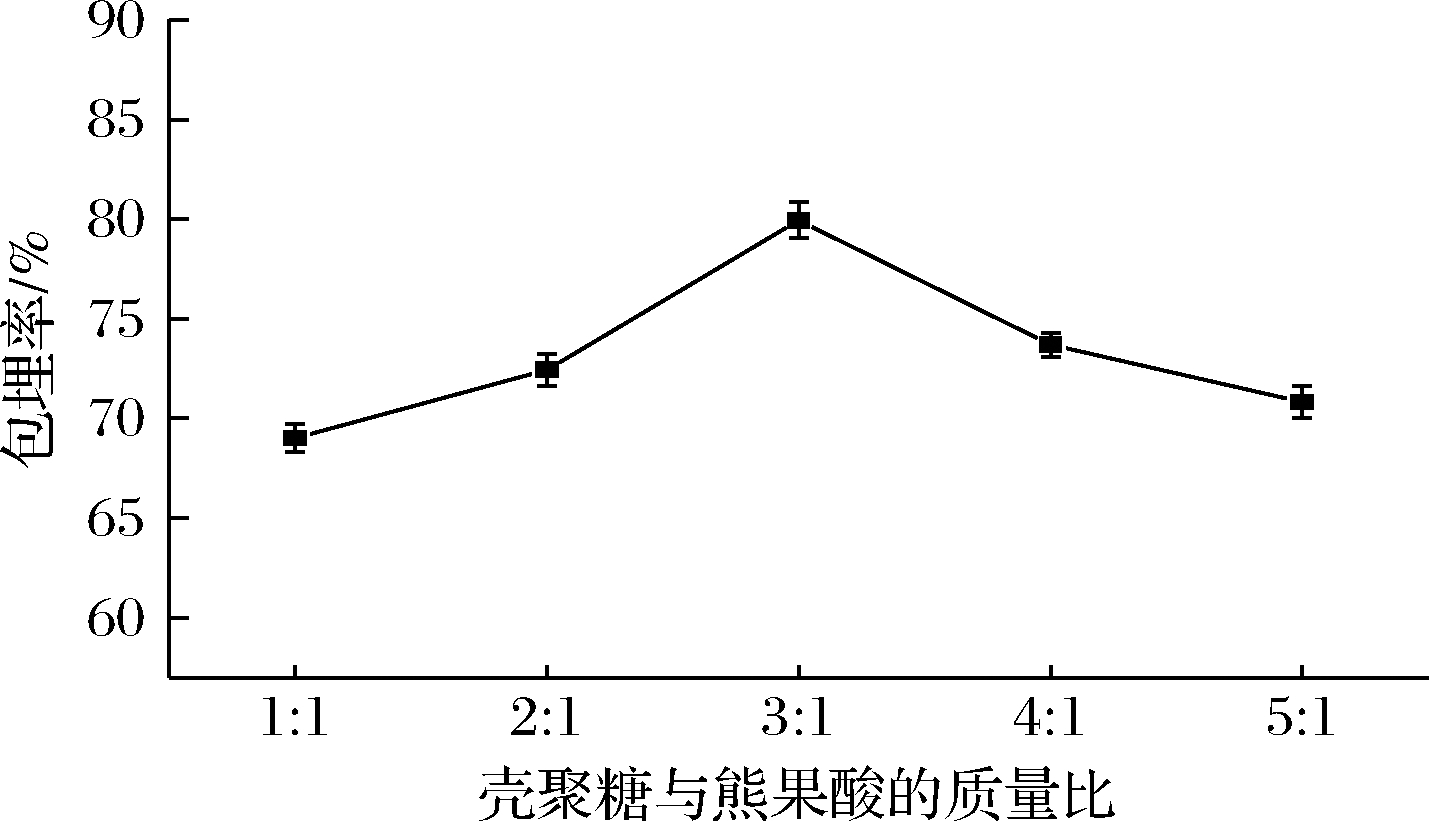
图2 壳聚糖与熊果酸的质量比对熊果酸包埋率的影响
Fig.2 Effect of mass ratio of chitosan to ursolic acid on encapsulation efficiency of ursolic acid
2.1.3 壳聚糖与三聚磷酸钠的质量比对包埋率的影响
如图3所示,随着壳聚糖与三聚磷酸钠质量比的增加,负载熊果酸的壳聚糖纳米颗粒的包埋率呈现先上升后下降的趋势,当壳聚糖与三聚磷酸钠质量比为5∶1时,溶液中壳聚糖分子带的正电荷氨基基团与三聚磷酸钠带的负电荷磷酸基团之间充分交联反应,负载熊果酸的壳聚糖纳米颗粒包埋率较高。壳聚糖与三聚磷酸钠质量比过高,即溶液中三聚磷酸钠加入量过低,三聚磷酸钠分子带的负电荷磷酸基团不足以与壳聚糖带的正电荷氨基基团交联形成纳米颗粒,因此当壳聚糖与三聚磷酸钠质量比高于5∶1,熊果酸的包埋率呈现下降的趋势。

图3 壳聚糖与三聚磷酸钠的质量比对熊果酸包埋率的影响
Fig.3 Effect of mass ratio of chitosan to sodium tripolyphosphate on encapsulation efficiency of ursolic acid
2.2 正交试验结果分析
为筛选出制备负载熊果酸的壳聚糖纳米颗粒的最佳条件,在单因素试验结果的基础上进行正交试验,正交试验结果及方差分析分别如表2和表3所示。根据极差分析可知,各因素对壳聚糖纳米颗粒包埋率的影响顺序为:壳聚糖与熊果酸质量比>壳聚糖与三聚磷酸钠质量比>壳聚糖溶液质量浓度,比较各因子的k值可知,获得最大负载熊果酸的壳聚糖纳米颗粒包埋率的最优组合为:A2B3C1。根据方差分析可知,壳聚糖与熊果酸质量比对包埋率影响极显著(P<0.01),壳聚糖质量浓度和壳聚糖与三聚磷酸钠质量比对包埋率影响显著(P<0.05)。制备负载熊果酸的壳聚糖纳米颗粒的最佳条件为壳聚糖与熊果酸质量比为4∶1,壳聚糖溶液质量浓度为2.0 mg/mL,壳聚糖与三聚磷酸钠质量比为4∶1,此条件下熊果酸的包埋率为79.52%。
表2 正交试验结果
Table 2 The results of orthogonal experimental
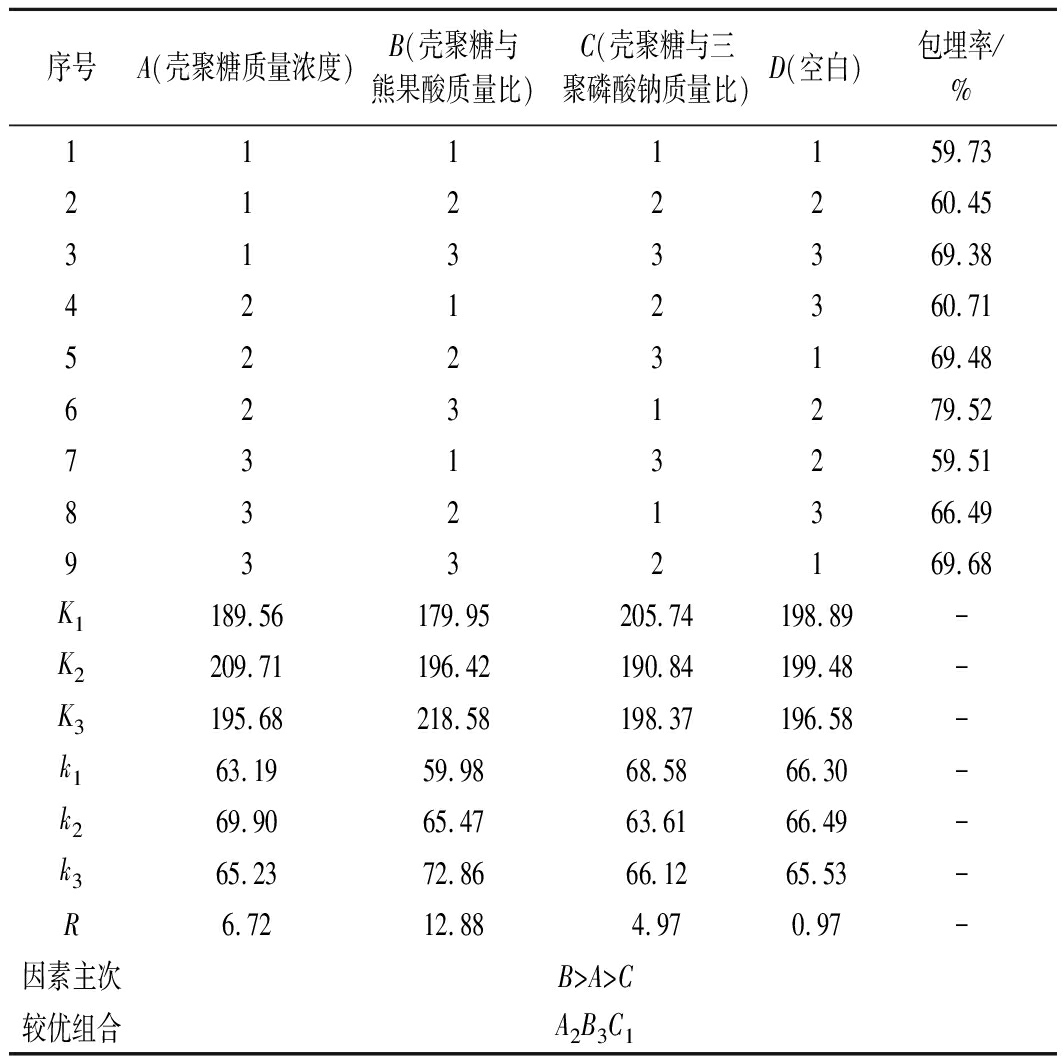
序号A(壳聚糖质量浓度)B(壳聚糖与熊果酸质量比)C(壳聚糖与三聚磷酸钠质量比)D(空白)包埋率/%1111159.732122260.453133369.384212360.715223169.486231279.527313259.518321366.499332169.68K1189.56179.95205.74198.89-K2209.71196.42190.84199.48-K3195.68218.58198.37196.58-k163.1959.9868.5866.30-k269.9065.4763.6166.49-k365.2372.8666.1265.53-R6.7212.884.970.97-因素主次B>A>C较优组合A2B3C1
注:-表示无数据(下同)
表3 试验结果方差分析
Table 3 Variance analysis of experimental
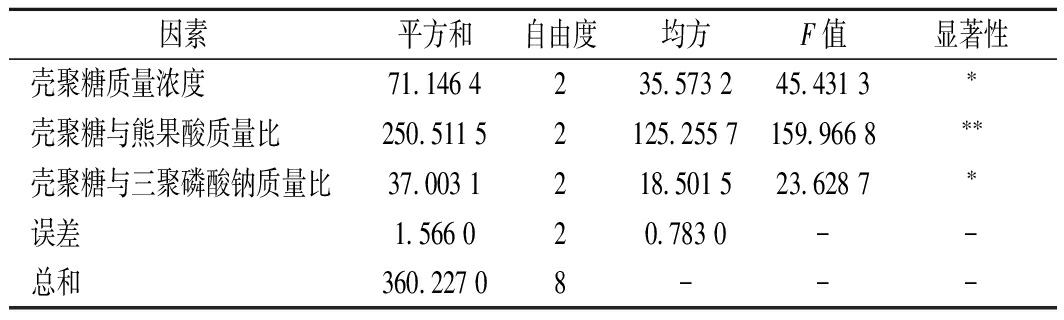
因素平方和自由度均方F值显著性壳聚糖质量浓度71.146 4235.573 245.431 3∗壳聚糖与熊果酸质量比250.511 52125.255 7159.966 8∗∗壳聚糖与三聚磷酸钠质量比37.003 1218.501 523.628 7∗误差1.566 020.783 0--总和360.227 08---
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
2.3 结构表征
为进一步表征熊果酸在壳聚糖纳米颗粒最佳制备条件下的包埋形貌,通过扫描电镜观察该纳米颗粒的外观(图4)。干燥后的负载熊果酸的壳聚糖纳米颗粒是球形,具有相对光滑的表面。颗粒分布相对均匀,表明离子凝胶法能有效地制备负载熊果酸的壳聚糖纳米颗粒。

图4 负载熊果酸的壳聚糖纳米颗粒扫描电镜图
Fig.4 Scanning electron micrograph of ursolic acid loaded chitosan nanoparticles
负载熊果酸的壳聚糖纳米颗粒的粒径分布如图5所示。由图5可知,负载熊果酸的壳聚糖纳米颗粒的粒径在180 nm左右,与文献报道的采用自组装方法制备的粒径在200~300 nm的靶向羧甲基壳聚糖-熊果酸纳米药物相近[24]。壳聚糖纳米颗粒粒径越小,包埋率越高且具有缓释作用[5]。负载熊果酸的壳聚糖纳米颗粒的多分散指数为0.476±0.03,其粒径呈正态分布且分布较窄,说明壳聚糖纳米颗粒分布相对均匀和集中。
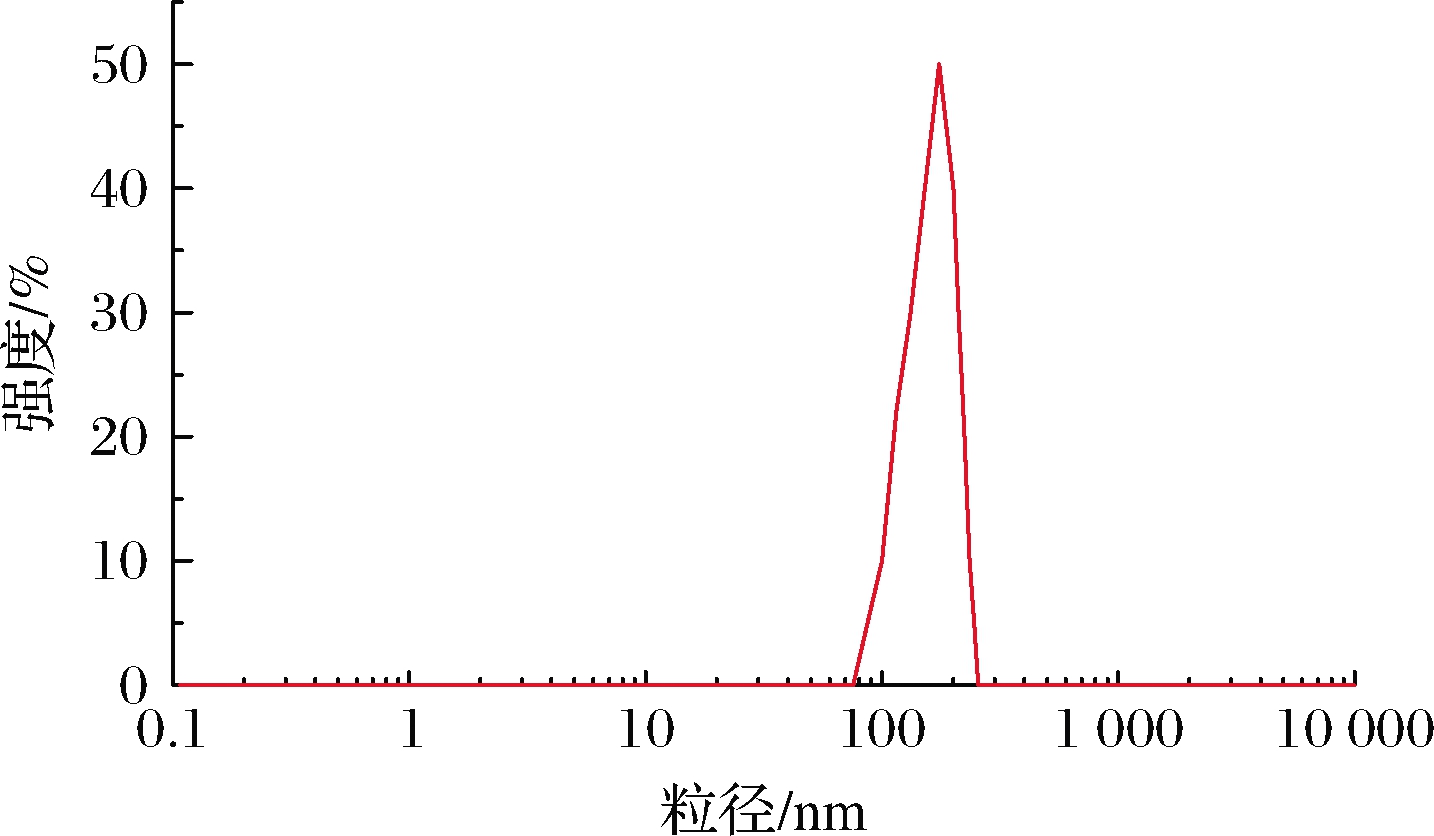
图5 负载熊果酸的壳聚糖纳米颗粒的粒径分布
Fig.5 Particle size distribution of ursolic acid loaded chitosan nanoparticles
2.4 体外溶出度分析
熊果酸和负载熊果酸的壳聚糖纳米颗粒在模拟胃肠液中的溶出度如图6所示。由图6可知,熊果酸在模拟胃液和模拟肠液中的溶出度均低于10%,而负载熊果酸的壳聚糖纳米颗粒在模拟胃肠液中的溶出度分别为55.8%和16.9%,分别是熊果酸原药的4.7倍和1.1倍。表明负载熊果酸壳聚糖纳米颗粒的溶解速率显著高于未包埋的熊果酸,壳聚糖纳米颗粒包埋熊果酸可以显著提高熊果酸的溶解度。

图6 负载熊果酸的壳聚糖纳米颗粒在模拟 胃肠液中的溶出度
Fig.6 Dissolution of ursolic acid loaded chitosan nanoparticles in simulated gastrointestinal fluid
3 结论
本文通过单因素试验和正交试验优化了离子凝胶法制备壳聚糖纳米颗粒的工艺,得到最佳制备工艺参数为:壳聚糖溶液质量浓度为0.2 mg/mL,壳聚糖与熊果酸质量比为4∶1,壳聚糖与三聚磷酸钠质量比为4∶1,此时的熊果酸包埋率为79.52%。在最佳制备条件下,负载熊果酸的壳聚糖纳米颗粒呈表面光滑的球形,粒径在180 nm左右,且分布较窄。负载熊果酸的壳聚糖纳米颗粒在模拟胃肠液中的溶出度显著提高。因此,利用正交试验优化的负载熊果酸壳聚糖纳米颗粒的制备工艺可以有效提升熊果酸的溶出度。
[1] 张梦, 何曼, 孙强, 等.基于Hedgehog信号通路的熊果酸诱导结直肠癌SW480细胞凋亡的机制研究[J].中草药, 2021, 52(8):2 365-2 373.
ZHANG M, HE M, SUN Q, et al.Mechanism study on ursolic acid induced apoptosis of colorectal cancer SW480 cells based on Hedgehog signaling pathway[J].Chinese Traditional and Herbal Drugs, 2021, 52(8):2 365-2 373.
[2] 周茜, 韩雪, 韩晓梅, 等.响应面试验优化乌梅熊果酸提取工艺及其对大肠杆菌的抑制作用[J].食品科学, 2016, 37(8):67-73.
ZHOU Q, HAN X, HAN X M, et al.Optimization of ursolic acid extraction from fructus mume and evaluation of its antibacterial activity against Escherichia coli [J].Food Science, 2016, 37(8):67-73.
[3] 马浩然, 贾海莲, 张文龙, 等.熊果酸对酒精性肝损伤大鼠肠道菌群的影响[J].食品科学, 2018, 39(11):146-151.
MA H R, JIA H L, ZHANG W L, et al.Effect of ursolic acid on gut microbiota in rats with alcohol-induced liver injury[J].Food Science, 2018, 39(11):146-151.
[4] SONG S, GAO K, NIU R M, et al.Binding behavior, water solubility and in vitro cytotoxicity of inclusion complexes between ursolic acid and amino-appended β-cyclodextrins[J].Journal of Molecular Liquids, 2019, 296:111993.
[5] L PEZ-HORTAS L, PÉREZ-LARR
PEZ-HORTAS L, PÉREZ-LARR N P, GONZ
N P, GONZ LEZ-MU
LEZ-MU OZ M J, et al.Recent developments on the extraction and application of ursolic acid.A review[J].Food Research International, 2018,103:130-149.
OZ M J, et al.Recent developments on the extraction and application of ursolic acid.A review[J].Food Research International, 2018,103:130-149.
[6] JESUS J A, LAGO J H G, LAURENTI M D, et al.Antimicrobial activity of oleanolic and ursolic acids:An update[J].Evidence-Based Complementary and Alternative Medicine, 2015, 2015:620472.
[7] SUN C X, XU C Q, MAO L K, et al.Preparation, characterization and stability of curcumin-loaded zein-shellac composite colloidal particles[J].Food Chemistry, 2017, 228:656-667.
[8] YAN J, GUAN Z Y, ZHU W F, et al.Preparation of puerarin chitosan oral nanoparticles by ionic gelation method and its related kinetics[J].Pharmaceutics, 2020, 12(3):216.
[9] 林洪斌, 郭训练, 刘茜,等.纳米壳聚糖粒子制备工艺优化及抗菌性研究[J].食品与发酵工业, 2020, 46(3):110-117.
LIN H B, GUO X L, LIU Q, et al.Preparation process optimization and antibacterial activity analysis of nano-chitosan particles[J].Food and Fermentation Industries, 2020, 46(3):110-117.
[10] 陈文彬, 严文静, 徐幸莲, 等.α-生育酚壳聚糖纳米粒的制备、表征及体外缓释抗氧化性能[J].食品科学, 2017, 38(22):216-223.
CHEN W B, YAN W J, XU X L, et al.Preparation, characterization and in vitro sustained antioxidant activity of α-tocopherol-loaded chitosan nanoparticles[J].Food Science, 2017, 38(22):216-223.
[11] HERNANDEZ-PATLAN D, SOLIS-CRUZ B, CANO-VEGA M A, et al.Development of chitosan and alginate nanocapsules to increase the solubility, permeability and stability of curcumin[J].Journal of Pharmaceutical Innovation, 2019, 14(2):132-140.
[12] WU J, WANG Y P, YANG H, et al.Preparation and biological activity studies of resveratrol loaded ionically cross-linked chitosan-TPP nanoparticles[J].Carbohydrate Polymers, 2017, 175:170-177.
[13] THANDAPANI G, P S P, P N S, et al.Size optimization and in vitro biocompatibility studies of chitosan nanoparticles-ScienceDirect[J].International Journal of Biological Macromolecules, 2017, 104:1 794-1 806.
[14] 谭啸, 邱婷婷, 李若男, 等.壳聚糖纳米粒子的制备和在食品抑菌中的研究进展[J].食品科学, 2020, 41(23):347-353.
TAN X, QIU T T, LI R N, et al.Recent progress in the preparation and application of chitosan nanoparticles as an antimicrobial in foods[J].Food Science, 2020, 41(23):347-353.
[15] YAN J, GUAN Z Y, ZHU W F, et al.Preparation of puerarin chitosan oral nanoparticles by ionic gelation method and its related kinetics[J].Pharmaceutics, 2020, 12(3):216-233.
[16] 龙门, 冯超, 李永佳, 等.缓释型茶树精油-壳聚糖微胶囊的制备、表征及体外释放规律[J].食品科学, 2019, 40(16):242-248.
LONG M, FENG C, LI Y J, et al.Preparation, characterization and in vitro release characteristics of sustained-release chitosan microcapsules containing tea tree oil[J].Food Science, 2019, 40(16):242-248.
[17] LI W J, PENG H L, NING F J, et al.Amphiphilic chitosan derivative-based core-shell micelles:Synthesis, characterisation and properties for sustained release of Vitamin D3[J].Food Chemistry, 2014, 152:307-315.
[18] 任海伟, 邢雪晔, 张湘越, 等.白酒糟制备高纯度微晶纤维素工艺优化及其结构表征[J].中国食品学报, 2020, 20(4):108-117.
REN H W, XING X Y, ZHANG X Y, et al.Preparation process optimization and structure characterization of microcrystalline cellulose from grains stillage[J].Journal of Chinese Institute of Food Science and Technologys, 2020, 20(4):108-117.
[19] 胡蒋宁, 熊超越, 李想, 等.超声制备中长链结构酯纳米乳液及其体外消化的研究[J].中国食品学报, 2019, 19(3):175-183.
HU J N, XIONG C Y, LI X, et al.Studies on the preparation of nano-emulsions with medium-and long-chain triacylglycerols and its digestion in vitro[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(3):175-183.
[20] 李淑坤, 汪晶, 仝萌, 等.姜黄色素-共聚维酮共研磨粉体性质及溶出度研究[J].中草药, 2020, 51(23):5 949-5 955.
LI S K, WANG J, TONG M, et al.Properties and dissolution of curcumin-PVP co-grinding powder[J].Chinese Traditional and Herbal Drugs, 2020, 51(23):5 949-5 955.
[21] LIU Z Z, YANG L.Antisolvent precipitation for the preparation of high polymeric procyanidin nanoparticles under ultrasonication and evaluation of their antioxidant activity in vitro[J].Ultrasonics Sonochemistry, 2018, 43:208-218.
[22] 张睿. 气-液包埋法制备肉桂油-β-环糊精微胶囊的研究[D].广州:广东工业大学, 2017.
ZHANG R.Study on preparation of cinnamon oil-β-cyclodextrin microcapsules by gas-liquid embedding method[D].Guangzhou:Guangdong University of Technology, 2017.
[23] 滑海涛, 李敏, 翟晓曼, 等.反应时间、芯壁比及表面活性剂用量对阿维菌素微囊制备的影响[J].农药学学报, 2010, 12(1):54-60.
HUA H T, LI M, ZHAI X M, et al.Studies on the influence of polymerization time ratio of core material to wall material and percentage of SDS on the preparation of abamectin capsule suspensions[J].Chinese Journal of Pesticide Science, 2010, 12(1):54-60.
[24] 张依诺, 吴珊, 刘峥, 等.靶向羧甲基壳聚糖-熊果酸纳米药物载体的制备及表征[J].精细与专用化学品, 2019, 27(2):38-41.
ZHANG Y N, WU S, LIU Z, et al.Preparation and characterization of targeted carboxymethyl chitosan-ursolic acid nano-drug carriers[J].Fine and Specialty Chemicals, 2019, 27(2):38-41.