葡萄酒中的苹果酸乳酸发酵(malolactic fermentation, MLF)是经过酒精发酵(alcohol fermentation, AF)之后由乳酸菌主导的发酵过程,也叫做二次发酵[1]。在苹果酸乳酸发酵过程中,乳酸菌在苹果酸乳酸酶的作用下,以L-苹果酸为底物,生成L-乳酸和二氧化碳[2]。自发的苹果酸乳酸发酵通常是不可控制的,而且葡萄酒中严苛的环境如低pH、高酒精浓度、高SO2浓度和低温会阻碍乳酸菌生长,最终导致发酵被迫中止[3]。目前可启动苹果酸-乳酸发酵的乳酸菌有片球菌属、明串珠菌属、酒球菌属和乳杆菌属4个属,其中酒球菌属的酒类酒球菌(Oenococcus oeni)和乳杆菌属的植物乳杆菌(Lactobacillus plantarum)能够克服严苛的葡萄酒环境,被广泛应用于食品科学技术和发酵产品中[4]。目前,国内葡萄酒市场使用最广泛的苹果酸乳酸发酵剂是酒酒球菌,但是酒酒球菌发酵存在发酵时间长,能耗高的问题,且低pH、营养不足、高浓度乙醇等都能抑制菌的生长。只有在酒酒球菌浓度>1×108 CFU/mL,且在亚致死的酒精浓度下驯化时,才能启动并完成苹果酸乳酸发酵[5];而植物乳杆菌能在低pH条件下很好地发挥功能,对乙醇的耐受性高达14%,具有与酒酒球菌相似的耐受性,并且具有更多样化的酶活性,可以产生更多的芳香化合物,都有助于植物乳杆菌成为最新一代的葡萄酒苹果酸乳酸发酵剂。许多学者对植物乳杆菌的应用价值进行了详细研究,有学者从果酒中分离出优良的乳杆菌菌株,并将其应用于樱桃酒[6]、猕猴桃酒[7]、葡萄酒[8]的酿造与发酵,也有学者将乳清液作用于复配生产冷冻干燥植物乳杆菌发酵剂[9]。然而我国由于优良菌株和技术的缺失,目前仍大量依靠国外的商业发酵剂,难以展现我国本土的风土特性[10]。本研究选用实验室保藏的3株植物乳杆菌,研究了其在不同品种葡萄酒的苹果酸乳酸发酵过程菌密度的变化,对苹果酸降解率、糖代谢、花色苷和颜色等方面进行综合评价,旨在筛选出能够高效完成苹果酸乳酸发酵的植物乳杆菌。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株与培养基
植物乳杆菌XJ-25、XJ-14、XJA-2,分离自新疆赤霞珠葡萄酒中。所用菌株均采用MRS固体培养基划线培养,在37 ℃条件下培养7 h。
MRS液体培养基(g/L):葡萄糖 20,牛肉膏 10,蛋白胨 10,酵母膏 5,醋酸钠 5,Tween-80 1 mL/L,醋酸氢二钾 2,柠檬酸氢二铵 2,MgSO4·7H2O 0.2,MnSO4·H2O 0.05,半胱氨酸 0.5。
MRS固体培养基:液体培养基成分中添加15 g/L琼脂粉。
MLO-Ⅰ液体培养基(预适应培养基)(g/L):MRS 50,D-果糖 40,D-葡萄糖 20,L-苹果酸 4,Tween-80 1,维生素B6 0.1 mg/L,用1 mol/L HCl溶液调整pH为4.6,乙醇5%(体积分数)。
MLO-Ⅱ液体培养基(预适应培养基):在MLO-Ⅰ液体培养基的基础上, 用1 mol/L HCl溶液调整pH为3.5,乙醇10%(体积分数)。
1.1.2 供试酒样
供试酒样为酒精发酵结束(未启动苹果酸乳酸发酵,未添加SO2)的宁夏贺兰山东麓银川产区2019年耘岭酒庄酒赤霞珠葡萄酒,2019年九月兰山酒庄西拉葡萄酒,2020年张裕摩塞尔十五世酒庄蛇龙珠葡萄酒和2020年陕西玉川美乐葡萄酒。试验酒样的基本理化指标如表1所示。
表1 试验酒样基本理化指标
Table 1 Basic physical and chemical parameters of wine samples

葡萄品种酒度/%葡萄糖/(g·L-1)果糖/(g·L-1)总酸/(g·L-1)挥发酸/(g·L-1)FSO2/(mg·L-1)TSO2/(mg·L-1)pH赤霞珠14.54.02.47.20.2511453.56西拉 13.243.72.77.80.3020653.45美乐 12.793.82.56.80.2218563.60蛇龙珠13.73.42.17.00.3223643.57
1.1.3 主要试剂、仪器与设备
标准品L-苹果酸、L-乳酸(色谱纯),纯度≥99.0%,美国Sigma公司;标准品葡萄糖、果糖(色谱纯),纯度≥99.0%,Aladdin公司;MALOSTART®,法国LAFFORT公司;牛肉膏、蛋白胨、酵母膏、醋酸钠、Tween-80、醋酸氢二钾、柠檬酸氢二铵、MgSO4·7H2O、MnSO4·H2O,四川西陇化工有限公司;L-苹果酸、D-葡萄糖、D-果糖、维生素B6,索莱宝有限公司。
UV-2450 紫外分光光度计、BL-220H型电子天平、AUX 220型电子天平,日本岛津公司;HH-4 恒温水浴锅,上海森信试验仪器有限公司;Eppendorf Centrifuge 5417R1 离心机,德国Eppendorf公司;Milli-Q BiocelTM 超纯水仪,美国Millipore公司;Agilent 1260 Infinity Ⅱ 液相色谱,安捷伦科技有限公司。
1.2 试验方法
1.2.1 菌株的活化与转接
将3株植物乳杆菌甘油管从-80 ℃冰箱中取出,以1%的接种量接入MRS液体培养基中,在37 ℃培养箱培养9 h,然后以1%的接种量转接到新鲜MRS液体培养基中,培养6 h。
1.2.2 菌株的预适应培养
将3株植物乳杆菌分别以10%的接种量转接入MLO-Ⅰ(pH=4.6,乙醇5%)培养基中,培养48 h。再以10%的接种量转接入MLO-Ⅱ(pH=3.5,乙醇10%)培养基中,培养36 h。
1.2.3 苹果酸乳酸发酵
酒精发酵结束后的原酒用0.22 μm有机滤膜在超净工作台中进行过滤,加入0.2 g/L MALOSTART®(灭活酵母)混匀,低温(4 ℃)静置2 h。取MLO-Ⅱ 培养基中菌液,8 000 r/min离心10 min,用50 mL生理盐水洗涤,重复2次。330 mL厌氧瓶中装有280 mL葡萄酒,以5%的接种量分别接入植物乳杆菌XJ-25,XJ-14,XJA-2,最终浓度为1×108CFU/mL,在21 ℃条件下用厌氧瓶培养。把未接种任何菌株的葡萄酒作为对照组。
1.2.4 基本理化指标
对酒度、总酸、挥发酸、游离SO2和总SO2的测定方法参照文献[11]。
1.2.5 生物量测定
每隔24 h取样,用质量分数为0.75%的生理盐水连续稀释,取100 μL涂布在含有100 mg/L放线菌酮的MRS-琼脂培养基上,将平板在37 ℃下培养60 h后进行乳酸菌的计数。
1.2.6 有机酸和糖
每隔8 h取样监测有机酸。将葡萄酒样品用超纯水稀释5倍,用0.22 μm有机滤膜过滤后用于Agilent 1260 Infinity Ⅱ HPLC分析。标准品苹果酸和乳酸配制质量浓度分别为1、0.8、0.6、0.4、0.2、0.1、0.05、0.01 g/L的系列标准溶液,0.22 μm水系滤膜过滤后用于HPLC测试。色谱条件:色谱柱为BioRad Aminex HPX 87-H (300 mm×7.8 mm),流动相为5 mmol/L H2SO4溶液,流速为1.0 mL/min,柱温为60 ℃,进样量为20 μL,检测波长210 nm。
发酵结束后取样检测还原糖、乙醇。标准品葡萄糖和果糖配制质量浓度分别为0.6、0.4、0.2、0.1、0.05、0.01 g/L的系列标准溶液,标准品乙醇配制质量浓度分别为2、1.5、1、0.5、0.1、0.05 g/L的系列标准溶液,用0.22 μm水系滤膜过滤后用于HPLC测试。葡萄酒样品用超纯水稀释10倍,用0.22 μm有机滤膜过滤后用于HPLC分析。Agilent 1260 Infinity Ⅱ 折光示差检测器,检测器温度40 ℃。色谱条件同有机酸相同,进样量为20 μL。
1.2.7 花色苷测定方法
参考YANG等[12]的方法,采用HPLC进行分析。以二甲花翠素-3-O-葡萄糖苷为标准品,根据保留时间与最大吸收波长,确定花色苷种类,对样品的花色苷进行定量分析。HPLC条件:色谱柱为Kromasil 100-5-C18(250 mm×4.6 mm×5 μm);流动相A为V(超纯水)∶V(乙睛)∶V(甲酸)=8∶4∶1;流动相B为V(超纯水)∶V(乙睛)∶V(甲酸)=4∶4∶1。洗脱程序为:0~45 min:0%~35% B;45~46 min:35%~100% B;46~50 min:100% B;50~51 min:100% ~0% B;51~55 min:0% B。进样量为20 μL;流速1.0 mL/min;柱温35 ℃;检测波长520 nm。葡萄酒样品用0.22 μm有机滤膜过滤后用于HPLC分析。
1.2.8 颜色参数CIELAB的测定
具体参照李运奎等[13]的方法,葡萄酒样品经0.45 μm有机系滤膜过滤后,以去离子水作为参比。用1 mm玻璃比色皿,连续扫描可见光区400~780 nm UV-Visible谱段,扫描间隔1 nm。取450、520、570、630 nm处测定的吸光度并校正到1 cm光程后[14],计算CIELAB参数a*(与红色相关)、b*(与黄色相关)和L*(澄清度)![]() 和
和![]()
1.2.9 数据处理
采用SPSS 18.0对试验数据进行差异性分析(analysis of variance,ANOVA)检查各个结果的显著性差异,组间多重比较采用Duncan法,P<0.05,差异显著,P<0.01,差异极显著。采用Origin 2021b作图。
2 结果与分析
2.1 不同品种葡萄酒中植物乳杆菌的生长量变化
本试验中,植物乳杆菌在不同品种葡萄酒的苹果酸乳酸发酵期间生物量的动态变化如图1所示。
由图1可知,3株植物乳杆菌经过适应性培养后接入4个不同品种的葡萄酒中,活菌数均保持在8 lgCFU/mL。在赤霞珠葡萄酒中,3株植物乳杆菌的活菌数均呈现出短暂的上升趋势,然后快速下降,在120 h后缓慢下降。美乐葡萄酒中,XJ-25的活菌数在前64 h呈现快速下降的趋势,而后上升再下降,120 h后稳定在6.8 lgCFU/mL。与卜潇等[8]的研究相比,经过MLO适应性培养基预驯化的植物乳杆菌在葡萄酒中具有更高的存活率。PASSOS等[15]的研究表明,在添加2或10 mmol/L苹果酸的培养基中,植物乳杆菌的生长速率提高且最大细胞产量增加。BRAVO-FERRADA等[16]表明植物乳杆菌经过含有体积分数为6%或10%乙醇的MLO(pH=4.6)培养基预驯化后,能够显著减少细胞膜损伤并提高菌株在高酒精度高酸度葡萄酒中的生存能力。同时,膜完整性是保证L-苹果酸降解的关键因素。

a-赤霞珠葡萄酒;b-美乐葡萄酒;c-西拉葡萄酒;d-蛇龙珠葡萄酒
图1 不同品种葡萄酒苹果酸乳酸发酵过程中植物乳杆菌的生长量动态变化
Fig.1 Dynamic changes of biomass in different varieties of wines during malolactic fermentation by L.plantarum
2.2 植物乳杆菌发酵不同品种葡萄酒过程中苹果酸-乳酸的动态变化
如图2所示,在赤霞珠葡萄酒中,前64 h内,XJ-25消耗苹果酸速率最快,72 h以后,3株菌都能完全消耗苹果酸(<0.2 g/L),苹果酸含量由2.27 g/L下降至0.17 g/L左右。苹果酸乳酸发酵期间苹果酸含量与乳酸呈显著负相关,乳酸生成速率与苹果酸降解速率基本一致,72 h以后乳酸含量达到最大值2.09 g/L。在西拉葡萄酒中,XJ-14在前88 h内均保持较高的苹果酸消耗速率,降至0.28 g/L;88 h后,XJA-2将苹果酸降至1.26 g/L后保持不变。最终XJ-14和XJA-2生成乳酸的含量分别为2.83、2.3 g/L。在美乐葡萄酒中,144 h内苹果酸均呈现缓慢降低的趋势,XJ-14为降酸最快的菌株,将苹果酸降至0.38 g/L;XJ-25与XJA-2降酸速率相似,在144 h内降低了72.63%。XJ-14的乳酸含量从0.42 g/L上升至1.82 g/L。在蛇龙珠葡萄酒中,3株菌在56 h内均能够将苹果酸消耗彻底,且3株菌消耗苹果酸的速率和生成乳酸的速率基本一致;发酵结束时,乳酸终含量平均为2.03 g/L。
XJ-14对赤霞珠、西拉、美乐、蛇龙珠葡萄酒中的苹果酸降解率分别达到90.67%、90.15%、84.35%、92.20%,能够对苹果酸完全降解(<0.2 g/L),表现出良好的降酸能力。与卜潇等[8]的研究相比,植物乳杆菌经过预适应培养,且在过滤后的葡萄酒中添加了乳酸菌营养剂MALOSTART®之后,相同的菌株能够完全消耗苹果酸。BRAVO-FERRADA等[17]将经过MLO培养基预适应的植物乳杆菌在含有4.5 g/L苹果酸的模拟酒中进行发酵,苹果酸消耗率显著提高21%~43%。Fiano葡萄酒中,经过预适应培养的植物乳杆菌M10在未添加营养剂的葡萄酒中几乎无法代谢苹果酸[18]。因此,预适应培养与乳酸菌营养剂都是植物乳杆菌是否能够完全消耗苹果酸的关键因素。
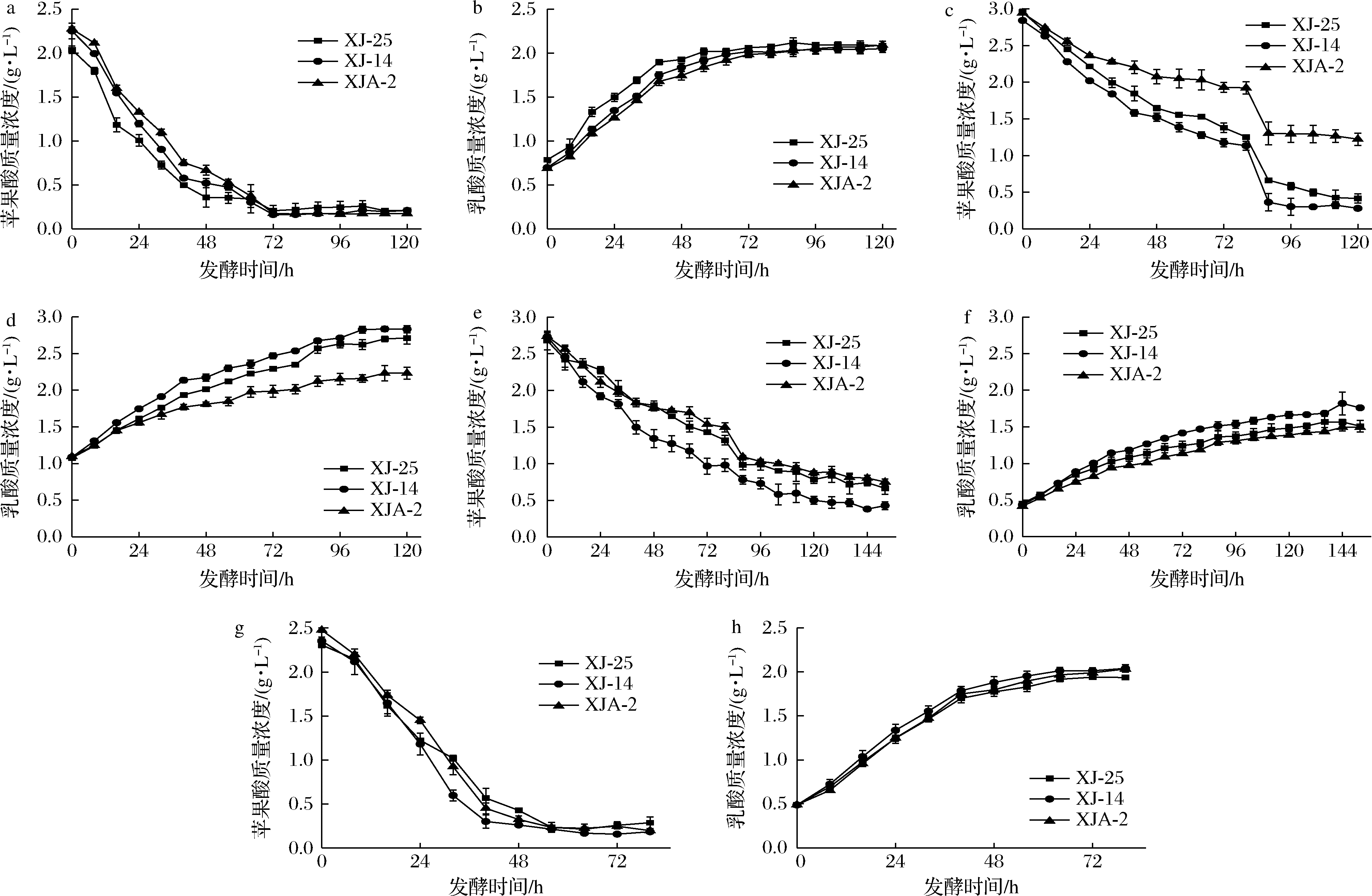
a-赤霞珠葡萄酒中苹果酸含量;b-赤霞珠葡萄酒中乳酸含量;c-美乐葡萄酒中苹果酸含量;d-美乐葡萄酒中乳酸含量; e-西拉葡萄酒中苹果酸含量;f-西拉葡萄酒中乳酸含量;g-蛇龙珠葡萄酒中苹果酸含量;h-蛇龙珠葡萄酒中乳酸含量
图2 不同品种葡萄酒苹果酸乳酸发酵过程中苹果酸和乳酸动态变化
Fig.2 Dynamic changes of malic acid and lactic acid concentration in different varieties of wines during malolactic fermentation by L.plantarum
2.3 植物乳杆菌发酵不同品种葡萄酒还原糖与酒精度的变化
由表2可知,苹果酸乳酸发酵结束后,葡萄糖和果糖被大量利用。在4个不同品种的葡萄酒中,3株菌对葡萄糖的消耗率均达到80%以上,XJ-14在西拉葡萄酒中的葡萄糖消耗率最高,为87.47%。而3株菌对果糖的消耗率为30.77%~74.75%不等,XJ-14在西拉葡萄酒中的果糖消耗率也最高,为74.75%,XJA-2在西拉葡萄酒中果糖消耗率最低,为30.7%。除了美乐葡萄酒,其他品种葡萄酒的乙醇含量均有所上升。在大量苹果酸被消耗后,葡萄酒的pH值略微上升,此时葡萄酒中剩余还原糖作为碳源仍可以被乳酸菌继续利用。
表2 植物乳杆菌发酵不同品种葡萄酒还原糖与酒精度的变化
Table 2 Reducing sugar and ethanol content in different varieties of wines after malolactic fermentation by L.plantarum

指标品种酒精发酵结束未接种XJ-25XJ-14XJA-2赤霞珠4.1±0.07a3.92±0.21a0.60±0.01c0.77±0.05bc0.80±0.07b葡萄糖/(g·L-1)西拉 3.67±0.14a3.19±0.11b0.52±0.09c0.46±0.07c0.61±0.08c美乐 3.8±0.36a3.86±0.09a0.61±0.07b0.58±0.02b0.62±0.09b蛇龙珠3.32±0.16a2.99±0.13b0.64±0.01c0.62±0.04c0.65±0.08c赤霞珠2.43±0.13a2.49±0.19a1.04±0.09c1.06±0.03c1.37±0.07b果糖/(g·L-1)西拉 2.73±0.19b3.15±0.22a0.85±0.08d0.75±0.04d1.89±0.09c美乐 2.5±0.36a2.57±0.39a1.16±0.23b1.23±0.04b1.49±0.17b蛇龙珠2.02±0.18b2.50±0.45a0.62±0.03c0.51±0.05c0.63±0.19c赤霞珠11.35±0.2d11.45±0.28cd11.74±0.03bc11.91±0.25ab12.16±0.02a乙醇(体积分数)/%西拉 12.55±0.1b13.28±0.16a13.32±0.22a13.41±0.12a13.54±0.14a美乐 13.35±0.2a13.06±0.25b12.67±0.06c12.82±0.11bc12.77±0.03bc蛇龙珠13.67±0.14bc13.49±0.03c13.62±0.19c14.12±0.43ab14.38±0.26a
注:同行不同小写字母表示差异显著(P<0.05)
2.4 植物乳杆菌发酵结束后的花色苷含量
通过HPLC共检出9种单体花色苷,包括5种非酰化的花色苷、1种乙酰化的花色苷和3种香豆酰酰化的花色苷。检测结果与HE等[19]一致,欧亚种葡萄酒中的花色苷主要是由5种基本花色苷及其乙酰、香豆酰酰化的衍生物构成。
如图3所示,苹果酸乳酸发酵结束后,所检测到的9种花色苷,其含量在4个品种的葡萄酒中各不相同,花色苷总含量最高的为西拉葡萄酒,为27.42 mg/L。赤霞珠葡萄酒中总花色苷含量最低,仅有13.32 mg/L。未接种乳酸菌的葡萄酒,在21 ℃条件下静置120 h后,单体花色苷总含量均有不同程度的损失,损失率为21.62%(赤霞珠)~67.80%(西拉)。这可能是由于花色苷与乙醛、苯乙烯、丙酮酸进行缩合,形成聚合花色苷[20]。经过植物乳杆菌发酵后,赤霞珠葡萄酒中花色苷总含量均增加了5倍,而蛇龙珠葡萄酒的花色苷总含量损失了44.97%~88.46%。Pn 3-O-Glu为赤霞珠和西拉葡萄酒中的主导单体花色苷,分别占总花色苷的60.44%和60.80%,Pn 3-acetylglc 次之,约占总花色苷的15%。Mv 3-O-Glu和Mv 3-acetylglc是美乐和蛇龙珠葡萄酒中2种主导的单体花色苷,分别占葡萄酒中总花色苷的61.88%和74.13%。经过苹果酸乳酸发酵,Mv 3-O-Glu成为赤霞珠葡萄酒的主导花色苷,含量上升至51.97~57.63 mg/L,占花色苷总含量的65.14%~65.65%。在西拉葡萄酒中观察到同样的现象。梁娜娜等[21]研究发现,葡萄酒酿造过程中各类单体花色苷呈现下降趋势,较酒精发酵结束后浸渍分汁相比,马瑟兰在经过苹乳发酵后总花色苷含量有所增加,主要为二甲花翠素类花色苷含量增加。这与我们在赤霞珠和西拉葡萄酒中观察到的一致。
2.5 不同品种葡萄酒的CIELAB参数
发酵结束后不同品种葡萄酒的CIELAB参数如表3所示。在所有酒样中,西拉的L*值最高,光泽度最好。所有处理组的a*>35, b*<10,表明了酒体颜色中红色色调占比较大,黄色占比较少。在赤霞珠和美乐葡萄酒中,XJ-25的L*值最高,光泽度最好;在西拉葡萄酒中,XJ-14的L*值最高,光泽度最好;在蛇龙珠葡萄酒中,XJA-2的L*值最高,光泽度最好。饱和度![]() 表征葡萄酒颜色的色彩饱和程度,色调角 hab 表征色彩的总体倾向,取值0°、90°、180°和270°分别为红色、黄色、绿色和蓝色色调[22]。供试酒样的饱和度
表征葡萄酒颜色的色彩饱和程度,色调角 hab 表征色彩的总体倾向,取值0°、90°、180°和270°分别为红色、黄色、绿色和蓝色色调[22]。供试酒样的饱和度![]() 较高、色调角hab较低,酒体色彩饱和度较好并呈紫红或宝石红(新红葡萄酒颜色特征),外观品质较好。如表3所示,在西拉和美乐葡萄酒中XJA-2的
较高、色调角hab较低,酒体色彩饱和度较好并呈紫红或宝石红(新红葡萄酒颜色特征),外观品质较好。如表3所示,在西拉和美乐葡萄酒中XJA-2的![]() 最高,色彩饱和程度最好。总色差
最高,色彩饱和程度最好。总色差![]() 差异较大,说明不同处理组之间葡萄酒的颜色差异显著,其中,所有处理酒样的总色差
差异较大,说明不同处理组之间葡萄酒的颜色差异显著,其中,所有处理酒样的总色差![]() 表明单独发酵处理与对照处理酒样的色彩差异已达到强烈程度[22]。在赤霞珠、西拉、美乐葡萄酒中,XJ25和XJ14的
表明单独发酵处理与对照处理酒样的色彩差异已达到强烈程度[22]。在赤霞珠、西拉、美乐葡萄酒中,XJ25和XJ14的![]() 较大,表示该酒样与对照处理酒样的色彩差异已经达到浓烈的程度。
较大,表示该酒样与对照处理酒样的色彩差异已经达到浓烈的程度。

a-Dp-3-O-Glu含量;b-Cy-3-O-Glu含量;c-Pt-3-O-Glu含量;d-Pn-3-O-Glu含量; e-Mv-3-O-Glu含量;f-Pn 3-acetylglc含量;g-Mv 3-acetylglc含量;h-Pn 3-p-coumglc trans含量;i-Mv 3-p-coumglc trans含量
图3 发酵结束后不同品种葡萄酒花色苷含量
Fig.3 The anthocyanin concentration in different varieties of wines after malolactic fermentation
注:Dp 3-O-Glu(花翠素 3-O-葡萄糖苷),Cy 3-O-Glu(花青素3-O-葡萄糖苷),Pt 3-O-Glu(3′-甲花翠素 3-O-葡萄糖苷), Pn 3-O-Glu(甲基花青素 3-O-葡萄糖苷),Mv 3-O-Glu(二甲花翠素 3-O-葡萄糖苷),Pn 3-acetylglc[甲基花青素 3-O-(6-O-乙酰基)-葡萄糖苷], Mv 3-acetylglc[二甲花翠素 3-O-(6-O-乙酰基)-葡萄糖苷],Pn 3-p-coumglc trans[甲基花青素3-O-(6-O-反式-对香豆酰基]-葡萄糖苷), Mv 3-p-coumglc trans[二甲花翠素 3-O-(6-O-反式-对香豆酰基)-葡萄糖苷]
以4组酒精发酵刚结束的酒样处理的CIELAB数据分别作为4组基值,对供试16个酒样进行色差计算分析,ΔL*、Δa*、Δb*的绝对值大部分>1.5,说明16个处理间色差程度差异明显。所有处理的ΔL*<0,说明经过苹果酸乳酸发酵的酒样的颜色均暗于酒精发酵结束的葡萄酒,其中XJ-25处理酒样的颜色最暗。这说明经过苹果酸乳酸发酵后,葡萄酒的颜色会变得老熟,色度会降低,这与之前的研究相一致[23]。16组酒样的Δa*>0,说明所有处理酒样颜色中的红色色调显著高于对照处理;Δb*值为正数表明偏黄,值为负数表明偏蓝。所有处理Δb*<0,说明整体颜色偏蓝。在赤霞珠、美乐、蛇龙珠葡萄酒中,XJ-25处理酒样的颜色都最暗,XJ-14处理酒样的颜色都最亮。经过苹果酸乳酸发酵,XJA-2发酵的葡萄酒的色彩饱和程度最好;XJ-14发酵的葡萄酒颜色最亮。
2.6 发酵结束后不同品种葡萄酒中花色苷与CIEAB参数的相关系数
花色苷是葡萄酒主要的呈色物质,其含量和结构稳定性对葡萄酒感官品质具有重要影响[24]。在葡萄酒酿造过程中,花色苷的组成及含量的变化会影响CIELAB颜色参数的变化,二者具有一定的相关性[21]。
将9种单体花色苷与对应的葡萄酒颜色参数进行相关性分析(表4)可知。不同品种的葡萄酒经过植物乳杆菌发酵后,花色苷与葡萄酒的CIELAB参数之间有一定的相关性。Dp 3-O-Glu、Pt 3-O-Glu、Mv 3-O-Glu、Pn-3-acetylglc、Mv-3-acetylglc与Mv-3-p-coumglc trans都呈极显著正相关。b*与 Cy 3-O-Glu、Pn 3-O-Glu的相关性均<-0.60,呈极显著负相关,b*值升高(黄色色调增高,紫红色调降低),即相关物质含量降低。由表4可知,这2种物质在赤霞珠葡萄酒中显著降低。L*与a*呈极显著负相关,b*与a*呈显著负相关。
表3 发酵结束后不同品种葡萄酒的CIELAB参数
Table 3 The CIELAB parameters of different varieties of wines after malolactic fermentation
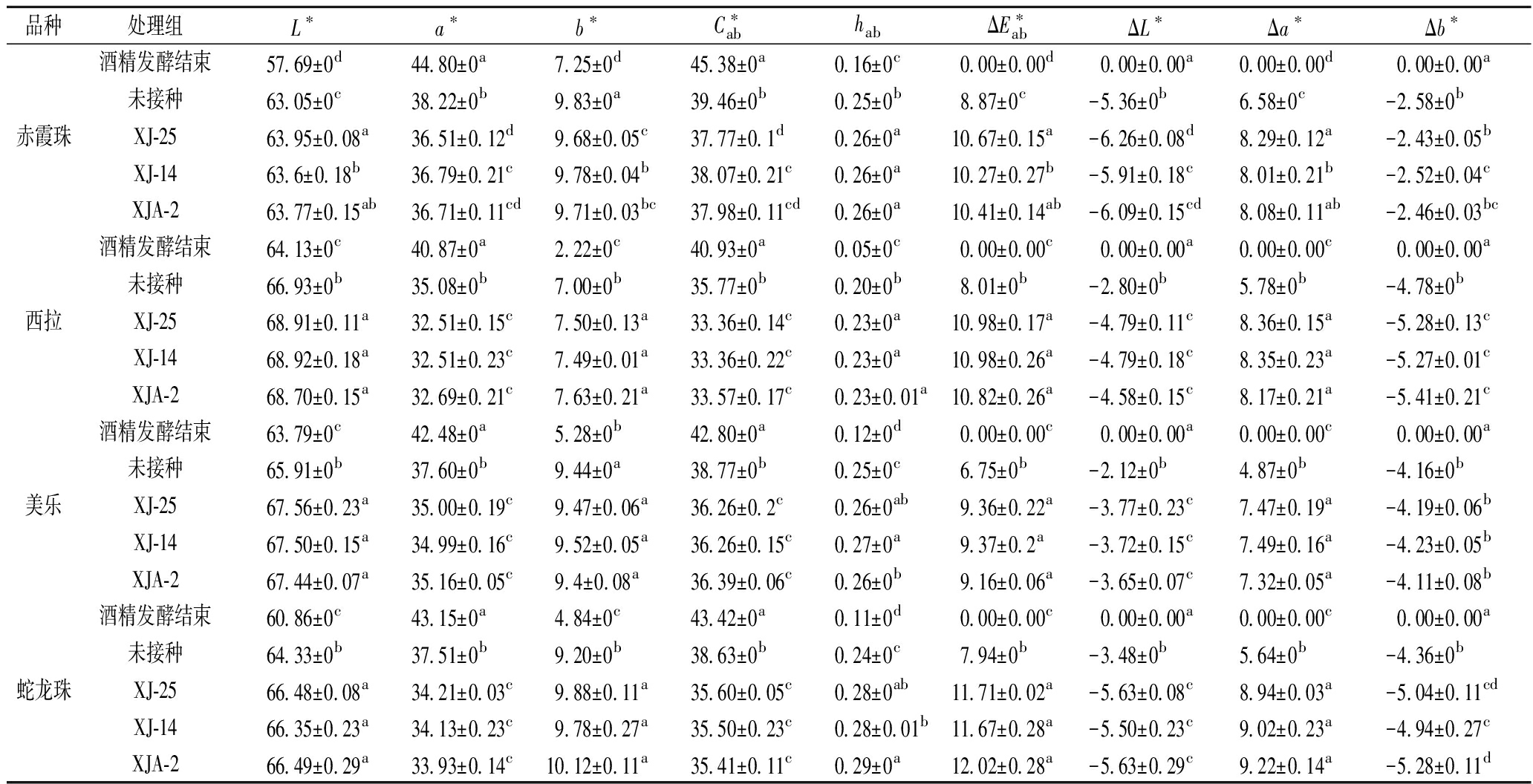
品种处理组L∗a∗b∗C∗abhabΔE∗abΔL∗Δa∗Δb∗酒精发酵结束57.69±0d44.80±0a7.25±0d45.38±0a0.16±0c0.00±0.00d0.00±0.00a0.00±0.00d0.00±0.00a未接种63.05±0c38.22±0b9.83±0a39.46±0b0.25±0b8.87±0c-5.36±0b6.58±0c-2.58±0b赤霞珠XJ-2563.95±0.08a36.51±0.12d9.68±0.05c37.77±0.1d0.26±0a10.67±0.15a-6.26±0.08d8.29±0.12a-2.43±0.05bXJ-1463.6±0.18b36.79±0.21c9.78±0.04b38.07±0.21c0.26±0a10.27±0.27b-5.91±0.18c8.01±0.21b-2.52±0.04cXJA-263.77±0.15ab36.71±0.11cd9.71±0.03bc37.98±0.11cd0.26±0a10.41±0.14ab-6.09±0.15cd8.08±0.11ab-2.46±0.03bc酒精发酵结束64.13±0c40.87±0a2.22±0c40.93±0a0.05±0c0.00±0.00c0.00±0.00a0.00±0.00c0.00±0.00a未接种66.93±0b35.08±0b7.00±0b35.77±0b0.20±0b8.01±0b-2.80±0b5.78±0b-4.78±0b西拉XJ-2568.91±0.11a32.51±0.15c7.50±0.13a33.36±0.14c0.23±0a10.98±0.17a-4.79±0.11c8.36±0.15a-5.28±0.13cXJ-1468.92±0.18a32.51±0.23c7.49±0.01a33.36±0.22c0.23±0a10.98±0.26a-4.79±0.18c8.35±0.23a-5.27±0.01cXJA-268.70±0.15a32.69±0.21c7.63±0.21a33.57±0.17c0.23±0.01a10.82±0.26a-4.58±0.15c8.17±0.21a-5.41±0.21c酒精发酵结束63.79±0c42.48±0a5.28±0b42.80±0a0.12±0d0.00±0.00c0.00±0.00a0.00±0.00c0.00±0.00a未接种65.91±0b37.60±0b9.44±0a38.77±0b0.25±0c6.75±0b-2.12±0b4.87±0b-4.16±0b美乐XJ-2567.56±0.23a35.00±0.19c9.47±0.06a36.26±0.2c0.26±0ab9.36±0.22a-3.77±0.23c7.47±0.19a-4.19±0.06bXJ-1467.50±0.15a34.99±0.16c9.52±0.05a36.26±0.15c0.27±0a9.37±0.2a-3.72±0.15c7.49±0.16a-4.23±0.05bXJA-267.44±0.07a35.16±0.05c9.4±0.08a36.39±0.06c0.26±0b9.16±0.06a-3.65±0.07c7.32±0.05a-4.11±0.08b酒精发酵结束60.86±0c43.15±0a4.84±0c43.42±0a0.11±0d0.00±0.00c0.00±0.00a0.00±0.00c0.00±0.00a未接种64.33±0b37.51±0b9.20±0b38.63±0b0.24±0c7.94±0b-3.48±0b5.64±0b-4.36±0b蛇龙珠XJ-2566.48±0.08a34.21±0.03c9.88±0.11a35.60±0.05c0.28±0ab11.71±0.02a-5.63±0.08c8.94±0.03a-5.04±0.11cdXJ-1466.35±0.23a34.13±0.23c9.78±0.27a35.50±0.23c0.28±0.01b11.67±0.28a-5.50±0.23c9.02±0.23a-4.94±0.27cXJA-266.49±0.29a33.93±0.14c10.12±0.11a35.41±0.11c0.29±0a12.02±0.28a-5.63±0.29c9.22±0.14a-5.28±0.11d
注:同列不同小写字母表示差异显著(P<0.05)
表4 发酵结束后不同品种葡萄酒中花色苷与CLEAB参数的相关系数 Fig.4 The correlation coefficients of anthocyanins and CIELAB of different varieties of wines after malolactic fermentation
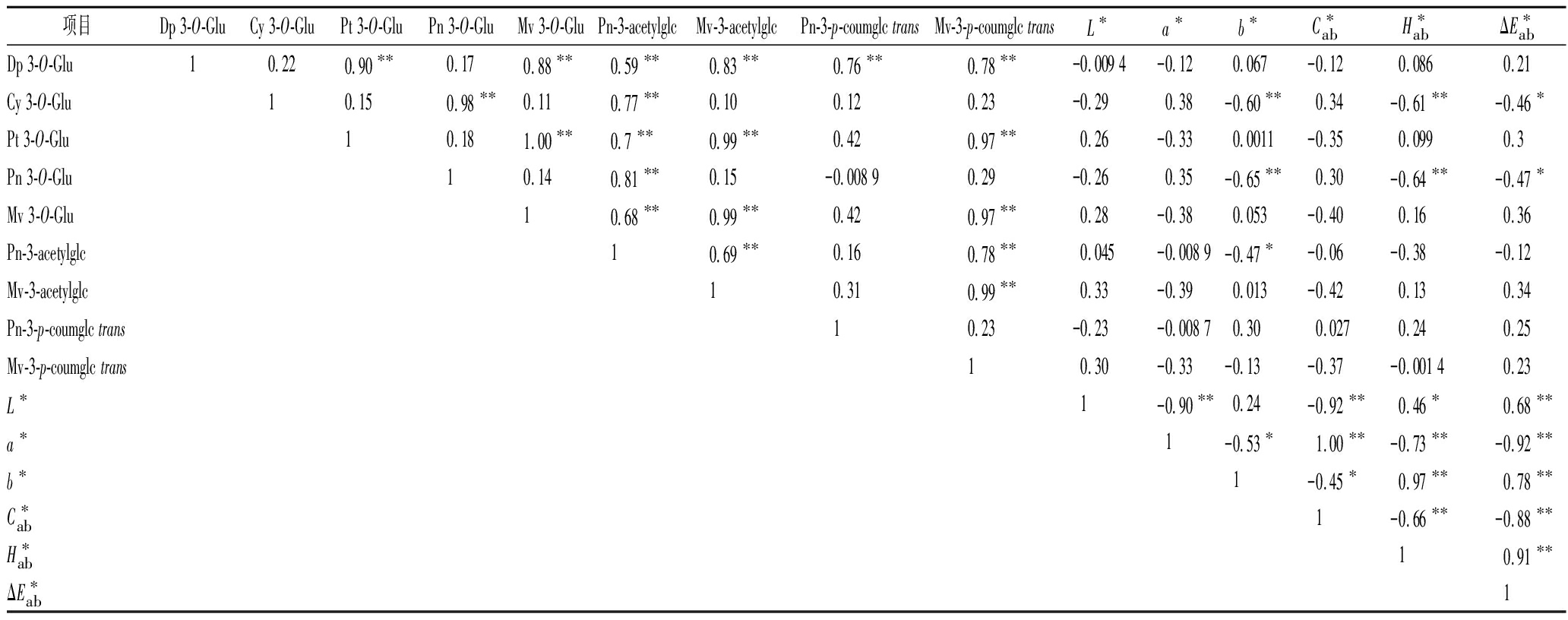
项目Dp 3-O-GluCy 3-O-GluPt 3-O-GluPn 3-O-GluMv 3-O-GluPn-3-acetylglcMv-3-acetylglcPn-3-p-coumglc transMv-3-p-coumglc transL∗a∗b∗C∗abH∗abΔE∗abDp 3-O-Glu10.220.90∗∗0.170.88∗∗0.59∗∗0.83∗∗0.76∗∗0.78∗∗-0.009 4-0.120.067-0.120.0860.21Cy 3-O-Glu10.150.98∗∗0.110.77∗∗0.100.120.23-0.290.38-0.60∗∗0.34-0.61∗∗-0.46∗Pt 3-O-Glu10.181.00∗∗0.7∗∗0.99∗∗0.420.97∗∗0.26-0.330.0011-0.350.0990.3Pn 3-O-Glu10.140.81∗∗0.15-0.008 90.29-0.260.35-0.65∗∗0.30-0.64∗∗-0.47∗Mv 3-O-Glu10.68∗∗0.99∗∗0.420.97∗∗0.28-0.380.053-0.400.160.36Pn-3-acetylglc10.69∗∗0.160.78∗∗0.045-0.008 9-0.47∗-0.06-0.38-0.12Mv-3-acetylglc10.310.99∗∗0.33-0.390.013-0.420.130.34Pn-3-p-coumglc trans10.23-0.23-0.008 70.300.0270.240.25Mv-3-p-coumglc trans10.30-0.33-0.13-0.37-0.001 40.23L∗1-0.90∗∗0.24-0.92∗∗0.46∗0.68∗∗a∗1-0.53∗1.00∗∗-0.73∗∗-0.92∗∗b∗1-0.45∗0.97∗∗0.78∗∗C∗ab1-0.66∗∗-0.88∗∗H∗ab10.91∗∗ΔE∗ab1
注:“*”表示显著相关(P<0.05);“**”表示极显著相关(P <0.01)
3 结论
在本研究中,分离自新疆赤霞珠葡萄酒的3株植物乳杆菌在4个不同品种的葡萄酒中均表现出较高的菌密度和良好的降酸能力。其中,XJ-25和XJ-14在不同条件的葡萄酒环境中都能够保持较高的菌密度,有利于进行苹果酸乳酸发酵。XJ-25在不同葡萄酒中积累的花色苷含量较多,但发酵后的酒样色度下降明显,颜色老熟。XJ-14在不同葡萄酒环境中苹果酸降解能力都最强,且发酵后的酒样颜色最亮,具有良好的外观品质。XJA-2发酵后的酒样色彩饱和度最高,但是在活菌数、糖酸代谢、花色苷积累方面能力都较弱。因此整体来看,XJ-14的苹果酸乳酸发酵性能更为突出,更具有成为优良发酵剂的商业化潜力。
[1] 张春晖, 王华, 李华.苹果酸-乳酸发酵对干红葡萄酒品质的影响[J].西北农业大学学报, 1999,27(6):74-78.
ZHANG C H, WANG H, LI H.Effects of malolactic fermentation on dry red wine quality[J].The Journal of Northwest Agricultural University, 1999,27(6):74-78.
[2] 李华. 现代葡萄酒工艺学[M].西安:陕西人民出版社, 2000.
LI H.Modern Enology[M].Xi′an:Shaanxi People′s Press, 2000.
[3] LAFON-LAFOURCADE S, CARRE E, RIBÉREAU-GAYON P.Occurrence of lactic acid bacteria during the different stages of vinification and conservation of wines[J].Applied and Environmental Microbiology, 1983, 46(4):874-880.
[4] VALDÉS LA HENS D, BRAVO-FERRADA B M, DELFEDERICO L, et al.Prevalence of Lactobacillus plantarum and Oenococcus oeni during spontaneous malolactic fermentation in Patagonian red wines revealed by polymerase chain reaction-denaturing gradient gel electrophoresis with two targeted genes[J].Australian Journal of Grape and Wine Research, 2015, 21(1):49-56.
[5] BRIZUELA N S, BRAVO-FERRADA B M, LA HENS D V, et al.Comparative vinification assays with selected Patagonian strains of Oenococcus oeni and Lactobacillus plantarum[J].LWT-Food Science and Technology, 2017, 77:348-355.
[6] SUN S Y, GONG H S, LIU W L, et al.Application and validation of autochthonous Lactobacillus plantarum starter cultures for controlled malolactic fermentation and its influence on the aromatic profile of cherry wines[J].Food Microbiology, 2016, 55:16-24.
[7] 李静, 樊明涛, 孙慧烨.植物乳杆菌对猕猴桃酒降酸效果的研究[J].食品工业科技, 2016, 37(1):165-169.
LI J, FAN M T, SUN H Y.Effect of Lactobacillus plantarum on the deacification of kiwifruit wine[J].Science and Technology of Food Industry, 2016, 37(1):165-169.
[8] 卜潇, 薛雪, 程静, 等.葡萄酒中植物乳杆菌苹果酸-乳酸发酵潜能评价[J].中国农业科学, 2017, 50(5):959-968.
BU X, XUE X, CHENG J, et al.Evaluation on malolactic fermentation potential of wine Lactobacillus plantarum[J].Scientia Agricultura Sinica, 2017, 50(5):959-968.
[9] BRIZUELA N S, ARNEZ-ARANCIBIA M, SEMORILE L, et al.Whey permeate as a substrate for the production of freeze-dried Lactiplantibacillus plantarum to be used as a malolactic starter culture[J].World Journal of Microbiology & Biotechnology, 2021, 37(7):1-12.
[10] 张莉. 葡萄酒MLF优良乳酸菌发酵剂制备关键技术研究[D].保定:河北农业大学, 2016.
ZHANG L.Study on key technology of preparation of starter for superior wine MLF lactic acid bacteria[D].Baoding:Hebei Agricultural University, 2016.
[11] 王华. 葡萄酒分析检验[M].北京:中国农业出版社, 2011.
WANG H.Wine Analysis and Testing[M].Beijing:China Agriculture Press, 2011.
[12] YANG P, YUAN C L, WANG H, et al.Stability of anthocyanins and their degradation products from Cabernet Sauvignon red wine under gastrointestinal pH and temperature conditions[J].Molecules, 2018, 23(2):354.
[13] 李运奎, 韩富亮, 张予林, 等.基于CIELAB色空间的红葡萄酒颜色直观表征[J].农业机械学报, 2017, 48(6):296-301.
LI Y K, HAN F L, ZHANG Y L, et al.Visualization for representation of red wine color based on CIELAB color space[J].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(6):296-301.
[14] BOISIER B, MANSOURI A, GOUTON P, et al.Wine color characterization and classification for nuances reproduction[C]//2009 Fifth International Conference on Signal Image Technology and Internet Based Systems.Marrakech:IEEE Computer Society, 2009:93-98.
[15] PASSOS F V, FLEMING H P, HASSAN H M, et al.Effect of malic acid on the growth kinetics of Lactobacillus plantarum[J].Applied Microbiology and Biotechnology, 2003, 63(2):207-211.
[16] BRAVO-FERRADA B M, TYMCZYSZYN E E, G MEZ-ZAVAGLIA A, et al.Effect of acclimation medium on cell viability, membrane integrity and ability to consume malic acid in synthetic wine by oenological Lactobacillus plantarum strains[J].Journal of Applied Microbiology, 2014, 116(2):360-367.
MEZ-ZAVAGLIA A, et al.Effect of acclimation medium on cell viability, membrane integrity and ability to consume malic acid in synthetic wine by oenological Lactobacillus plantarum strains[J].Journal of Applied Microbiology, 2014, 116(2):360-367.
[17] BRAVO-FERRADA B M, HOLLMANN A, BRIZUELA N, et al.Growth and consumption of L-malic acid in wine-like medium by acclimated and non-acclimated cultures of Patagonian Oenococcus oeni strains[J].Folia Microbiologica, 2016, 61(5):365-373.
[18] LOMBARDI S J, PANNELLA G, IORIZZO M, et al.Inoculum strategies and performances of malolactic starter Lactobacillus plantarum M10:Impact on chemical and sensorial characteristics of Fiano wine[J].Microorganisms, 2020, 8(4):516.
[19] HE F, LIANG N N, MU L, et al.Anthocyanins and their variation in red wines I.Monomeric anthocyanins and their color expression[J].Molecules, 2012, 17(2):1 571-1 601.
[20] LIU Y, ZHANG X K, SHI Y, et al.Reaction kinetics of the acetaldehyde-mediated condensation between (-)-epicatechin and anthocyanins and their effects on the color in model wine solutions[J].Food Chemistry, 2019, 283:315-323.
[21] 梁娜娜, 韩深, 何非, 等.几种红葡萄酿酒过程中花色苷组成与CIELab参数的相关分析[J].中国酿造, 2014, 33(1):48-55.
LIANG N N, HAN S, HE F, et al.Correlation analysis of anthocyanin compositions and CIELab parameters during the process of wine fermentation by several red grape varieties[J].China Brewing, 2014, 33(1):48-55.
[22] 雷用东, 邓小蓉, 罗瑞峰, 等.3种颜色体系在食品应用中的研究进展[J].食品科学, 2016, 37(1):241-246.
LEI Y D, DENG X R, LUO R F, et al.Progress in the application of three types of color system in color measurement of foods[J].Food Science, 2016, 37(1):241-246.
[23] 李华, 王华, 袁春龙.葡萄酒工艺学[M].北京:科学出版社, 2007.
LI H, WANG H, YUAN C L, et al.Wine Technology[M].Beijing:Science Press, 2007.
[24] 苗丽平, 赵新节, 韩爱芹, 等.红葡萄酒中花色苷的影响因素[J].酿酒科技, 2016(2):40-46.
MIAO L P, ZHAO X J, HAN A Q, et al.The main influencing factors of anthocyanins in red wine[J].Liquor-Making Science & Technology, 2016(2):40-46.