核桃又名胡桃、羌桃,属胡桃科胡桃属植物,在我国有1 700年的栽种历史。核桃仁味甘性平,具有健胃、补血、润肺、益肾和补脑等功效,其蛋白质及不饱和脂肪酸含量丰富,谷氨酸和精氨酸的占比较高,是一种较优质的植物蛋白资源[1]。
多酚类化合物是植物体内复杂次生的多元酚结构代谢物,因其具有抗氧化、抗炎、抑菌、降低心血管风险等作用[2],常作为添加剂和功能性成分应用于食品行业。在一些食品的加工过程中,多酚常与蛋白质共存并发生共价或非共价相互作用,改变蛋白质的结构和性质,进而影响食品的感官、功能和营养特性[2-3]。研究表明,多酚可在一定程度上降低面筋蛋白聚合物的尺寸和强度[4];提高蛋白质的溶解性、消化性、抗氧化性及界面性质[5-7];诱导蛋白质的二级、三级结构改变[8-11];影响蛋白质的表面疏水性及水包油乳状液的物理和氧化稳定性等[12-13]。
目前,多酚与植物蛋白互作的研究主要以大豆蛋白、面筋蛋白为主,而核桃蛋白作为植物蛋白重要来源之一,却鲜有相关研究报道。因此本研究分别采用8种常见的多酚(阿魏酸、白藜芦醇、橙皮素、儿茶素、槲皮素、姜黄素、没食子酸、杨梅素)与核桃蛋白制备复合物,研究多酚对其加工性质和光谱特性的影响,探讨核桃蛋白-多酚的互作机制,为多酚在核桃蛋白制品生产加工中的应用起一定指导作用。
1 材料与方法
1.1 实验材料
核桃仁,云南省保山市隆阳区;福林酚试剂,北京鼎国昌盛生物技术有限责任公司;牛血清白蛋白,上海伯奥生物科技有限公司;阿魏酸、白藜芦醇、橙皮素、儿茶素、槲皮素、姜黄素、没食子酸、杨梅素,上海源叶公司;其他试剂均为国产分析纯级。
1.2 设备与仪器
ModulyoD真空冷冻干燥机,美国Thermo公司;FJ200-SH型数显高速分散均质机,上海标本模型厂;UV-1000紫外可见分光光度计,北京莱伯泰科技仪器有限公司;Lumina荧光分光光度计,Thermo Scientific Coporation;F50型酶标仪,Tecan;3K15高速冷冻离心机,美国Sigma公司;204F1差示量热扫描仪,德国耐驰仪器制造有限公司。
1.3 实验方法
1.3.1 核桃蛋白的提取工艺
工艺流程为:
核桃仁→浸泡(5 mg/mL NaOH溶液,30 min)→清水漂洗→剥去仁皮→烘干(55 ℃)→粉碎→石油醚脱脂→抽滤→滤渣烘干→粉碎→提取[料液比1∶25(g∶mL),pH 9.0,搅拌1 h]→离心(5 500 r/min,10 min)→上清液→酸沉(pH 5.0,静置12 h)→离心(5 500 r/min,10 min)→沉淀→蒸馏水洗至中性→冻干[14]。
1.3.2 多酚-核桃蛋白复合物的构建
参考ALI[15]的方法并稍加改动。分别将阿魏酸、白藜芦醇、橙皮素、儿茶素、槲皮素、姜黄素、没食子酸、杨梅素这8种多酚配制为10 μmol/mL的溶液,与3 mg/mL的核桃蛋白溶液混匀后,于37 ℃振荡培养12 h,经透析72 h后冻干为多酚-核桃蛋白复合物(polyphenol-walnut protein,PWP)。
1.3.3 紫外吸收光谱扫描
以pH 7.9磷酸盐缓冲液将PWP配制为3 mg/mL溶液,设定狭缝宽度为2.0 nm,取样间隔为1 nm,于195~450 nm扫描吸光度值,并以相同质量浓度的核桃蛋白溶液作对照。
1.3.4 荧光光谱扫描
取10 μmol/mL的核桃蛋白样液,分别与不同体积的阿魏酸溶液(10 μmol/mL)混匀,使其终浓度分别为0、0.01、0.02、0.04、0.08 μmol/mL。于激发波长280,狭缝宽度4 nm,发射扫描波长290~420 nm扫描其荧光光谱,并由Stern-Volmer方程计算猝灭速率常数(Kq),猝灭常数(Ksv),结合常数(Ka)以及结合位点数(n)[16]。按相似的方法扫描其他7种多酚的荧光光谱,并按照公式(1)和公式(2)计算相应的参数。
(1)
(2)
式中:Ka,结合常数;KSV,猝灭常数;n,结合位点;F0,加入猝灭剂前蛋白的荧光强度;F,加入猝灭剂后蛋白的荧光强度;[Q],猝灭剂或者药物浓度;Kq,速率常数;τ0,荧光分子的平均寿命,约为10-8s。
1.3.5 溶解度的测定
取15 mg PWP样品分散于15 mL pH 7.9磷酸盐缓冲液中,室温下振荡分散30 min,然后于5 500 r/min离心10 min,取上清液测定蛋白质质量。PWP溶解度的计算如公式(3)所示[14]:
溶解度![]()
(3)
式中:m1为PWP样品的总蛋白质质量,g;m2为上清液的蛋白质质量,g。
1.3.6 持水性和持油性的测定
取100 mg PWP样品(m)于20 mL离心管并称重(m1),加入4 mL水振荡30 s使其分散均匀,于5 500 r/min 离心10 min后,倾去上清液,再次称重(m2),按公式(4)计算持水性(water holding capacity,WHC)。将上述水换为油,其余操作相同,按公式(5)计算吸油性(oil holding capacity,OHC)[14]:
(4)
(5)
1.3.7 起泡性及泡沫稳定性的测定
将PWP配制为3 mg/mL的磷酸缓冲液,取25 mL于12 000 r/min高速分散1 min。记录分散停止时的体积(V0)和停止后30 min的体积(V30),起泡性(foaming capacity,FC)和泡沫稳定性(foaming stability,FS)分别按公式(6)和(7)计算[17]:
(6)
(7)
式中:V0为均质停止时的泡沫体积,mL;V30为均质停止30 min时的泡沫体积,mL。
1.3.8 差示扫描量热的测定
采用差示扫描量热法测定PWP的变性温度,以空铝盒作为空白对照,扫描范围为25~125 ℃,扫描速率为10 ℃/min。以样品吸热或放热的速率(单位样品mJ/s)为纵坐标,以温度为横坐标作图。
1.3.9 数据处理与分析
每个实验重复3次后取平均值。数据使用SPSS软件(版本22.0)进行数据显著性分析,P<0.05为具显著性差异,并使用Origin 2018软件作图。使用R软件(版本4.03)进行聚类相关性热图分析和主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 核桃蛋白-多酚互作的紫外-可见光谱分析
紫外吸收光谱280 nm附近的吸收峰是大多数蛋白的共性,这是由于色氨酸和酪氨酸残基对光的吸收。8种多酚与核桃蛋白复合后的紫外吸收光谱如图1所示,核桃蛋白与多酚复合后的紫外吸收光谱的峰形变宽,280 nm附近的吸光度值增大,且最大吸收峰位略微红移,表明发色基团所处环境由极性向非极性变化,核桃蛋白与多酚形成了新的复合物。由于多酚与蛋白之间的相互作用,导致结合位点附近的蛋白二级结构和微环境发生了变化[18],并使结合位点暴露在一个更加疏水的微环境中。橙皮素、杨梅素及槲皮素与核桃蛋白复合后,在330 nm附近还出现了一个的吸收峰,可能是因多酚氧化形成的。这与高瑾等[19]的研究结果类似,没食子酸等多酚与玉米醇溶蛋白复合后,其特征吸收峰增大,且最大峰位发生迁移。

a-阿魏酸;b-白藜芦醇;c-橙皮素;d-儿茶素;e-槲皮素;f-姜黄素;g-没食子酸;h-杨梅素
图1 核桃蛋白与8种多酚互作的紫外-可见光谱
Fig.1 UV-Vis absorption spectrum of interaction between walnut protein and eight polyphenols
2.2 核桃蛋白与8种多酚互作的荧光光谱分析
蛋白质中的酪氨酸、色氨酸和苯丙氨酸残基可发射荧光[20]。核桃蛋白与8种多酚互作的荧光光谱如图2所示,随着多酚浓度的增加,核桃蛋白的内源荧光强度有规律地被猝灭,说明多酚与核桃蛋白的结合过程中,发射荧光的色氨酸残基、酪氨酸残基和苯丙氨酸残基所处的微环境发生变化,导致其内源荧光发生猝灭,且猝灭效果因多酚种类的不同而显现出差异,当槲皮素浓度为0.08 μmol/mL时,几乎可完全将核桃蛋白的内源荧光猝灭,说明槲皮素与核桃蛋白互作时,更接近于位于蛋白疏水空腔内自发荧光的氨基酸残基[21]。
在荧光猝灭过程中,阿魏酸、橙皮素与核桃蛋白复合发生了红移现象,其他多酚的复合则发生轻微的蓝移现象,由此推测这8种多酚对核桃蛋白的荧光猝灭可能是静态猝灭引起的[21]。通过Stern-Volmer方程计算猝灭速率常数(Kq),猝灭常数(Ksv),结合常数(Ka)及结合位点数(n),如表1所示,多酚与核桃蛋白的猝灭速率常数Kq大于各类荧光猝灭剂对生物大分子的最大猝灭速率常数[约为2.0×1010L/(mol·s)],说明8种多酚对核桃蛋白的荧光猝灭作用是以静态猝灭为主。杨梅素、槲皮素、姜黄素的Ka值较大,说明它们与核桃蛋白之间可形成较稳定的复合物。这与JIA等[22]的研究结果相似,绿原酸、阿魏酸等多酚与蛋白质结合后,可使荧光光谱不同程度地猝灭,并出现光谱的红移或蓝移现象。
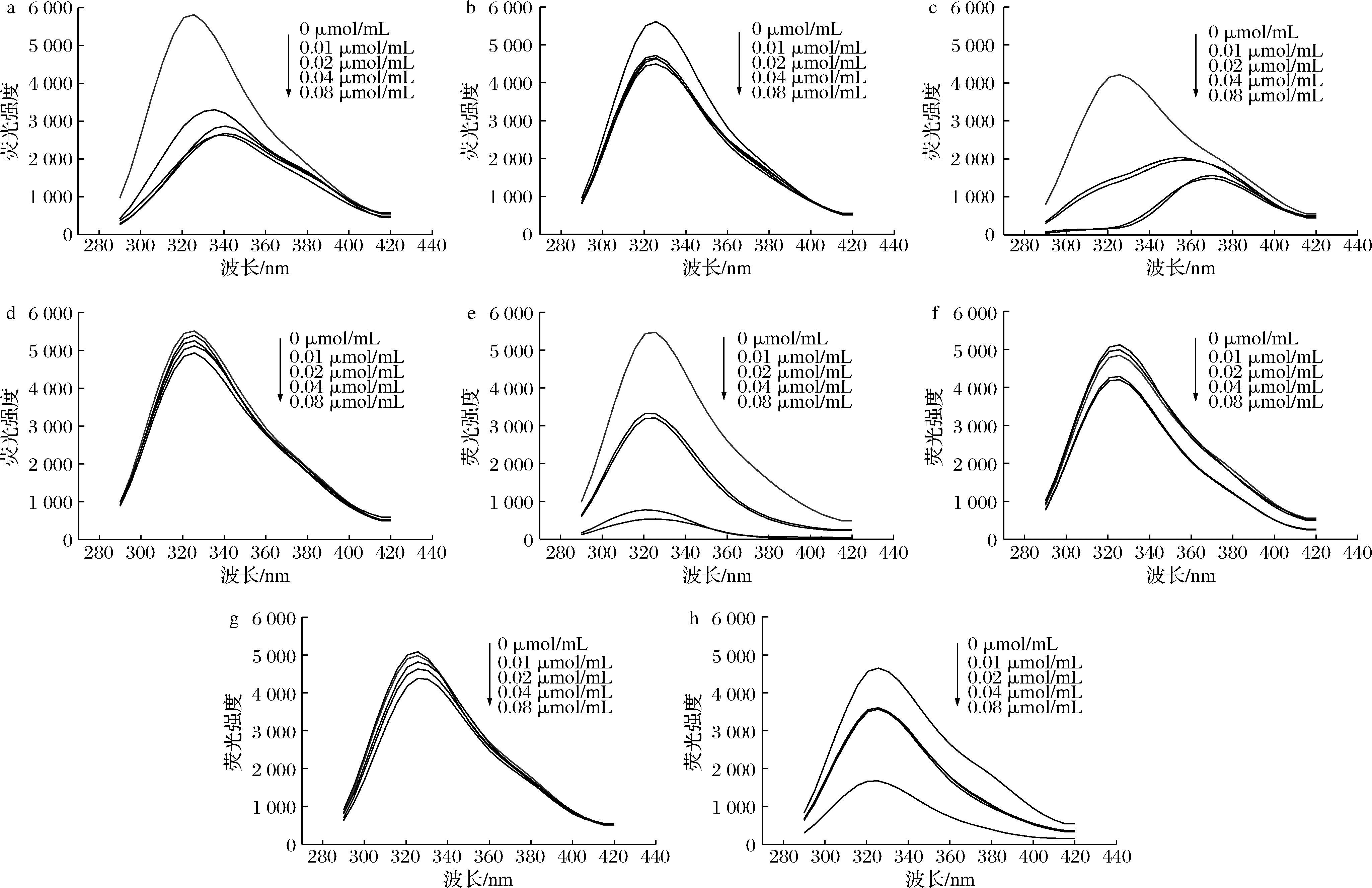
a-阿魏酸;b-白藜芦醇;c-橙皮素;d-儿茶素;e-槲皮素;f-姜黄素;g-没食子酸;h-杨梅素
图2 核桃蛋白与8种多酚互作的荧光光谱
Fig.2 Fluorescence spectrum of interaction between walnut protein and eight polyphenols
在NCBI PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)中输入化合物名称,查询得杨梅素、槲皮素、姜黄素、橙皮素、阿魏酸、没食子酸、白藜芦醇、儿茶素的疏水参数计算参考值分别为1.2、1.5、3.2、2.4、1.5、0.7、3.1、0.4,对应的氢键供受体数依次为6/8、5/7、3/6、2/6、5/7、2/4、4/5、5/6。由此可判断核桃蛋白与8种多酚间的相互作用是以氢键为主,疏水相互作用为辅,与HASLAM等[23]提出多酚-蛋白质相互作用的“多点疏水-氢键结合”理论较为契合。
2.3 多酚对核桃蛋白溶解度的影响
8种多酚对核桃蛋白溶解度的影响如图3所示,核桃蛋白和8种多酚结合后溶解性均显著降低(P<0.05),其中槲皮素降幅最大。可能是核桃蛋白侧链上的羟基、氨基和羧基可与多酚形成氢键和疏水相互作用,屏蔽了氨基酸残基所带电荷,从而影响核桃蛋白的溶解性。此外,碱性条件下多酚易被氧化,生成醌类或半醌类物质,其极易与核桃蛋白的亲核基团(如游离氨基和巯基)共价结合,引起蛋白交联,并减少其亲水官能团与水的接触面积,进一步降低核桃蛋白的溶解性。这与代世成等[24]的研究结果相似,儿茶素可与大豆蛋白形成网状结构,从而导致溶解度的下降。
表1 PWP的荧光猝灭速率常数(Kq),猝灭常数(Ksv), 结合常数(Ka)及结合位点数(n)
Table 1 Quenching rate constant (Kq), quenching constant (KSV), binding constant (Ka) and number of binding sites (n) of PWP
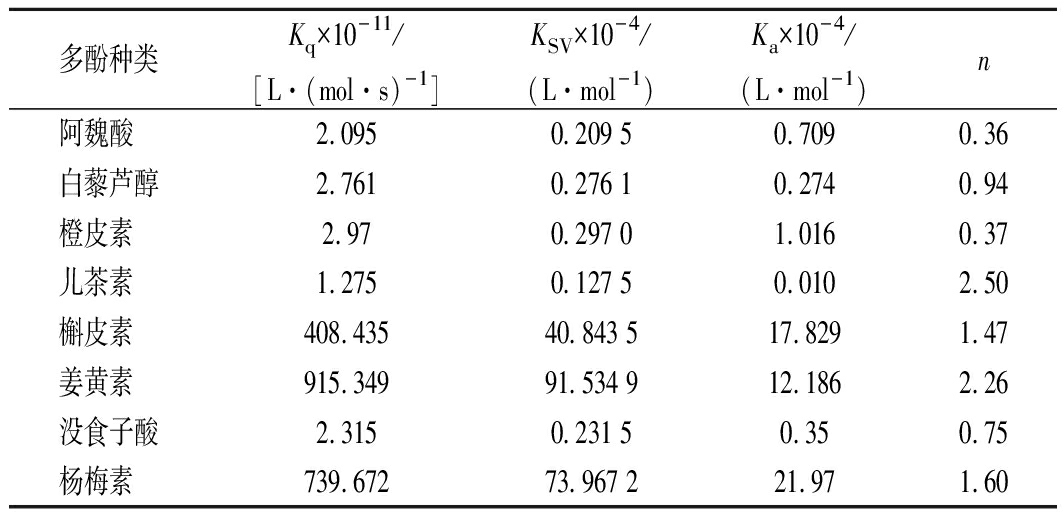
多酚种类Kq×10-11/[L·(mol·s)-1]KSV×10-4/(L·mol-1)Ka×10-4/(L·mol-1)n阿魏酸 2.0950.209 50.7090.36 白藜芦醇2.7610.276 10.2740.94 橙皮素 2.970.297 01.0160.37 儿茶素 1.2750.127 50.0102.50 槲皮素 408.43540.843 517.8291.47 姜黄素 915.34991.534 912.1862.26 没食子酸2.3150.231 50.35 0.75 杨梅素 739.67273.967 221.97 1.60

图3 八种多酚对核桃蛋白溶解度的影响
Fig.3 Effect of eight polyphenols on solubility of walnut protein
注:WP-核桃蛋白;FA-WP-阿魏酸-核桃蛋白; R-WP-白藜芦醇-核桃蛋白;H-WP-橙皮素-核桃蛋白; CA-WP-儿茶素-核桃蛋白;Q-WP-槲皮素-核桃蛋白; CU-WP-姜黄素-核桃蛋白;GA-WP-没食子酸-核桃蛋白; M-WP-杨梅素-核桃蛋白;柱状图上不同小写英文字母表示 差异显著,P<0.05(下图同)
2.4 多酚对核桃蛋白持水性的影响
如图4所示,核桃蛋白与8种多酚复合后持水性显著降低,其中阿魏酸的降幅最大。核桃蛋白可与多酚通过分子间交联形成不溶性物质[7],削弱蛋白质与水的相互作用,不利于水分的保持,导致持水性的降低,而蛋白质的持水能力与其结合水的能力成正比,因此与2.3中溶解度的结果相符合,与大豆蛋白-多酚复合物和乳清蛋白-多酚复合物的持水性结果相似[10,16]。

图4 八种多酚对核桃蛋白持水性的影响
Fig.4 Effect of eight polyphenols on WHC of walnut protein
2.5 多酚对核桃蛋白吸油性的影响
多酚对核桃蛋白吸油性的影响如图5所示,儿茶素、橙皮素和槲皮素可显著增加核桃蛋白的吸油性,而其他5种多酚对核桃蛋白的吸油性影响不大。可能是因为多酚以氢键,疏水等相互作用与核桃蛋白复合,其中儿茶素、橙皮素和槲皮素可使核桃蛋白的构象发生较大变化,部分蛋白质结构展开,分子间孔隙率提高,导致吸油性的增强[7],这与岳鑫[10]的研究中一定浓度红松种鳞多酚可提高乳清蛋白吸油性的结果类似。
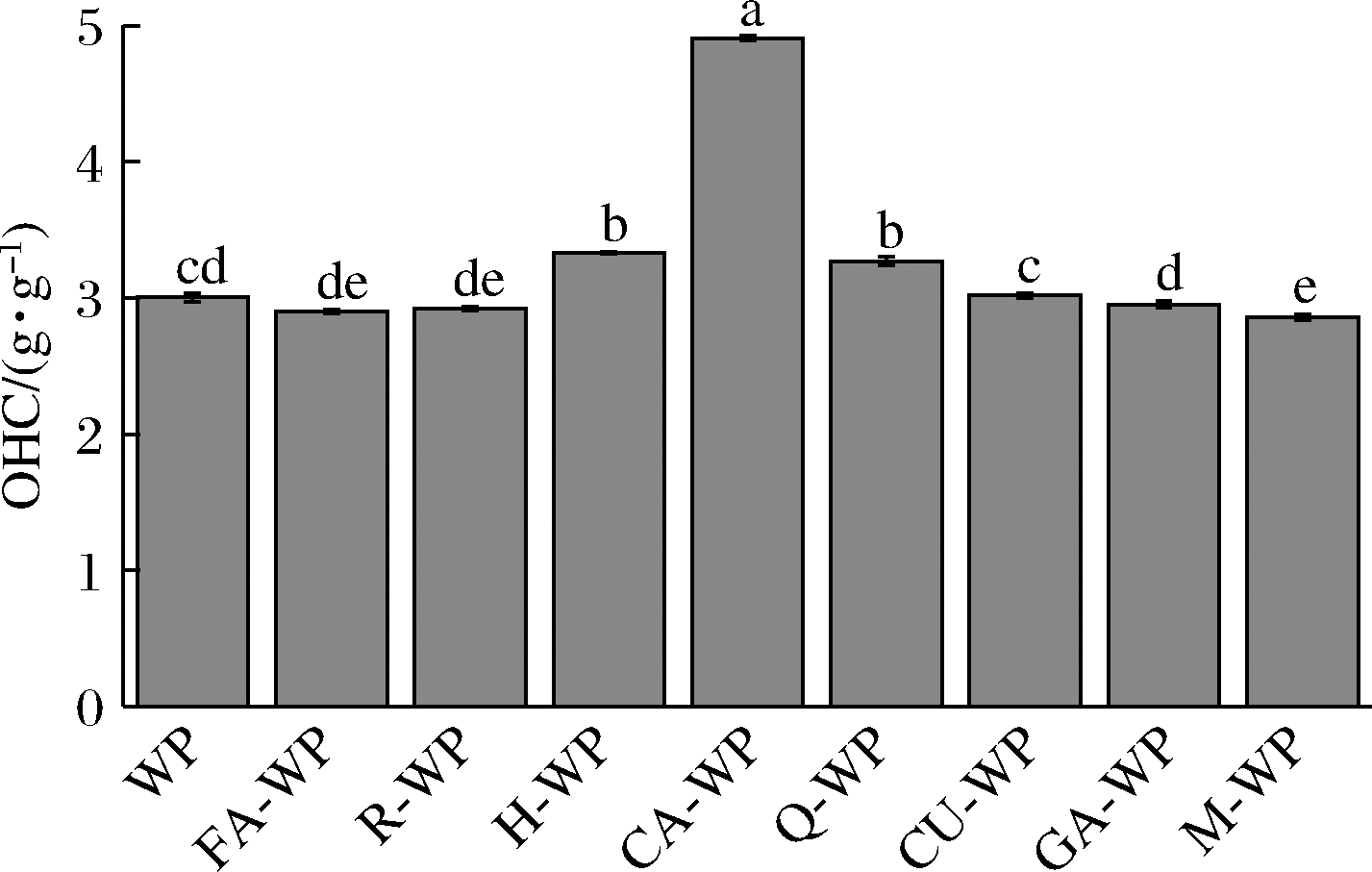
图5 八种多酚对核桃蛋白吸油性的影响
Fig.5 Effect of eight polyphenols on OHC of walnut protein
2.6 多酚对核桃蛋白起泡性能的影响
多酚对核桃蛋白泡沫性和泡沫稳定性的影响如图6所示,除橙皮素、姜黄素和阿魏酸外,大部分多酚对核桃蛋白的起泡性和起泡稳定性有提高作用,其中儿茶素和没食子酸显著提高了核桃蛋白的起泡性能。蛋白质的起泡性取决于其分子柔性大小,多酚中的羟基和疏水基可通过非共价键和核桃蛋白结合,形成更厚的多层蛋白吸附膜,使其泡沫性增加[6]。与曹艳芸[6]、覃思等[25]的研究结果相似,多酚可在一定程度上提高乳清蛋白、大豆蛋白的起泡性能。而核桃蛋白与橙皮素、姜黄素和阿魏酸复合后起泡稳定性的降低,可能是因为泡沫稳定性取决于其形成黏膜的刚性和弹性,在这些多酚的作用下,核桃蛋白形成的泡沫表面强度和刚性较强,泡沫更易破裂,具体机制还有待进一步探讨。
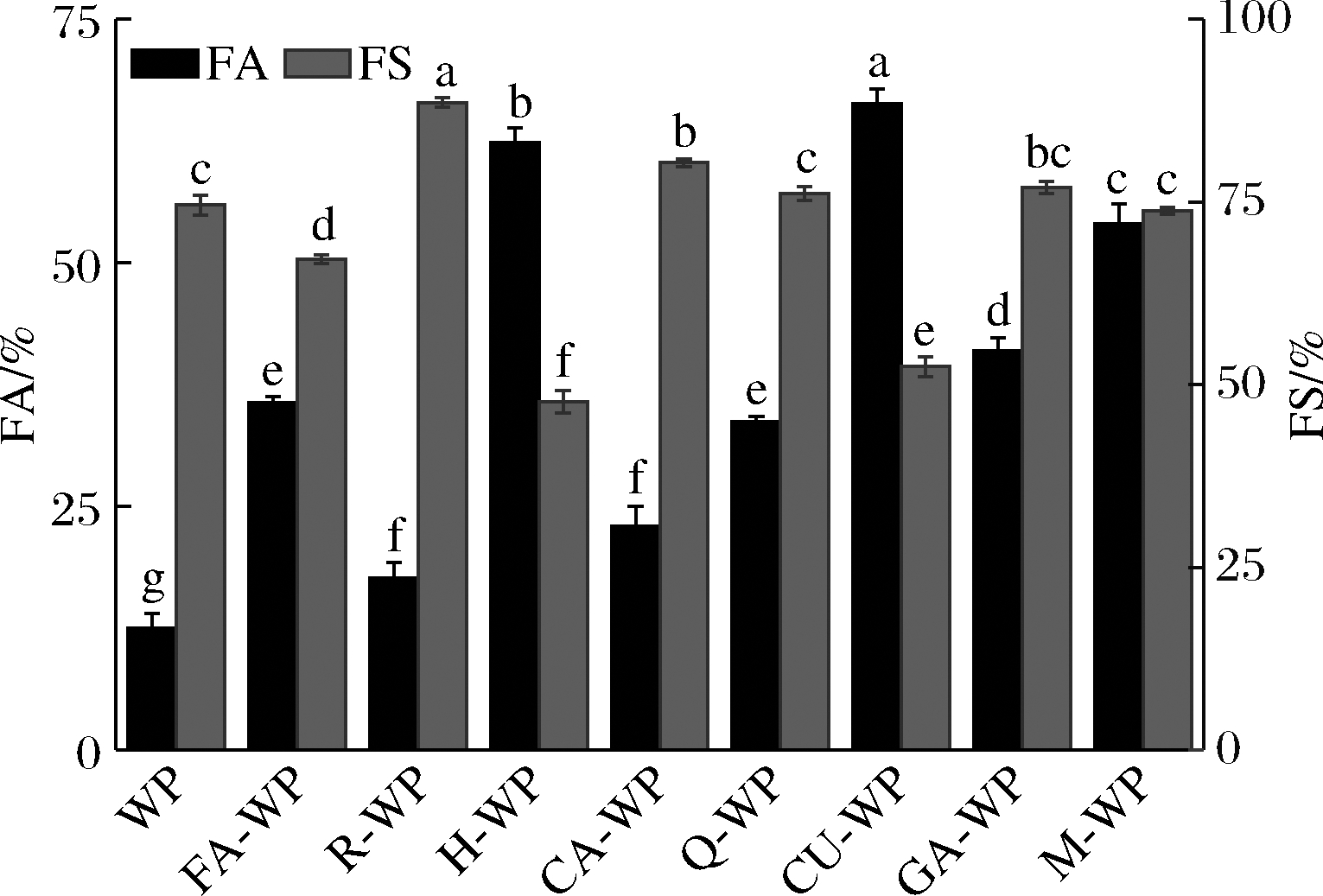
图6 八种多酚对核桃蛋白起泡性和起泡稳定性的影响
Fig.6 Effects of eight polyphenols on FA and FS of walnut protein
注:同一颜色柱状图上不同小写英文字母表示差异显著(P<0.05)
2.7 多酚对核桃蛋白变性温度的影响
核桃蛋白与8种多酚复合后的热学特性如表2所示。核桃蛋白与8种多酚复合后,初始变性温度、最大变性温度和变性焓全部提高,其中白藜芦醇-核桃蛋白复合物的最大变性温度为103.24 ℃,增幅最大。其次为杨梅素、儿茶素、槲皮素和橙皮素。说明核桃蛋白与8种多酚复合后,热稳定性得以提高。可能是因为多酚与核桃蛋白形成的非共价键和其他作用力使核桃蛋白对热更稳定,表现为变性温度升高。这与乳蛋白-多酚复合物的热稳定性结果相一致[26]。
表2 PWP的热学特性
Table 2 Thermal characteristic of PWP conjugates
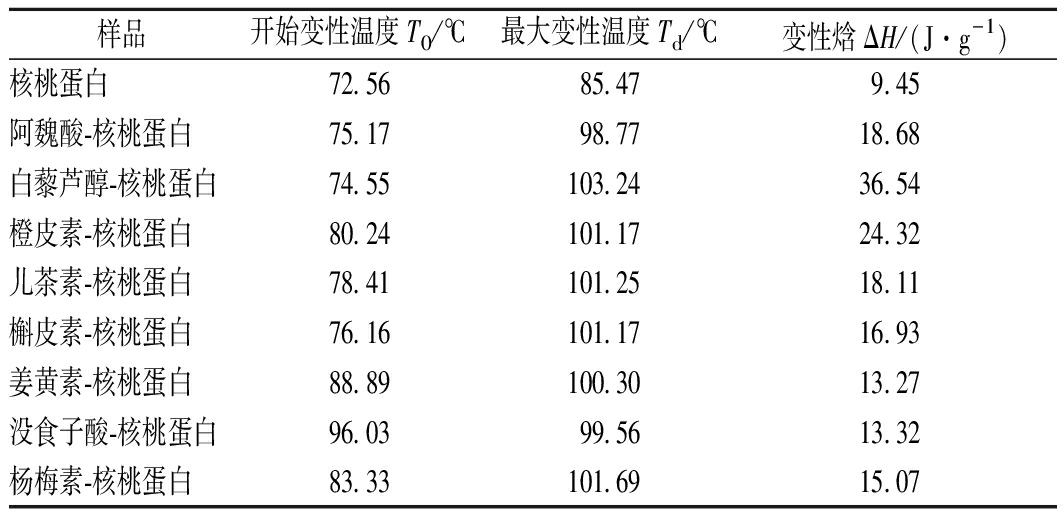
样品开始变性温度T0/℃最大变性温度Td/℃变性焓ΔH/(J·g-1)核桃蛋白72.5685.479.45阿魏酸-核桃蛋白75.1798.7718.68白藜芦醇-核桃蛋白74.55103.2436.54橙皮素-核桃蛋白80.24101.1724.32儿茶素-核桃蛋白78.41101.2518.11槲皮素-核桃蛋白76.16101.1716.93姜黄素-核桃蛋白88.89100.3013.27没食子酸-核桃蛋白96.0399.5613.32杨梅素-核桃蛋白83.33101.6915.07
2.8 相关性分析和主成分分析
对各PWP的加工性质和热性能进行相关性热图分析和PCA。相关性热图中聚类距离越近和相关性系数越高,说明样本之间较为接近。另外各组样本分布在不同维度空间的不同区域,同组的样品在空间分布比较集中,因此可以采用PCA从不同维度展现样品间的关系。PCA图中样本距离越近,说明样本越相似。如图7所示,儿茶素-核桃蛋白复合物与核桃蛋白的聚类距离最近、相关性系数最高、PCA图中的距离也最近,说明儿茶素-核桃蛋白复合物的性质与核桃蛋白较为接近。由表1可知,儿茶素与核桃蛋白的结合常数Ka值较小,也说明其与核桃蛋白之间形成的复合物相对较不稳定,导致对核桃蛋白性质影响较小。另外,其他多酚与核桃蛋白、儿茶素-核桃蛋白复合物的聚类距离较远、相关性系数也较低,且在PCA图上与两者明显分开,且距离较远,说明其他复合物的加工性质和热性能与核桃蛋白和儿茶素-核桃蛋白复合物可明显区分,其中阿魏酸、没食子酸、杨梅素、槲皮素对核桃蛋白的作用较为相近。姜黄素、橙皮素、杨梅素与核桃蛋白的相关性系数最低,PCA图距离也较远,说明这3个多酚对核桃蛋白的加工性质和热性能影响较大。
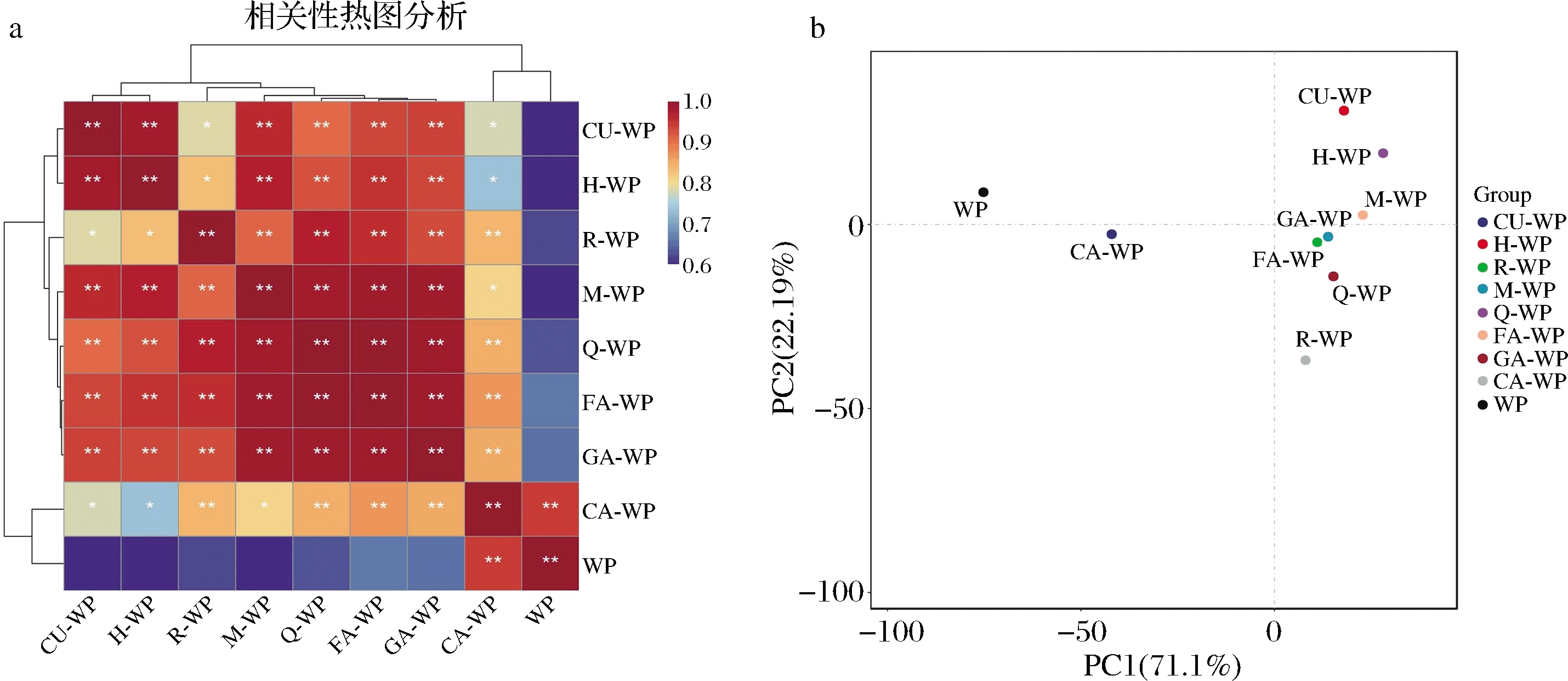
a-相关性热图;b-PCA图
图7 PWP的相关性分析图和PCA图
Fig.7 The correlation heatmap and PCA of PWP complexes
3 结论
阿魏酸等8种多酚与核桃蛋白形成了复合物,其对核桃蛋白的荧光猝灭作用是以静态猝灭为主,主要作用力是以氢键为主,疏水相互作用为辅。8种多酚的加入均降低了核桃蛋白的溶解性和持水性;一些多酚的复合可增强核桃蛋白的吸油性,而大部分多酚可提高核桃蛋白的起泡性能和热稳定性。总体来看,姜黄素、橙皮素、杨梅素对核桃蛋白的加工性质和热性能影响较大,而儿茶素影响较小。研究通过分析8种多酚对核桃蛋白性质的影响,可为多酚-植物蛋白的互作机制研究提供一些参考,对多酚在蛋白制品中的应用具有一定意义。
[1] KONG X Z, ZHANG L N, SONG W G, et al.Separation, identification and molecular binding mechanism of dipeptidyl peptidase IV inhibitory peptides derived from walnut (Juglans regia L.) protein[J].Food Chemistry, 2021, 347:129062.
[2] QUAN T H, BENJAKUL S, SAE-LEAW T, et al.Protein-polyphenol conjugates:Antioxidant property, functionalities and their applications[J].Trends in Food Science & Technology, 2019, 91:507-517.
[3] LI Y T, HE D, LI B, et al.Engineering polyphenols with biological functions via polyphenol-protein interactions as additives for functional foods[J].Trends in Food Science & Technology, 2021, 110:470-482.
[4] GIRARD A L, AWIKA J M.Effects of edible plant polyphenols on gluten protein functionality and potential applications of polyphenol-gluten interactions[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):2 164-2 199.
[5] ZHONG Y J, ZHAO J C, DAI T T, et al.The effect of whey protein-puerarin interactions on the formation and performance of protein hydrogels[J].Food Hydrocolloids, 2021, 113:106444.
[6] 曹艳芸. 乳清蛋白与多酚在中性pH条件下的相互作用对蛋白功能性质的影响研究[D].无锡:江南大学, 2017.
CAO Y Y.Functionality modification of whey proteins induced by the binding with phytophenolics at neutral pH[D].Wuxi:Jiangnan University, 2017.
[7] 胡湘蜀. 茶多酚组分解析及其与大豆分离蛋白相互作用的研究[D].无锡:江南大学, 2015.
HU X S.The Study of tea polyphenols components analysis and its interaction with soybean protein isolate[D].Wuxi:Jiangnan University, 2015.
[8] 文鹏程, 焦瑶瑶, 张卫兵, 等.茶多酚对牛奶蛋白结构的影响[J].食品与发酵工业, 2020, 46(8):40-47.
WEN P C, JIAO Y Y, ZHANG W B, et al.Effect of tea polyphenols on the structure of milk protein[J].Food and Fermentation Industries, 2020, 46(8):40-47.
[9] S![]() CZYK
CZYK  , SWIECA M, KAPUSTA I, et al.Protein-phenolic interactions as a factor affecting the physicochemical properties of white bean proteins[J].Molecules(Basel Switzerland), 2019, 24(3):408.
, SWIECA M, KAPUSTA I, et al.Protein-phenolic interactions as a factor affecting the physicochemical properties of white bean proteins[J].Molecules(Basel Switzerland), 2019, 24(3):408.
[10] 岳鑫. 红松种鳞多酚稳定性及其与乳清蛋白相互作用的研究[D].哈尔滨:东北林业大学, 2019.
YUE X.Study on the stability of polyphenols from Pinus koraiensis seed scales and its interaction with whey protein[J].Harbin:Northeast Forestry University, 2019.
[11] MA C M, ZHAO X H.Depicting the non-covalent interaction of whey proteins with galangin or genistein using the multi-spectroscopic techniques and molecular docking[J].Foods, 2019, 8(9):360.
[12] ZHAO M M, JIAO M, ZHOU F B, et al.Interaction of β-conglycinin with catechin-impact on physical and oxidative stability of safflower oil-in-water emulsion[J].Food Chemistry, 2018, 268:315-323.
[13] DAI T T, LI R Y, LIU C M, et al.Effect of rice glutelin-resveratrol interactions on the formation and stability of emulsions:A multiphotonic spectroscopy and molecular docking study[J].Food Hydrocolloids, 2019, 97:105234.
[14] 张雪春, 李如蕊, 程群, 等.羟自由基氧化对核桃蛋白性质和结构的影响[J].食品与发酵工业,2021,47(18):107-112.
ZHANG X C, LI R R, CHENG Q, et al.Effect of hydroxyl radical oxidation on properties and structure of walnut protein[J].Food and Fermentation Industries,2021,47(18):107-112.
[15] ALI M.Chemical, structural and functional properties of whey proteins covalently modified with phytochemical compounds[J].Journal of Food Measurement and Characterization, 2019, 13(4):2 970-2 979.
[16] XU J J, GUO S Y, LI X J, et al.Gel properties of transglutaminase-induced soy protein isolate-polyphenol complex:Influence of epigallocatechin-3-gallate[J].Journal of the Science of Food and Agriculture, 2021, 101(9):3 870-3 879.
[17] LI S G, HUANG Y, AN F P, et al.Hydroxyl radical-induced early stage oxidation improves the foaming and emulsifying properties of ovalbumin[J].Poultry Science, 2019, 98(2):1 047-1 054.
[18] 王启明, 唐瑜婉, 李春翼, 等.NaCl浓度对麦醇溶蛋白与槲皮素相互作用的影响[J].食品科学, 2021, 42(8):29-39.
WANG Q M, TANG Y W, LI C Y, et al.Spectroscopic analysis of interaction between gliadin and quercetin under different NaCl concentrations[J].Food Science, 2021,42(8):29-39.
[19] 高瑾, 梁宏闪, 赵靖昀, 等.玉米醇溶蛋白/多酚相互作用及复合物制备与表征[J].食品科学,2022,43(1):102-110.
GAO J, LIANG H S, ZHAO J Y, et al.Interactions between Zein/Polyphenols and characterization of their complex[J].Food Science,2022,43(1):102-110.
[20] 王广策, 管斌,林洪.食品蛋白质化学[M].北京:化学工业出版社, 2005:179.
WANG G C, GUAN B, LIN H.Food Protein Chemistry[M].Beijing:Chemical Industry Press, 2005:179.
[21] ACHARYA D P, SANGUANSRI L, AUGUSTIN M A.Binding of resveratrol with sodium caseinate in aqueous solutions[J].Food Chemistry, 2013, 141(2):1 050-1 054.
[22] JIA J J, GAO X, HAO M H, et al.Comparison of binding interaction between beta-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J].Food Chemistry, 2017, 228:143-151.
[23] HASLAM, EDWIN.Natural polyphenols (vegetable tannins) as drugs:Possible modes of action[J].Journal of Natural Products, 1996, 59(2):205-215.
[24] 代世成, 连子腾, 马林智, 等.超声预处理对大豆分离蛋白-儿茶素非共价/共价复合物结构及功能的影响[J/OL].食品科学.2021.https://kns.cnki.net/kcms/detail/11.2206.TS.20210531.1116.004.html.
DAI S C, LIAN Z T, MA L Z, et al.Effects of ultrasonic pretreatment on the structural and function of SPI-catechin non-covalent/covalent complexes[J/OL].Food science.2021.https://kns.cnki.net/kcms/detail/11.2206.TS.20210531.1116.004.html.
[25] 覃思, 吴卫国, 刘焱, 等, 茶多酚及其单体和加工环境对蛋清蛋白起泡性能影响的研究[J].食品科学, 2009, 30(1):90-94.
QIN S, WU W G, LIU Y, et al.Study on effects of tea polyphenols and monomers as well as environmental factors on foaming property of egg albumen protein[J].Food Science, 2009, 30(1):90-94.
[26] 魏子淏. 乳蛋白-EGCG和壳聚糖—绿原酸复合物的制备、结构表征及功能评价[D].北京:中国农业大学, 2015.
WEI Z H.Preparation, structural characterization and functional evaluation of milk protein-EGCG and chitosan-chlorogenic acid complexes[D].Beijing:China Agricultural University, 2015.