酶介导的生物催化已经成为一种可以有效减少工业生产中有毒有害物质产生的绿色、可持续技术[1-2]。脂肪酶作为一类具有催化脂化、酯交换和酯水解等多种功能的酶,通常具有催化活性高、底物范围广、区域选择性强和对应选择性好等特点[3]。鉴于以上特征,脂肪酶已被广泛用作生物技术领域的多功能生物催化剂,使用范围涵盖食品生产、药物、洗涤剂配方、皮革制品以及生物柴油制造等领域[4-8]。源自嗜热菌的嗜热脂肪酶因其在高温以及有机溶剂环境中所展现出的优异催化活性和稳定性而受到更多关注[9-11]。例如,来自产碱杆菌属的嗜热脂肪酶最佳反应温度为60~70 ℃。该酶在酸性或碱性条件下仍具有优异的催化活性和稳定性[12-14]。除上述酶学特征外,在工业生物催化中,普遍需要生物催化剂具有较高酶活力,并且具备一定的储藏稳定性、可重复使用性以及易于与反应体系分离等特性。然而,受限于生物大分子的固有特性,游离酶并不能满足这类需求。为满足实际生产需求,将游离酶进行固定化是一种行而有效的策略。
近年来,自组装的有机-无机杂化纳米花已作为一种新型的酶固定方法被开发与应用[15]。通过该方法,可有效解决游离酶在工业生物催化中所存在的功能酶稳定性差、无法重复利用、无法长期储藏等问题。WANG等[16]发现α-淀粉酶杂化纳米花比游离的α-淀粉酶具有更高的稳定性;漆酶的催化效率则在形成基于Cu2+的酶杂化纳米花后被提高了2.2倍[17]。尽管无机杂化纳米花可以有效增强酶的活性和稳定性,但该反应混合物必须在4 ℃下孵育3 d,缓慢的合成过程严重限制了该类固定方法在实际中的广泛应用。为突破此限制,BATULE等[18]于近年来使用声化学技术开发了一种可快速合成有机-无机杂化纳米花的新方法,使得有机-无机杂化纳米花的自组装过程在室温条件下超声5 min即可完成。
在本研究中,首先以大肠杆菌为载体对嗜热脂肪酶进行表达,并经过亲和柱纯化获得游离酶;随后利用声化学方法快速制备脂肪酶-无机杂化纳米花,并对合成条件进行了优化。针对所制备的脂肪酶杂化纳米花,使用扫描电子显微镜 (scanning electron microscope,SEM)、X射线衍射(X-ray diffraction,XRD) 和傅里叶红外光谱 (Fourier transform infrared spectroscopy,FT-IR) 对其进行相应的表征。为探究该固定化酶在实际中的应用潜力,还对所获得的脂肪酶杂化纳米花的稳定性和催化活性进行了研究,以期为该类酶的有效应用提供研究基础。
1 材料与方法
1.1 菌株
E.coli pTIG-liP/BL21(DE3)为本实验室保存。
1.2 试剂、培养基和仪器
LB培养基(g/L):酵母粉 5、胰蛋白胨 10、NaCl 10,115 ℃灭菌20 min。
主要试剂:对硝基苯酚棕榈酸酯(p-nitrophenyl palmitate),SIGMA公司;氨苄青霉素,上海生物工程股份有限公司,其他试剂均为国产分析纯。
主要仪器:SCG蛋白纯化系统,苏州赛谱仪器有限公司;KQ-100型超声波清洗器,昆山超声仪器有限公司;酶标仪,TECAN公司;超声细胞破碎仪,SONICMATERIALS INC.USA;NEXUS傅里叶变换红外光谱仪,美国尼高力仪器公司;Bruker advance D8 型X射线衍射仪,德国布鲁克AXS公司。
1.3 实验方法
1.3.1 脂肪酶的表达
将重组菌E.coli pTIG-liP/BL21(DE3)划线于氨苄青霉素抗性平板上37 ℃倒置培养12 h,挑取单菌落接种于15 mL LB液体培养基中,在37 ℃,200 r/min的条件下培养12 h,以体积分数2%的转接量转接至50 mL LB培养基中,培养条件不变,继续培养至OD600=0.6~0.8时,添加终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactosid,IPTG)诱导表达,在16 ℃,200 r/min条件下,诱导培养24 h,离心弃上清液收集菌体,用20 mmol/L Tris-HCl缓冲液(pH 8.0)洗涤3次,破碎细胞收集上清液即为粗酶液。
1.3.2 脂肪酶的纯化与聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
将粗酶液用5 mL镍柱纯化,收集纯化的脂肪酶(Lip),用20 mmol/L的磷酸盐缓冲溶液(PBS)透析去除高浓度咪唑,用SDS-PAGE分析检测。
1.3.3 Lip杂化纳米花的制备条件优化
以Lip做为有机部分,以Cu、Co、Ca、Mn、Ni做为无机部分,制备Cu2+纳米花、Co2+纳米花、Ca2+纳米花、Mn2+纳米花以及Ni2+纳米花。具体实验步骤如下:取5 mL离心管,将0.01~0.15 mg/mL的脂肪酶与1~3 mmol/L的5种金属离子混合后再用pH 6~9的PBS(20 mmol/L)补齐至1 mL,充分混匀5 min,将样品置于水浴超声仪中超声1~15 min。10 000 r/min离心10 min后收集样品,并用去离子水洗涤3次,通过Bradford方法测量上清液中的酶浓度以确定杂化纳米花中的包封率。包封率按公式(1)计算:
(1)
式中:ER,包封率,%;ρ1,上清液蛋白质量浓度,mg/mL;ρ0,初始蛋白质量浓度,mg/mL
1.3.4 脂肪酶活力测定
参照SHA等[19]的方法测定,稍作改动。底物1:15 mmol/L对硝基苯酚棕榈酸酯溶于二甲基亚砜中;底物2:用50 mmol/L Tris-HCl分别溶解脱氧胆酸钠与阿拉伯树胶使其终质量浓度分别为1.2 g/L与0.55 g/L,并用1 mol/L HCl溶液调节pH至8.0;将底物1与底物2按体积比1∶100(mL∶mL)混合,现配现用,反应前将混合物置于45 ℃孵育5 min。反应体系:取混合物2.4 mL,加入0.1 mL适当稀释的酶液,于85 ℃下准确反应5 min后,加入0.1 mL浓度为1 mol/L的Na2CO3溶液终止反应,空白对照为不加酶液的缓冲液,最后于波长410 nm处测定吸光值。酶活力定义:1 min产生1 μmol对硝基苯酚所需要的酶量为一个酶活力单位(U)。酶活力回收率定义为固定化酶吸光值与游离酶吸光值的比值除以包封率,按公式(2)计算:
酶活力回收率![]()
(2)
式中:A1,固定化酶吸光值;A0,对照组吸光值;A2,游离酶吸光值;RE,包封率,%
1.3.5 Lip杂化纳米花的表征
1.3.5.1 SEM 分析
将3种制备好的Cu2+固定化酶冷冻干燥,对样品进行喷金预处理后,置于样品台上,用SEM进行扫描观察,以不加酶的磷酸盐沉淀作为对照。
1.3.5.2 FT-IR分析
将样品放置在检测孔处,使用FT-IR对其进行分析,通过软件分析采集数据,以不加酶的磷酸盐沉淀作为对照。
1.3.5.3 XRD分析
将样品充分研磨后,覆盖于检测中心,并将其轻轻压实后再进行检测。扫描角度为5°~90°,扫描速度为5 ℃/min,采集数据后与Jade软件中PDF卡片标准库比对,分析物质结晶情况。
1.3.6 Lip与Lip杂化纳米花的酶学性质
1.3.6.1 最适反应pH以及pH稳定性测定
在pH 4.0~11.0的缓冲液中测定游离酶和固定化酶的酶活力,将实验中所测得的最高酶活力记作100%,并计算其他pH值条件下的相对酶活力,确定最适pH值。pH稳定性测定:将适量稀释的脂肪酶置于pH 4.0~11.0的不同缓冲液中,室温孵育4 h后测定残留酶活力,以未处理酶的酶活力作为100%,测定孵育后脂肪酶相对酶活力。不同pH缓冲体系分别为:NaAc-HAc(pH 3.0~5.0)、Na2HPO4-NaH2PO4(pH 6.0~7.0)、Tris-HCl(pH 8.0~9.0)、Gly-NaOH(pH 10.0~11.0)。
1.3.6.2 最适反应温度及温度稳定性测定
在60~95 ℃内测定游离酶以及固定化酶的酶活力,以最高酶活力作为100%并计算其他温度下的相对酶活力,确定最适反应温度。温度稳定性测定:在60~95 ℃孵育1 h,以未处理酶的酶活力作为100%,测定孵育后脂肪酶相对酶活力。
1.3.6.3 固定化酶的储藏稳定性及可重复使用性
储藏稳定性:将固定化酶放置在室温条件下30 d,每3 d测定1次酶活力, 以初始酶活力为100%,测定固定化酶储藏稳定性。
可重复使用性:在固定化酶反应后,通过离心(10 000 r/min, 5 min)将固定化酶与反应混合物分离,并用去离子水洗涤2次,回收的固定化酶立刻用于下一个反应的测量,以初始酶活力为100%,测定固定化酶的可重复使用性。
1.3.6.4 动力学研究
以对硝基苯酚棕榈酸酯为底物,在85 ℃下与脂肪酶反应,测得初始反应速度,利用Origin软件中的Michaelis-Menten方程进行非线性拟合,得到Km值,根据蛋白质分子质量和蛋白质浓度计算kcat和kcat/Km值,确定游离脂肪酶以及固定化脂肪酶对对硝基苯酚棕榈酸酯的特异性,kcat按公式(3)计算:
(3)
(4)
式中:kcat,催化常数,s-1;Vm,最大反应速率,μmol/min;[E],蛋白物质的量,μmol;T,反应时间,s;ρ,蛋白质质量浓度,mg/mL;V,酶液体积;M,蛋白质分子质量,kDa。
2 结果与分析
2.1 Lip的表达与纯化
如图1所示,通过10% SDS-PAGE分析,在3号泳道38 kDa处观察到明显的目的蛋白积累,并且与预测的分子质量一致。凝胶泳道中呈现出清晰的目标蛋白条带,表明在此获得了纯度较高的Lip。
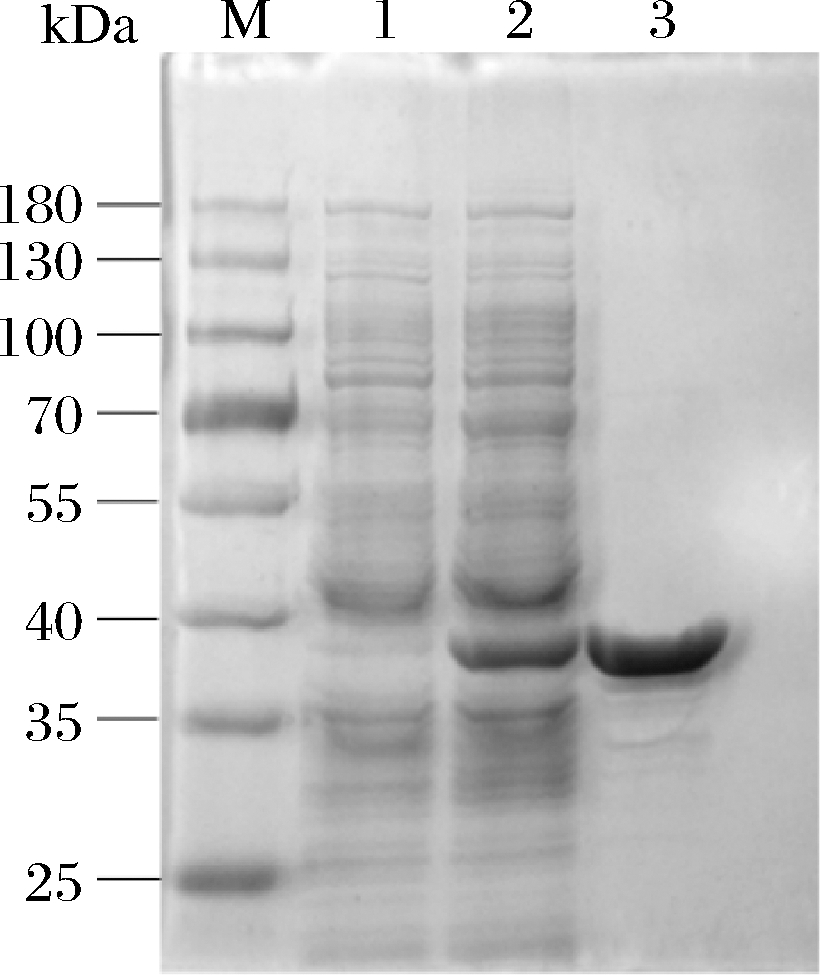
M-marker;1-空载;2-粗酶;3-纯酶
图1 Lip SDS-PAGE分析
Fig.1 Lip SDS-PAGE analysis
2.2 Lip杂化纳米花固定化酶的制备与条件优化
在杂化纳米花的合成过程中,酶与金属离子会形成强复合物。该合成过程经历3个连续的步骤,包括成核、生长以及自组装成花状结构[15]。在纳米花形成过程中,合成条件对于金属离子纳米花的活性有很大的影响,ZHANG等[20]发现脂肪酶杂化纳米花的形成与金属离子类别、脂肪酶的浓度、温度有关;而BATULE等[18]则发现通过声化学的方法仅超声5 min就可以快速完成杂化纳米花的自组装过程并且超声时间对其活性影响较大。除此之外,SAR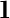 等[21]也发现不同铜盐类型会影响纳米花的生长和形态。为了进一步了解不同合成条件对所形成的脂肪酶杂化纳米花的活性影响,本研究对金属离子种类、浓度、脂肪酶浓度、超声时间和PBS的pH在内的各项参数进行了系统的研究。由图2可知,用声化学方法制备脂肪酶纳米花时,只有Cu2+可以获得包封率较高的杂化纳米花,当Cu2+浓度为3 mmol/L时,包封率可达100%,且酶活力回收率可达到82.79%。而使用其他金属离子固定化后的包封率除Co2+外普遍低于50%,虽然Co2+可使包封率达到65.20%,但与其相对应的酶活力回收率会显著下降。上述结果可能是由于固定化酶的载量过高导致空间位阻增大所造成的。综合包封率及酶活力回收率,本研究选择Cu2+进行后续的固定化条件优化。
等[21]也发现不同铜盐类型会影响纳米花的生长和形态。为了进一步了解不同合成条件对所形成的脂肪酶杂化纳米花的活性影响,本研究对金属离子种类、浓度、脂肪酶浓度、超声时间和PBS的pH在内的各项参数进行了系统的研究。由图2可知,用声化学方法制备脂肪酶纳米花时,只有Cu2+可以获得包封率较高的杂化纳米花,当Cu2+浓度为3 mmol/L时,包封率可达100%,且酶活力回收率可达到82.79%。而使用其他金属离子固定化后的包封率除Co2+外普遍低于50%,虽然Co2+可使包封率达到65.20%,但与其相对应的酶活力回收率会显著下降。上述结果可能是由于固定化酶的载量过高导致空间位阻增大所造成的。综合包封率及酶活力回收率,本研究选择Cu2+进行后续的固定化条件优化。

a-包封率;b-酶活力回收率
图2 不同金属离子纳米花
Fig.2 Nanoflowers formed with different metal ions
考虑到不同铜盐类型可能会造成固定化效果的差异性,分别使用CuCl2、Cu (NO3)2和CuSO4作为金属离子纳米花制备材料,以期获得最优的固定化酶。如图3所示,与游离酶相比,CuCl2和Cu (NO3)2制备的纳米花[Lip-CuCl2和Lip-Cu(NO3)2]的酶活力最高,分别提升了21.15%和10.24%。就包封率而言,CuSO4制备的纳米花(Lip-CuSO4)最高可达100%。对比扫描电镜结果(图5)可以看出, Lip-CuSO4显示出花瓣状的致密结构,这类结构可为脂肪酶固定化提供更多的附着位点从而导致包封率的提高;Lip-CuCl2和Lip-Cu (NO3)2的结构较Lip-CuSO4更为致密,这有利于底物分子与酶的活性中心结合从而提高固定化酶酶活力[13]。综合对比后选择了金属离子浓度为3 mmol/L的Lip-CuSO4(包封率最高)和金属离子浓度为2 mmol/L的Lip-CuCl2(酶活力回收率最高)2个组来进行后续的优化。

a-包封率;b-酶活力回收率
图3 不同铜盐纳米花
Fig.3 Nanoflowers formed by different copper salts
如图4-a所示,随着脂肪酶浓度的提升,酶活力回收率逐渐提高。在脂肪酶质量浓度达到0.05 mg/mL时,由CuSO4和CuCl2所制备的纳米花均达到最高的酶活力回收率。其中Lip-CuSO4的酶活力回收率为78.6%,Lip-CuCl2为110.6%。从图4-b可知,Lip-CuSO4在pH 6~8所测得的酶活力回收率均在90%左右,当PBS的pH为7时酶活力回收率最高可达93.4%, Lip-CuCl2酶活力回收率最高达137.9%。由图4-c所示,通过对比不同超声时间(1、5、10、15 min)对酶活力回收率的影响后发现,超声5 min所制备的Lip-CuSO4纳米花酶活力回收率最高可达86.4%,而超声10 min制备的Lip-CuCl2纳米花酶活力回收率最高可达145.7%。

a-酶浓度;b-PBS缓冲液pH;c-超声波时间
图4 Lip杂化纳米花制备条件优化
Fig.4 Optimization of preparation conditions for Lip hybrid nanoflowers
鉴于以上结果,在后续的实验中则选取金属离子浓度3 mmol/L、脂肪酶质量浓度0.05 mg/mL、pH 7的PBS、超声5 min作为Lip-CuSO4纳米花的制备条件。而Lip-CuCl2则以金属离子浓度2 mmol/L、脂肪酶质量浓度0.05 mg/mL、pH 7的PBS、超声10 min为最佳制备条件。通过以上合成条件优化,相较于优化前Lip-CuSO4的酶活力回收率从78.6%提升到了93.4%,Lip-CuCl2的酶活力则从110.6%提升到了145.7%。
2.3 Lip杂化纳米花的表征
2.3.1 SEM结果分析
由图5可知,对照组中并未观察到特定的形貌结构,而实验组中Lip-CuSO4纳米花结构呈现为松散的花瓣状;Lip-CuCl2和Lip-Cu(NO3)2相较于Lip-CuSO4结构则为更加致密的绣球花状。本研究中所形成的纳米花结构与此前使用Cu3(PO4)2·3H2O作为晶核固定脂肪酶的多篇文献所报道的纳米花结构基本一致[18, 22-23],从而进一步表明本研究中的Lip已被成功固定。

a-Lip-CuSO2对照;b-Lip-CuCl2对照;c-Lip-Cu(NO3)2对照;d-Lip-CuSO4;e-Lip-CuCl2;f-Lip-Cu(NO3)2
图5 Lip杂化纳米花SEM图
Fig.5 SEM image of Lip hybrid nanoflower
2.3.2 FT-IR结果分析
由图6可看出,在1 650 cm-1左右和1 540 cm-1左右分别存在来源于C![]() O双键以及N—H单键特征峰的伸缩振动,表明脂肪酶已被成功固定。而在1 050 cm-1左右可观察到来源于PO43-的特征峰,表明脂肪酶杂化纳米花中存在Cu3(PO4)2·3H2O,进一步说明脂肪酶已成功固定于Cu3(PO4)2·3H2O上[18, 22-23]。
O双键以及N—H单键特征峰的伸缩振动,表明脂肪酶已被成功固定。而在1 050 cm-1左右可观察到来源于PO43-的特征峰,表明脂肪酶杂化纳米花中存在Cu3(PO4)2·3H2O,进一步说明脂肪酶已成功固定于Cu3(PO4)2·3H2O上[18, 22-23]。

a-Lip-CuSO4;b-Lip-CuCl2;c-Lip-Cu(NO3)2
图6 Lip杂化纳米花FT-IR图
Fig.6 FT-IR image of Lip hybrid nanoflower
2.3.3 XRD结果分析
对比Cu3(PO4)2·3H2O标准卡片(JCPDS,卡片 00-022-0548),3种脂肪酶纳米花衍射峰与其基本吻合(图7),表明这3种脂肪酶杂化纳米花均具有良好的结晶度,且上述杂化纳米花的无机成分为Cu3(PO4)2·3H2O[18, 22-23]。
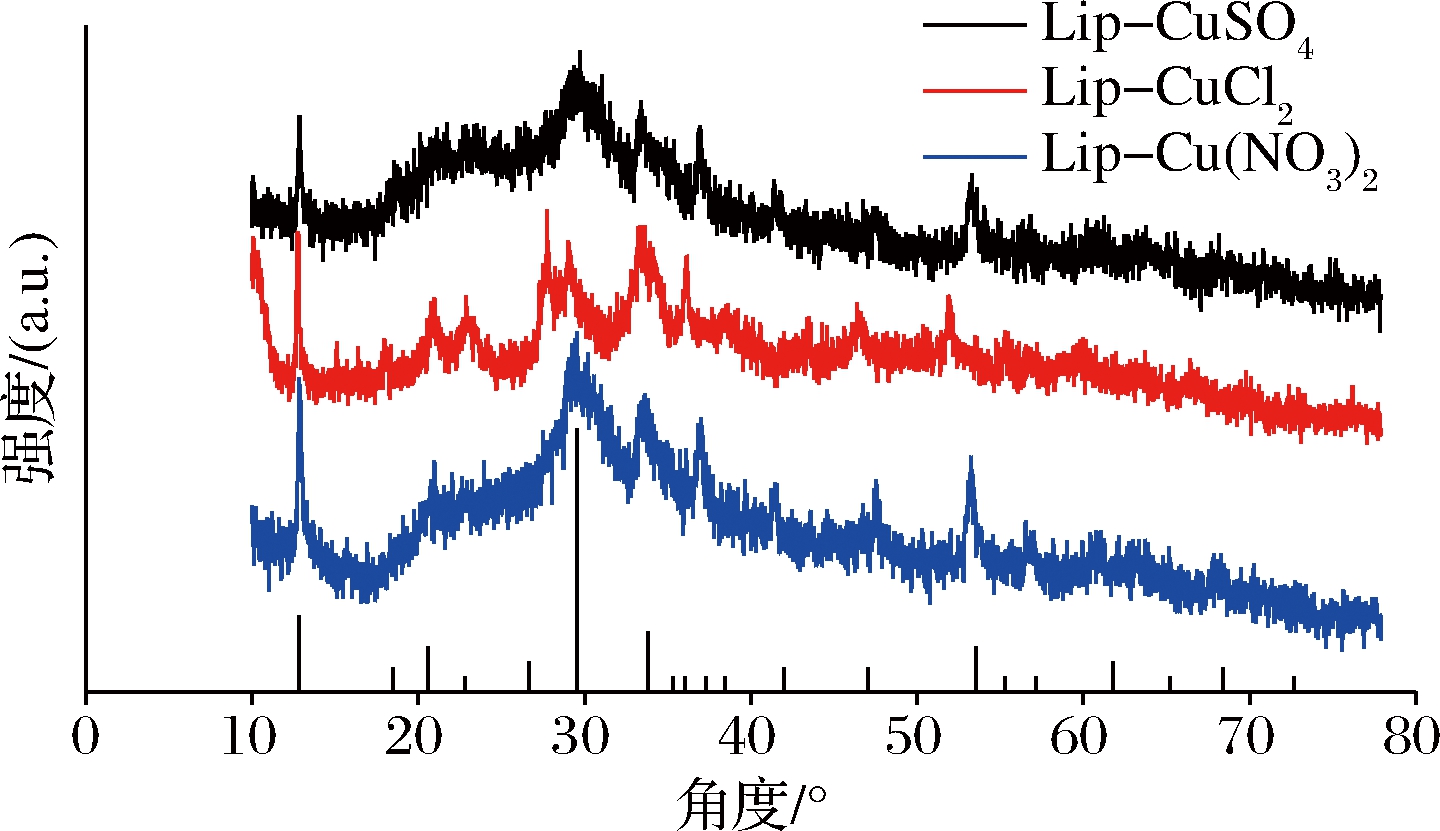
图7 Lip纳米花XRD图
Fig.7 XRD pattern of Lip Nanoflower
2.4 Lip与Lip杂化纳米花的酶学性质
如图8-a所示,Lip的最佳反应温度为85 ℃,通过固定化所获得的脂肪酶杂化纳米花的最适反应温度可提高至90 ℃。此外,游离酶与固定化酶在95 ℃时均可保持较高的酶活力,具有较强的热稳定性。由图8-b可看出,Lip固定化前后的最佳pH均为9,而固定化后的脂肪酶则拥有更宽泛的pH适用范围,说明杂化纳米花的形成可以保护酶免受极端条件的影响[22]。值得注意的是,本研究中所固定的脂肪酶本身已具备较高的温度以及pH稳定性(图8-c和图8-d)。尽管Lip-CuSO4与Lip-CuCl2纳米花的pH稳定性都较好,且Lip-CuCl2纳米花具有更高的酶活力,但这2种杂化纳米花的温度稳定性均低于游离酶。此现象可能是由于固定化过程中破坏了酶的部分结构使酶的刚性下降所引起的[20]。
a-最适反应温度;b-最适反应pH;c-温度稳定性;d-pH稳定性
图8 温度和pH对游离酶和Lip纳米花的影响
Fig.8 Effect of temperature and pH on free enzymes and Lip nanoflowers
针对游离酶和固定化酶,通过测量其对不同浓度的对硝基苯酚棕榈酸脂的初始反应速率,利用Origin软件中的Michaelis-Menten方程进行非线性曲线拟合,得到Km和Vm值,并计算kcat 和kcat/Km值。如表1所示,游离酶的Km值为0.005 mmol/L, Lip-CuSO4纳米花Km基本无变化,Lip-CuCl2纳米花的Km值提高了2.6倍,表明固定化后的酶对底物的亲和能力有所降低。这可能是由于酶的构象发生变化,导致形成的底物-酶复合物的概率降低;或者是由于传质阻力的增加导致底物对固定化酶活性位点的可及性降低,但与底物的弱结合可能使酶易于在反应部位消除产物[21,24]。在催化效率方面,Lip-CuSO4纳米花的kcat/Km值增加了约6%,Lip-CuCl2纳米花的kcat/Km值增加了约34%。结果表明脂肪酶纳米花将底物转化为产物的活性有所增强,这可能与脂肪酶纳米花独特的花状结构具有高比表面积有关[23]。
表1 游离酶和Lip纳米花动力学参数
Table 1 Kinetic parameters of free enzyme and Lip nanoflower

酶Km/(mmol·L-1)kcat/(s-1)kcat/Km/(s-1·L·mmol-1)Lip0.005 031.538305.5Lip-CuSO40.004 961.620 7326.8Lip-CuCl20.013 133.634407.7
2.5 Lip纳米花的储藏稳定性与可重复使用性
固定化酶的储藏稳定性与可重复使用性对于实际应用有重要的意义,本研究通过长期室温储存以及连续5个反应分别评估了脂肪酶杂化纳米花的储藏稳定性以及可重复使用性。如图9-a所示,在经过30 d的室温储藏后游离酶的酶活力只有原来的44%,而固定化酶仍能保持80%以上的酶活力,这可能是由于纳米花独特的花状结构能够更好地保护酶免受外界条件的干扰[22]。

a-储藏稳定性;b-可重复使用性
图9 Lip纳米花的储藏稳定性与可重复使用性
Fig.9 Storage stability and reusability of Lip nanoflower
如图9-b所示,脂肪酶杂化纳米花在连续使用5次后仍能保持近40%的酶活力,而彭开敏等[25]以猪肝酯酶作为有机部分,磷酸钙作为无机部分制备纳米花,在固定化酶重复使用6次后活性仅为10%左右,表明本研究中所采取的固定化策略可有效提高该嗜热脂肪酶的可重复使用性。
3 结论与讨论
本文系统地研究了不同金属离子、铜盐类型、酶浓度、超声时间和PBS的pH对脂肪酶杂化纳米花活性的影响。发现采用声化学方法制备的杂化纳米花Cu2+固定化效果最好。在铜盐类型的研究中发现SO42-可能有助于提高脂肪酶杂化纳米花的载量,而Cl-与NO3-则有助于脂肪酶杂化纳米花酶活力的提升。上述差异可能是由不同铜盐类型制备的脂肪酶纳米花结构不同所导致的。通过SEM、FT-IR和XRD分析表明Lip成功固定于Cu3(PO4)2·3H2O上。与游离酶相比,Lip-CuSO4与Lip-CuCl2纳米花的最适反应温度有所提高,而最适反应pH无变化。在催化效率方面,Lip-CuSO4的催化效率是游离酶的106%,Lip-CuCl2的催化效率是游离酶的134%。此外,制备的脂肪酶杂化纳米花,室温储藏30 d仍能保持80%以上的酶活力,有效地提升了该酶的储藏稳定性。综上所述,采用声化学方法制备无机杂化纳米花可为脂肪酶固定化提供一种简单快捷的途径,并且在一定程度上提高固定化酶的催化活性和稳定性,进一步证实通过该方法获得的Lip杂化纳米花在工业生物催化方面具有广泛的应用潜力。
[1] 彭燕鸿, 苏爱秋, 黄伟文, 等.微生物嗜热脂肪酶研究进展[J].食品与发酵工业, 2021, 47(6):289-294.
PENG Y H, SU A Q, HUANG W W, et al.Research progress on microbial thermophilic lipase[J].Food and Fermentation Industries, 2021, 47(6):289-294.
[2] CHOI J M, HAN S S, KIM H S.Industrial applications of enzyme biocatalysis:Current status and future aspects[J].Biotechnology Advances, 2015, 33(7):1 443-1 454.
[3] BREN K L.Engineered biomolecular catalysts[J].Journal of the American Chemical Society, 2017, 139(41):1 4 331-14 334.
[4] GAO J, SHI L L, JIANG Y J, et al.Formation of lipase Candida sp. 99-125 CLEAs in mesoporous silica:Characterization and catalytic properties[J].Catalysis Science & Technology, 2013, 3(12):3353.
[5] XIANG X R, SUO H B, XU C, et al.Covalent immobilization of lipase onto chitosan-mesoporous silica hybrid nanomaterials by carboxyl functionalized ionic liquids as the coupling agent[J].Colloids and Surfaces B:Biointerfaces, 2018, 165:262-269.
[6] JIN W B, XU Y, YU X W.Formation lipase cross-linked enzyme aggregates on octyl-modified mesocellular foams with oxidized sodium alginate[J].Colloids and Surfaces B:Biointerfaces, 2019, 184:110501.
[7] LI J, ZHANG J D, SHEN S G, et al.Magnetic responsive Thermomyces lanuginosus lipase for biodiesel synthesis[J].Materials Today Communications, 2020, 24:101197.
[8] 张昕怡, 许蕊, 王钰棋, 等.新型嗜热耐碱脂肪酶的纯化表征及应用[J].化工学报, 2020, 71(11):5 246-5 255.
ZHANG X Y, XU R, WANG Y Q, et al.Purification and characterization of novel thermo-alkaline lipase and its application[J].CIESC Journal,2020, 71(11):5 246-5 255.
[9] SHAHINYAN G, MARGARYAN A, PANOSYAN H, et al.Identification and sequence analyses of novel lipase encoding novel thermophillic bacilli isolated from Armenian geothermal springs[J].BMC Microbiology, 2017, 17(1):103.
[10] LI J, LIU X M.Identification and characterization of a novel thermophilic, organic solvent stable lipase of Bacillus from a hot spring[J].Lipids, 2017, 52(7):619-627.
[11] ATALAH J, C CERES-MORENO P, ESPINA G, et al.Thermophiles and the applications of their enzymes as new biocatalysts[J].Bioresource Technology, 2019, 280:478-488.
CERES-MORENO P, ESPINA G, et al.Thermophiles and the applications of their enzymes as new biocatalysts[J].Bioresource Technology, 2019, 280:478-488.
[12] WANG Y H, LI Q S, ZHANG Z M, et al.Solvent effects on the enantioselectivity of the thermophilic lipase QLM in the resolution of (R, S)-2-octanol and (R, S)-2-pentanol[J].Journal of Molecular Catalysis B Enzymatic, 2009, 56(2-3):146-150.
[13] WANG C H, HAN H B, JIANG W, et al.Immobilization of thermostable lipase QLM on core-shell structured polydopamine-coated Fe3O4 nanoparticles[J].Catalysts, 2017, 7(12):49.
[14] LI Q, CHEN Y X, BAI S W, et al.Immobilized lipase in bio-based metal-organic frameworks constructed by biomimetic mineralization:A sustainable biocatalyst for biodiesel synthesis[J].Colloids and Surfaces B:Biointerfaces, 2020, 188:110812.
[15] GE J, LEI J D, ZARE R N.Protein-inorganic hybrid nanoflowers[J].Nature Nanotechnology, 2012, 7(7):428-432.
[16] WANG L B, WANG Y C, HE R, et al.A new nanobiocatalytic system based on allosteric effect with dramatically enhanced enzymatic performance[J].Journal of the American Chemical Society, 2013, 135(4):1 272-1 275.
[17] PATEL S K S, OTARI S V, LI J L, et al.Synthesis of cross-linked protein-metal hybrid nanoflowers and its application in repeated batch decolorization of synthetic dyes[J].Journal of Hazardous Materials, 2018, 347:442-450.
[18] BATULE B S, PARK K S, KIM M I, et al.Ultrafast sonochemical synthesis of protein-inorganic nanoflowers[J].International Journal of Nanomedicine, 2015, 10:137-142.
[19] SHA C, YU X W, LIN N X, et al.Enhancement of lipase r27RCL production in Pichia pastoris by regulating gene dosage and co-expression with chaperone protein disulfide isomerase[J].Enzyme and Microbial Technology, 2013, 53(6-7):438-443.
[20] ZHANG B L, LI P T, ZHANG H P, et al.Preparation of lipase/Zn3(PO4)2 hybrid nanoflower and its catalytic performance as an immobilized enzyme[J].Chemical Engineering Journal, 2016, 291:287-297.
[21] SAR M, AKGÖL S, KARATA
M, AKGÖL S, KARATA M, et al.Reversible immobilization of catalase by metal chelate affinity interaction on magnetic beads[J].Industrial & Engineering Chemistry Research, 2006, 45(9):3 036-3 043.
M, et al.Reversible immobilization of catalase by metal chelate affinity interaction on magnetic beads[J].Industrial & Engineering Chemistry Research, 2006, 45(9):3 036-3 043.
[22] CHEN J X, GUO Z T, XIN Y, et al.Preparation of efficient, stable, and reusable copper-phosphotriesterase hybrid nanoflowers for biodegradation of organophosphorus pesticides[J].Enzyme and Microbial Technology, 2021, 146:109766.
[23] LI C H, ZHAO J, ZHANG Z J, et al.Self-assembly of activated lipase hybrid nanoflowers with superior activity and enhanced stability[J].Biochemical Engineering Journal, 2020, 158:107582.
[24] MA X J, ZHANG L, XIA M F, et al.Mimicking the active sites of organophosphorus hydrolase on the backbone of graphene oxide to destroy nerve agent simulants[J].ACS Applied Materials & Interfaces, 2017, 9(25):21 089-21 093.
[25] 彭开敏,叶泰,曹慧,等.猪肝酯酶杂化“纳米花”的制备及其对菊酯类农药的水解性能研究[J].分析测试学报, 2018, 37(12):1 412-1 417.
PENG K M, YE T, CAO H, et al.Preparation of porcine liver esterase hybrid “Nanoflowers” and their hydrolyzing properties toward pyrethroid pesticides[J].Journal of Instrumental Analysis, 2018, 37(12):1 412-1 417.