番茄红素(lycopene)是一种脂溶性天然色素,具有强抗氧化和清除自由基的活性,能抗衰老、调血脂和预防各种癌症,已被用于健康食品和功能性饮料的开发。番茄红素属于四萜类化合物,其生物合成通过异戊烯基焦磷酸(isopentenyl diphosphate, IPP)和二甲基烯丙基焦磷酸(dimethylallyl diphosphate, DMAPP)作为前体,由香叶基香叶基二磷酸合成酶(CrtE)生成香叶基二磷酸酯,在八氢番茄红素合成酶(CrtB)作用下合成八氢番茄红素,然后由八氢番茄红素去饱和酶(CrtI)作用产生番茄红素。IPP和DMAPP来源于甲羟戊酸(mevalonate, MVA)途径和2-C-甲基-D-赤藓醇-4-磷酸(methyl-D-erythritol 4-phosphate, MEP)途径,微生物中酵母和其他真菌通常存在MVA途径,而大多数细菌如大肠杆菌只存在MEP途径[1]。番茄红素主要通过植物天然提取、化学合成和微生物合成获取,但植物天然提取法成本高,化学合成法有化学残留且易造成环境污染。相比而言,微生物合成具有无污染、生产周期短等优势,是较为理想的生产方式。
利用微生物作为细胞工厂异源合成番茄红素已成为当前研究热点,特别是大肠杆菌作为常用萜类合成底盘细胞,具有MEP途径为异源合成番茄红素直接提供前体,有明显的天然优势和研究前景。目前微生物异源生产番茄红素主要依赖于代谢工程改造来提高其产量。ALPER等[2]采用基因组尺度代谢流平衡分析,组合敲除谷氨酸脱氢酶(△gdhA)、丙酮酸脱氢酶(△aceE)和甲醛脱氢酶(△fDhE),增强E.coli内源MEP途径的前体物质DMAPP和IPP合成,使番茄红素产量提高37%。XIE等[3]对番茄红素合成酶(CrtYB)进行修饰,与来源于红发夫酵母(Xanthophyllomyces dendrorhous)crtI和crtE及酿酒酵母MVA途径中限速酶HMG1催化区tHMG1共表达,使番茄红素单位细胞产量达到24.41 mg/g菌体干重(dry cell weight,DCW)。
培养基成分和发酵条件优化也是提高微生物异源生产番茄红素的通用策略。KIM等[4]对产番茄红素工程菌的培养基进行碳源优化,将葡萄糖和L-阿拉伯糖作为辅助碳源补充到以甘油为碳源的培养基中,使番茄红素的浓度和得率显著提高,终产量达到1.35 g/L,比优化前提高了约7倍。JIN等[5]构建异源合成番茄红素重组菌株,以LB培养基作对照,另外选取2×YT+G培养基和SM培养基进行优化,优化后2×YT+G培养基的产量最高,相比优化前提高1.12倍。本研究基于已构建的大肠杆菌番茄红素异源合成质粒pACLYC,首先筛选出高产番茄红素的大肠杆菌菌株,在LB培养基基础上,通过单因素试验和响应面法优化大肠杆菌生产番茄红素的培养条件,进一步提高番茄红素合成效率,为大肠杆菌异源生产番茄红素奠定基础,进而促进番茄红素相关益生制剂及功能性食品开发。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒
大肠杆菌DH5α、JM110、Top10和BL21(DE3)及pACLYC质粒,本实验室保存。pACLYC携带番茄红素合成酶基因crtE、crtB和crtI,氯霉素抗性。由大肠杆菌异源合成番茄红素途径可知,大肠杆菌以内源IPP和DMAPP合成FPP为前体,通过CrtE、CrtB和CrtI 3个异源酶连续催化合成番茄红素。
1.1.2 培养基和抗生素
LB培养基(g/L):胰蛋白胨10、酵母浸出粉5、NaCl 10。LB固体培养基需加入20 g/L琼脂粉。本研究添加的抗生素为氯霉素,其工作浓度为50 μg/mL。
1.1.3 主要试剂和仪器
番茄红素(HPLC级,≥90%,CAS#502-65-8)标准品,上海源叶生物有限公司;Trizol、氯霉素,生工生物工程(上海)股份有限公司;二氯甲烷、丙酮为分析纯,甲醇为色谱纯,国药集团;质粒提取试剂盒,Axygen公司;Nanodrop 2000c超微量核酸蛋白定量仪,美国Thermo公司;冷冻离心机,德国Sigma公司;DU-800型分光光度计,美国Beckman公司;生化培养箱,上海博迅实业有限公司;Lightcycle96实时PCR系统,瑞士Roche公司。
1.2 实验方法
1.2.1 重组大肠杆菌构建
分别取1 μL pACLYC质粒转化至100 μL E.coli DH5α、JM110、Top10和BL21(DE3)感受态细胞,冰上静置30 min,42 ℃水浴90 s后冰上静置5 min,加入900 μL LB液体培养基于37 ℃下200 r/min摇床复苏1 h,取100 μL菌液涂布于含氯霉素的LB固体培养基,倒置于37 ℃恒温箱培养16 h挑取转化子。
1.2.2 宿主菌发酵
挑取1.2.1中平板上长出的单菌落接种于含4 mL LB培养基的试管中,37 ℃、200 r/min振荡培养12 h,然后按2%(体积分数)接种量转接至250 mL锥形瓶(含50 mL LB培养基)中,37 ℃、200 r/min发酵24 h后收集菌体用于番茄红素提取和测定产量。
1.2.3 标准曲线的制备
称取2 mg番茄红素标准品,加入丙酮进行溶解,定容至10 mL容量瓶,配制成200 μg/mL母液。将其用丙酮稀释成150、100、50、25、12.5 μg/mL溶液后在波长472 nm处测定吸光值。以番茄红素质量浓度X(μg/mL)对吸光值Y进行线性回归,回归方程为Y=0.002 8X-0.015,R2为0.996。
1.2.4 生物量和番茄红素检测
将发酵液稀释5倍后,用分光光度计测定OD600,菌体总OD600值为稀释倍数乘以稀释菌液的OD600读数。取10 mL发酵液于已称重的离心管中,离心收集菌体后置于65 ℃烘干至恒重,称量获得发酵液中菌体干重,建立OD600与菌体干重的线性关系。
用1 mL丙酮进行番茄红素萃取,置于55 ℃水浴锅中萃取15 min,其间每隔5 min涡旋振荡20 s,然后12 000×g离心10 min取上清液用分光光度计在472 nm下检测番茄红素含量,代入1.2.3中的回归方程[6]。
1.2.5 单因素实验
基于LB培养基,分别添加葡萄糖、果糖、蔗糖和甘油等碳源(6 g/L)及不同浓度(0、2、4、6、8、10 g/L)的果糖,柠檬酸氢二铵、NH4Cl、(NH4)2SO4和尿素等无机氮源(5 g/L)及不同NH4Cl质量浓度(0、5、10、15、20 g/L),正己烷、正庚烷、正十二烷和正十六烷等氧载体(10%,体积分数)和不同正十二烷体积分数(0%、5%、10%、15%、20%)对番茄红素产量的影响,确定最佳条件。
1.2.6 响应面优化试验设计
在单因素试验的基础上,采用Box-Behnken响应面设计,对大肠杆菌异源生产番茄红素的关键因素进一步优化,以获得番茄红素高产。
1.2.7 RNA提取和q-PCR反应
大肠杆菌工程菌培养后收集菌体,参照生工Trizol法提取RNA,Nanodrop 2000c测定RNA浓度,琼脂糖凝胶电泳检测RNA完整度。然后依据TaKaRa公司反转录试剂盒的方法制备cDNA。q-PCR通过Lightcycle96实时PCR系统进行测定。用2-ΔΔCT方法分析每个基因的数据,以clpB基因作为内参基因,基因引物由华大基因股份有限公司合成(表1)。
表1 本研究使用的引物序列
Table 1 Primers used in this study

引物名称引物序列 (5′→3′)Dxs-FGGAATTGGTATTGCGGTTGCDxs-RAATCACCAGCATATCAGGACGDxr-FACTCGCATGGTAGAACAGTGDxr-RTTGCCCACTTAAGACTTCGGIspD-FTCGTGAGCTGTTACATGACTGIspD-RGGCGCGTGACTTTAATGTTATCIspE-FTGTTCCTGTCTTTGTTCGGG
续表1

引物名称引物序列 (5′→3′)IspE-RGTCGGAATACTTACACCAGGGIspF-FGTTGACCGATGCATTGCTTGIspF-RTATAACCCTTCGCCTGAATACGIspG-FAGCAACGCCTGGAAGATATCIspG-RGCACGCCATCTTCATAGAGGIspH-FTCCTGATTTTCTCCGCACACIspH-RGCATCAAACACCGTCAAATCGIDI-FCTTACATCTCGCGTTCTCCAGIDI-RTCTTCGTTGCTTTCTCCCAGClpB-FCACCGCCAACATTACTCAAGClpB-RTCTTCAGCACCTTGATCGTTC
1.3 数据处理
所有实验数据为3次重复实验平均值,采用Origin 2019作图,SPSS Statistics 26.0、Design-Expert 10.0.0进行数据处理与分析。
2 结果与分析
2.1 不同大肠杆菌菌株对番茄红素生产的影响
NAM等[7]采用4种不同大肠杆菌异源合成β-胡萝卜素,发现不同宿主生产β-胡萝卜素具有明显差异,不同大肠杆菌异源合成番茄红素可能存在明显差异。本研究采用4株大肠杆菌DH5α、JM110、Top10和BL21(DE3)作为番茄红素异源生产宿主。结果表明Top10番茄红素产量和得率高于其他菌株,达到124.8 mg/L和12.43 mg/g。BL21(DE3)发酵产量仅次于Top10(118.4 mg/L),其次是DH5α和JM110,表明不同菌株异源合成番茄红素确实存在显著差异(图1)。4株菌株都是常用的大肠杆菌菌株,但只有BL21(DE3)是最常用蛋白表达宿主菌,能高效表达各种异源蛋白,其余3种菌株都为常见的基因工程克隆宿主。Top10得率也显著高于其他3株菌,可能是由于其MEP途径合成前体IPP和DMAPP最强。
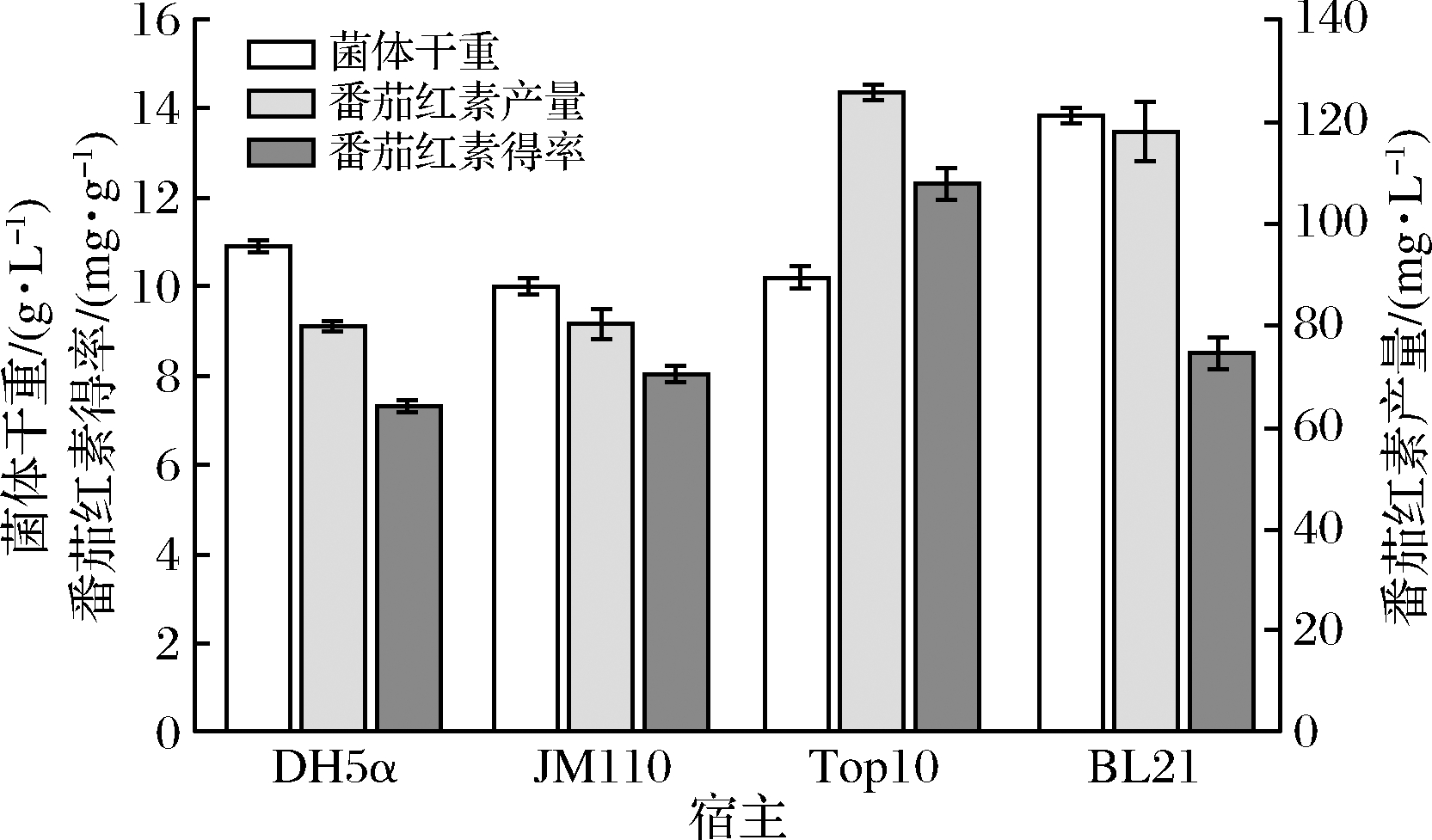
图1 不同大肠杆菌菌株对番茄红素生产的影响
Fig.1 Effect of different E.coli strains on lycopene production
注:番茄红素得率均通过测定菌体干重(DCW)得到(下同)
李文[8]在选择异源合成番茄红素的大肠杆菌时,BL21(DE3)合成番茄红素的产量也不是最高,与本研究结果相似。因此,E.coli Top10/pACLYC为生产番茄红素的最优重组菌株用于后续研究。
2.2 单因素试验优化大肠杆菌异源合成番茄红素
LB培养基是大肠杆菌培养使用最普遍的培养基,它可以促使微生物以较高生长率快速生长。为进一步提高大肠杆菌异源合成番茄红素产量,通过单因素试验对LB培养基进行优化,分析碳源、无机氮源和氧载体对大肠杆菌异源合成番茄红素的影响。
2.2.1 碳源对番茄红素生产的影响
微生物生长与代谢产物积累受培养基显著影响,在LB培养基中添加碳源能改善菌株生长和影响目标代谢物合成。本研究选取的4种常见碳源中,添加果糖的番茄红素产量和得率最高,达到326 mg/L和15.8 mg/g,而添加蔗糖和甘油的番茄红素产量和得率与LB培养基(空白)相比差异不大,添加蔗糖产量和得率为80.6 mg/L和7.6 mg/g,添加甘油产量和得率为83.6 mg/L和5.1 mg/g。添加葡萄糖得到的番茄红素产量及得率最低,仅为22.5 mg/L和1.8 mg/g(图2-a)。李文[8]也发现添加果糖后番茄红素产量最高,与本研究结果一致,这可能与E.coli Top10/pACLYC对果糖的利用效率有关。DU等[9]比较分别添加葡萄糖和果糖的大肠杆菌工程菌转录情况,发现果糖吸收代谢、丙酮酸分解代谢、三羧酸(tricarboxylic acid, TCA)循环和氧化磷酸化相关的基因转录差异显著(P<0.05)。MEP途径需要消耗大量的NADPH和ATP,增强胞内还原力和能量供给是提高异源萜类合成的关键[4]。果糖添加后提高TCA循环和磷酸戊糖途径模块基因表达,增加NADH和NADPH供给和加强MEP途径的前体物3-磷酸甘油醛和丙酮酸的合成代谢。TCA循环中基因转录水平显著变化也暗示细胞的NADH和NADPH还原力供给增加,为菌体生长和番茄红素合成提供丰富的辅助因子和能量[10]。
确定果糖是大肠杆菌异源合成番茄红素最佳碳源后,进一步对果糖最适添加浓度进行优化。当果糖质量浓度为6 g/L时,番茄红素产量和得率最高,达到445.8 mg/L和23.35 mg/g,显著高于其他浓度组(P<0.05);随着果糖浓度进一步增加,番茄红素合成趋势显著下降,当果糖质量浓度为10 g/L时,番茄红素产量和得率仅为119.1 mg/L和6.04 mg/g。研究表明果糖质量浓度为6 g/L时,大肠杆菌生长达到稳定,且番茄红素产量最高,而过高浓度果糖对番茄红素合成不利(图2-b)。

a-碳源种类;b-果糖
图2 不同碳源对番茄红素生产的影响
Fig.2 Effect of different carbon sources on lycopene production
2.2.2 无机氮源对番茄红素生产的影响
氮源对微生物生长同样不可或缺,用于细胞大分子物质(如蛋白质、核酸等)和含氮代谢物的合成,充足的氮源是实现高效合成的必要条件。MUSSAGY等[11]研究添加氮源对红酵母CCT-2186生产类胡萝卜素的影响,发现无机氮源NH4NO3的补给能进一步促进目标代谢物胡萝卜素合成和积累。本研究选取的4种无机氮源中,添加NH4Cl的番茄红素产量和得率最高,达到562.4 mg/L和24.03 mg/g。添加柠檬氢二铵后番茄红素产量和得率与空白LB培养基相比显著下降(P<0.05),可能是柠檬氢二铵会使发酵液的pH值显著降低,在酸性条件下酶的催化活性显著降低,抑制菌体生长和色素合成(图3-a)。李一萌[12]选择5种氮源对产番茄红素工程菌株的培养基进行优化,发现不同氮源对菌体生长和类胡萝卜素合成存在显著差异(P<0.05),与本研究类似。
随着NH4Cl浓度增加,番茄红素产量和单位细胞得率随之增加,在添加质量浓度为5 g/L时,番茄红素产量和得率最高,达到537.4 mg/L和24.4 mg/g,显著高于其他NH4Cl添加浓度(P<0.05),表明NH4Cl质量浓度为5 g/L时细胞活力旺盛,环境适应能力强,能够使番茄红素发酵体系发挥最大功效,而过高浓度NH4Cl对菌体番茄红素合成有抑制作用,反而降低产量(图3-b)。与只添加果糖相比,NH4Cl添加使番茄红素产量和得率进一步增加,表明添加NH4Cl后促进大肠杆菌异源合成番茄红素能力。
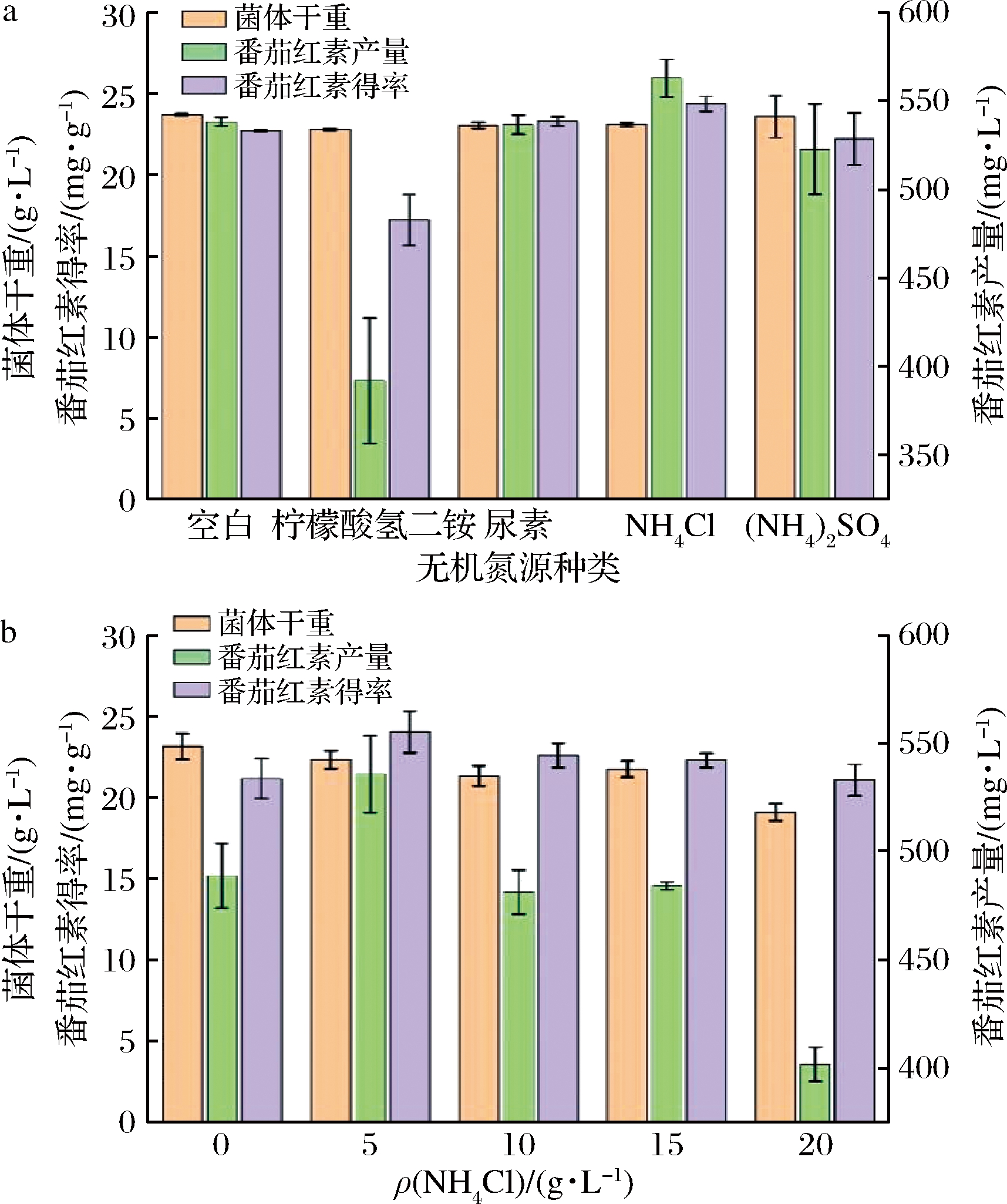
a-无机氮源种类;b-NH4Cl
图3 不同无机氮源对番茄红素生产的影响
Fig.3 Effect of different inorganic nitrogen sources on lycopene production
2.2.3 氧载体对番茄红素生产的影响
发酵工程中添加氧载体后可以减少气液传递阻力,提高氧传质效率[13]。任东雪等[14]采用添加氧载体的策略,选择正己烷、正庚烷和正十二烷等氧载体,显著提高前体L-谷氨酸转化效率。因此本研究选用正己烷、正庚烷、正十二烷和正十六烷作为氧载体[15],探讨氧载体对番茄红素生产影响。正十二烷发酵得到的番茄红素产量和得率高于其他氧载体,分别为457.5 mg/L和26.18 mg/g;正己烷发酵的番茄红素产量和得率却显著低于其他氧载体(P<0.05),仅为80 mg/L和5.87 mg/g,可能是由于10%正己烷的添加抑制菌体生长,显著影响番茄红素前体的合成和能量供给,造成产量和得率明显降低(图4-a)。与对照不添加氧载体相比,选用正庚烷、正十二烷和正十六烷都能促进番茄红素积累。ZHANG等[16]发现正十二烷是富马酸酶表达的最适氧载体,可以增加ATP浓度,改变能量代谢途径,为富马酸酶蛋白折叠提供充足的能量,与本研究结果相一致,选用正十二烷能更好促进番茄红素合成。
氧载体添加量对番茄红素合成也有明显差异,产量和得率随正十二烷含量的增加先升高后降低,添加量10%时番茄红素产量和得率达到最大值,且显著高于其他氧载体(P<0.05),达到512 mg/L和27.03 mg/g,说明氧载体正十二烷可提高番茄红素产量,且相较于添加果糖和NH4Cl,番茄红素得率最高(图4-b)。
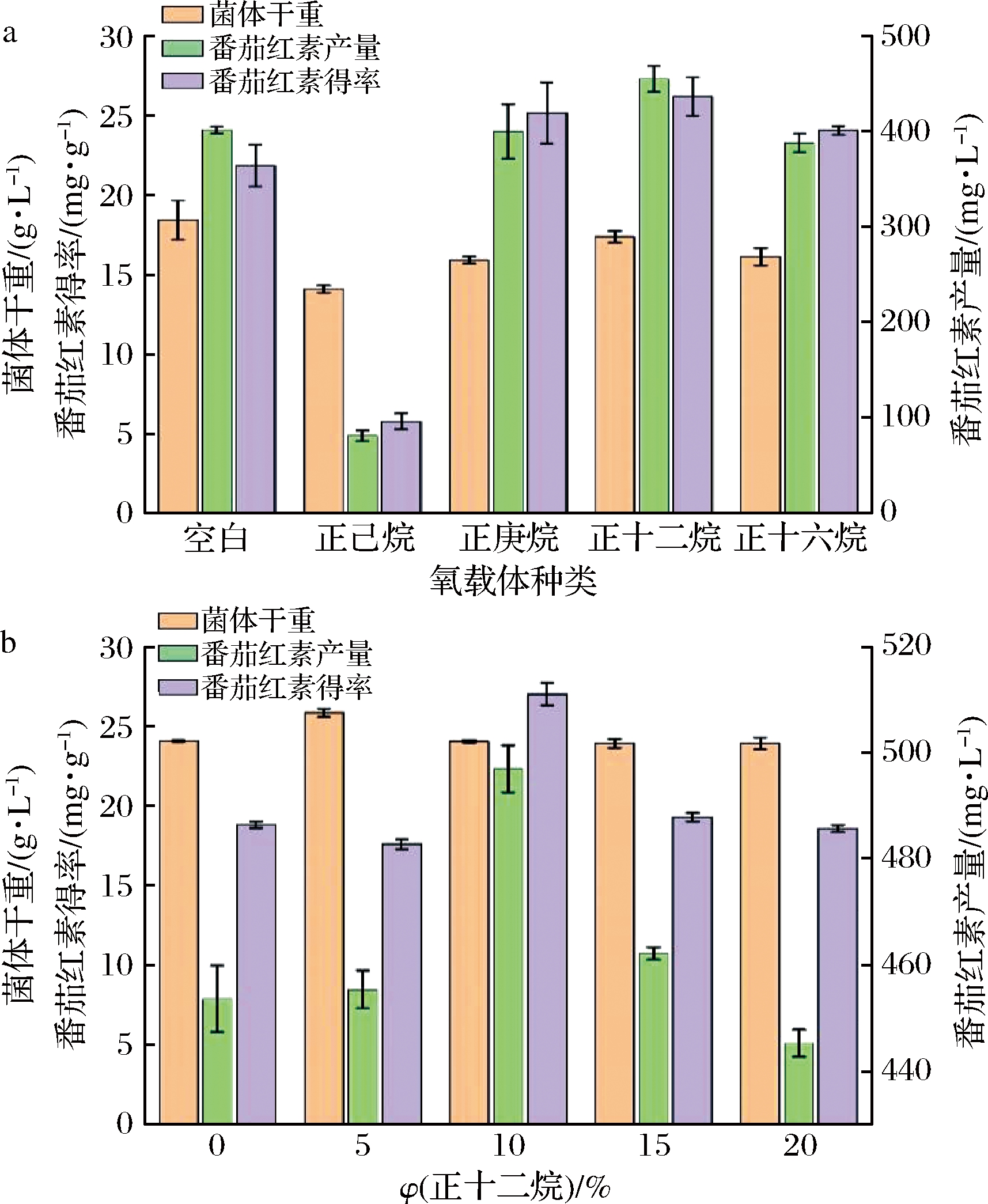
a-氧载体种类;b-正十二烷添加量
图4 不同氧载体对番茄红素生产的影响
Fig.4 Effect of different oxygen carriers on lycopene production
2.3 响应面法优化大肠杆菌生产番茄红素的条件
上述单因素试验结果发现果糖、NH4Cl和氧载体对番茄红素产量影响较为显著,本研究在此基础上利用响应面法采用Box-Behnken响应面设计对其进一步优化(表2)。
利用Design Expert软件对表2结果进行方差分析及二次多项回归拟合,得到大肠杆菌生产番茄红素得率对果糖、NH4Cl和正十二烷的多元回归方程为:
Y=84.29-14.76A-2.12B+3.08C+7.84AB+0.175 9AC-7.98BC-23.66A2-8.26B2-4.19C2
模型的方差和显著性分析结果中模型概率值P<0.000 1,表明该模型极显著,而模型的失拟项不显著(0.089 91>0.05),说明该模型拟合度较高(表3)。决定系数R2=0.998 6,调整决定系数![]() 0.996 7,说明此模型与实际拟合较好,误差较小,可用于对大肠杆菌生产番茄红素得率进行预测。
0.996 7,说明此模型与实际拟合较好,误差较小,可用于对大肠杆菌生产番茄红素得率进行预测。
表2 响应面试验设计和结果
Table 2 Box-Behnken design and results

试验号A(果糖)/(g·L-1)B(NH4Cl)/(g·L-1)C(氧载体)/(%)番茄红素得率/(mg·g-1 DCW)110101014.32 2651027.17 3651027.27 4651027.30 5601527.81 61001010.14 760520.44 8610523.75 91051514.32 1025522.25 11251523.91 122101018.62 13651026.91 14651027.48 156101520.81 16201024.58 17105512.44
方差分析中的显著性检验可以判断自变量对因变量的影响。果糖、NH4Cl和氧载体3个因素对响应值都有极显著影响(P<0.01);其中交互项果糖和NH4Cl,NH4Cl和氧载体影响极显著(P<0.01),果糖和NH4Cl不显著(P>0.05);各因素的平方项对响应值也具有极显著影响(P<0.01)。3个因素对大肠杆菌生产番茄红素得率的影响程度为:果糖添加量>正十二烷添加量>NH4Cl添加量。
表3 响应面试验结果方差分析
Table 3 Analysis results of regression and variance of response surface experiment

方差来源平方和自由度均方F值P值模型546.97960.77537.19<0.000 1∗∗A181.721181.721 606.26<0.000 1∗∗B3.7413.7433.050.000 7∗∗C7.9217.9269.99<0.000 1∗∗AB25.67125.67226.92<0.000 1∗∗AC0.012 910.012 90.114 20.745 4BC26.54126.54234.62<0.000 1∗∗A2245.811245.812 172.73<0.000 1∗∗B230.00130.00265.16<0.000 1∗∗C27.7217.7268.24<0.000 1∗∗残差0.791 970.113 1失拟项0.612 030.204 04.540.089 1净误差0.179 940.045 0总离差547.7616R2=0.998 6,R2adj=0.996 7
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
如图5所示,NH4Cl和正十二烷曲面斜度较为平缓,等高线图接近圆形,说明交互作用不显著(P>0.05);果糖和NH4Cl、果糖和正十二烷的曲面均较为陡斜,其等高线图偏椭圆形,表明交互作用显著(P<0.05),与方差分析结果一致。响应面最高点在模型设计范围之内,说明此响应面变量设计较好,可以用于后续分析。与传统方法相比通过响应面法建立模型,测试不同变量之间的整体关系,在多变量系统中能快速筛选关键因素。郭燕等[17]同样采用单因素试验和Box-Behnken试验优化发酵条件,使浓香型白酒中己酸乙酯和丁酸乙酯的含量分别增加1.68倍和1.38倍。张博等[18]采用响应面方法对肠杆菌MCYS-7生产L-半胱氨酸发酵条件进行优化,使得摇瓶发酵产量提高169%。
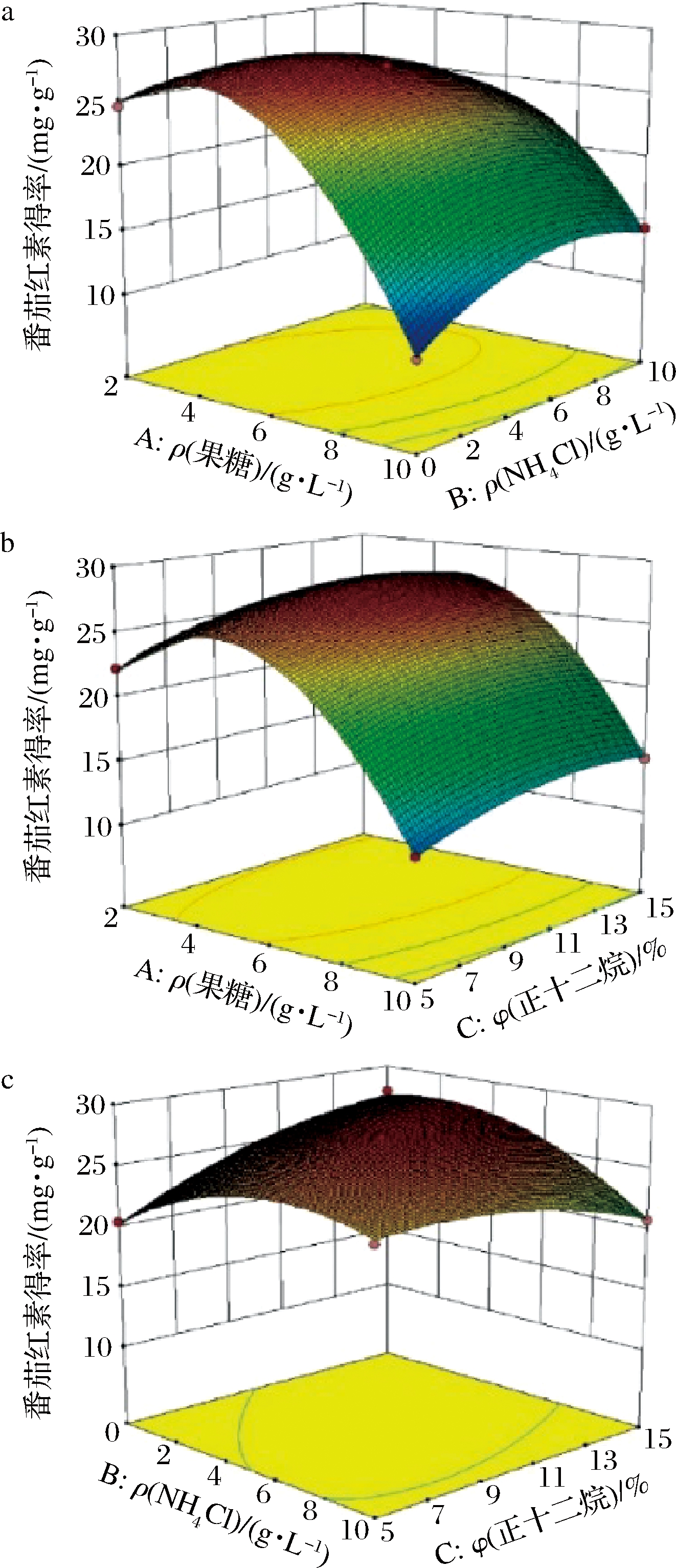
a-果糖与NH4Cl;b-果糖与正十二烷;c-NH4Cl与正十二烷
图5 各因素交互作用对大肠杆菌生产番茄红素的影响
Fig.5 Effect of the factors on lycopene production in E.coli
根据Design-Expert 10.0软件分析得出最优理论条件:果糖4.22 g/L、NH4Cl 0.89 g/L、正十二烷体积分数15%,预测产量为29.25 mg/g。按此条件生产番茄红素,实际产量达到29.3 mg/g,与预测值非常接近,说明模型能够较好预测大肠杆菌生产番茄红素的得率。与优化前相比,优化后的菌体和丙酮萃取液在颜色上明显加深,表明优化后的番茄红素产量更高(图6)。
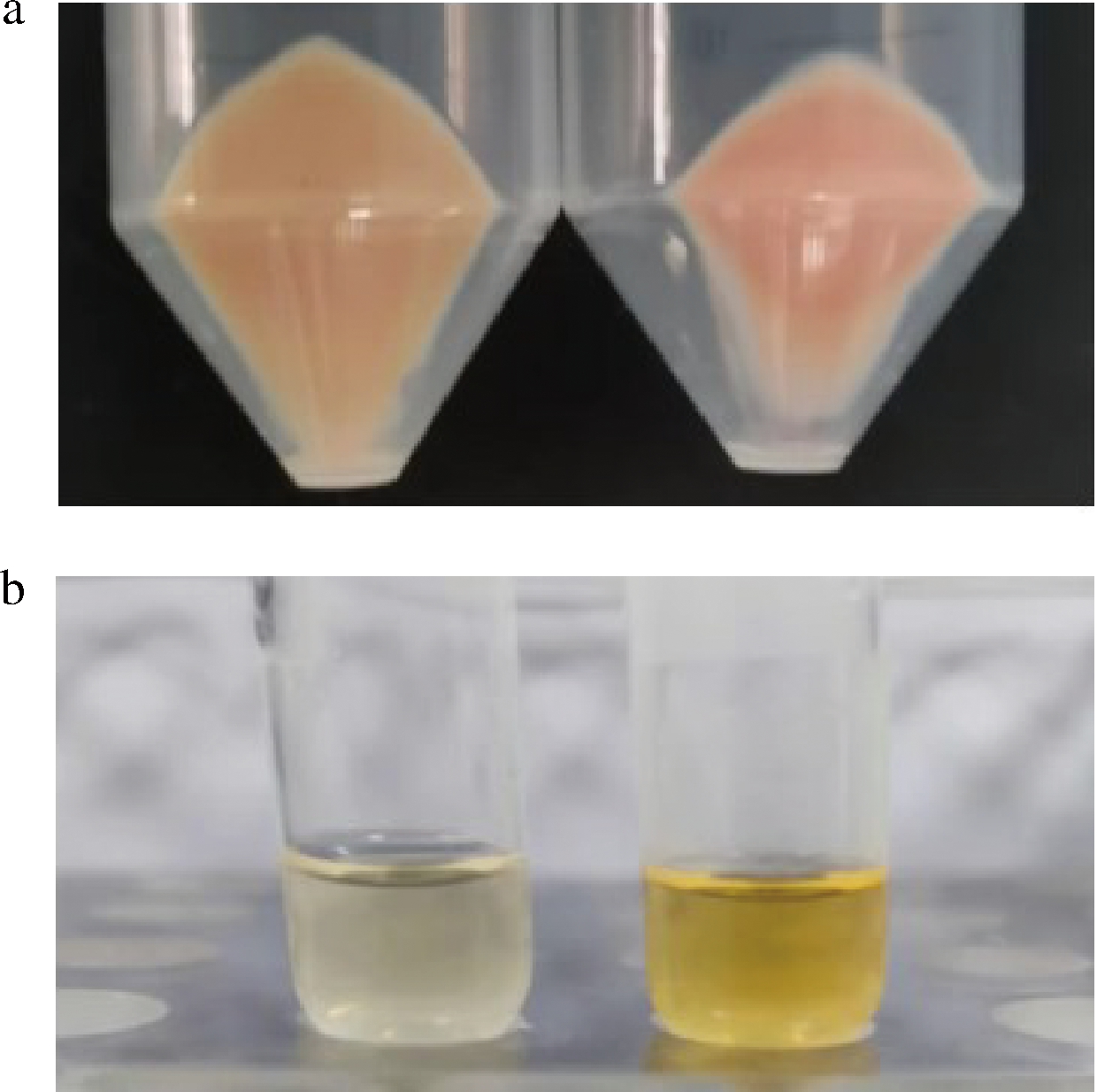
a-离心菌体;b-发酵萃取液
图6 优化前后的大肠杆菌菌体和萃取液
Fig.6 Cells and acetone extract of E.coli before and after optimization
注:左为优化前,右为响应面优化后
2.4 优化培养基对E.coli异源合成番茄红素转录水平的影响
本研究通过q-PCR分析番茄红素合成途径和相关基因在培养基优化前后的表达水平变化,结果表明优化后IspG、IspD、IspF、idi和crtE的mRNA表达量显著上调(图7)。大肠杆菌自身MEP途径代谢流量很弱,相关中间代谢物积累较少[19],基因表达量上调可促使更多的代谢通路流向番茄红素前体DMAPP和IPP的合成。DMAPP和IPP积累后进一步流向番茄红素合成,与crtE、crtB和crtI基因密切相关,优化后crtE的转录水平显著上调4.4倍,最终使番茄红素合成显著提高(P<0.05)。而部分基因(dxs和IspE)表达出现下调,可能是优化后中间代谢物积累使MEP途径产生反馈抑制[20]。异源生物合成模块与内源前体合成模块之间的代谢通量平衡是提高目标代谢物产量的关键因素和有效方法。本试验优化前后的关键基因转录水平差异也表明在异源合成过程中,调控前体和合成模块中关键基因表达,能显著促进目标代谢产物的合成。

图7 优化培养基后大肠杆菌异源合成番茄红素的基因的表达水平
Fig.7 The transcription of E.coli heterologous synthesizing lycopene gene through the optimized medium
3 结论
本研究筛选出大肠杆菌Top10为最佳番茄红素生产菌株,基于LB培养基,通过单因素试验和响应面法分析得出,果糖、NH4Cl和正十二烷对于番茄红素的产量影响极显著(P<0.01)。最佳培养基配比:LB培养基中添加4.22 g/L果糖、0.89 g/L NH4Cl和15%(体积分数)正十二烷。最优条件下番茄红素得率达到29.3 mg/g,相比优化前提高了138%。本研究显著提高番茄红素异源合成效率,为大肠杆菌生产番茄红素奠定基础。
[1] LI X, WANG Z X, ZHANG G L, et al.Improving lycopene production in Saccharomyces cerevisiae through optimizing pathway and chassis metabolism[J].Chemical Engineering Science, 2019, 193:364-369.
[2] ALPER H, JIN Y S, MOXLEY J F, et al.Identifying gene targets for the metabolic engineering of lycopene biosynthesis in Escherichia coli[J].Metabolic Engineering, 2005, 7(3):155-164.
[3] XIE W P, LV X M, YE L D, et al.Construction of lycopene-overproducing Saccharomyces cerevisiae by combining directed evolution and metabolic engineering[J].Metabolic Engineering, 2015, 30:69-78.
[4] KIM Y S, LEE J H, KIM N H, et al.Increase of lycopene production by supplementing auxiliary carbon sources in metabolically engineered Escherichia coli[J].Applied Microbiology and Biotechnology, 2011, 90(2):489-497.
[5] JIN W Y, XU X, JIANG L, et al.Putative carotenoid genes expressed under the regulation of Shine-Dalgarno regions in Escherichia coli for efficient lycopene production[J].Biotechnology Letters, 2015, 37(11):2 303-2 310.
[6] 杨帆, 苏卜利, 王永红, 等.启动子对重组大肠杆菌合成番茄红素能力的影响[J].食品与发酵工业, 2020, 46(17):27-32.
YANG F, SU B L, WANG Y H, et al.Effects of promoters for lycopene production in engineering Escherichia coli[J].Food and Fermentation Industries, 2020, 46(17):27-32.
[7] NAM H K, CHOI J G, LEE J H, et al.Increase in the production of β-carotene in recombinant Escherichia coli cultured in a chemically defined medium supplemented with amino acids[J].Biotechnology Letters, 2013, 35(2):265-271.
[8] 李文. 果糖提高crtEBI重组大肠杆菌合成番茄红素产量的研究[D].天津:天津科技大学, 2014.
LI W.Studies on enhancing lycopene production by fructose in crtEBI recombinant Escherichia coli[D].Tianjin:Tianjin University of Science & Technology, 2014.
[9] DU W, SONG Y J, LIU M Y, et al.Gene expression pattern analysis of a recombinant Escherichia coli strain possessing high growth and lycopene production capability when using fructose as carbon source[J].Biotechnology Letters, 2016, 38(9):1 571-1 577.
[10] 陈艳. 高产番茄红素酿酒酵母的设计构建与发酵过程优化[D].天津:天津大学, 2017.
CHEN Y.Design and construction of lycopene overproducing Saccharomyces cerevisiae and fermentation process optimization[D].Tianjin:Tianjin University, 2017.
[11] MUSSAGY C U, GUIMAR ES A A C, ROCHA L V F, et al.Improvement of carotenoids production from Rhodotorula glutinis CCT-2186[J].Biochemical Engineering Journal, 2021, 165:107827.
ES A A C, ROCHA L V F, et al.Improvement of carotenoids production from Rhodotorula glutinis CCT-2186[J].Biochemical Engineering Journal, 2021, 165:107827.
[12] 李一萌. 基因工程菌发酵与杜氏藻环化酶的阻遏产番茄红素的研究[D].广州:华南理工大学, 2015.
LI Y M.Research on lycopene production by optimizing fermentation conditions of genetically engineered bacteria and repressing lycopene cyclase Lyc B1 of Dunalie bardawil[D].Guangzhou:South China University of Technology, 2015.
[13] XIA Y J, CHEN Y, LIU X F, et al.Enhancement of antroquinonol production during batch fermentation using pH control coupled with an oxygen vector[J].Journal of the Science of Food and Agriculture, 2019, 99(1):449-456.
[14] 任东雪, 陈鹏程, 郑璞, 等.外源氧载体和前体L-谷氨酸添加策略提高Bacillus subtilis HB-1发酵产γ-聚谷氨酸[J].食品与生物技术学报, 2020, 39(6):84-92.
REN D X, CHEN P C, ZHENG P, et al.Addition of exogenous oxygen carrier and precursor L-glutamic acid enhanced the production of γ-poly glutamic acid by fermentation of Bacillus subtilis HB-1[J].Journal of Food Science and Biotechnology, 2020, 39(6):84-92.
[15] ZUO Z Q, XUE Q, ZHOU J, et al.Engineering Haloferax mediterranei as an efficient platform for high level production of lycopene[J].Frontiers in Microbiology, 2018, 9:2893.
[16] ZHANG S, SONG P, LI S.Application of n-dodecane as an oxygen vector to enhance the activity of fumarase in recombinant Escherichia coli:Role of intracellular microenvironment[J].Brazilian Journal of Microbiology, 2018, 49(3):662-667.
[17] 郭燕, 邓杰, 任志强, 等.响应面优化酿酒酵母与窖泥酯化细菌协同发酵产丁酸乙酯和己酸乙酯[J].食品科学, 2021, 42(10):209-217.
GUO Y, DENG J, REN Z Q, et al.Optimization of the production of ethyl hexanoate and ethyl butyrate by cofermentation of Saccharomyces cerevisiae and esterifying bacteria from pit mud of Chinese Baijiu using response surface methodology[J].Food Science, 2021, 42(10):209-217.
[18] 张博, 史永吉, 杨辉, 等.通过发酵优化提高大肠杆菌生产L-半胱氨酸产量[J].食品与发酵工业, 2021, 47(18):175-180.
ZHANG B,SHI Y J,YANG H, et al.Enhancement of L-cysteine production in Escherichia coli through fermentation optimization[J].Food and Fermentation Industries, 2021, 47(18):175-180.
[19] WANG J F, XIONG Z Q, LI S Y, et al.Exploiting exogenous MEP pathway genes to improve the downstream isoprenoid pathway effects and enhance isoprenoid production in Escherichia coli[J].Process Biochemistry, 2015, 50(1):24-32.
[20] BANERJEE A, WU Y, BANERJEE R, et al.Feedback inhibition of deoxy-d-xylulose-5-phosphate synthase regulates the methylerythritol 4-phosphate pathway[J].Journal of Biological Chemistry, 2013, 288(23):16 926-16 936.