γ-氨基丁酸(γ-aminobutyric acid, GABA)是一种天然存在的非蛋白质氨基酸,是中枢神经系统中重要的抑制性神经传导物质,主要存在于脑和骨髓中[1]。GABA是由谷氨酸脱羧酶(glutamic acid decarboxylase, GAD)不可逆催化L-谷氨酸(L-glutamic acid, L-Glu)生成的[2]。GABA具有多种生理功能,能够改善睡眠和治疗抑郁[3]、增强免疫力[4]、降低血压[5]、提高视觉皮层功能[6]、抵制肥胖[7]、减轻焦虑和更年期综合症[8]以及治疗癫痫病[9]等。
目前制备GABA的方法有化学合成法、植物富集法、微生物发酵法及全细胞转化法等。利用化学合成法生产GABA安全性较差,有化学残留,不易达到医药及食品行业的标准[10];植物富集法虽然安全性好,但制得的GABA浓度太低,无法用作医药、食品添加剂[11];微生物发酵法具有成本低的优点,但得到的GABA是一个多相的复杂体系,浓度低,下游分离成本高,是生产高纯度、高浓度GABA的一个瓶颈问题;全细胞转化法则克服了微生物发酵法分离提纯困难的缺点,具有产品浓度高、成本低等优点。
乳酸菌已广泛用于食品行业,被公认为是安全的(General Recognized As Safe, GRAS)食品级微生物[8]。中国国家卫生健康委员会已批准短乳杆菌(Lactobacillus brevis)与希氏乳杆菌(Lactobacillus hilgardii)发酵制备的GABA为新食品原料。CATALDO等[12]采用Lactobacillus brevis CRL 2013制备GABA,产量达到265 mmol/L(27.3 g/L);LYU等[13]采用Lactobacillus brevis 9530工程菌发酵制备GABA,最高产量达到104.38 g/L。孙丽慧等[14]以Lactobacillus brevis DLF-19076为发酵菌株,采用全细胞催化工艺使得GABA产量达到85.71 g/L,摩尔转化率为87.84%。本研究采用短乳杆菌GLB-127发酵制备GAD,利用短乳杆菌全细胞催化L-Glu制备GABA。
1 材料与方法
1.1 试验材料
1.1.1 菌种
短乳杆菌(Lactobacillus brevis)GLB-127,革兰氏阳性菌,为本实验室筛选保存。
1.1.2 培养基
种子培养基(g/L):葡萄糖20.0(单独灭菌),蛋白胨10.0,牛肉浸粉8.0,酵母浸粉4.0,K2HPO4 2.0,柠檬酸氢二铵2.0,乙酸钠5.0,MgSO4 0.2,MnSO4 0.04,吐温-80 1.0。pH 5.6,121 ℃灭菌15 min。
初始发酵培养基(g/L):葡萄糖20.0(单独灭菌),蛋白胨10.0,牛肉浸粉8.0,酵母浸粉4.0,L-谷氨酸钠10.0,K2HPO4 2.0,柠檬酸氢二铵2.0,乙酸钠5.0,MgSO4 0.2,MnSO4 0.04,吐温-80 1.0。pH 5.6,121 ℃灭菌15 min。
优化后发酵培养基(g/L)[15-16]:葡萄糖20.0(单独灭菌),蛋白胨10.0,玉米浆干粉15.0,牛肉浸粉8.0,酵母浸粉4.0,L-谷氨酸钠25.0,K2HPO4 2.0,柠檬酸氢二铵2.0,乙酸钠5.0,MgSO4 1.0,MnSO4 0.04,吐温-80 1.0。pH 5.6,121 ℃灭菌15 min。
1.2 实验方法
1.2.1 短乳杆菌的分子鉴定
1.2.1.1 基因组DNA的提取[17]
将原始菌接种于液体培养基扩大培养后利用TIANGEN DNA KIT提取原始菌基因组DNA。
1.2.1.2 PCR扩增
吸入适量基因组DNA,Taq酶,dNTPs及16S引物进行PCR扩增实验。引物序列为:27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-TACGGCTACCTTGTACGACTT-3′。引物由通用生物合成。
1.2.1.3 PCR产物电泳检测及测序
待PCR扩增反应完毕后,进行1%的琼脂糖凝胶电泳鉴定。使用Axygen凝胶回收试剂盒回收所需PCR产物片段,采用3730XL测序仪进行测序实验。
1.2.2 扫描电镜制样方法
采用德国蔡司公司的热场发射扫描电子显微镜观察菌体形态特征。将短乳杆菌湿菌体用2.5%戊二醛在4 ℃固定4 h。然后用磷酸盐缓冲液洗涤菌体2遍。最后采用乙醇梯度脱水,喷金观测[18]。
1.2.3 系统发育树构建
将测序所得16S rDNA序列在NCBI数据库中进行BLAST,根据序列同源性,选取不同模式菌株,采用MEGA-X构建系统发育树,确定菌株种属关系[19]。
1.2.4 培养方法
1.2.4.1 静置培养
将种子液以5%的接种量转接发酵摇瓶,将发酵摇瓶在30 ℃培养箱中静置培养48 h。
1.2.4.2 摇床培养
将种子液以5%的接种量转接发酵摇瓶,将发酵摇瓶在30 ℃摇床中以不同转速培养一定时间。
1.2.4.3 发酵罐培养
采用上海保兴BIOTECH-10BGZ发酵罐进行放大实验,碳源为葡萄糖,氮源为氨水,补料碳源与氮源根据pH变化由蠕动泵自动补入。
1.2.5 全细胞转化方法
初始转化体系组成为70.0 g/L的L-Glu,4.9 g/L MgSO4,1.0 g/L磷酸吡哆醛,全细胞催化酶质量浓度为25.0 g/L。
1.2.6 检测方法
1.2.6.1 菌体浓度[16]
取一定量的发酵液用纯化水稀释一定的倍数,用UV-1200分光光度计在600 nm下测定吸光值,计算得OD600。取一定体积发酵液离心去上清液称量,计算得菌体湿重。
1.2.6.2 GABA与L-Glu
采用岛津LC-20ADXR高效液相色谱仪测定,色谱柱为Inertsil ODS-C18色谱柱(4.6 mm×250 mm,5 μm);检测波长为210 nm;流动相为0.1%高氯酸与乙腈以体积比9∶1混合,pH 3.0;柱温30 ℃;进样量20 μL;分析时间为12 min。GABA与L-Glu混合标准品液相色谱检测图见图1。
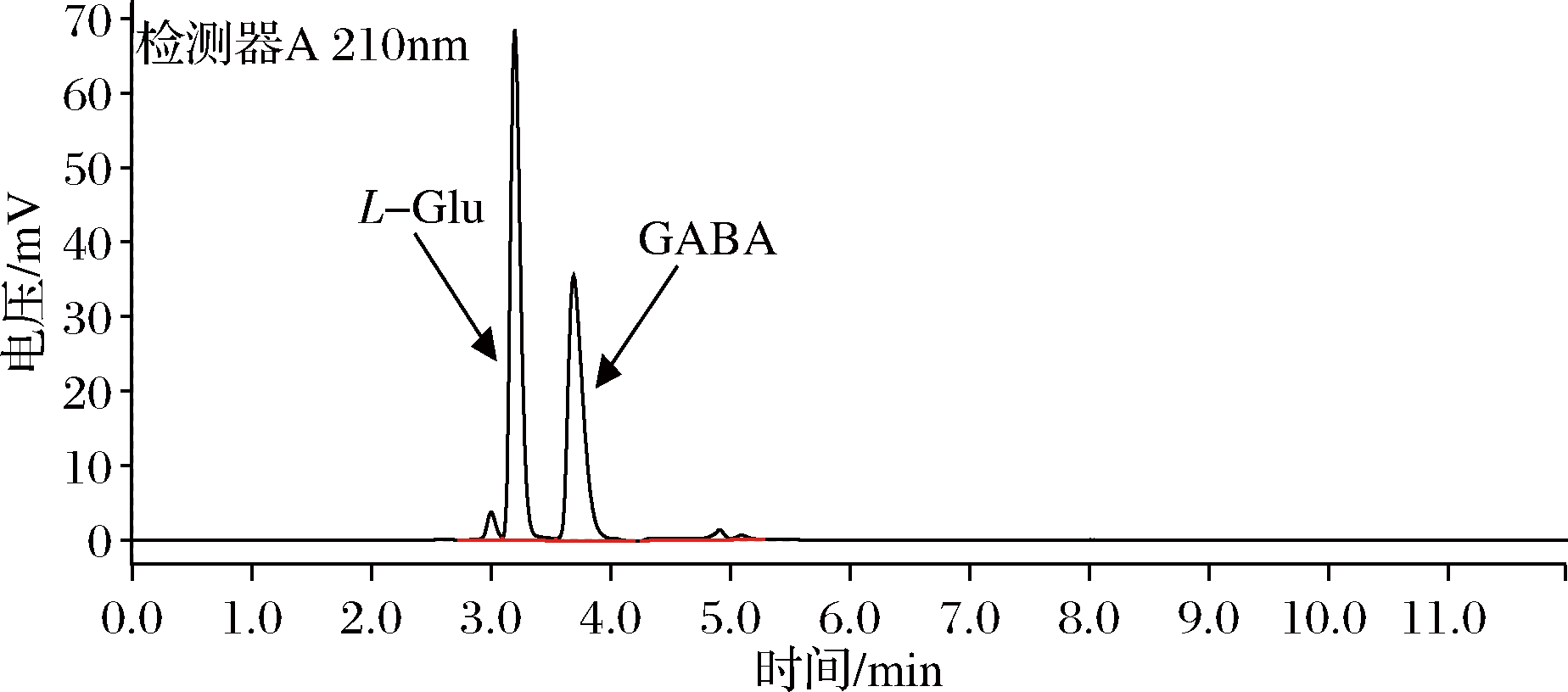
图1 GABA与L-Glu混合标准品HPLC检测图
Fig.1 HPLC chromatogram of GABA and L-Glu standard substance
1.2.6.3 酶活力测定
配制pH为4.4的0.2 mol/L醋酸钠溶液。用其配制50.0 g/L的L-谷氨酸钠、5.0 g/L MgSO4、1.0 g/L磷酸吡哆醛混合反应液。加入湿菌体于55 ℃条件下水浴反应30 min,离心取上清液用HPLC检测GABA,计算酶活力。
2 结果与分析
2.1 16S rDNA序列分析法鉴定短乳杆菌
图2为短乳杆菌GLB-127菌株16S rDNA扩增产物琼脂糖凝胶电泳图,可以看到菌株在1 500 bp处有一荧光条带,并且没有拖尾现象,满足测序的要求。将菌株16S rDNA测序后,得到测序结果,序列长度为1 461 bp。将所得序列在NCBI进行BLAST相似性比对,与Lactobacillus brevis 2651相似度最高,达99.86%,确定其为短乳杆菌。

1-GLB-127 PCR扩增产物;M-Marker
图2 短乳杆菌GLB-127 16S rDNA PCR扩增产物琼脂糖凝胶电泳图
Fig.2 Agarose gel electrophoresis pattern of 16S rDNA amplified from L.brevis GLB-127
2.2 短乳杆菌GLB-127扫描电镜观察
通过扫描电子显微镜可以看到(图3),短乳杆菌呈短杆状,表面光滑粗壮,无杂菌污染,菌体长度1~2 μm,宽度约0.6 μm。

图3 短乳杆菌GLB-127扫描电镜形态图
Fig.3 Scanning electron microscope image of L.brevis GLB-127
2.3 短乳杆菌系统分类
菌株Lactobacillus brevis GLB-127经16S rDNA基因序列分析鉴定为短乳杆菌,短乳杆菌属于厚壁菌门芽孢杆菌纲里的乳杆菌目乳杆菌科乳杆菌属[20]。采用MEGA-X软件构建该菌的系统发育树(图4)。从系统发育树可以看出L.brevis GLB-127与L.brevis 2560及L.brevis 2651亲缘关系最近,为属内同种。

图4 短乳杆菌GLB-127 16 s rDNA序列系统发育树
Fig.4 Phylogenetic tree of L.brevis GLB-127 based on its 16S rDNA sequences
2.4 发酵培养条件优化
2.4.1 培养转速优化
转速优化实验分4组进行,对比4种不同转速培养条件下OD600及酶活力的差别(图5)。随着转速的不断提高,菌体生物量不断增加,这是因为转速的增加有利于菌体的供氧,促进了菌体的生长。在150 r/min培养条件下,短乳杆菌OD600达到了7.05,超过了静止发酵时的3.45,但是GAD活性却是在静置时最高,为191.1 U/g菌体湿重,是50 r/min培养条件下的2.8倍,这与短乳杆菌为厌氧菌相吻合。高转速有利于菌体的生长,却不利于GAD的表达,所以后续实验选择静置培养。

图5 转速对酶活力及生物量的影响
Fig.5 Effect of rotation speed on enzyme activity and biomass
2.4.2 培养温度优化
随后又考察了诱导培养温度对OD600及酶活力的影响(图6)。培养温度控制在37 ℃菌体生物量最高,OD600为4.21,比25 ℃培养条件下高出63.2%;培养温度控制在30 ℃时GAD酶活力最高,达到了200.1 U/g菌体湿重,比37 ℃条件下高出25.6%。这是因为酶蛋白生成速率与酶蛋白空间结构的形成存在关系,低温放缓了蛋白质的生成速率,利于形成酶蛋白正确的空间构象,但过低的温度不利于生物量的积累,综合考虑诱导培养温度控制在30 ℃最合适[21]。
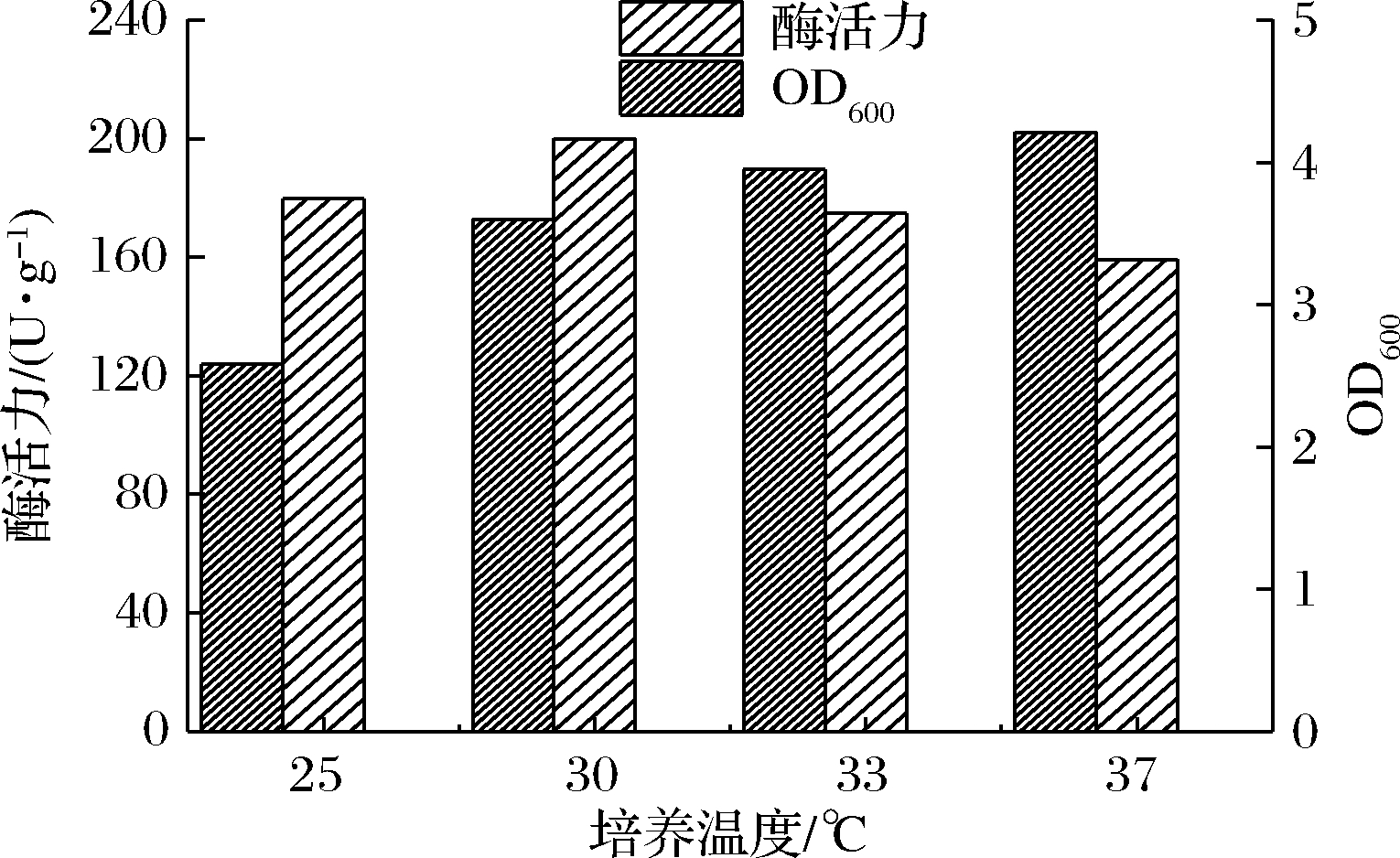
图6 诱导培养温度对酶活力及生物量的影响
Fig.6 Effect of culture temperature on
enzyme activity and biomass
2.5 转化条件优化
2.5.1 转化温度的优化
发酵培养条件确定后,对转化温度进行了优化(图7)。在45 ℃条件下进行转化效果最好,GABA为66.4 g/L,比37 ℃高出33.9%,这是因为温度升高,有利于酶促反应速度的提升;与45 ℃相比,在50 ℃转化条件下,GABA降低了21.2%,这是因为过高的温度影响了全细胞催化酶的半衰期,使GAD快速失活,不利于GABA产量的积累[22]。
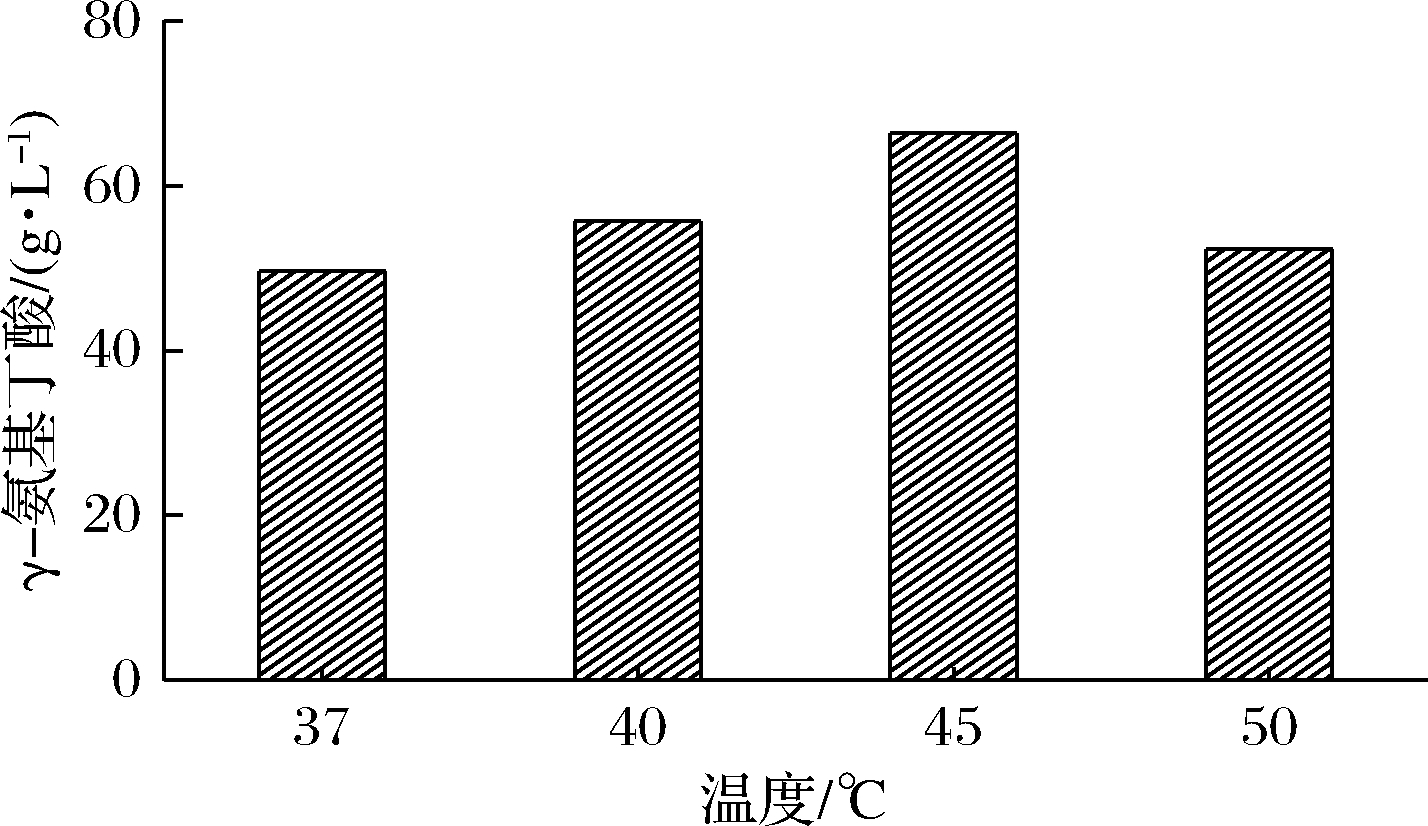
图7 温度对转化效果的影响
Fig.7 Effect of temperature on the conversion rate
2.5.2 全细胞催化酶加量优化
随后对转化体系中全细胞催化酶添加量进行了优化(图8),随着全细胞催化酶用量增加,反应速率大大加快,转化体系中不溶的L-Glu消失,经补加L-Glu,当全细胞用量为75 g/L时,GABA达到160.5 g/L,比全细胞用量为50 g/L时高出38.9%。当全细胞催化酶加量超过75 g/L时,GABA不再增加,说明此时GAD活性位点已经全部被底物L-Glu占据,过量的酶无益于产量的继续增加[23],考虑到工业化生产的实际需求,为节约成本,全细胞菌体选取75 g/L的添加量。
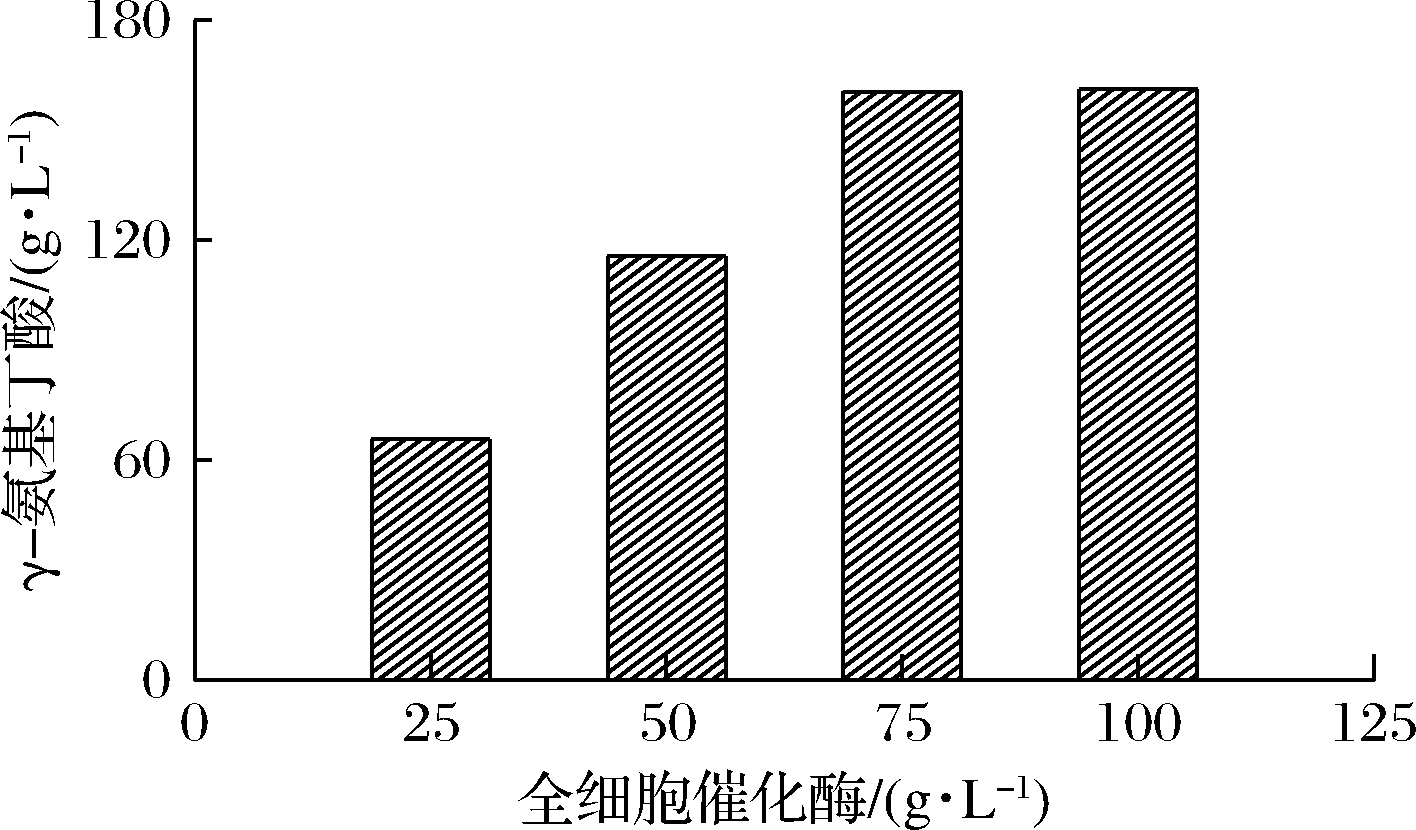
图8 全细胞催化酶加量对转化效果的影响
Fig.8 Effect of whole cell catalytic enzyme amount on conversion rate
2.6 发酵培养基优化
为进一步提高GABA产量,满足工业化生产要求,特进行培养基优化实验。实验分为2组进行,分别采用1.1.2中初始发酵培养基与优化后发酵培养基进行摇瓶发酵实验。由表1可知,培养基经过优化,GABA得到了提升,达到了240.6 g/L,产量比初始培养基提高了55.3%,转化率达98.1%。
表1 发酵培养基优化实验
Table 1 Optimization of fermentation medium

实验组ρ(L-Glu)/(g·L-1)菌体OD600ρ(GABA)/(g·L-1)转化率/%初始培养基3503.36154.963.2优化培养基3504.62240.698.1
2.7 发酵罐放大实验
2.7.1 发酵实验
根据摇瓶实验进行了10 L发酵罐放大实验,发酵罐底料量按照6 L称量,加入5 L纯化水溶解。种子液OD600为2.4,镜检短杆无杂菌。发酵培养过程中,用氨水控制发酵液pH为6.6,搅拌转速0 r/min。流加500 g/L葡萄糖使发酵液初始碳源为50 g/L,3 h后继续流加葡萄糖,共计1 000 mL,氨水共补入115 mL,发酵时间为48 h[24]。放罐时菌体OD600为7.9,酶活力为315.9 U/g菌体湿重。
2.7.2 转化实验
发酵结束后,将2.7.1中离心所得菌体按照湿重75 g/L的添加量加入转化液中,然后再加入500 g/L的L-Glu,其余成分的添加量见1.2.5。温度控制在45 ℃,pH用磷酸控制在4.6。转化液HPLC色谱图如图9所示,转化结束后,经HPLC检测转化液中GABA为345.1 g/L,转化率为98.5%。将转化液离心后收集全细胞菌体,可加入新的转化体系中继续转化L-Glu生产GABA,收集离心上清液用于后续的提取纯化。
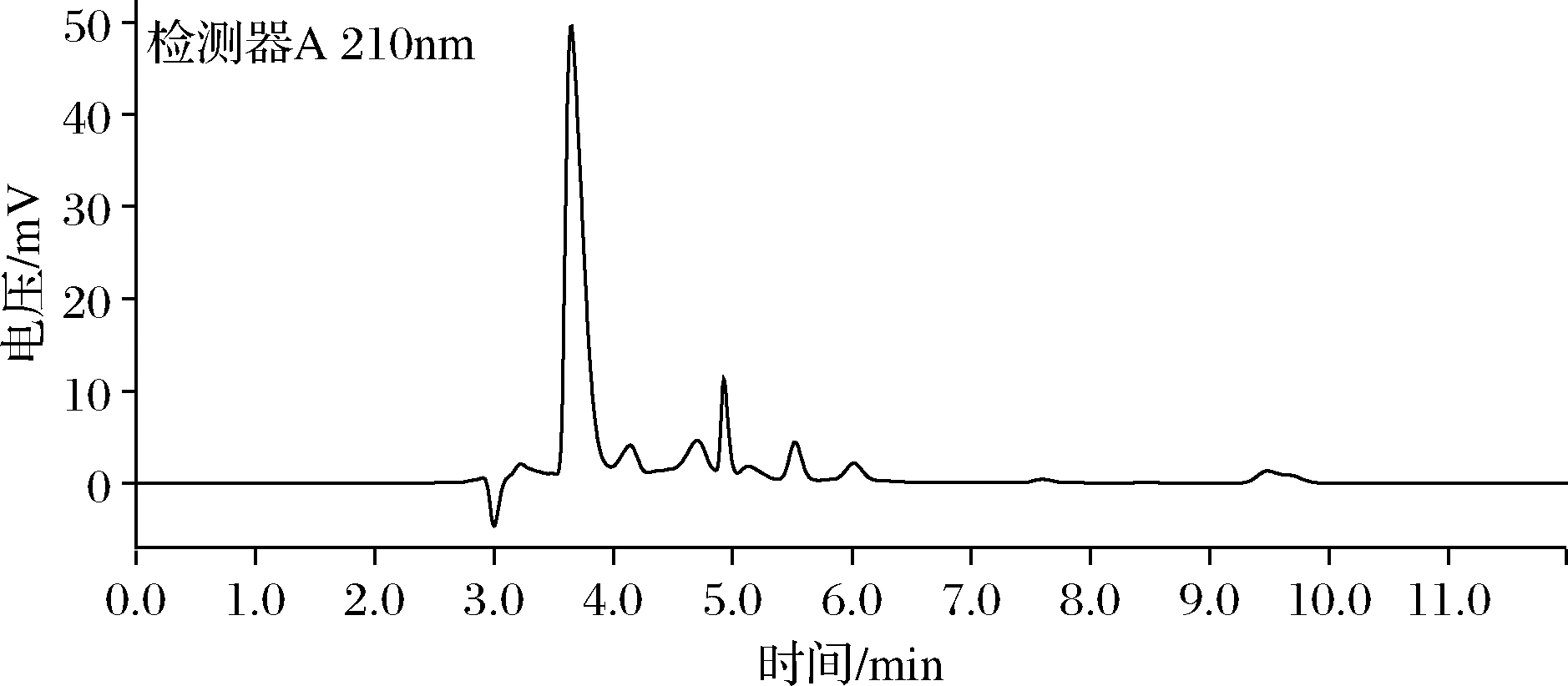
图9 转化液HPLC检测色谱图
Fig.9 HPLC chromatogram of conversion liquid
3 结论
本研究以短乳杆菌发酵表达GAD制备GABA,经扫描电子显微镜与分子生物学鉴定所用微生物为短乳杆菌,系统分类为乳杆菌属的一种。通过发酵培养条件的优化,确定了短乳杆菌GLB-127在30 ℃条件下静置培养所产GAD活性最高,达到了200.1 U/g菌体湿重。进一步对转化条件及发酵培养基进行优化,确定了转化体系的最适反应温度为45 ℃,全细胞最佳用量为75 g/L;在MRS培养基基础上添加15 g/L玉米浆干粉及1.0 g/L MgSO4,使得摇瓶中GABA达到了240.6 g/L,比初始培养基提高了55.3%。最后在10 L发酵罐成功放大,GAD活性较摇瓶发酵有了明显提升,达到了315.9 U/g,GABA达345.1 g/L,转化率为98.5%。该研究大幅度提高了短乳杆菌发酵制备的新食品原料GABA产量,对其产业化具有重要的指导作用。
[1] NGO D H, VO T S.An updated review on pharmaceutical properties of gamma-aminobutyric acid[J].Molecules (Basel, Switzerland), 2019, 24(15):2678.
[2] WU C H, HSUEH Y H, KUO J M, et al.Characterization of a potential probiotic Lactobacillus brevis RK03 and efficient production of γ-aminobutyric acid in batch fermentation[J].International Journal of Molecular Sciences, 2018, 19(1):143.
[3] SHABEL S J, PROULX C D, PIRIZ J, et al.Mood regulation.GABA/glutamate co-release controls habenula output and is modified by antidepressant treatment[J].Science, 2014, 345(6 203):1 494-1 498.
[4] ABDOU A M, HIGASHIGUCHI S, HORIE K, et al.Relaxation and immunity enhancement effects of γ-aminobutyric acid (GABA) administration in humans[J].BioFactors, 2006, 26(3):201-208.
[5] HAYAKAWA K, KIMURA M, KASAHA K, et al.Effect of a γ-aminobutyric acid-enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J].British Journal of Nutrition, 2004, 92:411-417.
[6] LEVENTHAL A G, WANG Y C, PU M L, et al.GABA and its agonists improved visual cortical function in senescent monkeys[J].Science, 2003, 300(5 620):812-815.
[7] OH S H, MOON Y J, SOH J R, et al.Effect of water extract of germinated brown rice on adiposity and obesity indices in mice fed a high fat diet[J].Preventive Nutrition and Food Science, 2005, 10(3):251-256.
[8] CUI Y H, MIAO K, NIYAPHORN S, et al.Production of gamma-aminobutyric acid from lactic acid bacteria:A systematic review[J].International Journal of Molecular Sciences, 2020, 21(3):995.
[9] TANG S R, LUO Z, QIU X W, et al.Interactions between GHRH and GABAARs in the brains of patients with epilepsy and in animal models of epilepsy[J].Scientific Reports, 2017, 7:18110.
[10] 林杨, 唐琦勇, 楚敏, 等.γ-氨基丁酸的功能、生产及食品应用研究进展[J].中国调味品, 2021, 46(6):173-179.
LIN Y, TANG Q Y, CHU M, et al.Research progress on function, production and food application of γ-aminobutyric acid[J].China Condiment, 2021, 46(6):173-179.
[11] 田蕊. 产γ-氨基丁酸乳酸菌的筛选鉴定、紫外诱变及发酵条件优化[D].呼和浩特:内蒙古农业大学, 2018.
TIAN R.Screening, identification, UV mutagenesis and fermentation conditions optimization of γ-aminobutyric acid by Lactobacillus[D].Hohhot:Inner Mongolia Agricultural University, 2018.
[12] CATALDO P G, VILLEGAS J M, GIORI G S D, et al.Enhancement of γ-aminobutyric acid (GABA) production by Lactobacillus brevis CRL 2013 based on carbohydrate fermentation[J].International Journal of Food Microbiology, 2020, 333:108792.
[13] LYU C J, ZHAO W R, PENG C L, et al.Exploring the contributions of two glutamate decarboxylase isozymes in Lactobacillus brevis to acid resistance and γ-aminobutyric acid production[J].Microbial Cell Factories, 2018, 17(1):180.
[14] 孙丽慧,李胜男,宫宇晴,等.短乳杆菌DLF-19076全细胞催化合成γ-氨基丁酸[J].食品科技, 2019, 44(8):31-36.
SUN L H, LI S N, GONG Y Q, et al.Synthesis of γ-aminobutyric acid by whole cells of Lactobacillus brevis DLF-19076[J].Food Science and Technology, 2019, 44(8):31-36.
[15] 冯宇,高年发,张颖,等.短乳杆菌生产γ-氨基丁酸培养基的优化[J].现代食品科技, 2010, 26(1):34-37.
FENG Y, GAO N F, ZHANG Y, et al.Optimization of fermentation medium for γ-aminobutyric acid production by Lactobacillus brevis[J].Modern Food Science and Technology, 2010, 26(1):34-37.
[16] 张言慧,吉武科,高爱存,等.酶法转化精氨酸生产胍基丁胺[J].食品与发酵工业, 2019, 45(24):40-44.
ZHANG Y H, JI W K, GAO A C, et al.Production of agmatine from arginine by enzyme transformation[J].Food and Fermentation Industries, 2019, 45(24):40-44.
[17] 刘家亨.高产nisin乳酸乳球菌的构建及新型nisin生产体系的开发[D].天津:天津大学, 2018.
LIU J H.Construction of nisin high-yield Lactococcus lactis strain and development of novel nisin production system[D].Tianjin:Tianjin University, 2018.
[18] DENG Y, MAN C X, FAN Y, et al.Preparation of elemental selenium enriched fermented milk by newly isolated Lactobacillus brevis from kefir grains[J].International Dairy Journal, 2015, 44:31-36.
[19] YANG J S, TAN H S, CAI Y M.Characteristics of lactic acid bacteria isolates and their effect on silage fermentation of fruit residues[J].Journal of Dairy Science, 2016, 99(7):5 325-5 334.
[20] 王阶平, 刘波, 刘欣, 等.乳酸菌的系统分类概况[J].生物资源, 2019, 41(6):471-485.
WANG J P, LIU B, LIU X, et al.Taxonomy of lactic acid bacteria[J].Biotic Resources, 2019, 41(6):471-485.
[21] 叶姣, 陈长华, 夏杰, 等.温度对重组大肠杆菌生长及外源蛋白表达的影响[J].华东理工大学学报, 2002, 28(4):364-367.
YE J, CHEN C H, XIA J, et al.Effect of temperature on the growth of recombinant E.coli and on the expression of recombinant protein[J].Journal of East China University of Science and Technology, 2002, 28(4):364-367.
[22] ARCUS V L, PRENTICE E J, HOBBS J K, et al.On the temperature dependence of enzyme-catalyzed rates[J].Biochemistry, 2016, 55(12):1 681-1 688.
[23] 刘立明,孙安然,宋伟,等.一种精氨酸脱羧酶及其应用:中国, CN105861529A[P].2016-08-17.
LIU L M, SUN A R, SONG W, et al.Arginine decarboxylase and application thereof:China, CN105861529A[P].2016-08-17.
[24] 张悦, 田锡炜, 王永红, 等.拟干酪乳杆菌发酵生产L-乳酸过程中在线生理参数CER和RQ用于指导发酵过程优化[J].食品工业科技, 2016, 37(12):233-236;319.
ZHANG Y, TIAN X W, WANG Y H, et al.Optimization of L- lactic acid fermentation process in Lactobacillus paracasei through on- line physiological parameter CER and RQ[J].Science and Technology of Food Industry, 2016, 37(12):233-236;319.