内生真菌是一类定殖于植物组织细胞间隙且对宿主无不利影响的一类微生物,特别是一些富含次生代谢物质的植物组织[1]。研究表明,一些内生真菌能产生种类多样、活性强且结构新颖的活性功能物质[2],作用于植物生长、品质形成和环境适应等方面[3],甚至直接或间接的参与植物的次生代谢,影响次生代谢产物的合成和积累[4]。植物内生真菌是挖掘新型活性成分以及化合物的重要潜在资源,筛选功能性内生真菌、研究作用品质影响、与宿主的互作关系等是当前植物学、药学的热点研究领域[5-6]。
明日叶(Angelica keiskei)为伞形科当归属药食兼用型的稀有植物,因具有强盛生命力,“今天摘叶明天长新芽”而得名[7],其茎叶富含黄酮、泛酸、维生素B12、胆碱等物质,特别是以查尔酮为代表的黄酮类活性物质含量较高,具有抗菌、抗病毒、抗氧化、改善炎症等作用[8-9],在保健品、饮料、日化品中应用较多。根据共生理论[10],明日叶不同器官内生真菌的种类和功能可能较为丰富,目前还未见关于明日叶内生真菌相关报道,基于此,本研究以明日叶为材料,研究不同器官中可培养内生真菌的多样性和分布情况,筛选具有产黄酮和抑菌功能的菌株,为明日叶各器官内生真菌多样性及提供可应用的功能菌株奠定基础。
1 材料与方法
1.1 试验材料与仪器
明日叶采自宜宾学院农场基地,采用随机取样法收集健康新鲜的茎、叶、花、果实于无菌取样袋中,24 h内分离各组织的内生真菌。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、马铃薯葡萄糖液体培养基(potato dextrose broth,PDB),国药集团化学试剂北京有限公司;镁粉、HCl、NaOH、FeCl3、乙醇、Al(NO3)3、NaClO,均为分析纯,成都市科隆化学品有限公司;真菌基因组DNA提取试剂盒,生工生物工程(上海)有限公司。
AR2130电子分析天平,德国赛多利斯集团;LDZX-75KBS高温蒸汽灭菌锅,中国上海申安医疗器械厂;JJ060387超净工作台,中国吴江市净化设备总厂;Pico-21台式离心机,Thermo Fisher;DHG-9620A型电热恒温鼓风干燥箱,上海一恒科技有限公司;DHP-9082生化培养箱,上海齐欣科学仪器有限公司;HH-S数控恒温水浴锅,江苏省金坛市医疗仪器厂。
1.2 试验方法
1.2.1 明日叶内生真菌的分离
采用经典三步消毒法(乙醇-NaClO-乙醇)对明日叶各器官消毒,即分别用体积分数75%乙醇消毒40 s和30 g/L NaClO消毒3 min,期间无菌水冲洗多次。空白对照:最后一次冲洗的无菌水涂布在分离培养基上,28 ℃培养并观察,未见任何菌长出则说明表面消毒彻底。将消毒后组织放在无菌滤纸上,吸干水分,利用解剖刀切取植物组织,叶片和花切成0.5 cm×0.5 cm小片,茎和果实切成0.5 cm×0.5 cm×0.5 cm小块,接种到PDA平板上,28 ℃恒温培养。待菌落长出后,挑取不同形态菌落的菌丝接种到新的平板上。经多次纯化,得到明日叶内生真菌[11]。
1.2.2 内生真菌属种分子鉴定
参考耿直等[12]的方法并加以改进,利用无菌接种环挑取真菌纯培养物少许,混悬于PCR裂解液中,80 ℃裂解15 min,裂解产物作为PCR扩增模板。采用通用引物ITS1和ITS4进行扩增,最后扩增目标产物用1%(质量分数)琼脂糖凝胶电泳检测,合格后送上海生工测定序列。利用NCBI网站BLAST程序在线进行序列的同源性比对。
1.2.3 内生真菌功能菌株筛选
产黄酮功能筛选参考杨梦莉等[13]的方法,选择NaOH溶液、FeCl3乙醇溶液、浓盐酸-镁粉溶液初步筛选产黄酮菌株,利用硝酸铝显色法测定菌株黄酮含量。抑菌功能初步筛选采用平板对峙培养法,将分离纯化的明日叶菌株分别接种于PDA平板中心位置,再以内生真菌为中心将病原菌(细菌:大肠杆菌、金黄色葡萄球菌、志贺氏菌、沙门氏菌;真菌:黄曲霉、赭曲霉、禾谷镰刀霉)接种于平板四周,以仅接病原菌的平板作为阴性对照,实验和对照均设3次重复,27 ℃恒温培养,观察待测菌对病原菌的拮抗作用[14]。将初筛后菌株采用滤纸片法进行复筛,将3种真菌指示菌菌液和4种细菌指示菌菌液各0.2 mL分别均匀涂布在固体培养基上,把直径1 cm的无菌滤纸片浸泡在明日叶内生真菌菌液中1 min,无菌镊子取出,分别贴在涂布有不同病原指示菌的平板上,每个平板贴3张滤纸片呈等边三角形排列,37 ℃恒温培养,观察内生真菌对各种病原菌的抑制作用[15],确定菌株的抑菌性能。
1.2.4 最佳菌株发酵条件的优化
参考柏倩等[16]的方法对筛选的菌株进行发酵条件优化。以黄酮产量为标准设置单因素和正交试验。单因素试验:设置基本发酵条件为起始pH自然,将目的菌株接入到装液量为60 mL/150 mL的发酵培养基中,于28 ℃、150 r/min条件下振荡培养7 d。以此为基础,调整各因素水平,研究不同发酵时间(d)、发酵温度(℃)、转速(r/min)、装液量(mL/150 mL)、起始pH对黄酮含量的影响,因素与水平见表1。正交试验:根据单因素试验结果,选取对试验结果影响大的因素进行正交试验设计。
表1单因素试验的因素和水平
Table 1 Factors and levels of single factor tests

因素水平发酵时间/d357911发酵温度/℃2426283032转速/(r·min-1)90120150180210装液量/[mL·(150 mL)-1]3045607590起始pH值56789
2 结果与分析
2.1 明日叶内生真菌分离
明日叶的不同器官共分离可培养内生真菌34株,对其进行分子鉴定,发现25株内生真菌的ITS基因序列与数据库中的模式菌株的相似性介于99%~100%。根据设定的ITS基因序列同源性>97%作为同一分类单元,由表2可知,34株内生真菌划分属于1门、4纲、8目、10科、10属、22种,优势纲为Dothideomycetes(64.7%),优势目Cladosporiales(32.4%),优势科Cladosporiaceae(32.4%),优势属Cladosporium(32.4%),优势种为Alternaria alternata(11.8%),其中,果实的12株菌鉴定为5属8种,分别为Alternaria alternata、Alternaria brassicae、Aspergillus fumigatus、Aspergillus japonicus、Cladosporium cladosporioides、Cladosporium anthropophilum、Epicoccum nigrum、Pyronema domesticum,优势种属为Alternaria alternata;茎的11株菌鉴定为5属10种,分别为Cladosporium sp.、Cladosporium tenuissimum、Cladosporium perangustum、Cladosporium anthropophilum、Cladosporium cladosporioides、Cladosporium colocasiae、Epicoccum nigrum、Colletotrichum boninense、Myxospora crassiseta、Cercospora canescens,优势种属为Cladosporium tenuissimum;叶的9株菌鉴定为5属8种,分别为Cladosporium tenuissimum、Colletotrichum karsti、Fusarium graminearum、Fusarium asiaticum、Fusarium sp.、Phyllosticta cf.capitalensis、Cercospora apii、Cercospora canescens,优势种属为Colletotrichum karsti;花的2株鉴定为1属2种,分别为Aspergillus uvarum、Aspergillus japonicus。果实和茎的共有属为Epicoccum,茎和叶的共有属为Cercospora、Colletotrichum,果实、茎和叶共有属为Cladosporium,果实和花共有属为Aspergillus,果实、茎、叶和花未见共有属(图1)。
表2 明日叶不同器官内生真菌分布及ITS序列 BLAST 比对结果
Table 2 Distribution of endophytic fungi in different organs of A.keiskei and the results of ITS sequence BLAST comparison

属数目(丰度)菌株相似性最高菌株(GenBank 序列号)相似性/%部位Alternaria5(14.7%)MRY-1(产黄酮1.194 mg/g)(抑制志贺氏菌、沙门氏菌、黄曲霉、赭曲霉)Alternaria alternata strain MUCL 45332(DQ242504.1)99.43果实MRY-5(抑制赭曲霉)、MRY-15(抑制沙门氏菌、黄曲霉)Alternaria alternata AAF14 (KX384640.1)98.79~98.95果实MRY-9(产黄酮1.179 mg/g)(抑制黄曲霉)Alternaria alternata 1-lei (JF835805.1)97.85果实MRY-14Alternaria brassicae strain 10a2-1 (KT192321.1)99.42果实Aspergillus2(5.9%)MRY-10(抑制黄曲霉、赭曲霉)Aspergillus fumigatus strain ND61 (MG659655.1)99.63果实MRY-34(产黄酮0.762 mg/g)(抑制大肠杆菌、志贺菌、黄曲霉、赭曲霉、禾谷镰刀霉)Aspergillus japonicus strain MPVCT 360(EU440776.1)99.44果实Cladosporium3(8.8%)MRY-3(抑制黄曲霉、赭曲霉)Cladosporium cladosporioides F32-02(KX664373.1)99.21果实MRY-12(产黄酮0.914 mg/g)Cladosporium anthropophilum CLAD66(MK111536.1)100果实MRY-20(抑制黄曲霉、赭曲霉)Cladosporium cladosporioides Au-VII-1.2(MF475950.1)98.61果实Epicoccum1(2.9%)MRY-11(抑制黄曲霉、赭曲霉)Epicoccum nigrum SFC101788(MF186034.1)99.15果实Pyronema1(2.9%)MRY-16(抑制金黄色葡萄球菌)Pyronema domesticum strain CBS 299.56(MH857649.1)99.16果实Cladosporium7(20.6%)MRY-13(抑制大肠杆菌、金黄色葡萄球菌、黄曲霉、赭曲霉)Cladosporium sp.WSN6(KC178629.1)99.41茎MRY-17(抑制赭曲霉)Cladosporium tenuissimum A16(KY921927.1)99.02茎MRY-19(抑制黄曲霉、赭曲霉)Cladosporium perangustum strain G10(MK722299.1)98.91茎MRY-22(抑制志贺氏菌、赭曲霉)Cladosporium tenuissimum strain PWF-5(MK905459.1)99.22茎MRY-23(抑制黄曲霉)Cladosporium anthropophilum CLAD109(MK111479.1)99.80茎MRY-24(抑制金黄色葡萄球菌)Cladosporium cladosporioides Au-VII-1.2(MF475948.1)99.80茎MRY-29(抑制大肠杆菌、沙门氏菌、赭曲霉)Cladosporium colocasiae 41-M-2(EU076964.1)99.02茎Epicoccum1(2.9%)MRY-4(产黄酮0.745 mg/g)(抑制沙门氏菌、赭曲霉)Epicoccum nigrum strain DNA20 (MF327375.1)99.40茎Colletotrichum1(2.9%)MRY-21(抑制大肠杆菌、赭曲霉)Colletotrichum boninense 13422(JF683320.1)99.10茎Myxospora1(2.9%)MRY-28(抑制大肠杆菌、志贺氏菌、黄曲霉、赭曲霉)Myxospora crassiseta strain CBS 731.83(MH861682.1)98.72茎Cercospora1(2.9%)MRY-31(抑制金黄色葡萄球菌)Cercospora canescens (MK074844.1)99.00茎Cladosporium1(2.9%)MRY-27Cladosporium tenuissimum A16(KY921927.1)98.85叶Colletotrichum2(5.9%)MRY-6(产黄酮0.959 mg/g)(抑制大肠杆菌、金黄色葡萄球菌、黄曲霉、赭曲霉)Colletotrichum karstii strain BRIP 66246 (MK298301.1)99.43叶MRY-18(产黄酮0.861 mg/g)(抑制大肠杆菌、志贺氏菌、黄曲霉)Colletotrichum karsti voucher HGUP191072(MZ724778.1)98.19叶Fusarium3(8.8%)MRY-7(抑制黄曲霉)Fusarium graminearum 1893 (KC577196.1)99.78叶MRY-8(抑制黄曲霉)Fusarium asiaticum EF-MA2(MK850335.1)99.37叶MRY-26(抑制大肠杆菌、沙门氏菌、黄曲霉、赭曲霉)Fusarium sp.2 JM-2014(KJ920732.1)99.01叶Phyllosticta1(2.9%)MRY-25(抑制黄曲霉)Phyllosticta cf.capitalensis G9(KP734252.1)98.33叶Cercospora2(5.9%)MRY-32(产黄酮 0.953 mg/g)Cercospora apii FAEII23 (KC662111.1)99.20叶MRY-33Cercospora canescens (MK074844.1)99.40叶Aspergillus2(5.9%)MRY-2(抑制黄曲霉、赭曲霉、禾谷镰刀霉)Aspergillus uvarum voucher HGUP192016(MZ541956.1)99.44花MRY-30(产黄酮1.079 mg/g)(抑制黄曲霉、赭曲霉、禾谷镰刀霉)Aspergillus japonicus strain MPVCT 360(EU440776.1)99.44花
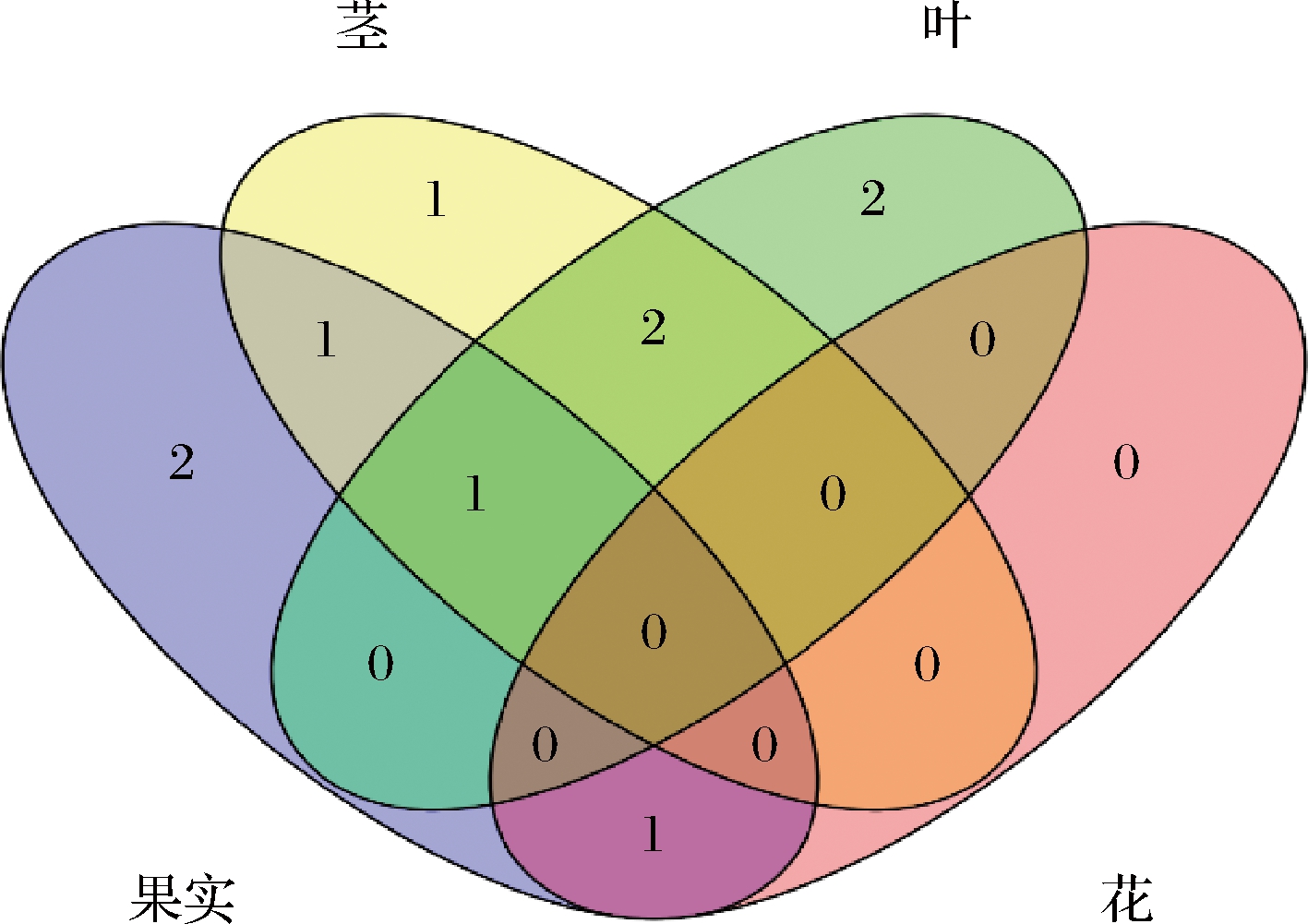
图1 明日叶内生真菌的Venn 图
Fig.1 The venn diagram of endophytic fungi strains in A.keiskei
2.2 明日叶可培养内生真菌系统发育分析
采用BioEdit软件全序列比对,MEGA X软件聚类分析,以邻接法构建明日叶果实(图2-a)、茎(图2-b)和叶(图2-c)、花(图2-d)器官分离的可培养内生真菌的系统发育树,其中bootstrap检验值≥50%,重复1 000次。以纲为类群单位,系统发育树将果实器官中分离的5个属分为4个不同的类群,将茎器官中分离的5个属分为3个不同的类群,将叶器官中分离的4个属分为2个不同的类群,将花器官中分离的1个属分为1个不同的类群,说明明日叶不同器官分离的可培养内生真菌系统发育存在一定多样性。

a-果实;b-茎;c-叶;d-花
图2 明日叶果实、茎、叶、花器官内生真菌群进化树
Fig.2 Endophytic fungi phylogenetic tree in organs of fruit, stem, leaf and flower in A.keiskei
2.3 明日叶内生真菌功能菌筛选分析
由表2可知,34株内生真菌中9株能产黄酮,1株分离自茎、3株分离自叶、1株分离自花、4株分离自果实,共归类于6属,分别是Alternaria、Aspergillus、Cladosporium、Colletotrichum、Cercospora和Epicoccum。菌株产黄酮强弱依次为MRY-1、MRY-9、MRY-34、MRY-12、MRY-32、MRY-18、MRY-30、MRY-6和MRY-4,其中MRY-1黄酮产量为1.194 mg/g。根据病原细菌抑菌性能检测,34株可培养内生真菌中8株抑制大肠杆菌、5株抑制金黄色葡萄球菌、5株抑制志贺菌、5株抑制沙门氏菌。对至少1种病原细菌显示抑制效果的有15株(44.1%),其中对2种及以上病原细菌有抑制作用的菌株8株,占总菌株23.5%。根据病原真菌抑菌性能测定结果显示,20株抑制黄曲霉、19株抑制赭曲霉、3株抑制镰刀霉。26株内生真菌(76.5%)对至少1种真菌指示菌有抑制效果,对2种及以上病原真菌显示抑制作用有13株,占总菌株38.2%。某些菌株抑菌效果较好,同时对病原真菌和病原细菌表现出抑菌效果的有12株(35.3%)。利用滤纸片法复筛,整体表现较强抑菌作用的菌株分别是MRY-1、MRY-13、MRY-28、MRY-34、MRY-26,包括5属:Alternaria、Cladosporium、Myxospora、Aspergillus、Fusarium。可知MRY-1具有较好的产黄酮和抑菌能力,其形态图见电子增强出版附件(https://doi.org/10.13995/j.cnki.11-1802/ts.029994)。
2.4 发酵条件优化单因素试验
由图3可知,MRY-1黄酮产量在第7天时达最高,原因可能是菌株新陈代谢与黄酮类物质呈正相关,发酵时间越长,菌株繁殖越快,黄酮产量越多。但时间过长,营养物质无法满足菌株生长代谢,黄酮变少,基于此,后期正交试验选择培养时间分别为5、7、9 d。当温度低于26 ℃时,菌株生长被限制,温度28 ℃时菌株产黄酮量最佳,温度过高,黄酮产量缓慢下降。基于此,后期正交试验选择培养温度分别为26、28、30 ℃。转速方面,黄酮产量在120 r/min时最高,转速的增加黄酮产量逐渐降低,基于此,选择90、120、150 r/min较合适。装液量在75 mL时菌株产黄酮最多,超过后总黄酮量有明显下降趋势。因此正交试验选择装液量为45、60、75 mL(150 mL锥形瓶)较为合适。内生真菌在pH为7时黄酮产量达到最高,pH过酸和过碱都会降低菌株黄酮产量,因此确定正交试验培养基起始pH值为7。
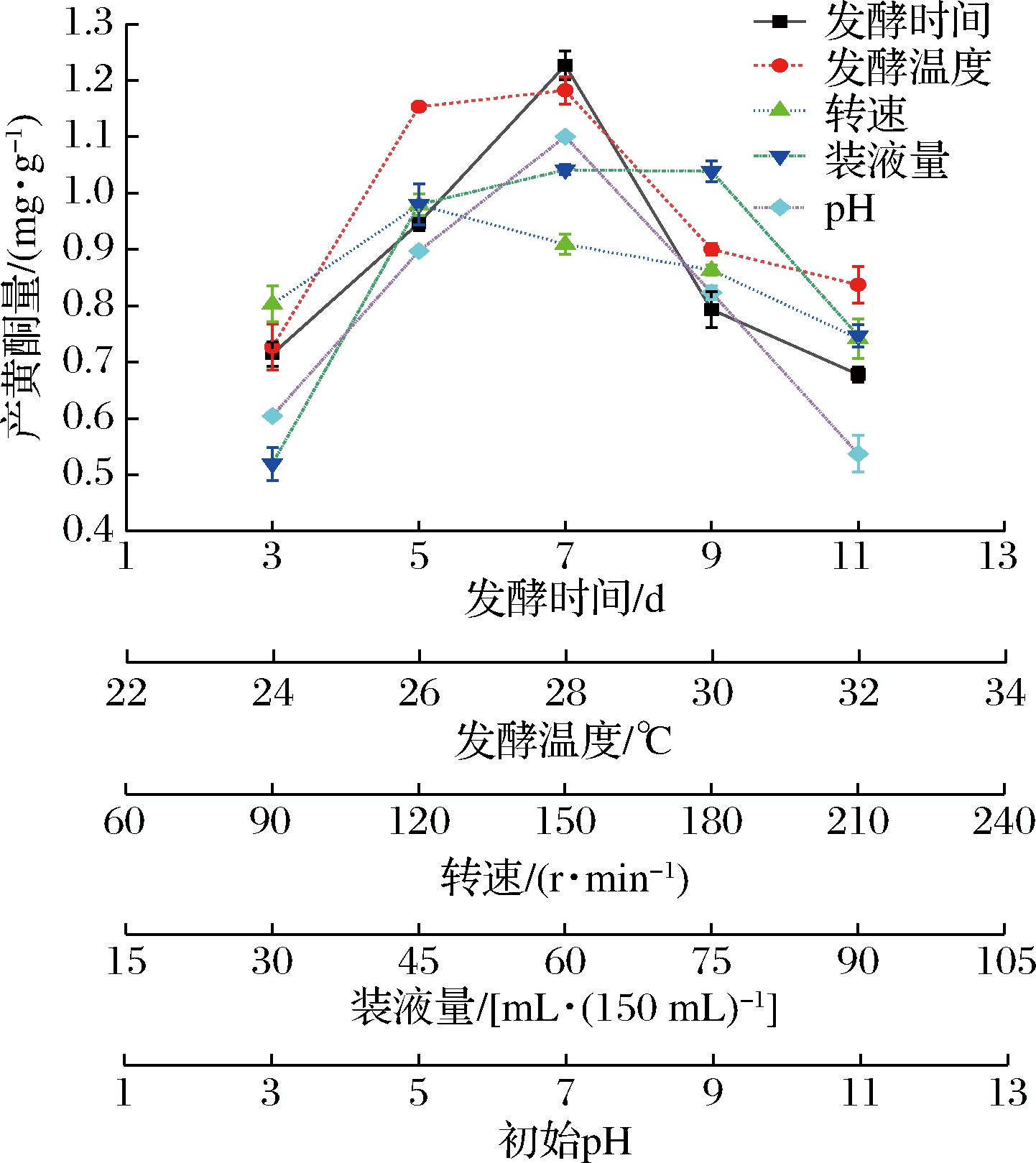
图3 MRY-1菌株发酵条件的单因素试验结果
Fig.3 Single factor test results of fermentation conditions of MRY-1 strain
2.5 发酵条件优化正交试验
在单因素试验基础上,设计了关于发酵时间、发酵温度、转速、装料量4个因素的L9(34)正交试验,结果见表3。可知影响菌株MRY-1黄酮产量的主次因素顺序分别为发酵时间>转速>发酵温度>装液量,以菌株黄酮产量为指标,得出MRY-1最优培养基条件为A2B1C2D2,即时间7 d、温度26 ℃、转速120 r/min、装液量60 mL/150 mL,MRY-1黄酮质量分数为1.598 mg/g。
表3 正交试验结果与分析
Table 3 Results and analysis of orthogonal tests
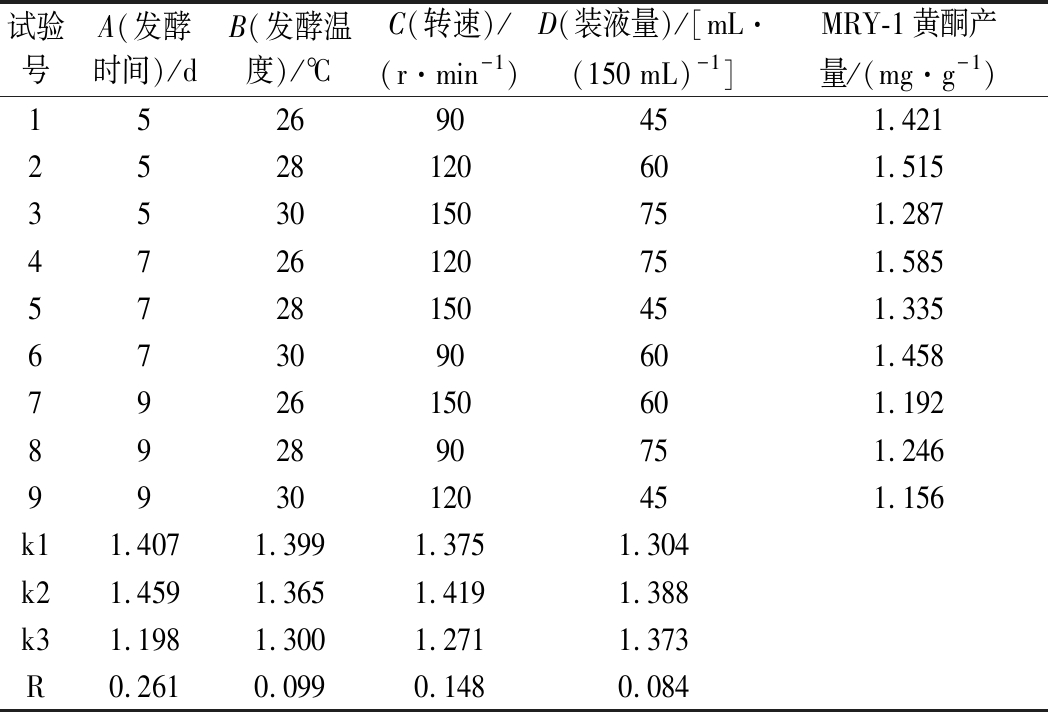
试验号A(发酵时间)/dB(发酵温度)/℃C(转速)/(r·min-1)D(装液量)/[mL·(150 mL)-1]MRY-1黄酮产量/(mg·g-1)152690451.4212528120601.5153530150751.2874726120751.5855728150451.335673090601.4587926150601.192892890751.2469930120451.156k11.407 1.3991.3751.304k21.4591.3651.4191.388k31.1981.3001.2711.373R0.2610.0990.1480.084
3 结论与讨论
植物内生真菌资源十分丰富,大部分植物体内含有1种或以上的内生真菌。目前菌株种类数量已超过100万种[17],由于其长期寄生植物,直接或间接地参与植物的次生代谢,影响次生代谢产物的合成和积累,因此内生真菌可产生与寄生植物相同或相似的物质,是探索新的且有意义的活性物质的重点方向[18]。已报道的植物内生真菌绝大多数属于Alternaria、Fusarium、Ascomycetes、Penicillium等真菌[19]。徐全智[20]以宁夏枸杞为材料,获得363株内生真菌分属14个属,其中Alternaria(46%)、Thielavia(14%)和Aspergillus(13%)为优势属。宋海燕等[21]从4个地区棉花样本中分离出79个菌株16个属,包括Alternaria、Setosphaeria、Fusarium等。本研究筛选得到的34株明日叶可培养内生真菌分属于1门、4纲、8目、10科、10属、22种,果实的12株优势种属为Alternaria alternata;茎的11株菌优势种属为Cladosporium tenuissimum,叶的9株优势种属为Colletotrichum karsti,花仅有属Aspergillus sp.,与绝大多数药用被子植物内生真菌菌株多样性结果相似[6]。
银杏、青钱柳、灯盏花、甘草等各种植物中分离筛选产黄酮类物质的内生真菌包括Alternaria sp.、Aspergillus sp.、Fusarium sp.、Sirosporium sp.、Eupenicillium sp.等,其产黄酮能力各有差异。如杨志军等[22]从甘草中筛选得到内生菌的代谢物总黄酮量1.13 mg/g;周宁[23]筛选到甘蔗叶2株产黄酮类化合物的内生真菌GZ-4(Aspergillus niger)和GZ-5(Aspergillus aculeatus),总黄酮量分别为1.21和4.03 mg/g;赵晓璐等[24]从荷叶筛选的棘孢曲霉Aspergillus aculeatus总黄酮量为8.2 mg/g;何福林等[25]分离的银杏内生真菌Phoma glomerate Enf 7黄酮产量最高达0.7 mg/g。本研究分离的9株明日叶产黄酮内生真菌产黄酮量为0.745~1.195 mg/g,其中菌株MRY-1(Alternaria alternata)优化发酵条件后黄酮产量提高至1.598 mg/g,产黄酮能力中等,后期将进一步优化黄酮类物质的提取方法,提高黄酮获得量。
内生真菌抑菌机理主要通过分泌产生具有抑菌功能的物质,从空间和营养上抑制病原菌繁殖,或诱导植物产生抗病性能力。从植物中筛选抑菌能力的内生真菌对生物防治具有现实意义。施文广等[26]从檀香紫檀植物根、茎、叶组织分离的337株内生真菌中,16株(35.56%)对金黄色葡萄球菌、伤寒沙门氏菌、大肠杆菌和痢疾杆菌具有抑制活性,36株(80.00%)可抑制白色念珠菌和黑曲霉,15株(33.33%)对6种测试细菌和真菌均具抑制活性。本研究同样显示明日叶内生真菌对病原指示真菌具有抑制作用的菌株数量多于抑制细菌指示菌,其中6株有较强的抑菌性能,包括链格孢属、枝孢属、粘孢子属、曲霉属、镰刀霉属。赵梓伊等[27]研究发现桑葚总黄酮对5种病原指示菌有不同程度的抑制作用,其中对大肠杆菌、白色假丝酵母及金黄色葡萄球菌的抑菌效果最强,表明桑葚总黄酮可以作为天然活性成分用作抑菌剂。本实验筛选的9株产黄酮菌株中7株具有抑菌能力,且6株菌株可抑制2种以上指示病原菌,说明产黄酮与抑菌作用存在正相关性,后续将提取产黄酮内生真菌的黄酮类产物,检测提取物的抑菌能力。
内生真菌作为一种潜在的自然资源,具有广阔的应用前景。本研究从明日叶果实、茎、叶、花分离的34株内生真菌,对其进行产黄酮和抑菌活性测定,结果表明明日叶存在较高比例的功能性菌株,为全面挖掘明日叶内生真菌代谢物研究提供了菌株资源,同时也为解决科学利用药食兼用的明日叶活性物质资源提供了新思路,但具体的活性成分的化学结构及生理功能有待进一步探究,特别是MRY-1菌株,后续将对其深入探讨。同时还可以通过培养基配方的改良、微生物诱变育种等手段,增强菌株的稳定性。
[1] DICKIE I A, MART NEZ-GARC
NEZ-GARC A L B, KOELE N, et al.Mycorrhizas and mycorrhizal fungal communities throughout ecosystem development[J].Plant and Soil, 2013, 367(1-2):11-39.
A L B, KOELE N, et al.Mycorrhizas and mycorrhizal fungal communities throughout ecosystem development[J].Plant and Soil, 2013, 367(1-2):11-39.
[2] 菲尔则娜·艾尔肯, 靳文婷, 帕孜来提·拜合提.中国树花可培养内生真菌分离、鉴定及系统发育分析[J].生物技术, 2018,28(2):142-150.
FARZANA A, JIN W T, PAZILAT B Identification and phylogenetic analysis of endophytic fungi in Ramalina sinensis[J].Biotechnology, 2018,28(2):142-150.
[3] 魏艳妮, 杨冰月, 罗露, 等.远志内生真菌分离与鉴定研究[J].辽宁中医药大学学报, 2021, 23(5):35-40.
WEI Y N, YANG B Y, LUO L, et al.Isolation and identification of endophytic fungi from Yuanzhi (Polygalae radix)[J].Journal of Liaoning University of Traditional Chinese Medicine, 2021,23(5):35-40.
[4] HARIKRISHNAN M, SAIPRIYA P P, PRABHA P, et al.Multi-functional bioactive secondary metabolites derived from endophytic fungi of marine algal origin[J].Current Research in Microbial Sciences, 2021, 23(5):35-40.
[5] GUPTA S, CHATURVEDI P, KULKARNI M G, et al.A critical review on exploiting the pharmaceutical potential of plant endophytic fungi, Biotechnology[J].Biotechnology Advances, 2020, 39:107462.
[6] 郭顺星. 药用植物内生真菌研究现状和发展趋势[J].菌物学报, 2018, 37(1):1-13.
GUO S X.The recent progress and prospects of research on endophytic fungi in medicinal plants[J].Mycosystema, 2018,37(1):1-13.
[7] 吴敬章, 王磊, 张菊平.明日叶的价值及其开发利用[J].中国野生植物资源, 2015, 34(5):60-61.
WU J Z, WANG L, ZHANG J P.The value and utilization of Angelica keiskei Koidzmi[J].Chinese Wild Plant Resources, 2015, 34(5):60-61.
[8] SUGAMOTO K, MATSUSITA Y I, MATSUI K, et al.Synthesis and antibacterial activity of chalcones bearing prenyl or geranyl groups from Angelica keiskei[J].Tetrahedron, 2011, 67(29):5 346-5 359.
[9] CAO X H, ZHANG M, MUJUMDAR A S, et al.Effect of microwave freeze-drying on microbial inactivation, antioxidant substance and flavor quality of ashitaba leaves (Angelica keiskei Koidzumi)[J].Drying Technology, 2019, 37(6):793-800.
[10] PAPIK J, FOLKMANOVA M, POLIVKOVA-MAJOROVA M, et al.The invisible life inside plants:Deciphering the riddles of endophytic bacterial diversity[J].Biotechnology Advances, 2020, 44:107614.
[11] 司延如, 尹祾轩, 王国辉, 等.天然黄酮类化合物对血压的调节作用机制研究进展[J].山东医药, 2020,60(36):108-111.
SI Y R, YIN L X, WANG G H, et al.Research progress on the mechanism of natural flavonoids regulating blood pressure[J].Shandong Medical Journal, 2020, 60(36):108-111.
[12] 耿直, 王利平, 冯玉琦, 等.高聚硒植物堇叶碎米荠内生菌分离鉴定及硒耐受性评价[J].农业生物技术学报, 2021, 29(9):1 795-1 807.
GENG Z, WANG L P, FENG Y Q, et al.Isolation, identification and selenium tolerance assay of endophytic microbes from selenium hyperaccumulator Cardamine violifolia[J].Journal of Agricultural Biotechnology, 2021, 29(9):1 795-1 807.
[13] 杨梦莉, 赖泳红, 郭凤根, 等.灯盏花内生真菌分离及其产黄酮内生真菌的初步研究[J].西南农业学报, 2018, 31(2):318-321.
YANG M L, LAI Y H, GUO F G, et al.Isolation and selection of flavones-forming endophytic fungi from Erigeron breviscapus[J].Southwest China Journal of Agricultural Sciences, 2018, 31(2):318-321.
[14] 张晓勇, 李树江, 严凯, 等.红花龙胆内生真菌多样性分析及抑菌活性菌株筛选[J].分子植物育种, 2021, 19(14):4 714-4 725.
ZHANG X Y, LI S J, YAN K, et al.Diversity analysis of endophytic fungi isolated from Gentiana rhodantha and screening for biocontrol stains[J].Molecular Plant Breeding, 2021, 19(14):4 714-4 725.
[15] 张青苗, 魏希颖, 刘清梅.具抑菌活性连翘内生真菌的分离与鉴定[J].微生物学通报, 2013, 40(9):1 649-1 656.
ZHANG Q M, WEI X Y, LIU Q M.Isolation and identification of antimicrobial activity of endophytic fungi from Forsythia suspensa[J].Microbiology China, 2013, 40(9):1 649-1 656.
[16] 柏倩, 黄凌莉, 徐倩.产黄酮银杏内共生真菌发酵工艺优化[J].化学与生物工程, 2019, 36(8):43-48.
BAI Q, HUANG L L, XU Q.Optimization in fermentation process of flavonoids-producing endophytes fungi from Ginkgo biloba L.[J].Chemistry & Bioengineering, 2019, 36(8):43-48.
[17] GOKHALE M, GUPTA D, GUPTA U, et al.Patents on endophytic fungi[J].Recent Patents on Biotechnology, 2017, 11(2):120-140.
[18] ALY A H, EDRADA-EBEL R, INDRIANI I D, et al.Cytotoxic metabolites from the fungal endophyte Alternaria sp.and their subsequent detection in its host plant Polygonum senegalense[J].Journal of Natural Products, 2008, 71(6):972-980.
[19] YAO Y Q, LAN F, QIAO Y M, et al.Endophytic fungi harbored in the root of Sophora tonkinensis Gapnep:Diversity and biocontrol potential against phytopathogens[J].Microbiology Open, 2017, 6(3):e00437.
[20] 徐全智. 宁夏枸杞内生真菌多样性及其生防作用评价[D].银川:宁夏大学, 2017.
XU Q Z.Endophytic fungi resources from Lycium barbarum L.in Ningxia and its evaluation of biocontrol effect[D].Yinchuan:Ningxia University, 2017.
[21] 宋海燕, 李丽莉, 李超, 等.棉花不同部位内生真菌群落结构及多样性分析[J].中国棉花, 2019, 46(1):20-25.
SONG H Y, LI L L, LI C, et al.Analysis of community structure and diversity of endophytic fungi in different parts of cotton[J].China Cotton, 2019, 46(1):20-25.
[22] 杨志军, 邓毅, 杨秀娟, 等.甘草内生菌的鉴定及总黄酮 总皂苷的含量测定[J].解放军药学学报, 2018, 34(4):337-340.
YANG Z J, DENG Y, YANG X J, et al.Identification and determination of total flavonoids and total saponins contents in endophytes from Glycyrrhiza uralensis[J].Pharmaceutical Journal of Chinese PLA, 2018, 34(4):337-340.
[23] 周宁. 甘蔗叶产黄酮内生真菌的筛选与鉴定[D].南宁:广西大学, 2017.
ZHOU N.Screening and identification of flavonoids-producing endophytic fungi from sugarcane leaves[D].Nanning:Guangxi University, 2017.
[24] 赵晓璐, 周宁, 谢庆武, 等.产黄酮荷叶内生真菌的筛选与鉴定[J].中成药, 2016, 38(11):2 512-2 515.
ZHAO X L, ZHOU N, XIE Q W, et al.Screening and identification of endophytic fungi producing flavonoids in lotus leaf[J].Chinese Traditional Patent Medicine, 2016, 38(11):2 512-2 515.
[25] 何福林, 陈小明, 张瑞, 等.产黄酮银杏内生真菌的分离与鉴定[J].天然产物研究与开发, 2017, 29(7):1 141-1 147.
HE F L, CHEN X M, ZHANG R, et al.Isolation and identification of two flavonoid-producing endophytic fungi from Ginkgo biloba Linn[J].Natural Product Research and Development, 2017, 29(7):1 141-1 147.
[26] 施文广, 梁金虎, 冯美茹, 等.檀香紫檀内生真菌多样性与抗菌活性分析[J].南方农业学报, 2021, 52(2):538-546.
SHI W G, LIANG J H, FENG M R, et al.Diversity and antimicrobial activities of endophytic fungi in Pterocarpus santanilus[J].Journal of Southern Agriculture, 2021, 52(2):538-546.
[27] 赵梓伊, 霍岩, 张一鸣, 等.桑葚总黄酮体外抗氧化及其抑菌活性分析[J].饲料研究, 2020, 43(10):69-73.
ZHAO Z Y, HUO Y, ZHANG Y M, et al.Analysis of antioxidant and antibacterial activity of total flavonoids of mulberry[J].Feed Research, 2020, 43(10):69-73.