纳米纤维素是一维尺寸在100 nm以下的纤维素材料,主要分为3种类型:纤维素纳米晶(cellulose nanocrystals,CNC),纤维素纳米纤丝(cellulose nanofibrils,CNF)以及细菌纳米纤维素(bacterial nanocellulose,BNC)[1-2]。纳米纤维素具有天然两亲性、独特的纳米结构、高纵横比、高弹性模量和良好的可持续性和生物相容性等优点,近年来在稳定Pickering乳液方面受到广泛关注[3-5]。纳米纤维素稳定乳液性能主要与其形貌结构和亲/疏水性相关,尺寸较短的CNC的刚性更强,在稳定乳液的过程中能紧密吸附在液滴表面,但易发生乳液絮凝;而较长的CNF柔性更好,主要以三维网状结构分布在水相中,能够抑制乳液絮凝。由于纳米纤维素亲水性较强,目前关于其作为乳化颗粒研究主要集中在单一类型的化学改性处理或与其他纳米颗粒复合后共同稳定乳液[6],而对于不同类型的天然未改性纳米纤维素(如CNC和CNF)协同稳定Pickering乳液研究鲜有报道。本课题组前期从柠檬籽中提取不同类型纳米纤维素,发现较短的CNC在油/水界面上紧密吸附,而较长的CNF在相邻乳液液滴之间形成桥连结构,并在连续相中形成三维网络结构,提高乳液稳定性[7]。
姜黄素(curcumin)是一种具有生物活性的天然多酚化合物,主要是从姜黄的根茎中分离获得,具有抗氧化性、抗肿瘤、抑菌等生物活性,广泛应用于食品、生物制药等领域[8-9]。姜黄素作为一种亲脂性活性物质,存在水溶性和稳定性低、生物利用度差等缺点[10]。此外,在环境条件下如光、热及氧化的条件下更加容易发生降解[11],这使得其生物利用度和药物动力学非常低,是目前在食品及生物医药行业中面临的主要瓶颈。针对姜黄素的特性及其存在的这些问题,已有研究通过递送系统来负载姜黄素或将其包封以提升稳定性,例如乳液、水凝胶、脂质体等[9],其中乳液体系递送系统受到广泛关注。相比于传统乳液体系,Pickering乳液具有较好的抗脂质氧化和高稳定性等性能,可提供封闭的微环境来包封姜黄素,不仅使其溶解度、稳定性和抗光热降解性明显提高,也是防止油脂腐败变质的有效途径[12]。
本文在前期研究的基础上,以离子液体-球磨法制备的柠檬籽纤维素纳米纤丝(lemon seed cellulose nanofibrils,LSCNF)和传统硫酸水解法获得的柠檬籽纤维素纳米晶(lemon seed cellulose nanocrystals,LSCNC)作为协同稳定剂制备Pickering乳液,并用于包封亲脂性的姜黄素。考察了在固定LSCNC浓度下,LSCNF添加量对姜黄素乳液粒径、微观结构、流变性能的影响;同时对乳液体外模拟消化、姜黄素保留率和生物利用度进行了相关研究,以期为纳米纤维素稳定的Pickering乳液在生物活性物质包埋递送中的应用提供基础数据。
1 材料与方法
1.1 材料与试剂
榨油后的柠檬籽,重庆汇达柠檬加工集团有限公司;1-丁基-3-甲基咪唑氯盐(1-butyl-3-methylimidazolium chloride,[BMIM]Cl)离子液体,中科院兰州化学物理研究所;HCl、NaOH、无水甲醇(均为分析纯),成都市科隆化学品有限公司;亚氯酸钠,重庆跃翔化工有限公司;姜黄素,色谱级(HPLC≥95%),南通飞宇生物科技有限公司;葵花籽油(食品级),上海佳格集团;胃蛋白酶(分析纯),北京索莱宝科技有限公司;脂肪酶(分析纯),上海麦克林生化科技有限公司;胆汁盐(分析纯),生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.2 仪器及设备
Heraeus Multifuge X3R台式高速冷冻离心机,美国赛默飞世尔科技公司;BX 53光学显微镜,日本OLYMPUS公司;Malvern Mastersizer 2000激光粒度仪,英国马尔文仪器有限公司;MCR 302模块化旋转与界面流变仪,奥地利安东帕有限公司;XHF-DY高速分散器,宁波新芝生物科技股份有限公司;UV-2450紫外分光光度计,日本岛津公司。
1.3 实验方法
1.3.1 柠檬籽纳米纤维素的制备方法
柠檬籽纤维素的提取参考文献[13]:提取纤维素后,分别通过硫酸水解法提取LSCNC和离子液体辅助球磨法制备LSCNF;LSCNC和LSCNF的制备流程和结构参考文献[7]。
1.3.2 包埋姜黄素的Pickering乳液的制备
参考LU等[14]的方法制备包埋姜黄素的Pickering乳液。首先将姜黄素以质量浓度1 mg/mL添加到葵花籽油中,在磁力搅拌下于120 ℃加热30 min,然后超声处理10 min以确保姜黄素完全溶解。将含姜黄素的油相与柠檬籽纳米纤维素悬浮液[0.5%(w/v)LSCNC和0.1%、0.5%和1%(w/v)的LSCNF]混合,油/水体积比为1∶1,通过高速分散器在9 000 r/min下均质1 min后得到含姜黄素的Pickering乳液,于4 ℃下储藏。根据LSCNF的添加量(0.1%、0.5%和1%)不同,所制备的姜黄素乳液分别命名为0.1% Cur、0.5% Cur和1% Cur。
1.3.3 姜黄素标准曲线的绘制
准确称量1 mg干燥的姜黄素标准品,将其溶解在无水甲醇溶液中并定容至10 mL,即得质量浓度0.1 mg/mL的姜黄素标准液。分别准确吸取1、2、3、4、5 mL姜黄素标准液加入到10 mL容量瓶中,然后用无水甲醇定容,并于425 nm处测定其吸光度值。分别以姜黄素浓度和吸光度值为横纵坐标,得到标准曲线:y=169.42x-0.047 5,R2=0.998 8;其中y为吸光值,x为姜黄素质量浓度(mg/mL)。
1.3.4 包埋姜黄素的Pickering乳液的贮存稳定性
使用数码相机获取乳液在4 ℃贮存时的外观照片,观察乳液在15 d内是否出现破乳现象,评估其稳定性。进一步在室温(25 ℃)储藏条件下通过光学显微镜评估乳液样品在对应贮存期间(第1、7、15天)的微观结构,使用立式显微镜捕获图像。
1.3.5 Pickering乳液粒径测定
使用Mastersizer 2000马尔文激光粒度分析仪在室温(25 ℃)下采用激光衍射分析乳液的液滴尺寸分布。测试过程中,所用的乳液相对折射率为1.105,即葵花油油相(1.47)与去离子水水相(1.33)之比,由此计算液滴尺寸分布。根据尺寸分布的结果,将平均液滴尺寸报告为体积平均直径(d4,3)[15],计算如公式(1)所示:
(1)
式中:di,直径;ni,di的颗粒数。
1.3.6 Pickering乳液的流变性测定
使用安东帕流变仪在室温(25 ℃)下测定新鲜乳液样品的流变性能。选用PP25平板,将乳液样品放置在平板上,并在样品周围涂覆少量硅油以防止水分蒸发,设定平板间隙为1 mm,施以0.5%的恒定应力,在剪切速率0.1~100 s-1进行剪切黏度测试,在频率0.1~100 rad/s进行频率扫描以获得对应的储能和损耗模量(G′和G″)。所有流变学测量均在线性黏弹性区域中进行。
1.3.7 包埋姜黄素的Pickering乳液的保留率测定
将新鲜制备的姜黄素Pickering乳液密封放置在4和25 ℃的环境中(未避光),定期取出少量的Pickering乳液测定其中姜黄素的含量变化。参照王春颖[12]和冯鑫等[16]的方法测定姜黄素含量并进行一定的修改:每个样品取出0.1 mL于15 mL离心管中,各自加入9.9 mL无水甲醇在漩涡混合器上充分振荡进行破乳,离心处理10 min(10 000 r/min),取上层含姜黄素的无水甲醇溶液待测,用紫外分光光度计测其在425 nm的吸光度值,结合标准曲线计算姜黄素的含量,如公式(2)所示:
(2)
式中:K,姜黄素保留率,%;ρt,在对应温度下储藏t d后姜黄素的质量浓度,mg/mL;ρ0,初始Pickering乳液中姜黄素的质量浓度,mg/mL。
1.3.8 姜黄素模拟体外消化
将2 g NaCl和7 mL盐酸溶解在蒸馏水中,然后将其总体积调整至1 L获得模拟胃液(simulated gastric fluid,SGF)。取一定量SGF在37 ℃下预热5 min,将制备的姜黄素乳液样品(5 mL)与SGF(15 mL)混合,用0.5 mol/L的NaOH溶液将混合物pH调整至2.5,然后在37 ℃的恒温摇床以100 r/min的转速连续消化2 h,以模拟胃部消化状况。
将样品转移到100 mL的锥形瓶中,用0.5 mol/L的NaOH溶液将样品pH调整至7.0,向反应容器中加入4.5 mL盐溶液(含0.25 mol/L CaCl2溶液和3.75 mol/L NaCl溶液)、10.5 mL的胆汁盐溶液(5 mg/mL),再将系统的pH调至7.0后加入7.5 mL新鲜制备的脂肪酶溶液(1.6 mg/mL),继续置于37 ℃恒温摇床(100 r/min)中消化2 h,以模拟小肠消化状态。消化期间不断将0.15 mol/L NaOH溶液滴定到反应容器中使反应体系的pH维持在7.0。
1.3.9 游离脂肪酸释放
在文献[17-18]的方法基础上进行脂质消化实验,在脂质消化过程中使用0.15 mol/L NaOH溶液不断维持反应体系的pH(7.0),其中姜黄素乳液释放的游离脂肪酸含量(free fatty acid,FFA,%)则以公式(3)计算得出:
(3)
式中:cNaOH,NaOH溶液的浓度,0.15 mol/L;VNaOH,中和生成的FFA所需的NaOH体积,L;MLipid,所用油的分子质量;mLipid,所用油质量,2.34 g。
1.3.10 姜黄素生物可及性的测定
参考HE等[19]的方法,对姜黄素的生物可及性的测定略有修改,经过胃肠道模拟消化阶段后,收集消化后的混合样品并转移到离心管中,在4 ℃下用12 000×g离心30 min,样品在离心管底部为不透明的未消化的固形物,中间为透明的淡黄色胶束层,最上层是未消化的油脂。姜黄素的生物可及性用公式(4)计算:
姜黄素的生物可及性![]()
(4)
1.3.11 数据分析
每组试验至少重复3次,获得的实验数据部分表示为平均值±标准偏差,并使用Origin 2019软件进行作图。
2 结果与分析
2.1 姜黄素Pickering乳液的贮存稳定性分析
图1为包埋姜黄素的Pickering乳液储藏1~15 d后的光学显微镜图片(25 ℃)和乳液外观图(4 ℃),在光镜图中均未检测到明显的针状晶体,这表明姜黄素包封在这些乳液中不会发生沉淀,同时由LSCNC/LSCNF协同稳定的乳液在长期贮存过程中具有良好的稳定性。通过乳液的外观可清楚看到新制的姜黄素乳液呈现较明亮且均匀的黄色,表面没有油相漏出。LSCNF的添加量对乳液相的体积有明显的影响,在LSCNF的添加量为0.1%时,可明显看到乳液底部析出较多水相,且在4 ℃下放置15 d后底部析水层最多;当LSCNF的添加量为1%时,乳液外观无明显改变且在放置15 d后依旧不会出现底部析出水层的现象,但乳液粒径有所降低,乳液储藏稳定性增加,这主要归因于LSCNF对乳液絮凝的抑制作用[7]。

图1 LSCNC和LSCNF协同稳定的姜黄素乳液在放置1、7、15 d后的光学显微镜图(25 ℃)和外观图(4 ℃)
Fig.1 Optical microscope image (25 ℃) and appearance (4 ℃) of curcumin emulsion stabilized by LSCNC
and LSCNF after storage for 1, 7, and 15 days
2.2 姜黄素包埋对Pickering乳液粒径的影响
一般来说,乳液液滴的数量级在微米时,姜黄素的加入不会改变系统的液滴尺寸[20],只有在纳米乳液的情况下,姜黄素晶体的大小和浓度会影响到乳液液滴的变化程度。有研究曾报道过将姜黄素掺入表面活性剂稳定的纳米乳液中会增加乳液的平均液滴尺寸,从而使体系不稳定[21]。图2为姜黄素包埋前后的LSCNC/LSCNF稳定的Pickering乳液的粒径,其中LSCNC的质量分数固定为0.5%,LSCNF的添加量分别为0.1%、0.5%和1%。

图2 LSCNC和LSCNF协同稳定的乳液在包埋姜黄素前后的粒径对比图
Fig.2 Comparison of droplets size before and after embedding curcumin in LSCNC and LSCNF co-stabilized emulsions
未包埋姜黄素的Pickering乳液的粒径分别是0.1%组(156.32±13.19)、0.5%组(143.42±13.43)和1%组(98.73±7.66)μm。而包埋姜黄素的Pickering乳液(对照组)的粒径分别是0.1%组(166.07±20.41)、0.5%组(137.84±16.00)和1%组(102.73±5.94)μm。Pickering乳液在包埋姜黄素前后的乳液液滴的粒径变化较小,这可能是因为姜黄素晶体的尺寸与乳液相比过于微小,因此Pickering乳液包封姜黄素后的体系液滴的尺寸不会受到明显的影响[22]。
2.3 姜黄素包埋对Pickering乳液的流变特性的影响
如图3所示,对照组的Pickering乳液和姜黄素Pickering乳液的黏度均随着剪切速率的增加而降低,这表明包埋前后的乳液均具有剪切稀化的性能,乳液的黏性和弹性不会遭到破坏,而且姜黄素也不会影响Pickering乳液非牛顿流体的特性。但在相同的LSCNF添加量的情况下,含姜黄素的Pickering乳液的黏度较高,且LSCNF的浓度在1%时,该姜黄素乳液(1% Cur)的表观黏度最大。在频率0.1~100 rad/s,其中姜黄素乳液(1% Cur-G′)稳定乳液的G′和G″值均为最大,比未包埋的Pickering乳液(1% G′)的储能模量大2~3倍以上。
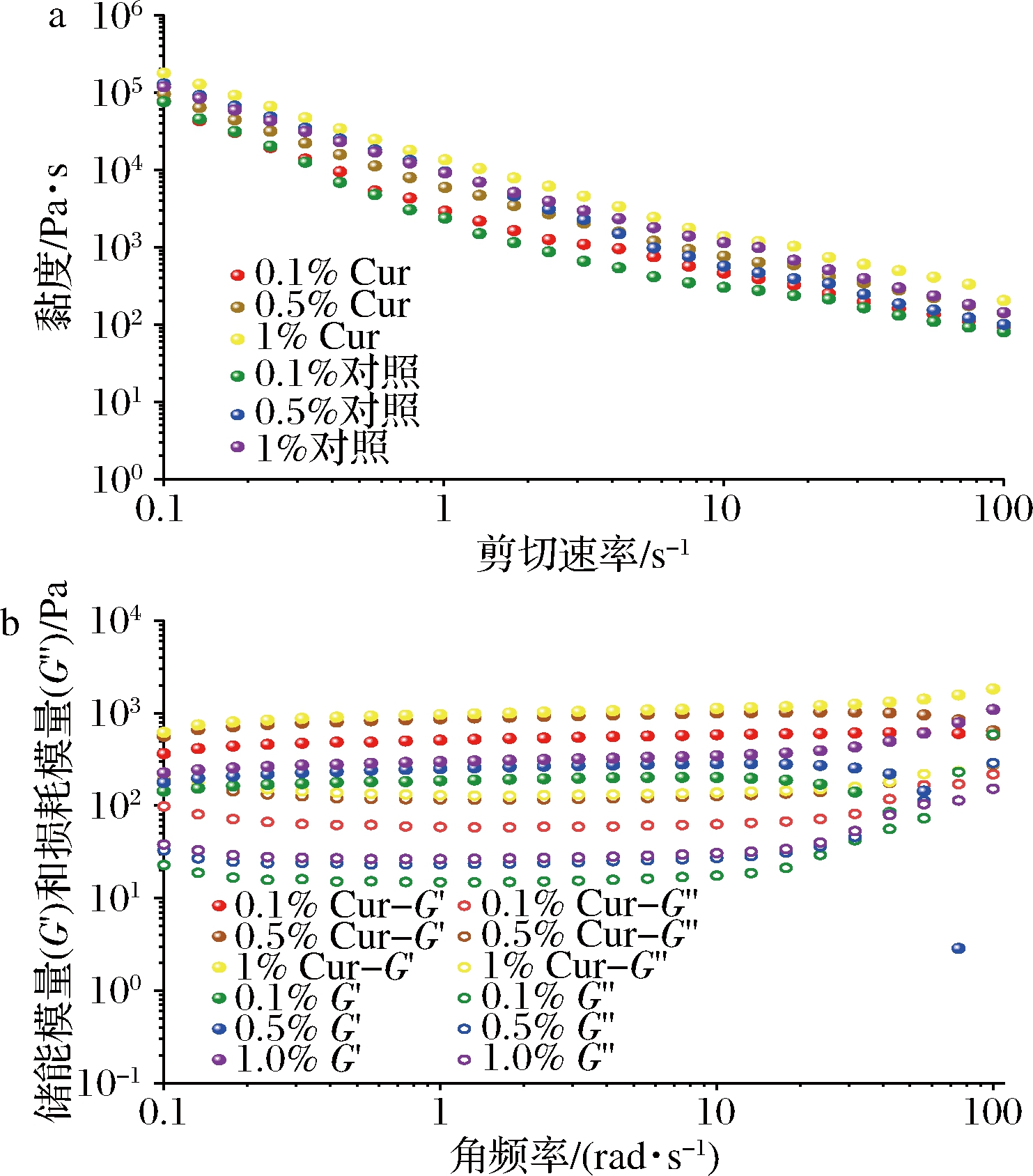
a-不同剪切速率下黏度变化曲线;b-频率扫描曲线
图3 包埋姜黄素对LSCNC和LSCNF协同稳定的Pickering乳液流变特性的影响
Fig.3 Effect of embedding curcumin on the rheological properties of LSCNC and LSCNF co-stabilized Pickering emulsions
姜黄素Pickering乳液的黏性和弹性均高于未包埋的Pickering乳液,乳液黏弹性的增加表明其稳定性增强,表明以乳液作为运载系统包埋一定量的姜黄素可以较好地增大乳液的黏弹性,促使最终的Pickering乳液稳定性增强。王春颖[12]在利用蛋清蛋白质作为乳化颗粒用于制备高内相(high internal phase,HIPE)Pickering乳液后,以其作为负载系统包埋姜黄素的过程中也发现了类似的现象。
2.4 姜黄素在Pickering乳液中的保留效果
姜黄素受光热等环境因素的影响较大,限制了其在食品和药物中的应用。为了探究Pickering乳液包埋姜黄素后在不同环境下的贮存效果,将制备的样品分别在4和25 ℃下贮存30 d,研究其在Pickering乳液中的保留率,如图4所示。结果表明,无论在哪种温度下,乳液的保留率均随放置时间的延长而减小,但是在不同的贮存温度下姜黄素的保留率差异明显。4 ℃下所有姜黄素乳液样品在放置30 d后姜黄素的保留率达到68%以上,而对照组(仅葵花籽油溶解)姜黄素保留率约为60%;在较高温度(25 ℃)下存放,经乳液包埋的姜黄素放置30 d后的保留率约为53%~60%,而对照组低于50%。由此可见,较低的存放温度可以抑制姜黄素的降解,同时乳液体系包埋能够延缓姜黄素的降解。此外,LSCNF添加提升了乳液对姜黄素的保留效果,0.5% LSCNC/1% LSCNF稳定的乳液在4和25 ℃下的保留效果最佳,这也可能与其稳定的乳液的高黏弹性有关:LSCNF在水相中能形成更加紧密的三维网络结构,降低了网络孔隙率,增大了油/水界面上的的覆盖率。

a-4 ℃;b-25 ℃
图4 LSCNC和LSCNF协同稳定的姜黄素Pickering
乳液在不同温度下贮存30 d后的姜黄素保留率
Fig.4 Curcumin retention rate of curcumin Pickering emulsions co-stabilized by LSCNC and LSCNF after 30 d at 4 and 25 ℃
2.5 姜黄素Pickering乳液的体外消化特性
图5为含姜黄素乳液样品和对照组(仅葵花籽油)在胃肠道消化后的FFA释放率曲线图。在接触肠道消化液的前40 min内,试样中FFA的释放率迅速增加,在消化进行至60 min时,游离脂肪酸的释放仍在进行但增速减缓且趋于平稳,在消化结束时(120 min),乳液试样的FFA释放量约为25%~35%,对照组样品则在40%左右。随着LSCNF浓度从0.1%升高到1%,姜黄素乳液的FFA总释放率由40%降低至25%左右。不同姜黄素Pickering乳液样品之间的消化曲线差异可能是由于固体颗粒含量(LSCNC/LSCNF)阻碍脂肪酶进入油滴的能力不同所致。LSCNC可形成薄层覆盖于油滴表面限制脂肪酶分子进入脂质[23],而LSCNF的存在也能促进脂肪的聚结和絮凝,同时LSCNF浓度提高后形成更紧密的三维网状纤维结构也降低了乳液孔隙率,促进乳液的表观黏度和弹性提高,从而阻碍胰蛋白酶进入脂肪油滴干扰油相的水解,导致FFA释放缓慢且总体释放率较低[24],尤其在脂肪分解的后期,可用的胆汁盐浓度因去除累积的脂肪酸和促进脂肪酶与油滴表面之间的结合而降低[14],FFA的释放曲线趋于平坦。由此可见较多的纳米纤维素颗粒会阻碍姜黄素乳液的消化,可为增强饱腹感的功能食品提供思路。

图5 LSCNC和LSCNF协同稳定的姜黄素乳液在体外消化后的FFA释放曲线
Fig.5 FFA release curve of curcumin emulsions co-stabilized by LSCNC and LSCNF after in vitro digestion
2.6 姜黄素Pickering乳液的生物利用度
姜黄素的生物利用度取决于其生物可及性,后者定义为最初摄入的生物活性物质经胃肠道液后可被上皮细胞吸收的部分[25]。在经过胃肠道消化后收集混合物离心处理,可明显看到未消化的黄色油脂在上层聚集,白色的固体纳米纤维素颗粒在底部,而含姜黄素的胶束层处于中间。通过紫外分光光度计分析胶束层中姜黄素的含量而后评估其生物可及性。如图6所示,消化后的乳液胶束层中姜黄素含量较低,且随LSCNF浓度的增加而逐渐降低,在1% LSCNF时姜黄素生物可及性最低(约30%),而对照组(仅油相)中姜黄素的生物可及性相对较高(约35%)。乳液中姜黄素的生物利用度低可能归因于2个因素:脂解程度较低和存在极性化合物,因在脂解过程中,仅有少量的油滴水解则释放到水相中的姜黄素也随之减少[14]。实际上,FFA的释放率与姜黄素的释放程度也是相关的,较低的总释放率也会影响姜黄素的生物可及性[24]。LSCNF浓度的增加阻碍了FFA的释放,导致部分的脂质未被消化,这也意味着姜黄素不会从液滴释放到周围的胶束相中,这是姜黄素生物可及性的关键因素。
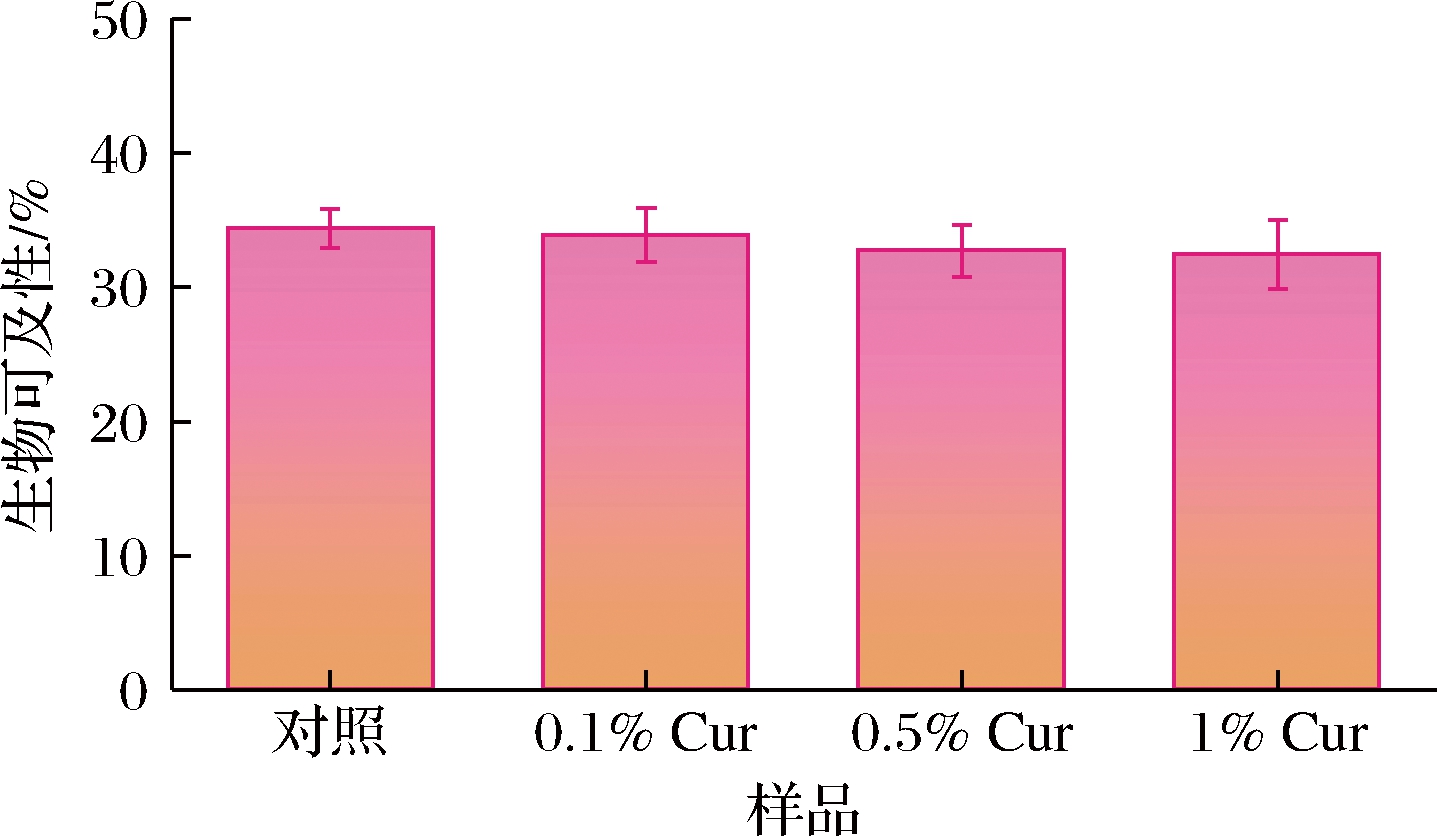
图6 LSCNC和LSCNF协同稳定的姜黄素乳液在体外消化后的姜黄素生物可及性
Fig.6 Bioavailability of curcumin after in vitro digestion of curcumin emulsions co-stabilized by LSCNC and LSCNF
3 结论
柠檬籽纳米纤维素(LSCNC/LSCNF)协同稳定的Pickering乳液可用于姜黄素的包埋递送,制备的姜黄素乳液在放置15 d后的物理稳定性仍然保持良好,同时与未包埋的乳液相比没有破坏其原有的理化性质(如乳化性能和乳液粒径),而在流变性能上略有增强,这也有利于促进乳液的稳定性。在0.5% LSCNC浓度下,随着LSCNF浓度的增加(0.1%~1%),其稳定的Pickering乳液包埋姜黄素的保留率逐渐增加,4 ℃下储藏30 d后姜黄素保留率最高可达75%以上。此外,随着LSCNF浓度的增加,乳液体外模拟消化后的游离脂肪酸释放率降低,同时姜黄素的生物利用度也轻微降低。当前研究对与不同形态纳米纤维素协同稳定乳液及作为生物活性物质递送系统具有重要意义,拓宽了纳米纤维素的应用范围和新型乳液递送系统开发途径。
[1] 张欢, 戴宏杰, 陈媛, 等.纳米纤维素的制备及其在Pickering乳液中的应用研究进展[J].食品研究与开发, 2020, 41(15):173-181.
ZHANG H, DAI H J, CHEN Y, et al.Research progress in nanocellulose preparation and its application in Pickering emulsions[J].Food Research and Development, 2020, 41(15):173-181.
[2] BANGAR S P, WHITESIDE W S.Nano-cellulose reinforced starch bio composite films- A review on green composites[J].International Journal of Biological Macromolecules, 2021, 185:849-860.
[3] BAI L, GRECA L G, XIANG W C, et al.Adsorption and assembly of cellulosic and lignin colloids at oil/water interfaces[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2019, 35(3):571-588.
[4] FUJISAWA S, TOGAWA E, KURODA K.Nanocellulose-stabilized Pickering emulsions and their applications[J].Science and Technology of Advanced Materials, 2017, 18(1):959-971.
[5] KEDZIOR S A, GABRIEL V A, DUBÉ M A, et al.Nanocellulose in emulsions and heterogeneous water-based polymer systems:A review[J].Advanced Materials, 2021, 33(28):2002404.
[6] DAI H J, WU J H, ZHANG H, et al.Recent advances on cellulose nanocrystals for Pickering emulsions:Development and challenge[J].Trends in Food Science & Technology, 2020, 102:16-29.
[7] DAI H J, ZHANG H, CHEN Y, et al.Co-stabilization and properties regulation of Pickering emulsions by cellulose nanocrystals and nanofibrils from lemon seeds[J].Food Hydrocolloids, 2021, 120:106884.
[8] MEHANNY M, HATHOUT R M, GENEIDI A S, et al.Exploring the use of nanocarrier systems to deliver the magical molecule;Curcumin and its derivatives[J].Journal of Controlled Release, 2016, 225:1-30.
[9] 任爽, 董文霞, 刘锦芳, 等.食品运载体系包埋姜黄素的研究进展[J].食品科学, 2021, 42(9):264-274.
REN S, DONG W X, LIU J F, et al.Progress in food delivery systems used for curcumin encapsulation[J].Food Science, 2021, 42(9):264-274.
[10] 吴唯娜, 冯洁茹, 方静宇, 等.铁皮石斛酶解多糖对姜黄素乳液功能性质的影响[J].食品与发酵工业, 2021, 47(5):63-70.
WU W N, FENG J R, FANG J Y, et al.Effect of zymolytic Dendrobium officinale polysaccharides on the functional properties of curcumin emulsion[J].Food and Fermentation Industries, 2021, 47(5):63-70.
[11] 黄璐瑶, 杜艳瑜, 陆晓丹, 等.大黄鱼鱼卵磷脂乳化姜黄素工艺的研究[J].食品与发酵工业, 2020, 46(13):196-202.
HUANG L Y, DU Y Y, LU X D, et al.Study on the technology of emulsifying curcumin in phospholipids of large yellow croaker roe[J].Food and Fermentation Industries, 2020, 46(13):196-202.
[12] 王春颖. 蛋清蛋白高内相皮克林乳液的制备及其包埋姜黄素的性能研究[D].长春:吉林大学, 2020.
WANG C Y.Preparation of high internal phase Pickering emulsion stabilized by egg white protein and its properties of embedding curcumin[D].Changchun:Jilin University, 2020.
[13] ZHANG H, CHEN Y, WANG S S, et al.Extraction and comparison of cellulose nanocrystals from lemon (Citrus limon) seeds using sulfuric acid hydrolysis and oxidation methods[J].Carbohydrate Polymers, 2020, 238:116180.
[14] LU X X, HUANG Q R.Stability and in vitro digestion study of curcumin-encapsulated in different milled cellulose particle stabilized Pickering emulsions[J].Food & Function, 2020, 11(1):606-616.
[15] FENG X, DAI H J, MA L, et al.Properties of Pickering emulsion stabilized by food-grade gelatin nanoparticles:Influence of the nanoparticles concentration[J].Colloids and Surfaces B:Biointerfaces, 2020, 196:111294.
[16] 冯鑫, 马良, 戴宏杰, 等.食品级Pickering乳液的稳定性及β-胡萝卜素的装载研究[J].食品与发酵工业, 2021, 47(6):18-25.
FENG X, MA L, DAI H J, et al.The study on stability of food-grade Pickering emulsion and the loading of β-carotene[J].Food and Fermentation Industries, 2021, 47(6):18-25.
[17] WINUPRASITH T, KHOMEIN P, MITBUMRUNG W, et al.Encapsulation of vitamin D3 in Pickering emulsions stabilized by nanofibrillated mangosteen cellulose:Impact on in vitro digestion and bioaccessibility[J].Food Hydrocolloids, 2018, 83:153-164.
[18] TAN H, ZHAO L F, TIAN S S, et al.Gelatin particle-stabilized high-internal phase emulsions for use in oral delivery systems:Protection effect and in vitro digestion study[J].Journal of Agricultural and Food Chemistry, 2017, 65(4):900-907.
[19] HE S H, ZHOU S J, GUO W Y, et al.Investigation of curcumin emulsion stability and gastrointestinal digestion prepared with rapeseed oil body[J].Journal of Food Process Engineering, 2020, 43(12):e13556.
[20] MCCLEMENTS D J, LI Y.Structured emulsion-based delivery systems:Controlling the digestion and release of lipophilic food components[J].Advances in Colloid and Interface Science, 2010, 159(2):213-228.
[21] BORRIN T R, GEORGES E L, MORAES I C F, et al.Curcumin-loaded nanoemulsions produced by the emulsion inversion point (EIP) method:An evaluation of process parameters and physico-chemical stability[J].Journal of Food Engineering, 2016, 169:1-9.
[22] ARAIZA-CALAHORRA A, AKHTAR M, SARKAR A.Recent advances in emulsion-based delivery approaches for curcumin:From encapsulation to bioaccessibility[J].Trends in Food Science & Technology, 2018, 71:155-169.
[23] LU W, KELLY A L, MIAO S.Improved bioavailability of encapsulated bioactive nutrients delivered through monoglyceride-structured O/W emulsions[J].Journal of Agricultural and Food Chemistry, 2017, 65(14):3 048-3 055.
[24] HE S H, GU C, WANG D G, et al.The stability and in vitro digestion of curcumin emulsions containing konjac glucomannan[J].LWT, 2020, 117:108672.
[25] FERN NDEZ-GARC
NDEZ-GARC A E, CARVAJAL-LÉRIDA I, PÉREZ-G
A E, CARVAJAL-LÉRIDA I, PÉREZ-G LVEZ A.In vitro bioaccessibility assessment as a prediction tool of nutritional efficiency[J].Nutrition Research, 2009, 29(11):751-760.
LVEZ A.In vitro bioaccessibility assessment as a prediction tool of nutritional efficiency[J].Nutrition Research, 2009, 29(11):751-760.