马氏珍珠贝(Pinctada martensii Dunker)为软体动物门双壳纲珍珠贝目珍珠贝科珠母贝属动物,主产于广西北海,是海水珍珠的母贝,具有重要的药用价值及经济价值。在马氏珍珠贝生产珍珠过程中,其软体部分被丢弃,未得到充分利用。传统本草记载海洋贝类软体具有多种功效,如《本草纲目》记载蛤蜊肉润五脏,止消渴;《中华本草》记载干贝味甘,咸,性微温,主消渴;《食疗本草》记载蚌肉味甘,咸,性寒,主烦热,消渴;蛏肉甘、咸、寒,主治烦热口渴;《本草纲目》记载牡蛎肉甘、温、无毒,治酒后烦热,止渴。现代研究表明贝类软体中主要为蛋白质类成分,其经酶解后可释放出多种生物活性肽,如抗氧化肽、降糖肽、降压肽等,其中降糖活性肽尤其受到关注。杂色蛤酶解物中的肽类成分可通过抑制二肽基肽酶-IV(dipeptidylpeptidase-IV,DPP-IV)的活性及减少胰岛素抵抗发挥降糖作用[1];扇贝裙边可改善正常小鼠对糖的耐受能力[2],华贵栉孔扇贝的闭壳肌酶解产物具有抑制α-葡萄糖苷酶、α-淀粉酶和脂肪酶的活性[3];风味蛋白酶酶解牡蛎得到的多肽对α-淀粉酶的半数抑制率IC50为3.806 mg/mL[4]。
近年来,网络药理学和分子对接技术被广泛应用于发现新的药物靶点和分子机制。通过网络药理学,董又滋等[5]对黄芪-当归药的成分进行了分析,结果表明其中的22个生物活性成分可能通过作用于白细胞介素-6(interlukin-6, IL-6)、血管内皮生长因子(vascular endothelial growth factor , VEGF) A、肿瘤坏死因子(tumor necrosis factor, TNF)、TP53基因、核转录因子等多个靶点治疗扩张型心肌病(dilated cardiomyopathy,DCM),其主要途径为调节细胞凋亡、改善氧化应激及炎症反应,调节糖脂代谢;孙元芳等[6]对桑叶的研究表明桑叶中的槲皮素、山奈酚、β-谷甾醇等19个关键药效成分以前列腺素内过氧化物合酶-2(prostaglandin-endoperoxide synthase-2, PTGS2)、IL-6、TNF、糖原合成酶激酶-3(glycogen synthase kinase-3 beta, GSK3B)、半胱氨酸天冬氨酸蛋白酶3(caspase-3, CASP3)、血清白蛋白(albumin, ALB)、过氧化氢酶(catalase, CAT)、雄激素受体(androgen receptor, AR)为关键靶点,调节胰岛素抵抗、IL-17、TNF信号通路和糖尿病并发症中的AGE-RAGE信号通路,起到降糖作用。通过分子对接技术,吴娟等[7]对黄连-肉桂治疗糖尿病的物质基础进行了研究,结果表明黄连中各生物碱成分与糖尿病各蛋白靶点均有较强结合,肉桂药效成分与靶点过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors γ, PPAR-γ)、AR、胰岛素样生长因子受体(insulin-like growth factor 1 receptor, IGF-1R)、血小板衍生生长因子受体(platelet-derived growth factor receptors, PDGFR)结合活性较好。因此,网络药理学联合分子对接技术可用于复杂体系中降糖活性成分的发现,具有快速高效、整体性、系统性等优势与特点[8]。
基于此,本文以马氏珍珠贝软体为对象,通过模拟酶切获得其肽类成分信息,将分子对接技术筛选与网络药理学分析结合,筛选马氏珍珠贝中潜在活性肽类成分,最终通过体外活性评价实验确证获得的肽类成分的DPP-IV抑制活性,从而快速寻找发现马氏珍珠贝软体的潜在降糖活性肽。
1 材料与方法
1.1 数据库与软件
Chem Draw 7.0;Peptide Cutter(https://web.expasy.org/peptide cutter/);SYBYL-X2.0;GeneCards(https://www.genecards.org/);OMIM-GENE-MAP(https://omim.org/search/advanced/geneMap)Cytoscape 3.7.0;Metascape(https://metascape.org/gp/index.html#/main/step1);Swiss Target Prediction (http://www.swisstargetprediction.ch/);RCSB PDB(http:/www.rcsb.org/pdb);String 11.0数据库(https://www.string-db.org)。
1.2 材料与仪器
新鲜马氏珍珠贝软体,采自广西北海;DPP-IV,美国BioLegend公司;IIe-Pro-IIe(纯度>98.0%),南京金斯瑞生物科技有限公司;胰蛋白酶(Promega质谱测序级)、乙腈、甲醇、甲酸等质谱用试剂均为质谱级,德国Merck公司;二硫苏糖醇(dithiothreitol,DTT),翼飞雪生物科技有限公司;碘乙酰胺(iodoacetamide,IAA),合肥博美生物科技有限公司;Sep-pack C18固相萃取小柱,Waters公司;多肽测定试剂盒,美国Thermo公司。
BT125D电子分析天平,德国Sartorious有限公司;FA2004电子分析天平,上海上平仪器设备有限公司;真空浓缩蒸发仪,美国Labconco公司;戴安U3000 Nano RSLC纳升液相系统,美国DIONEX公司;Thermo Q Exactive Plus Orbitrap质谱仪,美国Thermo Fisher公司。
1.3 实验方法
1.3.1 马氏珍珠贝软体蛋白质的鉴定
样品处理:将马氏珍珠贝软体反复冲洗后匀浆,取部分进行冻干,备用。取10 mg冻干粉加入1 mL 4% SDS裂解液提取蛋白。蛋白质用0.1 mol/L DTT还原,8 mol/L尿素溶液变性,0.2 mol/L IAA烷基化。2 μg胰蛋白酶于37 ℃酶解过夜,加入60 μL 10%三氟乙酸溶液终止反应,Sep-pak C18固相萃取小柱脱盐处理,离心浓缩仪干燥,得马氏珍珠贝软体酶解物,采用多肽试剂盒测定多肽含量,-20 ℃保存备用。
色谱条件:色谱柱:Reprosil C18 AQ(75 μm×150 mm, 5 μm),Thermo Scientific Q Exactive Plus Orbitrap LC-MS/MS系统分析马氏珍珠贝样品;进样量1 μL,流速400 nL/min;流动相A V(乙腈)∶V(甲酸)∶V(水)= 2∶0.2∶98,流动相B V(乙腈)∶V(甲酸)∶V(水)=80∶0.2∶20,2%~30% B线性梯度洗脱120 min。
质谱条件:电子能量2.5 kV;离子传输毛细管温度200 ℃;质谱一级全扫描范围300~2 000 m/z;分离宽度3。串联质谱分析获得总离子色谱图,通过碰撞诱导解离,产生一系列MS/MS图。二级质谱数据采用PEAKS 8.5软件进行搜库鉴定分析,选择软体动物门数据库(Mollusca,2021年1月下载于www.uniprot.org)。
检索参数:前体离子误差10 ppm;子离子误差1 Da。允许2个位点误切,假阳性率≤1%,样品搜库选择胰蛋白酶酶切(Trypsin)方式;其他参数为默认参数,在上述检索条件下所得分值有显著性意义(P<0.05),被认定为鉴定结果有效。
1.3.2 主要蛋白质的模拟酶切
蛋白质的模拟酶切通过Peptide Cutter在线工具。将鉴定得到的3种主要蛋白质(肌动蛋白、肌球蛋白、微管蛋白)的Uniprot ID输入到Peptide Cutter的对话框,分别选择胃蛋白酶(pH>2)、胃蛋白酶(pH=1.3)、胰蛋白酶、胰蛋白酶+胃蛋白酶(pH>2)、胰蛋白酶+胃蛋白酶(pH=1.3)进行酶切。
1.3.3 潜在活性肽段的筛选
Chem Draw软件画出模拟酶切的849条肽段,保存为mol 2格式,作为分子对接的配体库;PDB数据库中下载3C59(高血糖素样肽-1受体)、5IFW(葡萄糖转运蛋白-4受体)、6B1E(二肽基肽酶-4受体)的晶体三维结构,作为受体库。利用SYBYL-X 2.0软件进行分子对接:对配体化合物进行去水加氢,加电荷,力学优化;受体蛋白删除对接不需要的分子,抽取其中的配体来创建结合口袋的原型分子,并暴露活性口袋,其余参数选择默认。
1.3.4 潜在活性肽段及2型糖尿病(type 2 diabetes mellitus,T2DM)靶点的筛选
通过Swiss Target Prediction平台,对筛选出的潜在活性肽段进行靶点预测,种属选择“人源”,其他参数默认,筛选结果包括蛋白质名称、Uniprot ID等信息。基于GeneCards和OMIM-GENE-MAP数据库筛选T2DM靶点,以“Type 2 diabetes mellitus”为关键词进行筛选,将GeneCards数据库和OMIM-GENE-MAP数据库收集的与T2DM相关的靶点取并集。汇总药物和疾病基因靶点,通过Venny.2.1.0获取潜在活性肽段与T2DM的共同靶点,绘制韦恩图。
1.3.5 药物靶点蛋白质相互作用(protein-protein interaction, PPI)网络
利用Cytoscape 3.7.0导入network文件和type文件,利用“Network Analyzer”功能对PPI网络进行拓扑属性分析,计算网络整体的“节点度值分布”,筛选出degree(Node Degree Distribution)大于二倍中位数的药物靶点绘制PPI。
1.3.6 蛋白互作网络构建与关键靶点筛选
将疾病和药物的共同靶点导入String 11.0数据库(https://www.string-db.org),设置蛋白种类为“homo sapiens”,获得蛋白互作网络图。将获得的网络图导出到Cytoscape 3.7.0,利用“Network Analyzer”功能对PPI网络进行拓扑属性分析,选择degree大于二倍中位数的靶点为关键靶点。degree反映了网络节点与其他节点的连接数目,degree是衡量一个节点在网络中重要性的主要拓扑参数,也是判断一个靶蛋白是否为“关键靶点”的重要依据。
1.3.7 GO功能及KEGG通路富集分析
利用Omicshare数据库(https://www.omicshare.com)将马氏珍珠贝软体关键靶点进行GO(Gene Ontology)功能及KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析,设置物种与背景均为“homo sapiens”(智人)、P<0.05进行操作,研究关键靶点投射的GO功能及KEGG信号通路与疾病之间的相互关系,明确马氏珍珠贝软体可能的药理机制和在体内可能的生物过程。
1.3.8 DPP-IV抑制率验证
参照课题组前期研究测定DPP-IV抑制率[1]。在405 nm下测定吸光度,DPP-IV抑制率计算如公式(1)所示:
DPP-IV抑制率![]()
(1)
式中:OD样品、OD样品空白、OD阴性、OD空白分别为样品、样品空白、阴性及空白在405 nm下的吸光度值。
1.4 数据处理
每次试验设3组平行,数据采用x±SD表示,用Excel、GraphPad 6.0统计分析软件对数据进行分析处理和图标的制作。
2 结果与分析
2.1 马氏珍珠贝软体中主要蛋白质的鉴定及模拟酶解
通过nano LC-MS/MS鉴别研究,从马氏珍珠贝软体中鉴定得到36种蛋白质,其中肌动蛋白、肌球蛋白、微管蛋白为其主要蛋白质类成分。通过Peptide Cutter在线酶切,肽段去重后得到马氏珍珠贝软体酶解肽段849条。
2.2 潜在活性肽段的筛选
849条肽段分别与3C59、5IFW、6B1E进行分子对接,与各受体分子对接评分最高的10条肽段如表1所示,去重后得到马氏珍珠贝软体治疗T2DM的潜在活性肽段28条,如表2所示。
2.3 潜在活性肽段靶点的筛选及PPI网络构建
Swiss Target Prediction平台的分析结果表明,28条潜在活性肽段对应的潜在靶点有377个。如图1所示,呈圆形排列的28个节点为马氏珍珠贝软体中的潜在活性成分,呈矩形排列的122个节点代表马氏珍珠贝软体的潜在靶点,2 261条边代表靶点和化学成分之间的相互作用,充分体现了马氏珍珠贝软体多成分、多靶点的特点。
表1 分子对接评分最高的10条肽段
Table 1 Top 10 peptides with the highest scores for molecular docking
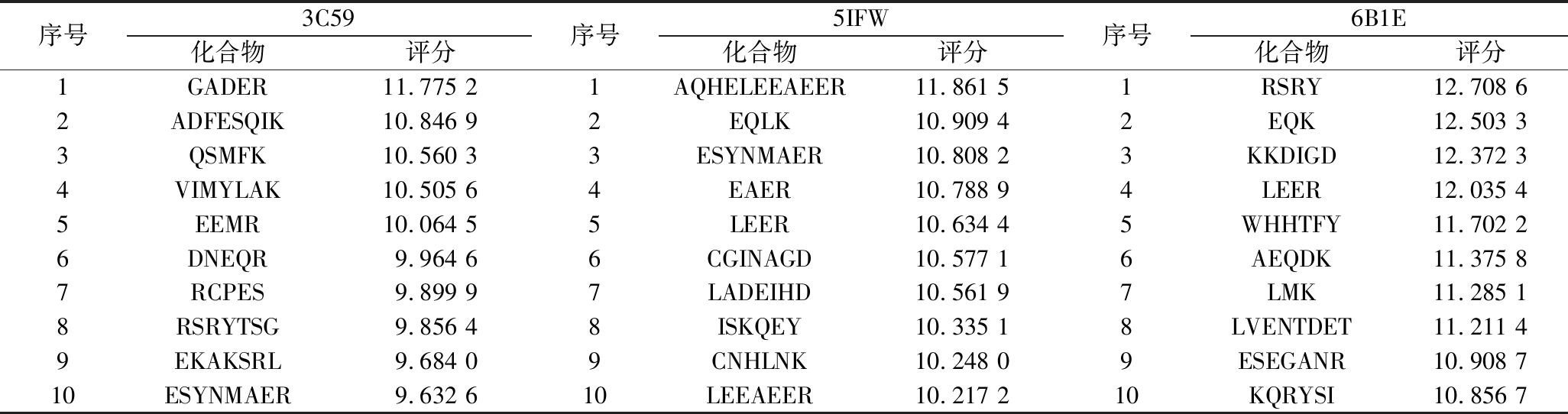
序号3C59化合物评分序号5IFW化合物评分序号6B1E化合物评分1GADER11.775 21AQHELEEAEER11.861 51RSRY12.708 62ADFESQIK10.846 92EQLK10.909 42EQK12.503 33QSMFK10.560 33ESYNMAER10.808 23KKDIGD12.372 34VIMYLAK10.505 64EAER10.788 94LEER12.035 45EEMR10.064 55LEER10.634 45WHHTFY11.702 26DNEQR9.964 66CGINAGD10.577 16AEQDK11.375 87RCPES9.899 97LADEIHD10.561 97LMK11.285 18RSRYTSG9.856 48ISKQEY10.335 18LVENTDET11.211 49EKAKSRL9.684 09CNHLNK10.248 09ESEGANR10.908 710ESYNMAER9.632 610LEEAEER10.217 210KQRYSI10.856 7
表2 28条潜在活性肽段
Table 2 28 potential active peptides
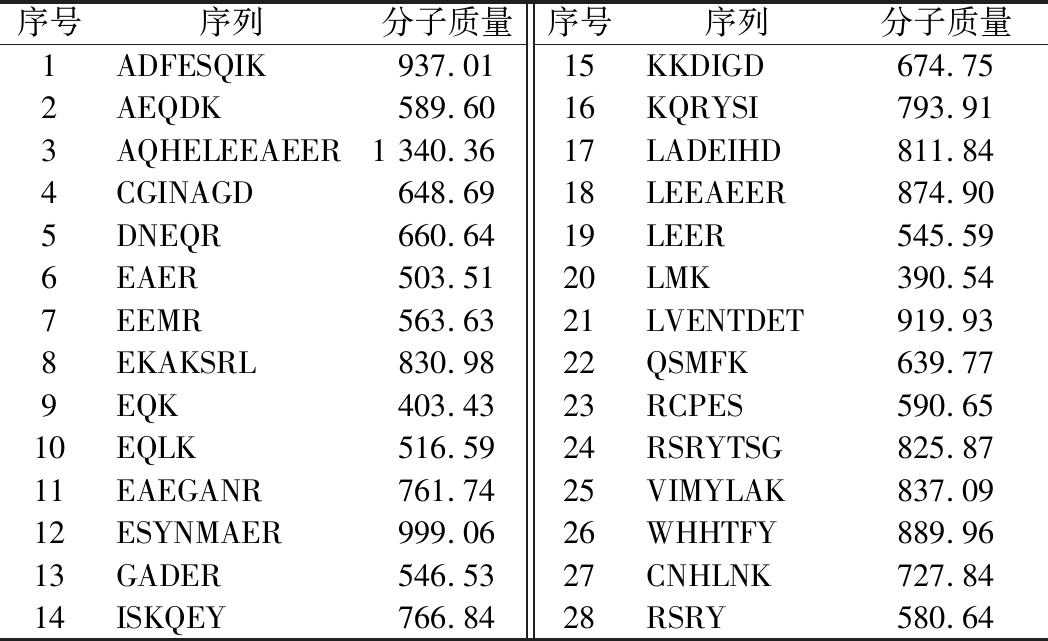
序号序列分子质量序号序列分子质量1ADFESQIK937.0115KKDIGD674.752AEQDK589.6016KQRYSI793.913AQHELEEAEER1 340.3617LADEIHD811.844CGINAGD648.6918LEEAEER874.905DNEQR660.6419LEER545.596EAER503.5120LMK390.547EEMR563.6321LVENTDET919.938EKAKSRL830.9822QSMFK639.779EQK403.4323RCPES590.6510EQLK516.5924RSRYTSG825.8711EAEGANR761.7425VIMYLAK837.0912ESYNMAER999.0626WHHTFY889.9613GADER546.5327CNHLNK727.8414ISKQEY766.8428RSRY580.64

图1 潜在活性肽段PPI
Fig.1 PPI of potentially active peptides
2.4 T2DM靶点的筛选
从GeneCards数据库中筛选出T2DM相关靶点4 977个,OMIM-GENE-MAP数据库中筛选出T2DM相关靶点499个,合并后删除重复值,最终得到1 705个T2DM相关靶点。
2.5 蛋白互助网络构建与关键靶点筛选
马氏珍珠贝软体潜在活性肽段与T2DM的共同靶点共104个,如图2所示。
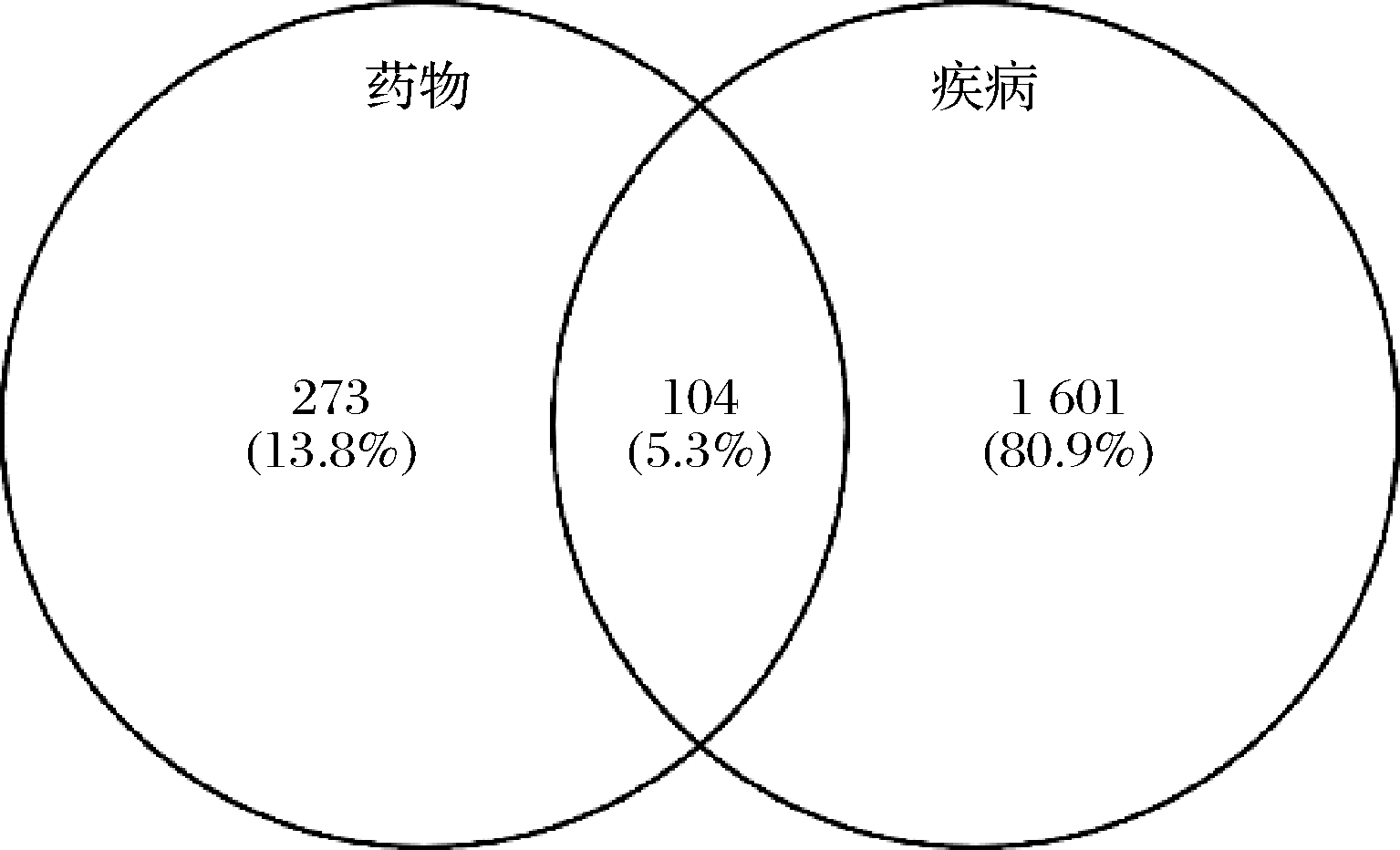
图2 药物-疾病共同靶点韦恩图
Fig.2 Venn diagram of drug-disease common targets
将104个交集靶点导入STRING数据库,构建PPI网络,结果见图3-a。选取交集靶点PPI网络中各节点连接度的2倍中位数值为最低阈值进行靶点筛选,共得到关键靶点25个(见表3),对25个关键靶点进行PPI网络构建,结果见图3-b。马氏珍珠贝软体酶解肽治疗T2DM的25个关键靶点中,RAC-α丝氨酸/苏氨酸蛋白激酶1(RAC-alpha serine/threonine-protein kinase-1, AKT1)连接度最高。AKT1被称为AKT激酶的3种紧密相关的丝氨酸/苏氨酸蛋白激酶(AKT1,AKT2和AKT3)之一,是胰岛素信号通路和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)信号通路的重要节点蛋白,在胰岛素抵抗中起关键作用[9]。研究表明,AKT1与代谢、增殖、细胞存活、生长和血管生成等过程相关。AKT是胰岛素信号传导中重要的下游分子,以磷酸化形式被活化,活化的AKT可促进机体糖原合成和葡萄糖转运,增加机体对胰岛素的敏感性,降低血糖水平,是使胰岛素最终发挥效应的关键分子[10-11]。基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)是基质金属蛋白酶家族的一员,主要调节中性粒细胞和巨噬细胞的合成和分泌,参与血管的再生及炎症反应等生理病理过程,可破坏细胞组织、产生炎症反应而发挥促炎作用。T2DM微血管病变患者的血糖水平升高能够使MMP-9过度表达[12]。MMP被认为参与了多种糖尿病并发症,糖尿病引起的视网膜及细胞中MMP9的激活被认为在糖尿病视网膜病的发病机理中起重要作用[13]。表皮生长因子受体(epidermal growth factor receptor, EGFR)是受体酪氨酸蛋白激酶erbB(erythroblastic oncogene B, ErbB)家族的成员,该家族由属于受体酪氨酸激酶超家族的4个跨膜受体组成。研究表明,抑制EGFR酪氨酸肾活性可以改善胰岛素抵抗[14]。原癌基因酪氨酸蛋白激酶Src是一种非受体酪氨酸激酶,可调节多种细胞功能,其过度活跃与胰腺β细胞的葡萄糖代谢受损有关[15]。丝裂原激活的蛋白激酶8(mitogen-activated protein kinase 8, MAPK8)参与细胞凋亡的复杂调节[16]。信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)在将细胞外信号从质膜传递到细胞核和线粒体中起着核心作用,影响转录和线粒体功能,从而调节多种生物过程[17]。

a-蛋白互作网络(104个);b-核心网络(25个)
图3 蛋白互作网络及核心网络
Fig.3 PPI network and core network
表3 25个关系靶点信息
Table 3 Information of 25 key targets
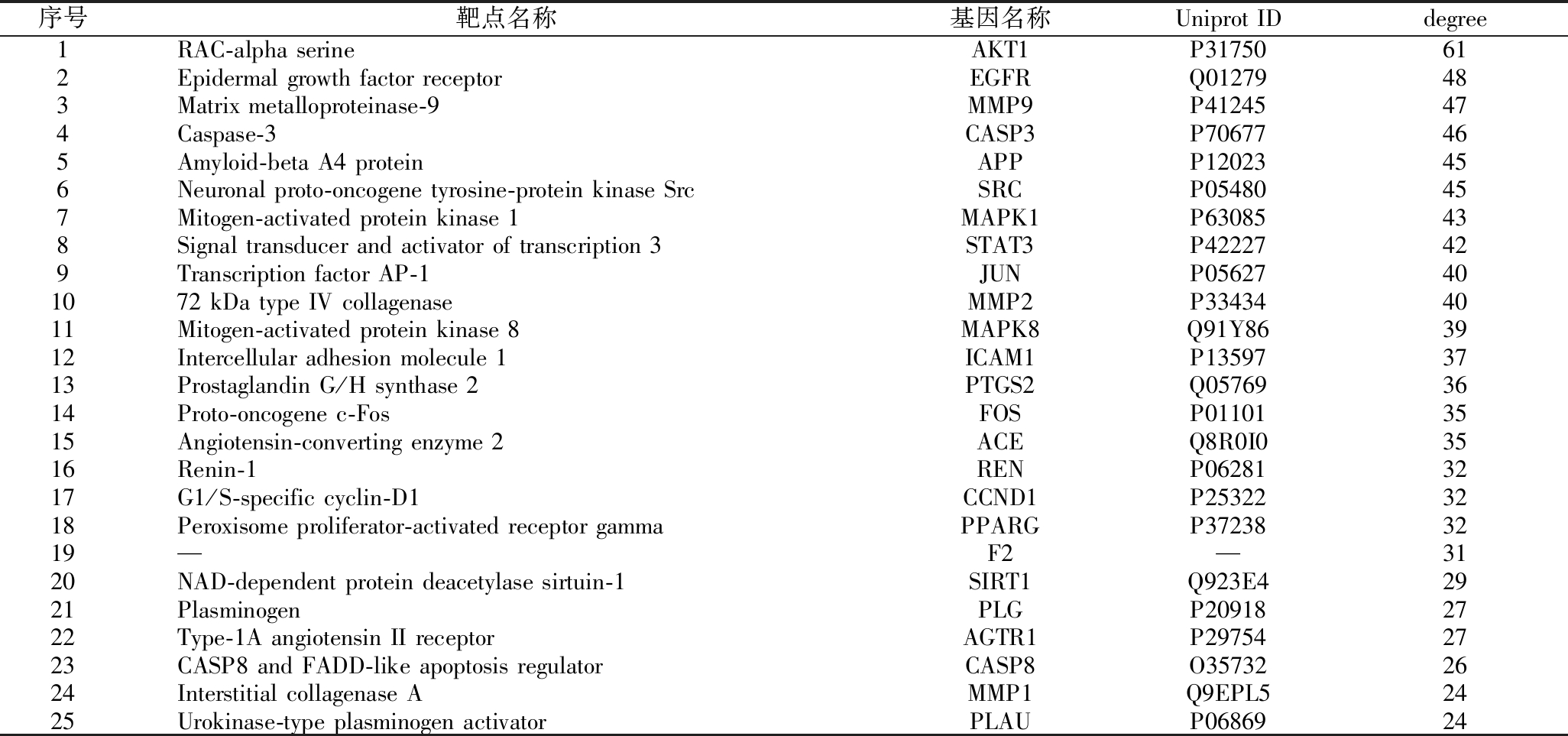
序号靶点名称基因名称Uniprot IDdegree1RAC-alpha serineAKT1P31750612Epidermal growth factor receptorEGFRQ01279483Matrix metalloproteinase-9MMP9P41245474Caspase-3CASP3P70677465Amyloid-beta A4 proteinAPPP12023456Neuronal proto-oncogene tyrosine-protein kinase SrcSRCP05480457Mitogen-activated protein kinase 1MAPK1P63085438Signal transducer and activator of transcription 3STAT3P42227429Transcription factor AP-1JUNP05627401072 kDa type IV collagenaseMMP2P334344011Mitogen-activated protein kinase 8MAPK8Q91Y863912Intercellular adhesion molecule 1ICAM1P135973713Prostaglandin G/H synthase 2PTGS2Q057693614Proto-oncogene c-FosFOSP011013515Angiotensin-converting enzyme 2ACEQ8R0I03516Renin-1RENP062813217G1/S-specific cyclin-D1CCND1P253223218Peroxisome proliferator-activated receptor gammaPPARGP372383219—F2—3120NAD-dependent protein deacetylase sirtuin-1SIRT1Q923E42921PlasminogenPLGP209182722Type-1A angiotensin II receptorAGTR1P297542723CASP8 and FADD-like apoptosis regulatorCASP8O357322624Interstitial collagenase AMMP1Q9EPL52425Urokinase-type plasminogen activatorPLAUP0686924
2.6 KEGG及GO通路富集分析
KEGG分析共获得124条通路(P<0.05),按照P值从小到大筛选出前20条通路,如图4所示。
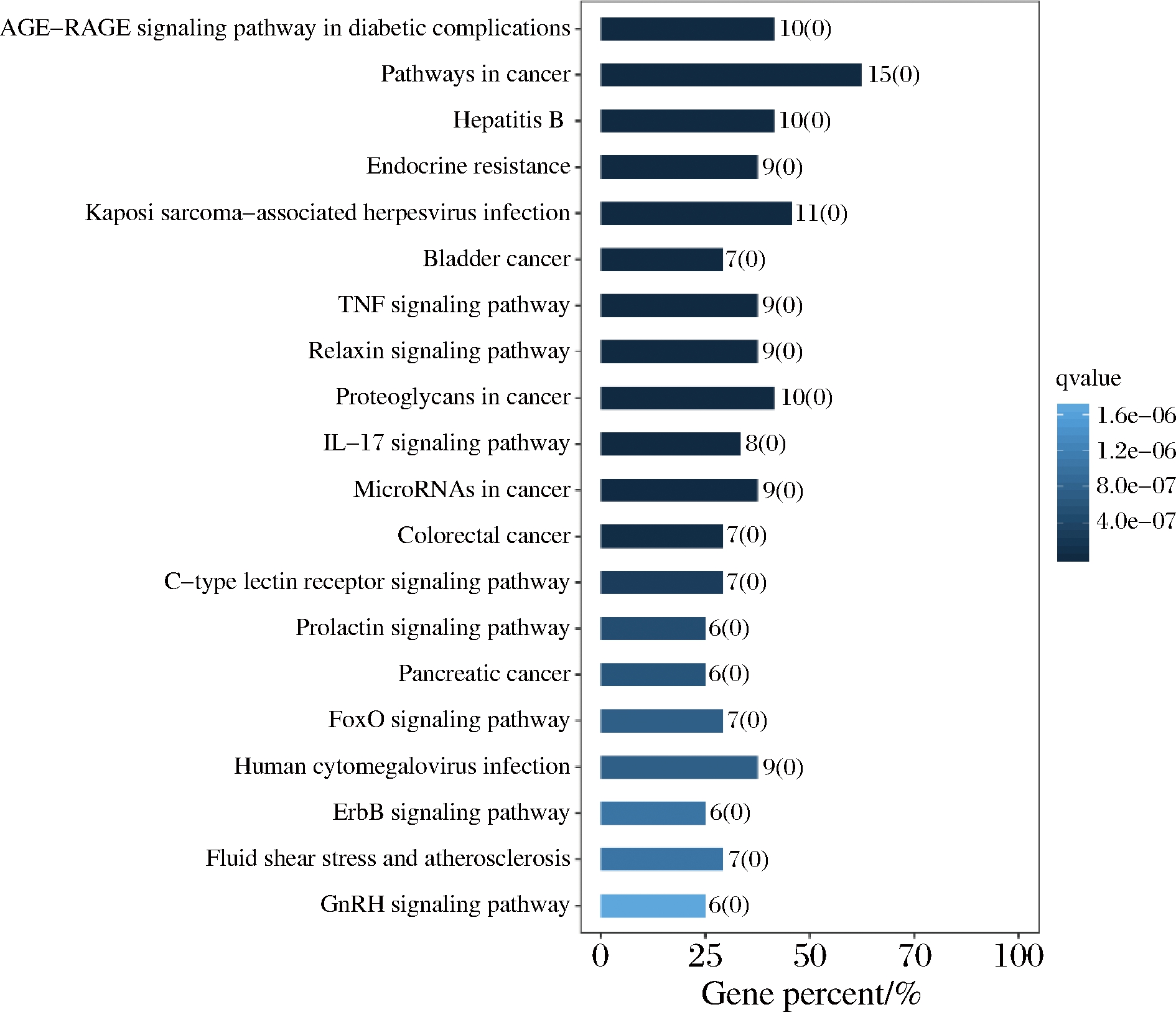
图4 KEGG通路富集分析
Fig.4 KEGG pathway enrichment analysis
主要通路有糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、癌症通路(pathways in cancer)、内分泌抵抗(endocrine resistance)、TNF信号通路(tumor necrosis factor signaling pathway)、松弛素信号通路(relaxin signaling pathway)、IL-17信号通路(IL-17 signaling pathway)、FoxO信号通路(forkhead box protein O signaling pathway)、ErbB信号通路(receptor tyrosine-protein kinase erbB ErbB signaling pathway)等。AGE-RAGE信号通路是糖尿病肾病的形成和进展中非常重要的一环,在调节T2DM TNF-α的产生和表达、氧化应激和内皮功能中起重要作用。在衰老的过程中,以及肾衰竭、炎症,特别是糖尿病情况下,晚期糖基化终末产物(advanced glycation end products,AGEs)的形成和沉积都会加速。BURR等[18]的研究表明与糖尿病相关的高血糖症将增加AGE水平和活跃的RAGE信号传导,加速细胞迁移,导致左心室硬化而患心血管疾病。针对RAGE信号通路调节剂的治疗,可能具有减轻糖尿病并发症发生的作用。TNF-α信号传导途径通过活化的内皮介导炎性细胞黏附的迁移参与T2DM肾病患者慢性肾脏疾病的发展[19]。松弛素介导的血管内皮生长因子(vascular endothelial growth factor, VEGF)和基质细胞衍生因子1-α的刺激,以及金属蛋白酶的调控表达,可改善糖尿病小鼠的心血管纤维化[20]。视网膜神经胶质细胞Müller中IL-17A的产生和Act1信号的激活可通过炎症反应加速糖尿病性视网膜病[21]。FoxO信号通路是胰岛素调节肝脏糖原异生及肝糖输出的信号通路之一。当胰岛素与肝细胞表面的胰岛素受体特异性结合,激活胰岛素受体底物(insulin receptors,IRs),使下游PI3K/AKT信号通路活化,下游转录因子FoxO1磷酸化而致其由细胞核排斥至细胞质,从而阻断下游糖异生基因的转录调控,致肝脏糖异生及肝糖输出减少[22]。
GO分析包括生物过程(biological process, BP)、细胞组分(cellular component, CC)、分子功能(molecular function, MF)3个部分。通过Omicshare在线云平台对马氏珍珠贝软体肽段治疗T2DM的25个潜在靶点进行GO富集分析,设定P<0.05,共获得2 183条生物过程或通路,其中1 943个与BP相关,98个与CC相关,142个与MF相关。根据P值从小到大排序,选取前20条GO条目,绘制柱状图,如图5所示。BP主要涉及对有机氮化合物的响应(response to organonitrogen compound)、含氮化合物反应(response to nitrogen compound)、含氧化合物反应(response to oxygen-containing compound)、对无机物的反应(response to inorganic substance)、蛋白质代谢过程的正调控(positive regulation of protein metabolic process)、调节细胞增殖(regulation of cell proliferation)等生物过程。CC主要涉及膜筏(membrane raft)、膜微区(membrane microdomain)、膜区(membrane region)、细胞外基质(extracellular matrix)等细胞组分。MF主要涉及作用于蛋白质的催化活性(catalytic activity, acting on a protein)、内肽酶活性(endopeptidase activity)、酶结合(enzyme binding)、作用于L-氨基酸肽的肽酶活性(peptidase activity, acting on L-amino acid peptides)等功能。关键靶点AKT1对GSK3同种型的磷酸化是驱动细胞增殖的一种机制[23],AKT还通过MAP3K5(凋亡信号相关激酶)的磷酸化调节细胞存活[24]。
2.7 体外DPP-IV抑制率验证
根据前述工作,对筛选的28条肽段进行DPP-IV抑制活性验证。如图6所示,在肽段浓度为2.5 mg/mL时,26号肽段的DPP-IV抑制率最高,为(83.45±2.54)%。其他肽段的DPP-IV抑制率小于0或低于50%可能是由于在肽段质量浓度为2.5 mg/mL时,肽段浓度过低,活性较弱未能与DPP-IV结合;也可能是由于肽段与DPP-IV的口袋结合作用较强,但该结合未产生活性。如图7所示,26号肽段的IC50为395 μmol/L。
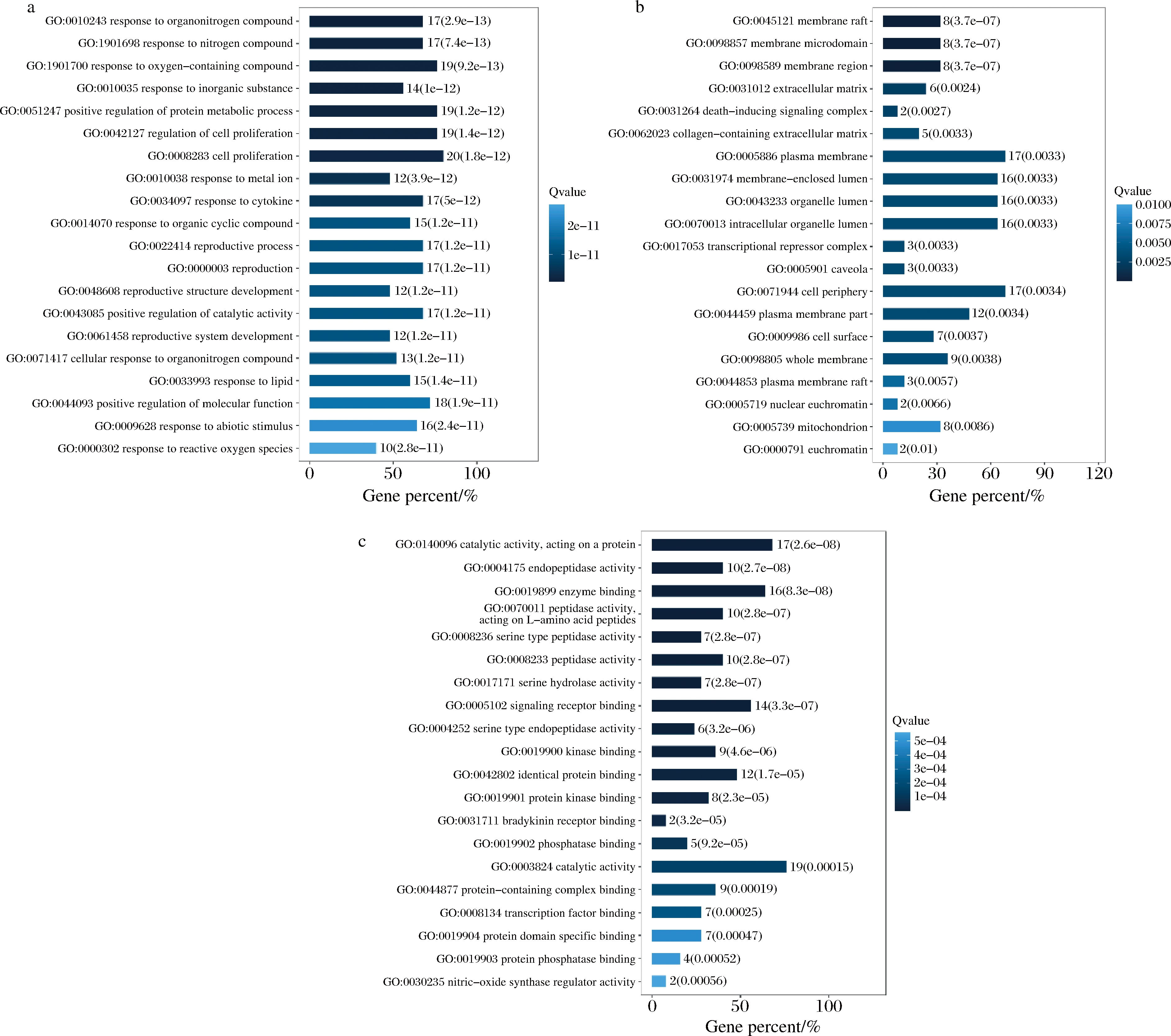
a-BP富集分析;b-CC富集分析;c-MF富集分析
图5 GO富集分析
Fig.5 GO enrichment analysis
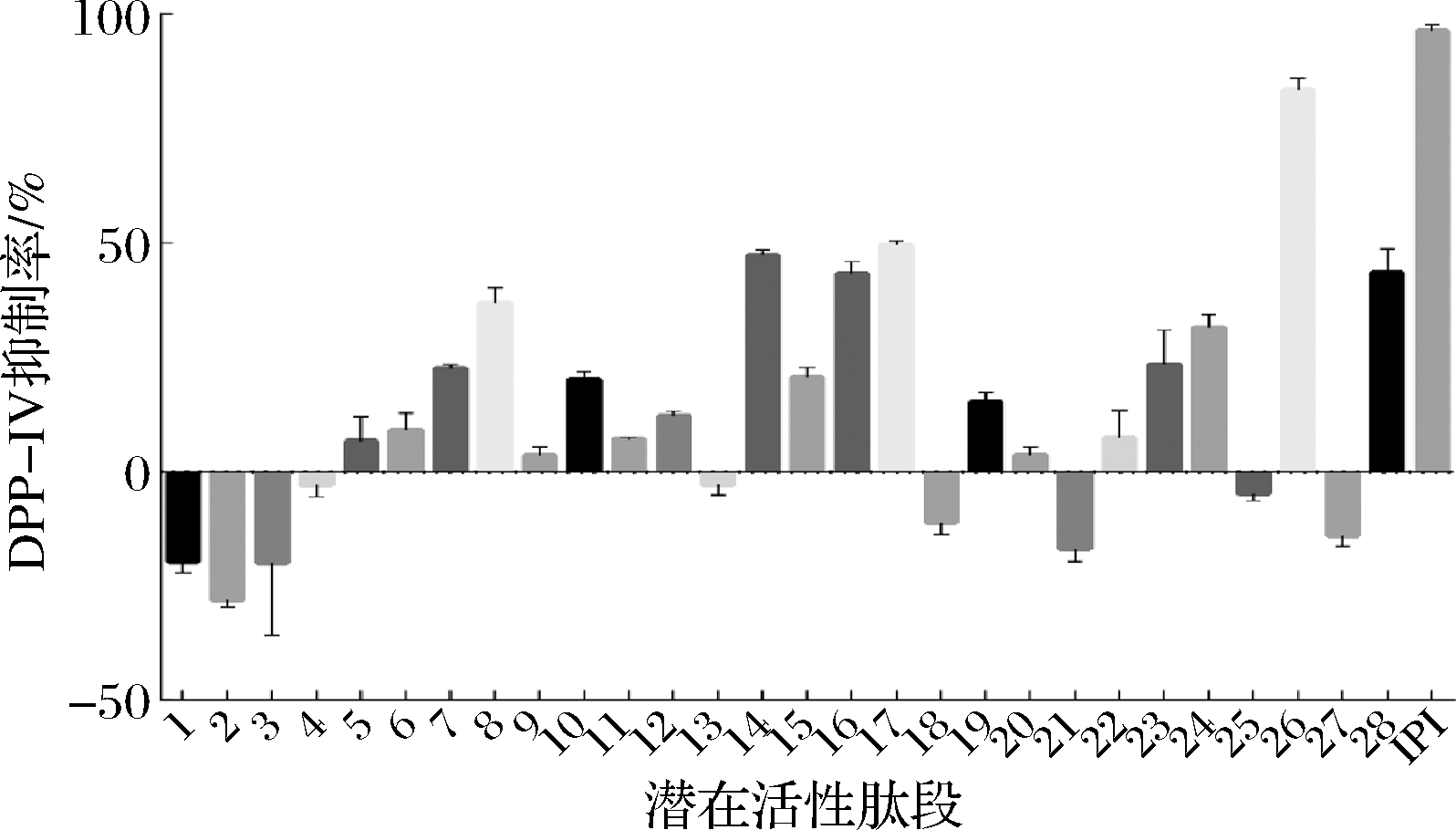
图6 潜在活性肽段体外DPP-IV抑制活性验证
Fig.6 In vitro DPP-IV inhibitory activity verification of potentially active peptides
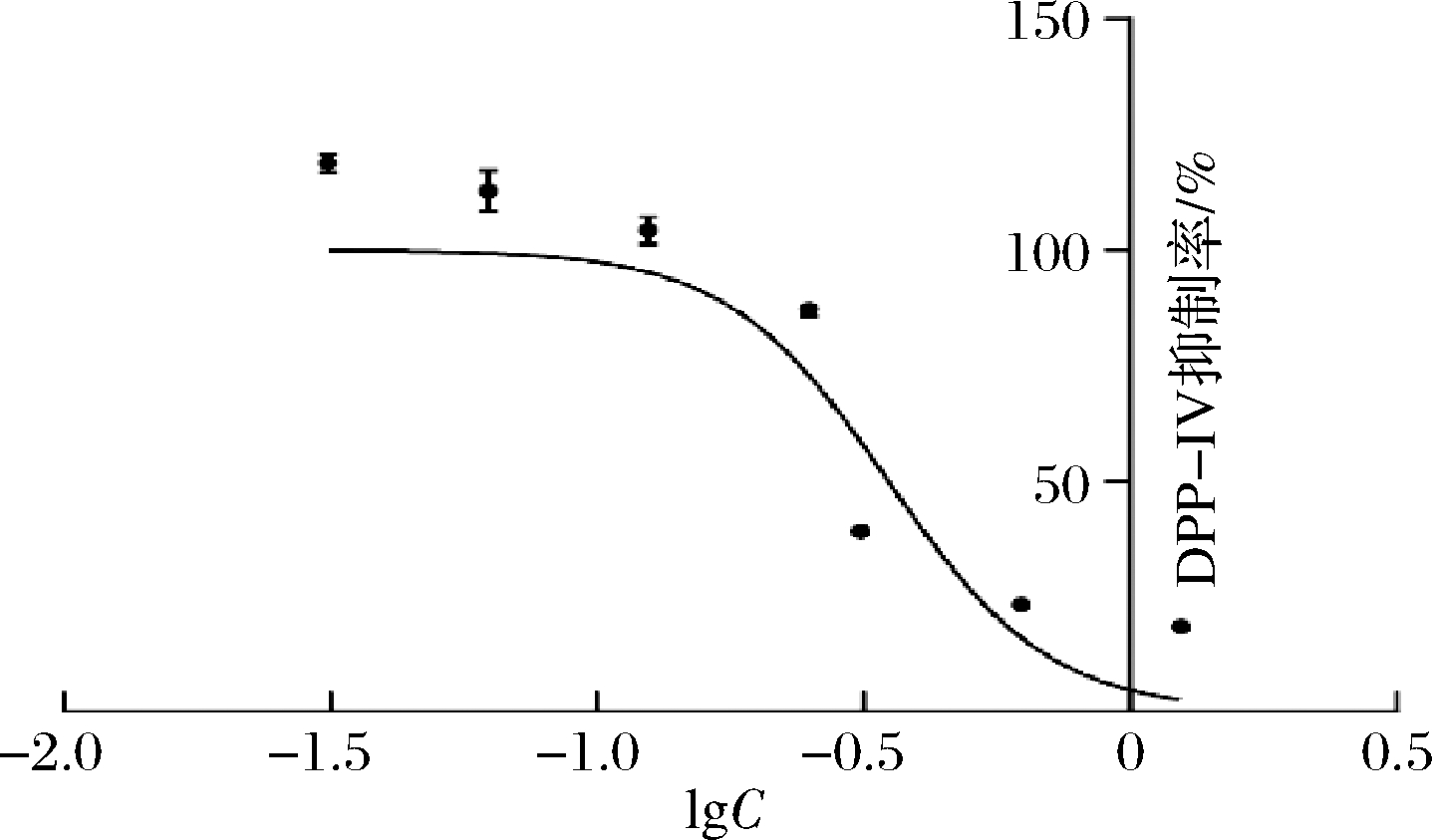
图7 26号肽在不同浓度下的DPP-IV抑制率
Fig.7 DPP-IV inhibition rate of peptide 26 at different concentrations
3 结论
本研究基于网络药理学和分子对接技术,筛选了马氏珍珠贝软体来源的潜在降糖活性肽。研究从849条模拟酶切肽段中发现了28条潜在降糖活性肽段,这些肽段通过参与细胞增殖与凋亡、蛋白质代谢、信号转导、炎症反应等过程发挥降糖作用。活性验证研究进一步验证19条肽段具有体外DPP-IV抑制活性,其中26号肽段活性最佳,体外DPP-IV抑制率的IC50为395 μmol/L。综上,本文采用网络药理学与分子对接技术结合的方法可快速筛选马氏珍珠贝软体来源的降糖活性肽,探讨其发挥降糖作用的可能途径,本文的研究思路对马氏珍珠贝活性肽类成分的发现提供数据与方法支撑,对马氏珍珠贝乃至海洋贝类等食品的开发与应用具有一定指导意义。
[1] 韩威, 郑丽杰, 陈露, 等.杂色蛤酶解物的降糖活性初步评价及其物质基础研究[J].食品工业科技, 2020, 41(14):311-315;322.
HAN W, ZHENG L J, CHEN L, et al.Preliminary evaluation of hypoglycemic activity and its material basis of Ruditapes philippinarum hydrolysate[J].Science and Technology of Food Industry, 2020, 41(14):311-315;322.
[2] 延海莹, 刘盟梦, 乔乐克, 等.扇贝裙边活性肽的制备及其降血糖活性研究[J].食品工业, 2018, 39(3):117-121.
YAN H Y, LIU M M, QIAO L K, et al.Study on scallop skirt active peptide and glucose tolerance activity[J].The Food Industry, 2018, 39(3):117-121.
[3] 林海生, 廖津, 章超桦, 等.华贵栉孔扇贝酶法制备α-葡萄糖苷酶抑制肽工艺优化[J].广东海洋大学学报, 2020, 40(5):97-104.
LIN H S, LIAO J, ZHANG C H, et al.Optimization of enzymatic preparation of α-glucosidase inhibitory peptides from Chlamys nobilis[J].Journal of Guangdong Ocean University, 2020, 40(5):97-104.
[4] 赵荣涛, 王宁丽, 魏鉴腾, 等.牡蛎蛋白酶解多肽降糖及抗氧化活性评价[J].食品工业科技, 2018, 39(3):28-31.
ZHAO R T, WANG N L, WEI J T, et al.Evaluation of hypoglycemic and antioxidant activity for peptides from oyster protein[J].Science and Technology of Food Industry, 2018, 39(3):28-31.
[5] 董又滋, 赵泉霖, 高丽君, 等.黄芪-当归药对治疗糖尿病心肌病的分子机制[J].中国实验方剂学杂志, 2021, 27(18):16-24.
DONG Y Z, ZHAO Q L, GAO L J, et al.Molecular mechanism of medicinal pair Astragali Radix-Angelicae Sinensis Radix against diabetic cardiomyopathy[J].Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(18):16-24.
[6] 孙元芳, 钟小天, 高建胜, 等.基于网络药理学的桑叶治疗2型糖尿病作用机制研究[J].中药材, 2021, 44(4):954-960.
SUN Y F, ZHONG X T, GAO J S, et al.Mechanism of action of Mori folium on type 2 diabetes mellitus based on network pharmacology[J].Journal of Chinese Medicinal Materials, 2021, 44(4):954-960.
[7] 吴娟, 张兴德, 郁红礼, 等.分子对接模拟预测黄连-肉桂抗糖尿病物质基础[J].时珍国医国药, 2020, 31(11):2 583-2 585.
WU J, ZHANG X D, YU H L, et al.Molecular docking simulation to predict the antidiabetic substance basis of Coptis chinensis and cinnamon[J].Lishizhen Medicine and Materia Medica Research, 2020, 31(11):2 583-2 585.
[8] 段贤春, 黄石, 彭代银, 等.网络药理学在中药复方研究中的应用[J].中国药理学通报, 2020, 36(3):303-308.
DUAN X C, HUANG S, PENG D Y, et al.Application of network pharmacology in the study of traditional Chinese medicine formula[J].Chinese Pharmacological Bulletin, 2020, 36(3):303-308.
[9] YANG S N, ZHANG Y, SHEN F K, et al.The flavonoid baicalin improves glucose metabolism by targeting the PH domain of AKT and activating AKT/GSK3β phosphorylation[J].FEBS Letters, 2019, 593(2):175-186.
[10] 马欢, 高楠楠, 陈俞如, 等.糖通饮对2型糖尿病大鼠胰腺组织PI3K-AKT通路的影响[J].贵州医科大学学报, 2020, 45(1):50-55.
MA H, GAO N N, CHEN Y R, et al.The effect of Tangtongyin formula on the PI3K-AKT signaling pathway in the pancreas of type 2 diabetic rats[J].Journal of Guizhou Medical University, 2020, 45(1):50-55.
[11] VAN VLIET S, MITTENDORFER B.When muscle doesn’t ‘Rac’ it up, adipose tissue ‘AKTs’[J].The Journal of Physiology, 2018, 596(12):2 273-2 275.
[12] 周霖, 刘红斌.老年2型糖尿病微血管病变与内皮素、基质金属蛋白酶-9及其他危险因素的相关性分析[J].实用医药杂志, 2020, 37(5):397-400.
ZHOU L, LIU H B.Correlation between endothelin, matrix metalloproteinase-9 and microangiopathy in elderly patients with type 2 diabetes[J].Practical Journal of Medicine & Pharmacy, 2020, 37(5):397-400.
[13] MOHAMMAD G, KOWLURU R A.Diabetic retinopathy and signaling mechanism for activation of matrix metalloproteinase-9[J].Journal of Cellular Physiology, 2012, 227(3):1 052-1 061.
[14] LI Z L, LI Y, OVERSTREET J M, et al.Inhibition of epidermal growth factor receptor activation is associated with improved diabetic nephropathy and insulin resistance in type 2 diabetes[J].Diabetes, 2018, 67(9):1 847-1 857.
[15] SATO H, NAGASHIMA K, OGURA M, et al.Src regulates insulin secretion and glucose metabolism by influencing subcellular localization of glucokinase in pancreatic β-cells[J].Journal of Diabetes Investigation, 2016, 7(2):171-178.
[16] SIDDIQUE T, AWAN F R.Effects of Reg3 delta bioactive peptide on blood glucose levels and pancreatic gene expression in an alloxan-induced mouse model of diabetes[J].Canadian Journal of Diabetes, 2016, 40(3):198-203.
[17] PIPICZ M, DEMJ N V, S
N V, S RKÖZY M, et al.Effects of cardiovascular risk factors on cardiac STAT3[J].International Journal of Molecular Sciences, 2018, 19(11):3572.
RKÖZY M, et al.Effects of cardiovascular risk factors on cardiac STAT3[J].International Journal of Molecular Sciences, 2018, 19(11):3572.
[18] BURR S D, HARMON M B, STEWART J A Jr.The impact of diabetic conditions and AGE/RAGE signaling on cardiac fibroblast migration[J].Frontiers in Cell and Developmental Biology, 2020, 8:112.
[19] LAMPROPOULOU I T, STANGOU Μ, SARAFIDIS P, et al.TNF-α pathway and T-cell immunity are activated early during the development of diabetic nephropathy in type II diabetes mellitus[J].Clinical Immunology, 2020, 215:108423.
[20] NG H H, LEO C H, PARRY L J, et al.Relaxin as a therapeutic target for the cardiovascular complications of diabetes[J].Frontiers in Pharmacology, 2018, 9:501.
[21] QIU A W, BIAN Z, MAO P G, et al.IL-17A exacerbates diabetic retinopathy by impairing Müller cell function via Act1 signaling[J].Experimental & Molecular Medicine, 2016, 48(12):e280.
[22] 王鑫蕾, 倪晓晴, 苏建友, 等.AKT/FOXO1信号通路在限热卡高脂饮食改善肥胖小鼠肝脏胰岛素抵抗中的作用[J].实用医学杂志, 2020, 36(16):2 199-2 204.
WANG X L, NI X Q, SU J Y, et al.The effect of AKT/FOXO1 signaling pathway on ameliorating obese mice hepatic insulin resistance with calorie restricted and high fat diet[J].The Journal of Practical Medicine, 2020, 36(16):2 199-2 204.
[23] WAKATSUKI S, SAITOH F, ARAKI T.ZNRF1 promotes Wallerian degeneration by degrading AKT to induce GSK3B-dependent CRMP2 phosphorylation[J].Nature Cell Biology, 2011, 13(12):1 415-1 423.
[24] KITAMURA T, KITAMURA Y, KURODA S, et al.Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt[J].Molecular and Cellular Biology, 1999, 19(9):6 286-6 296.