植源性食物是营养、膳食纤维、矿物质和酚类化合物的良好来源[1]。其中酚类化合物具有优异的抗氧化能力,以及预防慢性炎症、心血管疾病、癌症和糖尿病等疾病的功能得到广泛的研究。植物生长过程中酚类物质起到一定的生物防御作用、抗逆作用以及生长调节作用。植物酚类物质合成以苯丙烷代谢途径为主[2],见电子版附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.028750)。L-苯丙氨酸经苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL)脱氨基形成反式肉桂酸,在肉桂酸-4-羟化酶(cinnamic acid-4-hydroxylase,C4H)作用下生成p-香豆酸,经4-香豆酸辅酶A连接酶(4-coumarate-CoA ligase,4CL)作用生成p-香豆酰辅酶A,最后产生黄酮、花色苷和酚酸等酚类物质。种子萌发时,其部分结合态酚类物质转化为游离态,同时合成新的酚酸类化合物[3]。目前对于植源性食物尤其是芽类食物中酚类化合物的研究较多,CHEN等[3]发现金丝雀籽在发芽结束时游离酚、结合酚以及总酚含量与生子粒相比显著增加1 042%、120%和741%。PHAM等[4]对2种加拿大小麦、加拿大西部红春麦、加拿大西部琥珀杜伦麦的研究发现,在发芽过程中,小麦中酚类化合物含量和抗氧化活性增加。此外,籽粒萌发后,其自身大分子物质被降解成容易消化吸收的小分子物质,同时抗营养因子如植酸等含量显著降低[5],从而提升了籽粒营养和功能品质。
青稞(Hordeum vulgare L. var. nudum Hook.f)为禾本科大麦属一年生草本植物,为我国藏区主要的作物和粮食来源[6]。青稞中富含β-葡聚糖、膳食纤维等功能性成分[7],也是酚类物质的良好来源。杨希娟等[8]研究了青藏高原主要栽培品种的不同粒色青稞酚类化合物含量与抗氧化活性的差异,发现紫色、蓝色、黑色、黄色组青稞中酚类物质含量及抗氧化活性最高的品种分别为云青2 号、循化亮蓝、947和短白青稞。靳玉龙等[9]研究发现,藏区紫青稞7个品种中酚类物质和总黄酮含量差异较大。可见,青稞品种是萌发富集酚类物质的第一影响因素。此外,不同发芽条件对于植物种子酚类物质积累也有一定影响,KRUMA等[10]研究发现,除燕麦种子浸泡后总酚含量显著降低外,小麦、黑麦、黑小麦、大麦等谷物浸泡后总酚含量均显著增加。萌发12 h后大麦、小麦总酚含量没有显著变化,黑麦和小黑麦的总酚含量降低,燕麦的总酚含量增加,随着萌发时间的延长,酚类物质得到持续积累。因此,研究萌发条件对增加谷物中酚类物质至关重要。
本研究以我国藏区产果洛、喜马拉雅22号、喜马拉雅19号、冬青1号、藏青2000和藏青690等6个品种的青稞作为材料,分析其预萌芽后酚类物质含量变化,优选品种;研究萌发条件对青稞酚类物质积累的影响,为开发富含酚类物质的预萌芽青稞提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料及处理
青稞由西藏农牧学院植物科学学院实习农场提供,来源及编号见表1。经挑选、除杂后的青稞籽粒50 g,用1% NaClO溶液消毒15 min,用去离子水冲洗至pH中性。在30 ℃条件下用去离子水浸泡6 h,浸泡过的青稞籽粒用去离子水冲洗2次。将浸泡后的青稞籽粒均匀铺在发芽机(梦飞扬科技有限公司)苗盘上,在设定的萌发条件下进行发芽,每24 h换水1次,每次1 L。
表1 供试青稞种质材料地理来源及编号
Table 1 Geographical sources and numbers of tested highland barley

序号品种名称原产地备注Ⅰ果洛林芝冬青稞Ⅱ喜马拉雅22号日喀则春青稞Ⅲ喜马拉雅19号日喀则春青稞Ⅳ冬青1号西藏自治区农科院培育冬青稞Ⅴ藏青2000西藏自治区农科院培育春青稞Ⅵ藏青690西藏自治区农科院培育春青稞
品种筛选:浸泡的青稞在30 ℃条件下避光发芽36 h,测定发芽率、芽长、株重和呼吸强度;取发芽36 h的青稞,测定总酚、酚酸含量以及PAL、C4H、4CL活力。
萌发条件研究:控制发芽温度为30 ℃,研究发芽时间(0、36、54、72 h)以及控制发芽时间为36 h,研究发芽温度(25、30、35、40 ℃)对青稞酚类物质含量的影响。然后对发芽时间和温度进行Miscellaneous响应面设计优化,因素水平见表2。
表2 响应曲面分析因素水平
Table 2 Response surface analysis factors and levels

水平因素A-发芽时间/hB-发芽温度/℃124252363034835
1.2 指标测定
呼吸强度:采用小篮子法测定[11]。
芽长:随机选取30株青稞芽苗,用数显游标卡尺测量其芽长,结果以mm表示。
鲜重(fresh weight,FW):随机选取100株新鲜的青稞芽苗为1组并称取其质量,即为100株青稞芽苗的FW,重复称量3组,结果以g/100株表示。
干重(dry weight,DW):随机选取100株新鲜的青稞芽苗为1组,冷冻干燥后称取其质量,即为100株青稞芽苗的DW,重复称量3组,结果以g/100株表示。
酚类物质提取:采用MA等[12]的方法。取预萌芽青稞经真空冷冻干燥,粉碎后过40目筛得到青稞粉,提取游离酚和结合酚。
酚类物质含量测定:采用MA等[12]的方法测定预萌芽青稞游离酚、结合酚及总酚物质含量。总酚含量以mg GAE/100 g DW计。
酚酸含量:采用CHEN等[13]的方法测定预萌芽青稞的酚酸含量。
PAL活力:参照ASSIS等[14]的方法,稍作修改。以每小时每克青稞芽苗(FW)酶促反应体系吸光度值增加0.01为一个PAL活力单位(U),表示为0.01△OD290/(h·g),即U/g。
C4H活力:参照HAN等[15]的方法,稍作修改。以每分钟每克青稞芽苗(FW)酶促反应体系吸光度值增加0.01为一个C4H活力单位(U),表示为0.01△OD340/(min·g),即U/g。
4CL活力:参照HAN等[15]的方法,稍作修改。以每分钟每克青稞芽苗(FW)酶促反应体系吸光度值增加0.01为一个4CL活力单位(U),表示为0.01△OD333/(min·g),即U/g。
1.3 数据统计与分析
采用SPSS 25.0软件对数据进行方差分析,显著性水平为P<0.05。实验设3次生物学重复,数据以“平均值±标准差”表示。
2 结果与分析
2.1 萌发青稞品种生理代谢变化
由表3可知,喜马拉雅22号萌发36 h时发芽率为87.33%,显著高于其他5个品种。喜马拉雅19号在发芽36 h时芽长达到组间最大值,而此时藏青2000的芽长最短。发芽36 h时藏青690鲜重显著高于其他品种,此时果洛青稞鲜重显著低于其他品种,二者的干重也体现出同样的趋势。喜马拉雅19号和冬青1号的呼吸强度显著高于其他品种,果洛的呼吸强度则显著低于其他品种。
表3 不同青稞品种萌发36 h的生理变化
Table 3 Physiological changes of different barley varieties at 36 h of germination
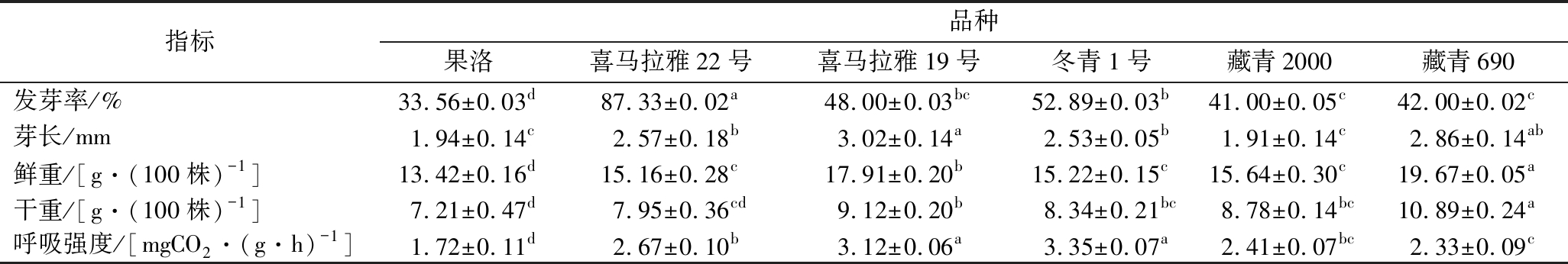
指标品种果洛喜马拉雅22号喜马拉雅19号冬青1号藏青2000藏青690发芽率/%33.56±0.03d87.33±0.02a48.00±0.03bc52.89±0.03b41.00±0.05c42.00±0.02c芽长/mm1.94±0.14c2.57±0.18b3.02±0.14a2.53±0.05b1.91±0.14c2.86±0.14ab鲜重/[g·(100株)-1]13.42±0.16d15.16±0.28c17.91±0.20b15.22±0.15c15.64±0.30c19.67±0.05a干重/[g·(100株)-1]7.21±0.47d7.95±0.36cd9.12±0.20b8.34±0.21bc8.78±0.14bc10.89±0.24a呼吸强度/[mgCO2·(g·h)-1]1.72±0.11d2.67±0.10b3.12±0.06a3.35±0.07a2.41±0.07bc2.33±0.09c
注:不同小写字母表示品种间存在显著性差异(P<0.05)
2.2 萌发青稞品种总酚含量
由图1可知,喜马拉雅19号、冬青1号以及藏青2000三个品种的总酚酸含量显著高于其他品种,其中喜马拉雅19号和冬青1号的结合酚含量也显著高于其他品种,而冬青1号和藏青2000的游离酚含量显著高于其他品种。
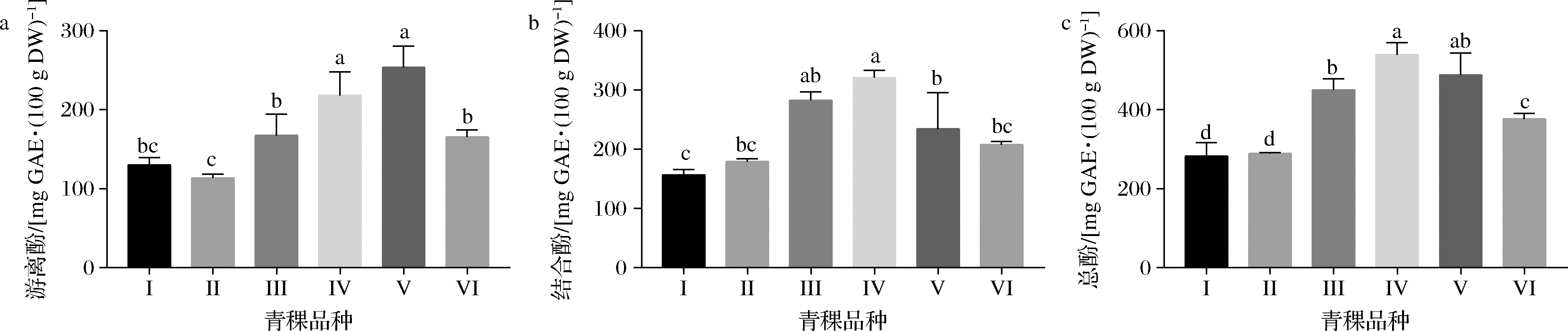
a-游离酚;b-结合酚;c-总酚
图1 不同萌芽品种青稞的游离酚、结合酚和总酚含量
Fig.1 Effects of different varieties on the free, bound and total phenolics content in germinated highland barley
注:图中I~VI分别表示果洛、喜马拉雅22号、喜马拉雅19号、冬青1号、藏青2000、藏青690的青稞品种;不同小写字母
表示品种间存在显著性差异(P<0.05)(下同)
2.3 萌发青稞品种酚酸含量
从表4可知,供试的6个品种发芽青稞的结合酚酸含量均高于其对应的游离酚酸含量,结合酚酸是发芽青稞酚酸的主要存在形式。其中芥子酸是发芽青稞中的主要酚酸,且主要以结合态存在。6个品种青稞中,均未检测到丁香酸。喜马拉雅22号中检测到没食子酸、原儿茶酸、对苯酚、香草酸和芥子酸均以结合态存在,喜马拉雅19号青稞中检测到的酚酸大多以结合态存在,其中没食子酸和对香豆酸以游离态存在。冬青1号、藏青2000中的阿魏酸以游离态存在。冬青1号和藏青2000中酚酸组成一致,结合态酚酸分别占71.33%和63.01%。供试品种冬青1号中总酚酸含量最高。
表4 不同萌芽青稞品种中的酚酸组成及含量
Table 4 The composition and content of phenolic acids in different varieties of germinated highland barley

酚酸存在形态酚酸含量/(μg·g-1 DW)ⅠⅡⅢⅣⅤⅥ没食子酸结合0.56±0.35a0.70±0.05aNDNDNDND游离4.33±0.01aND11.23±5.0a 16.10±14.48a13.53±0.69a6.37±2.07a原儿茶酸结合1.30±0.05c1.37±0.02c2.13±0.17b3.14±0.06aND1.21±0.21c游离1.32±0.55NDNDNDNDND对苯酚结合5.32±0.39bc12.03±3.78a8.58±0.82abc8.17±0.24abc9.35±0.71ab5.05±0.06c游离NDNDND1.20±0.41b6.78±0.51a9.40±2.85a香草酸结合13.61±0.16ab13.80±2.22a13.85±0.68a15.40±0.37a16.26±1.15a11.06±0.25b游离NDNDND4.76±0.75b3.52±0.54b7.52±0.5a咖啡酸结合NDND2.05±0.01a2.21±0.22a1.40±0.85aND游离NDNDNDNDNDND丁香酸结合NDNDNDNDNDND游离NDNDNDNDNDND
续表4

酚酸存在形态酚酸含量/(μg·g-1 DW)ⅠⅡⅢⅣⅤⅥ对香豆酸结合NDNDNDNDNDND游离NDND0.24±0.04d0.31±0.03c0.45±0.01b0.77±0.01a阿魏酸结合7.09±0.21NDNDNDNDND游离NDNDND0.84±0.10a0.98±0.02aND芥子酸结合15.91±0.73a9.90±10.81a29.57±0.78a30.59±0.29a20.21±18.76a24.23±0.24a游离NDND2.42±0.06a0.69±0.09b2.46±0.49a1.05±0.34b总酚酸结合43.8037.8056.1859.5147.2241.55游离5.650.0013.8923.9127.7223.91
注:ND,未检出
2.4 萌发青稞品种苯丙烷代谢关键酶活力测定
由图2可知,供试6种发芽青稞中PAL酶活力无显著性差异,其中冬青1号PAL酶活力最高为40.3 U/g FW。C4H酶活力具有显著性差异,其中冬青1号C4H酶活力为35.6 U/g FW,高于其他5个品种。喜马拉雅19号的4CL酶活力差异显著,为220.1 U/g FW,显著高于其他5个品种。

a-PAL;b-C4H;c-4CL
图2 不同品种青稞的PAL、C4H和4CL酶活力测定
Fig.2 Effects of different varieties on the PAL, C4H and 4CL activity of germinated highland barley
2.5 青稞萌发条件研究
2.5.1 萌发时间和温度对青稞总酚含量的影响
以冬青1号青稞为试材,控制温度30 ℃,研究萌发时间对酚类含量的影响。由图3-a可知,萌发显著提高青稞总酚含量,但是36~72 h差异不显著。游离酚含量随发芽时间的延长呈降低趋势,说明在发芽过程中游离酚酸会被降解或溶出。青稞中结合酚含量随发芽时间呈增加趋势,当发芽时间为36 h时达到最高。
控制发芽时间为36 h,研究不同发芽温度(25、30、35、40 ℃)对酚类物质含量的影响。图3-b显示,随着发芽温度的升高,青稞中总酚含量呈先增加后降低的趋势,当发芽温度为25和30 ℃时总酚含量最高。当发芽温度为35 ℃时,发芽青稞中总酚、游离酚和结合酚含量均低于其他组。发芽温度提高到40 ℃时,酚类含量高于35 ℃时的含量。

a-发芽时间;b-温度
图3 不同发芽时间和温度下酚类物质含量
Fig.3 Phenolics content at different germination time points and temperatures of germination
注:同一指标上不同小写字母表示处理间存在显著性差异(P<0.05)
2.5.2 萌发条件优化
在单因素试验的基础上,选用两因素三水平Miscellaneous实验设计对萌发富集酚类物质的条件进行优化,试验方案及结果见表5。
表5 响应面实验结果
Fig.5 The results of response surface analysis
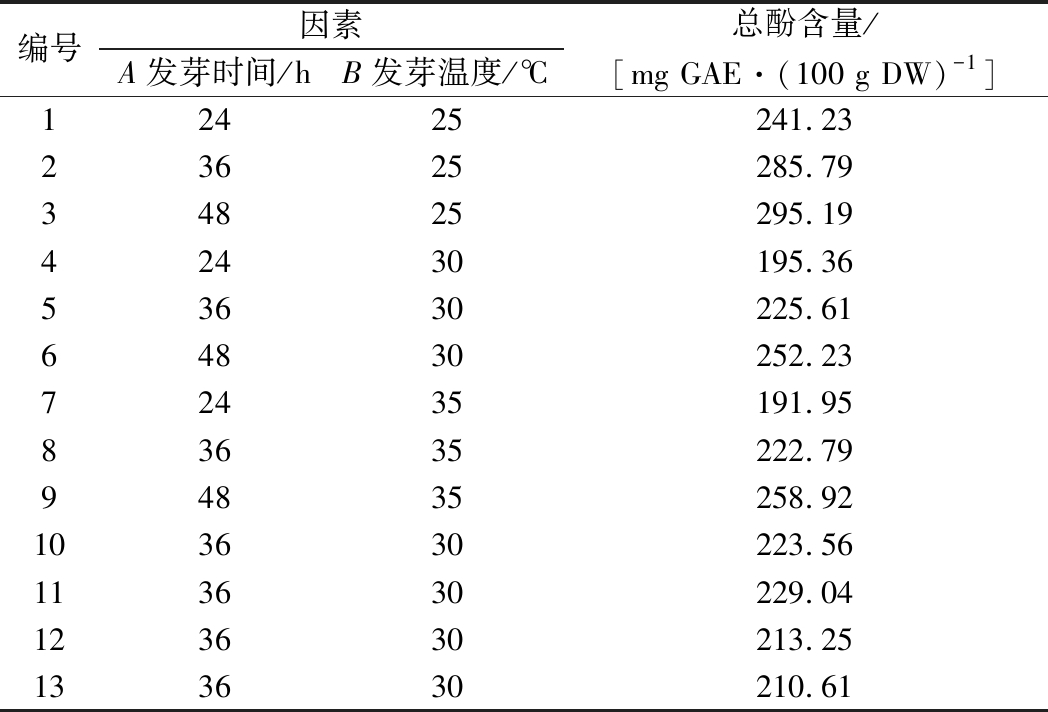
编号因素A发芽时间/hB发芽温度/℃总酚含量/[mg GAE·(100 g DW)-1]12425241.2323625285.7934825295.1942430195.3653630225.6164830252.2372435191.9583635222.7994835258.92103630223.56113630229.04123630213.25133630210.61
利用Design Expert 8.0软件,对表5中数据进行二次多元回归拟合,得到发芽时间、温度与总酚含量预测值的二次多项回归方程:
y(总酚含量)=221.91+28.43A-31.50B+3.24AB-1.86A2+28.64B2+10.12A2B+1.81AB2
萌发时间和温度对总酚含量都有显著的影响(P<0.05)。但是,两者之间对总酚含量的影响交互作用不显著(P>0.05)。由图4可知,随着发芽时间延长,总酚含量呈上升趋势,随着发芽温度的升高,总酚含量呈先下降后略微上升趋势。由回归方程可得到萌发富集青稞酚类物质的最佳条件为:萌发时间47.68 h,温度25.02 ℃。经验证,在此条件下(萌发时间48 h,萌发温度25 ℃),总酚含量可达296.72 mg GAE/100 g DW,是原料青稞(201.62 mg GAE/100 g DW)的1.47倍,说明本实验所拟合的二次多项式模型可预测青稞萌发条件和试验响应值之间的关系。
表6 响应曲面方差分析结果
Table 6 The ANOVA results of response surface analysis
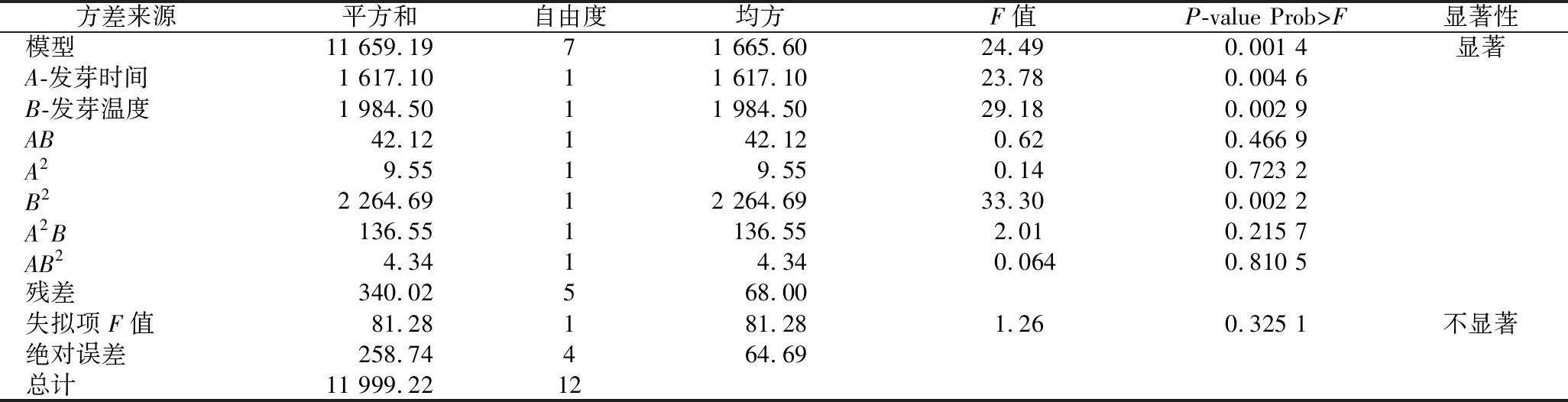
方差来源平方和自由度均方F值P-value Prob>F显著性模型11 659.1971 665.6024.490.001 4显著A-发芽时间1 617.1011 617.1023.780.004 6B-发芽温度1 984.5011 984.5029.180.002 9AB42.12142.120.620.466 9A29.5519.550.140.723 2B22 264.6912 264.6933.300.002 2A2B136.551136.552.010.215 7AB24.3414.340.0640.810 5残差340.02568.00失拟项F值81.28181.281.260.325 1不显著绝对误差258.74464.69总计11 999.2212
注:标准偏差8.25,平均值234.27,变异系数C.V.3.52%,相关系数R2 0.9717,校正决定系数![]() 拟合优度决定系数
拟合优度决定系数![]() 信噪比16.30
信噪比16.30

图4 响应曲面图
Fig.4 Response surface figure
3 结论与讨论
种子在萌发过程中,内源酶系被激活和合成新的水解酶,一些大分子营养物质被分解,形成小分子物质有利于种子萌发,此外也更容易被人体消化吸收。同时,种子中原不含有或含量极低的功能性物质如抗坏血酸[16]、γ-氨基丁酸、酚类等物质[17]被合成,并且一些抗营养物质如植酸[18]等被降解,从而提高其营养和功能品质。本研究结果表明,不同品种青稞的芽长、鲜/干重比、呼吸速率等生理指标差异显著(表3)。虽然喜马拉雅22号发芽率高,但是芽长、鲜重均较低。喜马拉雅19号和冬青1号青稞呼吸速率强,同时鲜重较高,说明这2个品种在发芽后生命活动强,代谢活动旺盛。白盼等[19]研究表明,青稞籽粒未发芽时,代谢酶活力低,并且大多以无活性的酶原形式存在。只有在开始发芽时,胚中会释放一种植物激素—赤霉素,在赤霉素的作用下,大量酶类被合成[20]。在这些酶的作用下,营养物质完成降解和转化。
本研究中,虽然供试的6个青稞品种均在青藏高原栽培,但是其酚类物质含量差异显著(图1)。不同品种发芽青稞酚类物质含量结果表明,发芽36 h后冬青1号的游离酚、结合酚及总酚含量均为最高。说明冬青1号青稞适合用于萌发富集酚类物质。根据酚类化合物的生物合成途径,PAL催化苯丙氨酸形成反式肉桂酸,是催化酚类化合物合成的起始反应,在酚类化合物合成中起到极其重要的调控作用。C4H催化反式肉桂酸形成对香豆酸,是酚类化合物合成的第二步反应。4CL催化对香豆酸形成的对香豆酰辅酶A是多种酚酸合成分支的重要前体物质[21]。本研究结果表明,供试青稞的PAL活性无显著差异,C4H活力在冬青1号青稞中最高,但是喜马拉雅19号青稞中4CL活力最高,这可能与6个青稞品种本底酶活力的高低有关。有研究表明,由于发芽过程中酶活力的提高,燕麦酚类物质含量得以提高。荞麦发芽产生的酚酸和黄酮类等次级代谢产物主要通过苯丙烷代谢途径合成,其中PAL是限速酶[23]。故PAL在酚类物质合成过程中具有重要的作用。不同品种青稞的内源酶有差异,导致芽长、鲜/干重比、呼吸速率等指标有差异。研究表明,谷物中酚类物质以酚酸为主,其中结合态的对香豆酸和阿魏酸为谷物中的主要酚酸[12]。然而在本研究中,游离型的没食子酸、结合型的香草酸和芥子酸为青稞中的主要酚酸(表4),并且与平原产青稞相比,酚酸组分更少[12]。除了品种差异外,还可能与栽培环境有关。
优选青稞品种后,通过单因素分析的方法研究发芽时间和温度对酚类物质含量的影响。结果表明,在萌发过程中,总酚含量升高,但是游离酚含量略有下降(图3-a),可能在浸泡和淋水发芽过程中游离酚溶出导致含量下降。赵珮等[24]研究表明在萌发过程中,酚类含量随萌发时间的变化不完全相同,本研究结果与之相一致。此外,本实验结果表明,低温(25~30 ℃)更有助于酚类物质的积累(图3-b)。与其他温度条件相比,35 ℃不利于酚类物质的累积。前人研究结果也显示青稞在35 ℃下萌发,酚类物质含量与25和30 ℃无显著差异[25]。冬青1号青稞产自西藏,为耐寒耐旱品种,生长环境温度为25~30 ℃,当温度为35 ℃时,不利于该品种生长,可能影响酚类物质的合成。当温度为40 ℃时,发芽青稞处于高温胁迫状态,可能激活了苯丙烷代谢途径中的关键酶,催化苯丙氨酸转化为酚类物质。通过进一步的响应面实验,在选定的发芽时间和发芽温度范围内,获得了最优条件为发芽时间48 h和温度25 ℃,与单因素试验结果相符合。
综上,供试的6个青稞品种中,结合萌发及其生长代谢与酚类合成情况,优选冬青1号青稞为萌发富集酚类物质的品种,冬青1号青稞中酚酸组成较少,且主要以游离型的没食子酸以及结合型的香草酸和芥子酸为主。萌发时间和温度对总酚含量有显著的影响,采用响应面法对萌发条件进行优化后得到的最佳组合为萌发时间48 h和温度25 ℃。
[1] PAJ![]() K P, SOCHA R, GA
K P, SOCHA R, GA KOWSKA D, et al.Phenolic profile and antioxidant activity in selected seeds and sprouts[J].Food Chemistry, 2014, 143:300-306.
KOWSKA D, et al.Phenolic profile and antioxidant activity in selected seeds and sprouts[J].Food Chemistry, 2014, 143:300-306.
[2] METWALLY A, FINKEMEIER I, GEORGI M, et al.Salicylic acid alleviates the cadmium toxicity in barley seedlings[J].Plant Physiology, 2003, 132(1):272-281.
[3] CHEN Z J, YU L L, WANG X K, et al.Changes of phenolic profiles and antioxidant activity in canaryseed (Phalaris canariensis L.) during germination[J].Food Chemistry, 2016, 194:608-618.
[4] PHAM V H, HATCHER D W, BARKER W.Phenolic acid composition of sprouted wheats by ultra-performance liquid chromatography (UPLC) and their antioxidant activities[J].Food Chemistry, 2011, 126(4):1 896-1 901.
[5] WANG X K, YANG R Q, JIN X L, et al.Effect of germination and incubation on Zn, Fe, and Ca bioavailability values of soybeans (Glycine max L.) and mung beans (Vigna radiate L.)[J].Food Science and Biotechnology, 2015, 24(5):1 829-1 835.
[6] 强小林, 迟德钊, 冯继林.青藏高原区域青稞生产与发展现状[J].西藏科技, 2008(3):11-17.
QIANG X L, CHI D Z, FENG J L.The highland barley production of the area of Qinghai-Tibet Plateau and current situation of the development[J].Tibet’s Science and Technology, 2008(3):11-17.
[7] 吴昆仑. 青稞功能元素与食品加工利用简述[J].作物杂志, 2008(2):15-17.
WU K L.Brief introduction of functional elements and food machining processing of hulless barley[J].Crops, 2008(2):15-17.
[8] 杨希娟, 党斌, 徐菲, 等.不同粒色青稞酚类化合物含量与抗氧化活性的差异及评价[J].中国粮油学报, 2017, 32(9):34-42.
YANG X J, DANG B, XU F, et al.Difference and evaluation of phenolics contents and antioxidant activity of colored hulless barley[J].Journal of the Chinese Cereals and Oils Association, 2017, 32(9):34-42.
[9] 靳玉龙, 白婷, 朱明霞.西藏不同紫青稞品种(系)中酚类物质的含量与特性分析[J].大麦与谷类科学, 2018, 35(4):12-15.
JIN Y L, BAI T, ZHU M X.Analysis of contents and properties of phenolic compounds in different colored hulless barley varieties planted in Tibet[J].Barley and Cereal Sciences, 2018, 35(4):12-15.
[10] KRUMA Z, TOMSONE L, ![]() INCE T, et al.Effects of germination on total phenolic compounds and radical scavenging activity in hull-less spring cereals and Triticale[J].Agronomy Research, 2016, 14(2):1 372-1 383.
INCE T, et al.Effects of germination on total phenolic compounds and radical scavenging activity in hull-less spring cereals and Triticale[J].Agronomy Research, 2016, 14(2):1 372-1 383.
[11] 李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社, 2000.
LI H S.Principles and Techniques of Plant Physiological Biochemical Experiment[M].Beijing:Higher Education Press, 2000.
[12] MA Y, WANG P, ZHOU T, et al.Role of Ca2+ in phenolic compound metabolism of barley (Hordeum vulgare L.) sprouts under NaCl stress[J].Journal of the Science of Food and Agriculture, 2019, 99(11):5 176-5 186.
[13] CHEN Z J, MA Y, WENG Y, et al.Effects of UV-B radiation on phenolic accumulation, antioxidant activity and physiological changes in wheat (Triticum aestivum L.) seedlings[J].Food Bioscience, 2019, 30:100409.
[14] ASSIS J S, MALDONADO R, MU OZ T, et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biology and Technology, 2001, 23(1):33-39.
OZ T, et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biology and Technology, 2001, 23(1):33-39.
[15] HAN C, LI J, JIN P, et al.The effect of temperature on phenolic content in wounded carrots[J].Food Chemistry, 2017, 215:116-123.
[16] 徐茂军. 不同品种大豆发芽过程中抗坏血酸合成积累的比较研究[J].中国粮油学报, 2003, 18(3):51-53;58.
XU M J.Comparative studies on ascorbic acid biosynthesis and accumulation of different soybean cultivars during sprouting[J].Chinese Cereals and Oils Association, 2003, 18(3):51-53;58.
[17] XU J G, TIAN C R, HU Q P, et al.Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nuda L.) during steeping and germination[J].Journal of Agricultural and Food Chemistry, 2009, 57(21):10 392-10 398.
[18] BILETSKA Y, SEMENIUK A, PEREPELYTSIA A.Research of the influence of soybean germination on changes in the amino acid composition and the content of phytic acid[J].Technology Audit and Production Reserves, 2020, 2(3(52)):35-37.
[19] 白盼, 宁正祥, 郭培国, 等.不同大麦籽粒品质及发芽后蛋白质含量和主要水解酶活力变化的研究[J].中国酿造, 2011, 30(12):117-121.
BAI P, NING Z X, GUO P G, et al.Barley quality and changes of protein contents and the major hydrolytic enzyme activities after germination in different barley[J].China Brewing, 2011, 30(12):117-121.
[20] AUTIO K, SIMOINEN T, SUORTTI T, et al.Structural and enzymic changes in germinated barley and rye[J].Journal of the Institute of Brewing, 2001, 107(1):19-25.
[21] VERMERRIS W, NICHOLSON R.Phenolic Compound Biochemistry[M].Dordrecht:Springer Netherlands, 2006.
[22] TIAN B Q, XIE B J, SHI J, et al.Physicochemical changes of oat seeds during germination[J].Food Chemistry, 2010, 119(3):1 195-1 200.
[23] ZHANG G, XU Z C, GAO Y Y, et al.Effects of germination on the nutritional properties, phenolic profiles, and antioxidant activities of buckwheat[J].Journal of Food Science, 2015, 80(5):H1111-H1119.
[24] 赵珮, 赵宁, 范巧宁, 等.大麦发芽过程中不同存在形式的酚类物质及其抗氧化活性变化[J].现代食品科技, 2015, 31(4):144-150;87.
ZHAO P, ZHAO N, FAN Q N, et al.Variations in the antioxidant activities of four crude polyphenolic extracts from barley during the germination process[J].Modern Food Science and Technology, 2015, 31(4):144-150;87.
[25] 董吉林, 李鹏冲, 申瑞玲, 等.青稞萌发工艺优化及营养成分分析[J].食品与机械, 2017, 33(2):158-161.
DONG J L, LI P C, SHEN R L, et al.Optimization of germinationp process and analysis of nutritional components in hull-less barley[J].Food & Machinery, 2017, 33(2):158-161.