淀粉是由葡萄糖分子通过糖苷键聚合形成的大分子化合物,包括线性结构的直链淀粉和大量分支结构的支链淀粉,分子间以氢键相互缔合并最终组装形成半晶体颗粒结构。按照X射线衍射图谱,可以将淀粉粒的晶体结构类型分为A、B和C型,不同晶体类型的淀粉粒结构与功能差异明显,其中A型晶体主要分布在禾谷类作物的种子中,B型晶体主要分布在植物块茎和高直链作物种子中,C型晶体由A、B型晶体组成,主要分布在豆类和薯蓣类植物的根状茎中,C型晶体中的A型和B型晶体含量不同,其波谱也不同,可进一步分为C型、CA型(以A型晶体为主)和CB型(以B型晶体为主)[1-3]。近年来,富含淀粉的药食两用植物的使用在功能食品开发中日益增长,其淀粉在功能性食品的加工性能、口感、营养特性中发挥着重要作用。由于多数药食两用植物淀粉资源产量受限,不适合大规模工业应用,但在功能食品、食品添加剂、医药辅料等方向有较大应用潜力。可以根据药食两用植物淀粉的特殊性质开发成功能食品,提高其应用价值。因此,必须对不同来源药食两用植物淀粉粒性质进行表征,为各行业的需求提供参考。
天然淀粉的结构和组成差异决定了它们的性质。淀粉粒在形态、直链淀粉含量和相对结晶度上的差异对淀粉的粒度分布、热力学、糊化特性和消化特性有显著影响,因此,淀粉粒的结构参数可以预测其理化性质[4]。PARK等[5]发现B型淀粉颗粒对面包质量产生负面影响,但对面条的性质有积极影响。冻融对A型淀粉颗粒表面无明显损伤,但会引起B型淀粉颗粒表面裂纹的形成。另外,与A型淀粉相比,B型淀粉对冷冻/解冻更为敏感,有利于面团向面包转化。因而可以通过增加A型淀粉粒的含量来改善冷冻面包的品质[6]。莲藕中的C型小淀粉粒能显著提高散射峰强度、溶解度、糊化温度、黏度系数、水解度和消化率;并降低短距有序参数和流变指数[7]。玉米淀粉和预胶化淀粉的共加工混合物,促进了粉末物质崩解成初级药物颗粒并加快药物的溶解速率,在人体消化道内快速分解。此外,淀粉还能保护生物活性物质免受热或氧化降解以及加工过程中的不良环境条件的影响[8]。
因此,对不同晶体类型淀粉粒的特征进行研究有助于加强对淀粉特性的理解。近年来,研究开始倾向于新的淀粉来源,而富含淀粉药食两用植物的使用在功能食品开发中日益增长,为传统淀粉寻找到了优良的替代品。基于这种背景,本研究对6种富含淀粉的药食两用植物进行了研究:薏苡(Coix lacryma-jobi L.var.mayuen (Roman.)Stapf);芡实(Euryale ferox);百合(Lilium brownii var.viridulum);贝母(Fritillaria);山药(Dioscorea oppositifolia L.);葛粉(Pueraria lobata (Willd.) Ohwi var.thomsonii (Benth) Vaniot der Maesen, kudzu),并对其晶体类型、淀粉形态、粒度分布、直链淀粉含量、膨胀力、溶解度和功能特性进行了分析和比较。
1 材料与方法
1.1 材料与试剂
山药采购于贵阳花溪;葛根购于广西藤县;芡实、贝母购于江苏盐城;薏苡仁购于贵州兴仁;百合购于甘肃白银。玉米支链淀粉、马铃薯直链淀粉、猪胰腺α-淀粉酶、淀粉葡萄糖苷酶,Sigma公司;NaCl、乙酸钠缓冲液、乙醇,天津市科密欧化学试剂有限公司。所用试剂均为分析纯。
1.2 仪器与设备
BX53光学显微镜,Olympus公司;Bettersize2600激光粒度分析仪,丹东百特仪器有限公司;Empyrean锐影X射线衍射仪,荷兰帕纳科公司;NicoletiS50傅立叶变换红外光谱分析仪,赛默飞世尔科技有限公司;Q2000差示扫描量热仪,美国TA公司。
1.3 实验方法
1.3.1 淀粉粒提取
薏仁、芡实和贝母用水浸泡过夜,百合、山药和葛根切成小块。榨汁机磨浆,加水搅拌,用4层纱布过滤,然后将滤液分别过100、200、300、400目筛,收集滤液,5 000 r/min离心10 min,获得沉淀。沉淀经ddH20悬浮,再离心。刮除表面杂质,反复几次,直到上清液澄清为止。沉淀在40 ℃下干燥2 d,研磨,过100目筛,-20 ℃密封保存备用。
1.3.2 X射线衍射(X-ray diffraction,XRD)分析
参考MAN等[9]方法,稍作修改,测试前淀粉置于盛有饱和NaCl水溶液的密闭容器中吸水1周。测试条件:电压45 kV,电流40 mA,衍射角(2θ)5°~40°,扫描速度1.2°/min,步长0.02°。
1.3.3 淀粉颗粒的形态观察
用体积分数50%甘油水溶液制备淀粉悬浮液,用配备有电荷耦合器件(charge coupled device,CCD)照相机的Olympus BX53光学显微镜观察淀粉粒的形貌特征。
1.3.4 粒度分布测定
淀粉颗粒粒度分布采用Bettersiz2600激光粒度分布仪进行测定,通过自动循环分散系统将样品输送到激光粒度仪的测定区域,分散剂采用蒸馏水,根据Mie散射原理对散射光产生的电信号进行处理,得到所测样品的粒度分布结果。
1.3.5 碘蓝值和直链淀粉含量的测量
参考MAN等[9]方法,稍作修改,称取10 mg淀粉置于10 mL带盖离心管中,加入5 mL二甲基亚砜溶液,混匀,95 ℃水浴0.5 h,期间不时涡旋以得到澄清溶液。冷却至室温,取1 mL淀粉溶液转移至50 mL容量瓶中,加入1 mL碘液(2 g/L I2,20 g/L KI),定容并摇匀,暗处静置20 min。使用7600SE型紫外分光光度计测定扫描吸收光谱(400~900 nm)并测定680 nm下的碘蓝值,测定620 nm处的吸光度值,并依据标准曲线计算直链淀粉含量,使用玉米支链淀粉、马铃薯直链淀粉制作标准曲线。
1.3.6 溶胀力(swelling power,SP)和溶解度(solubility,SOL)测定
参考KONIK-ROSE等[10]方法,稍作修改,将淀粉样品(30 mg)和蒸馏水(1.5 mL)混合,然后在95 ℃的水浴中保持30 min,间歇搅拌,冷却至室温。8 000×g离心10 min,将上清液在105 ℃下干燥至恒重,然后称重沉淀物。淀粉溶胀力计算为溶胀淀粉质量与淀粉初始干重之比。以干燥恒重的上清液与淀粉的质量比来计算溶解度。
1.3.7 衰减全反射傅里叶红外光谱(attenuated total reflection-Fourier infrared spectroscopy,ATR-FTIR)测定
参考MAN等[9]方法,稍作修改,取少量干燥淀粉悬浮于超纯水中调制成乳状,吸取少量到傅里叶变换远红外光谱仪的ATR样品台上,以超纯水为参照从波数800~4 000 cm-1进行扫描,得到淀粉的解卷积光谱。统计1 045、1 022、995 cm-1峰的强度,同时计算1 045/1 022、1 022/995的比值。
1.3.8 差示扫描量热(differential scanning calorimetry,DSC)分析
参考MAN等[9]方法,稍作修改,将3 mg淀粉与9 μL超纯水混合,并在铝锅中于4 ℃密封过夜。在室温下平衡1 h后,将样品在25~130 ℃的加热温度下以10 ℃/min的速度用空白板(空锅)扫描。主要测定参数为起始温度(To),峰值温度(Tp),最终温度(Tc)和糊化焓(ΔH)。
1.3.9 体外消化率测定
参考ENGLYST等[11]的方法,稍作修改。称取猪胰腺α-淀粉酶(0.45 g)至4 mL水中,通过水浴振荡(35 ℃,200 次/min)溶解20 min,然后以9 000 r/min离心10 min。将上清液(2.7 mL)转移至烧杯中,并将淀粉葡萄糖苷酶(4 mL)加入上述酶溶液中,该酶溶液为每次消化新鲜制备。将淀粉(100 mg)和4 mL 0.5 mol/L乙酸钠缓冲液(pH 5.2)添加到每个试管中。将酶溶液(1 mL)和玻璃珠加入到每个管中,将其在水浴振荡(37 ℃,200 次/min)中孵育。以20、120 min的间隔取等分试样(0.1 mL),并与1 mL的80%乙醇混合使酶失活,并使用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)方法测量上清液中葡萄糖含量。计算方法如公式(1)~(3)所示:
RDS/%=G20
(1)
SDS/%=G120-G20
(2)
RS/%=100%-RDS-SDS
(3)
式中:RDS,快消化淀粉;SDS,缓慢消化淀粉;RS,抗性淀粉;G20,前20 min消化的淀粉含量;G120,20~120 min内消化的淀粉含量。
1.4 数据分析
每组实验重复3次。数据以平均值±标准差的形式表示,采用Origin 19.0软件作图,采用SPSS 26进行数据统计分析。
2 结果与分析
2.1 晶体结构分析
XRD图谱可用于揭示淀粉颗粒的晶体结构特征。衍射特征峰的位置和强度可用于确定淀粉样品的晶体类型。在2θ值分别为15°、17°、18°、23°处具有明显衍射峰的样品属于A型晶体结构,而在5.6°、17°、22°、24°处具有明显衍射峰的样品属于B型晶体结构。C型晶体的结构结合了A和B晶体的特性,典型的C型结晶淀粉在17°和23°处显示强衍射峰,在5.6°和15°附近显示一些小峰[1-3]。如图1所示,淀粉粒的晶体特征表现出一定差异,其中薏仁、芡实淀粉在15°、17°、18°、23°处具有明显的衍射峰,属于A型晶体结构[1-3]。百合、贝母淀粉在5.6°、17°、22°、24°处具有明显的衍射峰,属于B型晶体结构[1-3]。山药和葛根淀粉在5.6°、15°、17°、22°处有明显的衍射峰,具有A型和B型淀粉的组合特征,因此属于C型晶体结构[1-3]。淀粉XRD波谱20°附近的峰为直链淀粉与脂的无定形峰[1],该峰在几种淀粉中都存在,但峰强度变化不大,说明直链淀粉与脂在不同晶体类型的淀粉中含量不同。从几种淀粉的XRD图谱可以看出B型淀粉在20°附近的峰强度变化最明显,说明有较高的直链-脂类复合物。
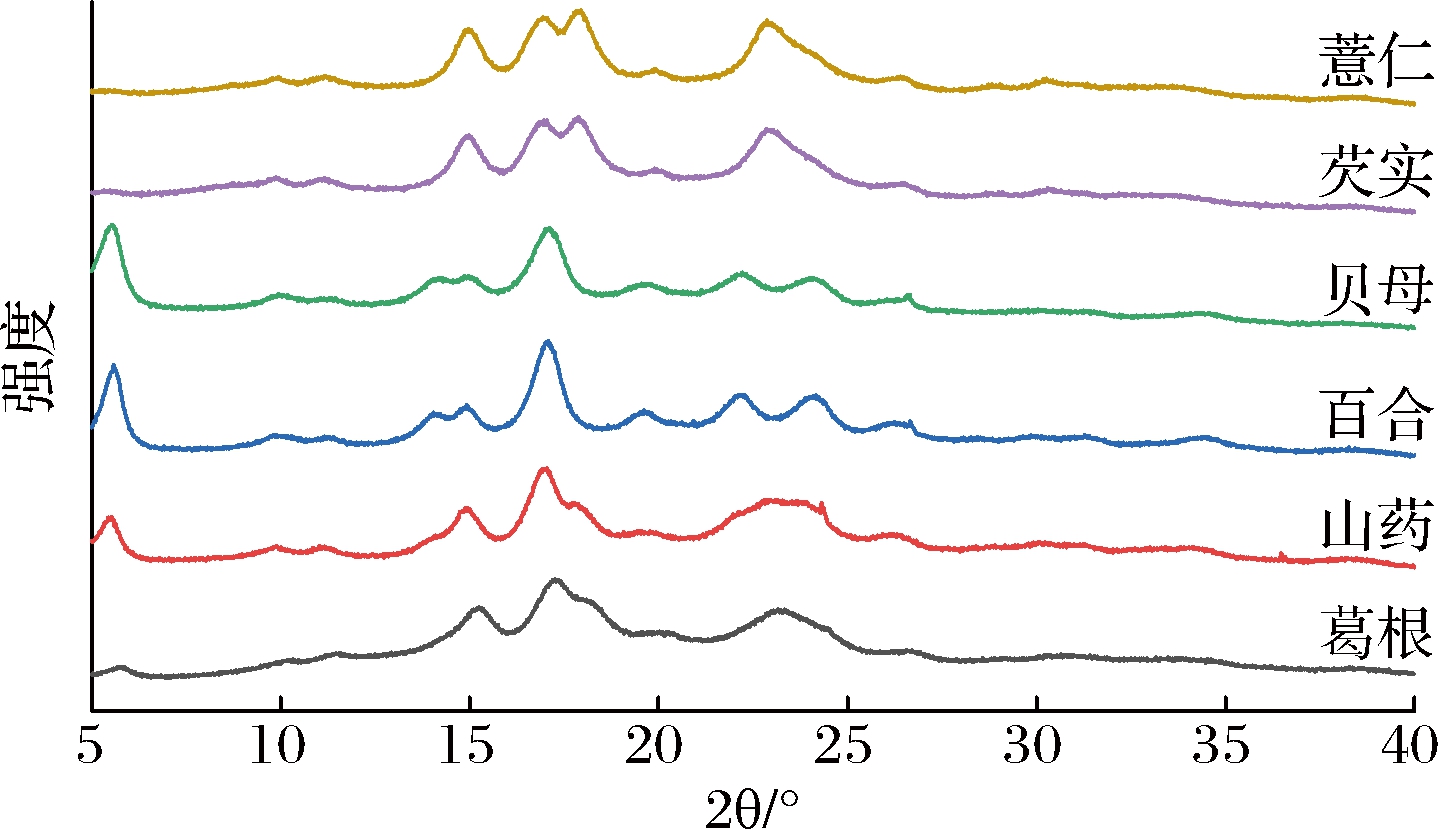
图1 淀粉粒的XRD图谱
Fig.1 XRD patterns of starch granules
2.2 淀粉颗粒的形态特征
如图2所示,不同晶体类型药食两用植物淀粉为近球形,椭球形和多角形。其中薏仁淀粉粒为典型的椭球形和多角形;芡实淀粉颗粒多呈椭球形或近球形;百合淀粉粒多具有不规则的多角形,某些颗粒为近球形;贝母淀粉颗粒多呈椭球形;山药淀粉粒除两端长且大小不同的扁平颗粒外,几乎都是椭球形或多角形;葛根淀粉粒多为不规则多角形。A型淀粉(芡实,薏仁)以小颗粒存在,B型淀粉(贝母,百合)几乎以大颗粒为主,C型淀粉中山药基本以中等颗粒存在,葛根淀粉粒则以小颗粒为主。淀粉颗粒的大小和形态显著影响淀粉的理化特性[12]。在本研究中,薏仁淀粉粒碘染色后表现出不同的特征,这可能受到多种因素的影响。一种因素是本实验所用薏仁直接从农户手中购买,薏苡在不断栽培过程中发生遗传性状变异,导致其同一或不同籽粒中组分特性发生不同的变化。另一因素可能受到了籽粒粒位分布的影响,对同一薏苡植株而言,在灌浆过程中,其颖花分化存在先后顺序,其籽粒的灌浆发育过程也不同步,不同部位的籽粒在夺取灌浆物质的能力方面也会具有一定差异[13]。先前研究也有报道,淀粉粒特性在作物生长过程中受灌浆进程、遗传因素、生态因子、栽培措施的影响[14]。薏仁淀粉粒的这种特异性可能受这些因素的影响,但还须进一步研究属于类似种属或不同种类的淀粉颗粒的形态差异。

A~F为未染色薏仁、芡实、贝母、百合、山药、葛根淀粉粒;a~f为其对应碘染色淀粉粒
图2 淀粉粒形态特征图
Fig.2 Morphological characteristics of starch granules
2.3 淀粉的粒度分布
淀粉粒度对食品加工过程非常重要,其差异会显著影响淀粉的理化性质,例如糊化、热性质、酶敏感性、结晶度和溶解度,这些理化性质的差异会使食品在加工过程中导致不同的结果[15]。淀粉粒度分布的研究揭示了淀粉质量差异的内在原因。淀粉的大小通常用颗粒长轴长度表示。尺寸<10 μm,10~30 μm以及>30 μm的颗粒分别称为小、中、大颗粒。不同晶体类型淀粉颗粒的粒度分布明显不同(表1),本研究中,不同晶体类型的淀粉粒数量平均直径D(1,0)在0.77~1.17 μm。A型(薏仁、芡实),B型(贝母、百合),C型(山药、葛根)淀粉颗粒大小与显微观察的结果一致。此结果可用于识别淀粉的来源和类型,并阐明淀粉质量差异的内在原因。
表1 淀粉粒粒度分布
Table 1 Particle size distribution of starch granules

样品D(1,0)/μm体积百分比/%小颗粒(<10 μm)中等颗粒(10~30 μm)大颗粒(>30 μm)薏仁0.85±0.008d15.0283.31.68芡实0.77±0.004e12.1266.2921.59贝母1.17±0.001a3.1231.3765.51百合1.14±0.005b3.7748.6247.61山药1.16±0.003a6.9589.783.27葛根0.92±0.001c70.0529.950
注:同列不同字母表示差异显著(P<0.05)(下同)
2.4 直链淀粉含量
表2显示了淀粉直链淀粉含量(amylose content,AC),最大吸收波长(λmax),相对结晶度(relative crystallinity,RC),碘蓝值(blue value,BV)。淀粉的AC、λmax和BV之间具有显著的正相关关系。λmax和BV,λmax和AC,BV和AC之间的相关系数分别为0.442、0.492和0.805。几种不同晶体类型淀粉的λmax差异显著,碘蓝值显示B型>C型>A型。直链淀粉含量是淀粉各特性的重要指标,显著影响淀粉的结构和功能特性,例如溶胀力、溶解度、黏度、糊化和回生[16]。而植物的成熟度、气候条件、土壤成分和植物来源显著影响淀粉的直链淀粉含量。不同晶体类型淀粉直链淀粉含量总体趋势为B型>C型>A型,这与碘蓝值结果一致。结果表明,不同晶体类型淀粉直链淀粉含量的多少与相对结晶度的大小呈现较好的反向关系,说明淀粉直链淀粉含量与相对结晶度有一定的关联性。
表2 AC,λmax, RC,BV, SP和SOL
Table 2 AC, λmax,RC, BV, SP and SOL of starch granules
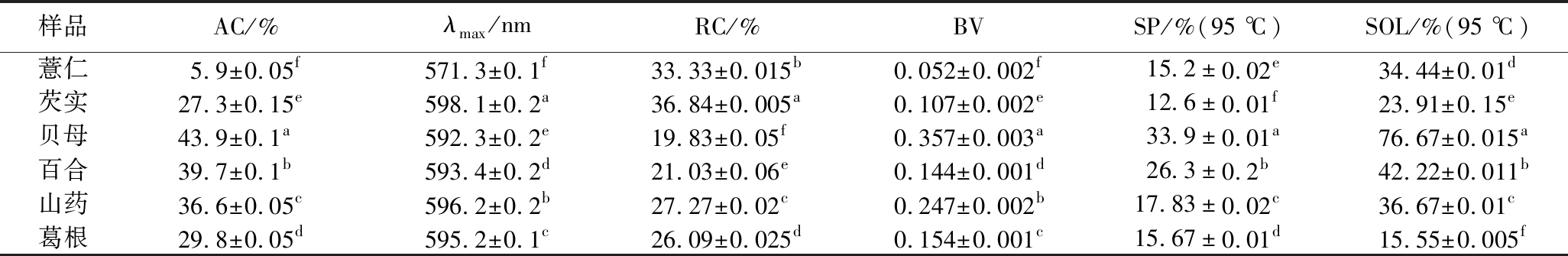
样品AC/%λmax/nmRC/%BVSP/%(95 ℃)SOL/%(95 ℃)薏仁5.9±0.05f571.3±0.1f33.33±0.015b0.052±0.002f15.2±0.02e34.44±0.01d芡实27.3±0.15e598.1±0.2a36.84±0.005a0.107±0.002e12.6±0.01f23.91±0.15e贝母43.9±0.1a592.3±0.2e19.83±0.05f0.357±0.003a33.9±0.01a76.67±0.015a百合39.7±0.1b593.4±0.2d21.03±0.06e0.144±0.001d26.3±0.2b42.22±0.011b山药36.6±0.05c596.2±0.2b27.27±0.02c0.247±0.002b17.83±0.02c36.67±0.01c葛根29.8±0.05d595.2±0.1c26.09±0.025d0.154±0.001c15.67±0.01d15.55±0.005f
2.5 溶胀力和溶解度
溶胀力表明淀粉颗粒的吸水程度,溶解度则反映淀粉溶胀过程中的溶解程度[17]。在分离的淀粉中,淀粉粒的溶胀力和溶解度存在显著差异(表2)。分离淀粉的溶胀力表现为B型>C型>A型。几种淀粉粒的溶胀力和溶解度均随温度的升高而增加。溶胀力测试用于测量淀粉糊化过程中水的吸收,研究表明,支链淀粉有助于水的吸收和溶胀,以及淀粉粒的糊化,而直链淀粉则倾向于延迟这些过程[18]。线性直链淀粉从溶胀的颗粒扩散并在颗粒外部形成连续相以抑制膨胀。另外有研究发现直链淀粉含量与溶胀力之间存在反比关系[19]。但在本研究中直链淀粉含量高的淀粉却呈现较高的溶胀力,与先前研究结果相反,结果之间的差异可能受植物的来源、气候条件、植物成熟度和土壤成分的影响。
通常,淀粉粒的溶解度与可溶性颗粒的存在有关,表示淀粉固体在水溶液中溶解或分散的能力[18]。温度是影响溶解度特性的最大因素,而且淀粉的溶解度随着温度的升高而增加,随着温度的降低而降低[20]。几种淀粉的溶解度指数呈现B型>C型>A型。研究报道,淀粉粒度分布以及直链淀粉含量的差异会显著影响淀粉的理化性质[15]。本研究结果也表明,溶胀力和粒度大小呈正相关关系、和直链淀粉含量呈一定的正相关关系;溶解度和粒度大小、直链淀粉含量呈正相关关系。淀粉粒这几个指标结果均呈现B型>C型>A型。在分离的淀粉中,由于直链淀粉含量和淀粉颗粒结构的差异,不同晶体类型淀粉粒的溶胀力和溶解度指数存在一定的差异。
2.6 ATR-FTIR
ATR-FTIR用于研究淀粉构象变化时淀粉颗粒外部有序结构以及在1 045、1 022、995 cm-1处的吸收强度,而1 045/1 022认为是量化淀粉外部结构有序度的量度,1 022/995的比例用作无定形与有序碳水化合物结构比例的指标[21]。图3-a显示了不同晶体类型淀粉在1 200~900 cm-1区域中去卷积的ATR-FTIR光谱。结果表明,不同晶体类型的淀粉表现出相似的ATR-FTIR光谱,这与XRD结果相符。
不同晶体类型淀粉的1 045/1 022、1 022/995峰强度比值有显著的差异(图3-b)。尽管FTIR无法区分淀粉晶体类型。但具有相同晶体类型的淀粉始终显示相似的FTIR光谱,与B型和C型淀粉相比,A型淀粉在1 022 cm-1处的谱带更为显著[21]。在ATR-FTIR波谱中,A型、B型、C型淀粉的去卷积波谱明显不同,B型淀粉1 045/1 022峰强度比值明显比A型和C型高,1 022/995峰强度比值明显比A型和C型低,而B型淀粉的1 045/1 022、1 022/995峰强度比值相似。1 045/1 022峰强度比值反映淀粉分子的有序程度,其比值越大,有序度越高[21]。在几种不同晶体类型的淀粉中,B型淀粉在1 045/1 022的比值最高,表明B型淀粉表层有序程度较高。
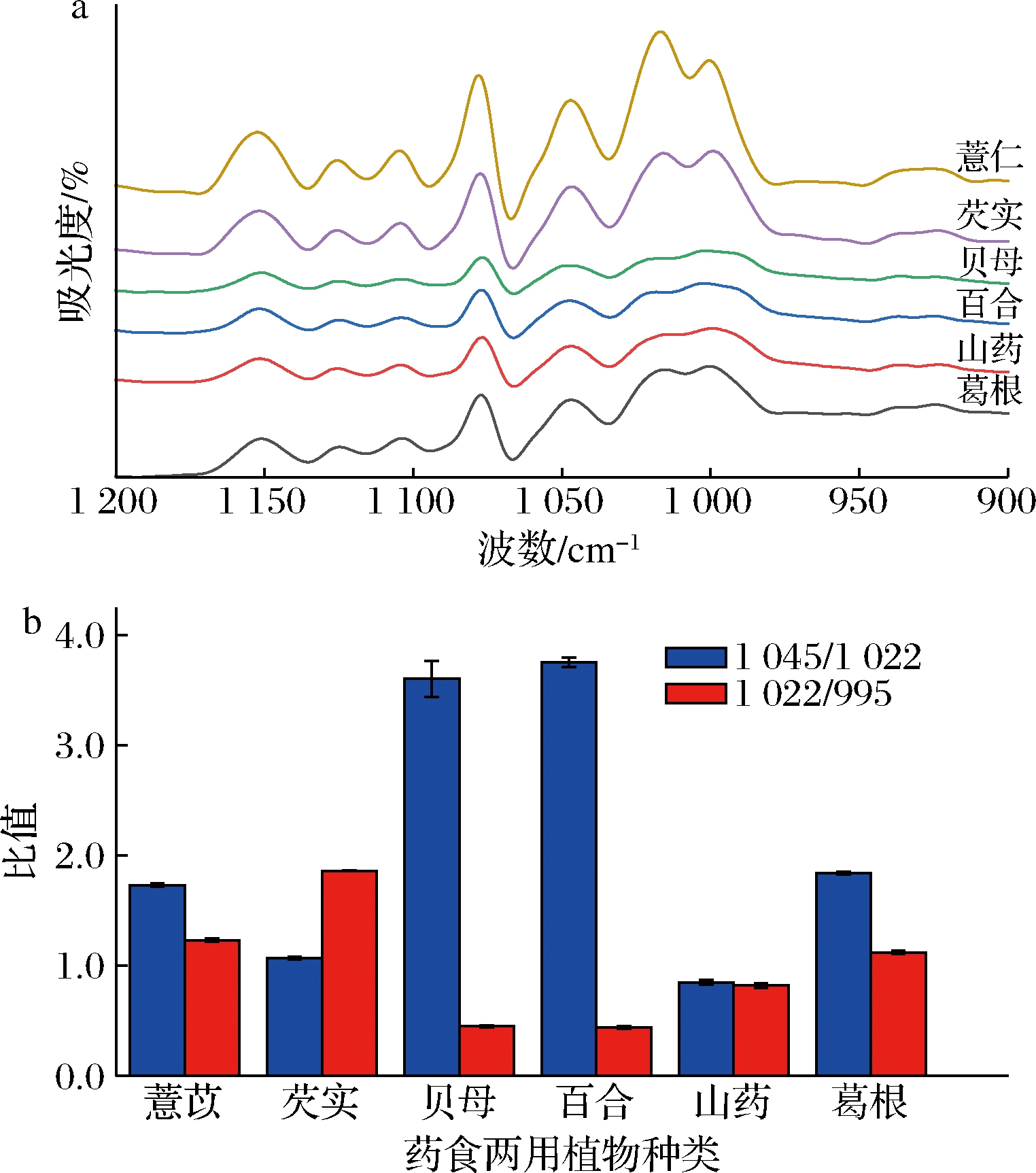
a-ATR-FTIR光谱;b-吸光度IR比
图3 淀粉粒解卷积的ATR-FTIR光谱和吸光度IR比
Fig.3 ATR-FTIR spectra of starch granule deconvolution and absorbance IR ratio
2.7 淀粉的热特性
通过DSC分析了淀粉的热性质(表3),几种淀粉的To,Tp和Tc分别为57.29~73.75,62.17~80.73、73.65~92.38 ℃。转变温度的差异可归因于粒度、淀粉颗粒的形态特征、结晶度、支链淀粉链长的分布、直链淀粉与支链淀粉的比例、淀粉的分子质量以及分子间的相互作用[22]。ΔT在16.36~25.24 ℃内变化,此范围与颗粒大小的均匀性和淀粉分子中结晶度相关。淀粉的ΔH与淀粉颗粒的结晶度关系密切,一般来说结晶度越高,糊化所需要的能量越大,发生相变所需的热焓值也越大[23]。不同晶型淀粉的ΔH在2.92~4.03 J/g,总体趋势为B型>C型>A型,结果与淀粉结晶度大小呈负相关关系(表2)。另有研究表明,B型比A型淀粉具有更高的To、TP、Tc值和更低的焓[24]。本研究结果表明,与A型和C型颗粒相比,B型淀粉粒显示出更低的T0、Tp、Tc值和更高的焓。淀粉的热性质通常与各种因素有关,在本研究中,几种淀粉的颗粒形态、晶体类型、直链淀粉含量、粒度分布的不同,可能导致不同的热力学性质。
表3 淀粉粒糊化参数
Table 3 Pasting parameters of starch granules
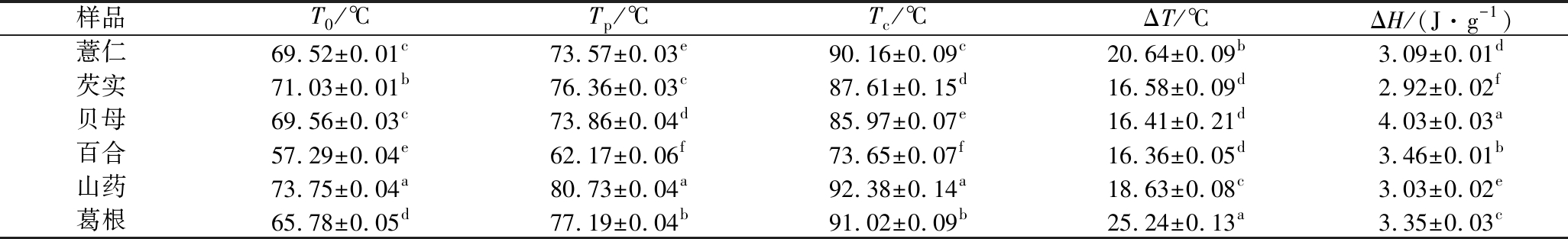
样品T0/℃Tp/℃Tc/℃ΔT/℃ΔH/(J·g-1)薏仁69.52±0.01c73.57±0.03e90.16±0.09c20.64±0.09b3.09±0.01d芡实71.03±0.01b76.36±0.03c87.61±0.15d16.58±0.09d2.92±0.02f贝母69.56±0.03c73.86±0.04d85.97±0.07e16.41±0.21d4.03±0.03a百合57.29±0.04e62.17±0.06f73.65±0.07f16.36±0.05d3.46±0.01b山药73.75±0.04a80.73±0.04a92.38±0.14a18.63±0.08c3.03±0.02e葛根65.78±0.05d77.19±0.04b91.02±0.09b25.24±0.13a3.35±0.03c
2.8 体外消化率
研究发现,B型淀粉粒的核结构稳定,而A型淀粉粒的核结构疏松。A型淀粉颗粒表面存在着许多小孔,颗粒内部存在着大量的通道,因此,酶可以沿着小孔进入颗粒中心水解淀粉,而B型淀粉颗粒没有这些特征,酶只能作用于淀粉的表面,因此,A型淀粉比B型淀粉更易水解[25]。另一研究也发现A型淀粉粒总表面积大于其表面积,而B淀粉粒的总表面积接近于表面积,也说明A型淀粉粒表面具有小孔结构[26]。另有研究发现,B、C型淀粉比A型淀粉对酶水解的抵抗力更强[27],以上结果与本研究结果相一致。如表4所示,葛根淀粉具有最高的RDS,可能与其淀粉颗粒大小和晶体类型有关。粒度分析表明葛根淀粉基本为小颗粒且晶体类型为CA型(以A型晶体为主),葛根淀粉在同一时间的水解程度比其他几种淀粉更加剧烈和快速,所以葛根淀粉RDS最高。SDS总体呈现为A型>B型淀粉,由于C型淀粉中山药淀粉为CB型(以B型晶体为主),葛根为CA型,所以葛根和山药淀粉的SDS含量分别与A型和B型淀粉接近。RS总体表现为B型>A型淀粉,葛根和山药淀粉因其晶体类型的不同,其RS含量也分别接近A型和B型淀粉。不同物种之间天然淀粉消化率的差异可能归因于许多因素的相互作用,例如不同的淀粉来源、颗粒大小。
表4 淀粉粒的RDS, SDS, RS
Table 4 RDS, SDS, RS of starch granules
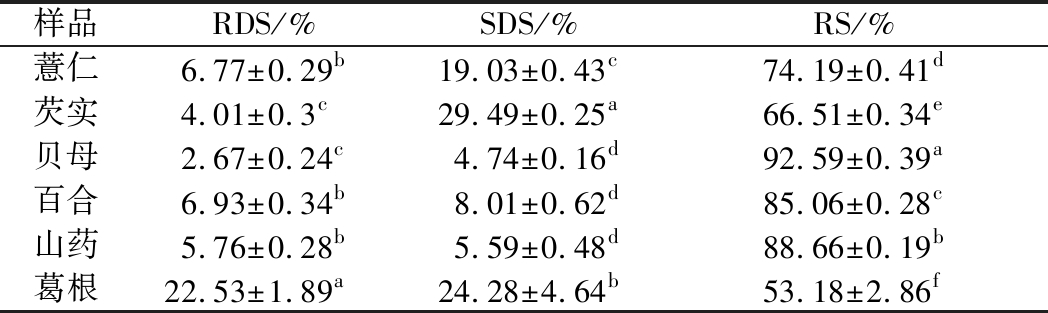
样品RDS/%SDS/%RS/%薏仁6.77±0.29b19.03±0.43c74.19±0.41d芡实4.01±0.3c29.49±0.25a66.51±0.34e贝母2.67±0.24c4.74±0.16d92.59±0.39a百合6.93±0.34b8.01±0.62d85.06±0.28c山药5.76±0.28b5.59±0.48d88.66±0.19b葛根22.53±1.89a24.28±4.64b53.18±2.86f
3 结论
淀粉的晶体结构会显著影响淀粉的功能性质。几种淀粉具有特定的晶体类型、颗粒形态、直链淀粉含量、粒径、膨胀力、溶解度、理化性质、功能性质和体外消化率,并且在各方面均存在显著差异。淀粉颗粒均表现出独有的球形、椭球形和多角形;淀粉在直链淀粉含量、碘蓝值、膨胀力、溶解度、热焓值均呈现B型>C型>A型淀粉的趋势;结晶度表现为A型>C型>B型淀粉;体外消化分析表明,C型晶体因其A型和B型晶体含量不同,其理化性质差异显著。本研究为不同晶体类型药食两用植物淀粉的使用提供科学基础,为传统淀粉提供替代品,并促进其在食品和非食品领域的应用。
[1] CHEETHAM N W H, TAO L P.Variation in crystalline type with amylose content in maize starch granules:An X-ray powder diffraction study[J].Carbohydrate Polymers, 1998, 36(4):277-284.
[2] YU J L, WANG S J, JIN F M, et al.The structure of C-type Rhizoma Dioscorea starch granule revealed by acid hydrolysis method[J].Food Chemistry, 2009, 113(2):585-591.
[3] WEI C X, XU B, QIN F L, et al.C-type starch from high-amylose rice resistant starch granules modified by antisense RNA inhibition of starch branching enzyme[J].Journal of Agricultural and Food Chemistry, 2010, 58(12):7 383-7 388.
[4] LAN X H, LI Y F, XIE S C, et al.Ultrastructure of underutilized tuber starches and its relation to physicochemical properties[J].Food Chemistry, 2015, 188:632-640.
[5] PARK S H, WILSON J D, SEABOURN B W.Starch granule size distribution of hard red winter and hard red spring wheat:Its effects on mixing and breadmaking quality[J].Journal of Cereal Science, 2009, 49(1):98-105.
[6] TAO H, WANG P, WU F F, et al.Particle size distribution of wheat starch granules in relation to baking properties of frozen dough[J].Carbohydrate Polymers, 2016, 137:147-153.
[7] LIN L S, HUANG J, ZHAO L X, et al.Effect of granule size on the properties of lotus rhizome C-type starch[J].Carbohydrate Polymers, 2015, 134:448-457.
[8] XU K, LIANG X C, LI P C, et al.Tough, stretchable chemically cross-linked hydrogel using core-shell polymer microspheres as cross-linking junctions[J].Polymer, 2017, 118:58-67.
[9] MAN J M, LIN L S, WANG Z F, et al.Different structures of heterogeneous starch granules from high-amylose rice[J].Journal of Agricultural and Food Chemistry, 2014, 62(46):11 254-11 263.
[10] KONIK-ROSE C M, MOSS R, RAHMAN S, et al.Evaluation of the 40 Mg swelling test for measuring starch functionality[J].Starch - Stärke, 2001, 53(1):14-20.
[11] ENGLYST H N, KINGMAN S M, CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(Suppl 2):S33-S50.
[12] REDDY C K, LUAN F, XU B J.Morphology, crystallinity, pasting, thermal and quality characteristics of starches from adzuki bean (Vigna angularis L.) and edible kudzu (Pueraria thomsonii Benth)[J].International Journal of Biological Macromolecules, 2017, 105:354-362.
[13] 吴慧, 胡大鹏, 田巧凤, 等.薏苡植株不同粒位籽粒品质性状的差异[J].江苏农业学报, 2017, 33(4):809-814.
WU H, HU D P, TIAN Q F, et al.Comparison of grain quality traits at different parts of Coix lacnyma-jobi plants[J].Jiangsu Journal of Agricultural Sciences, 2017, 33(4):809-814.
[14] 王磊磊. 小麦强弱势粒发育及其淀粉理化性质的研究[D].扬州:扬州大学, 2018.
WANG L L.Study on development of wheat superior and inferior grain and its physicochemical properties of starch[D].Yangzhou:Yangzhou University, 2018.
[15] ZENG J, GAO H Y, LI G L.Functional properties of wheat starch with different particle size distribution[J].Journal of the Science of Food and Agriculture, 2014, 94(1):57-62.
[16] GAO H M, CAI J W, HAN W L, et al.Comparison of starches isolated from three different Trapa species[J].Food Hydrocolloids, 2014, 37:174-181.
[17] CARCEA D M, ACQUISTUCCI D R.Isolation and physicochemical characterization of fonio (Digitaria exilis Stapf) starch[J].Starch - Stärke, 1997, 49(4):131-135.
[18] TESTER R, MORRISON W R.Swelling and gelatinization of cereal starches.I.effects of amylopectin, amylose, and lipids[J].Cereal Chemistry Journal, 1990, 67:551-557.
[19] HERMANSSON A M, SVEGMARK K.Developments in the understanding of starch functionality[J].Trends in Food Science & Technology, 1996, 7(11):345-353.
[20] KAUR A, SINGH N, EZEKIEL R, et al.Physicochemical, thermal and pasting properties of starches separated from different potato cultivars grown at different locations[J].Food Chemistry, 2007, 101(2):643-651.
[21] SEVENOU O, HILL S E, FARHAT I A, et al.Organisation of the external region of the starch granule as determined by infrared spectroscopy[J].International Journal of Biological Macromolecules, 2002, 31(1-3):79-85.
[22] GOUGH B M, PYBUS J N.Effect on the gelatinization temperature of wheat starch granules of prolonged treatment with water at 50 ℃[J].Starch - Stärke, 1971, 23(6):210-212.
[23] VAN HUNG P, MORITA N.Chemical compositions, fine structure and physicochemical properties of kudzu (Pueraria lobata) starches from different regions[J].Food Chemistry, 2007, 105(2):749-755.
[24] NARVAEZ-GONZALEZ E D, C RDENAS J.D.D.F, TABA S, et al.Effect of starch granule size on the thermal and pasting properties of maize[J].Revista Fitotecnia Mexicana, 2007, 30(3):269-277.
RDENAS J.D.D.F, TABA S, et al.Effect of starch granule size on the thermal and pasting properties of maize[J].Revista Fitotecnia Mexicana, 2007, 30(3):269-277.
[25] ZHANG G Y, AO Z H, HAMAKER B R.Slow digestion property of native cereal starches[J].Biomacromolecules, 2006, 7(11):3 252-3 258.
[26] JANE J L.Current understanding on starch granule structures[J].Journal of Applied Glycoscience, 2006, 53(3):205-213.
[27] SRICHUWONG S, ISONO N, MISHIMA T, et al.Structure of lintnerized starch is related to X-ray diffraction pattern and susceptibility to acid and enzyme hydrolysis of starch granules[J].International Journal of Biological Macromolecules, 2005, 37(3):115-121.