小青菜(Brassica campestris L.ssp.chinensis)是我国常见的叶菜类十字花科蔬菜,在我国的种植范围广,复种指数高。小菜蛾[Plutella xylostella(L.)]是小青菜种植生长过程中危害较为严重的一类害虫,严重影响了蔬菜的产量和品质。以丁虫腈为代表的苯基吡唑类杀虫剂是防治小菜蛾重要的农药品种之一,具有活性高、持效期长等特点。丁虫腈(丁烯氟虫腈)由我国自主创制[1],主要作用于昆虫中的γ-氨基丁酸依赖性神经传递系统[2]。相比其同类型杀虫剂氟虫腈而言,丁虫腈对蔬菜等作物的上鳞翅目、鞘翅目等害虫表现出同等甚至更高的活性,且大幅降低非靶标生物毒性,因此被作为氟虫腈的替代产品在我国各大蔬菜产区进行使用[3-5]。农药在施用过程中,会通过漂移、沉降、淋溶等多种途径进入到土壤中,进而造成土壤中农药残留的持续积累。研究数据表明丁虫腈在土壤中较为稳定,丁虫腈在江西红壤、太湖水稻土及陕西潮土3种不同类型土壤中,室温25 ℃条件下培养180 d后均未发生明显降解,半衰期均大于364.8 d[6]。进入土壤中的农药可通过直接或间接途径被蔬菜吸收并在植株内富集、转化,造成蔬菜中农药残留污染,最终影响蔬菜产品质量[7]。鉴于此,本研究以小青菜为研究对象,建立土壤-小青菜系统中丁虫腈及多种代谢物的高效快速残留检测方法,对于进一步开展蔬菜对土壤中农药的吸收、转运和代谢研究,以及蔬菜食品全程质量控制,保障蔬菜食品安全具有重要意义。
目前,关于蔬菜和土壤中丁虫腈残留方法的研究主要集中在丁虫腈母体本身。赵玉华等[8]利用QuEChERS结合气相色谱串联质谱(GC-MS/MS)建立了番茄,黄瓜和芹菜中丁虫腈的分析方法;罗智强等[9]利用气相色谱-电子捕获检测器(gas chromatography-electron capture detector,GC-ECD)建立了土壤中丁虫腈的农药残留检测方法;丁立平等[10]采用改进的QuEChERS-气质联用法(GC-MS/MS)建立了蔬菜中丁虫腈和氟虫腈的测定方法。然而,丁虫腈在进入作物及环境中后,会通过多种途径降解生成多种代谢产物,其中丁虫腈砜、丁虫腈硫醚、丁虫腈酰胺及氟虫腈等是丁虫腈的几种代表性代谢产物[11](图1),且这几种代谢物对于某些非靶标生物具有比母体更高的生物毒性。例如,代谢物丁虫腈砜(EC50=9.2 mg/L)和氟虫腈(EC50=3.5 mg/L)对蛋白核小球藻的48 h急性毒性分别为母体丁虫腈的(EC50=17.9 mg/L)的1.9倍和5.1倍;氟虫腈(LC50=0.11 mg/L)和丁虫腈砜(LC50=0.01 mg/L)对于大型蚤的48 h急性毒性分别为母体丁虫腈(LC50=0.60 mg/L)的5.5倍和60倍[11]。
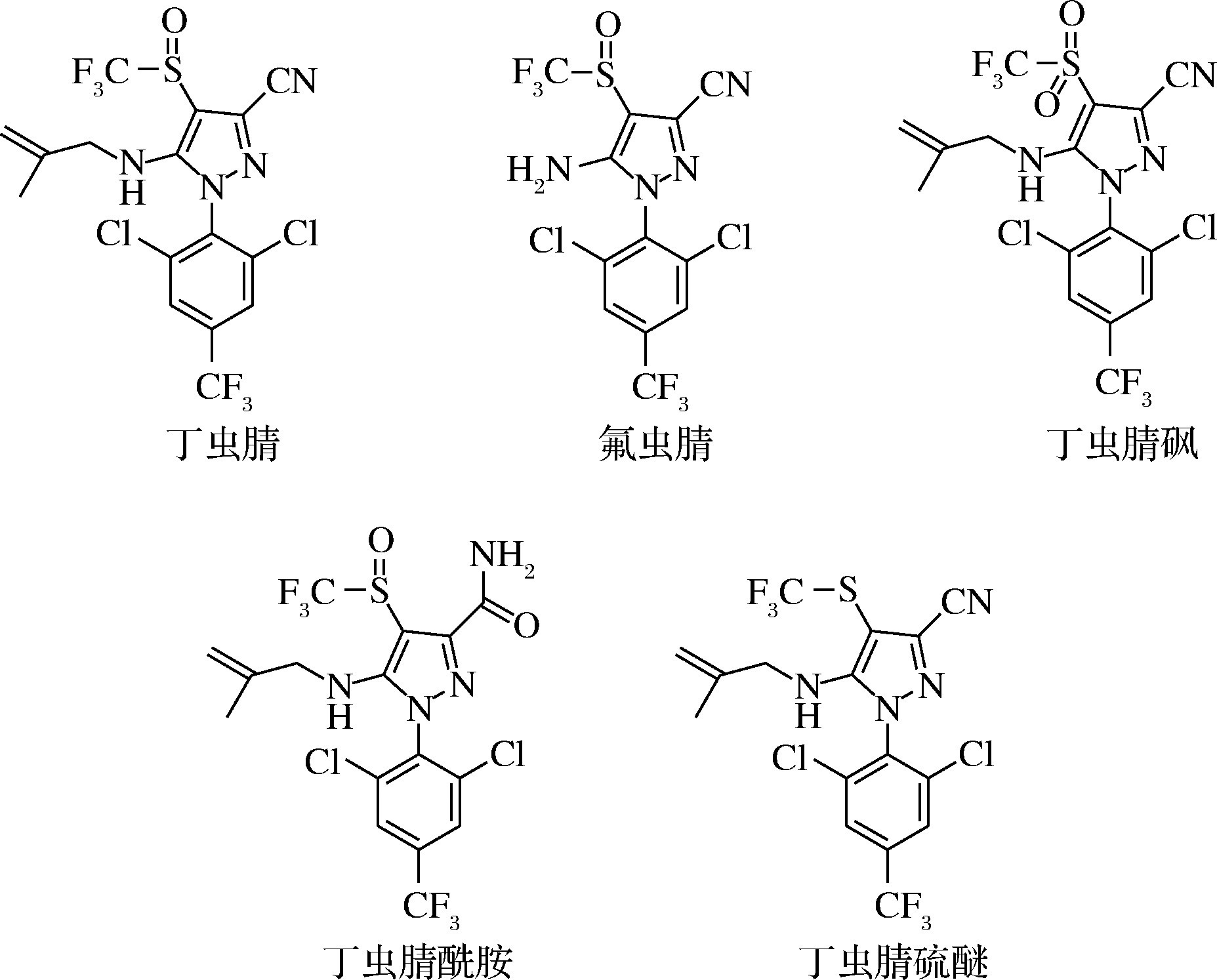
图1 丁虫腈及其代谢物的结构式
Fig.1 Structural formula of flufiprole and its metabolites
目前关于同时检测植物源样品和环境介质中丁虫腈及其代谢物的方法报道较少。何建等[12]利用固相萃取结合GC-ECD检测器建立了丁虫腈及氟虫腈代谢物在水稻植株、稻田水及稻田土壤样品中的检测方法。然而该方法的目标检测物仅包含了氟虫腈的几种典型代谢物MB46513,MB45950和MB46136等,而对于丁虫腈在作物及环境中的几种重要降解代谢产物如丁虫腈砜,丁虫腈硫醚和丁虫腈酰胺等均未涉及;且上述方法前处理过程较为繁琐,检测耗时较长(接近20 min)。此外,蔬菜样品基质较为复杂,含有多种干扰分析的成分(例如色素、甾醇等),采用GC-ECD检测,方法的选择性和灵敏度难以满足检测要求。相比之下,QuEChERS前处理技术结合UPLC-MS/MS用于植物源和环境样品中目标物的检测可以有效提高方法前处理效率、灵敏度和特异性[13-15]。
因此,本文通过利用QuEChERS结合UPLC-MS/MS建立了同时测定小青菜和土壤中的丁虫腈及其多种代谢产物残留量方法,并成功应用于实际样品的检测,旨在为下一步开展土壤-小青菜系统中丁虫腈的迁移、转化、降解研究及残留监测提供方法参考。
1 材料与方法
1.1 材料、试剂与仪器
Shimadzu LC-30AD液相色谱仪,日本岛津公司;AB SCIEX QTRAP 6500串联质谱仪,美国 AB SCIEX 公司;Sigma 3-15K台式冷冻离心机,德国Sigma公司;CK2000高通量组织研磨仪,北京托摩根公司。
Acquity UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm),简称T3柱,美国Waters公司;Titank F5柱色谱柱(100 mm×2.1 mm,1.8 μm),简称F5柱;ACE Excel 2 C18 色谱柱(100 mm×2.1 mm,2 μm),简称C18柱,广州菲罗门公司。
丁虫腈、丁虫腈砜、丁虫腈硫醚、氟虫腈、丁虫腈酰胺(纯度>99%),上海丁百生物科技有限公司;甲醇、乙腈(色谱纯),德国Sigma-Aldrich公司;甲酸(质谱纯),上海安谱科学仪器有限公司;乙二胺-N-丙基硅烷(primary secondary amine,PSA)、石墨化炭黑(graphitized carbon black,GCB),上海安谱科学仪器有限公司;3种不同外径规格(<8,10~20和20~30 nm)的多壁碳纳米管(multi-walled carbon nanotube,MWCNTs),中科院成都有机化学公司;超纯水由Mill-Q试剂水设备(美国Millipore公司)制备;有机相滤膜(0.22 μm),上海安谱科学仪器有限公司。
供试土壤及小青菜样品均采自西南大学农药残留检测与安全评价试验基地,土壤经风干、磨碎、过2 mm孔径筛后备用,其基本理化性质为:pH值6.73,有机质11.35 g/kg。供试小青菜品种为苏州青。
1.2 实验方法
1.2.1 仪器分析条件
色谱条件:采用F5柱,柱温40 ℃,流速0.4 mL/min,进样量1 μL。流动相为水(含体积分数0.1%甲酸)(A相)和乙腈(B相),梯度洗脱程序:0~5 min,10% B→90% B;5~7 min,90% B;7~9 min,90% B→10% B。
质谱条件:采用电喷雾离子源(electrospray ionization,ESI),扫描方式:正负离子同时扫描;多反应监测(multiple reaction monitoring,MRM)模式采集。碰撞气压力为Medium,气帘气为275.7 kPa,喷雾气压强和辅助加热气压强均为344.7 kPa,离子源温度为350 ℃,正离子模式离子化电压为+5 500 V,负离子模式离子化电压-4 500 V。丁虫腈及4种代谢物的详细质谱参数见表1所示。
表1 丁虫腈及其代谢物的质谱参数
Table 1 Mass spectrometry parameters for flufiprole and its metabolites

化合物ESI模式保留时间/min母离子(m/z)子离子(m/z)裂解电压/V碰撞电压/eVQ/q氟虫腈(-)4.73435.0330.0∗-40-234.07398.9-40-14丁虫腈砜(-)5.37505.0415.0∗-40-202.33281.9-40-45丁虫腈(+)5.04491.1422.1∗ 80 221.47405.18031丁虫腈酰胺(+)4.60509.1407.1∗ 70 352.19422.27025丁虫腈硫醚(+)5.25476.0310.1∗130 441.38372.313054
注:*为定量离子,Q为定量离子通道的峰面积,q为定性离子通道峰面积
1.2.2 样品提取与净化
小青菜茎、叶和根:准确称取5.00 g样品(根样品准确称取2.00 g)于50 mL具塞离心管中,加入10 mL乙腈并垂直振荡提取10 min,然后加入1 g NaCl并垂直振荡1 min,于10 000 r/min离心5 min,取1.5 mL上清液加入含有20 mg MWCNTs(外径为10~20 nm)的4 mL离心管中,涡旋1 min,于4 000 r/min离心3 min,取上清液过膜后上机。
土壤样品:准确称取5.00 g样品于50 mL具塞离心管中,加入5 mL超纯水,再加入25 mL乙腈并垂直振荡提取10 min,然后加入1 g NaCl并垂直振荡1 min,于10 000 r/min离心5 min,取1.5 mL上清液加入含有20 mg MWCNTs(外径为10~20 nm)的4 mL离心管中,涡旋1 min,于4 000 r/min离心3 min,取上清液过膜后上机。
1.2.3 标准溶液的配制
用乙腈分别溶解丁虫腈,丁虫腈砜,丁虫腈硫醚,氟虫腈及丁虫腈酰胺标准品配制成质量浓度为1 000 mg/L的标准储备液,然后各吸取适量的标准溶液配制质量浓度为100 mg/L的混合标准溶液,于-20 ℃避光保存,备用。
1.2.4 标准曲线的绘制
称取空白样品,按1.2.2节的方法前处理后,获得空白基质提取液,分别配制质量浓度为0.5、1、2.5、5、10、25、50和100 μg/L的基质标准工作溶液,通过UPLC-MS/MS检测以获得基质匹配标准曲线。
1.2.5 添加回收试验
取空白样品进行4个不同水平(5、50、200和1 000 μg/kg)的添加回收试验,每个水平重复5次,于室温下静置0.5 h后按照1.2.2节的方法进行前处理,获得样品提取液。测定前,将添加水平为1 000 μg/kg的样品提取液按V(空白基质提取液)∶V(样品提取液)=9∶1进行稀释,其余添加水平的样品不再进行稀释。计算添加回收率和相对标准偏差。
1.3 数据处理
数据采集、定量分析分别采用Analyst1.6.0和MultiQuant 3.0.2软件,并通过Origin Pro 8软件对试验结果进行作图。
2 结果与讨论
2.1 质谱条件优化
使用乙腈/水(0.1%甲酸)(4∶1,体积比)配制质量浓度为0.1 mg/L的单标溶液,采用注射泵以20 μL/min将单标溶液分别注入离子源。首先在Q1 Mass模式下进行全扫描,结果表明丁虫腈,丁虫腈硫醚和丁虫腈酰胺在正离子模式下[M+H]+的响应值显著高于负离子模式,而丁虫腈砜和氟虫腈2种化合物则相反,在负离子模式[M-H]-下响应值显著高于正离子模式。然后在Product Ion模式下进行碎片离子扫描,获得高丰度和高稳定性的子离子。最后在MRM模式下,对不同离子通道的裂解电压(正离子模式0~300 V,负离子模式-300~0 V)和碰撞电压(正离子模式5~180 eV,负离子模式-180~-5 eV)等参数进行优化,获得最佳响应的离子对信息。每种目标化合物选择2对离子对,以最高响应的子离子为定量离子,另一子离子作为定性离子。采用上述优化后的质谱方法检测不同浓度基质标准品及实测样品,不同离子通道的质谱图显示(图2),在上述几种目标物出峰位置均没有杂质峰干扰,且目标物具有较好的重现性。
2.2 液相条件优化
本文考察比较了乙腈/水和甲醇/水2种流动相组成中,在水相中加入体积分数0.1%甲酸后对于多种目标物响应值的影响,结果表明当体积分数0.1%甲酸水加入后,正离子模式下丁虫腈、丁虫腈酰胺和丁虫腈硫醚的响应值显著提升,负离子模式下的丁虫腈砜及氟虫腈的响应值变化不显著,因此,0.1%甲酸水被用于水相。
选择一种合适的固定相是实现多种目标物快速分离和检测的关键。本文在乙腈/0.1%甲酸水和甲醇/0.1%甲酸水流动相体系下,进一步考察比较了3种不同的色谱柱对于5种目标化合物色谱保留和分离效果的影响。由图2可以看出,使用F5柱在乙腈/0.1%甲酸水流动相体系条件下可实现丁虫腈及其4种代谢物的同时基线分离,且目标物保留时间最短(<5.5 min),分析效率最高。相比之下,在甲醇/0.1%甲酸水流动相体系下,使用3种色谱柱均难以实现丁虫腈酰胺和丁虫腈的色谱分离。在乙腈/0.1%甲酸水流动相体系下,使用T3柱仅能实现丁虫腈及其代谢物的部分分离,使用C18柱难以实现丁虫腈硫醚和丁虫腈砜的色谱分离,且目标物的保留时间均大于5.5 min。综合考虑分析效率及色谱分离度,最终选择F5柱-乙腈/0.1%甲酸水流动相体系用于丁虫腈及其代谢物的分析。
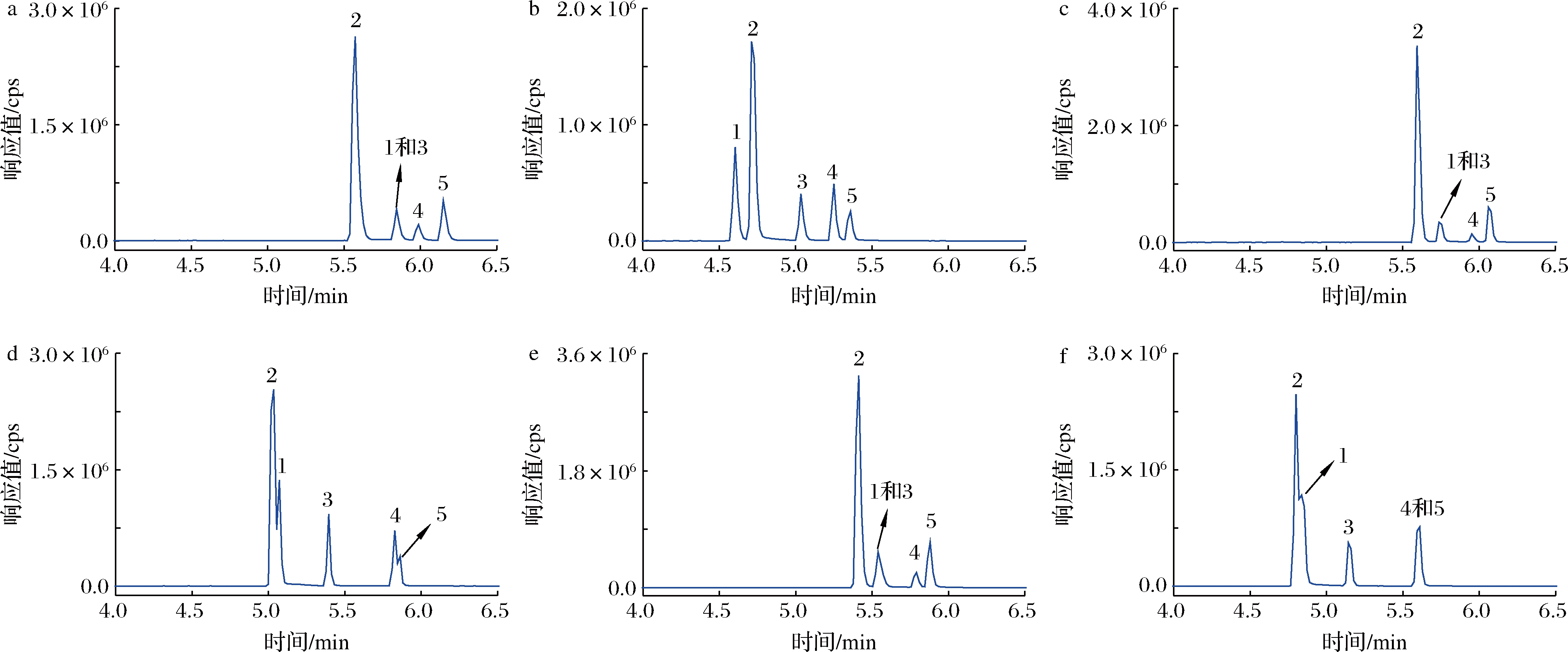
a F5柱-甲醇/0.1%甲酸水梯度洗脱;b F5柱-乙腈/0.1%甲酸水梯度洗脱;c T3柱-甲醇/0.1%甲酸水梯度洗脱;d T3柱-乙腈/0.1%甲酸水梯度洗脱;e C18柱-甲醇/0.1%甲酸水梯度洗脱;f C18柱-乙腈/0.1%甲酸水梯度洗脱;1-丁虫腈酰胺;2-氟虫腈;3-丁虫腈;4-丁虫腈硫醚;5-丁虫腈砜
图2 流动相组成及色谱柱对丁虫腈及其代谢物色谱分离和保留时间的影响
Fig.2 Effect of mobile phase compositions and chromatographic columns on chromatographic separation and retention time of flufiprole and its metabolites
2.3 小青菜和土壤净化剂的选择
蔬菜和土壤成分复杂,易对后续液质检测分析的准确性造成影响,因此对净化剂的选择具有更高的要求。在本实验室前期发表的检测方法基础之上[16-17],本文综合比较了8种净化剂对于样品中杂质净化效果和目标物回收率的影响。
由图3可以看出,未净化的土壤样品的提取液中色素杂质含量较低,故8种净化剂对土壤的净化效果外观上差异不显著。而对于小青菜样品,上述几种净化剂的净化效果则存在显著差异。使用不同质量(50和100 mg)的PSA净化剂对提取液中的色素几乎没有去除效果,净化效果显著弱于其他净化剂组合。色素杂质会导致色谱柱堵塞及仪器灵敏度降低。相比之下,含GCB组合(50 mg GCB,100 mg GCB,50 mg GCB+50 mg PSA)以及3种不同外径的MWCNTs则表现出良好的色素去除效果。

a-空白土壤样品基质净化效果对比;b-空白小青菜样品基质净化效果对比
注:1未净化空白基质提取液;2~4分别为使用20 mg外径为<8 nm,10~20 nm,20~30 nm的多壁碳纳米管净化的空白基质提取液;5~9分别为使用50 mg PSA,100 mg PSA,50 mg GCB,100 mg GCB,50 mg PSA+50 mg GCB净化的空白基质提取液
图3 土壤及小青菜空白基质样品中不同净化剂的净化效果比较
Fig.3 Comparison of purification efficacy of different sorbents in the control samples of pakchoi and soil
值得注意的是,GCB类净化剂在对色素杂质表现出较好的净化效果的同时,也会对某些特殊结构的目标化合物产生一定程度的吸附,从而影响目标化合物的准确定量。鉴于此,本文进一步考察比较了8种净化剂对丁虫腈及其代谢物回收率的影响。土壤样品和小青菜添加回收试验各设置3次重复,添加浓度为0.1 mg/kg。由图4可以看出,使用20 mg 10~20 nm MWCNTs作为净化剂时,土壤和小青菜中丁虫腈及其代谢物均可获得满意的回收率(大于83%);使用50 mg PSA和100 mg PSA作为净化剂时,小青菜中的丁虫腈硫醚的回收率低于70%;使用100 mg GCB为净化剂时,小青菜中丁虫腈硫醚的回收率低于80%;使用50 mg GCB+50 mg PSA为净化剂时,小青菜中丁虫腈硫醚和丁虫腈砜的回收率低于80%,土壤中丁虫腈砜的回收率低于80%;使用50 mg GCB为净化剂,目标物的回收率均大于80%,但目标物的回收率略低于20 mg外径10~20 nm MWCNTs。综合考虑净化效果和回收率,最终本实验选择20 mg外径10~20 nm MWCNTs作为土壤样品和蔬菜样品的净化剂。
2.4 方法验证
2.4.1 方法线性及基质效应
在0.5~100 μg/L的线性范围内,丁虫腈及其代谢物在小青菜(根、茎和叶)及土壤基质中的线性良好(相关系数≥0.9923)。基质效应(matrix effect,ME)是指目标物的离子化受共流出物的影响,从而导致目标物响应值增高或降低的现象,通过ME=(基质匹配标准曲线的斜率-溶剂标准曲线的斜率)/溶剂标准曲线的斜率计算[18]。ME在-20%~20%,属于弱基质效应;ME在-50%~-20%和20%~50%,属于中等基质效应;当ME<-50%或ME>50%时,表现为强基质效应[19]。由表2可知,丁虫腈及其4种代谢物在小青菜茎,叶和土壤基质中ME均介于-20%~20%,属于弱基质效应;而丁虫腈、丁虫腈酰胺、丁虫腈砜和丁虫腈硫醚在小青菜根基质中存在中等基质效应,为-37.4%~-27.9%。由于存在中等基质效应,为了保证分析结果的准确性,基质匹配标准曲线被用于上述几种目标物的定量分析。
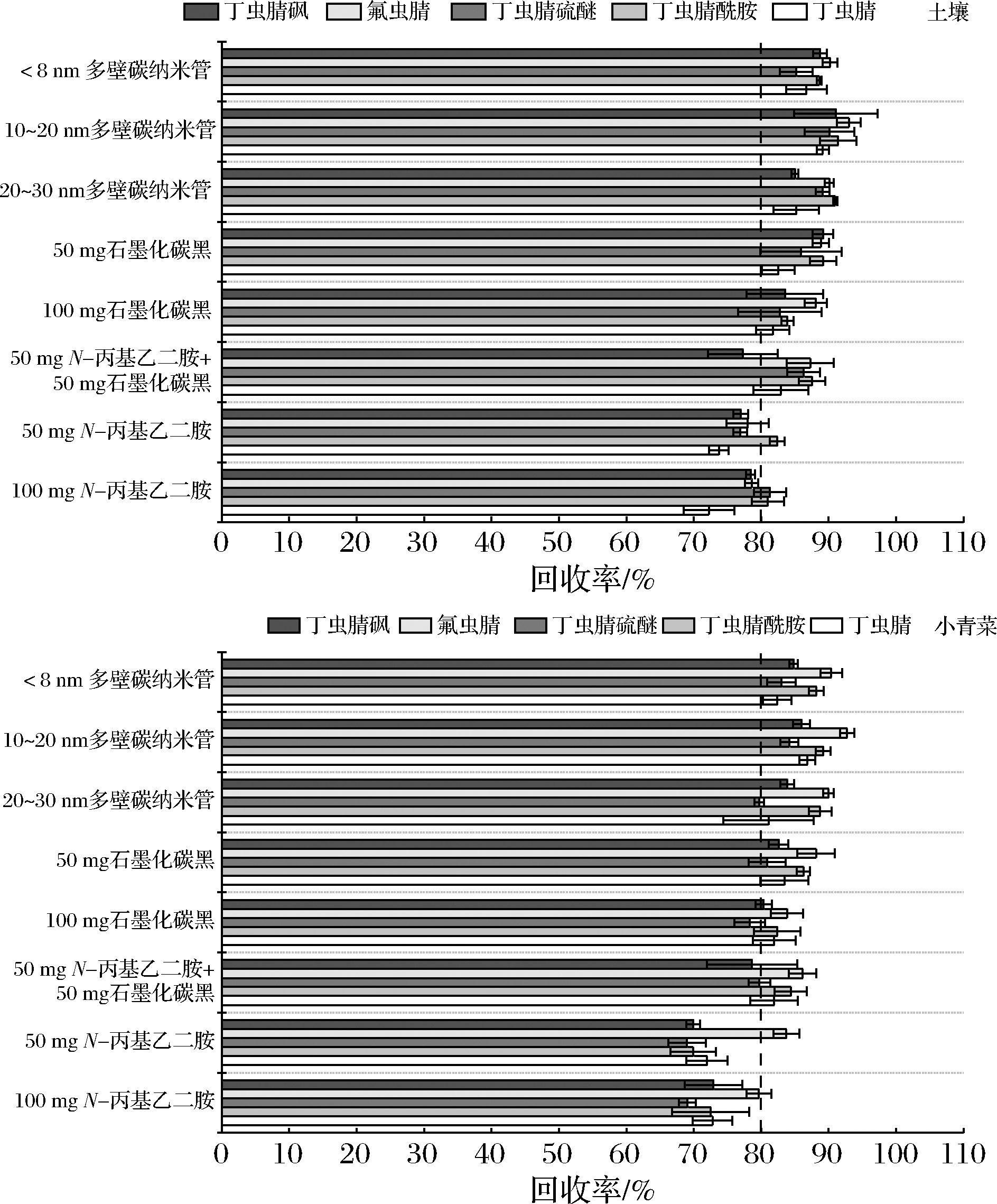
图4 不同净化剂对于土壤和小青菜中丁虫腈及其代谢物回收率的影响
Fig.4 Effects of different sorbents on the recovery of flufiprole and its metabolites in the soil and pakchoi samples
表2 丁虫腈及其代谢物在小青菜(根、茎和叶)和土壤中的线性关系
Table 2 Linear relationship of flufiprole and its metabolites in pakchoi (roots, stems and leaves) and soil samples

化合物基质线性范围/(μg·L-1)标准曲线相关系数斜率比基质效应/%丁虫腈乙腈0.5~100y=176 010x+1 8590.998 9——根0.5~100y=110 199x+1 2960.999 00.626-37.4茎0.5~100y=143 432x-5750.997 50.815-18.5叶0.5~100y=141 328x-6090.998 50.803-19.7土壤0.5~100y=145 179x-2 4830.994 50.825-17.5丁虫腈酰胺乙腈0.5~100y=221 843x+4 6450.998 6——根0.5~100y=158 716x+1 8160.999 30.715-28.5茎0.5~100y=224 946x+1 2660.996 91.0141.4叶0.5~100y=206 120x+3 6420.999 00.929-7.1土壤0.5~100y=203 413x+10 2640.994 50.917-8.3
续表2

化合物基质线性范围/(μg·L-1)标准曲线相关系数斜率比基质效应/%丁虫腈硫醚乙腈0.5~100y=80 595x+1 9920.999 2——根0.5~100y=54 374x+1220.999 20.675-32.5茎0.5~100y=73 440x+1 1030.997 70.911-8.9叶0.5~100y=77 584x-1 2630.999 20.963-3.7土壤0.5~100y=70 384x-2 8900.995 60.873-12.7氟虫腈乙腈0.5~100y=175 439x+9 4730.997 2——根0.5~100y=181 684x+6 4580.996 41.036 3.6茎0.5~100y=184 750x+1810.992 31.0535.3叶0.5~100y=184 141x+8 7900.995 41.055.0土壤0.5~100y=156 017x-1 0390.997 30.889-11.1丁虫腈砜乙腈0.5~100y=39 207x+4 2250.997 7——根0.5~100y=28 285x-6570.996 40.721-27.9茎0.5~100y=38 615x+1 2910.996 30.985-1.5叶0.5~100y=38 275x+1 6960.998 40.976-2.4土壤0.5~100y=33 837x-2610.995 50.863-13.7
2.4.2 回收率和方法定量限
通过开展添加回收实验,结果表明丁虫腈及其代谢物的回收率为76%~107%,相对标准偏差(relative standard deviation,RSD)为0.8%~7.6%(表3)。以满足农药残留分析添加回收率要求的最低添加浓度为方法的定量限(limit of quantification,LOQ)[17],丁虫腈及其4种代谢物在小青菜(根、茎、叶)及土壤中的LOQ均为5 μg/kg。
表3 丁虫腈及其代谢物在小青菜(根、茎和叶)和土壤中的添加回收率(n=5)
Table 3 Recovery of flufiprole and its metabolites in pakchoi (roots, stems and leaves) and soil samples (n=5)

化合物添加水平/(μg·kg-1)茎叶根土壤回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%丁虫腈51004.4913.6906.5786.850897.6913.2803.41016.3200863.6922.1931.4952.31 0001044.3917.2874.0901.9丁虫腈酰胺5892.6892.1851.5824.150872.5871.3842.0843.6200841.1863.1901.5922.510001042.8872.3871.4897.3丁虫腈硫醚5983.2944.8905.2763.050834.1862.9845.2836.3200862.6841.5901.9871.510001074.9875.6892.2905.1氟虫腈5842.9872.0843.1854.150880.9892.4821.8843.6200952.0920.8882.2921.010001061.8903.7882.6895.6丁虫腈砜5912.5851.7874.7854.150851.0804.9833.0843.6200931.7881.9891.6912.810001051.3842.7892.6893.5
2.5 实际样品检测
如图5所示,丁虫腈酰胺、丁虫腈砜以及氟虫腈为丁虫腈在小青菜-土壤系统中的主要代谢产物,而丁虫腈硫醚在实际样品中均未检出。在小青菜根、茎和叶样品中均检测出一定含量的氟虫腈和丁虫腈砜残留,残留质量分数分别为3.702,0.107,0.018 mg/kg及0.020,0.029,0.215 mg/kg。鉴于氟虫腈和丁虫腈砜2种代谢物具有较高的非靶标生物毒性,在丁虫腈的使用过程中,应当注意其代谢产物残留带来的环境安全风险。

1 丁虫腈酰胺;2 氟虫腈;3 丁虫腈;4 丁虫腈硫醚;5 丁虫腈砜
图5 小青菜(根、茎和叶)及土壤的实际样品液质检测色谱图
Fig.5 Typical UPLC-MS chromatograms of real samples of pakchoi (roots, stems and leaves) and soil
3 结论
本研究建立了小青菜和土壤中丁虫腈及其多种代谢物(丁虫腈砜、丁虫腈硫醚、丁虫腈酰胺及氟虫腈)残留的UPLC-MS/MS检测方法。供试样品经乙腈快速提取,MWNTs净化,UPLC-MS/MS检测,基质匹配标准曲线法定量。该方法操作简单、快速准确、灵敏度高、重现性良好,检测成本低。该方法LOQ为5 μg/kg,满足不同生长阶段小青菜样品中目标农药及代谢物残留检测的要求。实际样品检测结果表明,该方法具有较好的适用性,可用于土壤和小青菜中丁虫腈及其多种代谢产物的快速筛查及准确定量分析,同时为下一步开展土壤-小青菜系统中丁虫腈的迁移、转化、降解研究及残留监测提供参考。
[1] 李彦龙. 创制杀虫剂丁虫腈[J].农药, 2014, 53(2):126-128.
LI Y L.A novel insecticide flufi prole[J].Agrochemicals, 2014, 53(2):126-128.
[2] TIAN M M, ZHANG Q, HUA X D, et al.Systemic stereoselectivity study of flufiprole:Stereoselective bioactivity, acute toxicity and environmental fate[J].Journal of Hazardous Materials, 2016, 320:487-494.
[3] 牛洪涛. 丁烯氟虫腈对小菜蛾的生物活性及抗性风险评估[D].泰安:山东农业大学, 2008.
NIU H T.Biological activities of butene-fipronil to the diamondbck moth, Plutella xylostella (L.) and its resistance risk assessment[D].Tai’an:Shandong Agricultural University, 2008.
[4] 徐士才,傅俊璋,朱磊, 等.几种药剂防治水稻稻纵卷叶螟幼虫田间药效试验报告[J].农药科学与管理,2008,29(12):23-25.
XU S C, FU J Z, ZHU L, et al.Field efficacy of several insecticides against rice leaf roller larvae[J].Pesticide Science and Administration.2008,29(12):23-25.
[5] 于建垒, 宋国春, 李瑞娟, 等.丁虫腈在甘蓝中的残留特性及安全使用[J].中国蔬菜, 2011(20):79-83.
YU J L, SONG G C, LI R J, et al.Residue studies and safe application of flufiprole in cabbage[J].China Vegetables, 2011(20):79-83.
[6] 何健, 孔德洋, 吴文铸, 等.丁虫腈在环境中的降解特性[J].生态与农村环境学报, 2012, 28(5):539-543.
HE J, KONG D Y, WU W Z, et al.Degradation of flufiprole in the environment[J].Journal of Ecology and Rural Environment, 2012, 28(5):539-543.
[7] 单正军, 陈祖义.农产品农药污染途径分析[J].农药科学与管理, 2008, 29(3):40-49;14.
SHAN Z J, CHEN Z Y.Analysis of pollution channels of agricultural products[J].Pesticide Science and Administration,2008, 29(3):40-49;14.
[8] 赵玉华, 陈子雷, 王玉涛, 等.QuEChERS结合GC-MS/MS快速检测蔬菜中丁虫腈残留[J].山东农业科学, 2016, 48(7):129-132.
ZHAO Y H, CHEN Z L, WANG Y T, et al.Rapid determination of flufiprole residue in vegetables using QuEChERS and gas chromatography-triple quadrupole mass spectrometry[J].Shandong Agricultural Sciences, 2016, 48(7):129-132.
[9] 罗智强, 章虎, 王祥云, 等.电子捕获检测器-气相色谱法测定土壤中丁虫腈农药残留量[J].理化检验-化学分册, 2014, 50(3):330-332.
LUO Z Q, ZHANG H, WANG X Y, et al.Determination of residual amount of flufiprole in soil by GC with ECD[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2014, 50(3):330-332.
[10] 丁立平, 刘微, 方光伟, 等.改进QuChERS-气质联用法测定蔬菜中氟虫腈和丁烯氟虫腈残留量[J].分析试验室, 2013, 32(8):117-120.
DING L P, LIU W, FANG G W, et al.Determination of fipronil and butane-fipronil residues in vegetable by improved QuChERS-GC/MS[J].Chinese Journal of Analysis Laboratory, 2013, 32(8):117-120.
[11] GAO J, WANG F, JIANG W Q, et al.A full evaluation of chiral phenylpyrazole pesticide flufiprole and the metabolites to non-target organism in paddy field[J].Environmental Pollution, 2020, 264:114808.
[12] 何健, 孔德洋, 吴文铸, 等.稻田样品中丁虫腈及其代谢产物的残留分析方法[J].生态与农村环境学报, 2012, 28(4):451-455.
HE J, KONG D Y, WU W Z, et al.Determination of flufiprole and its metabolites in samples from paddy field[J].Journal of Ecology and Rural Environment, 2012, 28(4):451-455.
[13] 谭华东, 张汇杰, 武春媛.QuEChERS/UPLC-MS/MS法快速测定土壤中吡虫啉、啶虫脒与阿维菌素残留[J].农药, 2019, 58(1):45-49.
TAN H D, ZHANG H J, WU C Y.Rapid determination of avermectin, imidacloprid and acetamiprid residues in soil by QuEChERS/UPLC-MS/MS[J].Agrochemicals, 2019, 58(1):45-49.
[14] 田金凤, 尚远宏.QuEChERS净化-超高效液相色谱-串联质谱法测定凯特芒果中14种农药残留[J].食品与发酵工业, 2020, 46(9):272-277.
TIAN J F, SHANG Y H.Determination of fourteen kinds of pesticide residues in Kaite mango by QuEChERS with UPLC-MS/MS[J].Food and Fermentation Industries, 2020, 46(9):272-277.
[15] 范金平, 张盈, 魏进, 等.QuEChERS结合超高效液相色谱串联质谱法测定花椒中烯效唑残留量及贮藏稳定性[J].食品与发酵工业, 2021, 47(8):230-235.
FAN J P, ZHANG Y, WEI J, et al.Determination of uniconazole and storage stability in Zanthoxylum bungeanum Maxim by QuEChERS-UHPLC-MS/MS[J].Food and Fermentation Industries, 2021, 47(8):230-235.
[16] LI M M, LIU X G, DONG F S, et al.Simultaneous determination of cyflumetofen and its main metabolite residues in samples of plant and animal origin using multi-walled carbon nanotubes in dispersive solid-phase extraction and ultrahigh performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2013, 1 300:95-103.
[17] LI J, DONG C, AN W J, et al.Simultaneous enantioselective determination of two new isopropanol-triazole fungicides in plant-origin foods using multiwalled carbon nanotubes in reversed-dispersive solid-phase extraction and ultrahigh-performance liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2020, 68(21):5 969-5 979.
[18] 乐渊, 刘春华, 吴南村,等.多壁碳纳米管净化-液相色谱串联质谱法测定瓜菜中双酰胺类杀虫剂[J].食品安全质量检测学报.2019,10(10):2 961-2 966.
LE Y, LIU C H, WU N C,et al.Determination of diamide insecticide residues in melons and vegetables using multiwalled carbon nanotubes purification coupled with ultra performance liquid chromatography tandem mass spectrometry[J].Journal of Food Safety & Quality, 2019,10(10):2 961-2 966.
[19] HE Z Y, CHEN S S, WANG L, et al.Multiresidue analysis of 213 pesticides in leek and garlic using QuEChERS-based method and gas chromatography-triple quadrupole mass spectrometry[J].Analytical and Bioanalytical Chemistry, 2015, 407(9):2 637-2 643.