火锅作为最受欢迎的中国传统美食之一,其食品安全受到高度的关注。一些不法商贩在火锅食品中掺入罂粟壳以吸引回头客。罂粟壳俗称大烟壳,有止痛、止咳等作用,其主要成分包含罂粟碱、吗啡、那可丁、可待因、蒂巴因等多种生物碱类有毒物。消费者长期食用含有罂粟壳的食物及相关产品容易对人体神经系统造成损害,并可能造成慢性中毒[1],甚至会出现内分泌失调等症状,最终上瘾,具有潜在的吸食毒品的倾向,给社会造成极坏的影响[2]。此外,为防止火锅食品的细菌滋生,影响保质期及防止中毒,个别商家还添加了卫生部公布的食品中违法添加的物质——喹诺酮类抗生素。若长期食用残留喹诺酮类药物的食品,药物会在人体内积累,会使致病菌产生耐药性,从而危害人类健康。所以,建立一种同时测定火锅食品的生物碱和喹诺酮类物质的检测方法,为促进火锅行业的发展及保障消费者的健康安全具有重要意义。
目前,检测食品中罂粟壳的生物碱和喹诺酮类物质常用的方法有液相色谱法[3-4]、气相色谱法[5]、气相色谱-质谱联用法[6]和液相色谱-串联质谱法等[7-10]。而喹诺酮类药物检测方法多集中在动物源性食品和环境等领域[11-14],补充检验方法《BJS 201909》中涉及11种喹诺酮类药物的检测,其他关于火锅食品中喹诺酮类药物分析的研究鲜见报道[15-16]。在目前分析技术手段中,液相色谱-串联质谱法最具普遍性和实用性,其前处理简单、选择性好、灵敏度高。本研究将结合QuEChERS前处理技术,用超高效液相色谱-串联质谱(UPLC/MSMS)同位素内标法同时测定火锅食品中5种生物碱和15种喹诺酮类物质,为火锅食品中生物碱和喹诺酮类物质的测定提供快捷、灵敏、准确的检测技术支撑。
1 材料与方法
1.1 主要仪器与设备
Agilent 1290/6470超高效液相色谱-串联质谱仪,美国安捷伦公司;L-500型高速离心机,长沙湘仪离心机仪器有限公司;N-EVAP 12氮吹仪,美国Organomation公司;电子天平,常熟市双杰测试仪器厂;UMV-2多管旋涡混合器,北京普立泰科仪器有限公司;XW-80A型旋涡混合器,苏州江东精密仪器有限公司;Milli-Q Intergra115实验室超纯水制备系统,美国Millipore公司;移液器,大龙兴创实验仪器有限公司;5~50 mL瓶口分液器,德国普兰德公司。
1.2 试剂与材料
乙腈(色谱纯),德国Merck公司;甲酸(色谱纯)、0.22 μm PTFE微孔滤膜、粒度40~63 μm乙二胺-N-丙基硅烷(primary-secondary amine,PSA)填料和C18填料,上海安谱实验科技股份有限公司;乙酸铵(优级纯),山东西亚化学股份有限公司;MgSO4(分析纯),国药集团化学试剂有限公司;CH3COONa(分析纯),天津市博迪化工有限公司。
吗啡、可待因、蒂巴因、罂粟碱、那可丁混合标准溶液(质量浓度分别为50.0、50.0、10.0、10.0和10.0 μg/mL),喹诺酮混合标准溶液、吗啡-d3溶液、可待因-d3溶液、诺氟沙星-d5溶液、恩诺沙星-d5溶液、环丙沙星-d8溶液(质量浓度均为100.0 μg/mL),天津阿尔塔科技有限公司。
1.3 实验方法
1.3.1 标准溶液的配制
混合标准储备液的配制:分别准确称取0.50 mL的吗啡、可待因、蒂巴因、罂粟碱、那可丁混合标准溶液和0.05 mL喹诺酮混合标准溶液于5 mL容量瓶中,用V(乙腈)∶V(水)=1∶9混合液定容,得质量浓度为1 000 ng/mL(吗啡、可待因质量浓度为5 000 ng/mL)的混合标准储备液。
同位素内标工作溶液的配制:分别准确取0.10 mL的吗啡-d3溶液、可待因-d3溶液、诺氟沙星-d5溶液、恩诺沙星-d5溶液和环丙沙星-d8溶液至10 mL容量瓶中,用V(乙腈)∶V(水)=1∶9混合液定容,得质量浓度为1 000 ng/mL内标储备液。
混合标准工作曲线溶液的制备:分别取混合标准储备液0.010、0.050、0.10、0.25和0.50 mL于5个10 mL容量瓶中,并向不同浓度的容量瓶中准确加入0.10 mL的内标储备液,用V(乙腈)∶V(水)=1∶9混合液定容,得质量浓度为1、5、10、25和50 ng/mL的混合标准工作液,其中吗啡和可待因的质量浓度为5、25、50、125和250 ng/mL。混合标准工作液内标质量浓度为10 ng/mL。
1.3.2 样品前处理方法
1.3.2.1 试样制备和保存
取待测半固体样品(>200 g)放入均质机中,匀浆混匀;取待测液体样品(>200 g)置玻璃烧杯中,搅匀。将制备完的样品,装于洁净的聚四氟乙烯瓶中,密封并标记,于-18 ℃保存,备用。
1.3.2.2 提取
称取2 g试样(精确至0.01 g)于50 mL具塞离心管中,加入同位素内标溶液,加入1粒陶瓷均质子,再加入5 mL水,漩涡混合30 s,使样品分散均匀,加入乙腈-1%(体积分数)甲酸10 mL,置于多管漩涡混合器中,振荡提取5 min,然后加入1.5 g CH3COONa,6 g MgSO4,迅速振摇,以4 200 r/min离心5 min,待净化。
1.3.2.3 净化
吸取6 mL上清液加到预先放置1 200 mg无水MgSO4、400 mg PSA及400 mg C18填料的15 mL塑料离心管中,涡旋混匀1 min,4 200 r/min离心5 min,准确吸取2 mL上清液于15 mL离心管中,45 ℃水浴中氮吹至近干,加入1 mL V(乙腈)∶V(水)=1∶9混合液定容,涡旋复溶,过PTFE微孔滤膜,使用UPLC/MSMS进行分析。
1.4 实验条件
1.4.1 色谱条件
色谱柱:Agilent Eclipse plus C18(2.1 mm×150 mm,1.8 μm);流动相:A为体积分数0.1%甲酸水溶液(含5 mmol/L乙酸铵),B为乙腈;流速0.3 mL/min;柱温40 ℃;进样量5 μL;梯度洗脱程序:0~2 min(10% B),2~6 min(10%~30% B),6~9 min(30%~50% B),9~11.5 min(50%~95% B),11.5~14.5 min(95% B),15.0~16.0 min(95%~10% B),16.0~20.0 min(10% B)。
1.4.2 质谱条件
电喷雾离子源(electrospray ionization,ESI),多反应监测模式(multiple reaction monitoring,MRM),正离子扫描,毛细管电压5 500 V,喷嘴电压500 V,雾化气压力45 psi,干燥气流速8 L/min,干燥气温度300 ℃,鞘气流速10 L/min,鞘气温度300 ℃,各目标物定性、定量离子、锥孔电压、碰撞能量等参数列于表1。
表1 目标物的保留时间及质谱参数
Table 1 Retention times and mass spectrometric parameters for the analytes
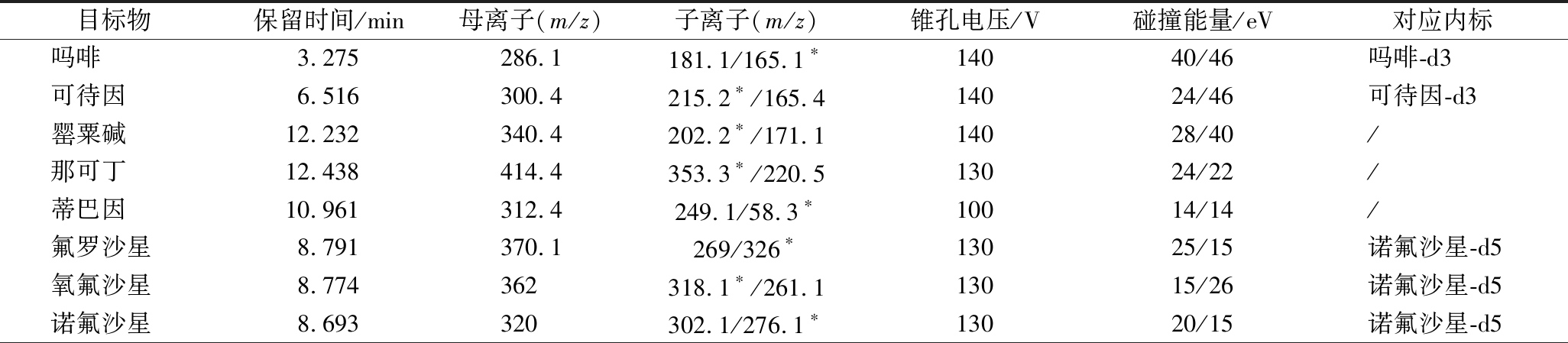
目标物保留时间/min母离子(m/z)子离子(m/z)锥孔电压/V碰撞能量/eV对应内标吗啡 3.275286.1181.1/165.1∗14040/46吗啡-d3可待因6.516300.4215.2∗/165.414024/46可待因-d3罂粟碱12.232340.4202.2∗/171.114028/40/那可丁12.438414.4353.3∗/220.513024/22/蒂巴因10.961312.4249.1/58.3∗10014/14/氟罗沙星8.791370.1269/326∗13025/15诺氟沙星-d5氧氟沙星8.774362318.1∗/261.113015/26诺氟沙星-d5诺氟沙星8.693320302.1/276.1∗13020/15诺氟沙星-d5
续表1

目标物保留时间/min母离子(m/z)子离子(m/z)锥孔电压/V碰撞能量/eV对应内标培氟沙星8.903334.1316.2∗/290.213020/16诺氟沙星-d5伊诺沙星8.391321 303.2∗/232.112520/36诺氟沙星-d5环丙沙星8.974332.1314.1∗/23113520/42环丙沙星-d8洛美沙星9.361352.1308.1∗/265.113010/20环丙沙星-d8达氟沙星9.414358.1340.1∗/25514025/46环丙沙星-d8奥比沙星10.029396.1352.1∗/295.113015/22环丙沙星-d8双氟沙星10.949400382.1/356.1∗14020/20环丙沙星-d8沙拉沙星10.739386.1368.1/342.1∗13020/15恩诺沙星-d5司帕沙星10.915393.1349∗/29213020/36恩诺沙星-d5噁喹酸13.037262160/216∗9040/30恩诺沙星-d5氟甲喹14.047262126/202∗10050/30恩诺沙星-d5恩诺沙星9.749360342.1/316.2∗12020/20恩诺沙星-d5吗啡-d33.275289.4185.214040/可待因-d36.515303.5215.314024/诺氟沙星-d58.674325.1307.213017/恩诺沙星-d59.748365.2321.212018/环丙沙星-d88.955340.2322.29018/
注:*为定量离子;/为未用内标物进行定量分析
2 结果与讨论
2.1 液相色谱条件的选择
本研究采用超高效液相色谱,为保证分离效果和峰形,选择1.8 μm粒径,规格为2.1 mm×150 mm的超高效液相色谱柱,经试验,在20 min内完成了20种化合物的分离,与传统色谱柱相比,分离效果较好,峰形更加优异。由于被分析物均在正离子模式下扫描,为了提高离子化效率,本实验考察了乙腈-0.1%(体积分数)乙酸水、乙腈-0.1%(体积分数)甲酸水、乙腈-5 mmol/L乙酸铵溶液和乙腈-0.1%甲酸水(含5 mmol/L乙酸铵溶液)等不同的流动相体系,经过比较,发现甲酸更有利于各化合物的离子化,质谱响应较好,同时,流动相中添加铵盐,改善了被分析物的峰形和分离效果,最终选择了乙腈-0.1%甲酸水(含5 mmol/L乙酸铵溶液)作为流动相体系进行色谱分析。
实验对定容溶液进行了优化,发现采用不同比例有机溶剂的溶液作为样品前处理后的定容液或标准稀释液,会对目标物峰形产生显著的影响,有机溶剂比例过高会造成部分目标物的色谱峰形坍塌,特别是吗啡和可待因的色谱峰严重拖尾。经过多次实验,确定以V(乙腈)∶V(水)=1∶9溶液作为定容溶液,再通过色谱分离,可获得良好的峰形,如图1所示。

1~20分别代表吗啡、可待因、伊诺沙星、诺氟沙星、氧氟沙星、氟罗沙星、培氟沙星、环丙沙星、洛美沙星、达氟沙星、恩诺沙星、奥比沙星、司帕沙星、蒂巴因、沙拉沙星、双氟沙星、罂粟碱、那可丁、噁喹酸、氟甲喹
图1 各目标物特征离子色谱图
Fig.1 Chromatograms of the compounds
2.2 质谱条件的优化
采用直接进样的方式,将配制好的各组分混合标准工作液,注入质谱仪进行全扫描,得到的母离子均为[M+H]+,在正离子模式(ESI+)下,优化锥孔电压,对母离子进行子离子扫描和MRM扫描,获得每个母离子的特异碎片离子,优化碰撞能量,选择2个丰度较高的离子作为定量和定性离子,各目标物质谱参数见表1。以优化好的质谱参数联机液相色谱仪,优化毛细管电压、雾化气压力、干燥气流量和温度、鞘气温度和流量等离子源参数,最后选择的参数见1.4.2中的质谱条件。
2.3 样品前处理的优化
2.3.1 样品的提取
喹诺酮类化合物结构上既有羟基,又有叔氨基,是两性化合物,易溶于酸性或碱性溶液,罂粟壳5种生物碱属弱碱性化合物。火锅食品基质较为复杂,在添加溶剂提取前,需要加水对样品进行分散,增加提取溶剂与样品的接触面积。在已有研究的基础上,本文采用QuEChERS法常用的乙腈作为提取溶剂,分别考察了在相同加标量10 μg/kg(吗啡、可待因50 μg/kg)的情况下纯乙腈、乙腈-1%(体积分数)甲酸、乙腈-1%(体积分数)乙酸对各目标物的提取效率,结果以回收率表示。3种不同溶剂中,乙腈-1%(体积分数)甲酸提取效果优于其他2类溶剂,回收率最低的吗啡为38%,最高的达氟沙星为142%(图2)。从溶剂整体效果考虑,选择1%甲酸乙腈作为实验溶剂提取剂。
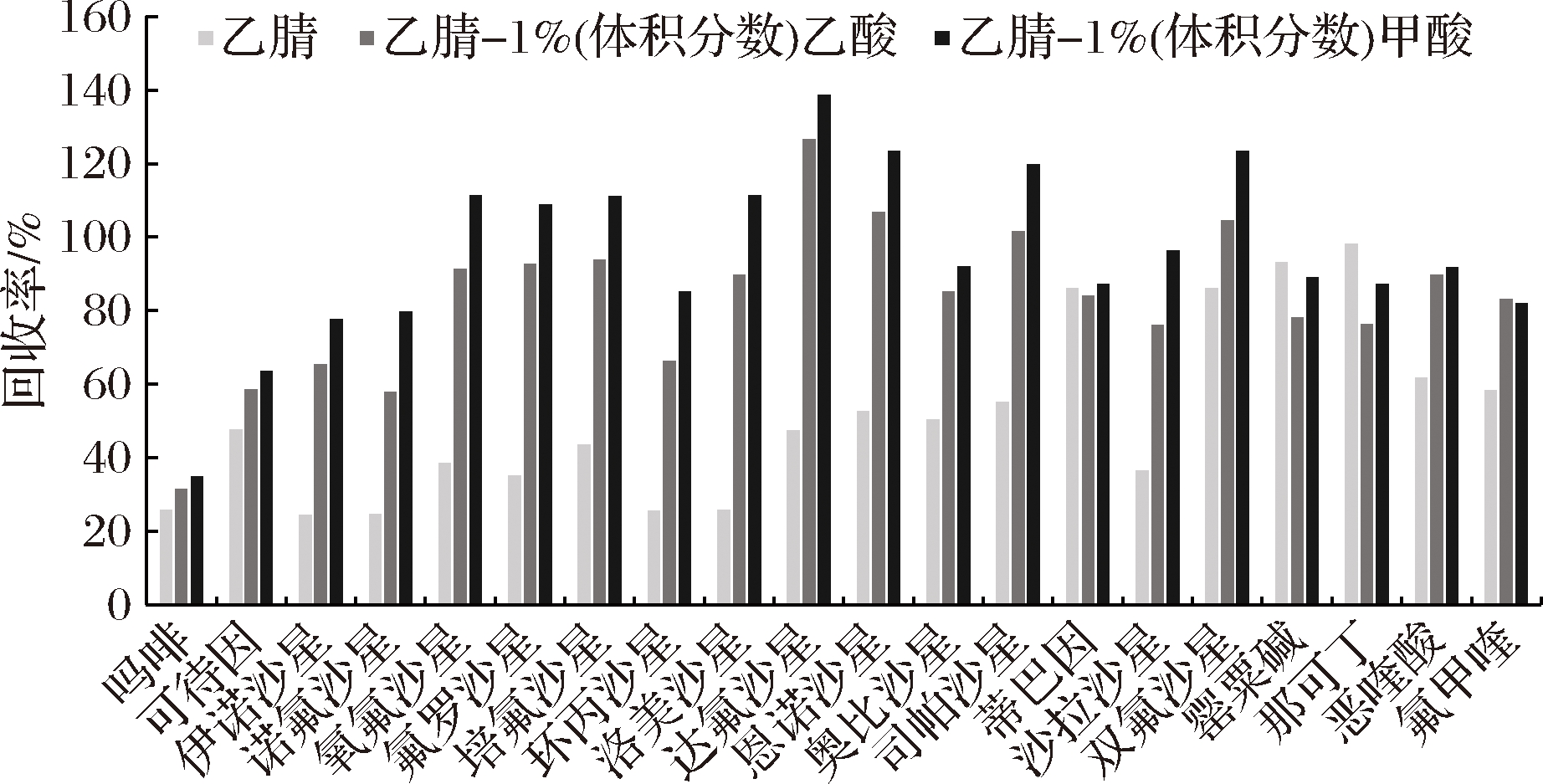
图2 不同提取溶剂的回收率
Fig.2 Recoveries of analytes with different extraction solvents
2.3.2 基质效应的考察
通过优化的前处理过程和仪器条件,分别测定空白提取液与纯溶剂中各目标物的离子响应值,考察各目标物的基质效应(matrix effect,ME),基质效应的计算参考文献[17]进行,如公式(1)所示:
(1)
式中:A,空白样品基质中目标物的离子响应值;B,纯溶剂中各目标物相同浓度的离子响应值。
当ME<0.5或者>1.5时,表示存在较强的基质抑制或者增强效应;当0.8 图3 优化的净化条件下各目标物的基质效应 移取适量的混合标准储备溶液,用V(乙腈)∶V(水)=1∶9溶液稀释,配制标准系列溶液,按照已优化的色谱条件和质谱参数进行检测,罂粟碱、那可丁、蒂巴因以定量离子的峰面积(y)为纵坐标、质量浓度(x)为横坐标绘制工作曲线,其他目标物以定量离子与相应同位素内标峰面比值(y)为纵坐标、质量浓度与内标浓度比值(x)为横坐标绘制标准工作曲线,各组分的线性范围在1.0~250 ng/mL,线性关系良好,线性相关系数≥0.997 5,结果见表2。采用空白样品添加目标物,按照1.3.2样品前处理步骤进行处理,并上机测定,以定量离子峰的3倍信噪比(signal-to-noise ratio,S/N)确定方法的检出限(limit of detection,LOD),各目标物的检出限见表2。 表2 目标物的线性范围、线性回归方程、相关系数及检出限 目标物线性范围/(ng·mL-1)线性方程相关系数R2检出限/(μg·kg-1)吗啡5.0~250y=35.394 6x-2.261 60.999 35.0可待因5.0~250y=28.600 3x+0.118 90.999 55.0罂粟碱1.0~50y=3 532.1x+1 461.50.999 11.0那可丁1.0~50y=1 240.8x+1 478.40.998 21.0蒂巴因1.0~50y=1 293.6x+7 639.30.999 31.0氟罗沙星1.0~50y=1.094 3x+0.038 20.999 11.0氧氟沙星1.0~50y=1.400 7x+0.101 90.998 91.0 续表2 目标物线性范围/(ng·mL-1)线性方程相关系数R2检出限/(μg·kg-1)诺氟沙星1.0~50y=0.963 6x-0.003 20.997 81.0培氟沙星1.0~50y=1.093 6x+0.058 40.998 51.0伊诺沙星1.0~50y=1.638 8x+0.002 20.998 51.0环丙沙星1.0~50y=1.129 3x+0.015 30.998 81.0洛美沙星1.0~50y=0.735 6x+0.039 30.998 21.0达氟沙星1.0~50y=0.567 9x+0.035 20.997 61.0奥比沙星1.0~50y=2.048 4x+0.307 60.998 10.5双氟沙星1.0~50y=0.816 4x+0.108 90.999 21.0沙拉沙星1.0~50y=0.924 8x+0.083 30.998 61.0司帕沙星1.0~50y=0.381 6x+0.105 70.997 51.0噁喹酸1.0~50y=1.871 7x+0.157 90.999 50.5氟甲喹1.0~50y=5.862 7x+0.488 80.997 90.5恩诺沙星1.0~50y=0.647 1x+0.098 20.997 81.0 为验证此方法的可靠性,选取空白样品,分别加入低、中、高3个不同浓度水平的混合标准溶液,按照1.3.2前处理方法处理样品,每个水平重复测定6次,采用内标法和外标法定量,计算平均回收率和精密度,如表3所示。结果表明,本研究建立的方法在不同加标水平下,平均回收率为74.6%~114.8%,精密度(relative standard deviation,RSD)<15.1%,具有较高的回收率和良好的精密度,能够满足火锅食品中添加的喹诺酮类药物和罂粟壳中生物碱检测的要求。 表3 三个加标水平下目标物的回收率及精密度(n=6) 目标物低浓度中浓度高浓度添加量/(μg·kg-1)回收率/%RSD/%添加量/(μg·kg-1)回收率/%RSD/%添加量/(μg·kg-1)回收率/%RSD/%吗啡 5.098.37.525.0103.112.750.098.711.8可待因5.096.64.425.097.67.550.0102.711.3罂粟碱1.090.29.15.087.212.610.084.38.3那可丁1.087.010.05.083.64.410.074.68.9蒂巴因1.076.14.55.080.79.210.086.310.6氟罗沙星1.0106.03.75.0114.55.210.0112.610.7氧氟沙星1.087.815.15.0114.87.510.090.814.9诺氟沙星1.093.67.65.099.68.510.0105.99.6培氟沙星1.0111.210.65.090.25.710.089.112.6伊诺沙星1.092.25.75.0102.311.210.0100.510.1环丙沙星1.097.94.65.0106.24.810.0102.33.4洛美沙星1.0108.210.95.0110.78.410.0100.72.3达氟沙星1.096.84.35.0109.35.810.0106.56.6奥比沙星1.0100.83.75.0111.45.610.092.78.6双氟沙星1.0108.37.45.0106.03.710.0104.93.4沙拉沙星1.0111.52.65.0103.83.410.0102.210.7司帕沙星1.097.67.75.096.84.310.090.23.5噁喹酸1.0108.27.25.0109.37.110.0112.25.6氟甲喹1.0105.86.25.0101.34.410.0110.81.8恩诺沙星1.096.63.75.0100.83.610.0103.46.6 通过对超市及自制餐馆采集3个类别25批次样品,其中羊肉汤10批次,牛肉汤10批次及其他预包装火锅食品5批次,进行生物碱及喹诺酮类化合物检测,结果见表4。检测的25批次火锅食品中7批次检出罂粟碱类残留物,其中2批次羊肉汤检出吗啡、可待因、罂粟碱、那可丁和蒂巴因5个物质,含量为20.3~627 μg/kg;另外5批次检出不同类别的罂粟碱类药,含量为9.07~626 μg/kg,其余的火锅食品均未检出罂粟碱类和喹诺酮类药物,本研究检测出的生物碱类药物和喹诺酮类药物结果与冯月超等[15]、李航等[18]研究结果相当。同时实验按要求进行了平行样及加标回收质量控制,5种生物碱和15种喹诺酮类物质的质控回收结果为69.2%~107%,均符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》要求,表明结果准确、可靠。火锅食品中检出生物碱类药物的原因主要是添加了罂粟壳或使用含有罂粟碱类药物的香料导致;而未检出喹诺酮类药物主要是因为实验代表样主要为鲜的汤料,不需要添加杀菌剂;其次预包装的火锅食品为正规的生产商,质量控制较好,所以生物碱类药物及喹诺酮类均未检出。 表4 不同类别火锅食品中目标化合物检测结果 检测项目/(μg·kg-1)样品名称羊肉汤羊肉汤羊肉汤羊骨汤牛肉汤牛肉汤牛肉汤其他预包装火锅食品吗啡未检出62739045962652.0344未检出可待因67.754.240970.5未检出未检出78.0未检出罂粟碱未检出64.969.7未检出96.4未检出9.07未检出那可丁未检出47.369.1未检出未检出未检出未检出未检出蒂巴因未检出20.347.0未检出未检出未检出18.2未检出喹诺酮类物质未检出未检出未检出未检出未检出未检出未检出未检出 注:未统计在表上的羊肉汤和牛肉汤样品,此类物质均为“未检出” 本文结合QuEChERS前处理技术,对提取及净化方法、色谱及质谱条件进行了优化,建立了同时测定火锅食品中5种生物碱及15种喹诺酮类物质的检测方法。该方法操作简便,灵敏度高,适合火锅食品的非法添加物生物碱及喹诺酮类物质的快速筛查,为市场食品安全监管提供技术支撑。 [1] 李兴根, 乔勇升, 陈伟, 等.超高效液相色谱-串联质谱法快速测定火锅底料中的5种罂粟壳生物碱残留[J].分析测试学报, 2018, 37(4):446-451. LI X G, QIAO Y S, CHEN W, et al.Rapid determination of five alkaloids of poppy husk in hot pot soup by ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis, 2018, 37(4):446-451. [2] 徐丽红, 王建清, 陶秋, 等.高效液相色谱同时测定3类食品中的5种罂粟壳生物碱[J].分析测试学报, 2011, 30(12):1 387-1 391. XU L H, WANG J Q, TAO Q, et al.Determination of 5 opium poppy husk alkaloids in three types of food by HPLC[J].Journal of Instrumental Analysis, 2011, 30(12):1 387-1 391. [3] 郝红艳, 郭济贤, 顺庆生, 等.HPLC和HPCE法测定罂粟壳中3种生物活性生物碱[J].药学学报, 2000, 35(4):289-293. HAO H Y, GUO J X, SHUN Q S, et al.Determination of 3 bio active alkaloids in the Chinese drug pericarpium papaveris by HPLC and HPCE[J].Acta Pharmaceutica Sinica, 2000, 35(4):289-293. [4] 夏环, 王妍, 荆涛, 等.分子印迹固相萃取-高效液相色谱法测定蜂蜜中三种氟喹诺酮类抗生素残留[J].分析科学学报, 2012, 28(3):297-302. XIA H, WANG Y, JING T, et al.Determination of three fluoroquinolones antibiotics residue in honey using molecularly imprinted solid-phase extraction coupled with high performance liquid chromatography[J].Journal of Analytical Science, 2012, 28(3):297-302. [5] 李艳, 郭小桢, 陆艺炜, 等.磁固相萃取-气相色谱联用法测定火锅底料中的罂粟碱[J].山东化工, 2017, 46(16):73-75. LI Y, GUO X Z, LU Y W, et al.Determination of papaverine in hot pot sample by magnetic solid phase extraction/gas chromatography[J].Shandong Chemical Industry, 2017, 46(16):73-75. [6] 沈平, 谢朝梅, 谢燕湘, 等.GC-MS法直接测定食品中罂粟壳提取物的残留量[J].中国卫生检验杂志, 2015, 25(20):3 466-3 468. SHEN P, XIE C M, XIE Y X, et al.Direct determination of residues of poppy shell extracts in food by GC-MS[J].Chinese Journal of Health Laboratory Technology, 2015, 25(20):3 466-3 468. [7] 杨洁, 王智, 张辉珍, 等.液相色谱-质谱法测定火锅汤料中的罂粟碱[J].食品科学, 2014, 35(22):243-246. YANG J, WANG Z, ZHANG H Z, et al.Determination of papaverine and other alkaloids in hot pot soup seasoning by HPLC-MS-MS[J].Food Science, 2014, 35(22):243-246. [8] 王力清, 郦明浩, 李锦清, 等.超高效液相色谱-串联质谱法高通量快速测定调料中罂粟壳生物碱含量[J].食品与发酵工业, 2012, 38(8):168-172. WANG L Q, LI M H, LI J Q, et al.High throughput determination of alkaloids papaveris in seasonings by ultra performance liquid chromatography-tandem mass spectrometry[J].Food and Fermentation Industries, 2012, 38(8):168-172. [9] 郭黎明, 朱奎, 江海洋, 等.超高效液相色谱-串联质谱法同时测定鸡肝中残留的四环素类、磺胺类和喹诺酮类药物[J].色谱, 2009, 27(4):412-416. GUO L M, ZHU K, JIANG H Y, et al.Simultaneous determination of tetracyclines, sulfonamides and quinolones residues in chicken livers by ultra performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2009, 27(4):412-416. [10] 韩合敬, 魏秀丽, 郝智慧, 等.超高效液相色谱-串联质谱法测定中兽药散剂中4种喹诺酮药物[J].黑龙江畜牧兽医, 2017(1):282-283;285. HAN H J, WEI X L, HAO Z H, et al.Determination of four quinolone drugs in veterinary traditional Chinese medicine powders by ultra performance liquid chromatography-tandem mass spectrometry[J].Heilongjiang Animal Science and Veterinary Medicine, 2017(1):282-283;285. [11] 姚倩钰, 贺德春, 龚道新, 等.高效液相色谱-串联质谱法测定废水中5种喹诺酮类抗生素[J].中国环境监测, 2017, 33(3):139-146. YAO Q Y, HE D C, GONG D X, et al.Determination of five fluoroquinolone antibiotics in wastewater by high performance liquid chromatography-tandem mass spectrometry[J].Environmental Monitoring in China, 2017, 33(3):139-146. [12] 尹燕敏, 沈颖青, 朱月芳, 等.超高效液相色谱-串联质谱法同时测定水和沉积物中磺胺类、喹诺酮类和氯霉素类抗生素残留[J].分析科学学报, 2015, 31(2):228-232. YIN Y M, SHEN Y Q, ZHU Y F, et al.Simultaneous determination of sulfonamides, quinolones and chloramphenicols in water and sediment samples by ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Analytical Science, 2015, 31(2):228-232. [13] CAO G Z, ZHAN J, SHI X Z, et al.Analysis of 140 veterinary drugs and other contaminants in poultry muscle by ultrahigh-performance liquid chromatography-tandem mass spectrometry[J].Chromatographia, 2018, 81(4):707-718. [14] 刘柏林, 谢继安, 赵紫微, 等.超高压液相色谱-电喷雾串联四极杆质谱内标法同时测定禽类食品中11种喹诺酮类药物[J].中国食品卫生杂志, 2017, 29(3):316-321. LIU B L, XIE J A, ZHAO Z W, et al.Simultaneous determination of eleven quinolones drug residues in poultry products by ultra performance liquid chromatography-electrospray ionization tandem quadrupole mass spectrometry with isotope-labelled internal standards[J].Chinese Journal of Food Hygiene, 2017, 29(3):316-321. [15] 冯月超, 王颖, 王建凤, 等.液质联用法同时测定火锅调料中15种喹诺酮类抗生素[J].分析试验室, 2016, 35(8):924-927. FENG Y C, WANG Y, WANG J F, et al.Simultaneous determination of 15 quinolones in Chinese hotpot ingredient by high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2016, 35(8):924-927. [16] 曹鹏, 牟妍, 高飞, 等.分散固相萃取-超高效液相色谱-串联质谱法同时检测火锅食材中11种喹诺酮类药物[J].色谱, 2013, 31(9):862-868. CAO P, MOU Y, GAO F, et al.Simultaneous determination of 11 quinolones in hotpot ingredients by dispersive solid-phase extraction and ultra performance liquid chromatographytandem mass spectrometry[J].Chinese Journal of Chromatography, 2013, 31(9):862-868. [17] 马凯, 蔡芳叶, 黄永桥, 等.超高效液相色谱-串联质谱法检测蜂蜜中九种氨基糖苷类药物残留[J].食品与发酵工业, 2020, 46(18):203-208. MA K, CAI F Y, HUANG Y Q, et al.Detection of nine aminoglycosides residues in honey by ultra-performance liquid chromatography-tandem mass spectrometry[J].Food and Fermentation Industries, 2020, 46(18):203-208. [18] 李航, 贺亚玲, 陈小泉, 等.QuEChERS/UPLC-MS测定火锅调料中罂粟壳(粉)的研究[J].食品与药品, 2014, 16(4):284-287. LI H, HE Y L, CHEN X Q, et al.Determination of shells and powder of Papaver somniferum L.in chafing dish seasoning by ultra performance liquid chromatography-tandem mass spectrometry via QuEChERS[J].Food and Drug, 2014, 16(4):284-287.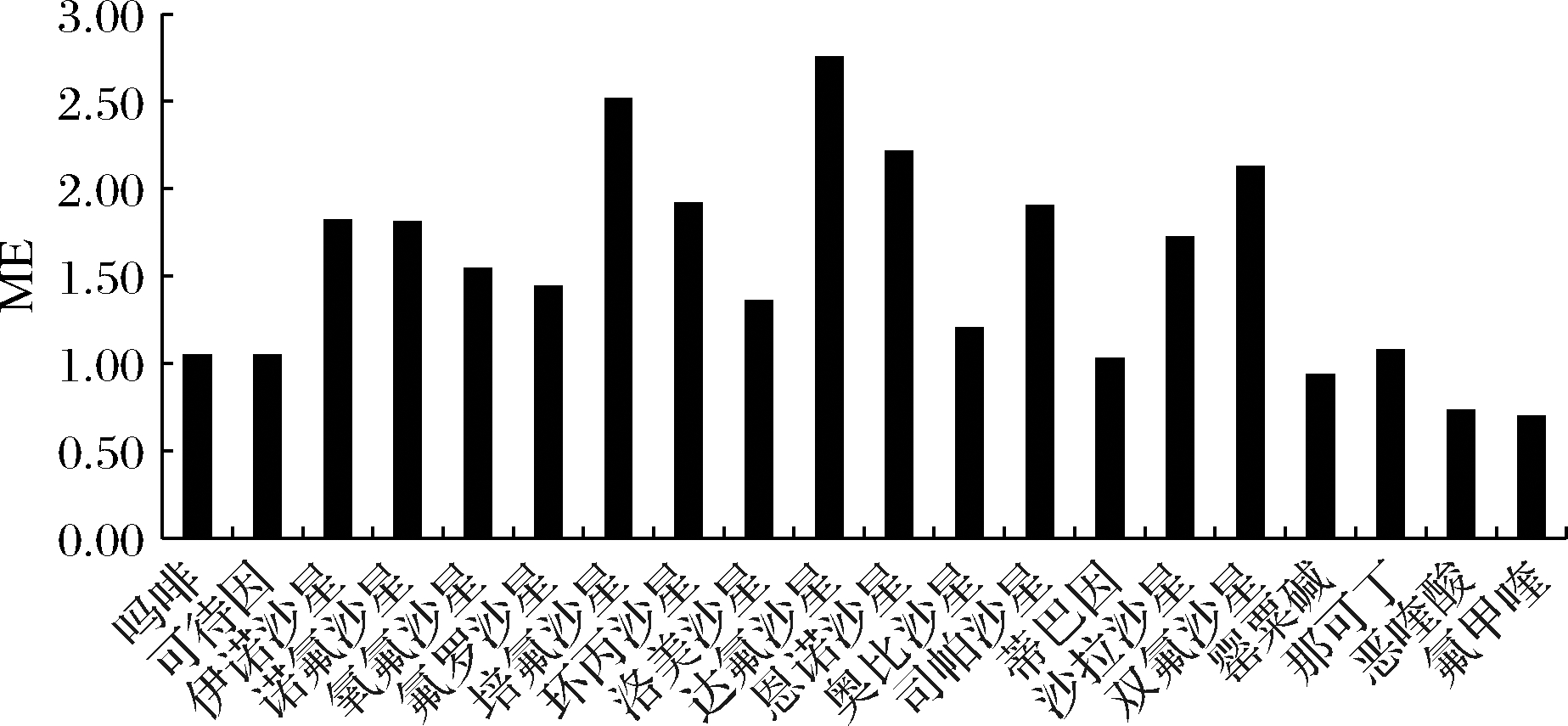
Fig.3 Matrix effects of the compounds under optimum purification conditions2.4 线性范围与检出限
Table 2 Linear ranges, linear regression equations, correlation coefficients and LODs of the compounds

2.5 方法回收率与精密度
Table 3 Recoveries and repeatabilities of the compounds spiked at three levels (n=6)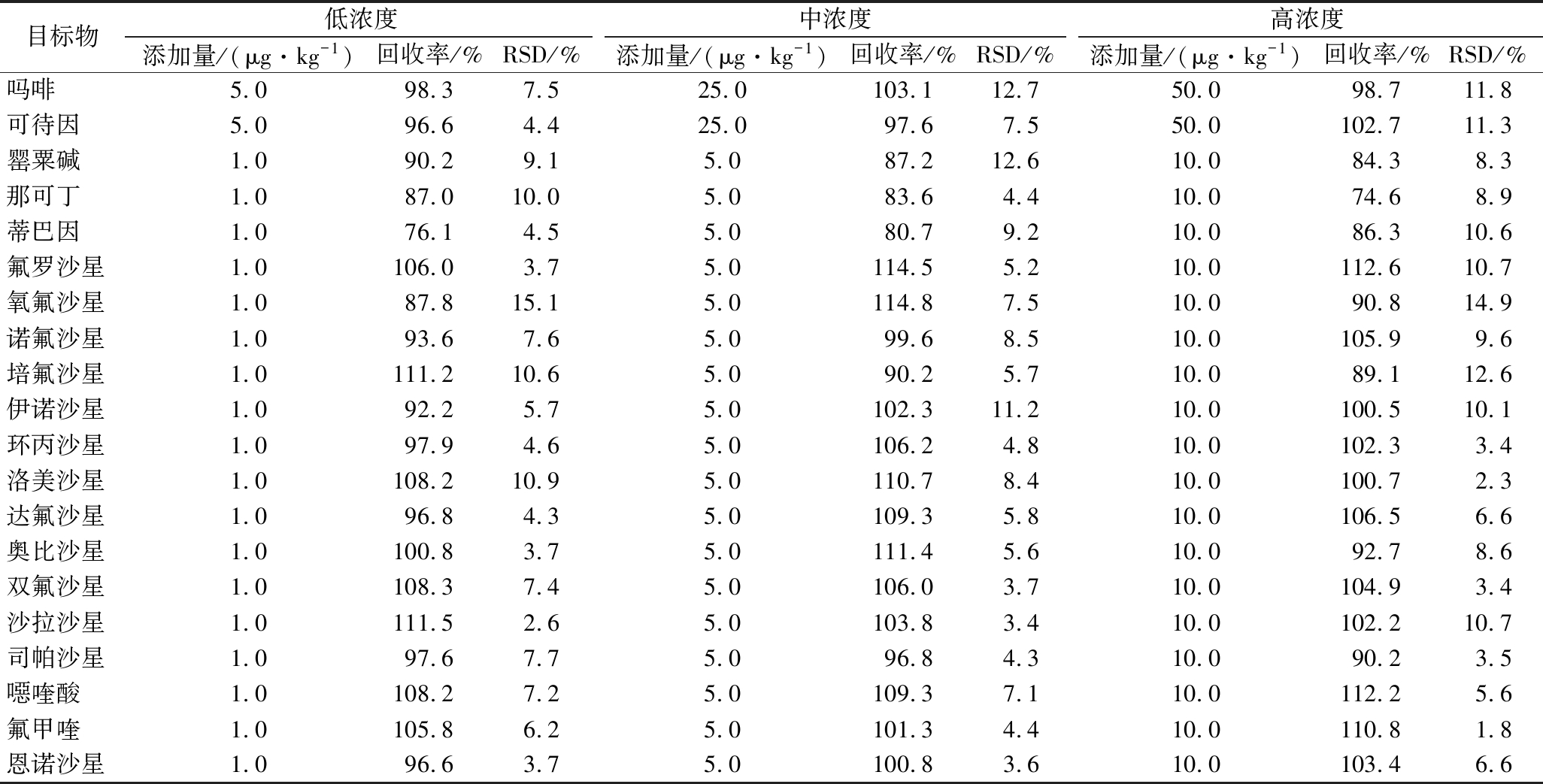
2.6 实际样品测定结果
Table 4 Results of the compounds in different kinds of hotpot food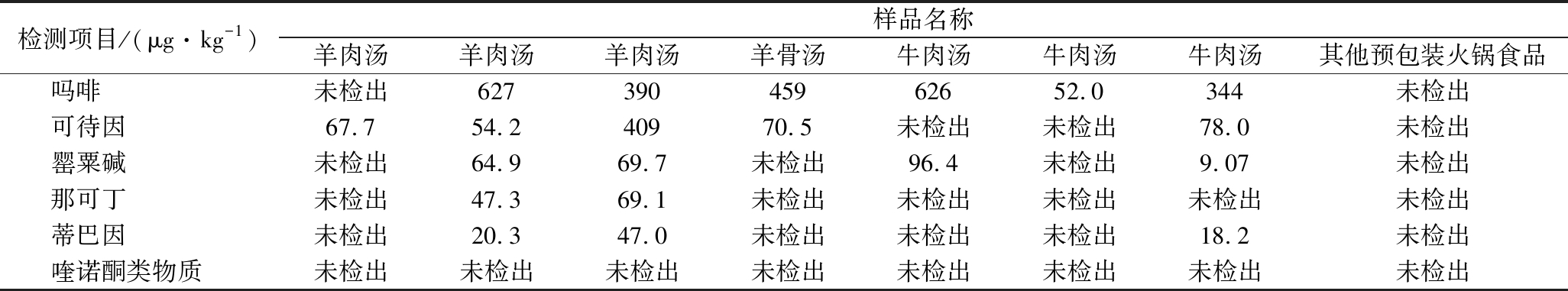
3 结论