据统计,人的一生中约有1/3的时间处于睡眠状态。睡眠是生物体的基本功能,对维持正常生理活动具有十分重要的作用。高质量的睡眠不仅有助于提高生活质量,而且在缓解疲劳、恢复体力、修复神经元、巩固记忆、维持代谢稳态等方面发挥着不可忽视的作用[1]。不同年龄段人群对睡眠时间的需求各不相同,正常成年人的正常睡眠时间大约在7~8 h[2]。研究表明,良好的睡眠可以降低某些慢性疾病的发病率;反之,睡眠不足则影响多种生理功能,例如认知、情绪、免疫、生殖功能等[3]。
1 失眠导致的公共卫生问题
失眠,是一种不容易自然地进入睡眠状态的症状,以难以入睡或是无法维持睡眠为主要特征,在临床上,持续3个月具有夜间入睡困难、睡眠时间减少、日间嗜睡、注意力和记忆力下降等症状可被诊断为失眠。据世界卫生组织调查表明,全球睡眠障碍发病率达到27%,其中失眠问题占据最主要因素[4]。新型冠状病毒肺炎全球大流行爆发以来,世界各国的失眠问题进一步恶化。张帆等[5]调查发现,在新型冠状病毒肺炎大规模爆发后的第一阶段,约44.1%的中国人存在睡眠障碍;有过隔离史的人比未参与隔离的人睡眠障碍的发病率高约7%[6]。在2020年前5个月,美国在谷歌搜索引擎上“失眠”的搜索量比前3年同期增加了58%[7]。2020年希腊的一项调查表明,37.6%的被调查者存在睡眠问题,远高于疫情前的失眠患病率[8]。此外,部分失眠患者的失眠症状持续加强,继而引发了多种并发症,例如抑郁症、阿尔兹海默症、糖尿病、心血管疾病等,这给世界公共卫生体系和人类生命质量带来了巨大的挑战[9-10]。
2 失眠的病理学机制及其治疗策略
2.1 失眠的病理学机制
临床上将失眠分为原发性失眠和继发性失眠。继发性失眠是由包括躯体疾病、精神障碍、药物滥用、睡眠呼吸紊乱等引起的失眠;原发性失眠的诊断缺乏特异性指标,主要是一种排除性诊断[11]。目前,关于失眠的发病机制并不清晰,但科学家普遍认为其是一个受多因素影响的慢性疾病。现有的关于失眠的病理学机制主要包括以下几个方面(图1):
2.1.1 神经递质系统紊乱
神经递质的合成和分泌功能紊乱是引起失眠的重要原因之一,包括褪黑素(melatonin, MT),5-羟色胺(5-hydroxytryptamine, 5-HT),γ-氨基丁酸(γ-aminobutyric acid, GABA)以及去甲肾上腺素(norepinephrine, NE)等[12]。MT是由色氨酸合成的抑制性神经递质,是人体内调控睡眠和觉醒的重要物质之一,其主要通过激活2种高亲和力G蛋白偶联受体MT1和MT2来调节睡眠和觉醒;人体内MT合成和分泌的失调是导致失眠的重要原因之一[12]。作为MT形成的重要前体物质,5-HT与人体昼夜节律和睡眠障碍等密切相关,通过与脑内5-HT1A受体、5-HT2受体作用或轻度激动5-HT1A受体或拮抗5-HT2受体均可增加深睡眠,并且两者之间具有协同作用[13]。GABA是大脑中重要的抑制性神经递质,主要功能为维持脑内兴奋和抑制的平衡,其在大脑内合成不足,则会引起脑内抑制功能不足,出现持续兴奋,进而引起失眠[14]。
2.1.2 “下丘脑-垂体-肾上腺轴”系统紊乱
下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴,是神经内分泌系统的重要组成部分,在调节人体免疫系统、心情、情绪以及昼夜节律等方面具有重要作用[15]。睡眠,尤其是深度睡眠,对HPA轴的活动具有抑制作用,而当促肾上腺皮质激素和皮质醇分泌增加,HPA轴被激活则可导致觉醒和失眠[16]。除HPA轴被过度激活引起失眠症状的发生外,HPA轴与机体内炎症因子的相互作用也是导致失眠发生发展的重要诱因,如慢性疾病、睡眠呼吸障碍、嗜睡等导致的体内炎症因子过度表达会引起HPA轴功能紊乱,而HPA轴的进一步紊乱又会反作用于与炎症相关的睡眠障碍[17]。由于HPA轴在神经系统中的重要作用,其功能的紊乱还会引起多种神经系统疾病的发生,这些HPA轴相关疾病,会促进失眠等睡眠障碍问题的加剧。
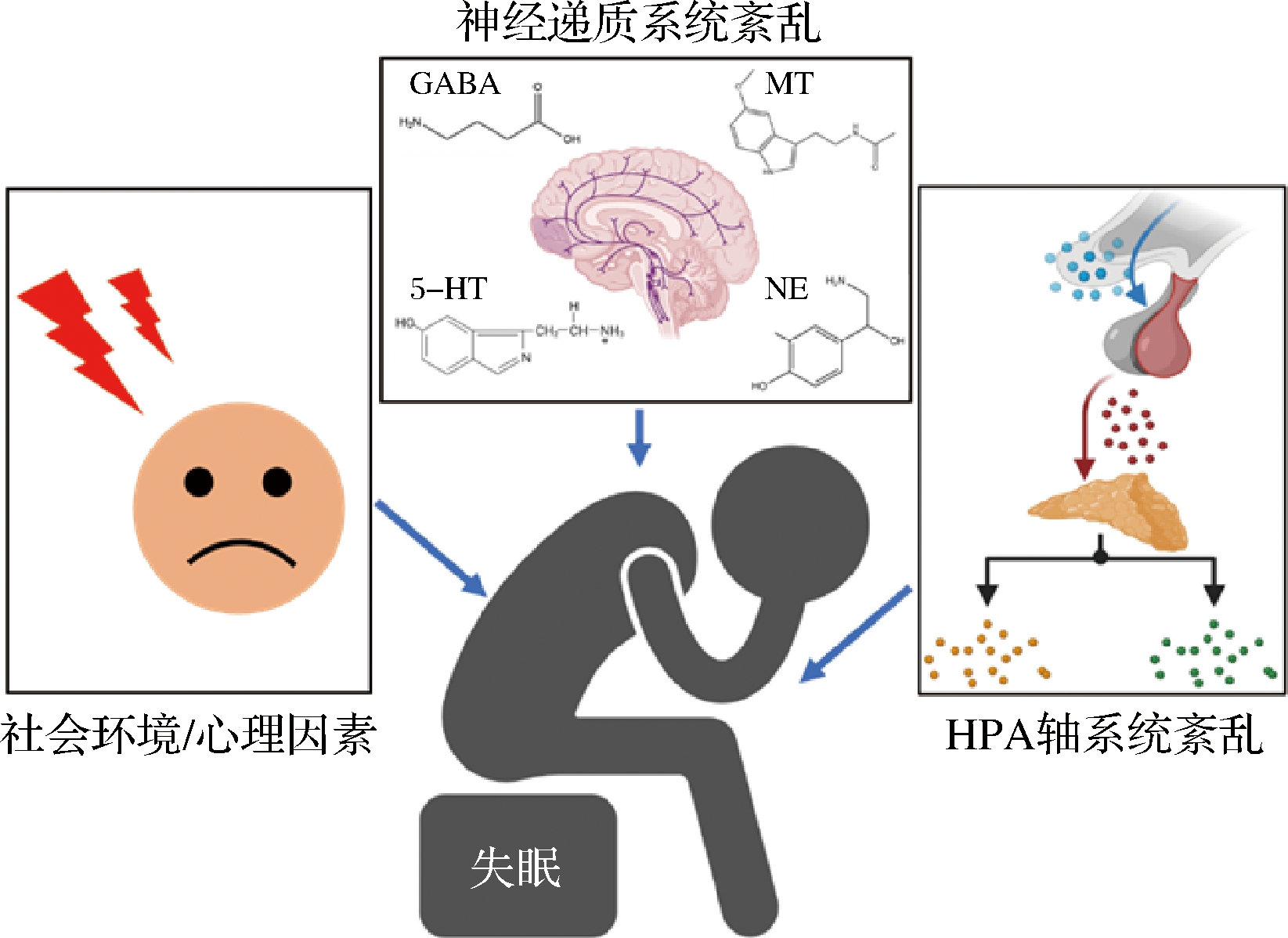
图1 失眠的病理学机制
Fig.1 Pathological mechanism of insomnia
2.1.3 社会环境与心理因素
除生理上导致的失眠外,外界社会环境和心理因素也是导致失眠的重要因素,如压力、焦虑、环境变化以及饮食方式等[18]。当一个人长时间处于压力状态下,更容易引起抑郁,焦虑等心理疾病的发生,这些心理问题会进一步促进失眠和其他睡眠问题的出现[19]。人的睡眠质量容易受到外界环境的影响,环境噪声过大、光照刺激过强、温度不适宜、环境的熟悉程度等因素都会使人入睡困难、睡眠易中断,从而导致失眠;日常饮食也是引起失眠的重要非直接因素之一,如咖啡因和茶多酚不耐受的人群,过度摄入咖啡因、茶多酚等对神经系统具有刺激性的膳食因子会导致失眠的发生,但是这种暂时性的失眠可受个人行为的调节[20]。
2.2 失眠的治疗手段
2.2.1 化学药物治疗
目前,化学药物是临床上治疗失眠的主要手段之一。如苯二氮卓类药物和Z-药物(唑吡坦、佐匹克隆和扎莱普隆),主要通过作用于GABA途径调节失眠患者的睡眠质量;阿莫美拉汀、延缓释放的MT等主要作用于MT和食欲素神经元途径,促进入睡或提高睡眠深度;组胺和5-HT受体拮抗剂等则直接作用于5-HT途径[21]。虽然化学药物的治疗具有价格低、效果快的特点,并取得了一定的治疗效果,但其副作用同样令人担忧。尤其是患者长期服用,在产生依赖性和耐受性的同时,造成一些神经损伤,一旦停止使用,可能会产生戒断反应,或对服用者的精神状态造成损伤[22]。因此寻找一种高效、低毒副作用的失眠治疗方法迫在眉睫。
2.2.2 非药物治疗
除直接采用化学药物治疗外,非药物治疗也是一种有效治疗失眠的手段,包括改善睡眠习惯、睡眠环境和心理疏导等[23]。此外,传统中医治疗,如针灸、穴位法以及中药熏香等对部分失眠患者同样展示出显著的治疗效果[24]。非药物治疗虽然取得了一定的治疗效果,但是存在治疗效果不稳定、个体差异大、治愈率低等缺点,且极容易受到外界干扰、易反复。
3 靶向肠道菌群改善失眠的理论探索及应用前景
3.1 肠道微生物调控睡眠的途径及机制
近年来大量研究发现,肠道菌群失调与睡眠障碍之间存在强相关性[25]。2016年一项研究表明,睡眠中断导致的昼夜节律紊乱显著地改变了小鼠的肠道菌群组成[26]。昼夜节律也称为生物钟,是由宿主建立以适应环境中的明暗循环,以24 h为周期波动变化,对人体生理稳态和健康至关重要;而睡眠与昼夜节律紧密联系,昼夜节律的紊乱会引起失眠、睡眠碎片化等睡眠问题[27]。持续4周的广谱抗生素治疗在剥夺小鼠肠道菌群的同时,也显著减少了小鼠非快速眼动(non-rapid eye movement, NREM)睡眠的时间,而快速眼动(rapid eye movement, REM)睡眠时间增多;这表明,肠道菌群的改变也能影响睡眠的质量。进一步的分析表明,这种现象与肠道菌群代谢产物中神经传递相关的氨基酸和维生素代谢异常存在显著相关性[28]。临床研究中也发现了类似的现象。失眠患者的肠道菌群多样性、厌氧菌和短链脂肪酸(short chain fatty acid, SCFA)产生菌的丰度显著低于健康人群;其特征菌属Lachnospira和Bacteroides的丰度与血清中IL-1β的水平呈显著正相关[29]。另一项基于婴儿的队列分析表明,肠道菌群产生的SCFA含量(尤其是丙酸)与婴儿睡眠时间存在正相关性[30]。值得注意的是,一项针对肠易激综合征(irritable bowel syndrome, IBS)患者的粪菌移植研究发现,移植了健康人粪便的IBS患者,其抑郁样/焦虑症状得到显著缓解的同时,睡眠质量也显著提高[31]。尽管以上报道的证据无法证明睡眠问题和肠道菌群组成之间的因果关系,但不可否认的是,肠道菌群可能是参与调控睡眠的一个重要靶点。
伴随着菌群-肠-脑轴理论的成熟,肠道微生物被证明可能通过以下几种机制与大脑进行交流,从而调控睡眠功能。(1)调节血清素系统:血清素(及其代谢产物MT)是生物体REM睡眠所必需的神经递质,而肠道是人体产生血清素的最主要场所。肠道微生物的存在是肠道血清素合成的必要条件,更是调控外周-中枢血清素转运系统的关键因素[32];(2)调节迷走神经和免疫系统:迷走神经是肠道微生物与中枢神经系统进行直接信号交流的最重要的神经。研究表明,迷走神经阻断术能够消除小鼠由于睡眠剥夺导致的全身性炎症,这表明迷走神经激活参与睡眠及睡眠障碍伴随的免疫功能异常[33];(3)调节血脑屏障:研究表明,连续10 d的睡眠剥夺导致大鼠血脑屏障通透性升高,而恢复睡眠后这种症状减轻[34]。已有证据表明,肠道菌群及其代谢产物(主要是乙酸)对血脑屏障的形成和维持至关重要[35];这表明肠道微生物可能通过调节血脑屏障间接地对睡眠功能发挥作用;(4)产生功能性代谢产物:肠道微生物能够产生多种功能性代谢物,例如5-HT、GABA、SCFA等。这些代谢物不仅直接作用于肠道神经系统或迷走神经,还能通过在循环系统中的波动水平,对宿主的生物节律发挥直接作用。SATEIA等[36]发现慢性抗生素治疗小鼠肠道中抑制性神经递质甘氨酸和GABA增加,其睡眠/觉醒周期也显著改变,但目前关于口服GABA调控睡眠的证据尚不充足。肠道微生物和睡眠沟通机制与途径总结如图2所示。
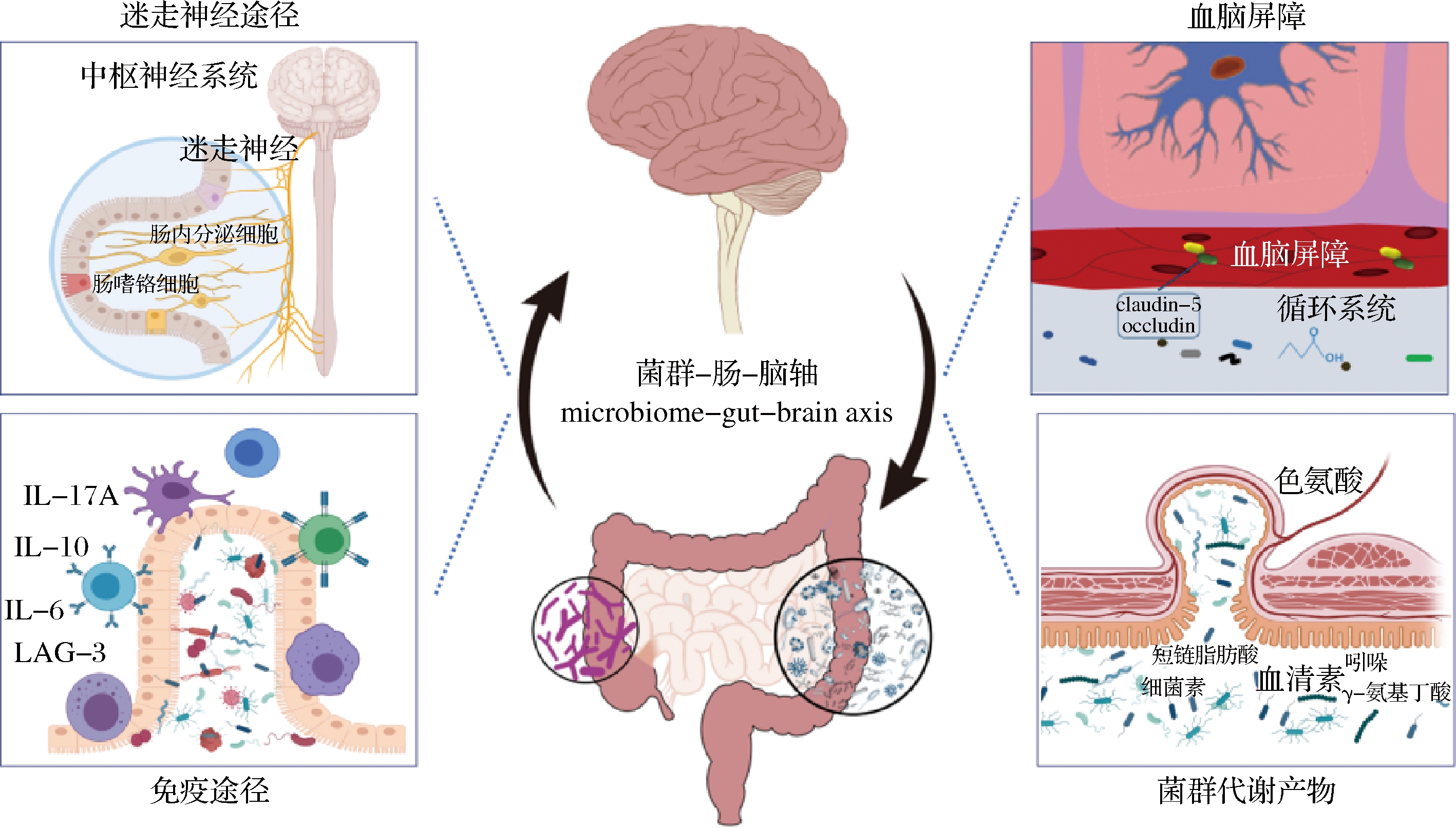
图2 肠道微生物调控睡眠的可能机制和途径
Fig.2 Possible mechanisms and pathways by which gut microbes regulate sleep
3.2 膳食策略改善失眠的应用总结
由上文可见,失眠与肠道菌群有着紧密联系。因此,调节肠道菌群可能是治疗失眠的一种潜在策略。近年来,科学家们也开始了应用膳食手段改善失眠的探索,其中最主要的代表为益生菌[25]。益生菌改善失眠的主要途径包括:(1)直接改变肠道微生物菌群的丰度和物种多样性,恢复失眠障碍引起的肠道微生物群紊乱,进而通过恢复肠道菌群稳态,发挥调节失眠的生物学作用;(2)通过调节肠道中某些特殊菌群的功能,如分泌SCFAs、代谢胆汁酸盐等方式间接调节肠-脑轴功能,进而改善失眠患者的症状。除益生菌外,其他膳食因子也具有改善睡眠质量和调节睡眠障碍的生理作用,如功能性蛋白质、不饱和脂肪酸、氨基酸等。目前关于膳食模式(例如高蛋白饮食、高纤维饮食等)与睡眠功能相关性的研究十分匮乏,这也为后续膳食营养学研究提供了新的思路。有助于改善睡眠的膳食因子的作用效果和具体机制总结如表1所示。
表1 膳食因子调节睡眠的作用与潜在机制
Table 1 Effect of nutritional factors on regulating the sleep and its potential mechanisms
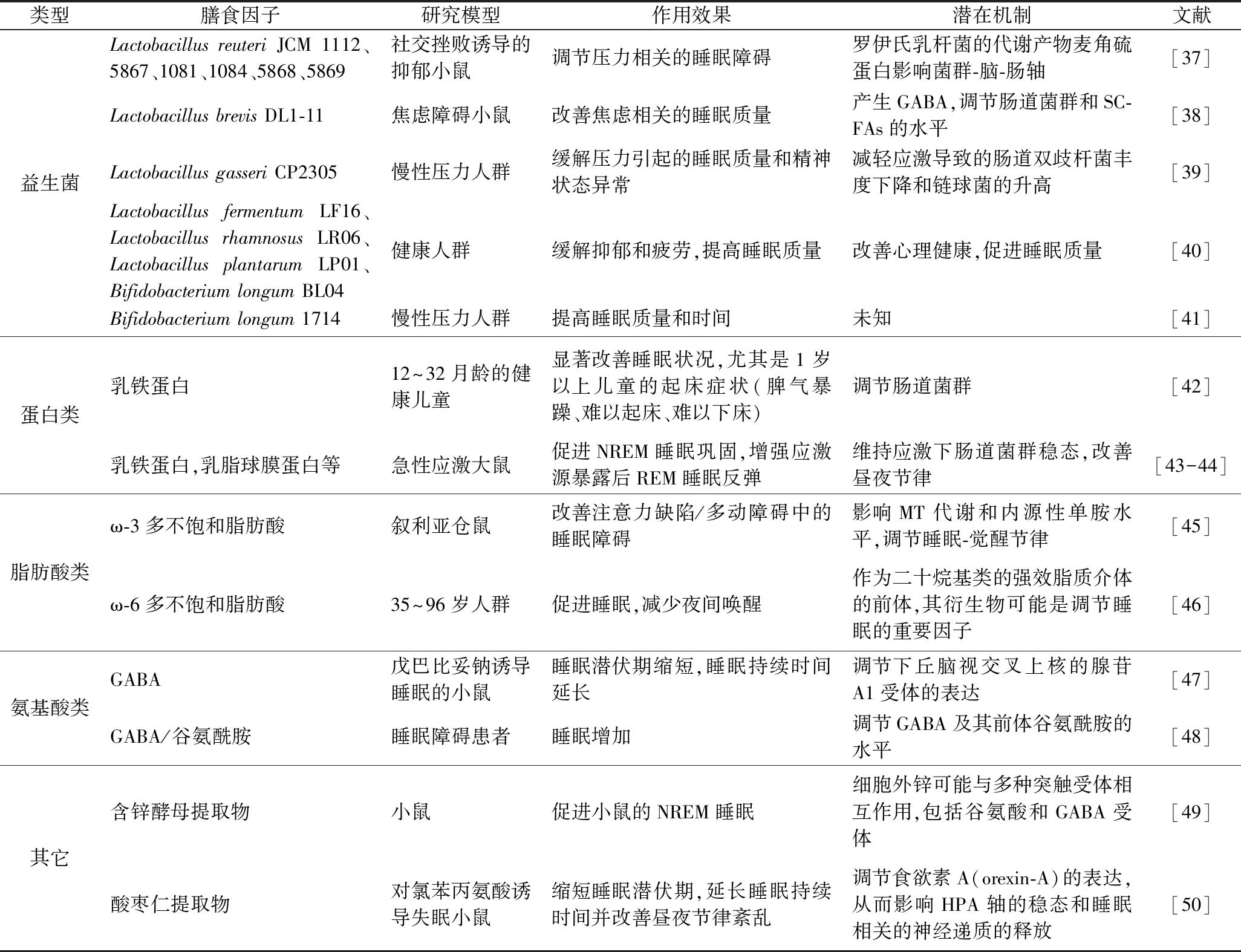
类型膳食因子研究模型作用效果潜在机制文献益生菌Lactobacillus reuteri JCM 1112、5867、1081、1084、5868、5869社交挫败诱导的抑郁小鼠调节压力相关的睡眠障碍罗伊氏乳杆菌的代谢产物麦角硫蛋白影响菌群-脑-肠轴[37]Lactobacillus brevis DL1-11焦虑障碍小鼠改善焦虑相关的睡眠质量产生GABA,调节肠道菌群和SC-FAs的水平[38]Lactobacillus gasseri CP2305慢性压力人群缓解压力引起的睡眠质量和精神状态异常减轻应激导致的肠道双歧杆菌丰度下降和链球菌的升高[39]Lactobacillus fermentum LF16、Lactobacillus rhamnosus LR06、Lactobacillus plantarum LP01、Bifidobacterium longum BL04健康人群缓解抑郁和疲劳,提高睡眠质量改善心理健康,促进睡眠质量[40]Bifidobacterium longum 1714慢性压力人群提高睡眠质量和时间未知[41]蛋白类乳铁蛋白12~32月龄的健康儿童显著改善睡眠状况,尤其是1岁以上儿童的起床症状(脾气暴躁、难以起床、难以下床)调节肠道菌群[42]乳铁蛋白,乳脂球膜蛋白等急性应激大鼠促进NREM睡眠巩固,增强应激源暴露后REM睡眠反弹维持应激下肠道菌群稳态,改善昼夜节律[43-44]脂肪酸类ω-3多不饱和脂肪酸叙利亚仓鼠改善注意力缺陷/多动障碍中的睡眠障碍影响MT代谢和内源性单胺水平,调节睡眠-觉醒节律[45]ω-6多不饱和脂肪酸35~96岁人群促进睡眠,减少夜间唤醒作为二十烷基类的强效脂质介体的前体,其衍生物可能是调节睡眠的重要因子[46]氨基酸类GABA戊巴比妥钠诱导睡眠的小鼠睡眠潜伏期缩短,睡眠持续时间延长调节下丘脑视交叉上核的腺苷A1受体的表达[47]GABA/谷氨酰胺睡眠障碍患者睡眠增加调节GABA及其前体谷氨酰胺的水平[48]其它含锌酵母提取物小鼠促进小鼠的NREM睡眠细胞外锌可能与多种突触受体相互作用,包括谷氨酸和GABA受体[49]酸枣仁提取物对氯苯丙氨酸诱导失眠小鼠缩短睡眠潜伏期,延长睡眠持续时间并改善昼夜节律紊乱调节食欲素A(orexin-A)的表达,从而影响HPA轴的稳态和睡眠相关的神经递质的释放[50]
4 总结和展望
菌群-肠-脑轴作为中枢神经和肠神经之间的双向信息交互系统,对于人体的许多生理功能调控起重要作用。肠道微生物通过迷走神经传入、免疫和微生物代谢产物等途径作用于中枢神经系统,肠道菌群紊乱则会引发焦虑、抑郁、睡眠障碍等问题。同时,失眠与失眠并发症会反作用于肠道神经系统,导致肠道菌群紊乱,形成恶性循环,从而进一步加深失眠问题。肠道菌群与睡眠障碍两者间的相关研究表明,维持肠道菌群稳态是改善失眠问题的关键。通过益生菌等膳食策略,能够调节菌群-肠-脑轴,达到改善失眠的目的。膳食治疗建立在对肠道微生物与中枢神经系统的深入研究上,作为一种安全、有效、无副作用的治疗手段,在未来对于治疗失眠问题和多种失眠并发症均有重要意义。
[1] HUDSON A N, VAN DONGEN H P A, HONN K A.Sleep deprivation, vigilant attention, and brain function:A review[J].Neuropsychopharmacology, 2020, 45(1):21-30.
[2] CHAPUT J P, WONG S L, MICHAUD I.Duration and quality of sleep among Canadians aged 18 to 79[J].Health Reports, 2017, 28(9):28-33.
[3] PAVLOVA M K, LATREILLE V.Sleep disorders[J].The American Journal of Medicine, 2019, 132(3):292-299.
[4] BOLLU P C, KAUR H.Sleep medicine:Insomnia and sleep[J].Missouri Medicine, 2019, 116(1):68-75.
[5] ZHANG F, SHANG Z L, MA H Y, et al.Epidemic area contact history and sleep quality associated with posttraumatic stress symptoms in the first phase of COVID-19 outbreak in China[J].Scientific Reports, 2020, 10:22463.
[6] WANG Y H, SHI L, QUE J Y, et al.The impact of quarantine on mental health status among general population in China during the COVID-19 pandemic[J].Molecular Psychiatry, 2021, 26(9):4 813-4 822.
[7] ZITTING K M, LAMMERS-VAN DER HOLST H M L V, YUAN R K, et al.Google trends reveals increases in Internet searches for insomnia during the 2019 coronavirus disease (COVID-19) global pandemic[J].Journal of Clinical Sleep Medicine:JCSM:Official Publication of the American Academy of Sleep Medicine, 2021, 17(2):177-184.
[8] VOITSIDIS P, GLIATAS I, BAIRACHTARI V, et al.Insomnia during the COVID-19 pandemic in a Greek population[J].Psychiatry Research, 2020, 289:113076.
[9] HERTENSTEIN E, FEIGE B, GMEINER T, et al.Insomnia as a predictor of mental disorders:A systematic review and meta-analysis[J].Sleep Medicine Reviews, 2019, 43:96-105.
[10] GREEN M J, ESPIE C A, POPHAM F, et al.Insomnia symptoms as a cause of type 2 diabetes Incidence:A 20 year cohort study[J].BMC Psychiatry, 2017, 17(1):94.
[11] 王玥, 朱国行.慢性原发性失眠的临床特点[J].中国临床神经科学, 2011, 19(6):601-605.
WANG Y, ZHU G X.The clinical characteristics of chronic primary insomnia in China[J].Chinese Journal of Clinical Neurosciences, 2011, 19(6):601-605.
[12] ZHANG R, YANG Y S, LIU X C, et al.Correlation study of basic Chinese medicine syndromes and neurotransmitter levels in patients with primary insomnia[J].Chinese Journal of Integrative Medicine, 2016,2016:27.
[13] MONTI J M.Serotonin control of sleep-wake behavior[J].Sleep Medicine Reviews, 2011, 15(4):269-281.
[14] PLANTE D T, JENSEN J E, WINKELMAN J W.The role of GABA in primary insomnia[J].Sleep, 2012, 35(6):741-742.
[15] VARGAS I, LOPEZ-DURAN N.Investigating the effect of acute sleep deprivation on hypothalamic-pituitary-adrenal-axis response to a psychosocial stressor[J].Psychoneuroendocrinology, 2017, 79:1-8.
[16] OTTE C, LENOCI M, METZLER T, et al.Hypothalamic-pituitary-adrenal axis activity and sleep in posttraumatic stress disorder[J].Neuropsychopharmacology, 2005, 30(6):1 173-1 180.
[17] IRWIN M R.Sleep and inflammation:Partners in sickness and in health[J].Nature Reviews Immunology, 2019, 19(11):702-715.
[18] LEE S Y, WUERTZ C, ROGERS R, et al.Stress and sleep disturbances in female college students[J].American Journal of Health Behavior, 2013, 37(6):851-858.
[19] ZHAO M X, TUO H Z, WANG S H, et al.The effects of dietary nutrition on sleep and sleep disorders[J].Mediators of Inflammation, 2020, 2020:3142874.
[20] IRWIN C, KHALESI S, DESBROW B, et al.Effects of acute caffeine consumption following sleep loss on cognitive, physical, occupational and driving performance:A systematic review and meta-analysis[J].Neuroscience & Biobehavioral Reviews, 2020, 108:877-888.
[21] ZHOU E S, GARDINER P, BERTISCH S M.Integrative medicine for insomnia[J].The Medical Clinics of North America, 2017, 101(5):865-879.
[22] ATKIN T, COMAI S, GOBBI G.Drugs for insomnia beyond benzodiazepines:Pharmacology, clinical applications, and discovery[J].Pharmacological Reviews, 2018, 70(2):197-245.
[23] CUNNINGTON D, JUNGE M F, FERNANDO A T.Insomnia:Prevalence, consequences and effective treatment[J].Medical Journal of Australia, 2013, 199:S36-S40.
[24] 于臻, 边新娜, 韩文文, 等.失眠的中医证治研究进展[J].西部中医药, 2020, 33(1):151-154.
YU Z, BIAN X N, HAN W W, et al.Research progress on TCM syndrome and treatment for insomnia[J].Western Journal of Traditional Chinese Medicine, 2020, 33(1):151-154.
[25] SEN P, MOLINERO-PEREZ A, O’RIORDAN K J, et al.Microbiota and sleep:Awakening the gut feeling[J].Trends in Molecular Medicine, 2021, 27(10):935-945.
[26] VOIGT R M, SUMMA K C, FORSYTH C B, et al.The circadian clock mutation promotes intestinal dysbiosis[J].Alcoholism:Clinical and Experimental Research, 2016, 40(2):335-347.
[27] ROENNEBERG T, MERROW M.The circadian clock and human health[J].Current Biology, 2016, 26(10):R432-R443.
[28] OGAWA Y, MIYOSHI C, OBANA N, et al.Gut microbiota depletion by chronic antibiotic treatment alters the sleep/wake architecture and sleep EEG power spectra in mice[J].Scientific Reports, 2020, 10:19554.
[29] LI Y Y, ZHANG B, ZHOU Y, et al.Gut microbiota changes and their relationship with inflammation in patients with acute and chronic insomnia[J].Nature and Science of Sleep, 2020, 12:895-905.
[30] HEATH A L M, HASZARD J J, GALLAND B C, et al.Association between the faecal short-chain fatty acid propionate and infant sleep[J].European Journal of Clinical Nutrition, 2020, 74(9):1 362-1 365.
[31] KUROKAWA S, KISHIMOTO T, MIZUNO S, et al.The effect of fecal microbiota transplantation on psychiatric symptoms among patients with irritable bowel syndrome, functional diarrhea and functional constipation:An open-label observational study[J].Journal of Affective Disorders, 2018, 235:506-512.
[32] YANO J M, YU K, DONALDSON G P, et al.Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J].Cell, 2015, 161(2):264-276.
[33] ZHANG Y J, XIE B, CHEN X Y, et al.A key role of gut microbiota-vagus nerve/spleen axis in sleep deprivation-mediated aggravation of systemic inflammation after LPS administration[J].Life Sciences, 2021, 265:118736.
[34] G MEZ-GONZ
MEZ-GONZ LEZ B, HURTADO-ALVARADO G, ESQUEDA-LE
LEZ B, HURTADO-ALVARADO G, ESQUEDA-LE N E, et al.REM sleep loss and recovery regulates blood-brain barrier function[J].Current Neurovascular Research, 2013, 10(3):197-207.
N E, et al.REM sleep loss and recovery regulates blood-brain barrier function[J].Current Neurovascular Research, 2013, 10(3):197-207.
[35] BRANISTE V, AL-ASMAKH M, KOWAL C, et al. The gut microbiota influences blood-brain barrier permeability in mice[J]. Science Translational Medicine, 2014, 6(263): 158-170.
[36] SATEIA M J, BUYSSE D J, KRYSTAL A D, et al.Clinical practice guideline for the pharmacologic treatment of chronic insomnia in adults:An American academy of sleep medicine clinical practice guideline[J].Journal of Clinical Sleep Medicine:JCSM:Official Publication of the American Academy of Sleep Medicine, 2017, 13(2):307-349.
[37] MATSUDA Y, OZAWA N, SHINOZAKI T, et al.Ergothioneine, a metabolite of the gut bacterium Lactobacillus reuteri, protects against stress-induced sleep disturbances[J].Translational Psychiatry, 2020, 10:170.
[38] YU L L, HAN X, CEN S, et al.Beneficial effect of GABA-rich fermented milk on insomnia involving regulation of gut microbiota[J].Microbiological Research, 2020, 233:126409.
[39] NISHIDA K, SAWADA D, KAWAI T, et al.Para-psychobiotic Lactobacillus gasseri CP2305 ameliorates stress-related symptoms and sleep quality[J].Journal of Applied Microbiology, 2017, 123(6):1 561-1 570.
[40] MATENCHUK B A, MANDHANE P J, KOZYRSKYJ A L.Sleep, circadian rhythm, and gut microbiota[J].Sleep Medicine Reviews, 2020, 53:101340.
[41] ALLEN A P, HUTCH W, BORRE Y E, et al.Bifidobacterium longum 1714 as a translational psychobiotic:Modulation of stress, electrophysiology and neurocognition in healthy volunteers[J].Translational Psychiatry, 2016, 6(11):e939.
[42] MIYAKAWA M, KUBO S, ODA H, et al.Effects of lactoferrin on sleep conditions in children aged 12-32 months:A preliminary, randomized, double-blind, placebo-controlled trial[J].Nature and Science of Sleep, 2020, 12:671-677.
[43] THOMPSON R S, ROLLER R, MIKA A, et al.Dietary prebiotics and bioactive milk fractions improve NREM sleep, enhance REM sleep rebound and attenuate the stress-induced decrease in diurnal temperature and gut microbial alpha diversity[J].Frontiers in Behavioral Neuroscience, 2017, 10:240.
[44] THOMPSON R S, VARGAS F, DORRESTEIN P C, et al.Dietary prebiotics alter novel microbial dependent fecal metabolites that improve sleep[J].Scientific Reports, 2020, 10:3848.
[45] LAVIALLE M, CHAMPEIL-POTOKAR G, ALESSANDRI J M, et al.An (n-3) polyunsaturated fatty acid-deficient diet disturbs daily locomotor activity, melatonin rhythm, and striatal dopamine in Syrian hamsters[J].The Journal of Nutrition, 2008, 138(9):1 719-1 724.
[46] MURPHY R A, NATHAN T, HARRIS W S, et al.Omega-3 and omega-6 polyunsaturated fatty acid biomarkers and sleep:A pooled analysis of cohort studies on behalf of the Fatty Acids and Outcomes Research Consortium (FORCE)[J].The American Journal of Clinical Nutrition, 2021, 115(3):864-876.
[47] AHN J H, IM C, PARK J H, et al.Hypnotic effect of GABA from rice germ and/or tryptophan in a mouse model of pentothal-induced sleep[J].Food Science and Biotechnology, 2014, 23(5):1 683-1 688.
[48] BYUN J I, SHIN Y Y, CHUNG S E, et al.Safety and efficacy of gamma-aminobutyric acid from fermented rice germ in patients with insomnia symptoms:A randomized, double-blind trial[J].Journal of Clinical Neurology (Seoul, Korea), 2018, 14(3):291-295.
[49] CHERASSE Y, SAITO H, NAGATA N, et al.Zinc-containing yeast extract promotes nonrapid eye movement sleep in mice[J].Molecular Nutrition & Food Research, 2015, 59(10):2 087-2 093.
[50] DONG Y J, JIANG N H, ZHAN L H, et al.Soporific effect of modified Suanzaoren Decoction on mice models of insomnia by regulating orexin-A and HPA axis homeostasis[J].Biomedicine & Pharmacotherapy, 2021, 143:112141.