食源性疾病是国内外突出的公共卫生问题,因食品链长、病原体来源复杂,食品易受到污染[1]。致病菌本身及其代谢产物对食品原料和产品造成污染,进而导致食品安全问题,致病菌在不同食品中的消长规律是食品安全研究关注的重要内容之一[2]。微生物数量的变化通常依赖于所涉及的食品基质和环境条件,建立数学模型有助于预测食物基质中细菌种群的行为,从而对产品的质量和安全进行预估[3]。通常使用动力学模型与概率模型对金黄色葡萄球菌生长、失活和产毒特性进行预测,如:种群密度、生长概率和毒素生成概率,并得到迟滞期(λ)、最大比生长速率(μmax)、最大种群数(ymax)、D值(某热力致死温度条件下某细菌中杀死90%原有残存活菌数时所需的时间)和z值(灭菌时间减少到原来的1/10所需升高的温度)等模型参数[4]。若要评价预测模型的拟合效果,需结合不同评价参数对模型进行内部和外部验证,判断其可靠性和准确性。微生物模型可用于预测微生物在不同环境条件下生长、失活等行为,能够在没有进行微生物检测的前提下,反映真实条件中微生物的数量变化情况,为食品产业链保证质量与安全提供参考。
金黄色葡萄球菌(Staphylococcus aureus,以下简称金葡菌)是需氧或兼性厌氧的革兰氏阳性球菌,不产芽孢,多数无荚膜,生长和产毒最适温度为37 ℃,最适pH值为7。金葡菌广泛存在于自然界,附着于人体和畜禽的皮肤及黏膜,约20%~30%的人携带此种致病菌,是最常见的人畜共患病原体之一[5]。临床上,呼吸道感染和表皮感染是金葡菌侵袭人体的主要方式,表现为肺炎、中耳炎和菌血症等;而在动物屠宰、食品加工、储存和销售等食品链中也易引入金葡菌,经过生长繁殖产生足量葡萄球菌肠毒素(Staphylococcal enterotoxins, SEs)进而导致消费者罹患疾病,出现恶心呕吐、腹部痉挛甚至休克等症状[6-7]。据统计,美国每年由食源性金葡菌引起的患病人数约为24万[8];我国20%~25%的细菌性食物中毒事件是由金葡菌引起的,其中约80%的中毒事件由葡萄球菌肠毒素A(Staphylococcal enterotoxin A, SEA)所致,故需对金葡菌及SEs进行重点监测和评估[9]。SEs是金葡菌在适宜条件下分泌的外毒素,根据抗原性将其分为SEA、SEB和SEC等经典的血清型和新型SEs(如SEG、SEH、SHI等)。此外毒素对高温、低pH值等条件具有很强的耐受性,故人们食用受金葡菌污染的食品,对蛋白酶有抵抗能力的SEs随食物进入消化系统从而增加食物中毒的风险,甚至导致大规模的食源性疾病暴发[10]。在国际上,统一使用105 CFU/mL作为金葡菌引起食物中毒的阈值[11]。由金葡菌SEs引起的食源性疾病具有自限性,恢复期一般为2 d左右,虽人群普遍易感,但极少出现死亡病例[11]。
近年来针对金葡菌导致的食品安全问题,国内外已有许多针对食品中金葡菌及SEs的预测建模研究,但最新研究进展尚待总结。本文综述了食品中金葡菌及SEs预测建模的最新进展,以期为金葡菌在食品中的定量风险评估和管理控制提供借鉴。
1 食品中金黄色葡萄球菌的生长预测建模
温度是影响微生物生长的关键因素之一,针对食品基质中金葡菌在不同温度下生长情况开展的建模研究如表1所示。关于金葡菌在等温条件下的生长建模研究较多,温度一般选择4~45 ℃。在描述不同食品中金葡菌的生长情况时,经验模型Baranyi、Logistic与Gompertz模型最为常用,经内外部验证模型适用于其他金葡菌菌株及同类型食品,而修正的Gompertz模型(modified Gompertz, mGompertz)拟合度也较高[12-14]。二级模型中,多项式、Huang、指数回归和Arrhenius模型均可精确地描述温度与λ和μmax的关系[13,15]。生长模型在波动温度下的验证更能反映可靠性,也可以基于Baranyi模型,做出相应的参数变化,应用于波动温度下微生物的生长预测。此外,直接建立更符合实际情况的非等温条件下的生长模型更有意义。如于艳艳[16]建立了非等温条件下原料乳中金葡菌的mGompertz生长模型,证明其实用性高于Combase Predictor软件。
表1 不同处理条件下金葡菌生长模型及参数
Table 1 Growth models and parameters of S.aureus under selected conditions
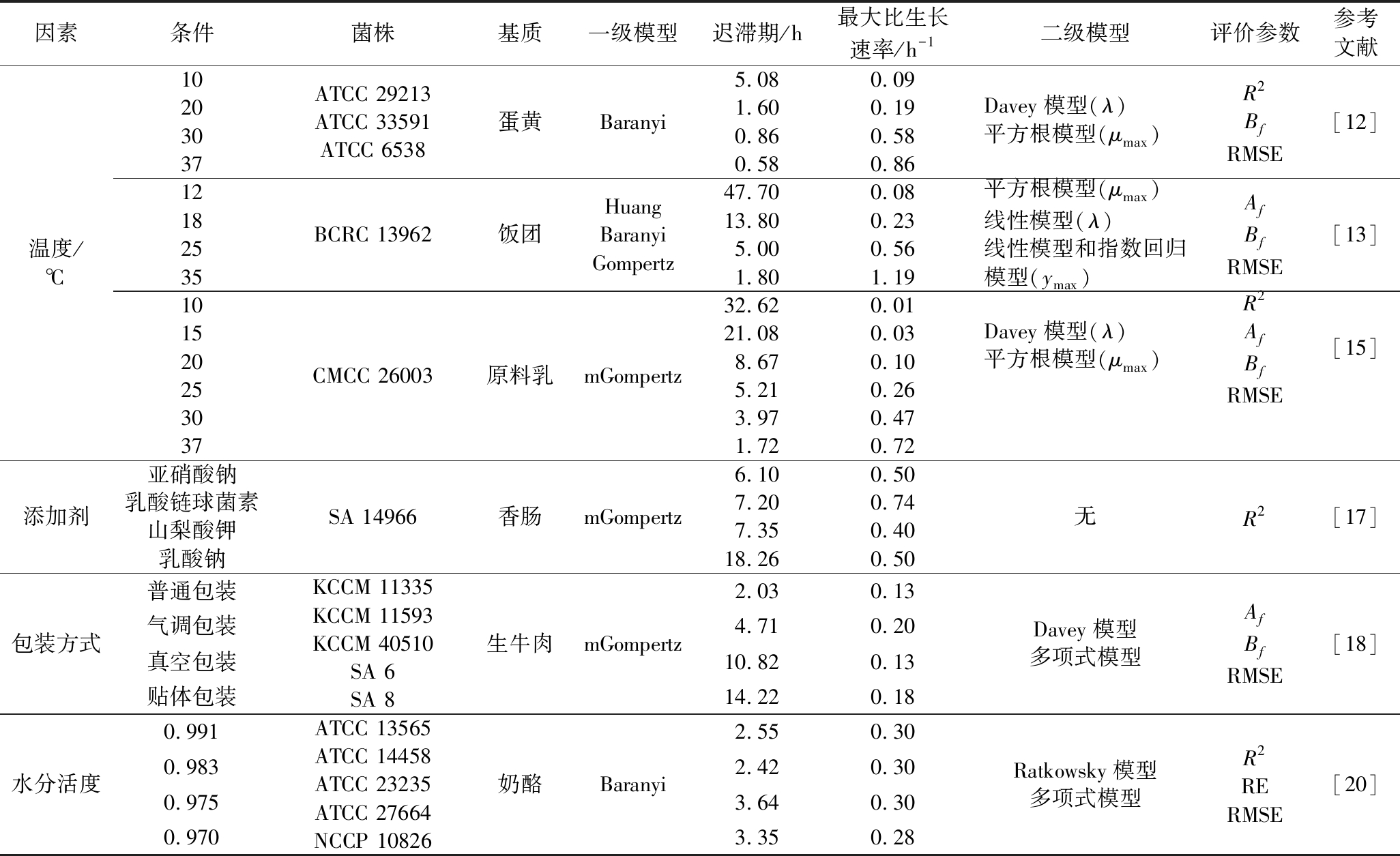
因素条件菌株基质一级模型迟滞期/h最大比生长速率/h-1二级模型评价参数参考文献温度/℃1020303712182535101520253037ATCC 29213 ATCC 33591ATCC 6538蛋黄BCRC 13962饭团CMCC 26003原料乳BaranyiHuangBaranyiGompertzmGompertz5.080.091.600.190.860.580.580.8647.700.0813.800.235.000.561.801.1932.620.0121.080.038.670.105.210.263.970.471.720.72Davey模型(λ)平方根模型(μmax)R2BfRMSE[12]平方根模型(μmax)线性模型(λ)线性模型和指数回归模型(ymax)AfBfRMSE[13]Davey模型(λ)平方根模型(μmax)R2AfBfRMSE[15]添加剂亚硝酸钠乳酸链球菌素山梨酸钾乳酸钠SA 14966香肠mGompertz6.100.507.200.747.350.4018.260.50无R2[17]包装方式普通包装气调包装真空包装贴体包装KCCM 11335KCCM 11593KCCM 40510SA 6SA 8生牛肉mGompertz2.030.134.710.2010.820.1314.220.18Davey模型多项式模型AfBfRMSE[18]水分活度0.9910.9830.9750.970ATCC 13565ATCC 14458ATCC 23235ATCC 27664NCCP 10826奶酪Baranyi2.550.302.420.303.640.303.350.28Ratkowsky模型多项式模型R2RERMSE[20]
pH、水分活度(Aw)和生物及非生物抑菌物质等也会影响金葡菌的生长。有研究以mGompertz模型拟合4种添加剂和包装方式的香肠和牛肉中金葡菌的生长曲线[17-18];骆驼奶和牛奶中金葡菌生长参数的差异通过一步动力学法分析,Cardinal和经验模型分别评价温度对μmax和λ的影响,结果表明骆驼奶中金葡菌的λ更长,可能与某些天然抗菌物质有关[19];此外,LEE等[20]发现Aw仅在15 ℃时影响了奶酪中金葡菌的λ值,考虑可能越接近金葡菌最适生长温度Aw的影响越小,应针对4~15 ℃做进一步的研究。因此,控制金葡菌生长的关键在于充分了解食品的理化性质,通过改变这些因素来降低潜在的风险;与最低抑菌浓度法相比,模型能够更直观、真实地描述金葡菌在食品基质中的生长。
综上,在拟合优度方面,常用的mGompertz、Logistic和Baranyi模型差别较小,在实际应用中,根据模型的拟合度、参数估计的精确性和不确定性综合考虑更为合理。首先,Logistic模型在环境因素复杂时准确度较低,却是很多模型开发的基础,如具有生理学意义的非线性Baranyi模型;相较于非线性的Gompertz模型,包含肩区和尾区的线性mGompertz模型应用更为广泛;经典的平方根模型及其修正式能准确预测温度对μmax的影响;而在处理多种因素时建立多项式模型是较优的选择。其次,早期模型开发的数据一般基于实验室纯培养试验,预测结果可能因食品基质的特性产生差异,故目前多采用具体食品基质直接培养。此外,温度在食品从农场到餐桌的过程中多呈动态变化,欲对生长模型进行评价,除了考量实验数据的拟合情况,还应探究能否正确预测非等温生长情况。从适用性角度看,微生物生长与环境之间的关系错综复杂,同时受到自身因素(菌株间的变异性)和环境因素(食品基质、微生物菌群差异)的影响,因此在大样本容量下建立的微生物预测模型普适性更高。
2 食品中金黄色葡萄球菌的失活预测建模
2.1 环境因素对失活的作用
在食品杀菌工艺中,建立不同环境因素下致病菌的失活模型可快速预测致病菌残存情况。处理方式主要分为热失活(微波加热、巴氏杀菌和烘烤等)和非热失活(臭氧、辐照、压强、脉冲电场和抑菌添加物等)两类。
热处理是食品工业和家庭厨房中灭活细菌的主要方式,常用D值和z值定量描述微生物热失活特征,但食品基质特征和菌株差异会造成金葡菌热失活异质性的产生。紫菜包饭和肉汤中金葡菌D60值分别为6.56和3.45 min[21],而BUZRUL等[22]发现肉汤中金葡菌D60值为4.95 min。食源性金葡菌热失活异质性的存在加大了工业生产中杀菌的难度,最终对危害特征描述甚至微生物风险评估的准确性产生影响,但热处理仍是最常用的有效杀菌方式。此外,微生物热失活曲线可能呈现线性或非线性特征,如ZHANG等[23]采用线性的一级动力学模型研究热处理对核桃中金葡菌存活的影响,但等温处理的参数可能无法准确估计非等温条件下金葡菌的存活情况,线性模型不适用于波动温度下的热失活规律。在热与其他物化处理相结合的栅栏技术研究中,也通常选择非线性模型描述细菌的失活曲线。如猪肉糜中建立热联合肉桂醛影响下金葡菌的多项式失活模型[24];热和压力联合处理斑节对虾中的金葡菌,Weibull模型较好地描述金葡菌的非线性失活曲线[25]。
非热加工技术在保障食品质量与安全方面也得到广泛应用。在脉冲紫外线下的熏肉中建立的Cerf模型和Weibull模型,对于参数的估计较好地描述了金葡菌失活现象,但Kamau模型的评价结果更好[26];肉汤中金葡菌在不同超声处理下,采用遗传算法-人工神经网络模型和自适应神经模糊推理系统模型预测金葡菌的种群数量,两者拟合性均良好,后者所需输入参数更少[27]。进一步地,KALKAN[28]采用傅里叶建模法预测奶酪中乳酸菌和发酵剂对金葡菌的抑菌作用;OBESO等[29]欲确定噬菌体在巴氏杀菌乳中杀灭金葡菌的有效浓度值。预测微生物学建立成熟的生长界面模型是进一步确定生长/无生长的基础,以此判断一定条件下微生物的生长概率,再基于栅栏效应对微生物进行控制。
2.2 应激条件对失活的作用
冷、热、酸、渗透压和消毒剂是食品生产中有效灭活微生物的常用方法。然而,这些应激条件可能会触发细菌的遗传调节和生理适应,使细菌显著抵抗其他应激条件,此现象称为交叉保护。早在1994年,研究发现经厌氧处理后,线性回归得到的D值和z值显示金葡菌在后续生存中的耐热性均显著提升,为提高真空包装类食品的安全性提供了参考[30]。不过交叉保护并非一定会发生,耐药金葡菌的酸抗性、热抗性和耐盐性均接近于敏感金葡菌[31];类似地,经冷藏的金葡菌在后续温和热处理下,其热抗性无显著变化[32]。由于金葡菌在混合培养时竞争能力较弱,在未加热的食物中种群数量较少,而巴氏杀菌处理易杀灭热敏感的微生物,更耐热的金葡菌容易得以存活、繁殖并产生SEs,故优化巴氏杀菌流程是降低金葡菌带来食源性风险的手段之一。
综上,金葡菌的失活建模研究主要围绕热处理开展,非热技术往往联合热处理或另一种非热技术共同抑制金葡菌的繁殖。线性失活模型较为常见,其中,对数线性模型适用于描述稳定均一的培养基基质或纯菌落的失活动力学。经典的D值和z值概念是基于热处理建立的,在温和热处理或非热处理过程中,研究者对细菌非线性生长行为的描述多选用非线性模型。如只有2个参数的Weibull等非线性模型具有更好应用性;人工神经网络作为集成的一、二级失活模型,有助于建立微生物失活动力学的整体方法。模型准确性和实用性的评价需要通过内部和外部验证全面衡量,但并非评价参数越多越好。最后,在设计和实施各种食品加工方法时,应考虑交叉保护现象,充分研究微生物的失活规律有助于管理者制定食品生产的标准。事实上,利用低温控制金葡菌生长也是研究热点之一,使用Weibull模型拟合低温下金葡菌失活数据,证明-18 ℃无法完全抑制其生长,如何选取合适的冷冻温度结合其他杀菌手段保障速冻米面制品及冷饮食品安全需要生产者慎重考虑[33]。
3 食品中金黄色葡萄球菌肠毒素生成预测建模
金葡菌食物中毒(Staphylococcal food poisoning, SFP)是SEs通过侵袭被感染者肠道引起的相关疾病[7]。SEs形成于细菌生长指数期末期或稳定期早期,由多种环境信号共同调节产生,其表达量直接影响金葡菌的致病能力。因此,当食物作为载体,细菌生长条件、微环境和细胞密度等均可成为影响SEs生成的原因,图1为环境条件促进和抑制不同SEs生成的调控网络[34]。在国际上,通常认为大于1.0 μg的SEs即可造成SFP,或将金葡菌菌落总数105CFU/g作为SEs导致人体患病的阈值[35]。实际上,金葡菌浓度在103 CFU/g时,仍可能产生足量SEs[36]。因此,SEs生成量取决于金葡菌浓度和外部环境的综合影响,目前的研究多集中于探究外界条件影响毒素生成的概率。
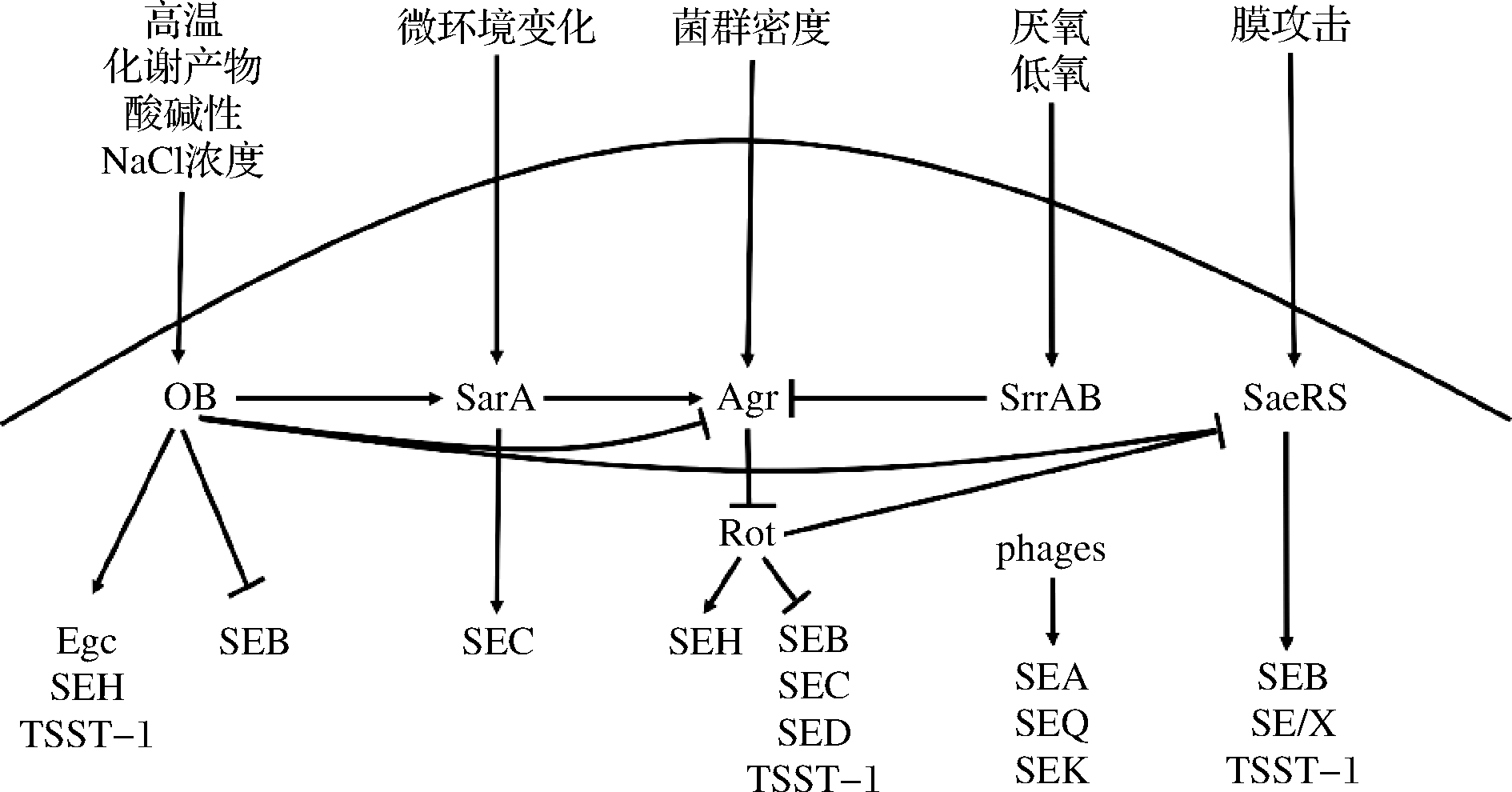
图1 环境条件分别通过不同系统调节SEs生成
Fig.1 Environmental conditions modulate SEs production through different systems
注:σB:sigma因子;SarA:SarA蛋白家族;Agr:Agr群体感应系统;SrrAB:SrrAB蛋白;SaeRS:SaeRS双组分系统;箭头表示上调,杠表示下调
3.1 肠毒素生成的边界模型
Logistic模型是描述SEs生成时最常用的模型。在不同温度、水分活度、盐浓度和乳酸的组合下,Logistic模型很好地描述了金葡菌和SEA生长和生成的单调增加(或减少)边界[37-39]。但模型的边界并非只有单调一种,当边界呈U型时,Logistic模型需要条件参数的平方项来更好地拟合[40]。目前,相关研究日益增多,模型的选取上也不仅仅局限于经典的Logistic模型。如mGompertz模型拟合不同状态下牛奶中SEA的生成量曲线;Arrhenius模型描述温度对SEA生成量的影响,证明相对于静置培养,振荡使SEA获得了更高的生成量,并缩短了λ,证明搅拌等加工方式可能会增加液态食品中SEA生成的风险,为食品企业调整生产条件、降低金葡菌产毒风险提供依据[41]。此外,由于不同SEs检测方法的检出限不一致,各研究选取的用于判断SEs是否形成的浓度阈值不同,在建立边界和概率模型时应尽量选择更加保守的浓度,提升模型预测的准确性。
不同的SEs及其亚型具有不同的产毒特性。多项式模型描述虾中防腐剂AMPNT-6抑制金葡菌生长和SEB生成的效果良好[42];Gompertz模型拟合紫菜包饭中金葡菌混合毒素SEA、SEC和SED的生成曲线,显示毒素生成量与温度和食品基质有关[21];牛奶中金葡菌浓度和SECbovine生成量之间可形成具有代表性的双相线性模型[43]。综上,金葡菌生长但不产SEs的临界条件研究对于食品企业制定生产标准具有实际意义;基于栅栏效应合理利用抑菌物质有助于控制金葡菌数量,降低食源性疾病暴发风险。金葡菌生长和SEs生成的主要影响因素及条件范围如表2所示。综上,菌株的毒力主要与菌株本身以及人群有关。金葡菌不同菌株在表达不同SEs基因时可能存在差异,从而导致毒力的异质性,在预测过程中,应根据SEs类型选择合适的产毒模型。
3.2 肠毒素生成的首次检测时间
若实际生产中食品贮藏时间超过预测的SEs被首次检测到的时间(detection times, DT),则不应继续销售。有研究通过多项式模型量化环境变量与鸡肉中SEA的DT的关系,结果显示温度与DT具有很高的相关性[44]。由于目前各研究对SEs的检测是间歇性的,而非连续地实时检测,故采用线性插值方法对观测到的DT进行校正,校正后的DT与实际DT较为接近,为工厂生产提供了更加准确的预测手段[45]。进一步地,对200组SEs生成数据集的验证,通过神经网络训练建立的SEs模型可准确预测肉制品加工过程中,亚硝酸钠含量等对金葡菌数量增加及SEs生成的影响[46]。模型可以很好地从历史温度等环境变量预测毒素的DT,深入了解毒素产生的临界点对各变量的响应规律,有助于更好地保藏食品和评估风险。
建立准确的SEs生成模型可为食品工业预防SFP提供有用的信息。首先,预测SEs生成应用最广泛的为Logistic模型,往往同时会与栅栏技术相结合,可充分体现环境因素对毒素生成的影响,但模型的建立基于生长界限已知的前提;mGompertz方程式能够以包含肩区和尾区的线性残存曲线建立模型;Arrhenius模型包含具有生物学意义的参数;而神经网络模型由于没有固定的模型结构,适用性较高。其次,等温和非等温、静态和非静态条件下SEs生成量有所不同,液体食物(如牛奶)的加工和运输过程往往是静态/非静态交替进行,如何更加准确地预测整条食品链中毒素的动态变化需要进一步研究。综上,根据SEs自身特性、生成条件及食品基质构建更具针对性和现实意义的预测模型是下一步研究的重点。
表2 金葡菌生长和SEs生成的主要影响因素及条件范围
Table 2 The main factors and conditions of S.aureus growth and SEs production
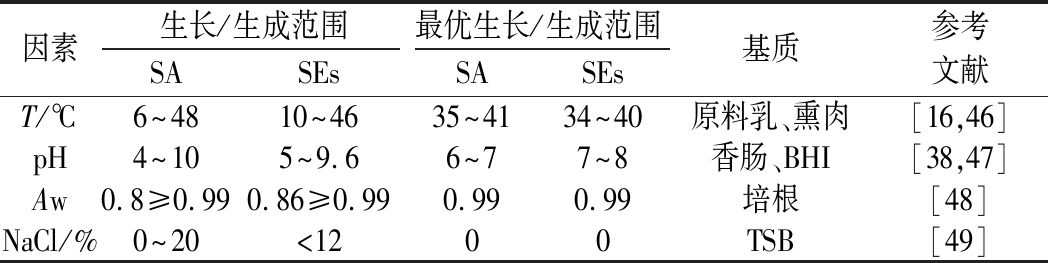
因素生长/生成范围最优生长/生成范围SASEsSASEs基质参考文献T/℃6~4810~4635~4134~40原料乳、熏肉[16,46]pH4~105~9.66~77~8香肠、BHI[38,47]Aw0.8≥0.990.86≥0.990.990.99培根[48]NaCl/%0~20<1200TSB[49]
注:BHI-脑心浸液肉汤;TSB-胰蛋白胨大豆肉汤
4 结论与展望
我国食品种类丰富,现阶段对于相应的金葡菌及SEs建模和风险评估研究较少,事实上居民消费受到SEs污染的风险较高,因此开展相关研究非常必要。本文总结了目前食源性金葡菌及SEs建模的相关进展,对食源性金葡菌的风险评估和质量控制具有重要意义,目前存在的问题及建议如下:
其一,金葡菌生长、失活及SEs生成一般与温度、Aw、pH、抑菌物质等条件有关。适宜条件促进金葡菌生长产毒,应激条件对其后续生长、失活和产毒可能产生交叉保护作用,具体机制尚待研究。但金葡菌经历史应激后,不同类型SEs的生成情况研究目前较少。
其二,现阶段对产SEs的预测主要基于金葡菌的生长模型,实际上由于食品的营养成分、包装特点、微生物相互作用和代谢特征等共同作用,细菌数量与毒素生成量之间的规律并不是固定的,此后可将研究重点转向预测环境因素对毒素生成的直接影响。
其三,目前对于金葡菌的剂量-效应研究极少,SEs建模研究均使用105 CFU/mL作为食物中毒的阈值。但更应建立SEs摄入与人体致病的剂量-效应研究,并根据人群结构、消费习惯和SEs类型建立适合我国国情的剂量-效应模型,提高预测建模结果的准确性。
其四,SEs生成模型的建立多基于混合菌株或产经典SEs菌株(SEA~SEE),事实上其他类型的SEs同样具有不可忽视的致病能力和食源性暴发案例,深入和全面研究食品中金葡菌产非经典SEs的具体条件、时间和生成量可填补金葡菌产毒预测模型建立的缺失。此外,为了更好地确定哪种SEs导致了SFP,建议SFP暴发后检测所有SEs的表型和基因型,有助于我们更好地描述SFP的真实发病率和流行率。
[1] 李茳, 张海洋, 张琦.食源性疾病监控及体系建设探究[J].食品安全导刊, 2020, 270(11):40-41.
LI J, ZHANG H Y, ZHANG Q.Research on monitoring and system construction of foodborne diseases[J].Food Safety Guide, 2020, 270(11):40-41.
[2] 赵静, 孙海娟, 冯叙桥.食品中食源性致病菌污染状况及其监测技术研究进展[J].食品安全质量检测学报, 2013, 4(5):1 353-1 360.
ZHAO J, SUN H J, FENG X Q.Advances on pollution of food-borne pathogens and its detection technology in food[J].Journal of Food Safety & Quality, 2013, 4(5):1 353-1 360.
[3] ROUPAS P.Predictive modelling of dairy manufacturing processes[J].International Dairy Journal, 2008, 18(7):741-753.
[4] WALLS I, SCOTT V N.Use of predictive microbiology in microbial food safety risk assessment[J].International Journal of Food Microbiology, 1997, 36(2-3):97-102.
[5] ONDUSKO D S, NOLT D.Staphylococcus aureus[J].Pediatrics in Review, 2018, 39(6):287-298.
[6] EVENSON M L, HINDS M W, BERNSTEIN R S, et al.Estimation of human dose of Staphylococcal enterotoxin A from a large outbreak of Staphylococcal food poisoning involving chocolate milk[J].International Journal of Food Microbiology, 1988, 7(4):311-316.
[7] DACK G M.Staphylococci in relation to food poisoning[J].American Journal of Public Health and the Nation’s Health, 1937, 27(5):440-443.
[8] DEWEY-MATTIA D, MANIKONDA K, HALL A J, et al.Surveillance for foodborne disease outbreaks:United States, 2009—2015[J].MMWR Surveillance Summaries, 2018, 67(10):1-11.
[9] 吴任之, 胡欣洁, 韩国全, 等.食源性金黄色葡萄球菌快速检测方法的研究进展[J].食品与发酵工业, 2021, 47(10):291-296.
WU R Z, HU X J, HAN G Q, et al.Research progress on rapid detection of food-borne Staphylococcus aureus[J].Food and Fermentation Industries, 2021, 47(10):291-296.
[10] 向红, 周藜, 廖春, 等.金黄色葡萄球菌及其引起的食物中毒的研究进展[J].中国食品卫生杂志, 2015, 27(2):196-199.
XIANG H, ZHOU L, LIAO C, et al.Progress of Staphylococcus aureus and food poisoning[J].Chinese Journal of Food Hygiene, 2015, 27(2):196-199.
[11] DING T, YU Y Y, SCHAFFNER D W, et al.Farm to consumption risk assessment for Staphylococcus aureus and Staphylococcal enterotoxins in fluid milk in China[J].Food Control, 2016, 59:636-643.
[12] PARK J H, KANG M S, PARK K M, et al.A dynamic predictive model for the growth of Salmonella spp.and Staphylococcus aureus in fresh egg yolk and scenario-based risk estimation[J].Food Control, 2020, 118:107421.
[13] 孟司奇, 丁高蓝, 肖兴宁, 等.巴氏杀菌乳中金黄色葡萄球菌的生长预测模型构建[J].浙江农业学报, 2020, 32(7):1 281-1 288.
MENG S Q, DING G L, XIAO X N, et al.Establishment of growth model of Staphylococcus aureus in pasteurized milk[J].Acta Agriculturae Zhejiangensis, 2020, 32(7):1 281-1 288.
[14] 郭明娟, 光翠娥, 干建平, 等.不同温度下椰汁中金黄色葡萄球菌的生长动力学模型比较[J].食品与生物技术学报, 2020, 39(2):89-96.
GUO M J, GUANG C E, GAN J P, et al.Comparison of growth prediction models of Staphylococcus aureus at different temperatures in coconut milk[J].Journal of Food Science and Biotechnology, 2020, 39(2):89-96.
[15] LU K H, SHEEN Y J, HUANG T P, et al.Effect of temperature on the growth of Staphylococcus aureus in ready-to-eat cooked rice with pork floss[J].Food Microbiology, 2020, 89:103374.
[16] 于艳艳. 原料乳中金黄色葡萄球菌生长模型的建立及风险评估[D].杭州:浙江大学, 2015.
YU Y Y.Growth models and risk assessment of Staphylococcus aureus in raw milk[D].Hangzhou:Zhejiang University, 2015.
[17] LIN L, HU J Y, WU Y, et al.Assessment of the inhibitory effects of sodium nitrite, nisin, potassium sorbate, and sodium lactate on Staphylococcus aureus growth and staphylococcal enterotoxin A production in cooked pork sausage using a predictive growth model[J].Food Science and Human Wellness, 2018, 7(1):83-90.
[18] YU H H, SONG Y J, KIM Y J, et al.Predictive model of growth kinetics for Staphylococcus aureus in raw beef under various packaging systems[J].Meat Science, 2020, 165:108108.
[19] XIE Z P, PENG Y B, LI C C, et al.Growth kinetics of Staphylococcus aureus and background microorganisms in camel milk[J].Journal of Dairy Science, 2020, 103(11):9 958-9 968.
[20] LEE H, KIM K, LEE S, et al.Kinetic behaviour of Staphylococcus aureus on cheese as a function of water activity and temperature[J].The Journal of Dairy Research, 2015, 82(1):64-69.
[21] MIN K J, JUNG Y J, KWON K Y, et al.Effect of temperature on the production of staphylococcal enterotoxin and thermal inactivation kinetics of Staphylococcus aureus in selected ready-to-eat (RTE) foods in Korea[J].Journal of Food Safety, 2013, 33(1):17-24.
[22] BUZRUL S, ALPAS H.Modeling inactivation kinetics of food borne pathogens at a constant temperature[J].LWT-Food Science and Technology, 2007, 40(4):632-637.
[23] ZHANG L H, KOU X X, ZHANG S, et al.Effect of water activity and heating rate on Staphylococcus aureus heat resistance in walnut shells[J].International Journal of Food Microbiology, 2018, 266:282-288.
[24] 卢杨柳, 马静一, 艾志录, 等.含肉桂醛猪肉糜中金黄色葡萄球菌热失活模型的建立[J].中国食品学报, 2019, 19(9):195-201.
LU Y L, MA J Y, AI Z L, et al.Thermal inactivation model of Staphylococcus aureus in ground pork contained cinnamaldehyde[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(9):195-201.
[25] KAUR B P, RAO P S.Modeling the combined effect of pressure and mild heat on the inactivation kinetics of Escherichia coli, Listeria innocua, and Staphylococcus aureus in black tiger shrimp (Penaeus monodon)[J].Frontiers in Microbiology, 2017, 8:1311.
[26] KEKLIK N M.Treatment of pastirma with pulsed UV light:Modeling of Staphylococcus aureus inactivation and assessment of quality changes[J].Food Science and Technology International, 2020, 26(2):185-198.
[27] SOLEIMANZADEH B, AMOOZANDEH A, SHOFERPOUR M, et al.New approaches to modeling Staphylococcus aureus inactivation by ultrasound[J].Annals of Microbiology, 2018, 68(6):313-319.
[28] KALKAN S.Predicting the antimicrobial effect of probiotic lactic acid bacteria against Staphylococcus aureus in white cheeses, using Fourier series modeling method[J].Journal of Food Safety, 2020, 40(1):e12724.
[29] OBESO J M, GARC A P, MART
A P, MART NEZ B, et al.Use of logistic regression for prediction of the fate of Staphylococcus aureus in pasteurized milk in the presence of two lytic phages[J].Applied and Environmental Microbiology, 2010, 76(18):6 038-6 046.
NEZ B, et al.Use of logistic regression for prediction of the fate of Staphylococcus aureus in pasteurized milk in the presence of two lytic phages[J].Applied and Environmental Microbiology, 2010, 76(18):6 038-6 046.
[30] UGBOROGHO T O, INGHAM S C.Increased D-values of Staphylococcus aureus resulting from anaerobic heating and enumeration of survivors[J].Food Microbiology, 1994, 11(4):275-280.
[31] MA Y N, LAN G, LI C, et al.Stress tolerance of Staphylococcus aureus with different antibiotic resistance profiles[J].Microbial Pathogenesis, 2019, 133:103549.
[32] KENNEDY J, BLAIR I S, MCDOWELL D A, et al.An investigation of the thermal inactivation of Staphylococcus aureus and the potential for increased thermotolerance as a result of chilled storage[J].Journal of Applied Microbiology, 2005, 99(5):1 229-1 235.
[33] SUO B, WANG X J, PAN Z L, et al.Inactivation and sublethal injury kinetics of Staphylococcus aureus in broth at low temperature storage[J].Journal of Food Protection, 2014, 77(10):1 689-1 695.
[34] HENNEKINNE J A, DE BUYSER M L, DRAGACCI S.Staphylococcus aureus and its food poisoning toxins:Characterization and outbreak investigation[J].FEMS Microbiology Reviews, 2012, 36(4):815-836.
[35] Food and Drug Administration.Bad bug book:foodborne pathogenic microorganisms and natural toxins handbook[R/OL]. United State, 2017.
[36] JABLONSKI L M, Bohach G A.Staphylococcus aureus[M].2nd ed. Washington DC: ASM Press,2001:411-434.
[37] ELAHI S, FUJIKAWA H.Comprehensive study of the boundaries of enterotoxin A production and growth of Staphylococcus aureus at various temperatures and salt concentrations[J].Journal of Food Science, 2019, 84(1-3):121-126.
[38] ELAHI S, FUJIKAWA H.Effects of lactic acid and salt on enterotoxin A production and growth of Staphylococcus aureus[J].Journal of Food Science, 2019, 84(11):3 233-3 240.
[39] VALERO A, PÉREZ-RODR GUEZ F, CARRASCO E, et al.Modelling the growth boundaries of Staphylococcus aureus:Effect of temperature, pH and water activity[J].International Journal of Food Microbiology, 2009, 133(1-2):186-194.
GUEZ F, CARRASCO E, et al.Modelling the growth boundaries of Staphylococcus aureus:Effect of temperature, pH and water activity[J].International Journal of Food Microbiology, 2009, 133(1-2):186-194.
[40] DING T, YU Y Y, HWANG C A, et al.Modeling the effect of water activity, pH, and temperature on the probability of enterotoxin A production by Staphylococcus aureus[J].Journal of Food Protection, 2016, 79(1):148-152.
[41] LIN L, CHEN M, OU J, et al.Kinetics of Staphylococcus aureus growth and Enterotoxin A production in milk under shaking and static conditions[J].Food Research International, 2021, 143:110298.
[42] ZHANG N, PU Y H, SUN L J, et al.Modeling the effects of different conditions on the inhibitory activity of antimicrobial lipopeptide (AMPNT-6) against Staphylococcus aureus growth and enterotoxin production in shrimp meat[J].Aquaculture International, 2017, 25(1):57-70.
[43] HUNT K, BUTLER F, JORDAN K.Modelling production of S.aureus enterotoxin Cbovine in milk, and its production during cheese making[J].Dairy Science and Technology, 2015, 95(5):747-757.
[44] HU J Y, LIN L, CHEN M, et al.Modeling for predicting the time to detection of Staphylococcal enterotoxin A in cooked chicken product[J].Frontiers in Microbiology, 2018, 9:1536.
[45] GUNVIG A, ANDRESEN M S, JACOBSEN T, et al.Staphtox predictor:A dynamic mathematical model to predict formation of Staphylococcus enterotoxin during heating and fermentation of meat products[J].International Journal of Food Microbiology, 2018, 285:81-91.
[46] GENIGEORGIS C, RIEMANN H, SADLER W W.Production of enterotoxin-B in cured meats[J].Journal of Food Science, 1969, 34(1):63-68.
[47] BARBER L E, DEIBEL R H.Effect of pH and oxygen tension on Staphylococcal growth and enterotoxin formation in fermented sausage[J].Applied Microbiology, 1972, 24(6):891-898.
[48] LEE R Y, SILVERMAN G J, MUNSEY D T.Growth and enterotoxin A production by Staphylococcus aureus in precooked bacon in the intermediate moisture range[J].Journal of Food Science, 1981, 46(6):1 687-1 692.
[49] SCHMIDT K A, DONEGAN N P, KWAN W A Jr, et al.Influences of sigma B and agr on expression of Staphylococcal enterotoxin B (seb) in Staphylococcus aureus[J].Canadian Journal of Microbiology, 2004, 50(5):351-360.