乳铁蛋白(lactoferrin, LF)是一铁结合的糖化球蛋白,人体重要的免疫蛋白之一,具有多样化的体内抑菌、免疫调节和各种生理功能,其免疫机理主要针对病原微生物的感染、炎症(如关节炎、过敏)以及神经退化性疾病等所作的应答,枢轴式调节先天和后天适应性免疫系统、双向调节促发炎和抗发炎以达到免疫稳态[1-3]。常见的LF依来源可分为人乳铁蛋白(human lactoferrin, hLF)、牛乳铁蛋白(bovine lactoferrin, bLF)、猪乳铁蛋白(porcine lactoferrin, pLF)、羊乳铁蛋白(sheep lactoferrin, sLF)以及重组人乳铁蛋白(recombinant human lactoferrin, rhLF)等。bLF作为热门的功能性食品成分,主要添加于婴幼儿配方奶粉及固体饮料中,用于强化机体免疫能力。目前富含bLF的产品大都为进口,且非食品领域的应用尚少,尚有很大的发展潜力。近年来有关bLF活性保留率与应用的相关技术研究和专利渐趋丰富,包括制备工艺技术与基于特定活性机理的产品研发等,值得总结归纳。
1 牛乳铁蛋白的来源及分子特性
牛乳铁蛋白(bLF)存在于牛的乳汁以及外分泌物中(包括唾液、黏膜等),乳汁的LF含量较高[1]。牛乳中bLF含量为0.03~1.36 g/L,其中脱脂牛乳的bLF含量约0.5 g/L[4-6],bLF的含量会随哺乳期的延长而降低。乳铁蛋白的分子质量大约为75~80 kDa,约有690~700个氨基酸残基构成了bLF的初级结构[3,7],等电点在9.3~9.5[4]。根据RCSB PDB(Research Collaboratory for Structural Bioinformat-ics Protein Date Bank, RCSB PDB)公共数据库LF的二维结构讯息,经PyMOL软件处理所得bLF的三维结构(图1,PDB代码=1BLF),可知bLF主要由α-螺旋和β-折叠构成的三维结构,包括2个叶(C叶和N叶),形状类似于两片银杏叶,每个叶中心都能结合一个铁离子。不同来源的牛乳铁蛋白的二级结构基本相似,但三级结构略微不同,bLF结构的差异使其具有不同的铁饱和度,铁饱和度会影响bLF的稳定性,如:铁饱和型LF(holo-lactoferrin, holo-LF)的热稳定性高于缺铁型LF(apo-lactoferrin, apo-LF),故bLF的活性和稳定性随牛奶的来源而异,主要与铁饱和度有关[8]。在相同的巴式杀菌条件(65~75 ℃加热60 s)下,中国牛奶bLF活性损失率(35%~43%)高于新西兰牛奶bLF(10%~33%),因中国牛奶中bLF的铁饱和度(11.6%)为新西兰牛奶bLF(21.9%)的一半[9]。综上,生产加工过程中选择bLF铁饱和度高的原料有助于加工稳定性。
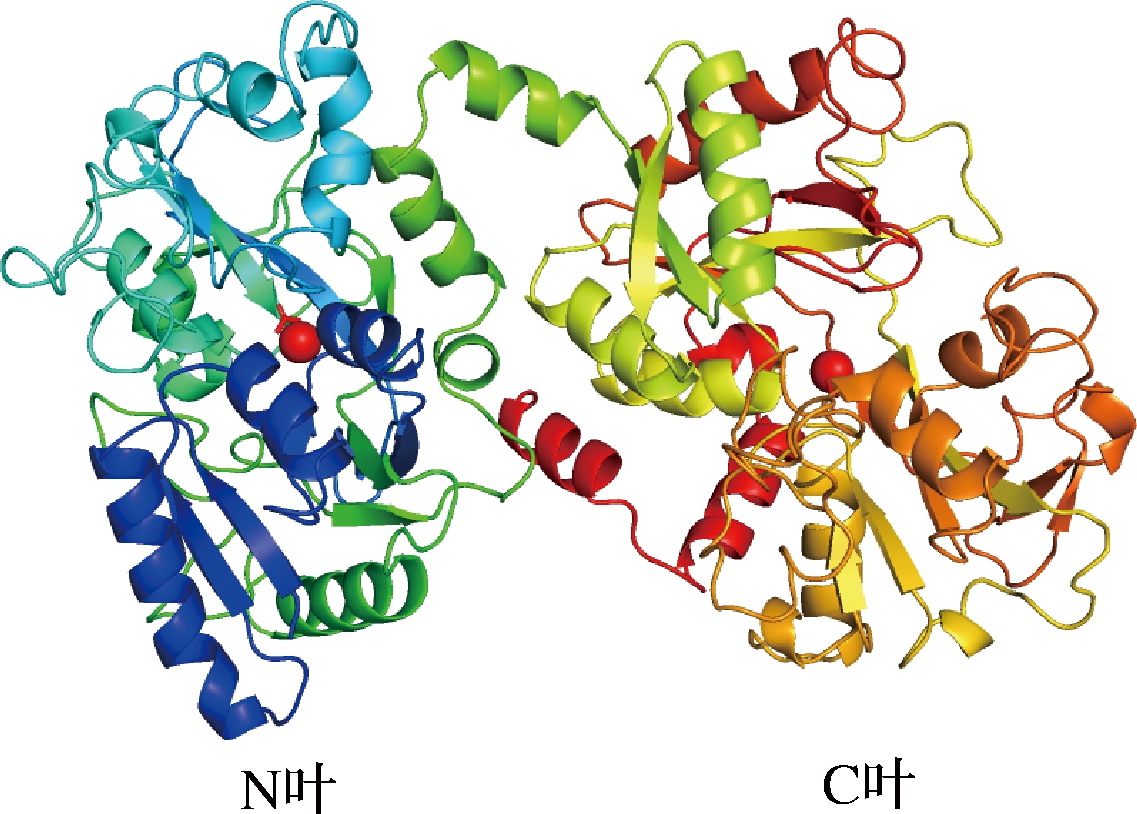
图1 牛乳铁蛋白的3D结构 (●Fe3+)
Fig.1 3D structure of bovine lactoferrin
2 生产制造工艺
2.1 生产工艺流程与技术创新
bLF的生产工艺流程,以未杀菌的原料牛乳经离心脱脂所得的脱脂乳为例,经三大工程阶段以生产bLF:调整、阳离子色谱分离纯化和配方粉末,如图2所示。

图2 自牛乳分离牛乳铁蛋白的生产工艺流程与创新技术
Fig.2 Production process flow and innovative techniques for isolating bLF from bovine milk
第一阶段调整工程的目的是去除酪蛋白和大颗粒杂质,单元操作包括:HCl溶液调pH 4.6沉淀并离心去除酪蛋白、上清液pH中和至6.5并冷却至8 ℃、预过滤或微过滤除去杂质。其中,去除酪蛋白的操作条件可以0.1~1 mol/L HCl溶液酸化至pH 4.6(酪蛋白的等电点)使酪蛋白凝集后,以4 000~5 000×g、15~20 min离心去除酪蛋白沉淀物[6]。上清液进行层析前的预过滤,可使用1.2~1.4 μm的滤膜微过滤或先用5 μm的滤膜初滤再用1 μm的滤膜微过滤[10],所得滤液含有乳清蛋白、bLF、乳过氧化物酶(lactoperoxidase, LPOase)、牛血清白蛋白(bovine serum albumin, BSA)及免疫球蛋白G (immunoglobulin G, IgG)等。
第二阶段层析工程的目的在于分离纯化上述各种功能性蛋白质,单元操作包括:强阳离子交换树脂吸附性色谱分离操作,将含各种功能性蛋白质的滤液加载色谱管柱中,依序以水洗出色谱柱中的缓冲液杂质和乳清蛋白等未吸附的物质、以低浓度盐溶液(16 g/L NaCl溶液)洗脱出低正电荷的蛋白质(LPOase、BSA和IgG)、及以高浓度盐溶液(100 g/L NaCl溶液)洗脱出高正电荷的bLF。工业上都采用磺酸化的强阳离子琼脂糖大孔树脂凝胶(SP Sepharose Big Bead,粒径100~300 μm)进行分离纯化操作,具有高效分离的优点,适用于大规模生产[10]。
第三阶段配方粉末工程的目的在于纯化bLF、巴氏杀菌和干燥粉末化,可同时进行食品配方操作以生产复配粉末食品,单元操作包括:bLF溶液进行超滤浓缩、透析脱盐、巴氏杀菌、最后干燥成bLF干燥粉末。其中,超滤浓缩可以使用30 kDa或50 kDa的超滤膜;巴氏杀菌的条件为73.5 ℃ 18 s或75 ℃ 15 s;干燥可采用冷冻干燥或喷雾干燥。所得bLF干燥粉末纯度为80%~96%,蛋白质含量>94%[10],bLF无明显变性、具有高生物活性。
近年来bLF的分离纯化工艺有许多面向创新的进展,都是基于上述强阳离子色谱分离操作加以改良,组合超过滤技术或多管柱化以提高产能或效率、bLF纯度或回收率。特将有关的具有规模生产潜力的新型分离技术进行比较,见表1,说明多种应用高新技术或新型材料以优化bLF分离纯化效果的色谱条件、效果和特点。已商业化用于中试规模工业生产有4种(后3种均为膜吸附色谱法):(1)以Streamline SP琼脂糖凝胶为吸附介质的模拟移动床技术,将传统的间歇色谱转变为连续色谱技术(20柱),1.25 mol/L NaCl溶液快速分离bLF,使蛋白质纯化过程中缓冲液消耗减少了4.3倍,bLF回收率高达105%,纯度大于90%[11]。(2)横流微滤(0.2 μm)和磺酸化的强阳离子交换层析相结合,三步洗脱(0.1、0.175、1.0 mol/L NaCl)选择性分离bLF,经过醋酸纤维素膜(分子质量切molecular-weight cut-off, MWCO=30 kDa)浓缩和冷冻干燥,bLF纯度约95%,该方法分离速度快,适用于工业生产[12]。(3)阳离子混合基质膜的膜吸附技术,将SP-琼脂糖凝胶FF(fast flow)混合在乙烯-乙烯醇聚合物基膜(孔隙率72%),进行阳离子交换层析兼超滤功能的分离纯化工程,bLF回收率可提高到88%,且具有操作简单、容易规模化到工业生产的优点[13]。(4)径向流膜吸附色谱法,采用阴离子交换色谱和阳离子交换色谱相结合的方式,可分离各种功能性蛋白质,所得产物的bLF纯度89%,但bLF回收率仅有38.6%,尚须进一步改良工艺以提高bLF回收率[14]。
表1 各种分离纯化工艺条件对牛乳铁蛋白纯度及回收率的影响
Table 1 Effects of various separation and purification process conditions on the purity and recovery rate of bovine lactoferrin

分离纯化方法色谱条件bLF的洗脱条件产品特征特点模拟移动床技术[11]Streamline SP琼脂糖凝胶(20柱);0.02 mol/L磷酸盐缓冲液,pH 6.5,0.12 mol/L NaCl溶液1.25 mol/L NaCl溶液纯度>90%回收率105%快速分离,降低了缓冲液消耗(减少4.3倍);已工业化应用横流微滤和强阳离子交换层析[12]0.02 mol/L磷酸盐缓冲液,pH 7.0;1.0 mol/L NaCl溶液纯度95%分离速度快;已工业化应用阳离子混合基质膜[13]含快流速SP琼脂糖凝胶的乙烯-乙烯醇聚合物基膜;0.02 mol/L磷酸盐缓冲液,pH 6.01.0 mol/L NaCl溶液回收率88%制备简单,易规模化;已工业化应用径向流膜吸附色谱法[14]先阴离子交换色谱、后阳离子交换色谱;0.03 mol/L磷酸盐缓冲液,pH 7.01.0 mol/L NaCl溶液纯度89.0%回收率38.6%分离各种功能性蛋白质;LF的回收率低Fe3O4磁性纳米粒子吸附[15]0.003 mol/L磷酸盐缓冲液,pH 6.00.5 mol/L NaCl溶液纯度93.1%回收率99.99%精准回收;高特异性;几乎零损失率;稳定性高超滤-膨胀床色谱法[16]Streamline SP琼脂糖凝胶;0.05 mol/L磷酸盐缓冲液,pH 7.00.5 mol/L NaCl溶液纯度92.7%回收率87.0%简化分离流程,减少进样体积;高原料损耗率
另外,Fe3O4磁性纳米粒子靶向性磁吸法和超滤-膨胀床色谱法为仍在实验室研究阶段的创新技术。磁性纳米颗粒由于具有比表面积大、易于收集和分散性好等优点而适用于蛋白质分离,而刀豆蛋白A被认为是从乳清中提纯bLF的理想配体。以铁和亚铁为原料通过共沉淀法制备Fe3O4磁性纳米粒子,并将刀豆蛋白A作为磁性纳米吸附剂吸附在磁性纳米粒子上,用于针对bLF的分离纯化。Fe3O4磁性纳米粒子靶向性磁吸法所得bLF产物纯度高达93%,回收率高达99.99%[15],是最新颖且高效的分离纯化技术,具有精准回收、高特异性、几乎零损失率、稳定性高等优点,已建立标准操作流程,但目前受限于Fe3O4磁性纳米粒子的量产问题而尚未能规模化应用于bLF的工业生产上。而超滤-膨胀床色谱法是结合2种分离操作的简化流程,在分离过程中减小样品体积是降低单位生产成本的关键,超滤使bLF的进样体积减少到原来的1/10,增加进样bLF浓度,减少bLF分离纯化的时间成本,而膨胀床色谱法解决了超滤浓缩导致的液体黏度高的问题,所得bLF产物纯度可高达92.7%且回收率达87%,但缺点是原料消耗率高且未回收bLF以外的功能性蛋白质[16]。
2.2 影响因子
来源、加工过程中加热、酸碱处理(pH值)、发酵、酶的存在都会影响乳铁蛋白的活性和稳定性,因此bLF在应用过程中必须考虑相关因素的影响。
2.2.1 来源的影响
bLF的活性和稳定性随牛奶来源而异,在65~75℃加热60 s下,新西兰牛奶中bLF的活性损失率(10%~33%)低于中国牛奶(35%~43%)。2种牛奶中bLF的热稳定性的差异可能与bLF铁饱和度水平有关,因中国牛奶中的铁饱和度(11.6%)约为新西兰牛奶(21.9%)的一半[9]。从热失活的D值(90%bLF失活所需时间)可以看出,holo-LF的热稳定性大约为apo-LF的3倍[17]。故提高bLF铁饱和度有助于提高其热稳定性,生产加工过程中对原料应选择铁饱和度高的bLF。
2.2.2 热处理的影响
bLF的结构和活性受加热温度和时间影响。加热会促使bLF结构展开并由二硫键介导形成分子间蛋白质聚集体,造成变性与多种活性的损失,如抑菌活性降低[18]、表面疏水性增加[19]、铁结合能力降低[20]等。WAZED等[17]发现bLF强化的即食婴儿配方奶粉在高温短时(high temperature short time, HTST)巴氏杀菌温度71.2℃下,处理57 s时bLF的保留率为91.9%,损失速率k为8.7×10-4 s-1,D值为44.1 min,Z值(降一个D值对数值所需增加的温度)为17.37 ℃;其D值介于apo-LF(D=21.7 min)和holo-LF(D=75 min)中间。此外,含bLF的配方产品最终通过冷冻干燥或喷雾干燥将其转化为粉末,喷雾干燥(进口温度为180 ℃,出口温度为95 ℃)与冷冻干燥(-30 ℃干燥24 h、0 ℃干燥12 h、20 ℃干燥6 h)条件下bLF的结构和活性不受影响[8]。由上可得干燥时间(t)-温度(T)关系线为:t=-0.363×T+111.99, R2=0.994,其中t单位为h,T单位为K,R2为决定系数。因此,热巴氏杀菌条件比干燥条件更值得关注,bLF在生产制备过程中尽量选择较低的热巴氏处理温度并缩短热处理时间,才能保留较多的活性。
2.2.3 pH值的影响
bLF的抗菌活性随pH而异,bLF在80~130 ℃加热5~60 min,pH 2.0和3.0下bLF的抑菌效果优于pH 1.0和4.0[21]。通过测定bLF与铁的结合度,发现bLF的变性温度在pH 7.0下为70 ℃,但pH降至3.0时为39 ℃,此现象与pH值7.0时bLF与铁的结合度最大有关,故bLF在pH 7.0的稳定性最高[22]。虽然中酸性条件下均有利于保护bLF的活性,但生产中仍须选择最适pH值,以满足不同产品的需求。
2.2.4 生产工艺因素的影响
除了以上常见的影响因子,还应考虑添加bLF的产品其生产工艺是否对bLF的结构和活性产生影响,如发酵工艺。研究表明牛乳添加holo-LF或天然乳铁蛋白后再进行酸奶发酵,bLF稳定性没有显著性变化[8],添加bLF对酸奶的物理性质影响较小,因此酸奶可以作为bLF的载体,开发bLF相关的功能产品。
此外,当添加bLF的产品其生产过程中需要添加酶时,也须考虑酶对bLF结构和活性的影响,现有研究表明bLF被胃蛋白酶水解成乳铁蛋白素或乳铁蛋白抗菌肽时,其抗菌、抗病毒的能力会增强[2],但在实际生产中,还需要考虑bLF水解产物是否会被生产中的其他物质或工艺条件影响。
2.3 高新技术与保护剂的应用现况
除了上述加工因素和铁饱和度的调控外,提高bLF稳定性或降低热破坏以保留bLF活性也可利用高新技术或复配食品添加物来改善,策略包括:高压处理、欧姆加热和脉冲电场处理、保护剂(盐、多糖胶体)的使用。
2.3.1 高压处理的应用
在替代传统的热杀菌技术的高新非热杀菌技术中,高压加工技术可替代热巴氏杀菌处理,保留bLF更多活性,深具应用潜力。在高压加工时,所采用的压力是影响bLF活性的关键因素。bLF的保留率会因为压力的增加而降低,例如室温下bLF的保留率以300~500 MPa处理5~20 min时为70%~83%,而600 MPa处理1 min时则降为66%[17]。此外,高压处理30 min下,bLF的水溶解度随着压力的增加(0.1~700 MPa)呈现先增加后降低的趋势,在最适压力400 MPa下,bLF达到最大溶解度、乳化性和发泡能力[23]。综上,适当的高压处理(300~500 MPa)可提高bLF的保留率并改善其功能特性,在选择压力时要避免压力过高或加压时间过长造成bLF活性的损失。
2.3.2 欧姆加热和脉冲电场的应用
欧姆加热处理是另一种新颖的工艺,可替代热巴式杀菌应用于bLF加工上。DE FIGUEIREDO等[24]将欧姆加热技术应用到bLF,发现针对bLF溶液,传统加热处理(90℃, 30 min)所得bLF粒径约为76.0 nm,而同等温度时间的欧姆加热所得粒径为68.7 nm,显示欧姆加热处理导致的bLF聚集程度低于传统加热者。针对bLF溶液,脉冲电场处理(60 ℃、电压35 kV/cm、脉冲时间19.2 μs)的杀菌效果与热巴氏杀菌处理(63 ℃、30 min)的效果一样[25]。因此,为了防止热巴式杀菌对bLF活性的破坏,可考虑同等杀菌效果的欧姆加热或脉冲电场处理。
2.3.3 保护剂(盐、多糖胶体)的应用
除了工艺上的改进,在加工过程中加入一定量的保护剂,也可保护bLF,减少损失。LIU等[26]在研究bLF的过程中加入了盐离子,发现bLF-多酚复合物的聚集程度随盐离子浓度(0~0.2 mol/L)的增加先降低后增加,适量添加NaCl溶液(0.1 mol/L)可有效减少bLF-多酚复合物因加热(90 ℃, 20 min)导致的聚集程度。特定多糖胶也可作为bLF的保护剂,减低bLF在热加工过程中的变性程度,例如褐藻酸钠可通过静电吸附作用与bLF形成可溶性bLF-褐藻酸钠复合物,抑制了bLF的加热变性和聚集;且褐藻酸钠的浓度越高,bLF的热稳定性越好,质量分数0.04%褐藻酸钠使bLF二级结构维持在80%以上[27]。然而,尚未见糖醇类(常用于蛋白质抗冻保护剂)应用于保护bLF的相关研究。综上,盐、多糖胶体的静电包埋作用对bLF有保护效果,多糖胶体和糖醇类相当多样化,值得未来深入研究,以归纳出最适的多糖胶体或糖醇类保护剂及其优化的制备条件,有助于强化bLF的工业应用。综上,将目前已知维持乳铁蛋白的高稳定性与提高功能性的相关工艺流程整合于图3。
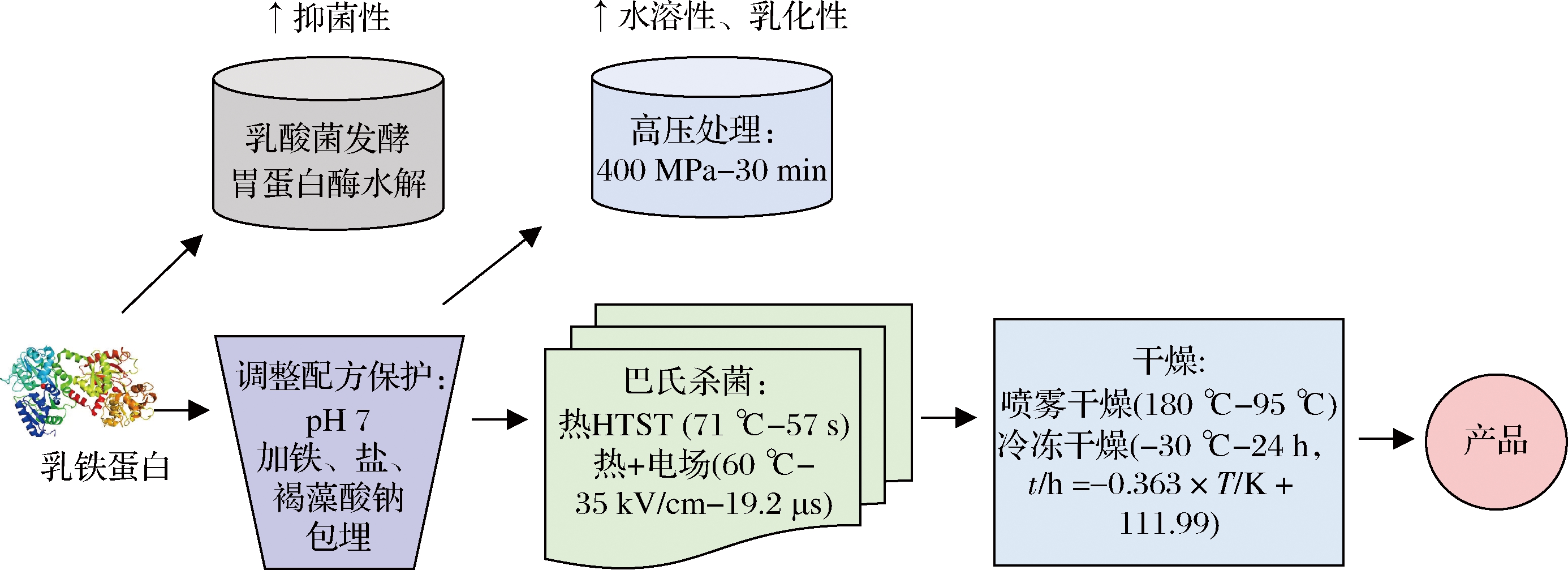
图3 提高乳铁蛋白稳定性与功能性的工艺整合流程
Fig.3 Integration flow chart of processes for increasing stability and functionality of lactoferrin
3 乳铁蛋白相关产品的研发与应用
图4是近十年来有关bLF在食品应用中针对不同人群的知识产权分布,国外对bLF的研究论文和专利数量皆远高于国内;整体上,以bLF应用于婴幼儿配方奶粉的研究主题的论文和专利数量最多(共约450篇),高于病患用疾病辅助品的研究和专利(共约260篇),远高于儿童和成年人用营养补充剂的研究与专利(共60~100篇)。老人用食品的研究和专利数量仍相当少。综上,bLF相关的研究论文与专利数量仍相当有限;研究论文和专利数量顺序依次为:婴儿>病患>儿童和成年>老人,显示针对老人、儿童和成人相关的bLF产品的研究有很大的研发空间,值得投入发展。由于2015年以前有关含乳铁蛋白食品的研发大都着重在配方奶粉和乳酸菌饮料的制备、生理功能与稳定性,已充分证实其具有提高免疫力、调节肠道菌群平衡及抗菌功能。因此,本综述特针对近5年(2017~2021年)新专利性研究的进展、有关新发现的多样生理功能,摘要说明如下。

图4 不同人群的乳铁蛋白研究分布
Fig.4 Distribution of studies on lactoferrin-related food products for different populations
3.1 乳铁蛋白在食品中的使用量
2000年,bLF被美国食品和药物管理局(U.S. Food and Drug Administration, FDA)批准为公认的安全物质,可用于不同的食品类别。欧洲委员会于2012年批准在特定食物中添加bLF以强化健康功能。同年,中华人民共和国国家卫生健康委员会(下称“卫健委”)发布的GB 14880—2012《食品安全国家标准 食品营养强化剂使用标准》将乳铁蛋白列入食品营养强化剂行列。表2比较了中国卫健委、美国FDA和欧盟委员会批准的食品中bLF的最大使用量[8]。中国目前规范的标准只涉及bLF应用到婴幼儿食品、风味发酵乳、调制乳以及含乳饮料,bLF最大使用量皆为100 mg/100 g。美国FDA允许bLF用于婴儿配方奶粉、奶粉、风味发酵乳、牛奶甜点及口香糖中,bLF使用量在100~400 mg/100 g。欧盟允许使用的食品范围更广,除了上述食品外,还包括不含酒精的饮料、糖、蛋糕和糕点以及奶酪基产品等,bLF用量范围在80~3 000 mg/100 g。各地区对bLF在特定食品中的最大用量的规范,与其膳食居民的饮食习惯有关,临床上每人每日摄取0.1~4.5 g bLF是安全无毒的(FDA),上述为产品研发者提供重要的bLF用量依据。
3.2 乳制品与机能饮料
乳铁蛋白最典型的应用方式是作为营养强化剂添加到婴幼儿配方奶粉、酸奶等乳制品中,以强化提升免疫力和调整肠道菌群稳态的功效,同时有助于婴幼儿神经发育与预防感染。临床研究发现,婴儿食用含0.6 g/L bLF的配方奶粉约365 d后神经发育状况完善,545 d后腹泻和呼吸相关不良事件显著减少[28]。奶粉配方中添加bLF (76 mg/100 g)可有效降低贫血婴儿腹泻和呼吸道感染的发病率[29]。这些研究表明强化bLF的婴儿配方奶粉可为婴幼儿提供功能性蛋白质和更快的能量,降低疾病发生率。此外,bLF在功能性饮料配方中的研究进展,如王春维等[30]将bLF(质量分数0.05%~0.6%)与高甲氧基果胶、维生素E、中链甘油三酸酯和鱼油等功能性物质制备成粒径小(400 nm)、溶液分布均一的速能饮品,能储存100 d以上不会出现分层现象。此为功能性蛋白质饮料的研发提供创新思维。由于国内bLF相关的机能性饮料较少,可能受限于bLF的生产成本和稳定性,亟待解决相关问题,以促进更多的相关产品研发,尤其是疾病患者所需的特医类饮料。
表2 官方核准的牛乳铁蛋白应用于食品中预期用途和最大使用量 单位:mg/100 g
Table 2 Intended uses and maximum levels authorized for bovine lactoferrin in foods
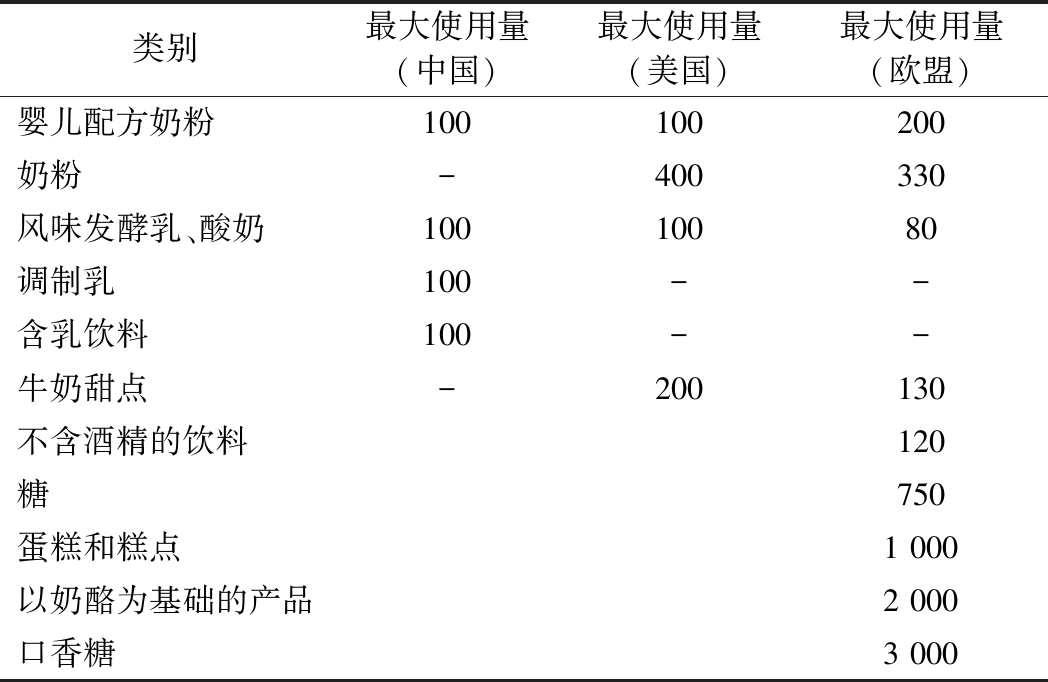
类别最大使用量(中国)最大使用量(美国)最大使用量(欧盟)婴儿配方奶粉100 100 200奶粉-400 330 风味发酵乳、酸奶100 100 80 调制乳100 --含乳饮料100 --牛奶甜点-200 130 不含酒精的饮料挠挠120 糖挠挠750 蛋糕和糕点挠挠1 000 以奶酪为基础的产品挠挠2 000 口香糖挠3 000
注:-表示未规定
3.3 辅助疾病预防的特医食品
3.3.1 在提升免疫相关疾病中的应用潜力
刘宁等[31]发明了一种针对提升6~12个月龄婴儿免疫力的营养配方米粉,配方中含有bLF、磷脂、枸杞粉等多种提升免疫力的成分,米粉冲调性好且不易结块,有益于婴幼儿的消化吸收,在满足婴幼儿基本营养需求的同时,解决了婴儿免疫力低下的问题。bLF在增强免疫力方面有一定的市场,可作为食品营养补充剂添加到除奶粉以外的食品配方中增强产品免疫功效。
3.3.2 在促进骨骼生长中的应用潜力
bLF及其水解产物有助于促进骨骼生长,主要通过促进成骨细胞的增殖和分化来实现,研究发现口服bLF(100 mg/kg)可以代替维生素D,有效地促进成骨细胞的增殖和分化,效果是维生素D的2~3倍[32]。ZHANG等[33]也发现bLF(铁饱和度17.9%)可以促进成骨细胞的增殖,质量浓度为100 μg/mL的效果最好。bLF是潜在的生物活性食品补充剂,预防相关疾病。
3.3.3 在预防治疗阿兹海默病中的应用潜力
LF具有缓解与衰老相关的认知衰退方面的潜力,口服bLF可预防阿尔茨海默病(alzheimer disease, AD)。MOHAMED等[34]阐明了LF通过影响AD病理中炎症和氧化应激的关键因子,减轻AD病理反应和认知能力下降。AGWA等[35]利用脑内皮细胞存在LF受体,制备了由bLF与共轭亚油酸(CLA)组成、粒径约53 nm的纳米胶束,将CLA靶向输送到脑组织中,对CLA的包封率达到76.0%,载药量为8.7%,有效清除AD进展过程中产生的自由基。因此,含bLF口服液可发展为特医类食品饮料,具有预防AD的潜力。
3.4 口腔保健食品和清洁用品
bLF在口腔保健方面具有应用潜力,近5年来国内外的最新专利如表3所示,共有5项发明专利,其一为添加了质量分数为1%~5% bLF的半边莲抗口腔幽门螺杆菌口腔喷剂,操作简单且口腔幽门螺杆菌去除率达到90%[36]。其二为含质量分数为0.1% bLF的口腔菌丛改善剂应用于洗口剂时,可有效抑制口腔病原菌和口臭菌的生长,改善口腔菌相[37]。另外,一种含有bLF(质量分数为0.1%~1% )能够缓解口干症、牙龈炎和去除口臭的牙膏,有效率达30%,还能减少牙龈炎相关细菌,减少率在25%以上[38]。此外,一种口腔溃疡膜剂,放入口中后能紧密黏附在口腔内表面,膜剂在口腔内的溶解时间是商品口腔膜剂的3~5倍,治疗口腔溃疡效果较好[39]。国外最新一项关于bLF的专利发现,bLF (质量分数为1% )与SiO2的复合物能够维持抗氧化和抗菌效果,时效长达20 d[40]。目前市场上已有添加bLF的口腔清洁产品,如DR.Wolff’s Biorepair牙膏和漱口水、Bluem口气清新剂等,有缓解口干症、预防牙周炎等功效。bLF在口腔保健方面有广阔的应用市场,然而尚缺国内自主品牌的产品,值得国人投入研发基于大健康政策与适合国人体质与特定健康目的的产品。
表3 bLF在口腔健康管理中的应用专利
Table 3 Application patent of bovine lactoferrin in oral health management

专利名称主要配方bLF质量分数/%优点半边莲抗口腔幽门螺杆菌喷剂[36]乳铁蛋白、半边莲、连翘酯苷、茶多酚、甘草甜素、酶制剂1~5使用简单;口腔幽门螺杆菌去除率90%口腔菌丛改善剂及口腔用组合物[37]乳铁蛋白、唾液酸、乳酮糖、精胺、精素0.1改善口腔菌相,抑制多种口腔病原菌、牙周病菌和口臭菌的生长,促进非病原菌生长一种治疗口干症的口腔护理组合物及其应用[38]乳铁蛋白、蔗糖丸芯、微晶纤维素、聚乳酸-羟基乙酸共聚物、山梨醇、甘油、木糖醇等0.1~1缓解口干症状、牙龈炎、去除口臭,有效率30%左右;减少牙龈炎相关细菌,减少率>25% 一种口腔溃疡膜剂及其制备方法[39]乳铁蛋白、聚乙烯醇、羧甲基纤维素钠、甘油、冰片、维生素、甜蜜素、乙醇6~10使用简单;膜剂厚度均一,口腔黏附效果好;在口腔内存在的时效长,是商品口腔膜剂的3~5倍;能够有效治疗口腔溃疡乳铁蛋白与SiO2的复合物、生产工艺及口腔卫生成分[40]乳铁蛋白、甘油、二氧化硅等1维持抗氧化和抗菌效果长达20 d
4 总结
综上,LF是机体内非常重要的多功能活性物质,兼具免疫活性与广谱抑菌性。可用于促进并平衡免疫系统、调整肠道功能的机能食品或饮料,也具有应用于特医食品以辅助治疗病源微生物源疾病的潜力,同时可作为抗菌药物的佐剂,应用领域广泛且深具商业价值。综合研发与应用的最新现况,bLF在多项领域最新授权的应用研究专利,已有的研究成果和专利如图5所示,表明LF(以bLF为主)在多项领域发挥着不同功效,如增强免疫、抗炎抗过敏、抑制微生物生长、调节菌群稳态、预防并治疗口腔问题、辅助疾病治疗等,因此bLF可应用在乳制品、功能饮料、膳食辅助食品、口腔保健清洁品、药物佐剂等多项领域,满足人类对健康生活的追求。
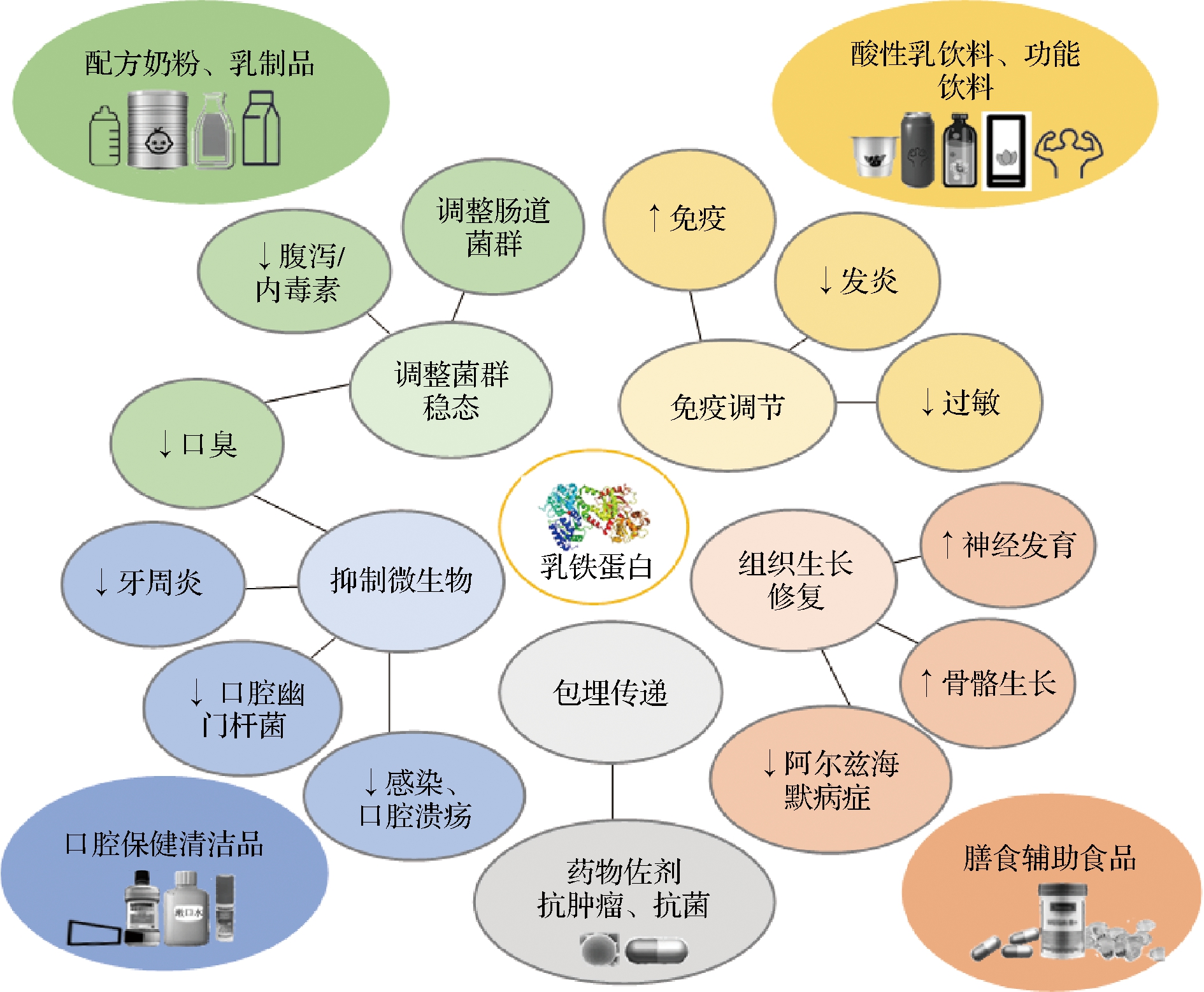
图5 乳铁蛋白的功效及产品应用图谱
Fig.5 Pictorial illustration for the functionality and product application of lactoferrin
5 展望
本文总结了加工过程中影响乳铁蛋白的结构和活性的因素(原料选择、加热、调节pH、发酵、高压处理、电场处理和添加保护剂)以及最新授权的应用研究专利。但目前国内相关商品仍有限,可能是与bLF生产成本昂贵且在加工、贮存或售架过程中不稳定有关。因此未来仍须针对高效量产活性bLF的技术持续创新,并针对各类bLF产品的配方与加工特性,深入研究有效的保护技术(例如纳米或微胶囊包埋)、保护剂配方或佐剂,使bLF产品维持商业上所需的稳定性、功能活性、长效性以及控制释放特性。此外,bLF配方在消化过程中的代谢组学特征也值得深入研究,阐明其体内代谢物分布图谱和功能机理,有助于含bLF特医食品配方的研发。期望扩展bLF应用范畴,提高相关产业的商业价值,促进社会大健康发展。
[1] LEGRAND D. Overview of lactoferrin as a natural immune modulator[J]. The Journal of Pediatrics, 2016, 173: S10-S15.
[2] MORENO-EXP SITO L, ILLESCAS-MONTES R, MELGUIZO-RODR
SITO L, ILLESCAS-MONTES R, MELGUIZO-RODR GUEZ L, et al. Multifunctional capacity and therapeutic potential of lactoferrin[J]. Life Sciences, 2018, 195:61-64.
GUEZ L, et al. Multifunctional capacity and therapeutic potential of lactoferrin[J]. Life Sciences, 2018, 195:61-64.
[3] IGLESIAS-FIGUEROA B F, ESPINOZA-S NCHEZ E A, SIQUEIROS-CEND
NCHEZ E A, SIQUEIROS-CEND N T S, et al. Lactoferrin as a nutraceutical protein from milk, an overview[J]. International Dairy Journal, 2019, 89:37-41.
N T S, et al. Lactoferrin as a nutraceutical protein from milk, an overview[J]. International Dairy Journal, 2019, 89:37-41.
[4] VOSWINKEL L, VOGEL T, KULOZIK U. Impact of the iron saturation of bovine lactoferrin on adsorption to a strong cation exchanger membrane[J]. International Dairy Journal, 2016, 56:134-140.
[5] RAI D, ADELMAN A S, ZHUANG W H, et al. Longitudinal changes in lactoferrin concentrations in human milk: A global systematic review[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(12):1539-1547.
[6] SIENKIEWICZ M, JA KIEWICZ A, TARASIUK A, et al. Lactoferrin: An overview of its main functions, immunomodulatory and antimicrobial role, and clinical significance[J]. Critical Reviews in Food Science and Nutrition, 2021.DOI:10.1080/10408398.2021.1895063.
KIEWICZ A, TARASIUK A, et al. Lactoferrin: An overview of its main functions, immunomodulatory and antimicrobial role, and clinical significance[J]. Critical Reviews in Food Science and Nutrition, 2021.DOI:10.1080/10408398.2021.1895063.
[7] DRAGO-SERRANO M E, CAMPOS-RODR GUEZ R, CARRERO J C, et al. Lactoferrin: Balancing ups and downs of inflammation due to microbial infections[J]. International Journal of Molecular Sciences, 2017, 18(3):501.
GUEZ R, CARRERO J C, et al. Lactoferrin: Balancing ups and downs of inflammation due to microbial infections[J]. International Journal of Molecular Sciences, 2017, 18(3):501.
[8] FRANCO I, PÉREZ M D, CONESA C, et al. Effect of technological treatments on bovine lactoferrin: An overview[J]. Food Research International, 2018, 106:173-182.
[9] LIU H Y, BOGGS I, WEEKS M, et al. Kinetic modelling of the heat stability of bovine lactoferrin in raw whole milk[J]. Journal of Food Engineering, 2020, 280:109977.
[10] KROLITZKI E, SCHWAMINGER S P, PAGEL M, et al. Current practices with commercial scale bovine lactoferrin production and alternative approaches[J]. International Dairy Journal, 2022, 126:105263.
[11] ANDERSSON J, MATTIASSON B. Simulated moving bed technology with a simplified approach for protein purification[J]. Journal of Chromatography A, 2006, 1 107(1-2):88-95.
[12] ULBER R, PLATE K, WEISS T, et al. Downstream processing of bovine lactoferrin from sweet whey[J]. Acta Biotechnologica, 2001, 21(1):27-34.
[13] SAUFI S M, FEE C J. Recovery of lactoferrin from whey using cross-flow cation exchange mixed matrix membrane chromatography[J]. Separation and Purification Technology, 2011, 77(1):68-75.
[14] VOSWINKEL L, KULOZIK U. Fractionation of all major and minor whey proteins with radial flow membrane adsorption chromatography at lab and pilot scale[J]. International Dairy Journal, 2014, 39(1):209-214.
[15] ZHANG J L, DI W, GONG P M, et al. Direct and fast capture lactoferrin from cheese whey on nanoparticles of Fe3O4 combined with concanavalin A[J]. Food Chemistry, 2019, 274:314-318.
[16] MACIEL K S, SANTOS L S, BONOMO R C F, et al. Purification of lactoferrin from sweet whey using ultrafiltration followed by expanded bed chromatography[J]. Separation and Purification Technology, 2020, 251:117324.
[17] WAZED M A, ISMAIL M, FARID M. Pasteurized ready-to-feed (RTF) infant formula fortified with lactoferrin: A potential niche product[J]. Journal of Food Engineering, 2020, 273:109810.
[18] XIONG L, BOEREN S, VERVOORT J, et al. Effect of milk serum proteins on aggregation, bacteriostatic activity and digestion of lactoferrin after heat treatment[J]. Food Chemistry, 2021, 337:127973.
[19] GOULDING D A, O’REGAN J, BOVETTO L, et al. Influence of thermal processing on the physicochemical properties of bovine lactoferrin[J]. International Dairy Journal, 2021, 119:105001.
[20] MOREL J, MD ZAIN S N, ARCHER R. Comparison of drying techniques for bovine lactoferrin: Iron binding and antimicrobial properties of dried lactoferrin[J]. International Dairy Journal, 2022, 124:105142.
[21] SAITO H, MIYAKAWA H, TAMURA Y, et al. Potent bactericidal activity of bovine lactoferrin hydrolysate produced by heat treatment at acidic pH[J]. Journal of Dairy Science, 1991, 74(11):3 724-3 730.
[22] SREEDHARA A, FLENGSRUD R, PRAKASH V, et al. A comparison of effects of pH on the thermal stability and conformation of caprine and bovine lactoferrin[J]. International Dairy Journal, 2010, 20(7):487-494.
[23] HE X Y, MAO L J, GAO Y X, et al. Effects of high pressure processing on the structural and functional properties of bovine lactoferrin[J]. Innovative Food Science & Emerging Technologies, 2016, 38:221-230.
[24] DE FIGUEIREDO FURTADO G, PEREIRA R N C, VICENTE A A, et al. Cold gel-like emulsions of lactoferrin subjected to ohmic heating[J]. Food Research International, 2018, 103:371-379.
[25] SUI Q, ROGINSKI H, WILLIAMS R P W, et al. Effect of pulsed electric field and thermal treatment on the physicochemical properties of lactoferrin with different iron saturation levels[J]. International Dairy Journal, 2010, 20(10):707-714.
[26] LIU F G, WANG D, MA C C, et al. Conjugation of polyphenols prevents lactoferrin from thermal aggregation at neutral pH[J]. Food Hydrocolloids, 2016, 58:49-59.
[27] LI Q Y, LAN H J, ZHAO Z T. Protection effect of sodium alginate against heat-induced structural changes of lactoferrin molecules at neutral pH[J]. LWT, 2019, 99:513-518.
[28] LI F, WU S S, BERSETH C L, et al. Improved neurodevelopmental outcomes associated with bovine milk fat globule membrane and lactoferrin in infant formula: A randomized, controlled trial[J]. The Journal of Pediatrics, 2019, 215:24-31.
[29] CHEN K, JIN S S, CHEN H X, et al. Dose effect of bovine lactoferrin fortification on diarrhea and respiratory tract infections in weaned infants with anemia: A randomized, controlled trial[J]. Nutrition, 2021, 90:111288.
[30] 王春维, 李奥, 彭凯迪, 等. 乳铁蛋白-高甲氧基果胶速能饮品的制备方法: 中国,CN106472923A[P]. 2018-04-17.
WANG C W, LI A, PENG K D, et al. Preparation method of lactoferrin-high methoxyl pectin rapid-energy-supply beverage: China, CN106472923A[P]. 2018-04-17.
[31] 刘宁, 任皓威, 杨翠翠. 一种提高6~12个月龄婴儿免疫力的营养配方米粉: 中国, CN107549612B[P]. 2021-01-12.
LIU N, REN H W, YANG C C. Nutritive formula rice flour capable of enhancing immunity of babies of 6-12 months old: China, CN107549612B[P]. 2021-01-12.
[32] 郭慧媛, 李依璇, 张昊, 等. 乳铁蛋白通过维生素D受体调控骨生成的研究: 中国,CN108671225A[P]. 2018-10-19.
GUO H Y, LI Y X, ZHANG H, et al. Study on lactoferrin regulation of bone formation by means of vitamin D receptor: China, CN108671225A[P]. 2018-10-19.
[33] ZHANG J L, HAN X, SHAN Y J, et al. Effect of bovine lactoferrin and human lactoferrin on the proliferative activity of the osteoblast cell line MC3T3-E1 in vitro[J]. Journal of Dairy Science, 2018, 101(3):1 827-1 833.
[34] MOHAMED W A, SALAMA R M, SCHAALAN M F. A pilot study on the effect of lactoferrin on Alzheimer’s disease pathological sequelae: Impact of the p-Akt/PTEN pathway[J]. Biomedicine & Pharmacotherapy, 2019, 111:714-723.
[35] AGWA M M, ABDELMONSIF D A, KHATTAB S N, et al. Self- assembled lactoferrin-conjugated linoleic acid micelles as an orally active targeted nanoplatform for Alzheimer’s disease[J]. International Journal of Biological Macromolecules, 2020, 162:246-261.
[36] 卞雪莲, 郁世芳, 徐春芬, 等. 半边莲抗口腔幽门螺杆菌喷剂: 中国,CN103920143A[P]. 2017-02-01.
BIAN X L, YU S F, XU C F, et al. Chinese lobelia spray for resisting oral helicobacter pylori: China, CN103920143A[P]. 2017-02-01.
[37] TAKIMOTO Y, MARUYAMA M, MORISHIMA S, et al. Agent for improving bacterial flora in oral cavity and oral composition: Japan, WO/2019/208699[P]. 2019-10-31.
[38] 江山. 一种治疗口干症的口腔护理组合物及其应用: 中国,CN106729649A[P]. 2017-05-31.
JIANG S. Oral care composition for treating xerostomia and application of oral care composition: China, CN106729649A[P]. 2020-11-10.
[39] 方雅悯, 于胜龙, 丁海燕, 等. 一种口腔溃疡膜剂及其制备方法:中国,CN106177923A[P]. 2016-12-07.
FANG Y M, YU S L, DING H Y, et al. Oral ulcer membrane and preparation method thereof: China, CN106177923A[P]. 2016-12-07.
[40] ISABEL C C J. Complex of lactoferrin and silica, process for preparing and compositions for oral hygiene: America, US/2021/085589[P]. 2021-09-15.