浓香型白酒是我国三大基本香型之一,其“窖香浓郁、绵柔甘洌、香味协调”的风格特点深受广大消费者喜爱,其消费总量占全国白酒的70%左右[1]。浓香型白酒通常以高粱、小麦、玉米等为主要原料,发酵过程中形成的大曲、窖泥和黄水等基质为白酒发酵过程提供了丰富的微生物,主要以芽胞杆菌、乳酸菌、高温放线菌等微生物为主[2-3],微生物能够为白酒发酵过程提供糖化发酵力,是白酒特征风味物质的主要来源。近年来,随着高通量测序技术和GC-MS技术的不断发展,解析微生物发酵代谢产物,探究白酒风味与微生物之间的关系,对提高白酒的产量和质量具有重要的意义。
芽胞杆菌属在白酒发酵过程中含量较多,且在自然界分布较广,能够分泌产生淀粉酶、蛋白酶、脂肪酶和纤维素酶等酶类物质,较其他微生物具有耐酸、耐乙醇、耐高温等优点[4-7]。目前,芽胞杆菌的开发和应用主要集中在枯草芽胞杆菌、地衣芽胞杆菌、解淀粉芽胞杆菌等菌株[8-10],针对其他芽胞杆菌的功能性研究相对较少。前期,本实验室从我国四川省宜宾地区浓香型白酒的黄水样品中分离到1株新种菌株黄水芽胞杆菌Bacillus aquiflavi 3H-10[11],是我国四川省宜宾地区首株酿酒微生物新种菌株,对于揭示宜宾地区浓香型白酒发酵过程机制具有重要价值。
为探究B.aquiflavi 3H-10在白酒发酵过程中的潜在功能特性,本研究基于第二代BGISEQ-500RS测序平台对菌株进行高通量测序获得基因组序列,预测其产酶基因及遗传基础,并测定菌株产生生物酶的能力、酶活力大小及发酵风味物质,为明晰该菌株在白酒发酵过程中的作用机制及后续大规模生产应用提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
黄水芽胞杆菌B.aquiflavi 3H-10,分离自我国四川省宜宾市五粮液浓香型白酒的黄水样品,保藏于中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC),保藏编号为CICC 24755。
1.1.2 试剂及耗材
福林酚,北京博奥拓达科技有限公司;三氯乙酸,天津市福晨化学试剂厂;酪蛋白,北京欣经科生物技术公司。
1.1.3 培养基
大豆酪蛋白琼脂(tryptose soya agar,TSA)培养基、大豆酪蛋白液体(tryptose soya broth,TSB)培养基,碧迪医疗器械(上海)有限公司。
蛋白酶培养基(g/L):KH2PO4 0.36、Na2HPO4 1.07、MgSO4 0.5、CaCl2 0.02、ZnCl2 0.14、NaCl 0.16、FeSO4 0.002、胰蛋白胨0.05、脱脂奶粉10、琼脂20、pH 6.5,113 ℃灭菌15 min。
淀粉酶培养基(g/L):糊精20、NaNO3 3.3、KCl 0.5、K3HPO4 1.0、FeSO4 0.01、MgSO4 5.0、琼脂 20、pH 6.5,113 ℃灭菌15 min。
纤维素酶培养基(g/L):羧甲基纤维素钠5.0、酵母膏0.1、蛋白胨0.5、琼脂20、pH 5.5~6.0,113 ℃ 灭菌15 min。
酯酶培养基(g/L):马铃薯200、蔗糖20、三丁酸甘油酯4.0、琼脂20.0、罗丹明B 0.2、pH 6.5,113 ℃灭菌15 min。
1.2 仪器与设备
2000型分光光度计,尤尼柯(上海)仪器有限公司;分析天平,梅特勒-托利多仪器(上海)有限公司;BHG—8082型恒温培养箱、THZ-98C恒温振荡培养箱,上海一恒科学仪器有限公司;HH-3A水浴锅,常州国华电器有限公司。
1.3 实验方法
1.3.1 B.aquiflavi 3H-10发酵液制备
将B.aquiflavi 3H-10冻干菌粉溶解后接种于TSA斜面培养基,37 ℃培养72 h得到斜面种子。选取单菌落接种于TSB液体培养基,37 ℃ 180 r/min摇床培养72 h得到发酵液,备用。
1.3.2 B.aquiflavi 3H-10全基因组测序及生物学分析
利用商业化细菌基因组DNA提取试剂盒(Bacterial DNA Kit,D3350)提取菌株的基因组DNA,利用MGIEasy通用DNA文库制备试剂套装构建文库,将质控合格后的文库按照BGISEQ-500RS高通量测序试剂套装(PE100)的操作说明完成上机测序。对下机数据进行过滤质控,去除质量值连续≤20的碱基数达到40%的序列、含N碱基数目>2%的序列和含有接头和重复序列污染的序列。过滤后的数据利用SPAdes v3.11.0软件进行多个Kmer参数的拼接,得到最优的组装结果作为菌株的基因组序列。使用Prodigal v2.6.3软件进行基因预测,获得各基因的核酸序列与蛋白质序列。将蛋白质序列与KEGG(Kyoto Encyclopedia of Genes and Genomes)[12]、NR(Non-Redundant Protein Sequence Database)[13]和CAZy(The Carbohydrate-Active Enzymes database)[14]数据库进行比对,预测B.aquiflavi 3H-10基因的功能。
1.3.3 B.aquiflavi 3H-10产生物酶能力分析
利用平板透明圈法对B.aquiflavi 3H-10产生物酶的潜力进行初步分析。将灭菌后的滤纸片分别放置于蛋白酶培养基、淀粉酶培养基、纤维素酶培养基和酯酶培养基的平板表面,每个平板上均匀放置3个滤纸片。取1.3.1发酵液20 μL分别接种到滤纸片上,待菌液稍吹干后将平板倒置于37 ℃培养。72 h后取出平板,肉眼观察蛋白酶培养基平板和酯酶培养基平板的滤纸片周围有无透明圈出现。在淀粉酶培养基平板和纤维素酶培养基平板中分别倒入5 mL 0.02 mol/L碘液和5 mL 0.2%刚果红溶液,使溶液均匀覆盖于培养基表面,放置5~10 min后,观察滤纸周围有无透明圈。
1.3.4 B.aquiflavi 3H-10蛋白酶酶活性测定
将1.3.1中得到的发酵液12 000 r/min,4 ℃,离心5 min,收集上清液,根据GB/T 23527—2009《蛋白酶制剂》的福林酚法测定初始粗酶液的蛋白酶活力。将40 ℃下1 min水解酪蛋白产生l μg酪氨酸定义为1个蛋白酶活力单位。发酵液蛋白酶活力按公式(1)计算:
发酵液蛋白酶活力![]()
(1)
式中:A,由标准曲线得出的样品最终稀释液的活力,U/mL;V,溶解样品所使用的容量瓶体积,mL;4,反应试剂的总体积,mL;n,样品稀释的倍数;m,样品的质量,g;1/10,反应时间10 min,以1 min计。
1.3.5 B.aquiflavi 3H-10发酵液风味物质测定
取TSA斜面培养基上的单菌落,接种于TSB液体培养基,37 ℃,180 r/min摇床培养72 h得到发酵液。利用GC-MS[15]测定发酵液中的代谢风味产物,分析B.aquiflavi 3H-10发酵产生的主体风味。使用未接种菌体的TSB液体培养基作为空白对照。
2 结果分析
2.1 B.aquiflavi 3H-10全基因组概况
利用BGISEQ-500RS高通量测序技术,并通过生物学软件质控、组装等分析,获得B.aquiflavi 3H-10的全基因组序列,GenBank登录号为JAAIWN000000000。组装得到120条scaffold,基因组大小为3.62 Mb,G+C含量为35.40 mol%,预测3 224个蛋白质编码基因、79个tRNA基因、14个rRNA基因以及4个其他RNA基因,测序质量良好。菌株B.aquiflavi 3H-10基因组与其近缘物种基因组的一般特性相一致[16],可以用于后续功能基因注释分析。
2.2 B.aquiflavi 3H-10产蛋白酶相关基因分析
将B.aquiflavi 3H-10基因的蛋白质序列与KEGG数据库和NR数据库进行比对,结果显示,共预测到22种编码蛋白酶的相关基因(表1)。其中,包括1个编码孢子蛋白酶YyaC的基因,产物具有裂解酸溶性小分子芽胞蛋白的功能[17];1个受控膜内蛋白水解(regulated intramembrane proteolysis,RIP)金属蛋白酶RseP编码基因和1个位点2蛋白酶家族蛋白,有研究报道,RseP在大肠杆菌中作为位点2蛋白酶的直系同源体,能够切割跨膜序列、释放跨膜蛋白信号[18]。此外,还包括与2个扁菱形家族膜内丝氨酸蛋白酶、6个CAAX蛋白酶和细菌素处理蛋白(CAAX proteases and bacteriocin-processing protein,CPBP)家族膜内金属蛋白酶、2个锌金属蛋白酶、7个ATP依赖的LonB、HslV、Clp家族蛋白和2个蛋白质调节剂相关的编码基因。这些丰富的蛋白酶编码基因提示,菌株B.aquiflavi 3H-10可能具有产生和分泌蛋白酶的潜力。
表1 B.aquiflavi 3H-10蛋白酶相关基因注释结果
Table 1 Annotation result of protease genes in strain B.aquiflavi 3H-10
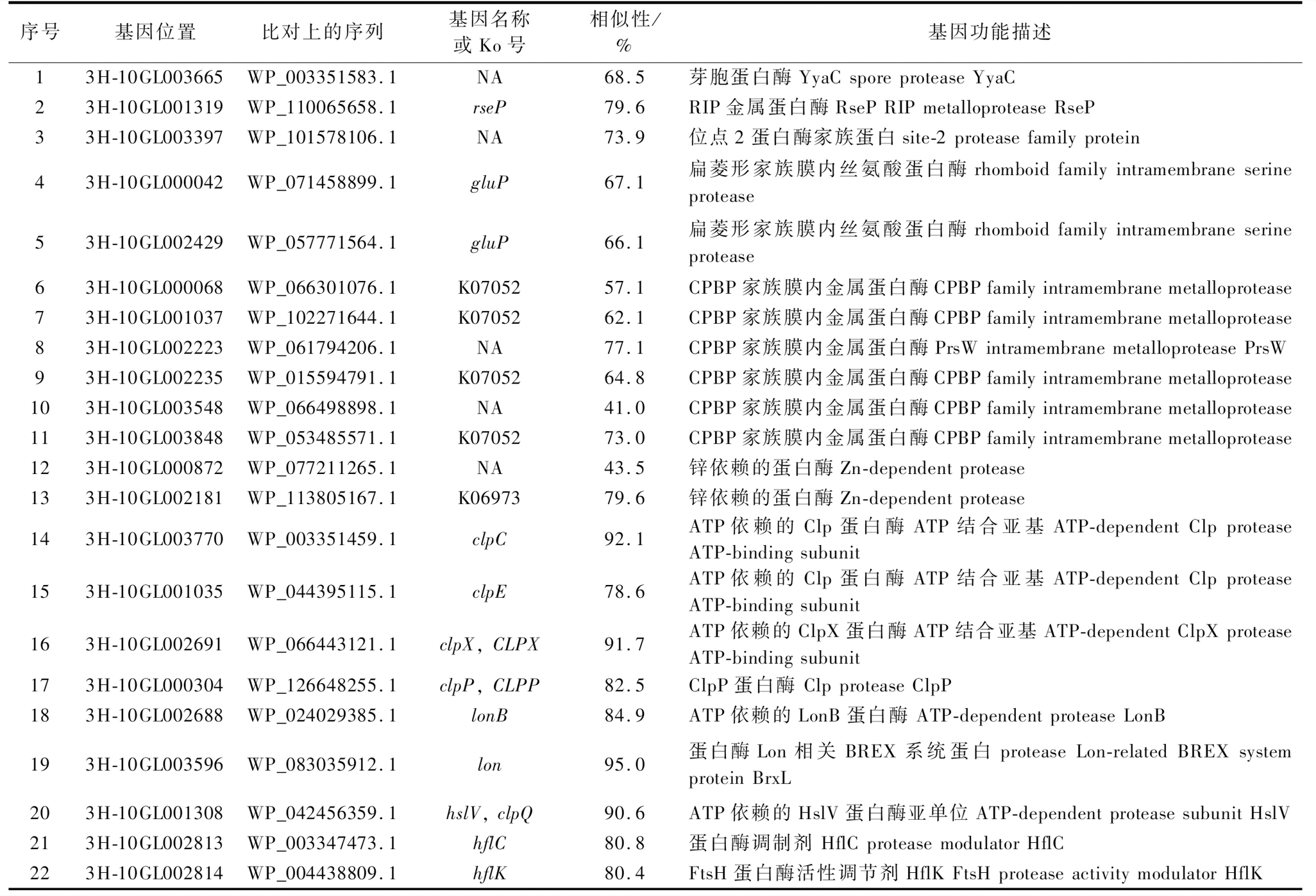
序号基因位置比对上的序列基因名称或Ko号相似性/%基因功能描述13H-10GL003665WP_003351583.1NA68.5芽胞蛋白酶YyaC spore protease YyaC23H-10GL001319WP_110065658.1rseP79.6RIP金属蛋白酶RseP RIP metalloprotease RseP33H-10GL003397WP_101578106.1NA73.9位点2蛋白酶家族蛋白site-2 protease family protein43H-10GL000042WP_071458899.1gluP67.1扁菱形家族膜内丝氨酸蛋白酶rhomboid family intramembrane serine protease53H-10GL002429WP_057771564.1gluP66.1扁菱形家族膜内丝氨酸蛋白酶rhomboid family intramembrane serine protease63H-10GL000068WP_066301076.1K0705257.1CPBP家族膜内金属蛋白酶CPBP family intramembrane metallopro-tease73H-10GL001037WP_102271644.1K0705262.1CPBP家族膜内金属蛋白酶CPBP family intramembrane metallopro-tease83H-10GL002223WP_061794206.1NA77.1CPBP家族膜内金属蛋白酶PrsW intramembrane metalloprotease PrsW93H-10GL002235WP_015594791.1K0705264.8CPBP家族膜内金属蛋白酶CPBP family intramembrane metallopro-tease103H-10GL003548WP_066498898.1NA41.0CPBP家族膜内金属蛋白酶CPBP family intramembrane metallopro-tease113H-10GL003848WP_053485571.1K0705273.0CPBP家族膜内金属蛋白酶CPBP family intramembrane metallopro-tease123H-10GL000872WP_077211265.1NA43.5锌依赖的蛋白酶Zn-dependent protease133H-10GL002181WP_113805167.1K0697379.6锌依赖的蛋白酶Zn-dependent protease143H-10GL003770WP_003351459.1clpC92.1ATP依赖的Clp蛋白酶ATP结合亚基ATP-dependent Clp protease ATP-binding subunit153H-10GL001035WP_044395115.1clpE78.6ATP依赖的Clp蛋白酶ATP结合亚基ATP-dependent Clp protease ATP-binding subunit163H-10GL002691WP_066443121.1clpX, CLPX91.7ATP依赖的ClpX蛋白酶ATP结合亚基ATP-dependent ClpX protease ATP-binding subunit173H-10GL000304WP_126648255.1clpP, CLPP82.5ClpP蛋白酶 Clp protease ClpP183H-10GL002688WP_024029385.1lonB84.9ATP依赖的LonB蛋白酶 ATP-dependent protease LonB193H-10GL003596WP_083035912.1lon95.0蛋白酶Lon相关BREX系统蛋白protease Lon-related BREX system protein BrxL203H-10GL001308WP_042456359.1hslV, clpQ90.6ATP依赖的HslV蛋白酶亚单位ATP-dependent protease subunit HslV213H-10GL002813WP_003347473.1hflC80.8蛋白酶调制剂 HflC protease modulator HflC223H-10GL002814WP_004438809.1hflK80.4FtsH蛋白酶活性调节剂HflK FtsH protease activity modulator HflK
2.3 B.aquiflavi 3H-10碳水化合物活性酶分析
碳水化合物活性酶(carbohydrate-active enzymes,CAZy)是微生物代谢的重要酶类,在代谢过程中主要发挥降解、修饰及生成糖苷键的功能。根据蛋白质结构域中的氨基酸序列相似性,可将CAZy划分为糖苷水解酶类(glycoside hydrolases, GHs)、糖基转移酶类(glycosyl transferases, GTs)、多糖裂解酶类(polysaccharide lyases, PLs)、糖水化合物酯酶类(carbohydrate esterases, CEs)、辅助模块酶类(auxiliary activities, AAs)和碳水化合物结合结构域(carbohydrate-binding modules, CBM)等蛋白质家族,目前被收录于CAZy数据库中[14]。通过与CAZy数据库比对,B.aquiflavi 3H-10中共含有17个CAZy(图1)。
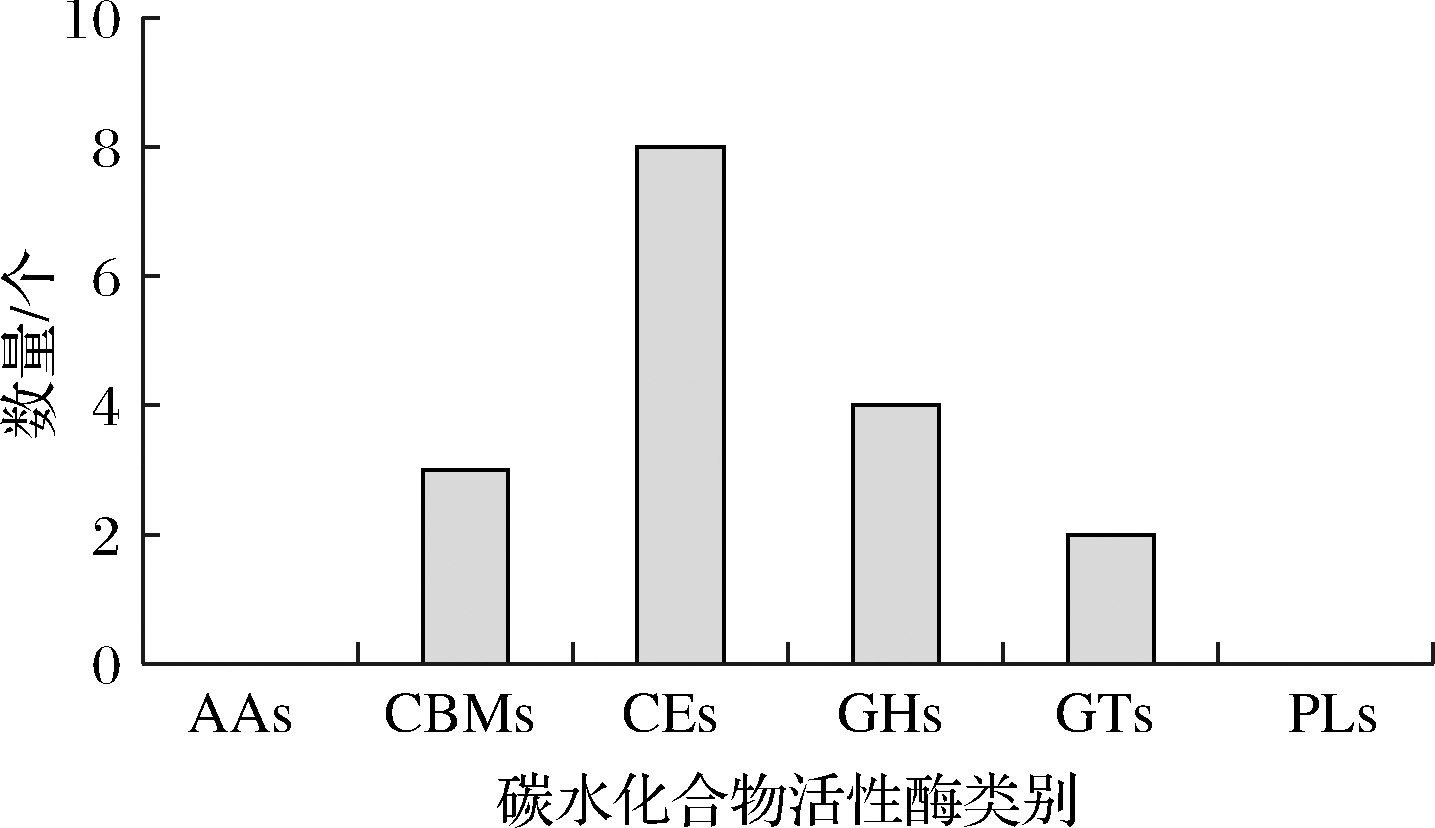
图1 B.aquiflavi 3H-10中不同类别的CAZy相关基因分布情况
Fig.1 Distribution of genes related to CAZy in B.aquiflavi 3H-10
由图1可以看到,CEs含量较高,所占比例为47.06%;其次依次为GHs、CBMs、GTs,所占比例分别为23.53%、17.65%和11.76%;不含有AAs和PLs。其中,CBMs可以促进酶与底物的结合,克服了水解酶类对不溶性多糖降解效率低的缺点[19]。这些酶类可为美拉德反应提供重要的糖类小分子物质,有助于酯类、纤维素和半纤维素等的酶促降解,因此推测B.aquiflavi 3H-10在白酒发酵过程中对底物原料的降解发挥着重要作用。
2.4 B.aquiflavi 3H-10的产酶特性及酶活力
通过观察平板上的透明圈发现,B.aquiflavi 3H-10在蛋白酶培养基平板上可观察到清晰的透明圈(图2),在淀粉酶培养基、纤维素酶培养基和酯酶培养基平板上无明显的透明圈。由此可见,该菌株具有较强的产生蛋白酶的能力,与其基因组中检测到多个蛋白酶编码基因的结果一致。
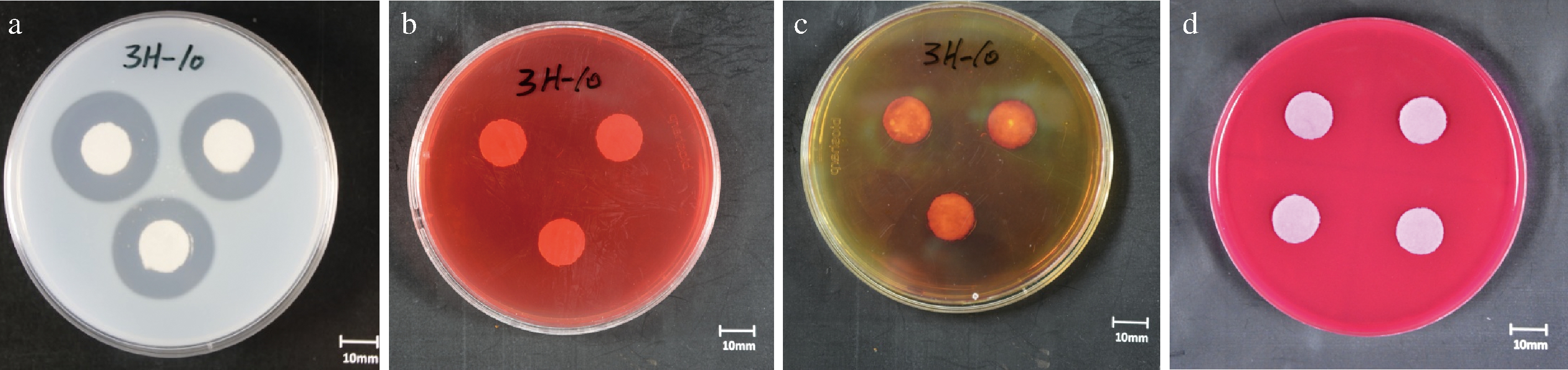
a-蛋白酶活力;b-纤维素酶活力;c-淀粉酶活力;d-酯酶活力
图2 B.aquiflavi 3H-10酶活力平板测定结果
Fig.2 Enzyme activity of B.aquiflavi 3H-10 on plates
按照GB/T 23527—2009《蛋白酶制剂》中福林酚法,测定B.aquiflavi 3H-10发酵液的蛋白酶活力为85 U/mL,高于已报道的部分芽胞杆菌(8.82~31.27 U/mL)的蛋白酶活力[20]。在发酵过程中,蛋白酶通过降解蛋白质生成氨基酸等小分子物质,可以促进其他微生物生长代谢,氨基酸与还原糖发生的褐变反应为特征风味物质提供重要的前体物质。考虑到B.aquiflavi 3H-10基因组数量较多的蛋白酶编码基因,推测通过优化发酵条件,菌株产蛋白酶的能力可进一步提升。B.aquiflavi 3H-10前期分离自浓香型白酒发酵过程中的黄水基质[11],其分泌的蛋白酶可以为发酵环境中的美拉德反应提供重要的前体物质,促进浓香型白酒发酵过程中特征风味的生成。
2.5 B.aquiflavi 3H-10的发酵风味物质分析
按照1.3.5的方法,采用GC-MS测定B.aquiflavi 3H-10发酵液中的代谢风味物质,与空白对照培养基中的物质比较,定性分析出B.aquiflavi 3H-10的发酵代谢物及其产生风味物质的贡献率。结果显示,B.aquiflavi 3H-10发酵液中共检测到56种代谢风味物质,与空白对照相比,共有31种物质的含量显著提高,主要以醇类化合物、酯类化合物和酮类化合物为主,这些风味物质与白酒中的呈香化合物基本一致[15,21]。其中,相对含量最高的5种成分依次是苯甲醛(杏仁香,坚果香)、2,5-二甲基吡嗪(炒芝麻香)、正丁醇(水果香)、3-甲基己醇和己酸乙酯。己酸乙酯是浓香型大曲酒的主体香味物质[15],也是葡萄酒中的重要香气成分[22],可赋予酒体甜香、水果香、窖香和青瓜香等味道。苯甲醛具有杏仁香和坚果香,已报道其对黄酒等传统发酵酒类独特风味的形成有重要贡献[23]。2,5-二甲基吡嗪和正丁醇可分别使酒体呈现炒芝麻香和水果香[22,24]。除此之外,B.aquiflavi 3H-10还可发酵产生异丁酸乙酯(花香,苹果香,水蜜桃香,水果香)、2-丁酮(焦糖)和三甲基吡嗪(浓厚的坚果香气)等风味物质。由此可见,B.aquiflavi 3H-10可发酵产生丰富的风味物质,有助于浓香型白酒主体风味物质的形成,并可赋予酒体多种独特的风味。因此,B.aquiflavi 3H-10对浓香型白酒发酵过程具有较大应用潜力。
表2 B.aquiflavi 3H-10发酵液风味物质检测结果
Table 2 Flavor compounds detected in the fermentation liquid of B.aquiflavi 3H-10

风味物质名称风味物质相对含量/%香气描述苯甲醛40.09杏仁香,坚果香2,5-二甲基吡嗪13.00炒芝麻香正丁醇12.5水果香3-甲基己醇4.86-己酸乙酯4.70甜香,水果香,窖香,青瓜香异丁酸乙酯3.50花香,苹果香,水蜜桃香,水果香2-丁酮3.39焦糖三甲基吡嗪3.56浓厚的坚果香气5-甲基-1-庚醇3.13-3-庚酮1.23-3-十一酮1.17-2-乙基-3,5-二甲基吡嗪1.14炒坚果香气2-甲基-5-己酮0.94-α-松油醇0.98新鲜紫丁香及木香乙酸-2-乙基己酯0.57菠萝香,苹果香,水果香二氢松油醇0.40-3-十三酮0.38-2-十二酮0.37-3-甲基-2-庚酮0.34-3-壬酮0.28-3-癸酮0.22-3-甲基-3-丁烯-1-醇0.15-6-甲基-2-庚酮0.15-3,5-二甲基-2-辛烷0.13-2-戊酮0.12-2-甲基丁酸乙酯0.07-γ-壬内酯0.05-3-羟基-2-丁酮0.04黄油,奶香β-苯乙醇0.04玫瑰,蜂蜜正十三醇0.02-异己醇0.02-
3 结论
本研究对我国四川省宜宾地区首株酿酒微生物新种黄水芽胞杆菌B.aquiflavi 3H-10[11]进行全基因组测序,通过与数据库比对分析潜在功能基因,并利用平板透明圈法、福林酚法和GC-MS技术研究其产生物酶特性、酶活力和发酵风味物质。基因分析显示,菌株B.aquiflavi 3H-10基因组中含有编码22种蛋白酶和多种碳水化合物酶类的基因,具有产生蛋白酶和碳水化合物的潜力。试验结果显示,菌株B.aquiflavi 3H-10在蛋白酶培养基平板上透明圈较明显,蛋白酶酶活力可达85 U/mL,并可产生56种代谢风味化合物,包括酯类、醇类、芳香族、羰基化合物、杂环化合物等,其中,苯甲醛(杏仁香,坚果香)、2,5-二甲基吡嗪(炒芝麻香)、正丁醇(水果香)、3-甲基己醇和浓香型大曲酒的主体香味物质的物质己酸乙酯(甜香,水果香,窖香,青瓜香)等成分相对含量较高。研究表明,黄水芽胞杆菌B.aquiflavi 3H-10具有显著的产蛋白酶能力,发酵产生浓香型白酒具有的特征风味物质,推测其在白酒发酵过程中具有潜在应用价值。芽胞杆菌作为重要功能菌株,在白酒发酵过程具有较好的应用潜力,后续有待进一步解析B.aquiflavi 3H-10在安全性和抗逆性等方面的特性,为该菌株的大规模开发利用提供前期研究基础。
[1] 程伟, 吴丽华, 徐亚磊, 等.浓香型白酒酿造微生物研究进展[J].中国酿造, 2014, 33(3):1-4.
CHENG W, WU L H, XU Y L, et al.Research progress on brewing microbes in the production process of Luzhou-flavor liquor[J].China Brewing, 2014, 33(3):1-4.
[2] LIU M K, TANG Y M, ZHAO K, et al.Contrasting bacterial community structure in artificial pit mud-starter cultures of different qualities:A complex biological mixture for Chinese strong-flavor Baijiu production[J].3 Biotech, 2019, 9(3):89.
[3] 谭崇尧, 徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技, 2018(9):118-122.
TAN C Y, XU J.Analysis of microbial structure of Nongxiang daqu from different regions by high-throughput sequencing[J].Liquor-Making Science & Technology, 2018(9):118-122.
[4] 周静, 黄晓辉, 肖冰梅, 等.一株多功能芽孢杆菌的鉴定[J].中国微生态学杂志, 2013, 25(9):997-1 000.
ZHOU J, HUANG X H, XIAO B M, et al.Identification of a multi-functional Bacillus strain[J].Chinese Journal of Microecology, 2013, 25(9):997-1 000.
[5] 惠明, 窦丽娜, 田青, 等.枯草芽孢杆菌的应用研究进展[J].安徽农业科学, 2008, 36(27):11 623-11 624;11 627.
HUI M, DOU L N, TIAN Q, et al.Advances in application research of Bacillus subtilis[J].Journal of Anhui Agricultural Sciences, 2008, 36(27):11 623-11 624;11 627.
[6] WANG J Y, WANG W S, WANG H Z, et al.Improvement of stress tolerance and riboflavin production of Bacillus subtilis by introduction of heat shock proteins from thermophilic Bacillus strains[J].Applied Microbiology and Biotechnology, 2019, 103(11):4 455-4 465.
[7] 汪海峰, 王井亮, 王翀, 等.一株肠源枯草芽孢杆菌的生长、抗逆和产酶特性分析[J].中国畜牧杂志, 2012, 48(17):66-70.
WANG H F, WANG J L, WANG C, et al.Research on growth property, resistance characteristics and enzyme activity of intestinal Bacillus subtilis[J].Chinese Journal of Animal Science, 2012, 48(17):66-70.
[8] 刘丹, 陈杰, 罗惠波, 等.浓香型大曲中的枯草芽孢杆菌对固态混菌发酵体系的扰动效应[J].食品与发酵工业, 2021, 47(11):38-44.
LIU D, CHEN J, LUO H B, et al.Disturbance effect of Bacillus subtilis in strong-flavor Daqu on the fermentation system of solid-state mixed bacteria[J].Food and Fermentation Industries, 2021, 47(11):38-44.
[9] 程国富, 郑自强, 卫春会, 等.蜡样芽孢杆菌与酿酒酵母混菌发酵效果探究[J].酿酒科技, 2021(3):53-59.
CHENG G F, ZHENG Z Q, WEI C H, et al.Mixed fermentation effect of Bacillus cereus frankland and Saccharomyces cerevisiae[J].Liquor-Making Science & Technology, 2021(3):53-59.
[10] YANG F, LIU Y F, CHEN L Q, et al.Genome sequencing and flavor compound biosynthesis pathway analyses of Bacillus licheniformis isolated from Chinese Maotai-flavor liquor-brewing microbiome[J].Food Biotechnology, 2020, 34(3):193-211.
[11] XIE J Y, CHENG K, ZHAO D, et al.Bacillus aquiflavi sp.nov., isolated from yellow water of strongly flavored Chinese Baijiu[J].International Journal of Systematic and Evolutionary Microbiology, 2020, 70(5):3 406-3 412.
[12] KANEHISA M, GOTO S.KEGG:Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research, 2000, 28(1):27-30.
[13] YE Y Z, CHOI J H, TANG H X.RAPSearch:A fast protein similarity search tool for short reads[J].BMC Bioinformatics, 2011, 12:159.
[14] CANTAREL B L, COUTINHO P M, RANCUREL C, et al.The carbohydrate-active enzymes database (CAZy):An expert resource for glycogenomics[J].Nucleic Acids Research, 2009, 37(Database issue):D233-D238.
[15] 范文来, 徐岩.中国白酒风味物质研究的现状与展望[J].酿酒, 2007, 34(4):31-37.
FAN W L, XU Y.The review of the research of aroma compounds in Chinese liquors[J].Liquor Making, 2007, 34(4):31-37.
[16] ZHOU Y X, LIU G H, LIU B, et al.Bacillus mesophilus sp.nov., an alginate-degrading bacterium isolated from a soil sample collected from an abandoned marine solar saltern[J].Antonie Van Leeuwenhoek, 2016, 109(7):937-943.
[17] WETZEL D, FISCHER R J.Small acid-soluble spore proteins of Clostridium acetobutylicum are able to protect DNA in vitro and are specifically cleaved by germination protease GPR and spore protease YyaC[J].Microbiology (Reading, England), 2015, 161(11):2 098-2 109.
[18] AKIYAMA Y, KANEHARA K, ITO K.RseP (YaeL), an Escherichia coli RIP protease, cleaves transmembrane sequences[J].The EMBO Journal, 2004, 23(22):4 434-4 442.
[19] BORASTON A B, BOLAM D N, GILBERT H J, et al.Carbohydrate-binding modules:Fine-tuning polysaccharide recognition[J].The Biochemical Journal, 2004, 382(Pt 3):769-781.
[20] 叶光斌, 王彩虹, 熊俐, 等.3株芽孢杆菌产酶性质的初步研究[J].江苏农业科学, 2013, 41(7):240-242.
YE G B, WANG C H, XIONG L, et al.Study on the enzymatic properties of three Bacillus strains[J].Jiangsu Agricultural Sciences, 2013, 41(7):240-242.
[21] 李俊刚, 郭文宇, 罗英, 等.利用GC-MS法对不同窖龄下浓香型白酒风味物质的研究[J].中国酿造, 2015, 34(9):141-144.
LI J G, GUO W Y, LUO Y, et al.Analysis of volatile compounds of Luzhou-flavor liquor from different pit ages by GC-MS[J].China Brewing, 2015, 34(9):141-144.
[22] LI H S, HAN X L, LIU H R, et al.Silage fermentation on sweet Sorghum whole plant for Fen-flavor Baijiu[J].Foods (Basel, Switzerland), 2021, 10(7):1477.
[23] 张雅卿, 叶书建, 周睿, 等.发酵食品风味物质及其相关微生物[J].酿酒科技, 2021(2):85-96.
ZHANG Y Q, YE S J, ZHOU R, et al.Flavoring substances and related microorganisms of fermented food[J].Liquor-Making Science & Technology, 2021(2):85-96.
[24] MAGI E, BONO L, DI CARRO M.Characterization of cocoa liquors by GC-MS and LC-MS/MS:Focus on alkylpyrazines and flavanols[J].Journal of Mass Spectrometry, 2012, 47(9):1 191-1 197.