沙门氏菌作为一种全球重要的人兽共患病食源性致病菌,以人类和动物为宿主,引发各种疾病。最常表现为胃肠炎,易引起恶心、呕吐、腹痛等症状,过量时能够危及人们的生命安全,严重时可导致死亡[1]。据统计在世界范围内,全球每年有超过1亿人感染沙门氏菌。而在中国有接近70%~80%细菌性食物中毒是由沙门氏菌感染所引起的[2]。德尔卑沙门氏菌(Salmonella enterica subsp.enterica Derby,S.Derby)是沙门氏菌中对猪具有宿主适应性的重要血清型[3],猪肉中的沙门氏菌是导致沙门氏菌感染的第二大来源,经检测,欧洲等26个国家猪源沙门氏菌的主要血清型主要有鼠伤寒沙门菌、德尔卑沙门菌和肠炎沙门菌,而且德尔卑沙门菌的分离率也在日渐增长。近几年,我国各地区也相继在猪肉中检测出德尔卑沙门氏菌[4]。沙门氏菌的爆发不仅对食品制造业造成巨大的经济损失,对消费者的安全威胁也逐渐增加。
沙门氏菌在外界环境中会受到多种胁迫因子的交叉协同作用,造成其对环境耐受性的改变。在食品加工及贮存过程中,常常会使用高温、有机酸、NaOH、消毒剂等杀菌措施。有研究表明,沙门氏菌在45 ℃下处理30 min(亚致死)后,菌体的耐受性出现增强的现象;当沙门氏菌在较为干燥的环境中,它的热适应能力也会随着增强,对紫外辐射也有着较强的耐受力[5]。沙门氏菌经过亚致死的高温胁迫后,毒力基因发生了改变,对宿主的感染率也随之提高。在贮藏过程中,由于多种因子的交叉胁迫作用,造成了沙门氏菌对环境耐受性的变化。另外,具有酸适应能力的沙门氏菌在受到温度及高渗环境的胁迫后,存活率反而高于一般性的沙门氏菌,但对NaClO的应激胁迫更为敏感[6]。为控制沙门氏菌的污染传播,本文以检出率较高的德尔卑沙门氏菌为对象,主要研究在高渗应激与其他环境温度(高温、低温、pH、NaClO、胆盐等)交叉胁迫对其生存的影响,以期为食品工业针对高渗耐受沙门氏菌选择合适灭菌及保藏技术提供理论指导。
1 材料与方法
1.1 材料和试剂
1.1.1 培养基及试剂
胰酪大豆胨液体培养基(tryptose soya broth,TSB)、胰酪大豆胨琼脂培养基(tryptose soya agar,TSA),北京陆桥技术有限公司;NaCl、无水乙醇、NaOH、胆盐、30%H2O2(分析纯)、柠檬酸(分析纯,≥99%),上海麦克林生化科技有限公司;NaClO(分析纯,有效氯≥5.5%),成都市科龙化工试剂厂。
1.1.2 菌株及活化保藏
德尔卑沙门氏菌(Salmonella enterica subsp.enterica Derby)CMCC 50719标准菌株,购自中国医学微生物菌种保藏中心。细菌在TSB中活化培养或在TSA培养基上斜面画线培养,37 ℃下培养18 h,并在-80 ℃冰箱中保藏备用。
1.1.3 仪器与设备
LDZX-50 KBS型立式高压蒸汽灭菌锅,上海申安医疗器械厂;752型紫外分光光度计,上海光谱仪器有限公司;DHG-9030 A型电热恒温鼓风干燥箱、SHP-160型智能生化培养箱、ZHP-100F型恒温培养振荡器、DK-S24型电热恒温水浴锅,上海三发科学仪器有限公司;DHG-9030 A型高速冷冻台式离心机,湖南湘仪实验仪器开发有限公司;BSC-1100ⅡA2-X型生物安全柜、BDF-86V50型-80超低温冰箱,济南鑫贝西生物技术有限公司;ME403E型电子天平,梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 德尔卑沙门氏菌高渗适应性诱导
高渗驯化:德尔卑沙门氏菌经TSB及固体平板活化后,挑取单菌落,接种于TSB,37 ℃、180 r/min培养18 h。再取0.1 mL菌悬液划线接种至含质量分数4% NaCl的TSA中,37 ℃恒温培养24 h。如此反复进行10轮驯化。将驯化后的耐渗菌株与对照菌株分别接种至TSB中,37 ℃、180 r/min培养18 h,平板菌落计数法获得以上菌株的初始浓度。各取1 mL培养液于灭菌后的1.5 mL离心管中,120 r/min离心3 min,弃上清液,分别加入1 mL饱和NaCl溶液重悬菌体。将2管菌液常温下处理2、4、8 h,用无菌生理盐水梯度稀释,取适宜稀释度平板菌落计数。存活率计算如公式(1)所示,评价德尔卑沙门氏菌高渗适应性菌株的耐受性。
存活率![]()
(1)
高渗适应性抗性评价实验:将耐渗菌株与对照菌株分别接种于TSB中,37 ℃、180 r/min培养2 h后,加入不同浓度已过滤除菌的NaCl溶液,调节其浓度依次为0.1、0.5、1 mol/L NaCl的TSB。每间隔1 h进行取样,应用紫外分光光度计OD600 nm评价菌株的生长状况,并绘制生长曲线。
1.2.2 高渗适应德尔卑沙门氏菌环境胁迫抗性分析
将德尔卑沙门氏菌耐渗菌株与对照菌株分别经TSB中,37 ℃培养18 h,取1 mL培养液于灭菌后的离心管中,120 r/min离心3 min,弃上清液。使用移液枪加入1 mL饱和NaCl溶液重悬菌体并在常温下处理4 h后,120 r/min离心3 min弃上清液。
参考刘佳玫等[7]的方法进行高渗适应德尔卑沙门氏菌抗胁迫能力实验。高温处理:用1 mL灭菌生理盐水重悬菌体,混合均匀后制成细胞悬液,分别置于50、55、65 ℃水浴锅中处理30 min,在60 ℃水浴锅中处理15、30、45、60 min后,快速置于冰上短暂冷却;低温处理:用1 mL灭菌生理盐水重悬菌体后,置于4 ℃冰箱冷藏;酸胁迫:用柠檬酸将无菌生理盐水的pH调整为1.5、2.0、2.5,使用移液枪各取1 mL加入离心管中重悬菌体(处理30 min);碱胁迫:用NaOH将无菌生理盐水的pH调整为11、12、13,使用移液枪各取1 mL加入离心管中重悬菌体(处理15 min);胆盐处理:将菌体分别重悬于0.22 μm滤膜除菌的质量分数15%、20%、25%胆盐溶液中处理30 min;紫外灯照射处理:用1 mL灭菌生理盐水重悬菌体,混合均匀后制成细胞悬液,分别置于距离紫外灯70 cm处照射5、10、15 min;NaClO溶液处理:将菌体分别重悬于无菌水与NaClO制成的质量分数0.3%、0.5%、1% NaClO溶液中处理30 min,用过量的Na2S2O3终止反应;H2O2胁迫:将菌体分别重悬于用体积分数30%的H2O2溶液与无菌水配制成的25、75、125 mmol/L H2O2溶液中处理30 min;乙醇处理:将菌体分别重悬于无菌水与无水乙醇配制成的体积分数65%、70%的乙醇溶液中处理5 min。
以上菌体在胁迫环境下处理一定时间后,120 r/min离心3 min,弃上清液。沉淀用1 mL生理盐水重悬,振荡混匀后梯度稀释,取适宜稀释度细胞悬液涂布TSA平板计数。根据胁迫前后的菌体数计算存活率大小。
1.2.3 数据分析
每个实验重复3次,实验数据利用SAS(V8)软件进行单因素方差分析,结果用Origin 8.0绘图。
2 结果与分析
2.1 德尔卑沙门氏菌高渗适应性
2.1.1 高渗驯化
德尔卑沙门氏菌在含有4% NaCl 的TSA中经过10轮驯化后,在饱和NaCl胁迫培养下的存活率如图1所示。随着高渗处理时间的延长,德尔卑沙门氏菌的存活率逐渐降低,但耐渗菌株的存活率显著高于对照菌株。饱和NaCl胁迫处理2 h时,耐渗菌株的存活率为105.94%,高于未处理菌落数。在胁迫处理8 h时,耐渗菌株的存活率降低至93.53%,而对照菌株的存活率仅有65.32%。此时耐渗菌株与对照菌株的存活率相差最大。以上结果表明,德尔卑沙门氏菌经质量分数4% NaCl胁迫环境驯化后,具有高渗耐受性,对于高渗环境存活率显著提高。与刘密等[8]的研究结果一致,在4% NaCl的BMM培养基中循环驯化使得沙门氏菌抗高渗胁迫的能力增强,证明驯化成功。

图1 德尔卑沙门氏菌耐渗菌株在饱和NaCl胁迫下的存活率
Fig.1 Survival rate of osmotic tolerant strains of S.Derby under saturated NaCl stress
注:“*”表示不同组间在同一处理下差异显著(P<0.05);“** ”表示差异极显著(P<0.01)(下同)
2.1.2 耐渗菌株的高渗适应
高渗适应德尔卑沙门氏菌耐渗菌株与未适应对照菌株在含有不同浓度NaCl的TSB中生长状况如图2所示。前5 h属于德尔卑沙门氏菌的快速繁殖期。在0.1 mol/L与0.5 mol/L NaCl胁迫下(图2-a、图2-b),耐渗菌株与对照菌株的生长趋势与对照实验菌株相同,随时间的延长逐渐上升,在18 h左右达到稳定期。德尔卑沙门氏菌耐渗菌株基本未受NaCl影响,细菌数量与对照组几乎相同。对照菌株受NaCl限制,细胞数量降低了15%。而在1 mol/L NaCl胁迫下(图2-c),耐渗菌株与对照菌株的生长趋势明显受到影响。但耐渗菌株的细菌增殖速率仍高于对照菌株。在18 h时,耐渗菌株还处于不断繁殖的状态,接近正常水平,而对照菌株因受到NaCl胁迫,细菌数量降低了50%。由此可见,经过驯化后的德尔卑沙门氏菌耐渗菌株能够适应高渗环境,不影响细菌正常繁殖水平。
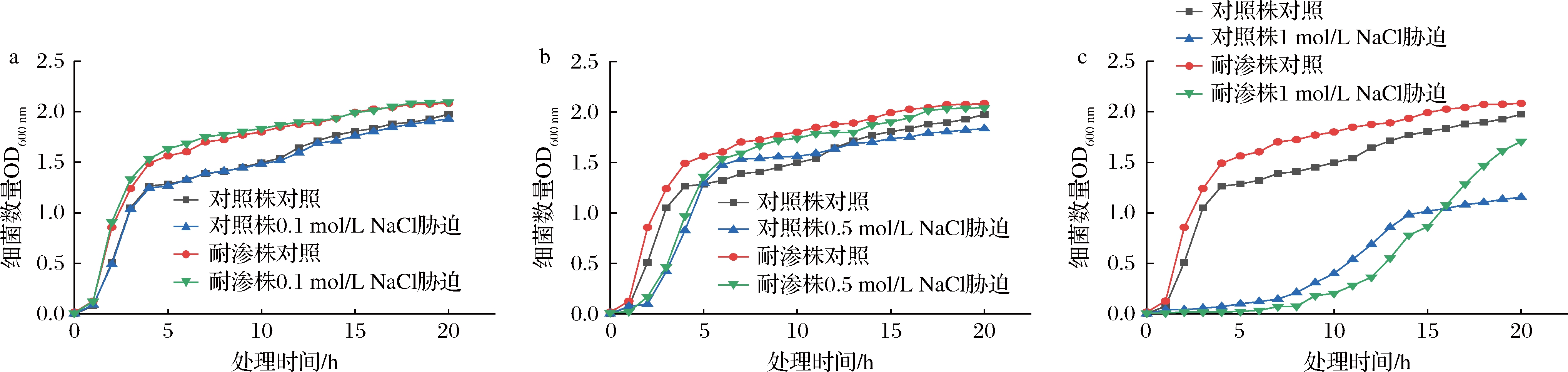
a-0.1 mol/L NaCl处理;b-0.5 mol/L NaCl处理;c-1 mol/L NaCl处理
图2 德尔卑沙门氏菌耐渗菌株的高渗适应性分析
Fig.2 Analysis of hypertonic adaptability of S.Derby osmotic resistant strains
2.2 高渗适应性德尔卑沙门氏菌抗环境胁迫能力
2.2.1 高渗适应性德尔卑沙门氏菌高温抗性
分别以50、55、60、65 ℃热水浴处理高渗适应性德尔卑沙门氏与非适应性对照的菌悬液,结果如图3所示。在50 ℃水浴条件下(图3-a),耐渗菌株与对照菌株都保持着非常高的存活率。50 ℃ 1 mol/L NaCl胁迫条件下,耐渗菌株的存活率为90.45%,高于对照菌株的82.71%。当温度达到55 ℃时(图3-b),耐渗菌株的存活仍然高于对照菌株。但随着NaCl浓度从0增加到1 mol/L时,耐渗菌株的存活率从92.62%降低为63.95%,减少了28.67%。而对照菌株只减少了17.09%(从68.85%降低至51.76%)。耐渗菌株存活率的减少量相对于对照菌株增加了1.68倍,存活率显著降低。当温度达到60 ℃时(图3-c),耐渗菌株的存活率开始随着NaCl浓度的升高逐渐低于对照菌株。在0.5 mol/L NaCl胁迫下,耐渗菌株与对照菌株的存活率基本相同(56.39%、54.03%),NaCl浓度达到1 mol/L时,耐渗菌株存活率降低为40.16%,低于对照菌株的48.04%。在65 ℃热水浴处理下时,耐渗菌株的存活率已经明显低于对照菌株。在1 mol/L NaCl胁迫下,耐渗菌株的存活率与对照菌株相差3.11倍(13.41%、41.73%),此时差距最大。在温度从50 ℃上升到65 ℃过程中,耐渗菌株在同一浓度NaCl胁迫下(0、0.1、0.5、1 mol/L)存活率分别降低了60.52%、58.14%、78.28%、77.04%,其中,当温度从55 ℃升高到60 ℃时,耐渗菌株的存活率减少量最为明显(23.24%、22.61%、19.57%、21.71%)且逐渐低于对照菌株。因此,针对60 ℃高温胁迫下高渗适应性德尔卑沙门氏菌的耐受性做进一步分析。

a-50 ℃;b-55 ℃;c-60 ℃;d-65 ℃
图3 高渗适应性德尔卑沙门氏菌在高温条件下的存活率
Fig.3 Survival rate of hypertonic adapted S.Derby under high temperature
2.2.2 高渗适应性德尔卑沙门氏菌在60 ℃条件下的存活率
根据2.2.1实验结果,选择在60 ℃温度下水浴加热处理15、30、45、60 min进一步探究耐渗菌株的高温耐受性。如图6所示,在60 ℃、15 min时(图4-a),耐渗菌株的存活率仍高于对照菌株。在此条件下,耐渗菌株的存活率随NaCl浓度的增加降低了11.52%(从76.42%降低至64.90%)。在30 min时(图4-b),耐渗菌株存活率逐渐低于对照菌株。

a-15 min;b-30 min;c-45 min;d-60 min
图4 高渗适应性德尔卑沙门氏菌在60 ℃条件下不同处理时间的存活率
Fig.4 Survival rate of hypertonic adapted S.Derby at 60 ℃ for different treatment times
当水浴时间延长至45 min以上时(图4-c、图4-d),耐渗菌株在高渗/高温交叉胁迫下存活率明显低于对照菌株。在60 ℃、60 min、1 mol/L NaCl胁迫下耐渗菌株存活率仅为36.48%,显著低于对照菌株的45.22%。这与翟立公等[9]的研究结果存在差异。这可能与细胞膜的感知温度系统及细胞膜的作用有关。在4组实验中未经NaCl胁迫时耐渗菌株的存活率(76.42%、69.38%、68.02%、61.79%)都高于对照株(73.05%、54.77%、51.31%、50.9%)。高渗适应性诱导的细胞高温抗性与rpoS基因表达量有关[10]。RpoS转录因子能够通过温度的改变控制核糖体结合部位的转录,同时RopS不仅是大多数致病菌稳定压力的因子也是调控外膜蛋白表达量的重要影响因子[11]。暗示其可能参与高渗适应性诱导的沙门氏菌高温交叉抗性。
2.2.3 高渗适应性德尔卑沙门氏菌在4 ℃低温条件的存活率
低温保鲜是延长及储存食品常用的保藏技术,耐渗菌株与对照菌株在4 ℃低温冷藏条件下存活状况良好(图5),2种菌株均呈现出缓慢下降的趋势。高渗适应德尔卑沙门氏菌在7~19 d的存活率明显高于对照菌株。在19 d内,耐渗菌株的存活率下降了17.25%,对照菌株降低了27.15%,但2种菌株的存活率整体均在70%以上,说明高渗适应性使德尔卑沙门氏菌对4 ℃低温环境产生抗性。低温储藏可作为某些食品保鲜的方法。包文智等[20]研究发现,环境胁迫诱导不改变细菌在低温条件下的存活情况,这些细菌对低温条件的不同反应,可能与微生物种类和环境胁迫处理条件不同有关,食品加工过程中沙门氏菌常处于多种胁迫因子的共同作用,同时也代表了沙门氏菌中广泛存在着与低温条件的交叉抗性[12]。

图5 高渗适应性德尔卑沙门氏菌在低温条件下的存活率
Fig.5 Survival rate of hypersonic adapted S.Derby under low temperature
2.2.4 高渗适应性德尔卑沙门氏菌酸胁迫抗性
如图6所示,2种菌株在柠檬酸胁迫下存活率都比较低且存活率差异显著。在pH 2.5胁迫条件下,耐渗菌株的存活率最高,但仅有49.75%。当处于pH 2环境下时,耐渗菌株与对照菌株的存活率相差35.76%(46.87%、11.11%),差异最大。在pH 1.5极酸性环境下时,对照菌株无法适应酸性环境,存活率为0,但此时耐渗菌株仍有5.46%的存活率。以上结果表明,高渗适应性诱导的德尔卑沙门氏菌对酸性环境产生交叉抗性。在食品加工阶段有机酸常常被用作杀菌剂,对蔬果、肉品表面微生物具有良好的杀菌效果[13]。而高渗适应性的德尔卑沙门氏菌能够抵抗酸性环境,无法被彻底消灭,因此在使用有机酸对腌制类食品杀菌时,应充分考虑到高渗诱导的细胞酸胁迫抗性,建立高效、彻底的杀菌条件,保证高渗适应性菌完全灭活。
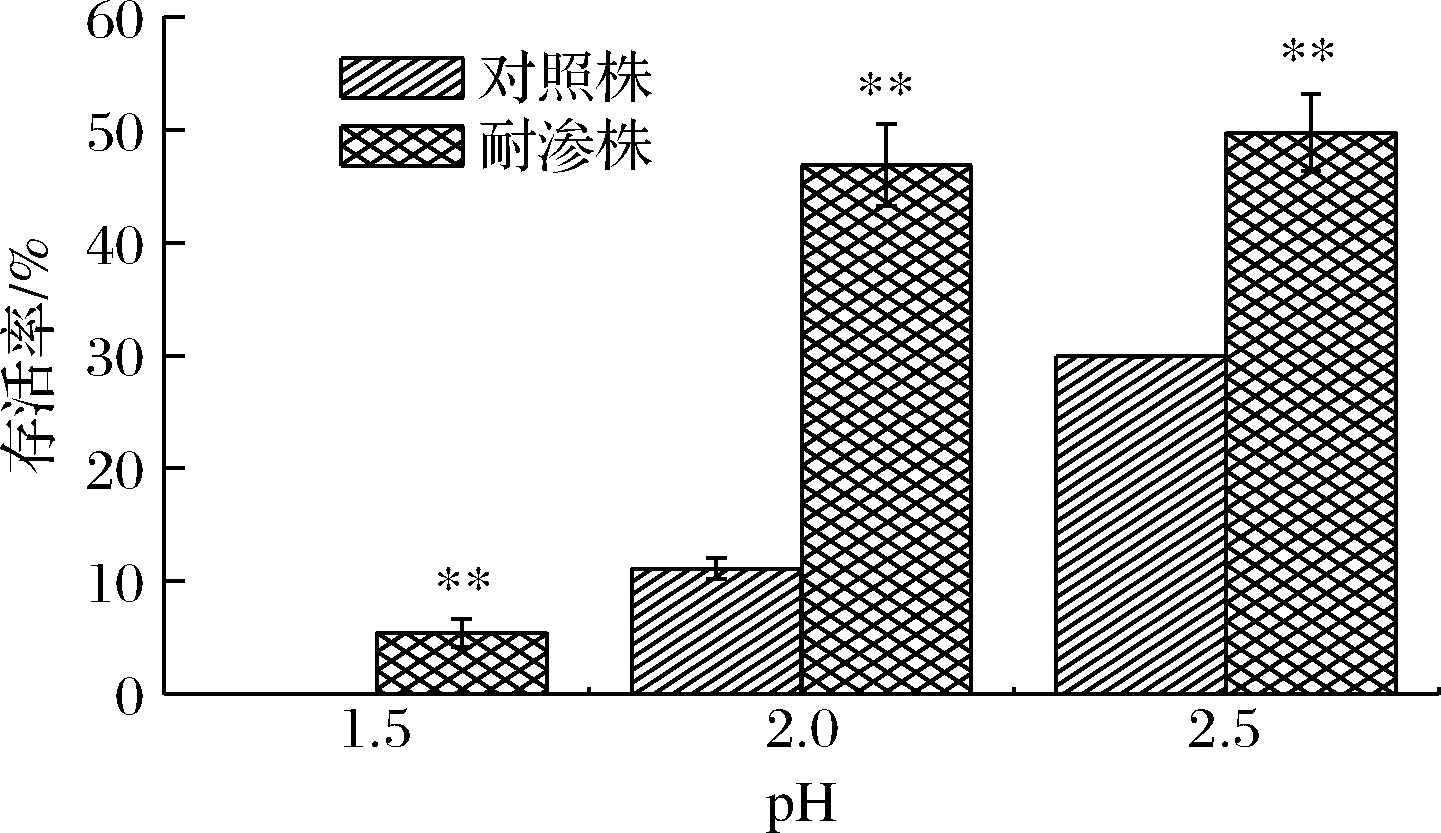
图6 高渗适应性德尔卑沙门氏菌在酸胁迫下的存活率
Fig.6 Survival rate of hypertonic adapted S.Derby under acid stress
2.2.5 高渗适应性德尔卑沙门氏菌碱胁迫抗性
如图7所示,当德尔卑沙门氏菌在低碱性环境时,耐渗菌株与对照菌株的存活率均较高。在pH 11胁迫条件下,耐渗菌株的存活率(94.63%)仅高于对照菌株(89.97%)的4.66%,在pH 12胁迫条件下耐渗菌株(93.51%)与对照菌株(83.95%)只相差9.56%,差异都不明显。但当pH增大到13,在强碱环境时,耐渗菌株与对照菌株存活率急剧降低。耐渗菌株存活率降低为55.33%仍高于对照菌株的21.86%。以上结果表明,德尔卑沙门氏菌高渗适应性使其对碱胁迫抗性增强。因此,在对腌制类等高盐类食品进行杀菌时,无法使用有机酸以及强碱起到灭菌效果。

图7 高渗适应性德尔卑沙门氏菌在NaOH胁迫下的存活率
Fig.7 Survival rate of hypertonic adapted S.Derby under NaOH stress
翟立公等[9]研究发现,高温耐受性德尔卑沙门氏菌对于强碱的敏感性提升。而高渗适应性德尔卑沙门氏菌对于高温抗性降低,因此,建立多种胁迫共同作用下的灭菌方式是一种新颖的选择。
2.2.6 高渗适应性德尔卑沙门氏菌胆盐抗性
胆盐是肝脏分泌的胆汁的重要成分,主要参与脂类食物在小肠的分解和吸收[14],因此在细菌通过胃部酸性屏障后,其依赖于胆盐抗性的肠道定殖、存活能力也是研究的一大热点。据报道沙门氏菌具有胆汁盐环境胁迫适应性[15],本实验采用质量分数15%、20%、25%的胆盐溶液模拟沙门氏菌可能面临的宿主胆盐环境,结果如图8所示,不同浓度的胆盐对于德尔卑沙门氏存活率影响较大。在15%胆盐胁迫下,耐渗菌株的存活率为83.77%,高于对照菌株的73.63%,此时2种菌株的存活率均在70%以上,处于较高水平。当胆盐浓度增大到20%时,耐渗菌株的存活率(43.90%)降低了39.87%,对照菌株存活率(31.37%)降低了42.26%。而在25%胆盐溶液中,耐渗菌株的存活率仅有19.65%,但高于对照菌株的15.90%。高渗适应性明显增强了菌株对胆盐的耐受性,也意味着高渗适应性德尔卑沙门氏菌一旦被误食进入人体肠道后,其致病率也显著提高了。

图8 高渗适应性德尔卑沙门氏菌在胆盐环境下的存活率
Fig.8 Survival rate of hypertonic adapted S.Derby in bile salt environment
2.2.7 高渗适应性德尔卑沙门氏菌在紫外灯照射条件下的存活率
紫外灯通过利用汞灯发出的紫外线,来实现杀菌消毒功能[16]。在生化实验室中,经常要对生物安全柜等仪器进行紫外光照射杀菌消毒,以防止杂菌污染。图9为德尔卑沙门氏菌耐渗菌株与对照菌株在距紫外灯70 cm处照射下的存活率。可以看出,耐渗菌株的存活率明显高于对照菌株。在照射5 min时,耐渗菌株与对照菌株的存活率均较高(64.95%、54.73%)。照射15 min时,耐渗菌株的存活率降低为46.32%。15 min照射下,耐渗菌株存活率只降低了18.63%。由此可见,在使用生物安全柜等仪器进行高渗适应性沙门氏菌生化实验时,应使用紫外灯长时间杀菌,同时配合多种消毒剂以达到彻底杀菌的目的。
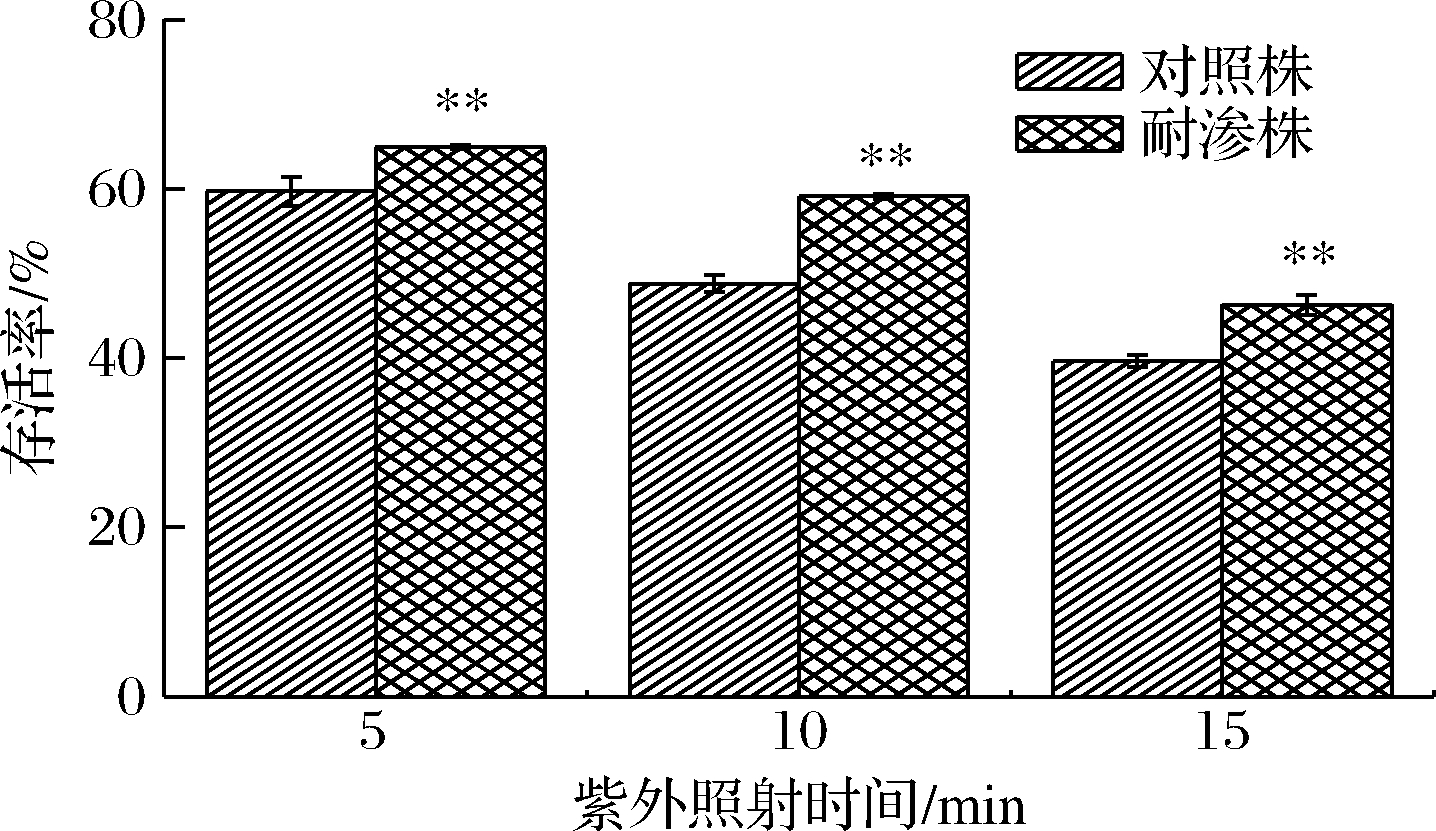
图9 高渗适应性德尔卑沙门氏菌在紫外灯照射
环境下的存活率
Fig.9 Survival rate of hypertonic adapted S.Derby under ultraviolet irradiation
2.2.8 高渗适应性德尔卑沙门氏菌对氧化类消毒剂抗性
高渗适应性德尔卑沙门氏菌在食品及加工器械消毒剂NaClO、H2O2溶液中的存活率如图10所示。
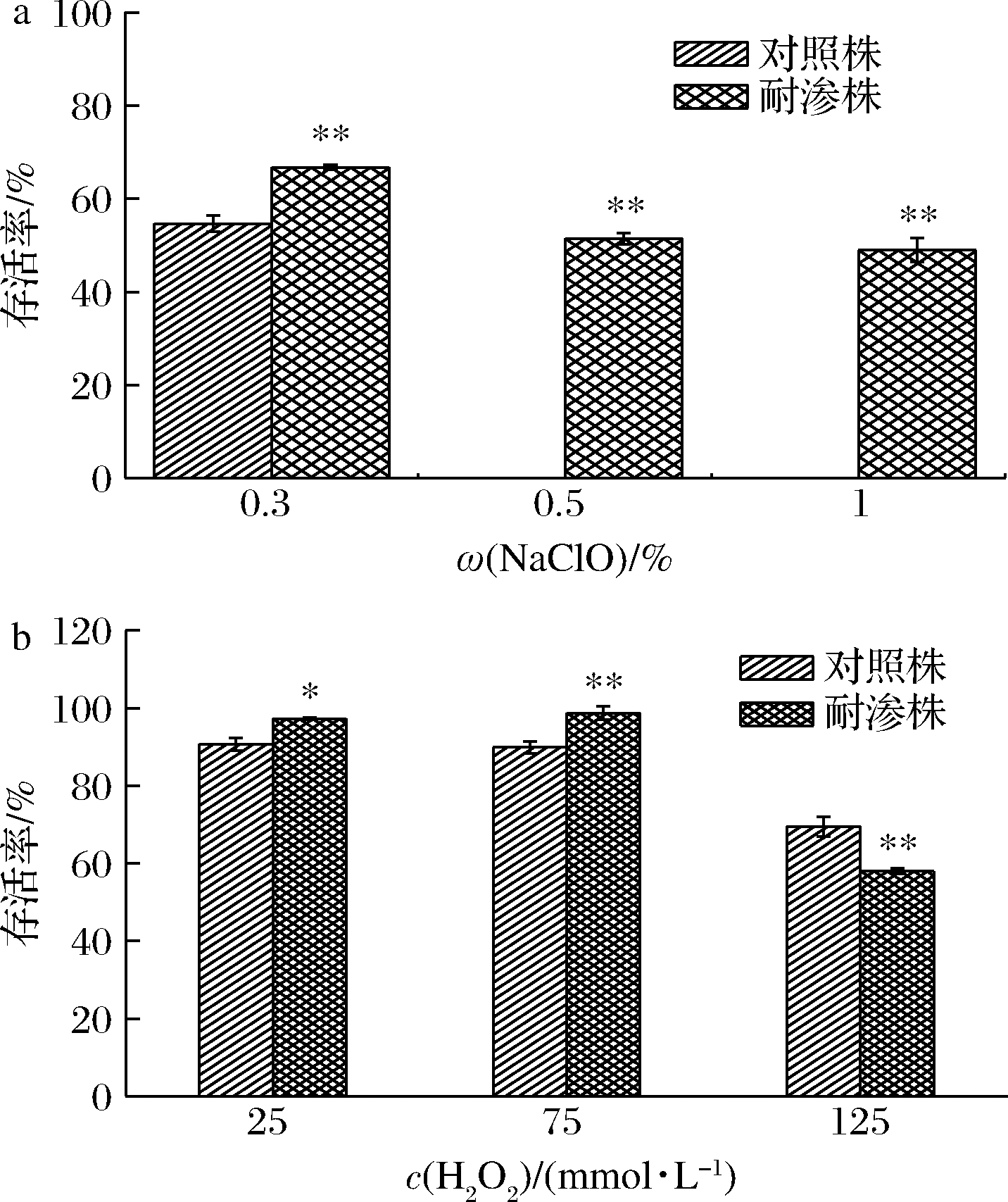
a-NaClO溶液处理;b-H2O2溶液处理
图10 高渗适应性德尔卑沙门氏菌在氧化类消毒剂胁迫下的存活率
Fig.10 Survival rate of hypertonic adapted S.Derby under oxidative disinfectant stress
由图10可知,2种消毒剂对德尔卑沙门氏菌的杀菌效果完全不同。明显能够看出德尔卑沙门氏菌对于NaClO的更为敏感。在质量分数0.3% NaClO溶液中(图10-a)耐渗菌株的存活率为66.64%,高于对照菌株的54.55%,两者存活率相差不大。当NaClO溶液浓度增大为0.5%时,耐渗菌株的存活率只降低为51.61%,但此时对照菌株已经被完全灭菌,在1%NaClO溶液中,耐渗菌株的存活率为49.11%,仍处于较高水平。然而与NaClO不同,在125 mmol/L高浓度H2O2溶液中,耐渗菌株的存活率虽然高达58.03%,却低于对照菌株的69.50%。
H2O2和NaClO都是氧化类消毒剂,但高渗适应性德尔卑沙门氏菌对二者的反应不同,一方面与处理时间不同有关,也反映出它们与细胞的作用方式不同。H2O2产生活性氧作用于细胞DNA、脂质和蛋白质[17],而NaClO强烈的杀菌效果与其破坏细胞膜渗透性、能量代谢等有关[18]。
2.2.9 高渗适应性德尔卑沙门氏菌对乙醇溶液敏感性
如图11所示,与NaClO与H2O2作用不同,德尔卑沙门氏菌在乙醇溶液环境中,存活率都处于低水平状态,但耐渗菌株对于乙醇的抗性明显强于对照菌株。当暴露于65%乙醇溶液时,耐渗菌株的存活率为44.33%高于对照菌株的39.94%。当乙醇体积分数增大5%时,耐渗菌株的存活率降低了2.85%(41.48%)。虽然在65%~70 %乙醇溶液中,耐渗菌株的存活率较低但仍未达到杀菌要求。CHIANG等[19]报道的酸适应性副溶血弧菌在8%乙醇溶液中的存活率显著提高,与本研究中高渗适应性德尔卑沙门氏菌对乙醇抗性增强结果一致。这说明乙醇、NaClO无法作为高渗适应沙门氏菌的有效消毒剂。高浓度H2O2或许能够起到杀菌效果,但H2O2属于易燃易爆物,不适用于广泛的消毒手段。综上所述,高温与高盐协同消除食品及加工环境沙门氏菌污染及传播是最为有效的方式。
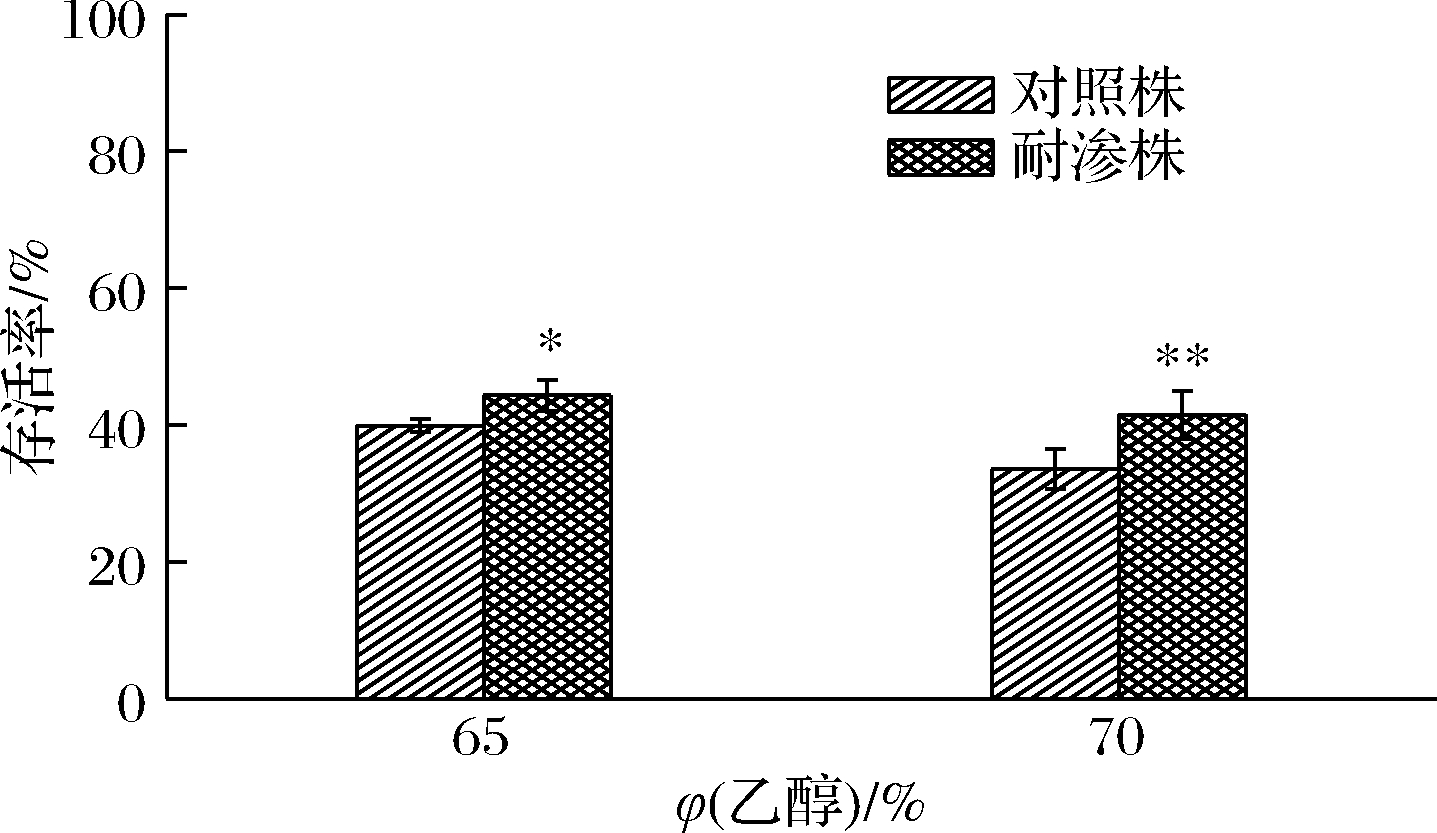
图11 高渗适应性德尔卑沙门氏菌在乙醇条件下的存活率
Fig.11 Survival rate of hypertonic adapted S.Derby under ethanol conditions
3 讨论
关于肠炎和鼠伤寒沙门氏菌在环境胁迫下的抗性研究已有很多,如海德尔堡沙门氏菌能够在酸性环境中产生适应性、鸭沙门氏菌的多重耐药性等[7,26]。本实验主要针对德尔卑沙门氏菌在高渗环境下的适应性以及胁迫环境下的耐受性。研究发现,在经过高渗驯化后,耐渗菌株只在胆盐、高温以及低pH胁迫环境下生存能力显著降低。而乙醇、强碱、NaClO、紫外光照射等都是对沙门氏菌有效的杀菌方式,但在本实验中,高渗适应性德尔卑沙门氏菌对以上胁迫环境的抗性明显增强。在以上环境胁迫时耐渗菌株的存活率是胆盐环境下的2~3倍、高温的4~5倍、极酸环境下的9~12倍。产生这种差异性的原因或许与沙门氏菌体内的转录因子有关。据报道RpoS转录调控因子是沙门氏菌体内稳定压力的因子,能够调控特异性基因的表达,在细菌中发挥着至关重要的作用[20]。在高温、高渗、胆盐及酸适应性,rpoS基因表达量均上调[14-15]。暗示其可能同时参与高渗适应性诱导的沙门氏菌高温、胆盐或低pH环境的交叉抗性。
细胞渗透压抗性与甜菜碱、脯氨酸、海藻糖等渗透压保护剂以及与渗透压相关的外膜蛋白诱导表达量和种类有关[19,21]。大多数食源性致病菌是通过氨基酸脱羧酶系统来维持体内pH的稳定,涉及的氨基酸主要为赖氨酸、精氨酸、谷氨酸[22]。有研究发现,在细菌的细胞壁中谷氨酰胺和赖氨酸能够有效提高对胆盐的抗性[23]。细菌感知温度的方式一是通过信号运输交换系统,二是通过RNA介导的反馈通道改变调节区域的结构[24]。沙门氏菌在适应以上4种环境胁迫的诱导基本都与基因调控蛋白质的表达量有关。RpoS蛋白是RNA聚合酶的一种σ因子,而RNA聚合酶是DNA逆转录合成RNA翻译蛋白质的重要产物[25]。因此,RpoS很有可能是细菌在受到环境胁迫时起到主要调节作用的转录因子。关于RpoS的调控机制仍有待进一步研究,这对于控制细菌耐受性的产生,以及彻底消灭具有环境抗性的食源性致病菌起到至关重要的作用,对于生物学研究也具有重要的意义。
4 结论
本实验主要针对德尔卑沙门氏菌单一菌种进行研究。发现德尔卑沙门氏菌在质量分数4% NaCl环境条件下驯化诱导后会产生高渗适应性,不仅能够使其在高浓度NaCl下正常存活,还具有良好的遗传稳定性。同时,能够诱导低温、NaOH、乙醇、双氧水、NaClO、紫外灯照射胁迫环境的交叉抗性。当高盐与这些措施协同杀菌时,会显著降低杀菌效果,产生的交叉保护也是食品安全一大隐患。但是高渗适应性也使得德尔卑沙门氏菌对某些压力环境的敏感性增强,如在高温、胆盐、极酸环境下,高渗适应性德尔卑沙门氏菌的存活率明显受到抑制,显著降低。研究结果表明以上措施可以与食用盐联合作用,采用较温和的手段提高食品杀菌效果,保证可能产生的高渗适应性菌快速灭活。由于高渗适应性德尔卑沙门氏菌对于多种消毒灭菌手段的抗性都显著提升,食品加工业还应加大开发新的有效杀菌措施,并通过对沙门氏菌对环境胁迫的反应机制研究,建立有效的食品安全系统,阻止疾病的传播。
[1] 童哲, 程苏云, 梅玲玲.浙江省272份食品沙门氏菌检测结果[J].浙江预防医学, 2003, 15(4):33-34.
TONG Z, CHENG S Y, MEI L L.The detection results on Salmonella of 272 food samples in Zhejiang province[J].Zhejiang Preventive Medicine, 2003, 15(4):33-34.
[2] HALD T.Scientifific opinion on a quantitative microbiological risk assessment of Salmonella in slaughter and breeder pigs[J].EFSA Journal, 2010, 20(30):225-231.
[3] 耿士忠, 潘志明, 刘杰, 等.猪及猪肉中沙门氏菌快速检测的研究进展[J].猪业科学, 2010, 27(6):100-105.
GENG S Z, PAN Z M, LIU J, et al.Research progress on rapid detection of Salmonella in pigs and pork[J].Swine Industry Science, 2010, 27(6):100-105.
[4] STEENACKERS H, HERMANS K, VANDERLEYDEN J, et al.Salmonella biofilms:An overview on occurrence, structure, regulation and eradication[J].Food Research International, 2012, 45(2):502-531.
[5] SHI X M, ZHU X N.Biofilm formation and food safety in food industries[J].Trends in Food Science & Technology, 2009, 20(9):407-413.
[6] SREY S, JAHID I K, HA S D.Biofilm formation in food industries:A food safety concern[J].Food Control, 2013, 31(2):572-585.
[7] 刘佳玫, 栗军杰, 陆兆新, 等.酸适应海德尔堡沙门氏菌对环境胁迫耐受性分析[J].食品科学, 2016, 37(21):209-213.
LIU J M, LI J J, LU Z X, et al.Tolerance of acid-adapted Salmonella heidelberg to various environmental stresses[J].Food Science, 2016, 37(21):209-213.
[8] YANG M L, JIANG R, LIU M, et al.Study of the probiotic properties of lactic acid bacteria isolated from Chinese traditional fermented pickles[J].Journal of Food Processing and Preservation, 2017, 41(3):e12954.
[9] 翟立公, 杜传来, 杨晴, 等.高温胁迫对德尔卑沙门氏菌抗逆性的影响[J].食品与机械, 2019, 35(6):69-73.
ZHAI L G, DU C L, YANG Q, et al.Effects of high temperature stress on stressresistance of thermotolerant Salmonella Derby stresses[J].Food & Machinery, 2019, 35(6):69-73.
[10] MASSÉ E, GOTTESMAN S.A small RNA regulates the expression of genes involved in iron metabolism in Escherichia coli[J].Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(7):4 620-4 625.
[11] H MMERLE H, VE
MMERLE H, VE EREK B, RESCH A, et al.Duplex formation between the sRNA DsrA and rpoS mRNA is not sufficient for efficient RpoS synthesis at low temperature[J].RNA Biology, 2013, 10(12):1 834-1 841.
EREK B, RESCH A, et al.Duplex formation between the sRNA DsrA and rpoS mRNA is not sufficient for efficient RpoS synthesis at low temperature[J].RNA Biology, 2013, 10(12):1 834-1 841.
[12] SHAH J, DESAI P T, CHEN D, et al.Preadaptation to cold stress in Salmonella enterica serovar Typhimurium increases survival during subsequent acid stress exposure[J].Applied and Environmental Microbiology, 2013, 79(23):7 281-7 289.
[13] LAURY A M, ALVARADO M V, NACE G, et al.Validation of a lactic acid- and citric acid-based antimicrobial product for the reduction of Escherichia coli O157:H7 and Salmonella on beef tips and whole chicken carcasses[J].Journal of Food Protection, 2009, 72(10):2 208-2 211.
[14] HERN NDEZ S B, COTA I, DUCRET A, et al.Adaptation and preadaptation of Salmonella enterica to bile[J].PLoS Genetics, 2012, 8(1):e1002459.
NDEZ S B, COTA I, DUCRET A, et al.Adaptation and preadaptation of Salmonella enterica to bile[J].PLoS Genetics, 2012, 8(1):e1002459.
[15] JOERGER R D, SARTORI C, FRYE J G, et al.Gene expression analysis of Salmonella enterica Enteritidis Nal® and Salmonella enterica Kentucky 3795 exposed to HCl and acetic acid in rich medium[J].Foodborne Pathogens and Disease, 2012, 9(4):331-337.
[16] 段颖颖, 乜辉, 黎朝进, 等.紫外LED过流式水杀菌的光学模拟分析[J].中国照明电器, 2021(6):19-22.
DUAN Y Y, NIE H, LI C J, et al.Optical simulation analysis of UV-LED overflow water disinfection[J].China Light & Lighting, 2021(6):19-22.
[17] RODRIGUES D, CERCA N, TEIXEIRA P, et al.Listeria monocytogenes and Salmonella enterica enteritidis biofilms susceptibility to different disinfectants and stress-response and virulence gene expression of surviving cells[J].Microbial Drug Resistance (Larchmont, N.Y.), 2011, 17(2):181-189.
[18] 王玮, 田静, 王左敏, 等.不同浓度NaClO配合被动超声对根管内细菌生物膜清除效果的研究[J].临床口腔医学杂志, 2019, 35(5):271-274.
WANG W, TIAN J, WANG Z M, et al.Evaluation of different concentration of sodium hypochlorite with passive ultrasonic irrigation against intra-canal biofilm in vitro[J].Journal of Clinical Stomatology, 2019, 35(5):271-274.
[19] CHIANG M L, CHEN H C, WU C, et al.Effect of acid adaptation on the environmental stress tolerance of three strains of Vibrio parahaemolyticus[J].Foodborne Pathogens and Disease, 2014, 11(4):287-294.
[20] 包文智, 李兴, 张海波, 等.rpoS基因在肠杆菌CGMCC 5087响应环境胁迫中的功能[J].微生物学通报, 2021, 48(1):104-112.
BAO W Z, LI X, ZHANG H B, et al.Functions of rpoS gene in response to environmental stress by Enterobacter sp.CGMCC 5087[J].Microbiology China, 2021, 48(1):104-112.
[21] LEYER G J, JOHNSON E A.Acid adaptation induces cross-protection against environmental stresses in Salmonella typhimurium[J].Applied and Environmental Microbiology, 1993, 59(6):1 842-1 847.
[22] KIEBOOM J, ABEE T.Arginine-dependent acid resistance in Salmonella enterica serovar Typhimurium[J].Journal of Bacteriology, 2006, 188(15):5 650-5 653.
[23] 毕洁. 胆盐水解酶提高乳酸菌胆盐耐受能力的酶学与生理学机制研究[D].无锡:江南大学, 2016.
BI J.Study on the enzymatic and physiological mechanism of bile salt hydrolase-mediated bile salt tolerance of lactic acid bacteria[D].Wuxi:Jiangnan University, 2016.
[24] 李宝华, 戈海泽, 刘树业.环境胁迫下细菌非编码小RNA对基因表达的调控[J].黑龙江医学, 2019, 43(6):690-694.
LI B H, GE H Z, LIU S Y.Regulation of bacterial small non-coding RNA on gene expression under environmental stress[J].Heilongjiang Medical Journal, 2019, 43(6):690-694.
[25] HENGGE-ARONIS R, LANGE R, HENNEBERG N, et al.Osmotic regulation of rpoS-dependent genes in Escherichia coli[J].Journal of Bacteriology, 1993, 175(1):259-265.
[26] 朱冬梅,彭珍,刘书亮,等.肉鸡屠宰加工过程中沙门氏菌的污染情况及其耐药性分析[J].食品科学, 2014, 35(17): 214-219.
ZHU D M, PENG Z LIU S L, et al. Contamination of Salmonella during slaughtering and processing of broilers and analysis of its drug resistance[J].Food Science,2014, 35(17): 214-219.