外泌体是直径在40~160 nm,由细胞内体形成的胞外囊泡,具有双层膜结构,主要成分包括蛋白质、RNA、DNA、氨基酸及各种代谢产物等[1]。研究表明,外泌体中的核酸、蛋白质等成分具有传递遗传信息,调节生理功能等特性[2-3]。不同来源的外泌体对不同受体细胞的影响存在差异[4]。目前对外泌体的应用研究主要集中在疾病诊断、药物输送等方面[5]。
乳汁作为哺乳动物幼体的主要营养来源,含有多种营养素及生长调节因子、免疫相关因子等重要生理活性物质[6]。WALSH等[7]指出,母乳能够为婴幼儿构建最为理想的肠道菌群。外泌体作为乳汁重要成分之一,能够携带和传递miRNA等信号分子,已成为目前食源外泌体的研究热点[8]。人体在摄入乳汁的过程中,乳源外泌体与肠道菌群间的相互作用不可避免,因此牛乳外泌体可能会对肠道内的各种益生菌生长及功能产生影响。
牛乳或母乳等乳源外泌体已被证明具有免疫调节、促进肠道上皮细胞增殖等生理功能[9-10]。YU等[11]研究发现,乳源外泌体可以促进大肠杆菌K-12 MG1655以及植物乳杆菌WCFS1的生长,调节细菌的基因表达。TONG等[12]指出,口服牛乳胞外囊泡调节了小鼠的肠道菌群,增强了小鼠的肠道免疫力。TENG等[13]证实,外泌体可调节小鼠肠道菌群结构、影响肠道菌群生长。肠道菌群作为人体的一种重要“消化器官”,通过调节免疫反应、肠道稳态、营养吸收、能量获取等过程进一步影响人体健康[14],同时拥有自己独特的调节方式,维持着正常的动态平衡。
双歧杆菌是益生菌的重要组成部分,对人体生长发育、免疫调节等益生功能有较多影响[15]。关于牛乳外泌体对肠道菌群中双歧杆菌等益生菌影响的研究报道不多,且大多并未探究牛乳外泌体对益生菌益生特性的影响,因此进一步探究牛乳外泌体对肠道益生菌生长及其功能的影响对研究与开发乳源外泌体具有重要意义。动物双歧杆菌F1-3-2是本实验室前期从婴幼儿粪便中分离得到的1株具有改善炎症等生理功能的益生菌。而耐受人体消化道是益生菌在肠道定植并进一步发挥作用的前提条件之一,益生菌必须能通过消化道等特殊生理环境并保持一定浓度方可发挥益生功能。此外,利用体外细胞模型的黏附性可间接反映出菌株黏附肠道上皮细胞的能力,细胞黏附性越强,菌株定植能力越强。在此基础上,本研究进一步探索了牛乳外泌体对动物双歧杆菌F1-3-2生长及其益生特性的影响,旨在为牛乳外泌体作为新型益生元的研究与开发提供理论依据。
1 材料与方法
1.1 试剂与仪器
主要试剂:CCK-8、2%磷钨酸、胰酶、胃蛋白酶、Triton X-100,北京索莱宝生物有限公司;BCA试剂盒、蛋白Marker、SDS-PAGE蛋白上样缓冲液、TNF-α ELISA试剂盒、IL-1β试剂盒,碧云天生物技术有限公司;TSG101抗体(一抗),上海Abcam公司;CD81抗体(一抗),美国Gene Tex公司;HRP二抗,上海斯信生物科技有限公司。
主要仪器:TGL-16M台式高速冷冻离心机,长沙湘仪有限公司;CP70ME超高速落地离心机,日本Hitachi公司;Multiskan FC酶标仪,Thermo Fisher公司;SHP-250生化培养箱,上海精宏有限公司;DYCZ-24F双垂直电泳槽,北京六一仪器厂;ZetaView PMX 110 纳米粒度追踪仪,德国Particle Metrix 公司。
1.2 实验方法
1.2.1 牛乳外泌体的提取鉴定
4 ℃条件下,参照TONG等[16]的方法,通过超速离心法提取牛乳外泌体。通过BCA试剂盒测定牛乳外泌体浓度。之后通过透射电镜、纳米颗粒追踪技术、免疫印迹实验对提取到的牛乳外泌体溶液进行鉴定,具体操作如下:
(1)超速离心法:通过凝乳酶分离鲜牛乳中的乳清,过0.22 μm滤膜后备用。使用超速离心机以100 000×g离心60 min,吸取上清液后再以135 000×g离心90 min,最后将沉淀的外泌体重悬于PBS中,100 000×g离心60 min。将完成离心的牛乳外泌体溶液移至100 kDa超滤管进行超滤,PBS复溶后于-80 ℃保存。
(2)透射电镜:移取10 μL溶解于PBS的外泌体及磷钨酸溶液,滴加至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,夹取铜片,将碳面浸入外泌体溶液浸染1 min后夹取铜片,用滤纸吸去多余外泌体,再将碳面浸入磷钨酸溶液负染1 min,吸去多余磷钨酸后放入培养皿,常温干燥,干燥后在透射电镜80 kV下观察外泌体形态及大小。
(3)纳米颗粒追踪技术:使用PBS稀释外泌体样品后,使用110 nm聚苯乙烯颗粒校准ZetaView系统,使用ZetaView PMX 110进行检测,通过ZetaView 8.04.02软件分析粒度及浓度。
(4)免疫印迹法:提取牛乳外泌体蛋白后,进行SDS-PAGE分析。制备5%/10%SDS-PAGE,上样20 μL后,在80 V条件下使样品达到分离胶,120 V条件下使样品达到分离胶底部。电泳完成后,根据Marker确定CD81、TSG101、Alix对应条带,PVDF膜浸入甲醇溶液激活后在80 V条件下转膜90 min。转膜后,将PVDF膜置入5%牛血清白蛋白的TBST缓冲液中封闭60 min;再次加入TBST洗涤3次,每次15 min。按V(一抗)∶V(一抗稀释液)=1∶1 000加入一抗,4 ℃摇床孵育过夜。再次用TBST洗涤3次后,按V(一抗)∶V(二抗稀释液)=1∶5 000加入二抗,室温摇床孵育60 min,TBST洗涤3次。按照V(A液)∶V(B液)=1∶1的比率配制发光液,将发光液滴加在PVDF膜上曝光拍照。
1.2.2 牛乳外泌体对动物双歧杆菌F1-3-2生长过程的影响
将冻存管保存的菌株以2%(体积分数)的接种量转接至10 mL MRS肉汤培养基中,厌氧培养,复苏后传代使用。实验组中添加外泌体溶液使其蛋白质量浓度为100 μg/mL,对照组中添加等量PBS,48 h内每隔4 h取样,在600 nm处测定吸光度,绘制生长曲线。
设置外泌体低、中、高剂量组,溶液蛋白浓度100 μg/mL(EXO-LOW)、150 μg/mL(EXO-MID)、200 μg/mL(EXO-HIGH),干预24 h后与对照组同时进行活菌计数,测定不同浓度牛乳外泌体对动物双歧杆菌F1-3-2生长的影响。
1.2.3 牛乳外泌体对动物双歧杆菌F1-3-2胃肠环境耐受性的影响
向PBS中不断滴加0.1 mol/L的盐酸至pH=3为止,用以模拟胃肠道酸性环境。向PBS中添加猪胆盐,配制质量分数为0.5%的胆盐溶液备用。向PBS中添加胰酶,配制质量分数为0.9%的胰酶溶液用以模拟胃肠道胰酶消化环境。向pH 2的PBS中添加胃蛋白酶,配制质量分数为0.3%的胃蛋白酶溶液用以模拟胃蛋白酶消化环境。
将活化后的动物双歧杆菌F1-3-2菌株转接至酸性环境中,实验组添加低、中、高剂量牛乳外泌体,对照组添加等量PBS。37 ℃下1.5、3 h后分别取出,进行活菌计数,测定牛乳外泌体对动物双歧杆菌F1-3-2耐酸性的影响。
将活化后的动物双歧杆菌F1-3-2菌株转接至MRS肉汤培养基中,调节胆盐质量分数为0.02%,用以模拟胃肠道胆盐环境。实验组添加低、中、高剂量牛乳外泌体,对照组添加等量PBS,37 ℃厌氧环境中培养24 h后取出,进行活菌计数,测定牛乳外泌体对动物双歧杆菌F1-3-2胆盐耐受性的影响。
将活化后的动物双歧杆菌F1-3-2菌株分别转接至胰酶及胃蛋白酶消化环境中,实验组添加低、中、高剂量牛乳外泌体,对照组添加等量PBS。37 ℃环境中1.5、3 h后分别取出,进行活菌计数,测定牛乳外泌体对动物双歧杆菌F1-3-2胰酶及胃蛋白酶耐受性的影响。
1.2.4 牛乳外泌体对动物双歧杆菌F1-3-2细胞黏附性的影响
根据SIDIRA等[17]的方法,将活化后的Caco-2细胞传代,细胞计数后以各孔细胞数1×105铺板,37 ℃培养24 h后各孔添加动物双歧杆菌F1-3-2菌体至109 CFU/mL,实验组添加牛乳外泌体使其质量浓度为100、150、200 μg/mL;对照组添加等量PBS,于CO2培养箱中共孵育16 h。用无菌PBS洗涤5次,除去未黏附的双歧杆菌,1 mL 1%(质量分数)Triton X-100裂解细胞20 min,进行活菌计数,测定牛乳外泌体对动物双歧杆菌F1-3-2细胞黏附性的影响。
1.2.5 牛乳外泌体对动物双歧杆菌F1-3-2抗炎特性的影响
将活化后的Caco-2细胞传代,细胞计数后以各孔细胞数1×105铺板,37 ℃培养24 h后实验组各孔以细菌数∶细胞数=100∶1的数量添加动物双歧杆菌F1-3-2菌体,之后添加牛乳外泌体使其质量浓度分别为0、100、150、200 μg/mL;空白对照组为等量PBS,37 ℃干预16 h后各孔添加10% CCK-8溶液,孵育1 h后使用酶标仪测量450 nm处吸光度,细胞存活率按公式(1)计算:
(1)
式中,A0,空白对照组450 nm处吸光度;A,实验组450 nm处吸光度。
将活化后的Caco-2细胞传代,细胞计数后以各孔细胞数1×105铺板,37 ℃培养24 h后使用2 μg/mL的脂多糖诱导构建炎症细胞模型,继续培养24 h后实验组各孔以细菌数∶细胞数=100∶1的数量添加动物双歧杆菌F1-3-2菌体,之后添加牛乳外泌体使其质量浓度分别为0、100、150、200 μg/mL;空白对照组为等量PBS,37 ℃干预16 h,收集炎症细胞培养液,3 000 r/min离心10 min收集培养上清液。根据ELISA试剂盒说明书,测定各培养液中炎症细胞因子TNF-α、IL-1β的水平。
1.2.6 数据分析
采用SPSS 21.0对实验数据进行差异显著性分析(P<0.05)。相同字母代表无显著差异,不同字母代表差异性显著。
2 结果与分析
2.1 牛乳外泌体的提取与鉴定
采用超速离心法提取牛乳外泌体后,利用透射电镜观察牛乳外泌体形态,结果如图1所示。提取的牛乳外泌体为双层膜结构的近似球体,其直径为30~200 nm,具有外泌体的典型形态特征,同时提取的外泌体杂质较少。目前,外泌体的提取方法主要包括超速离心法、免疫亲和捕获法、化学沉淀法等[18]。本研究结果表明超速离心法可以实现牛乳外泌体的提取分离。

图1 牛乳外泌体透射电镜图
Fig.1 Transmission electron micrograph of bovine milk exosomes
粒度大小是外泌体鉴定的重要指标之一。图2为牛乳外泌体粒径分布图及其颗粒浓度。通过超速离心法提取获得的牛乳外泌体粒径分布在100~200 nm,与透射电镜观察到的结果基本一致,粒径大小符合外泌体的定义。
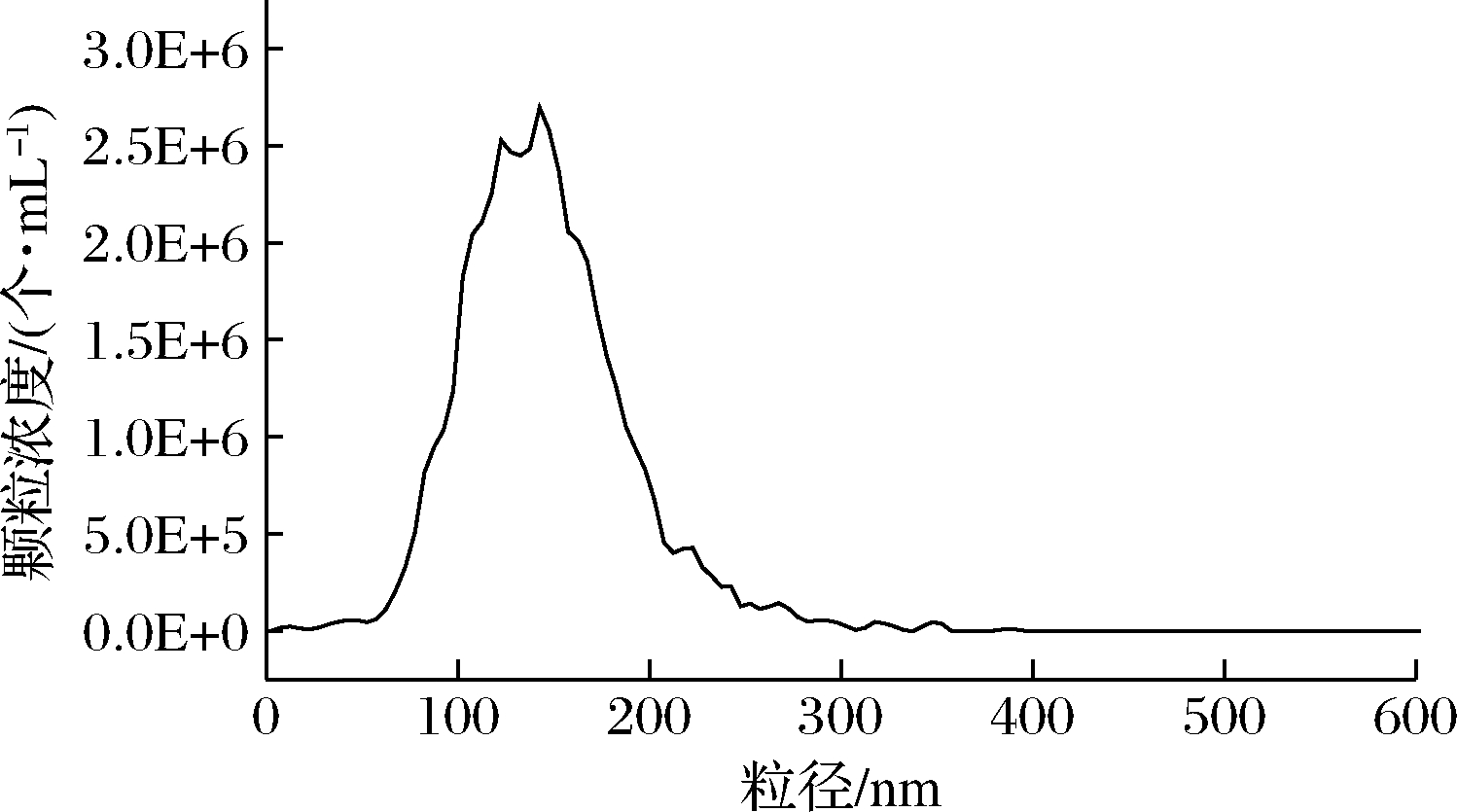
图2 牛乳外泌体粒径分布及其浓度
Fig.2 Particle size distribution and concentration of bovine milk exosomes
特异性标记蛋白是外泌体鉴定的另一重要指标。外泌体外膜及内容物中存在许多特异性标记蛋白,这些特异性蛋白可以辅助鉴定外泌体,包括CD9、CD63、CD81、TSG101、Alix等[19]。利用免疫印迹法对提取的牛乳外泌体的标志性蛋白进行了测定,结果如图3所示。提取的牛乳外泌体样本中检测到了外泌体标志性蛋白CD81、TSG101、Alix,表明超速离心法可成功提取牛乳外泌体。
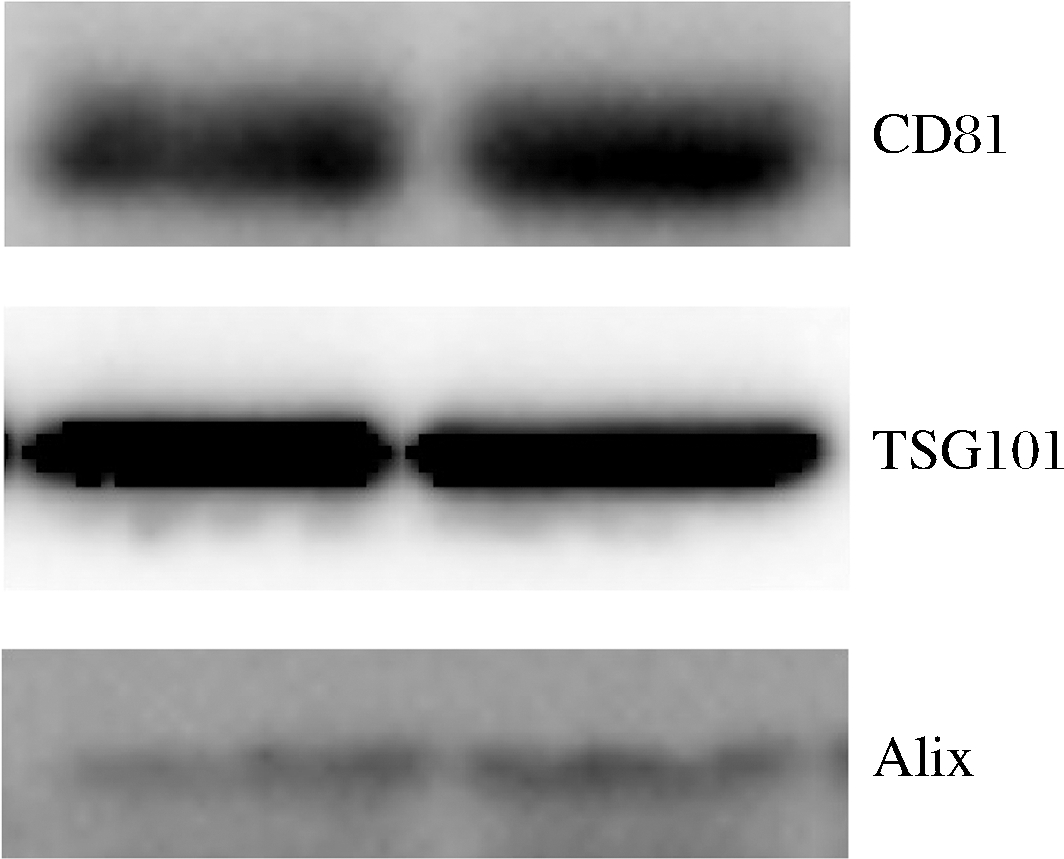
图3 牛乳外泌体特异性标记蛋白
Fig.3 Specific marker protein of bovine milk exosomes
2.2 牛乳外泌体对动物双歧杆菌F1-3-2生长过程的影响
牛乳外泌体对动物双歧杆菌F1-3-2生长的影响如图4-a所示,牛乳外泌体对动物双歧杆菌F1-3-2的生长促进显著,在24、28 h时促进效果最为显著,添加低剂量牛乳外泌体(100 μg/mL)后,菌浓度提升了1.8倍。进一步对外泌体浓度是否会影响促生长效果进行了探究,结果如图4-b所示。牛乳外泌体在低、中、高剂量下均对动物双歧杆菌F1-3-2生长有显著促进效果(P<0.05),但牛乳外泌体对动物双歧杆菌F1-3-2的促生长效果无明显剂量依赖性。
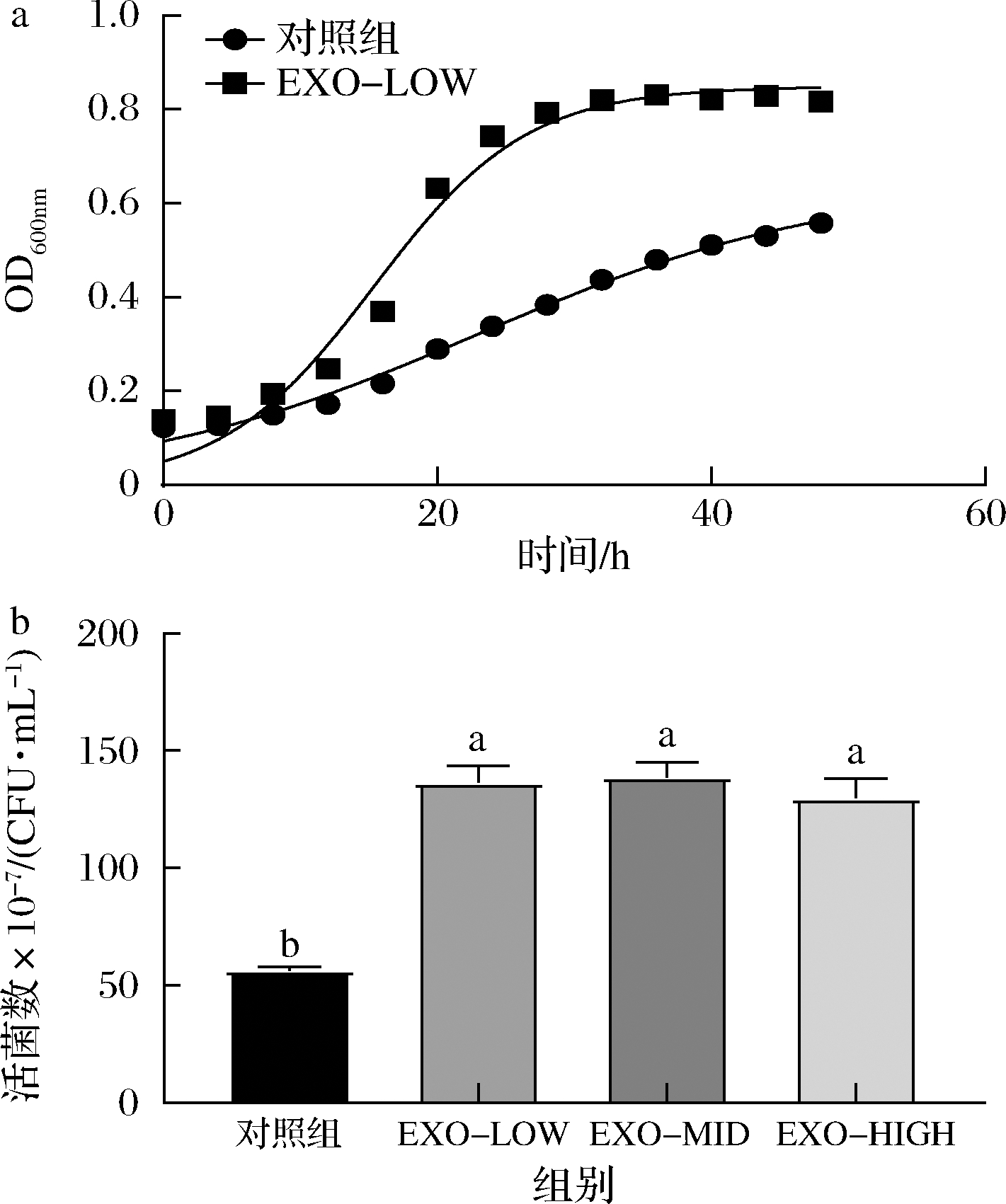
a-生长曲线;b-牛乳外泌体剂量对活菌数的影响
图4 牛乳外泌体对动物双歧杆菌F1-3-2生长过程的影响
Fig.4 Effects of bovine milk exosomes on the growth of B.animalis F1-3-2
2.3 牛乳外泌体对动物双歧杆菌F1-3-2肠胃环境耐受性的影响
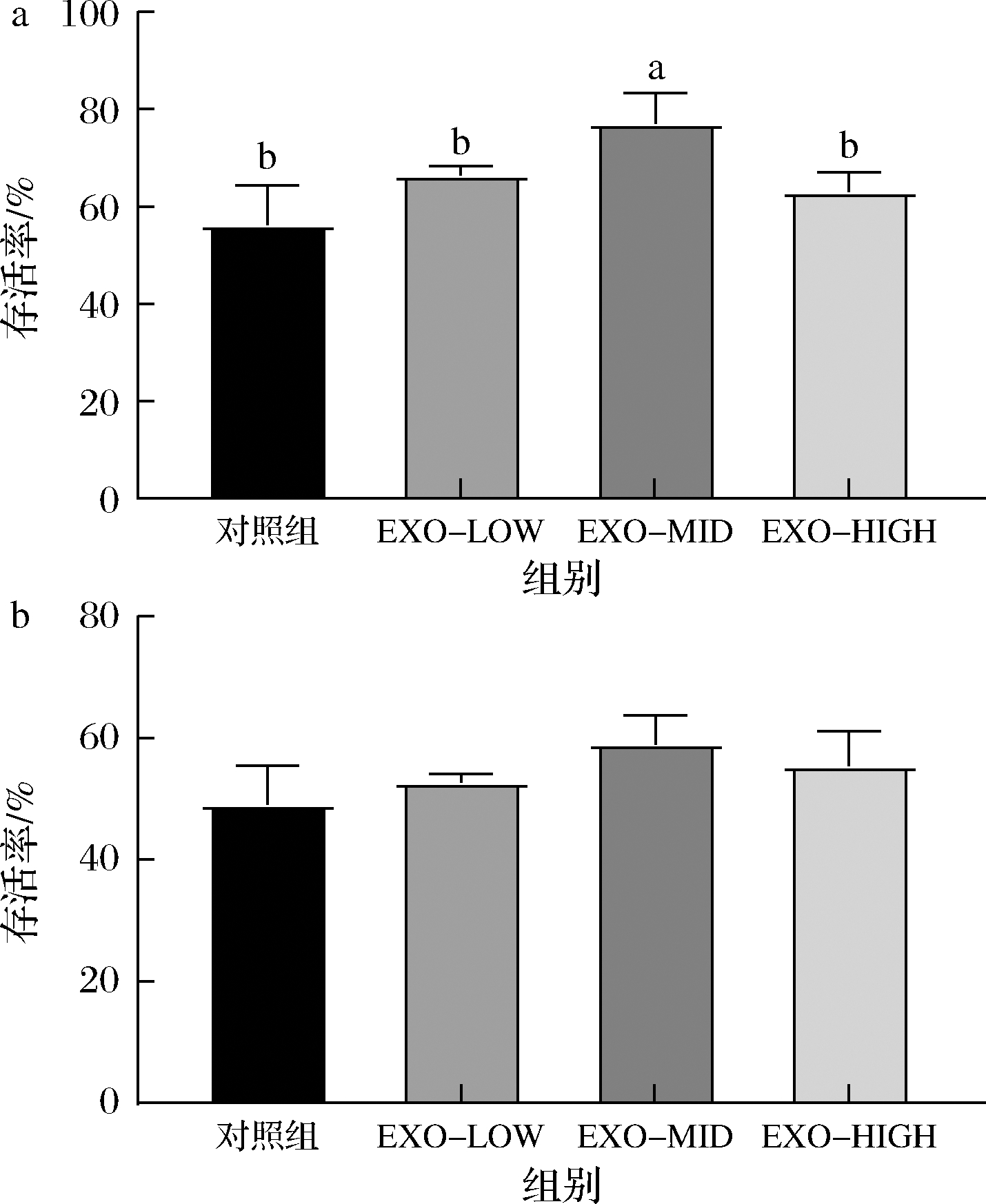
如图5所示,牛乳外泌体对动物双歧杆菌F1-3-2在酸性环境(pH 3.0)中存活率具有明显的改善作用。添加低剂量牛乳外泌体(100 μg/mL)后,动物双歧杆菌F1-3-2在酸性环境保持1.5 h的存活率由43.0%提升至76.3%(P<0.05),保持3.0 h后,存活率由34.3%提升至74.4%(P<0.05)。牛乳外泌体对动物双歧杆菌F1-3-2酸性条件下的保护作用无明显剂量依赖性。

a-1.5 h存活率;b-3.0 h存活率
图5 牛乳外泌体对动物双歧杆菌F1-3-2耐酸性的影响
Fig.5 Effects of bovine milk exosomes on the acid resistance of B.animalis F1-3-2
牛乳外泌体对动物双歧杆菌F1-3-2在胆盐环境存活率的影响如图6所示。

图6 牛乳外泌体对动物双歧杆菌F1-3-2胆盐耐受性的影响
Fig.6 Effects of bovine milk exosomes on the bile salt resistance of B.animalis F1-3-2
牛乳外泌体对动物双歧杆菌F1-3-2在胆盐环境中的存活率具有明显的提高作用。添加低剂量牛乳外泌体(100 μg/mL)后,动物双歧杆菌F1-3-2在胆盐环境24 h存活率由原来的34.1%提升至90.1%(P<0.05)。牛乳外泌体对动物双歧杆菌F1-3-2在胆盐环境的保护作用无明显剂量依赖性。
牛乳外泌体对动物双歧杆菌F1-3-2在胃肠道蛋白酶环境下存活率的影响如图7所示。牛乳外泌体对动物双歧杆菌F1-3-2在胰酶环境中的存活率具有一定程度的提高作用,中剂量牛乳外泌体(150 μg/mL)改善作用最为显著,动物双歧杆菌F1-3-2在胰酶环境中保持1.5 h后的存活率提升了38%(P<0.05),保持3.0 h后的存活率提升了20%。
a-1.5 h存活率;b-3.0 h存活率
图7 牛乳外泌体对动物双歧杆菌F1-3-2胰酶耐受性的影响
Fig.7 Effects of bovine milk exosomes on the trypsin resistance of B.animalis F1-3-2
牛乳外泌体对动物双歧杆菌F1-3-2在胃蛋白酶环境下存活率的影响如图8所示。F1-3-2在胃蛋白酶(pH=3.0)条件下作用3 h后存活率几乎为0,而牛乳外泌体有效提升了其在胃蛋白酶环境中的存活率。添加低剂量牛乳外泌体(100 μg/mL)后,动物双歧杆菌F1-3-2在胃蛋白酶环境保持1.5 h的存活率由18.8%提升至35.7%(P<0.05),保持3.0 h的存活率由0.5%提升至20.7%(P<0.05)。
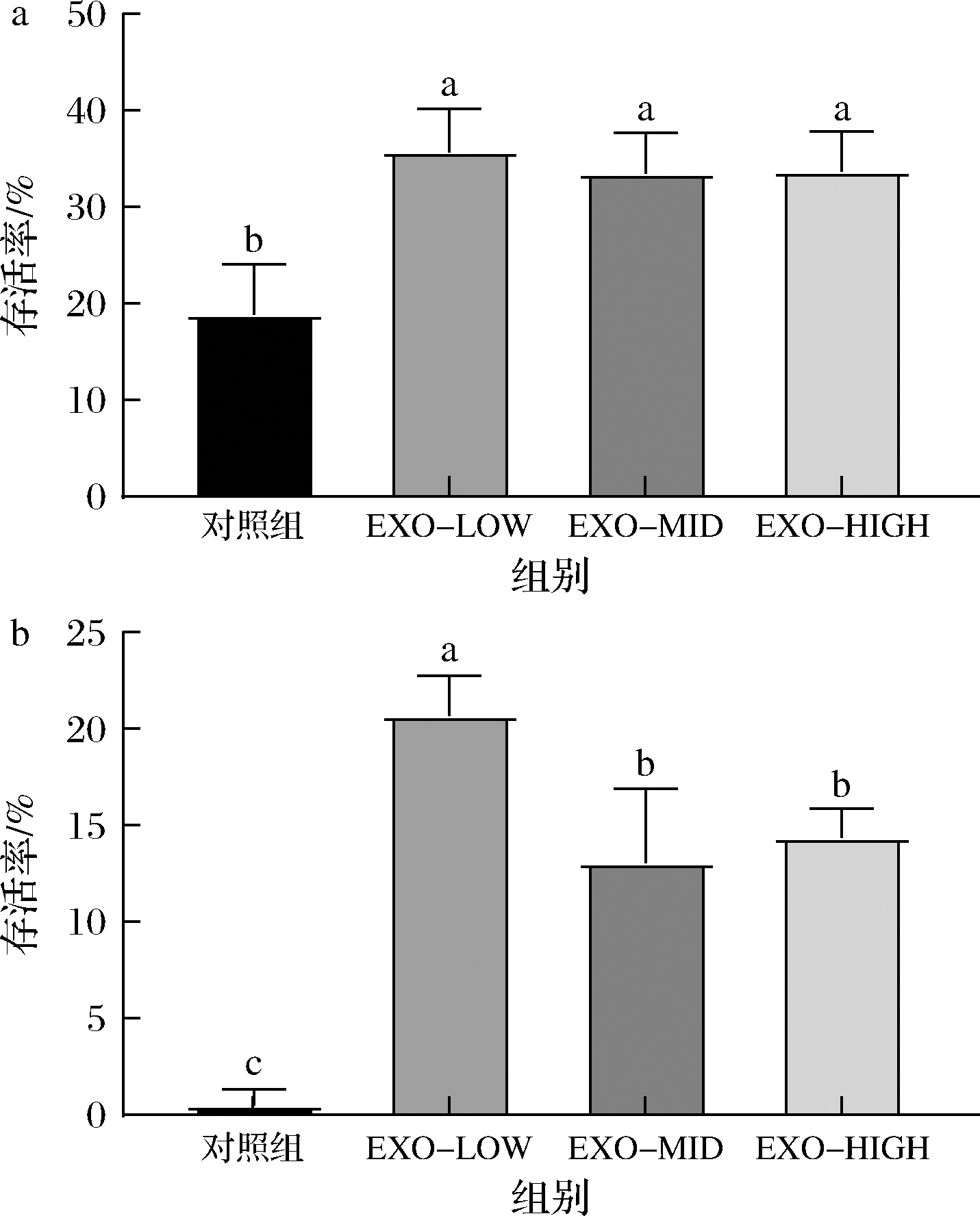
a-1.5 h存活率;b-3.0 h存活率
图8 牛乳外泌体对动物双歧杆菌F1-3-2胃蛋白酶耐受性的影响
Fig.8 Effects of bovine milk exosomes on the pepsin resistance of B.animalis F1-3-2
2.4 牛乳外泌体对动物双歧杆菌F1-3-2黏附性的影响
由图9可知,牛乳外泌体能够显著提高动物双歧杆菌F1-3-2菌株对Caco-2细胞的黏附性能(P<0.05)。随着牛乳外泌体剂量增大,影响效果更为显著。相比于对照组,高剂量牛乳外泌体(200 μg/mL)干预后,动物双歧杆菌F1-3-2菌株对Caco-2细胞的黏附能力上升了1.16倍(P<0.05)。
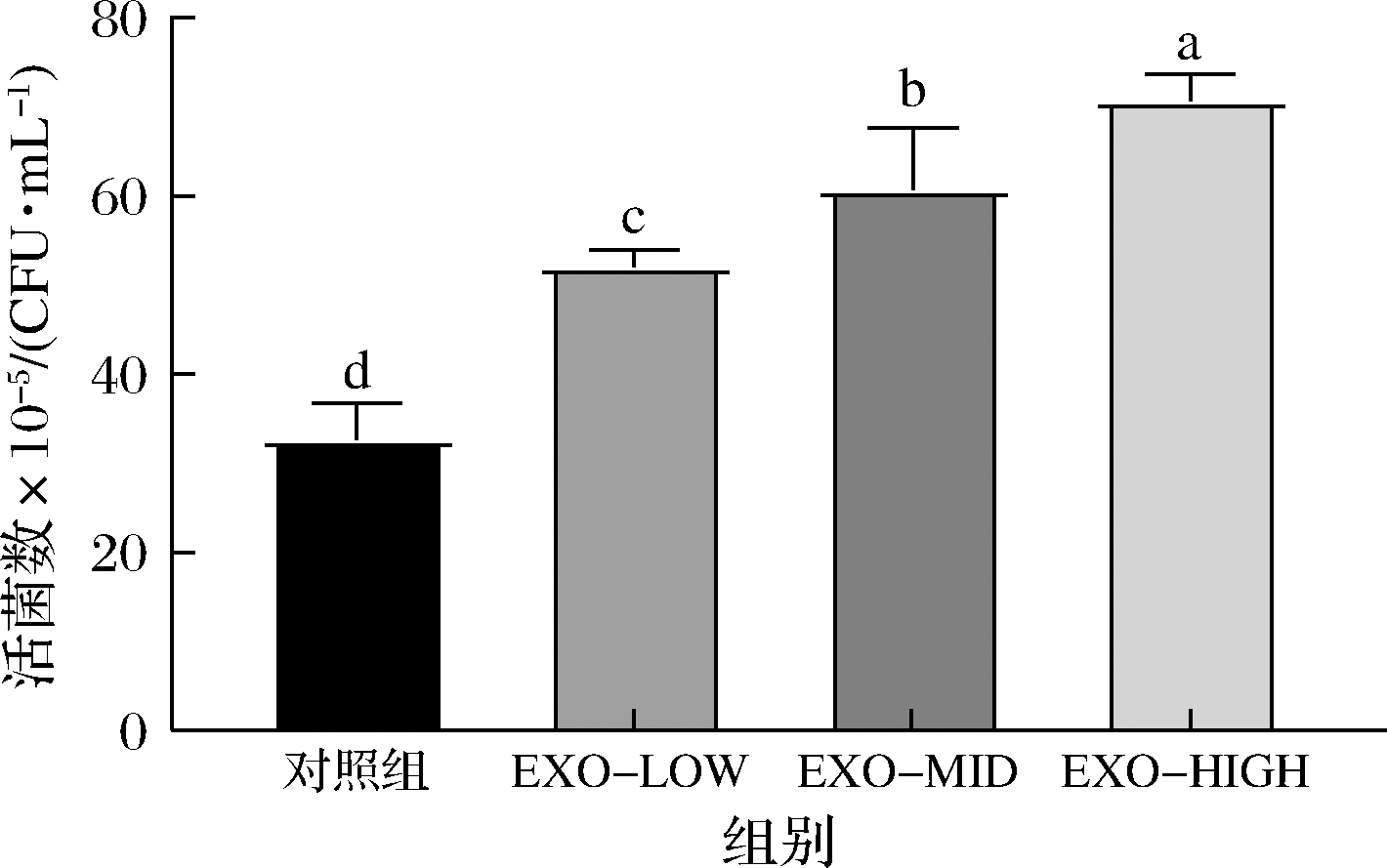
图9 牛乳外泌体对动物双歧杆菌F1-3-2黏附性的影响
Fig.9 Effects of bovine milk exosomes on the adhesion of B.animalis F1-3-2
2.5 牛乳外泌体对动物双歧杆菌F1-3-2抗炎特性的影响
牛乳外泌体和动物双歧杆菌F1-3-2前期均已被证实具有一定的抗炎活性。由图10可知,低剂量牛乳外泌体与动物双歧杆菌F1-3-2共同作用表现出了最佳抗炎效果。与对照组相比,其细胞上清液中TNF-α含量下降了29.3%(P<0.05),IL-1β含量下降了14.5%(P<0.05),抗炎效果优于动物双歧杆菌F1-3-2。随着牛乳外泌体剂量增大,牛乳外泌体与动物双歧杆菌F1-3-2协同抗炎效果反而降低,可能是由于牛乳外泌体同时促进了Caco-2细胞的生长所导致,炎症细胞的增多导致了炎症细胞因子水平的升高。
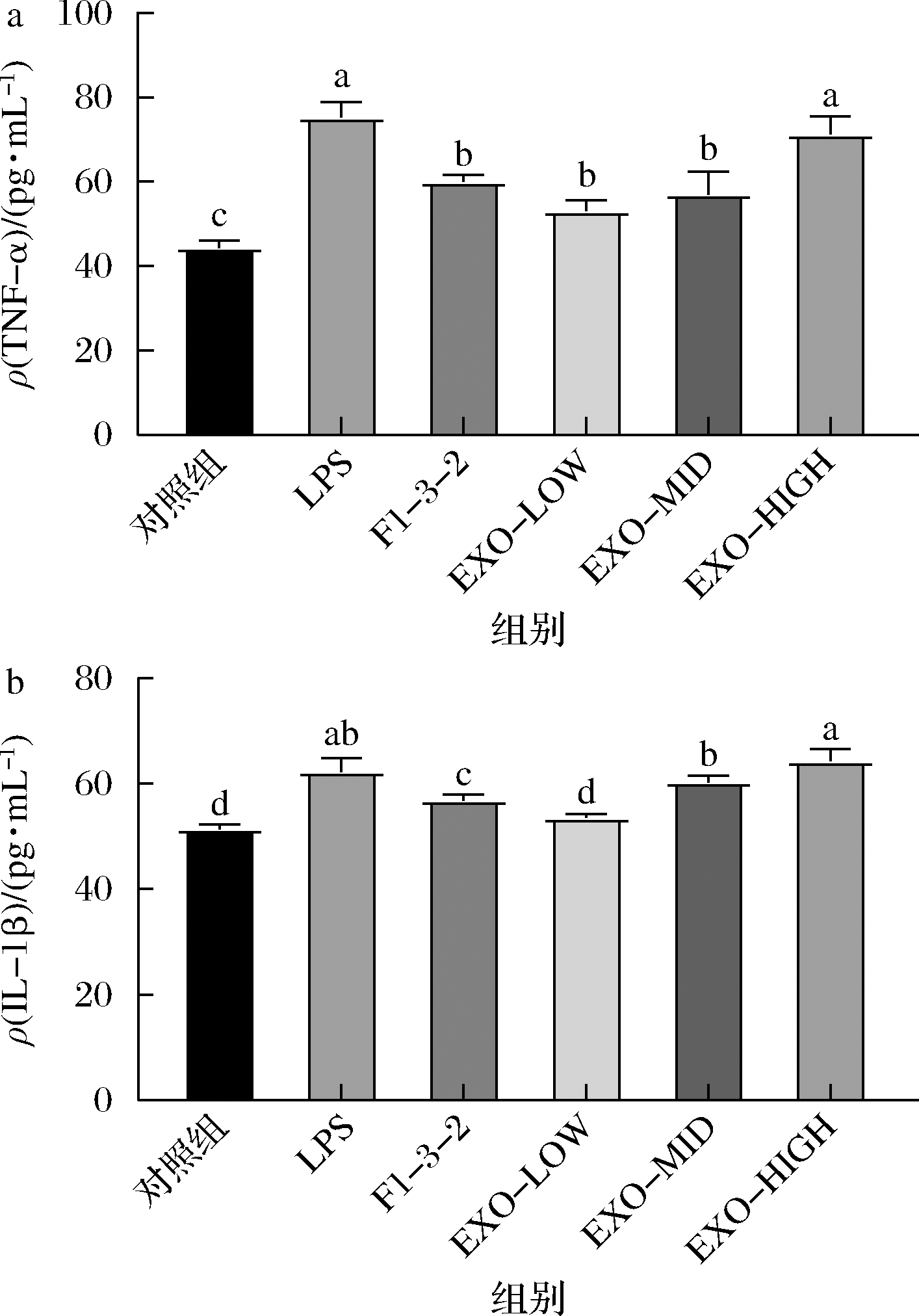
a-TNF-α水平;b-IL-1β水平
图10 牛乳外泌体及动物双歧杆菌F1-3-2对炎症因子水平影响
Fig.10 Effects of bovine milk exosomes and B.animalis F1-3-2 on the level of inflammatory cytokines
3 结论
牛乳外泌体对动物双歧杆菌F1-3-2的生长具有明显的促进作用,同时也能够提高动物双歧杆菌F1-3-2对肠胃环境的耐受性和黏附性能。牛乳外泌体与动物双歧杆菌F1-3-2体现出协同抗炎特性,相关炎症因子水平显著下调。牛乳外泌体有望作为一种新型益生元,发挥促进益生菌生长、提高益生功能等作用。
[1] COCUCCI E, MELDOLESI J.Ectosomes and exosomes:Shedding the confusion between extracellular vesicles[J].Trends in Cell Biology, 2015, 25(6):364-372.
[2] BARILE L, VASSALLI G.Exosomes:Therapy delivery tools and biomarkers of diseases[J].Pharmacology & Therapeutics, 2017, 174:63-78.
[3] LIAO W, DU Y, ZHANG C H, et al.Exosomes:The next generation of endogenous nanomaterials for advanced drug delivery and therapy[J].Acta Biomaterialia, 2019, 86:1-14.
[4] LIU S R, DA CUNHA A P, REZENDE R M, et al.The host shapes the gut microbiota via fecal microRNA[J].Cell Host & Microbe, 2016, 19(1):32-43.
[5] CHEN I H, XUE L, HSU C C, et al.Phosphoproteins in extracellular vesicles as candidate markers for breast cancer[J].Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(12):3 175-3 180.
[6] PEREIRA P C.Milk nutritional composition and its role in human health[J].Nutrition, 2014, 30(6):619-627.
[7] WALSH C, LANE J A, VAN SINDEREN D, et al.Human milk oligosaccharides:Shaping the infant gut microbiota and supporting health[J].Journal of Functional Foods, 2020, 72:104074.
[8] BETKER J L, ANGLE B M, GRANER M W, et al.The potential of exosomes from cow milk for oral delivery[J].Journal of Pharmaceutical Sciences, 2019, 108(4):1 496-1 505.
[9] ZHOU Q, LI M Z, WANG X Y, et al.Immune-related microRNAs are abundant in breast milk exosomes[J].International Journal of Biological Sciences, 2012, 8(1):118-123.
[10] CHEN T, XIE M Y, SUN J J, et al.Porcine milk-derived exosomes promote proliferation of intestinal epithelial cells[J].Scientific Reports, 2016, 6:33862.
[11] YU S R, ZHAO Z H, XU X Y, et al.Characterization of three different types of extracellular vesicles and their impact on bacterial growth[J].Food Chemistry, 2019, 272:372-378.
[12] TONG L J, HAO H N, ZHANG Z, et al.Milk-derived extracellular vesicles alleviate ulcerative colitis by regulating the gut immunity and reshaping the gut microbiota[J].Theranostics, 2021, 11(17):8 570-8 586.
[13] TENG Y, REN Y, SAYED M, et al.Plant-derived exosomal microRNAs shape the gut microbiota[J].Cell Host & Microbe, 2018, 24(5):637-652.
[14] DAHIYA D K, RENUKA, PUNIYA M, et al.Gut microbiota modulation and its relationship with obesity using prebiotic fibers and probiotics:A review[J].Frontiers in Microbiology, 2017, 8:563.
[15] TURRONI F, MILANI C, VENTURA M, et al.The human gut microbiota during the initial stages of life:Insights from bifidobacteria[J].Current Opinion in Biotechnology, 2022, 73:81-87.
[16] TONG L J, HAO H N, ZHANG X Y, et al.Oral administration of bovine milk-derived extracellular vesicles alters the gut microbiota and enhances intestinal immunity in mice[J].Molecular Nutrition & Food Research, 2020, 64(8):e1901251.
[17] SIDIRA M, KOURKOUTAS Y, KANELLAKI M, et al.In vitro study on the cell adhesion ability of immobilized lactobacilli on natural supports[J].Food Research International, 2015, 76:532-539.
[18] 郝海宁, 仝令君, 张兰威, 等.2种不同牛乳外泌体提取方法的比较研究[J].食品安全质量检测学报, 2020, 11(8):2 569-2 574.
HAO H N, TONG L J, ZHANG L W, et al.Comparative study of 2 kinds of different extraction methods of bovine milk exosomes[J].Journal of Food Safety & Quality, 2020,11(8):2 569-2 574.
[19] WITWER K W, BUZ S E I, BEMIS L T, et al.Standardization of sample collection, isolation and analysis methods in extracellular vesicle research[J].Journal of Extracellular Vesicles, 2013, 2(1):20360.
S E I, BEMIS L T, et al.Standardization of sample collection, isolation and analysis methods in extracellular vesicle research[J].Journal of Extracellular Vesicles, 2013, 2(1):20360.