甲型副伤寒沙门氏菌是引起人类伤寒病的病原之一。伤寒病是一类消化道传染病,可引起全身性感染,其临床症状是高度多变的,从以低烧和轻度不适为特征的轻度病症,到危及生命的全身性多种并发症,包括肠穿孔、肠出血、脑病等[1]。该类疾病被列为乙类传染病[2]。近些年,伤寒病仍然是全球范围内的一个重要的公共卫生问题[3],每年影响数百万人,在我国发病率也呈上升趋势。虽然抗生素(氯霉素、氨苄青霉素、甲氧氨嘧啶)将伤寒病的总死亡率降到了1%,但是随着抗生素的使用,出现了具有多重耐药性的菌株,如氟喹诺酮类药物耐药菌株[4]。2017年,世界卫生组织将耐氟喹诺酮沙门氏菌列为对人类威胁最大的12类细菌之一[5]。因此,抗生素替代治疗成为了研究热点。
益生菌被验证具有多种健康功效,如抑菌[6]、抗炎[7]、抗过敏[8]、提高机体免疫力[9-10]、降血脂[11]、抗肿瘤[12]等。益生菌可以通过定植、分泌代谢产物、调节肠道菌群、参与免疫等发挥其健康功效,甚至达到预防治疗疾病的作用[13]。大量研究表明,益生菌对一些致病菌有良好的抑制拮抗作用。赵梓雯等[14]发现短双歧杆菌YH68对鼠伤寒沙门氏菌有良好的抑菌作用,即使是在亚抑制浓度也能发挥其抑菌作用。KEMGANG等[15]发现,含鼠李糖乳杆菌S1K3 (MTCC5957)的发酵乳通过增强肠道黏膜免疫和非免疫保护机制对沙门氏菌产生抑制作用。林如琴等[16]通过体内外实验证实了嗜酸乳杆菌可以抑制致病菌大肠杆菌O157:H7在肠道内定植。本研究通过研究含有嗜酸乳杆菌和动物双歧杆菌乳亚种的益生菌乳饮料对甲型副伤寒沙门氏菌诱导腹泻模型小鼠的肠道菌群的影响,探究嗜酸乳杆菌和动物双歧杆菌乳亚种对甲型副伤寒沙门氏菌的抑制作用及其作用机制,从而为预防缓解甲型副伤寒沙门氏菌感染提供初步的实验依据。
1 材料与方法
1.1 实验样品
本实验所选样品为益生菌饮料,某乳业有限公司提供,含有嗜酸乳杆菌和动物双歧杆菌乳亚种,添加量为≥5×107 CFU/瓶。嗜酸乳杆菌菌粉,动物双歧杆菌乳亚种菌粉,石家庄君乐宝乳业有限公司。甲型副伤寒沙门氏菌(Salmonella paratyphi A) CMCC50973,中国医学菌种保藏中心(CMCC)。
1.2 实验动物
SPF级BALB/c小鼠42只,6周龄,雌雄各半,由中国食品药品检定研究院动物中心提供。
1.3 益生菌饮料对甲型副伤寒沙门氏菌诱导小鼠腹泻的改善作用
1.3.1 腹泻模型的构建
小鼠适应性饲养1周后,通过沙门氏菌的饲喂构建腹泻模型小鼠12只。培养S.paratyphi A CMCC50973至OD值为2.0,菌量约为9×109 CFU/mL。直接灌胃小鼠,连续3 d。
造模成功的判断标准:小鼠出现腹泻、无力、无食欲症状。
1.3.2 益生菌饮料对腹泻模型小鼠的影响
将12只腹泻模型小鼠分为2组,每组6只。对照组,每天正常饮用高压纯净水;实验组,喂养益生菌饮料原液。喂养3 d,并在此过程中观察小鼠腹泻情况,之后代谢笼采集小鼠粪便,取200 μg提取粪便总基因组,利用绝对荧光定量法测定每组小鼠粪便中乳杆菌和双歧杆菌含量。
1.3.3 益生菌对甲型副伤寒沙门氏菌的竞争性抑制作用
将12只普通小鼠,分为2组,每组6只。对照组,每天正常饮用高压纯净水;实验组,培养S.paratyphi A CMCC50973至OD值为2.0,菌量约为9×109 CFU/mL,按1∶1的比例与益生菌饮料原液混合饲喂小鼠。连续喂养3 d,在此过程中观察小鼠腹泻情况,之后代谢笼采集小鼠粪便,取200 μg提取粪便总基因组,利用绝对荧光定量法测定每组小鼠粪便中乳杆菌和双歧杆菌数量。
1.4 益生菌在小鼠肠道中的定植情况
将18只普通小鼠分3组,每组6只。空白组,每天正常引用高压纯净水;实验1组,喂养益生菌饮料原液;实验2组,在益生菌饮料原液基础上加入纯乳酸菌,使其乳酸菌浓度约为5×107 CFU/mL(相当于小鼠每天饮用1瓶益生菌饮料的乳酸菌量)。
在喂养第5、8、10天,采集代谢笼小鼠粪便,取200 μg提取粪便总基因组,利用绝对荧光定量PCR法测定每组小鼠粪便中乳杆菌和双歧杆菌含量。喂养10 d后,将小鼠致死,取小肠和大肠组织,提取肠组织的DNA,利用荧光定量PCR法测定组织内的乳杆菌和双歧杆菌的数量。
1.5 荧光定量检测益生菌
基于乳杆菌和双歧杆菌的基因信息,设计特异性引物序列(表1)。乳杆菌的特异性片段长度为341 bp,双歧杆菌的特异性片段长度为550 bp。将2种细菌特异性片段扩增后连接质粒,倍比稀释后制成荧光定量所需的标准品,作为模板进行PCR反应,绘制标准曲线。取200 μg小鼠粪便,提取总基因组,通过荧光定量PCR测定CT值,进而基于标准曲线确定菌数。
表1 荧光定量引物序列
Table 1 Primers used in fluorescence quantification
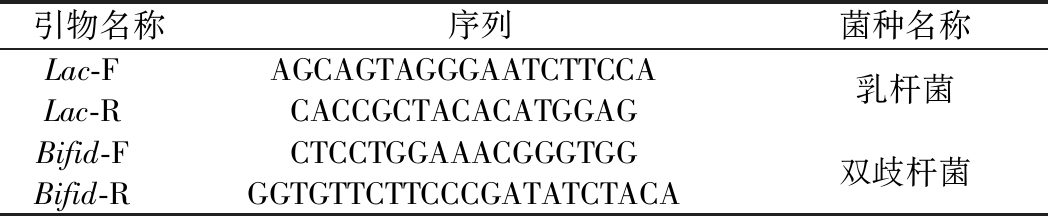
引物名称序列菌种名称Lac-FAGCAGTAGGGAATCTTCCALac-RCACCGCTACACATGGAG乳杆菌Bifid-FCTCCTGGAAACGGGTGGBifid-RGGTGTTCTTCCCGATATCTACA双歧杆菌
2 结果与分析
2.1 益生菌饮料对腹泻模型的影响
结果显示,对照组小鼠腹泻自愈缓慢,3 d后依然腹泻,水样便,每天多便;5 d后逐渐好转,粪便呈现颗粒状。实验组喂养益生菌饮料原液1 d后,小鼠腹泻停止,排便次数减少,便液浓稠;2 d后无腹泻;3 d后恢复正常。腹泻期间小鼠水样便的采集和核酸提取很困难,粪便中除了沙门菌外,几乎没有检测到乳杆菌及双歧杆菌。待小鼠自愈、粪便成形后,取粪便测定乳杆菌及双歧杆菌,结果如表2所示。
表2 腹泻型小鼠自愈后粪便中益生菌数量
Table 2 Probiotics counts in feces of diarrhea type mice after self-healing

组别乳杆菌(lg CFU/μL)双歧杆菌(lg CFU/μL)对照组7.795.88实验组8.656.42
由表2可知,实验组的乳酸杆菌和双歧杆菌的数量高于空白对照组,提示益生菌饮料不仅能抑制病原菌,还能通过增加2种益生菌的含量改善腹泻。
2.2 益生菌与甲型副伤寒沙门氏菌对普通小鼠肠道的影响
连续饲喂3 d后,与对照小鼠相比,同时饲喂沙门氏菌和益生菌饮料原液,小鼠活动力略有下降,食欲无明显差异,未出现水样便和腹泻。显示益生菌饮料中的乳杆菌和双歧杆菌具有竞争性抑制甲型副伤寒沙门氏菌的作用,从而对肠道起到了保作用。连续饲喂益生菌饮料和病原菌3 d,停2 d,第5天后的定量结果基本同正常小鼠,见表3。
表3 普通小鼠受试后5 d粪便中益生菌数量
Table 3 Probiotics counts in feces of normal mice 5 days after test

组别乳杆菌含量(lg CFU/g)双歧杆菌含量(lg CFU/g)对照组8.576.44实验组8.546.40
2.3 益生菌在肠道菌群的定植情况
由图1-a可知,3组小鼠粪便中的乳杆菌菌数在5 d时变化不显著,随着时间的延长,实验1组和2组的乳杆菌含量在8、10 d时较空白对照组明显增加。从图1-b可知,双歧杆菌变化明显,实验1组、实验2组在第5、8、10天,粪便中双歧杆菌的含量均比空白组明显增加。
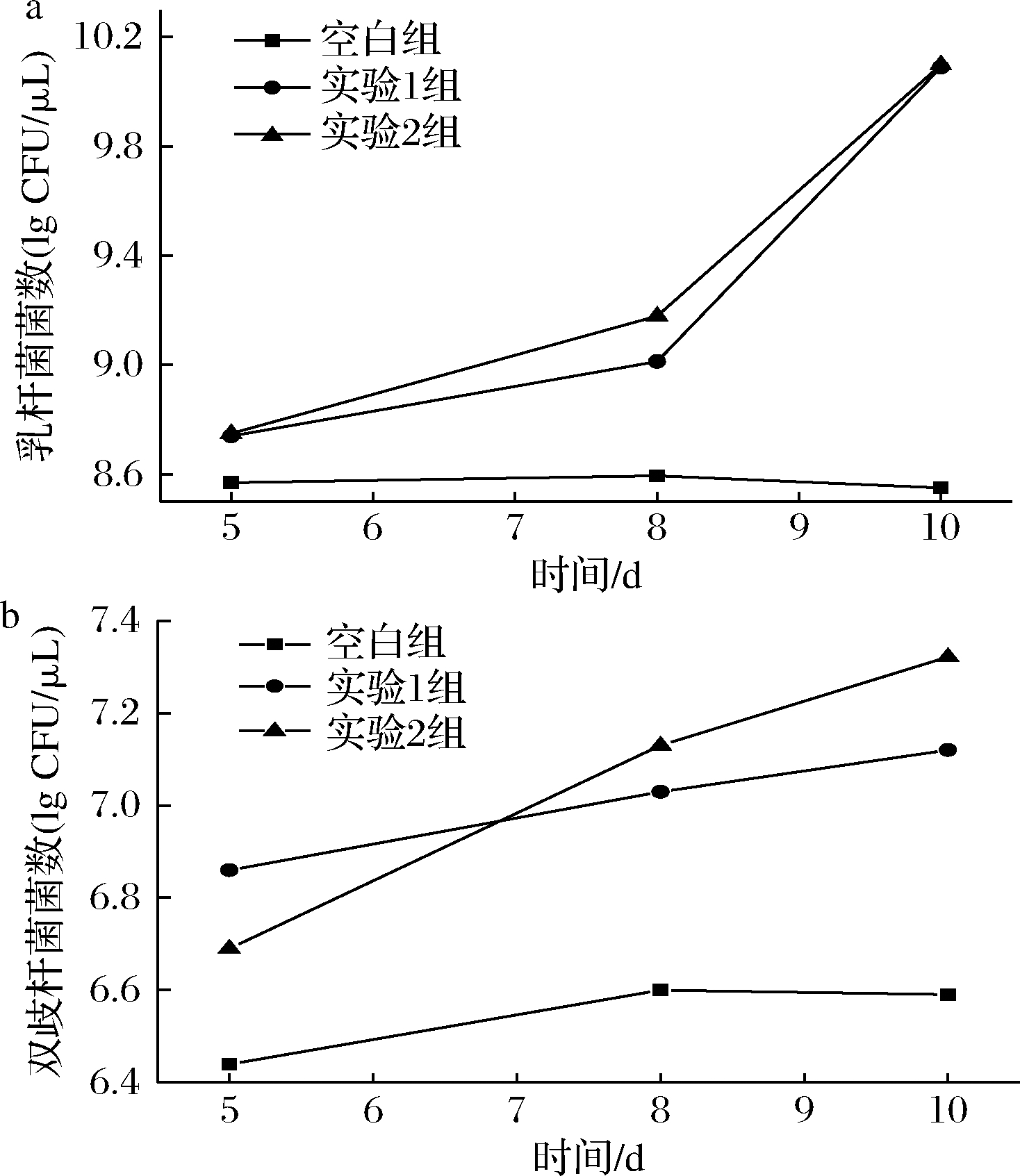
a-乳杆菌;b-双歧杆菌
图1 益生菌饮料对小鼠肠道乳杆菌和双歧杆菌的影响
Fig.1 Effect of probiotic beverage on intestinal L.acidophilus and B.animalis subsp.lactis in mice
实验组的肠组织DNA中,未能检测到乳杆菌及双歧杆菌。为了进一步探究菌株在肠道的定植情况,采用MRS培养基进行乳酸菌选择性培养。取肠道和胃部组织于1 mL的MRS培养基中,充分混匀,取上清液200 μL涂布平板,厌氧培养48 h后计数取总值,结果如表4所示。
表4 胃肠道组织内的益生菌数
Table 4 Probiotics counts in gastrointestinal tissues
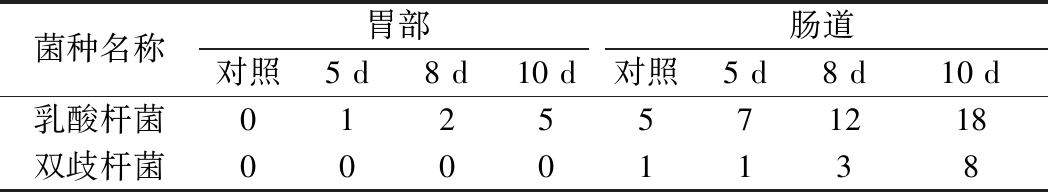
菌种名称胃部肠道对照5 d8 d10 d对照5 d8 d 10 d乳酸杆菌0125571218双歧杆菌00001138
从培养结果可以看出,随着饲喂时间的延长,胃部乳杆菌数在增加,但未检测到双歧杆菌;肠道内的乳杆菌和双歧杆菌的数目均随着喂养时间的增加呈上升趋势。
3 结论
本研究探究了嗜酸乳杆菌和动物双歧杆菌乳亚种益生菌饮料改善甲型副伤寒沙门氏菌诱导小鼠的腹泻作用。从结果看,不管在对腹泻模型小鼠还是在益生菌和沙门氏菌同时作用普通小鼠的实验中,益生菌饮料都发挥了抑制病原菌的作用,缓解了模型小鼠的腹泻症状,也预防普通小鼠感染沙门氏菌出现腹泻的症状,说明该款益生菌饮料中的嗜酸乳杆菌和动物双歧杆菌乳亚种在应用中保持了一定的稳定性,能够发挥对甲型副伤寒沙门氏菌的抑制功效。
目前,已发现的益生菌健康功效的作用机制有很多,抑制病原菌改善腹泻的作用机制可能有肠道内竞争性的占位、提高肠道益生菌数量、产生抑菌素、增强免疫力等[17]。而益生菌在肠道内的定植、黏附是这些作用机制的基础[18]。本研究为了进一步验证益生菌作用机制,从粪便和肠道组织两方面,探究了益生菌在小鼠肠道定植情况。2个实验组小鼠粪便中乳杆菌和双歧杆菌的数量与对照组相比明显增加,同时随着饲喂时间的增加益生菌也呈增加趋势,从结果可以推断这2株菌具有良好的定植能力。同时胃肠道组织内经过培养也检测到了2种益生菌,且随饲喂时间的延长益生菌的数目也在增加,进一步直观验证了2种益生菌具有定植能力。本研究中的嗜酸乳杆菌和动物双歧杆菌乳亚种的定植存在差异,从结果看嗜酸乳杆菌的定植能力要高于动物双歧杆菌乳亚种,正如王梦颖等[19]以小鼠为实验动物模型,对6株乳杆菌在肠道的定植能力进行了检测,结果发现不同菌株之间的定植能力存在差异。但不同菌株定植的差异,是受何种因素影响,比如菌株本身、肠道环境、受体等,仍需要进一步的研究。
本研究从益生菌的应用产品入手,发现益生菌在应用后仍具有改善甲型副伤寒沙门氏菌诱导小鼠腹泻的作用,在进一步的机制探究中发现嗜酸乳杆菌和动物双歧杆菌乳亚种具有一定的抑制病原菌和在肠道定植的能力。因此,提示嗜酸乳杆菌和动物双歧杆菌乳亚种在拮抗甲型副伤寒沙门氏菌具有良好的应用价值,为甲型副伤寒沙门氏菌相关感染的治疗提供了新思路。
[1] CRUMP J A. Progress in typhoid fever epidemiology[J]. Clinical Infectious Diseases, 2019(Supplement_1): S4-S9.
[2] 卫生部疾病预防控制局. 伤寒、副伤寒防治手册[M]. 北京: 人民卫生出版社, 2006.
Department of Disease Control and Prevention, Ministry of Health. Handbook on the prevention and treatment of typhoid and paratyphoid[M]. Beijing: People’s Medical Publishing House, 2006.
[3] SETHI S, GAUTAM V, GUPTA K, et al. Vertical transmission of Salmonella enterica serotype Paratyphi A leading to abortion[J]. JMM Case Reports, 2017, 4(11): e005127.
[4] GIBANI M M, BRITTO C, POLLARD A J. Typhoid and paratyphoid fever: A call to action[J]. Current Opinion in Infectious Diseases, 2018, 31(5): 440-448.
[5] TACCONELLI E, CARRARA E, SAVOLDI A, et al. Discovery, research, and development of new antibiotics: The WHO priority list of antibiotic-resistant bacteria and tuberculosis[J]. The Lancet Infectious Diseases, 2018, 18(3):318-327.
[6] SLATTERY C, COTTER P D, O’TOOLE P W. Analysis of health benefits conferred by Lactobacillus species from kefir[J]. Nutrients, 2019, 11(6): 1252.
[7] 李新秋, 佘勇, 陈军, 等. 益生菌对抗菌素致肠道菌群紊乱患者免疫指标及炎症指标的影响[J]. 航空航天医学杂志, 2020, 31(9): 1 091-1 092.
LI X Q, SHE Y, CHEN J, et al. Effects of probiotics on immune and inflammatory indexes in patients with intestinal flora disorder caused by antibiotics[J]. Journal of Aerospace Medicine, 2020, 31(9): 1 091-1 092.
[8] 吴炜倩, 陆合, 郭亚楠, 等. 益生菌防治过敏性疾病的进展和展望[J].中国微生态学杂志, 2020, 32(7): 862-865.
WU W Q, LU H, GUO Y N, et al. Progress and prospect of probiotics in the prevention and treatment of allergic diseases[J]. Chinese Journal of Microecology, 2020, 32(7): 862-865.
[9] 伍梓汐, 李姗珊, 沈曦, 等. 益生菌免疫调节功能研究[J].食品科技, 2017, 42(1): 29-33.
WU Z X, LI S S, SHEN X, et al. Effects on immunomodulatory of probiotics[J]. Food Science and Technology, 2017, 42(1):29-33.
[10] KEMGANG T S, KAPILA S, SHANMUGAM V P, et al. Cross-talk between probiotic Lactobacilli and host immune system[J]. Journal of Applied Microbiology, 2014, 117(2):303-319.
[11] LIN S Y, AYRES J W, WINKLER W JR, et al. Lactobacillus effects on cholesterol: In vitro and in vivo results[J]. Journal of Dairy Science, 1989, 72(11):2 885-2 899.
[12] 王志强, 马丽娟, 周海静, 等. 益生菌抗肿瘤作用及其机制的研究进展[J]. 国际口腔医学杂志, 2017, 44(6):636-641.
WANG Z Q, MA L J, ZHOU H J, et al. Research progress on antitumor effect and mechanism of probiotics[J]. International Journal of Stomatology, 2017, 44(6):636-641.
[13] 阿热爱·巴合提, 武瑞赟, 肖梦圆,等. 益生菌的生理功能及作用机理研究进展[J]. 食品与发酵工业, 2020, 46(22): 270-275.
AREAI B, WU R Y, XIAO M Y, et al. Research progress in physiological function and mechanism of probiotics[J]. Food and Fermentation Industries, 2020, 46(22): 270-275.
[14] 赵梓雯, 杨虹. 短双歧杆菌对鼠伤寒沙门氏菌的抑制[J]. 微生物学通报, 2019, 46(10): 2 673-2 688.
ZHAO Z W, YANG H. Inhibition of Salmonella typhimurium by Bifidobacterium breve[J]. Microbiology China, 2019, 46(10):2 673-2 688.
[15] KEMGANG T S, KAPILA S, SHANMUGAM V P, et al. Fermented milk with probiotic Lactobacillus rhamnosus S1K3 (MTCC5957) protects mice from Salmonella by enhancing immune and nonimmune protection mechanisms at intestinal mucosal level[J]. The Journal of Nutritional Biochemistry, 2016, 30: 62-73.
[16] 林如琴, 吴娴波, 张益多, 等. 嗜酸乳杆菌抑制大肠杆菌O157:H7肠道定植体内外实验[J]. 实用医学杂志, 2016, 32(16): 2 603-2 607.
LIN R Q, WU X B, ZHANG Y D, et al. Inhibiting effect of Lactobacillus acidophilus on intestinal colonization of enterohaemorrhagic E.coli O157:H7 in vitro and vivo[J]. The Journal of Practical Medicine, 2016, 32(16): 2 603-2 607.
[17] JUNGERSEN M, WIND A, JOHANSEN E, et al. The science behind the probiotic strain Bifidobacterium animalis subsp. lactis BB-12®[J]. Microorganisms, 2014, 2(2):92-110.
[18] GOPAL P K, PRASAD J, SMART J, et al. In vitro adherence properties of Lactobacillus rhamnosus DR20 and Bifidobacterium lactis DR10 strains and their antagonistic activity against an enterotoxigenic Escherichia coli[J]. International Journal of Food Microbiology, 2001, 67(3):207-216.
[19] 王梦颖, 赵国忠, 韩俊燕, 等. 食源性乳酸菌的分离及其在小鼠肠道的定植能力[J]. 中国食品学报, 2018, 18(5): 239-245.
WANG M Y, ZHAO G Z, HAN J Y, et al. Isolation of foodborne lactic acid bacteria and detection of the colonization ability in mouse intestinal tract[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(5): 239-245.