中国传统米酒是一种以糯米为原料,经半固态发酵而成的商品酒精饮料,其营养丰富,历史悠久,一般可以分为酿造米酒和蒸馏米酒[1-2],其中蒸馏米酒是在酿造米酒的基础上经蒸馏工艺而得到的酒精含量较高的米白酒,如桂林三花米香型白酒等[3]。已有研究表明,米酒对人体健康有多种益处,包括抗氧化、提高免疫等。如邓志辉[4]研究发现蒋巷米酒抗氧化性较好,还具有一定的抗疲劳能力。
近年来,关于米酒功能因子的研究多有报道。米酒发酵过程中,在酒曲中微生物以及各种酶的共同作用下,蛋白质、多糖类和脂肪等物质被降解成单糖、低聚糖和氨基酸等[5]。其中米酒中的多糖有两个来源:在发酵过程中,糯米中的淀粉被微生物降解,转化为低聚糖和多糖;除了原料外,也可由微生物产生,例如在酵母生长和裂解过程中,细胞壁中的β-葡聚糖被释放到米酒中,其中β-葡聚糖具有降血糖和抗氧化作用[6]。CHO等[7]表明韩国传统米酒中的多糖能增加正常小鼠免疫力,促进免疫抑制模型小鼠的免疫细胞增殖。因此米酒中的多糖可能具有多种生物活性功能。其中部分多糖类化合物由于可以调节肠道酸碱度、肠道微生物组成和丰度以及促进短链脂肪酸(short-chain fatty acids,SCFAs)等有益代谢物的形成[8-9],有益于宿主的健康,越来越多的应用于益生元的研究。
蒸馏米酒在蒸馏过程中会产生大量的蒸馏残液,而蒸馏工艺中酒精会与多糖类物质分离,导致大量多糖类物质溶解在残液中。不仅会提高生产成本,同时也会对环境造成大量污染。因此本文旨在研究蒸馏米酒的蒸馏残液中功能糖的提取及其益生功能,既可以获得酒精度较高的蒸馏米酒,又可以将蒸馏残液再利用,极大地降低了蒸馏米酒的生产成本和对环境的污染。
1 材料与方法
1.1 实验材料
糯米,五常市兴旺米业有限公司;米酒曲,安琪酵母股份有限公司;3 500 Da透析袋,无锡恒康医疗科技有限公司;其他试剂均为分析纯。
实验菌种:短双歧杆菌(FWX346)、动物双歧杆菌(ZJTZ1M2)、鼠李糖乳杆菌(FFJLY7L1)、干酪乳杆菌(FJSSZ4L6),均从健康人群粪便中分离,保藏单位为江南大学(中国无锡)食品微生物菌种保藏中心,保藏地址为江苏省无锡市蠡湖大道1800号。
MRS培养基(g/L):蛋白胨10,牛肉膏10,酵母膏5,乙酸钠2,柠檬酸氢二氨2,硫酸镁0.58,硫酸锰0.25,碳源5,L-半胱氨酸0.5。
1.2 仪器与设备
K15型冷冻高速离心机,美国Sigma公司;LC-1200型高效液相色谱、7890A气相色谱仪,美国Agilent公司;ICS5000离子色谱仪,美国戴安公司;MuLtimode 8原子力显微镜,德国布鲁克公司。
1.3 实验方法
1.3.1 蒸馏残液中多糖的分离纯化
取500 mL蒸馏米酒的蒸馏残液,50 ℃减压浓缩至原体积的1/3,添加95%乙醇至乙醇终体积分数为30%,4 ℃醇沉12 h,取上清液(6 000 r/min,离心15 min)添加95%乙醇至乙醇体积分数为80%,搅拌充分后,4 ℃继续醇沉12 h,收集沉淀(6 000 r/min,离心15 min),添加30%乙醇复溶后,4 ℃静置12 h,收集上清液(6 000 r/min,离心15 min),减压浓缩、冷冻干燥得到粗多糖,取一定量的粗多糖溶解后,采用Sevag试剂[V(三氯甲烷)∶V(正丁醇)=4∶1]除蛋白,添加样液1/5的Sevag试剂,放入摇床充分振荡后取上清液,重复操作直至中间无蛋白层出现,收集上清液减压浓缩除去样品中的有机试剂,使用截留分子质量3 500 Da的透析袋在超纯水中透析72 h后,减压浓缩冻干得到多糖样品并命名为CRWPs。
1.3.2 蒸馏残液中多糖的总糖和蛋白质的测量
总糖含量利用硫酸苯酚法测定,蛋白质的测定利用紫外全光谱扫描。
1.3.3 蒸馏残液中多糖的单糖组成的测定
采用ICS-5000离子色谱仪测定多糖的单糖组成,具体方法参照刘卫宝等[10]的研究报道,并略作修改。取5 mg 多糖样品加入300 μL三氟乙酸(2 mol/L)溶液,混匀后于100 ℃下水解6 h;冷却至室温后用氮气吹干,接着加入300 μL甲醇再次吹干,重复以上操作4~5次,以完全除去三氟乙酸。再加入25 mL超纯水溶解,稀释10倍后上样测定。色谱条件如下:CarboPac PA20阴离子交换柱,包括250 mm×4 mm分析柱、50 mm×4 mm保护柱;色谱柱温度为30 ℃;流动相由A(超纯水)、B(0.25 mol/L NaOH)和C(1 mol/L NaAc)组成,其中流动相B的比例分别为体积分数2.6%(0~30.0 min)、2.6%~80.0%(30.0~50.0 min);其中流动相C的比例分别为体积分数5.0%~80.0%(21.1~30.0 min);流量为0.5 mL/min;进样体积为20 μL。
1.3.4 蒸馏残液中多糖的分子质量的测定
利用高效凝胶过滤色谱法(high performance gel filtration chromatography,HPGFC)[11],以Superose 12(1.0 cm×30 cm)为色谱柱,进一步分析多糖的平均分子质量。由葡聚糖标准品得到标准曲线方程(y=-0.098 76x+6.782 9,R2=0.995),将多糖溶于超纯水(5 mg/mL),过0.22 μm滤膜,色谱条件如下:流动相:0.01 mol/L NaOH;流速:0.5 mL/min;柱温:30 ℃;进样量:20 μL。
1.3.5 流变特性测定
称取不同质量的多糖样品溶于超纯水得到不同质量浓度(5、10、20 mg/mL)的多糖溶液,待其充分溶解后,采用TA DHR-1型流变仪测量多糖溶液的流变特性。选取锥板C60夹具进行测量,在25 ℃、剪切速率0.1~1 000 s-1条件下进行扫描,并记录相应的表观黏度。
1.3.6 原子力显微镜分析
将多糖用超纯水配制成10 μg/mL的溶液,涡旋使其完全溶解。取5 μL滴至硅片上,室温条件下,置于干燥皿中过夜干燥。待完全干燥后,采用MuLtimode 8型原子力显微镜进行观察,扫描条件为:空气中非接触模式,氮探针;曲率半径10 nm;氮化硅悬臂,弹性系数2.80 N/m,扫描频率1.001 Hz。
1.3.7 发酵益生菌研究
选择短双歧杆菌(FWX346)、动物双歧杆菌(ZJTZ1M2)、鼠李糖乳杆菌(FFJLY7L1)、干酪乳杆菌(FJSSZ4L6)4株菌作为目标菌种进行培养,进行益生活性评价,以MRS培养基为基础培养基,并稍作修改,添加0.5 g/L L-半胱氨酸。以无碳源的MRS作为空白对照,以菊粉(5 g/L)为碳源作为益生参照物,以蒸馏残液中提取的多糖(5 g/L)为碳源作为实验组。首先制备益生菌种子液,取5 mL种子液加入30 mL无菌磷酸盐缓冲液(PBS,pH 7.0)中制成菌悬液,将菌悬液接种于厌氧管中,于37 ℃下厌氧培养48 h,分别在0、24、48 h取样,测定OD600值、pH、SCFAs和乳酸的变化。
1.3.8 SCFAs含量的测定
采用气相色谱法对发酵样品进行SCFAs含量分析[12]。发酵液5 000 r/min离心10 min,取2 mL上清液依次加入20 μL二乙基丁酸、500 μL盐酸、2 mL乙醚涡旋3~5 min,静置至液面分层,分离有机相,加入无水硫酸钠涡旋30 s,静置2 min取上清液过0.22 μm有机相膜,样品(0.5 μL)注入Agilent 7890A GC系统,采用HP-INOWAX色谱柱(30 m×0.25 mm,0.25 μm,Agilent,USA)和火焰离子化检测器(flame ionization detector,FID)。色谱条件:流速为1.5 mL/min,分流比为1∶20,加热过程为60~190 ℃,4 min,进样口温度为220 ℃,FID温度为250 ℃。
1.4 数据分析
所有实验均重复3次,结果表示为平均值±标准偏差。采用SPSS软件进行Duncan检验,进行统计分析,P<0.05时表示差异显著。
2 结果与分析
2.1 多糖和蛋白质含量测定
从蒸馏米酒蒸馏残液中分离得到的粗多糖得率为4.23 g/L,通过硫酸苯酚法(y= 9.741 4x-0.003 2,R2=0.999)测得杂多糖(CRWPs)中的总糖含量为(84.30±0.23)%,CRWPs的紫外全光谱扫描结果如图1所示,在260 nm和280 nm处均无明显吸收峰,结果表明CRWPs溶液不含有核酸和蛋白质。
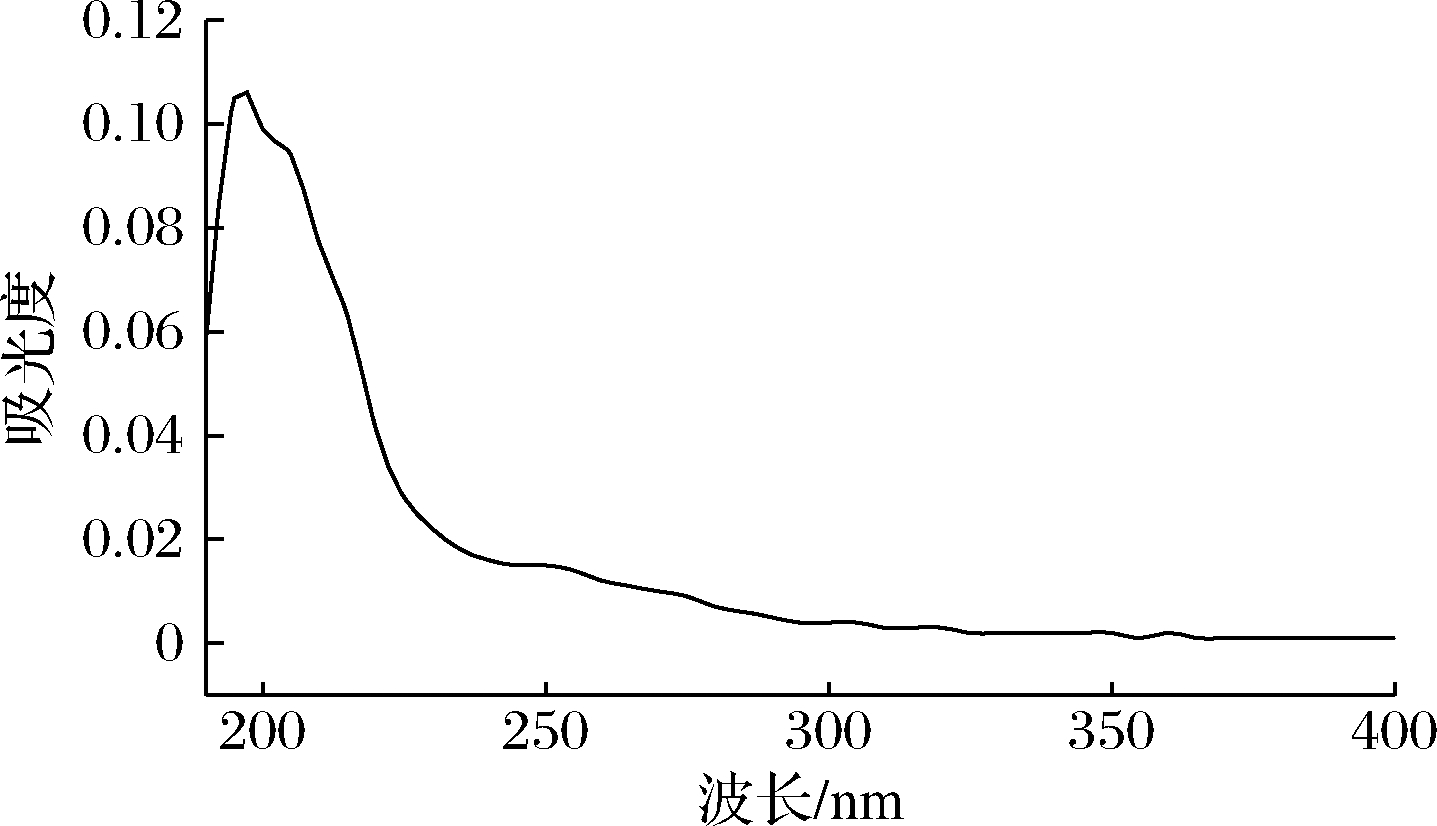
图1 波长为190~400 nm的紫外全光谱扫描曲线
Fig.1 Ultraviolet full spectrum scan in the wavelength range of 190-400 nm
2.2 多糖分子质量测定
HPGFC在多糖分子质量测定上应用广泛,具有高效、准确等特点,本研究通过HPGFC测定CRWPs的分子质量,结果如图2所示,根据分子质量葡聚糖标准曲线得到CRWPs的重均分子质量为8 554 Da,分子均一度为1.236,表明该多糖分子质量分布较窄。

图2 CRWPs的HPGFC色谱图
Fig.2 HPGPC chromatography of CRWPs
2.3 单糖组成分析
CRWPs的单糖组成结果如图3所示,CRWPs主要由葡萄糖(91.56%)、半乳糖(2.13%)、甘露糖(1.61%)、葡萄糖醛酸(1.84%)、半乳糖醛酸(1.34%)、岩藻糖(0.67%)和少量阿拉伯糖(0.12%)组成。CHO等[7]从韩国传统米酒中分离出的多糖主要由葡萄糖、甘露糖和半乳糖组成,其中甘露糖含量高达24.5%,不含糖醛酸。与韩国米酒多糖相比,CRWPs具有不同的单糖组成,这可能与原料、提取方法的不同有关。以上结果表明CRWPs是一种杂多糖。

a-单糖标准曲线;b-CRWPs的单糖组成
图3 单糖标准曲线和CRWPs的单糖组成
Fig.3 Standard curve of the monosaccharide and the monosaccharide composition of CRWPs
2.4 流变学特性分析
多糖的流变学特性是其应用到功能性食品的研究基础,具有重要的研究意义,如图4所示,当剪切速率为0.1~10 s-1时,不同浓度的多糖溶液的表观黏度逐渐降低,在10~100 s-1时趋于稳定,且都表现出典型的剪切变稀行为[13]。然后经牛顿幂律方程N=Krn-1拟合后,得到相应的稠度系数K值和流动特性指数n值,结果见表1。CRWPs流动特性指数n值均<1,且n值随多糖溶液浓度的增加而减小,稠度系数K随着多糖溶液浓度增加而上升,这表明CRWPs溶液具有假塑性流体的特征,且多糖溶液浓度越高,越能呈现更好的假塑性。

图4 不同浓度的CRWPs溶液的表观黏度随剪切速率变化的稳态流动曲线
Fig.4 Steady shear flow curves of CRWPs solutions with different concentrations as a function of shear rate
表1 不同浓度CRWPs溶液下稳态流变的幂率方程拟合参数
Table 1 Power law equation fitting parameters of different concentrations of CRWPs static rheological curve

样品质量浓度/(mg·mL-1)K/(mPa·sn-1)nR2530.310.141650.99810117.300.133400.99820137.800.073900.999
2.5 原子力显微镜实验结果
原子力显微镜近几年来广泛应用于研究多糖的表面形貌与结构,图5为10 μg/mL的CRWPs溶液在原子力显微镜下的平面图和立体图像。其中圆环的直径为0~149.34 nm,推测该多糖具有多分支的结构,在支链和直链的共同作用下,分子发生了聚集。多糖链的平均高度为0~23 nm,一般来说,多糖分子的单链高度为0.1~1.0 nm[14],说明观测到的不是多糖单链,可能是多条单链联结在一起。该结果可能是样品干燥时由于水分降低造成局部样品凝聚结块,由于多糖质量浓度大,羟基数目多,使得分子间氢键缔合作用增强。其中多糖链间聚合而形成点状或棒状结构,从而能够在AFM图像上看到接近23 nm的多糖链聚集结构,因此推测立体中细链条是由单条或多条糖链通过分子间的相互作用力形成的螺旋结构[15]。

a、b-扫描范围为400.0 nm×400.0 nm的平面图、立体图;c、d-扫描范围为4.0 μm×4.0 μm的平面图、立体图
图5 CRWPs原子力显微镜图
Fig.5 AFM image of CRWPs
2.6 发酵益生菌结果分析
2.6.1 OD600值的变化
CRWPs对2株双歧杆菌和2株乳杆菌增殖的影响如图6所示,与空白组相比,CRWPs和菊粉均能显著提高这4株菌的生物量(P<0.05),说明CRWPs能被这4株细菌利用,进而促进这4株菌的生长。其中短双歧杆菌的促生长效果最好,在48 h时OD600值达到了0.697±0.012,此外,CRWPs对短双歧杆菌和动物双歧杆菌的促生长效果比菊粉好,表明了CRWPs具有一定的益生活性。

a-短双歧杆菌(FWX346);b-动物双歧杆菌(ZJTZ1M2);c-鼠李糖乳杆菌(FFJLY7L1);d-干酪乳杆菌(FJSSZ4L6)
图6 不同碳源发酵益生菌后OD600值的变化
Fig.6 Changes in OD600 after prebiotics fermentation with different carbon sources
注:数据以平均值±标准差表示;不同小写字母表示不同碳源间存在显著性差异(P<0.05)(下同)
2.6.2 pH变化、SCFAs和乳酸的产量变化
产酸能力是评价益生元功能的一个重要指标,培养基的pH下降程度可以反映发酵过程中的产酸量[16]。由图7可知,与空白组相比较,菊粉和CRWPs的pH都有所下降,而发酵48 h后,菊粉和CRWPs的pH都有明显降低(P<0.05),结果表明,这4株菌可以利用CRWPs产生有机酸,导致pH值下降。在益生元代谢过程中,SCFAs是主要的最终产物,它不仅反映了被评价的益生菌的增殖活性,还能反映细菌对碳源的利用程度。其中乙酸、丙酸、丁酸是主要的脂肪酸,也是评价益生效应的重要指标[17]。短双歧杆菌的下降幅度最大(P<0.01),由5.850±0.001降到4.780±0.025,且短双歧杆菌的生物量增加幅度最大,这与图8中,CRWPs和菊粉组发酵48 h后的乙酸的含量明显高于空白组(P<0.05)的结果对应,说明CRWPs能促进乙酸的产生从而降低培养基的pH,因此表明在CRWPs为碳源的发酵过程中,短双歧杆菌的产酸能力最强,其中干酪乳杆菌下降幅度较小,表明干酪乳杆菌产酸能力要弱于双歧杆菌。

a-短双歧杆菌(FWX346);b-动物双歧杆菌(ZJTZ1M2);c-鼠李糖乳杆菌(FFJLY7L1);d-干酪乳杆菌(FJSSZ4L6)
图7 不同碳源发酵益生菌后pH的变化
Fig.7 Changes in pH after prebiotics fermentation with different carbon sources
由图8可知,发酵48 h后,CRWPs发酵中动物双歧杆菌、鼠李糖乳杆菌产生的丙酸显著高于其他组(P<0.05)。此外,CRWPs发酵中短双歧杆菌产生的乙酸和丁酸浓度显著高于其他组(P<0.05)。乙酸可被肠壁吸收并通过循环系统转运至靶器官,为脑、肝及周围组织提供能量[18]。丙酸能调节免疫细胞,促进抗菌因子的产生[19]。由图8-c可知,CRWPs为碳源的发酵过程中,鼠李糖乳杆菌有较好的产丁酸能力,丁酸盐作为一种新型分子,具有广泛的与肠道微生物和生理相关的生物学功能,有利于肠道上皮屏障的功能发挥[20-21]。由图8-d可知,CRWPs和菊粉产乳酸量均高于空白组,说明CRWPs可以被这4种益生菌利用产生乳酸,同时乳酸在乳杆菌与病原菌的竞争和排斥中扮演着重要作用[22],其中短双歧杆菌的产乳酸量最多,动物双歧杆菌产乳酸量最低。以上结果表明,CRWPs可以被这4株菌利用,引起细菌生物量的增加,同时显著增加主要代谢产物如SCFAs(乙酸、丙酸和丁酸)和乳酸的产量,并降低培养基的pH。综上所述,CRWPs可以作为益生元改善双歧杆菌和乳杆菌的生长,可能具有良好的益生活性。

a-乙酸含量变化;b-丙酸含量变化;c-丁酸含量变化;d-乳酸含量变化
图8 不同碳源发酵益生菌后SCFAs和乳酸的变化
Fig.8 Changes in SCFAs and lactic acid after prebiotics fermentation with different carbon sources
3 结论
本研究从蒸馏米酒的蒸馏残液中分离纯化出一种分子质量为8 554 Da的多糖CRWPs,其主要是由葡萄糖、半乳糖、甘露糖、葡萄糖醛酸等组成。流变学分析表明CRWPs溶液具有假塑性流体的特征,通过原子力显微镜观察推测该多糖具有多分支的结构。发酵益生菌结果表明CRWPs能够促进短双歧杆菌、动物双歧杆菌、鼠李糖乳杆菌和干酪乳杆菌这4株菌的生长,降低培养基的pH以及增加短链脂肪酸的产生。因此,CRWPs具有成为益生元的潜力,这极大地提高了蒸馏米酒蒸馏残液的利用率,为其在经济型、环境友好型食品行业中的应用奠定了基础。
[1] 温承坤,陈孝,王奕芳,等.米酒功能性成分研究进展[J].中国酿造,2019,38(12):5-8.
WEN C K,CHEN X,WANG Y F,et al.Research progress on functional components of rice wine[J].China Brewing,2019,38(12):5-8.
[2] 张高楠,苏钰亭,赵思明,等.4种甜米酒主要营养成分与滋味特征对比及分析[J].华中农业大学学报,2018,37(2):89-95.
ZHANG G N,SU Y T,ZHAO S M,et al.Analyses of nutritional composition in four kinds of fermented sweet rice wines and sensory evaluation with electronic tongue[J].Journal of Huazhong Agricultural University,2018,37(2):89-95.
[3] 邹凌波,王栋,余海燕,等.基于理化指标和风味成分的酿造米酒分类及其相关特性分析[J].食品与发酵工业,2019,45(13):78-84.
ZOU L B,WANG D,YU H Y,et al.Classification and characteristics of typical fermented Mijiu based on physicochemical parameters and flavor components[J].Food and Fermentation Industries,2019,45(13):78-84.
[4] 邓志辉.蒋巷米酒的快速发酵及其功能性研究[D].南昌:南昌大学,2019.
DENG Z H.Study on the rapid fermentation and function of Jiang Xiang rice wine.[D].Nanchang:Nanchang University,2019.
[5] 王婉君,赵立艳,汤静.新型米酒产品研究与开发进展[J].中国酿造,2018,37(5):1-4.
WANG W J,ZHAO L Y,TANG J.Research and development progress of new type rice wine products[J].China Brewing,2018,37(5):1-4.
[6] ALZORQI I,KETABCHI M R,SUDHEER S,et al.Optimization of ultrasound induced emulsification on the formulation of palm-olein based nanoemulsions for the incorporation of antioxidant β-D-glucan polysaccharides[J].Ultrasonics Sonochemistry,2016,31:71-84.
[7] CHO C W,HAN C J,RHEE Y K,et al.Immunostimulatory effects of polysaccharides isolated from Makgeolli (Traditional Korean rice wine)[J].Molecules,2014,19(4):5 266-5 277.
[8] GULL N B,GULL
N B,GULL N P,TAVARIA F,et al.In vitro assessment of the prebiotic potential of Aloe vera mucilage and its impact on the human microbiota[J].Food Function,2015,6(2):525-531.
N P,TAVARIA F,et al.In vitro assessment of the prebiotic potential of Aloe vera mucilage and its impact on the human microbiota[J].Food Function,2015,6(2):525-531.
[9] CHEN C,HUANG Q,FU X,et al.In vitro fermentation of mulberry fruit polysaccharides by human fecal inocula and impact on microbiota[J].Food &Function,2016,7(11):4 637-4 643.
[10] 刘卫宝,余讯,徐静静,等.黄芪多糖的分离、结构表征及益生活性研究[J].食品与发酵工业,2020,46(7):50-56.
LIU W B,YU X,XU J J,et al.Isolation,structure characterization and prebiotic activity of polysaccharides from Astragalus membranaceus[J].Food and Fermentation Industries,2020,46(7):50-56.
[11] LI C,FU X,HUANG Q,et al.Ultrasonic extraction and structural identification of polysaccharides from Prunella vulgaris and its antioxidant and antiproliferative activities[J].European Food Research and Technology,2015,240(1):49-60.
[12] WANG L,LI C,HUANG Q,et al.In vitro digestibility and prebiotic potential of a novel polysaccharide from Rosa roxburghii Tratt fruit[J].Journal of Functional Foods,2019,52:408-417.
[13] 王银平.玉木耳多糖的制备、结构表征及其与乳清蛋白相互作用研究[D].长春:吉林大学,2020.
WANG Y P.Preparation and structural characterization of polysaccharides from Auricularia cornea Var.Li.and their interactions with whey protein[D].Changchun:Jilin University,2020.
[14] 张子依.紫甘薯多糖的制备及结构初步分析[D].哈尔滨:哈尔滨商业大学,2020.
ZHANG Z Y.Study on preparation and structure of sweet potato polysaccharide[D].Harbin:Harbin University of Commerce,2020.
[15] 张红运,杨立娜,朱丹实,等.基于原子力显微图像和流变学特性的大豆种皮多糖构象分析[J].中国食品学报,2020,20(9):38-46.
ZHANG H Y,YANG L N,ZHU D S,et al.Conformational analysis of polysaccharide from soybean hull based on atomic force microscope and rheological properties[J].Journal of Chinese Institute of Food Science and Technology,2020,20(9):38-46.
[16] CHEN G J,HONG Q Y,JI N,et al.Influences of different drying methods on the structural characteristics and prebiotic activity of polysaccharides from bamboo shoot (Chimonobambusa quadrangularis) residues[J].International Journal of Biological Macromolecules,2020,155(8):674-684.
[17] DEN BESTEN G,VAN EUNEN K,GROEN A K,et al.The role of short-chain fatty acids in the interplay between diet,gut microbiota,and host energy metabolism[J].Journal of Lipid Research,2013,54(9):2 325-2 340.
[18] DI T,CHEN G J,SUN Y,et al.In vitro digestion by saliva,simulated gastric and small intestinal juices and fermentation by human fecal microbiota of sulfated polysaccharides from Gracilaria rubra[J].Journal of Functional Foods,2018,40:18-27.
[19] KOH A,DE VADDER F,KOVATCHEVA-DATCHARY P,et al.From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J].Cell,2016,165(6):1 332-1 345.
[20] WANG R X,LEE J S,CAMPBELL E L,et al.Microbiota-derived butyrate dynamically regulates intestinal homeostasis through regulation of actin-associated protein synaptopodin[J].Proceedings of the National Academy of Sciences of the United States of America,2020,117(21):11 648-11 657.
[21] MAKKI K,DEEHAN E C,WALTER J,et al.The impact of dietary fiber on gut microbiota in host health and disease [J].Cell Host &Microbe,2018,23(6):705-715.
[22] 赵晓雨,李梦,唐金秀,等.乳酸菌在抗病原微生物感染中的作用[J].微生物学杂志,2018,38(6):107-113.
ZHAO X Y,LI M,TANG J X,et al.The role of lactic acid bacteria in anti-pathogenic microorganism infection[J].Journal of Microbiology,2018,38(6):107-113.