高尿酸血症(hyperuricemia,HUA)是嘌呤代谢紊乱或尿酸排泄减少所致的一种代谢性疾病[1],我国高尿酸血症呈现高流行、年轻化、男性高于女性、沿海高于内地的趋势。据估算,全国患尿酸血症的人数达1.2亿,我国高尿酸血症的患病率已经高于糖尿病[2],已成为继高血压、高血糖、高血脂之后的第四大健康风险因素[3]。目前降尿酸药大致分为两类,一类是促进尿酸排泄药物(丙磺舒、苯溴马隆等),一类是减少尿酸合成药物(别嘌呤醇、非布司他等)[4],其中别嘌呤醇是经典的降尿酸药物,其治疗靶点为黄嘌呤氧化酶(xanthine oxidase,XO),但这些药物都有一定副作用,如皮疹、肾损害、心血管损害[5]等。近年来,食源性降尿酸活性肽逐渐成为研究热点,其降尿酸机制的研究多集中在抑制XO活性。
XO是嘌呤代谢的关键酶[6],能催化黄嘌呤或次黄嘌呤氧化为尿酸,在高尿酸血症的发展中起着至关重要的作用,从而可以通过抑制XO活性,降低尿酸的产生[7]。目前对食源性降尿酸物质的研究多集中在抑制XO活性,具有降尿酸活性的物质与XO相互作用,从而改变XO的二级结构,使酶的活性降低或使酶失活[8]。前人研究结果表明,食物来源的小分子肽[9]、黄酮类化合物[10]、多糖[11]等生物活性物质具有较强的降尿酸活性,小分子肽因其活性高、稳定性好、特异性强等优点[12],而受到人们高度关注。目前已从金枪鱼[13]、鲣鱼[14]、罗非鱼皮[15]、鲨鱼软骨[16]、核桃粉[17]、大米[9]、牛奶[3]等多种材料中分离到多种具有降尿酸功效的活性肽。
远东拟沙丁鱼(Sardinops sagax)又名斑点莎脑鱼,主要分布于太平洋、大西洋东部海域以及我国的黄海海域,具有营养丰富、价格低廉、生长快、繁殖力强等优点[18-19]。远东拟沙丁鱼富含多不饱和脂肪酸二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexenoic acid,DHA),鱼肉氨基酸组成广泛,具有人类营养和维持健康必需的优良蛋白质。据报道,远东拟沙丁鱼蛋白肽具有降血压、抗氧化、促进细胞修复、抑制血管紧张素转换酶等多种生物活性,是制备生物活性肽的优质原料[19-20]。本文以远东拟沙丁鱼为原料,采用碱性蛋白酶水解远东拟沙丁鱼肉,通过膜分离与色谱相结合分离纯化XO抑制肽,并以高尿酸细胞模型来评价XO抑制肽的降尿酸活性,为远东拟沙丁鱼的高值化利用提供科学依据。
1 材料与方法
1.1 材料与试剂
远东拟沙丁鱼,广东兴亿海洋生物工程有限公司;碱性蛋白酶:2×105 u/g,南宁庞博生物工程有限公司;氢氧化钠、磷酸二氢钠、磷酸氢二钠,均为分析纯,西陇科学股份有限公司;XO、黄嘌呤、别嘌呤醇、乙腈,均为色谱纯,美国Sigma公司;HK-2细胞,上海富衡生物科技有限公司;DMEM/F12培养基,PBS,0.25%胰蛋白酶,美国Gibco公司;胎牛血清,美国ZETA LIFE公司;戊烷磺酸钠、次黄嘌呤、腺苷、肌苷、尿酸,均为色谱纯,葡聚糖凝胶G-15,上海源叶生物科技有限公司;尿酸试剂盒,南京建成生物工程研究所有限公司;Casp-1、GSDMD、NLRP3、IL-1β ELISA试剂盒,江苏酶免生物技术有限公司。
1.2 仪器与设备
数显高速分散均质机,德国IKA公司;台式高速冷冻离心机,美国Sigma公司;Lynx6000落地高速冷冻离心机,美国Thermo Fisher公司;SHZ-C水浴恒温振荡器,上海博讯医疗生物仪器股份有限公司;陶瓷膜分离设备、卷式超滤膜设备,杭州沃腾膜工程有限公司;CA-2610旋转蒸发仪,日本EYELA公司;FDU-1100真空冷冻干燥机,日本EYELA公司;全自动酶标仪Varioskan,美国Thermo Fisher公司;1200高效液相色谱仪、超高效液相四级杆飞行时间串联质谱仪,美国Waters公司。
1.3 实验方法
1.3.1 酶解液的制备
将远东拟沙丁鱼鱼肉以料液比1∶2(质量比)加入蒸馏水,匀浆后,将pH调至9,以0.15(碱性蛋白酶)∶100(鱼肉)(质量比)加入碱性蛋白酶,在60 ℃下恒温水浴振荡酶解4 h,随后在沸水中灭酶15 min,冷却后以8 000 r/min、4 ℃离心20 min,取上清液进行陶瓷膜分离,除去悬浮物和大分子物质,即得到酶解液。
1.3.2 远东拟沙丁鱼酶解液的超滤分离
将酶解液依次通过截留分子质量为10、5、1 kDa的超滤膜进行超滤分为4个组分:>10 kDa、10~5 kDa、5~1 kDa、<1 kDa,分别测定其XO抑制率。
1.3.3 凝胶色谱分离
从4个超滤组分选择其中XO抑制率最高的组分进行凝胶色谱分离,检测214 nm处的波长,普通玻璃层析柱26 mm×100 cm,G-15凝胶高度为85 cm,确定最佳条件为:上样量8 mL,上样质量浓度20 g/L,流速为1.1 mL/min。收集并浓缩各洗脱峰,测出XO抑制率(根据1.2.3中的方法),活性最高的组分继续用反相液相色谱进行纯化分离。
1.3.4 反相高效液相色谱(reversed phase high performance liquid chromatography,RP-HPLC)分离
色谱柱:Phenomenex Synergi 4 μm Hydro-RP(150 mm×10 mm),流动相A:含0.1%三氟乙酸的超纯水,流动相B:含0.1%三氟乙酸的乙腈(色谱纯),在25 min内进行梯度洗脱。进样量50 μL,进样质量浓度2 g/L,流速2 mL/min,柱温30 ℃,检测波长为214 nm,多次重复进样收集各洗脱峰,旋转蒸发浓缩后调至一致浓度测XO抑制率。
1.3.5 超高效液相串联四级杆飞行时间质谱(ultra-high performance liquid chromatography quadrupole time of flight tandem mass spectrometry,UPLC-MS/MS)鉴定
将样品用去离子水稀释至50 μg/mL。进样条件:进样量20 μL,流速10 μL/min;离子源条件:毛细管电压3.0 k,锥孔电压40 V,偏差控制80,正离子模式,喷雾温度400 ℃,二级质谱电压源25.0 kV。
1.3.6 XO抑制率的测定
于96孔板中每孔加入50 μL待测样品及50 μL浓度为0.05 U/mL的XO溶液,振荡30 s,于25 ℃条件下保温5 min,再加入150 μL 0.48 mmol/L的黄嘌呤溶液,振荡30 s后,于25 ℃条件下保温25 min,测定290 nm处的吸光度值[14]。XO抑制率的计算如公式(1)所示:
XO抑制率![]()
(1)
式中:D1,加酶样品溶液的吸光度值;D2,不加酶样品溶液的吸光度值;D3,用缓冲液代替样品溶液的空白组的吸光度值;D4,不加酶空白组的吸光度值。
1.3.7 细胞实验
1.3.7.1 细胞培养
HK-2细胞从-80 ℃冰箱取出后,立即放入37 ℃水浴锅中解冻,移入盛有1 mL完全培养基[DMEM/F12+10%(体积分数)胎牛血清+1%(体积分数)双抗]的15 mL离心管中,在1 000 r/min、4 ℃下离心5 min,弃去上清液,加入1 mL完全培养基重新悬浮细胞,随后移入25 cm培养瓶,再加入4 mL完全培养基,将细胞吹打均匀,放入含5% CO2、37 ℃培养箱中,每48 h换1次培养基。
1.3.7.2 反相液相法检测细胞上清液中尿酸及其前体物质的含量
取细胞上清液,过0.22 μm滤膜,使用Waters Symmetry C18(5 μm,4.6 mm×250 mm)色谱柱进行分析,流动相A:0.2 mol/L KH2PO4、0.52 mmol/L戊烷磺酸钠;流动相B:0.2 mol/L KH2PO4、0.52 mmol/L戊烷磺酸钠、10%乙腈;在50 min内梯度洗脱,检测波长254 nm,柱温30 ℃,进样量20 μL,流速0.8 mL/min。
1.3.7.3 高尿酸模型的建立
将细胞于2×105 cell/mL接种于6孔板,培养24 h,弃去培养基,用PBS清洗3次,加入含1 mmol/L腺苷的基础培养基培养24 h,再0.05 U/mL XO培养2 h,取上清液检测。
1.3.7.4 苯丙氨酸-亮氨酸-精氨酸(Phe-Leu-Arg,FLR)与精氨酸-脯氨酸-赖氨酸(Arg-Pro-Lys,RPK)对高尿酸细胞的降尿酸作用
实验分为9组:空白组、模型组、FLR高剂量组、FLR中剂量组、FLR低剂量组、RPK高剂量组、RPK中剂量组、RPK低剂量组、阳性组(别嘌呤醇组)。将细胞以2×105 cell/mL接种于6孔板,培养至贴壁稳定后,第一步空白组、模型组加入完全培养基,阳性组加入含0.1 mmol/L别嘌呤醇的完全培养基,样品组(肽组)分别加入含高(2 mmol/L)、中(1 mmol/L)、低(0.5 mmol/L)3种浓度的肽溶液完全培养基,培养24 h,弃去培养液,PBS清洗3次,第二步空白组加入完全培养基,其余8组加入含2.0 mmol/L腺苷的基础培养基培养24 h,再加入0.05 U/mol XO培养2 h,取上清液测定尿酸含量。
1.3.7.5 细胞毒性实验
将细胞以1×105 cell/mL接种于96孔板,培养24 h待细胞贴壁后,加入不同浓度多肽培养24 h,再加入10 μL CCK8溶液培养1 h,测450 nm处吸光度,细胞存活率的计算如公式(2)所示:
细胞存活率![]()
(2)
式中:A样,加入多肽的吸光度;A空,不加多肽的吸光度。
1.3.7.6 细胞凋亡实验
提取细胞总蛋白,提取方法:弃去上清液,用预冷PBS清洗3次,每孔加入200 μL细胞裂解液,用细胞刮快速将细胞刮下来,移入1.5 mL PE管中,置于冰上裂解30~40 min,裂解中途用旋涡振荡器振荡1~2次,每次5~10 s,使细胞充分裂解,以12 000 r/min、15 min离心,小心取上清液检测。凋亡相关指标Casp-1、GSDMD、IL-1β、NLRP3的含量根据ELISA试剂盒说明(江苏酶免生物技术有限公司的ELISA试剂盒),按步骤操作。其原理是利用抗原抗体之间专一性结合的特征,对样本进行定量检测。
1.3.7.7 统计分析
数据处理采用Graphpad prism统计软件,进行单因素方差分析(One-Way ANOVA),P<0.05表示差异显著。所有试验均重复3次,结果用平均值±标准差表示。
2 结果与分析
2.1 超滤组分的XO抑制活性
据文献报道,多肽活性与分子质量大小紧密相关,XO抑制肽通常为2~10个氨基酸组成,且分子质量<1 kDa的肽[21]。盛周煌[15]利用5 kDa和3 kDa的超滤膜对罗非鱼皮胶原蛋白酶解液进行分离,收集到3个组分:>5 kDa、5~3 kDa、<3 kDa,发现<3 kDa组分的XO抑制率最佳。远东拟沙丁鱼酶解液经过超滤膜分离获得4个组分,即>10 kDa、10~5 kDa、5~1 kDa、<1 kDa,XO抑制活性的IC50值分别为62.51、51.06、45.65、15.89 g/L;因此,选择<1 kDa XO抑制活性最强组分进行进一步谱分离纯化。HE等[13]从鲣鱼酶解物中分离鉴定出13种具有XO抑制活性的二肽和三肽。MUROTA等[16]发现鲨鱼软骨水提物中分子质量为686.64 Da的五肽YLDNY,口服和静脉注射均显示出显著的降尿酸活性。本研究结果与其上述文献报道的结果一致,小分子肽的XO抑制活性更强。
2.2 凝胶、高效液相色谱分离
通过超滤得到的<1 kDa的组分经G-15葡聚凝胶进行分离,结果如图1-a所示,凝胶色谱分离出5个洗脱峰,分别标记为F1、F2、F3、F4、F5,将F1~F5分别收集,通过旋转蒸发浓缩,调至同一浓度后测定其XO抑制率,组分F2的抑制活性最高,IC50值为6.099 g/L,与<1 kDa组分相比,XO抑制活性提高了2.6倍。邹琳等[14]将鲣鱼酶解液经膜分离纯化后,分子质量在600~1 000 Da的组分XO抑制活性最高,其IC50值为9.18 g/L。因此选择组分F2继续进行RP-HPLC分离。
凝胶组分F2经过RP-HPLC分离,结果如图1-b所示,主要收集到6个吸收峰,标记为F2-1、F2-2、F2-3、F2-4、F2-5、F2-6,把6个组分收集浓缩,测得XO抑制率,结果显示,组分F2-1的抑制活性最高,IC50值为0.499 g/L;组分F2-4抑制活性次之,IC50值为0.712 g/L。并且F2-1和F2-4的峰面积占6个组分的70.62%,为凝胶组分F2的主要成分。MUROTA等[16]通过RP-HPLC对鲨鱼软骨碱性蛋白酶消化液进行分离纯化,收集具有大吸收峰的组分进行下一步质谱鉴定。因此选择组分F2-1、F2-4进行UPLC-MS/MS结构鉴定。
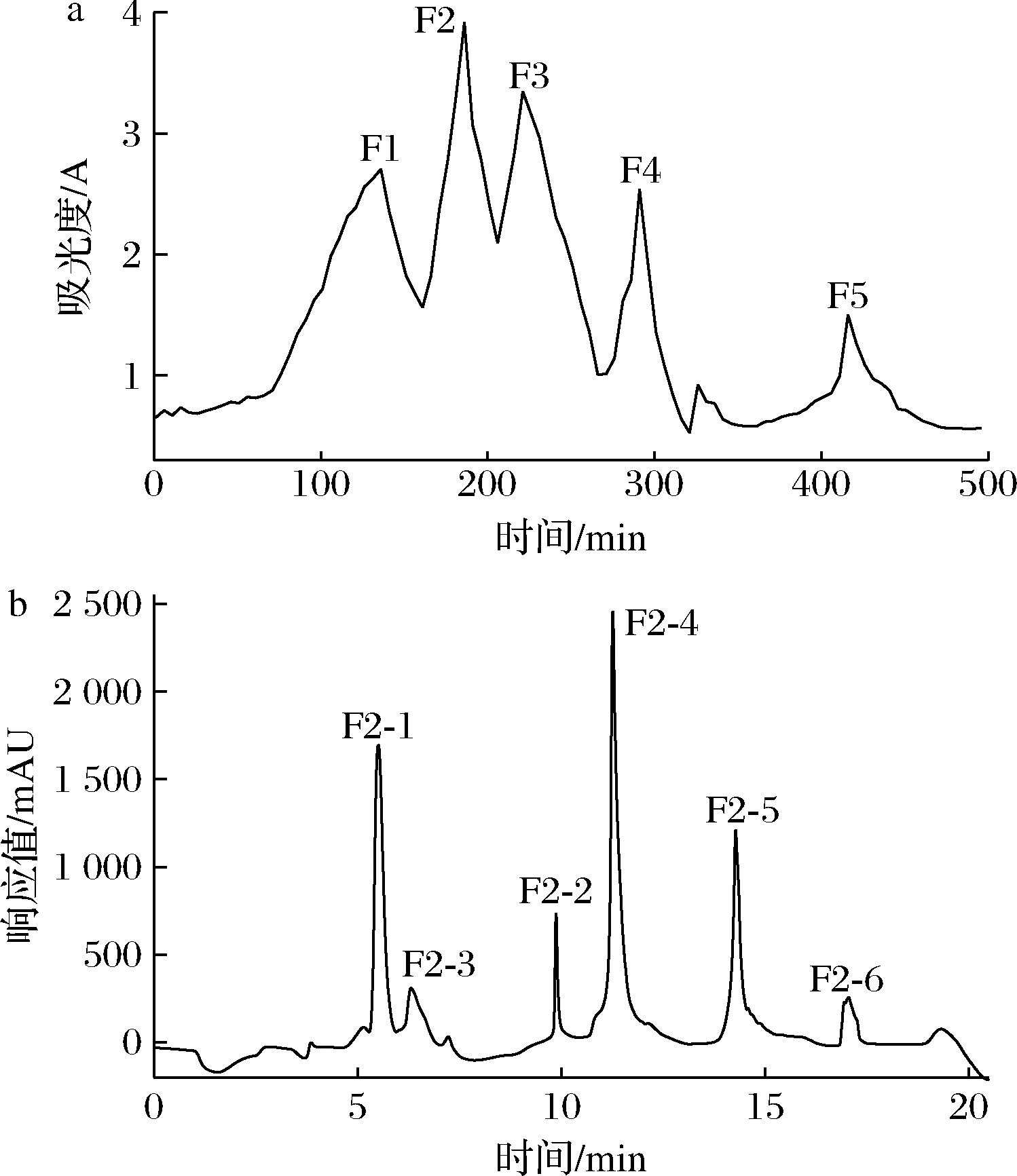
a-凝胶过滤分离色谱图;b-反相高效液相分离色谱图
图1 <1 kDa组分的色谱分离图
Fig.1 Chromatogram of component less than 1 kDa
2.3 氨基酸序列鉴定
质谱鉴定主要根据一级质谱中信号峰的相对丰度或者信号峰的质荷比选择母离子进行二级质谱分析,母离子通常为相对丰度最大或质荷比值最高的信号峰。将组分F2-1和F2-4用UPLC-MS/MS进行分析,结果如图2、图3所示,组分F2-1的一级质谱图如图2-a所示,质荷比(m/z)为435.28的峰对应母离子[M+H]+的信号,随后选择丰度最高的母离子[M+H]+(m/z=435.28)进行二级质谱分析。组分F2-4的一级质谱图如图3-a所示,选择质荷比最大(m/z=400.21)的信号峰作为母离子进行二级质谱分析。

a-组分F2-1一级质谱图;b-组分F2-1二级质谱图
图2 F2-1质谱鉴定图
Fig.2 Mass spectrum of F2-1
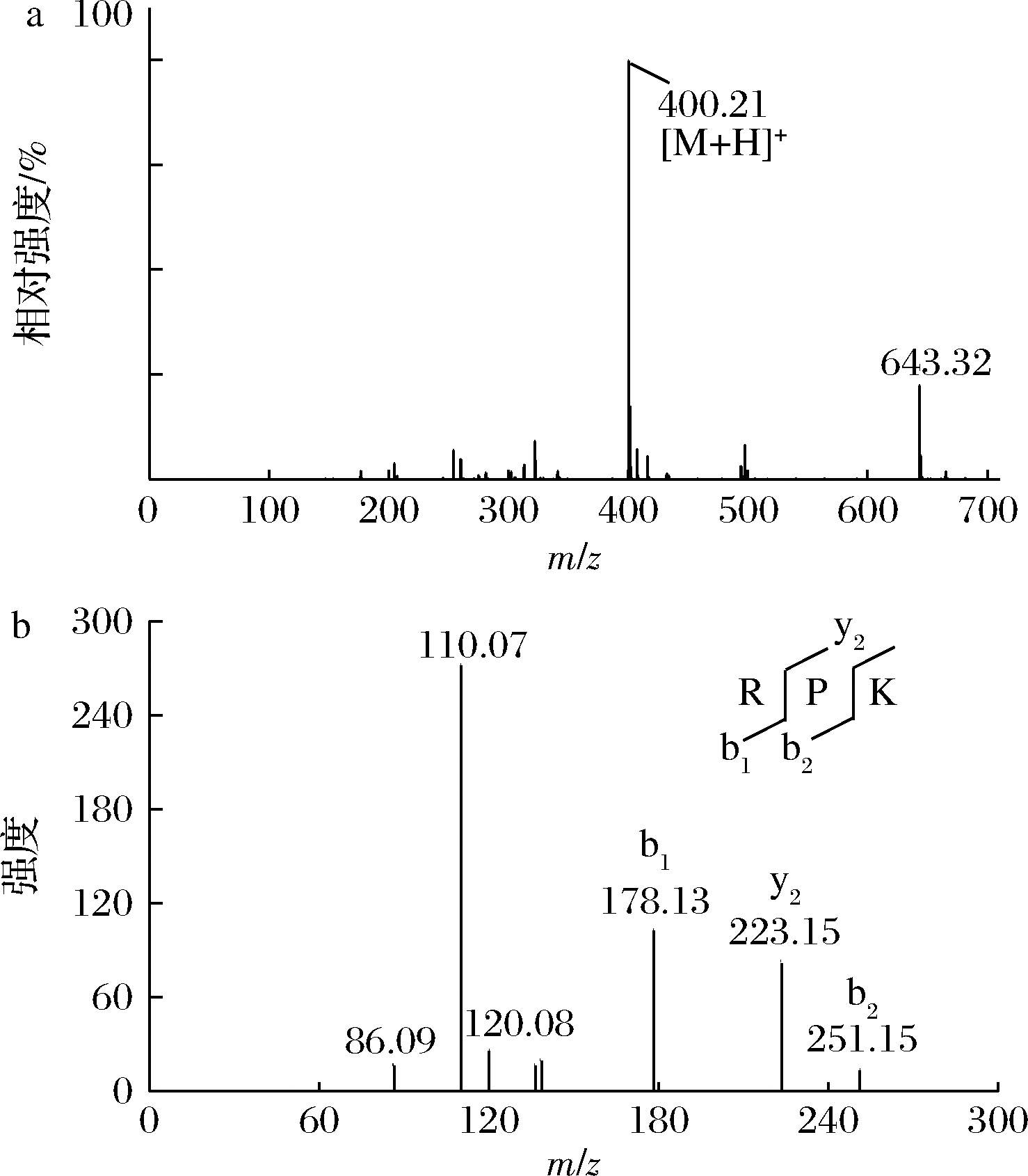
a-组分F2-4一级质谱图;b-组分F2-4二级质谱图
图3 F2-4质谱鉴定图
Fig.3 Mass spectrum of F2-4
在串联质谱中,主要通过二级质谱中的碎片离子来推测氨基酸序列,碎片离子主要分为C-端(由x、y、z代表)和N-端(由a、b、c代表)[22]。多肽链中酰胺键更容易断裂,所以更大几率出现b型和y型的离子[23]。由此来推测母离子[M+H]+(m/z=435.28)和母离子[M+H]+(m/z=400.21)的氨基酸序列。如图2-b所示,碎片离子y1的m/z=175.118 8,对应片段-Arg的相对分子质量,碎片离子y2的m/z=271.177 3,对应片段-Leu-Arg的相对分子质量,碎片离子b1的m/z=166.08,对应为Phe-的相对分子质量,所以鉴定其氨基酸序列为苯丙氨酸-亮氨酸-精氨酸(Phe-Leu-Arg(FLR),Mw=435.2U)。同理,如图3-b所示,碎片离子b1的m/z=178.134 1,对应片段Arg-的相对分子质量,碎片离子b2的m/z=251.150 8,对应片段Arg-Pro-的相对分子质量,碎片离子y2的m/z=223.155 7,对应片段-Pro-Lys的相对分子质量,所以鉴定其氨基酸序列为精氨酸-脯氨酸-赖氨酸(Arg-Pro-Lys(RPK),Mw=400.21 U)。LI等[8]从金枪鱼鱼水解物中提取鉴定出三肽WML,具有较高的XO活性,通过分子对接发现主要是其中的疏水氨基酸进入XO活性中心的疏水区,从而抑制XO的活性。MUROTA等[16]鉴定出具有XO抑制活性的13个二肽和三肽均含芳香族氨基酸:酪氨酸、苯丙氨酸、色氨酸,其中苯丙氨酸、色氨酸均为疏水氨基酸,而酪氨酸与苯丙氨酸结构相似。本研究与其他研究者结果一致,鉴定出的2个三肽均含疏水氨基酸,其中FLR含苯丙氨酸、亮氨酸,RPK含脯氨酸。
2.4 细胞毒性实验
收集鉴定出的2个三肽,需确定它们的安全无毒性,如果对细胞有毒副作用,使用后影响细胞正常生长,便失去了小分子活性肽无毒、易吸收等优点的意义,则不能继续使用。由图4可知,经过不同浓度肽、阳性药物处理的细胞存活率无显著性差异,说明在一定的浓度范围内给药对HK-2无明显细胞毒性,不影响细胞活力,后续实验在此浓度下进行无药物毒性影响。
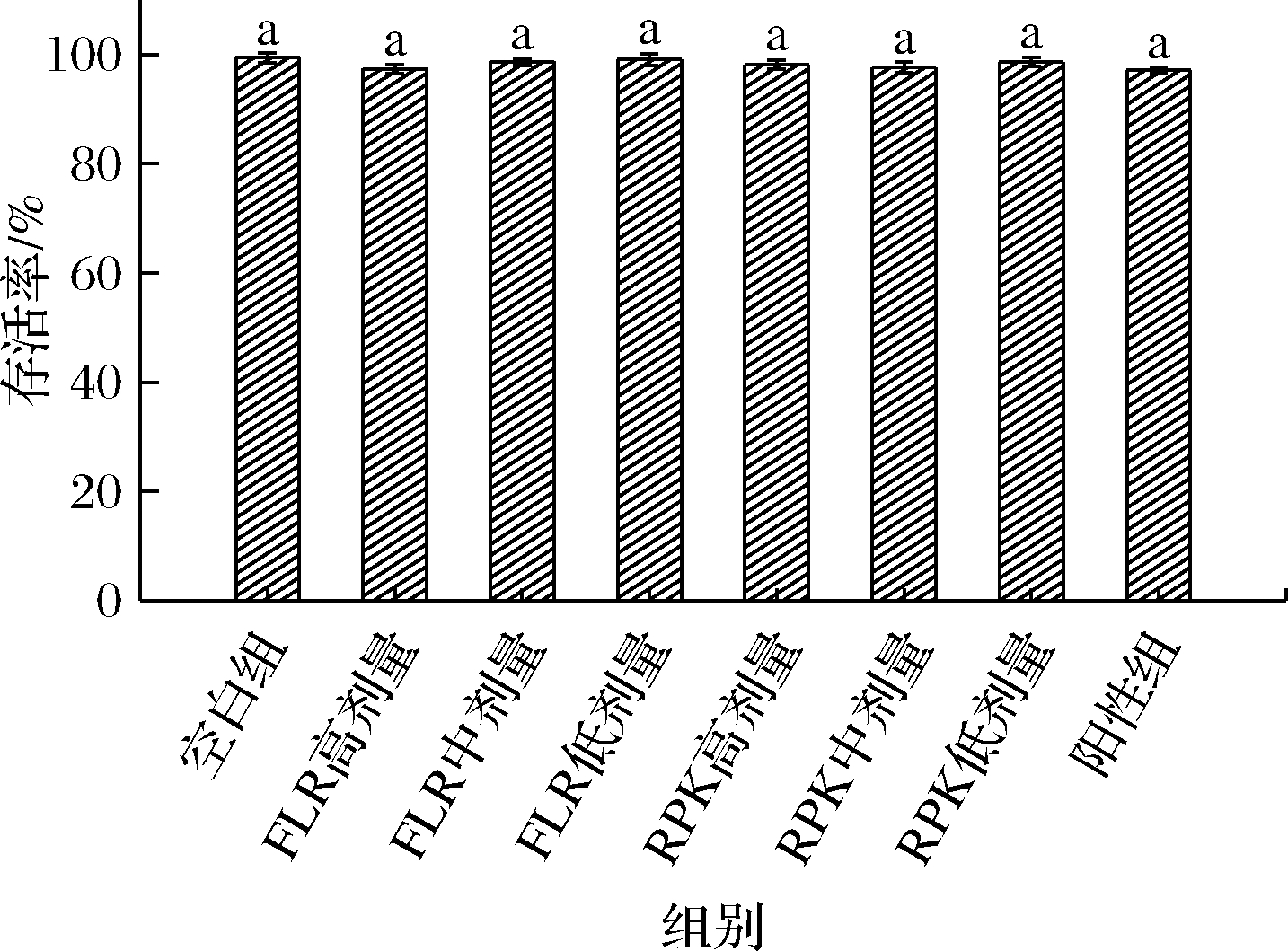
图4 不同浓度肽对细胞存活率的影响
Fig.4 Effects of different concentration peptides on cell survival
注:未使用同一字母连接的水平存在显著差异(P<0.05)(下同)
2.5 FLR、RPK对细胞上清液中尿酸及其前体物质水平的影响
目前,对高尿酸细胞模型的研究中,通过添加尿酸前体物很难构建高尿酸细胞模型,需另添加外源酶催化前体物以显著增加尿酸含量。HOU等[24]通过单因素试验,筛选用于构建高尿酸细胞模型的物质,最终采用腺苷和XO联合构建高尿酸细胞模型,显著增加尿酸及其前体物质含量。李宁娟[25]同样通过外源性XO结合腺苷构建高尿酸细胞模型,检测得细胞上清液尿酸水平为(1.52±0.02) mmol/L,达到高尿酸血症患者的尿酸水平。图5-a为细胞上清液中嘌呤相关物质的标准品图,对应图5-c中正常细胞上清液中尿酸及次黄嘌呤的含量,通过腺苷和XO联合造模后,根据图5-d可以看出尿酸和次黄嘌呤的含量明显增加,上清液中尿酸水平为735.92 μmol/L,达到高尿酸血症患者的尿酸水平,并且出现了通过XO催化次黄嘌呤产生的黄嘌呤,说明造模成功。图5-b显示,样品组(肽组)尿酸含量显著低于模型组,其中FLR和RPK的中、低剂量组降尿酸效果均优于其高剂量组,并且FLR低剂量组的尿酸含量显著低于空白组,与别嘌呤醇的降尿酸效果无显著性差异,显示出优越的降尿酸活性。说明FLR、RPK的降尿酸效果无剂量依赖性。

a-尿酸及其前体物标准品色谱图;b-各组尿酸含量;c-正常细胞上清液尿酸及其前体物含量;d-模型组细胞上清液尿酸及其前体物含量
图5 细胞上清液中嘌呤相关物质含量
Fig.5 Purine related substances in cell supernatant
2.6 细胞凋亡情况
高尿酸血症往往伴随着炎症的发生,是由于高尿酸导致炎症体Caspase-1/4/5/11的激活,切割一个叫做GSDMD的蛋白而诱发细胞凋亡(细胞膜破裂),从而释放大量炎性因子(IL-18、IL-1β、NLRP3等)[26],造成炎症。由图6-a可知,模型组Caspase-1含量显著高于其他组,其中FLR高、中、低剂量组、RPK低剂量组Caspase-1含量无显著性差异,RPK高剂量组Caspase-1含量显著高于中剂量组,中剂量组显著高于低剂量组,阳性组Caspase-1含量显著低于肽组,说明FLR、RPK各浓度均能显著降低Caspase-1含量,但RPK高、中剂量组效果没有低剂量组效果好。由图6-b可知,模型组和RPK高剂量组的GSDMD含量显著高于其他组,RPK高剂量组不能显著降低GSDMD含量,说明FLR高、中、低剂量、RPK中、低剂量均能显著降低GSDMD含量,降低效果与阳性药物无显著性差异。由图6-c可知,模型组IL-1β含量显著高于其他组,其中FLR中、低剂量组、RPK低剂量组、阳性组IL-1β含量显著低于FLR高剂量组、RPK高、中剂量组、空白组,说明FLR、RPK各浓度、阳性药物均能显著降低(P<0.05)IL-1β含量,其中FLR高剂量、RPK高、中剂量能将IL-1β含量降低至空白组水平,FLR中、低剂量、RPK低剂量、阳性药物能将IL-1β含量降低至空白组水平以下。由图6-d可知,模型组NLRP3含量显著高于其他组,FLR高、中、低剂量组中NLRP3含量显著低于空白组,其中FLR高、中剂量优于低剂量,RPK高剂量组NLRP3含量显著低于模型组,但显著高于空白组,RPK中剂量组NLRP3含量与空白组无显著性差异,RPK低剂量组NLRP3含量显著低于空白组,说明FLR高、中剂量组降低NLRP3含量效果最优,其次依次是RPK低剂量组、FLR低剂量组、阳性组、RPK中剂量组,RPK高剂量组不能将NLRP3含量将至空白组水平。FLR、RPK对细胞凋亡相关蛋白均有抑制作用,各剂量的抑制效果有或多或少的差异,总的来说低剂量组优于中、高剂量组。

a-Casp-1的含量;b-GSDMD的含量;c-IL-1β的含量;d-NLRP3的含量
图6 FLR、RPK对细胞凋亡相关指标的影响
Fig.6 Effects of FLR and RPK on related apoptosis indexes
3 结论
远东拟沙丁鱼肉加入碱性蛋白酶酶解,酶解液中XO抑制肽主要分布在分子质量<1 000 Da的超滤组分中;通过凝胶色谱分离、反相高效液相分离对分子质量<1 000 Da的超滤组分进行分离纯化,UPLC-MS/MS进行氨基酸序列鉴定,得到两个XO抑制肽,一个为FLR,分子质量435.28 Da,IC50值为0.499 g/L;另一个为RPK,分子质量400.21 Da,IC50值为0.712 g/L,与<1 000 Da的超滤组分相比,IC50值提高了20~30倍。通过高尿酸细胞模型进一步验证了FLR、RPK具有显著降尿酸活性,检测胞浆内炎症小体、炎症因子的水平,结果显示FLR、RPK具有改善炎症的作用。
本实验研究结果为远东拟沙丁鱼的高值化利用提供理论依据,同时也为食源性降尿酸肽的开发提供研究基础。但本实验仅对远东拟沙丁鱼XO抑制肽的体外活性进行评价,下一步应进行动物实验以评价XO抑制肽的体内降尿酸活性。
[1] CHEN Y E,LI C T,DUAN S N,et al.Curcumin attenuates potassium oxonate-induced hyperuricemia and kidney inflammation in mice[J].Biomedicine &Pharmacotherapy,2019,118:109195.
[2] 王旭,罗冬平,茹彦海,等.从慢性肾脏病角度看高尿酸血症与痛风的指南更新要点[J].中国全科医学,2021,24(33):4 191-4 195.
WANG X,LUO D P,RU Y H,et al.Interpretation of the major updates of guidelines regarding hyperuricemia and gout in chronic kidney disease[J].Chinese General Practice,2021,24(33):4 191-4 195.
[3] 骆贤亮,刘滔,钱忠英,等..降尿酸肽对高尿酸血症的作用及研究进展[J].食品科学,2021,42(5):340-348.
LUO X L,LIU T,QIAN Z Y,et al.Recent progress in research on hyperuricemia and uric acid-lowering peptides[J].Food Science,2021,42(5):340-348.
[4] ZHU C,XU Y,LIU Z H,et al.The anti-hyperuricemic effect of epigallocatechin-3-gallate (EGCG) on hyperuricemic mice[J].Biomedicine &Pharmacotherapy,2018,97:168-173.
[5] KONG L D,CAI Y,HUANG W W,et al.Inhibition of xanthine oxidase by some Chinese medicinal plants used to treat gout[J].Journal of Ethnopharmacology,2000,73(1-2):199-207.
[6] CHEN R J,CHEN M H,CHEN Y L,et al.Evaluating the urate-lowering effects of different microbial fermented extracts in hyperuricemic models accompanied with a safety study[J].Journal of Food and Drug Analysis,2017,25(3):597-606.
[7] OSADA Y,TSUCHIMOTO M,FUKUSHIMA H,et al.Hypouricemic effect of the novel xanthine oxidase inhibitor,TEI-6720,in rodents[J].European Journal of Pharmacology,1993,241(2-3):183-188.
[8] LI Y J,KANG X Y,LI Q Y,et al.Anti-hyperuricemic peptides derived from bonito hydrolysates based on in vivo hyperuricemic model and in vitro xanthine oxidase inhibitory activity[J].Peptides,2018,107:45-53.
[9] LIU N X,WANG Y,ZENG L,et al.RDP3,a novel antigout peptide derived from water extract of rice[J].Journal of Agricultural and Food Chemistry,2020,68(27):7 143-7 151.
[10] COS P,YING L,CALOMME M,et al.Structure-activity relationship and classification of flavonoids as inhibitors of xanthine oxidase and superoxide scavengers[J].Journal of Natural Products,1998,61(1):71-76.
[11] YANG Q X,WANG Q L,DENG W W,et al.Anti-hyperuricemic and anti-gouty arthritis activities of polysaccharide purified from Lonicera japonica in model rats[J].International Journal of Biological Macromolecules,2019,123:801-809.
[12] 吴远彩,李日美,申光荣,等.小肽对凡纳滨对虾生长、抗氧化能力、非特异性免疫及肠道菌群结构的影响[J].广东海洋大学学报,2021,41(5):1-9.
WU Y C,LI R M,SHEN G R,et al.Effects of dietary small peptides on growth,antioxidant capacity,nonspecific immunity and ingut microflora structure of Litopenaeus vannamei[J].Journal of Guangdong Ocean University,2021,41(5):1-9.
[13] HE W W,SU G W,SUN-WATERHOUSE D,et al.In vivo anti-hyperuricemic and xanthine oxidase inhibitory properties of tuna protein hydrolysates and its isolated fractions[J].Food Chemistry,2019,272:453-461.
[14] 邹琳,杭妙佳,李阳,等.鲣鱼黄嘌呤氧化酶抑制肽酶法制备工艺优化[J].浙江大学学报(农业与生命科学版),2019,45(5):550-562.
ZOU L,HANG M J,LI Y,et al.Optimization of enzymatic hydrolysis process for preparing xanthine oxidase inhibitory peptides from skipjack tuna[J].Journal of Zhejiang University(Agriculture and Life Sciences),2019,45(5):550-562.
[15] 盛周煌.罗非鱼皮胶原蛋白降尿酸活性肽的研究[D].广州:华南理工大学,2018.
SHENG Z H.Study on uric acid-reducing peptide of tilapia skin collagen[D].Guangzhou:South China University of Technology,2018.
[16] MUROTA I,TAGUCHI S,SATO N,et al.Identification of antihyperuricemic peptides in the proteolytic digest of shark cartilage water extract using in vivo activity-guided fractionation[J].Journal of Agricultural and Food Chemistry,2014,62(11):2 392-2 397.
[17] LI Q Y,KANG X Y,SHI C C,et al.Moderation of hyperuricemia in rats via consuming walnut protein hydrolysate diet and identification of new antihyperuricemic peptides[J].Food &Function,2018,9(1):107-116.
[18] BALDWIN C C.Fao species identification guide for fishery purposes.the living marine resources of the western central Pacific[J].Copeia,2003(1):212-214.
[19] 袁学文,王炎冰.远东拟沙丁鱼低聚肽化学组成及其增强免疫力功能评价[J].食品与发酵工业,2018,44(4):104-110.
YUAN X W,WANG Y B.Chemical composition of oligopeptide from Sardinops sagax and its immunoregulatory activity evaluation[J].Food and Fermentation Industries,2018,44(4):104-110.
[20] 李亚会,李积华,吉宏武,等.远东拟沙丁鱼抗氧化肽的分离纯化及结构解析[J].中国食品学报,2021,21(2):229-238.
LI Y H,LI J H,JI H W,et al.Isolation,purification and structural analysis of antioxidant peptides from Sardinops sagax[J].Journal of Chinese Institute of Food Science and Technology,2021,21(2):229-238.
[21] LIU N X,WANG Y,YANG M F,et al.New rice-derived short peptide potently alleviated hyperuricemia induced by potassium oxonate in rats[J].Journal of Agricultural and Food Chemistry,2019,67(1):220-228.
[22] SMITH J B,THÉVENON-EMERIC G,SMITH D L,et al.Elucidation of the primary structures of proteins by mass spectrometry[J].Analytical Biochemistry,1991,193(1):118-124.
[23] CRAIG A G,KOERBER S C,RIVIER J E,et al.A strategy to assign a series of fragment ions:Investigation of fragment ions involving peptide side chain and backbone cleavage[J].International Journal of Mass Spectrometry and Ion Processes,1993,126:137-149.
[24] HOU C L,LIU D,WANG M,et al.Novel xanthine oxidase-based cell model using HK-2 cell for screening antihyperuricemic functional compounds[J].Free Radical Biology and Medicine,2019,136:135-145.
[25] 李宇娟.鲣鱼降尿酸肽的制备分离、结构表征及功效机制研究[D].广州:华南理工大学,2019.
LI Y J.Preparation,isolation,structural characterization,and the effect mechanism of uric acid-lowering peptides derived from bonito[D].Guangzhou:South China University of Technology,2019.
[26] KUMAR A,SHALMANOVA L,HAMMAD A,et al.Induction of IL-8(CXCL8) and MCP-1(CCL2) with oxidative stress and its inhibition with N-acetyl cysteine (NAC) in cell culture model using HK-2 cell[J].Transplant Immunology,2016,35:40-46.