海带含有丰富的化学成分和生物活性物质,已被用于食品、饲料和药物前体等许多工业领域[1-2]。研究表明,海带中含有十分丰富的褐藻多糖,褐藻多糖又分为褐藻胶、褐藻淀粉与褐藻糖胶3种物质[3],其中褐藻胶占比为15%~25%,在功能性食品与部分药品的再加工过程中的应用价值非常高[4-5]。此外海带还含有丰富的褐藻酸、维生素、矿物质和多种微量元素,并因含有游离的谷氨酸而带有十分丰富的鲜味[6]。目前我国海带的培育技术已十分成熟,但海带加工利用却仍处于初级阶段,产品主要是盐渍海带、淡干海带和即食调味海带[7],创新性发展海带深加工产业、研发健康营养的海带加工制品,符合我国2030健康中国战略需求,同时可增加海带附加值,促进海带产业链可持续发展。
西南地区素有食用发酵食品的传统,蕴含着丰富的益生菌资源[8],但西南地区目前益生菌资源家底不清,挖掘与基础特性研究不足,已经成为制约西南地区发酵食品产业发展瓶颈。发酵食品的风味是影响产品感官品质和消费者接受度的重要因素,西南地区传统泡菜的愉悦风味来自于异型乳酸菌发酵和同型乳酸菌发酵[9],在发酵初期,异型乳酸菌迅速产生大量的乙酸、乙醇、甘露醇等风味物质,随着发酵进行,同型乳酸菌会取代异型乳酸菌大量产酸,使得最终产品具有十分酸爽的感觉,两者协同发酵形成了其独特的风味[10]。
针对以上问题,本研究以西南地区典型农家泡菜为原料,从中分离优势乳酸菌菌株,进行纯化、鉴定,并对其生理生化特征进行研究;在此基础上将其用于海带蔬菜汁发酵,研究了发酵过程中益生菌保留量及产品理化特性变化规律。旨在挖掘西南地区特色益生菌资源,并本着海带中益生元组分利用的理念,为益生菌发酵类健康食品开发提供理论依据。
1 材料与方法
1.1 原料与试剂
酸菜采自西南地区农家;海带和卷心菜购自重庆永辉超市;植物乳杆菌购自湖北省工业微生物菌种保藏与研究中心;MRS培养基(g/L):蛋白胨10、酵母提取物5、牛肉膏10、葡萄糖20、磷酸氢二钾2、柠檬酸三铵2、乙酸钠5、吐温80 1 mL、七水硫酸镁0.58、四水硫酸锰0.25,pH 6.2~6.4,121 ℃灭菌20 min。固体培养基加入15 g琼脂。种子培养基(g/L):蛋白胨10、牛肉膏10、酵母提取物5、葡萄糖20,pH 6.2~6.4,121 ℃灭菌20 min。蛋白胨、琼脂,山东拓普生物工程有限公司;牛肉膏,上海麦克林生化科技有限公司;磷酸氢二钾、柠檬酸铵、乙酸钠、葡萄糖、硫酸镁、硫酸锰、氯化钠 (均为分析纯),重庆川东化工集团有限公司;吐温80 (分析纯)、酵母提取物,成都市科隆化学品有限公司。
1.2 仪器与设备
SJ-CJ-2FD超净工作台,苏州苏洁净化设备有限公司;MAS-II plus微波合成萃取反应工作站,上海新仪微波化学科技有限公司;GZX-9140MBE电热恒温鼓风干燥箱、SPX-250B-Z生化培养箱,上海博讯实业有限公司;ATY224电子天平,Shimadzu Corporation;DW-HL100超低温冷冻冰箱,中科美菱低温科技股份有限公司;LDZH-100L立式高压蒸汽灭菌锅,上海申安医疗器械厂。
1.3 实验方法
1.3.1 样品的采集与制备
使用冰盒将采集的样品运回实验室。在无菌超净工作台中,称取1.0 g农家自制酸菜样品,置入含9 mL 无菌去离子水试管中,通过涡旋充分振荡,制备成母悬浮液。利用去离子水,将母悬浮液制备成10-1、10-2、10-3、10-4、10-5梯度稀释液,备用。
1.3.2 样品中菌株筛选与分离
吸取100 μL上述各稀释液涂布于MRS固体培养基上,35 ℃培养48 h,分离菌株,每个稀释液浓度重复3次。
单菌落培养。根据菌落形态、颜色、大小等用灭菌的牙签将MRS固体培养基上的不同类单菌落转接到对应培养基上划线纯化,最后将菌种用50%(体积分数)甘油贮藏于-80 ℃冰箱中。
1.3.3 菌株鉴定
菌株的形态学和生理生化特征参照《常见细菌系统鉴定手册》[11]。使用试剂盒提取菌体总DNA,以菌体DNA为模版,乳酸菌采用通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-TAGG GTTACCTTGTTACGACTT-3′)进行PCR扩增,将扩增后的PCR产物送往上海生工生物公司测序,将测得的基因序列使用Blast与NCBI数据库上的序列进行比对,选择同源性较高的相关序列使用MEGAX软件来构建菌株的系统进化树。
1.3.4 菌株L-1产酸能力检测
对菌株L-1产酸能力的评价方法分为pH值检测法和产酸速率检测法[12]。
1.3.5 菌株L-1的耐盐与耐酸能力检测
1.3.5.1 耐盐能力
将菌株L-1在种子培养基中活化12 h后,菌液的OD600值达到0.8。分别按1%(体积分数)的接种量接种于含有不同NaCl质量浓度(0、10、20、30、40、50、60 g/L)的100 mL种子液体培养基的250 mL三角瓶中,以不接菌的种子培养基作为空白对照,每组设3个重复,35 ℃,80 r/min摇床培养48 h后,用分光光度计在600 nm处测定培养液的吸光值。
1.3.5.2 耐酸能力
将菌株在种子培养基中活化12 h后,菌液的OD600值达到0.8。分别按1%(体积分数)的接种量接种至不同pH(1、2、3、4、5、6、7)的含有100 mL种子培养基的250 mL三角瓶中,以不接菌的种子培养基作为空白对照,每组设置3个重复,35 ℃,80 r/min培养48 h后,测定培养液在600 nm处OD值。
1.3.6 细菌菌悬液的制备
将本研究筛选到的菌株L-1和购买的植物乳杆菌接种于MRS固体培养基上35 ℃培养1 d,用牙签取菌体接种于含有100 mL种子液体培养基的250 mL 三角瓶中,35 ℃恒温下,80 r/min摇床培养18 h,直至菌液浓度达到1×108 CFU/mL,备用。
1.3.7 海带蔬菜汁制备
将海带与卷心菜去掉有病斑、腐烂点的样品,用自来水洗净后,将海带与水以质量比1∶3打浆,卷心菜与水以质量比1∶2打浆,备用。
实验设计:本研究在3个重复实验中进行了有因子排列的完全随机设计(3×4因子设计)。实验处理包括:(1) 3水平的配方因子(质量分数):25%海带+75%卷心菜;50%海带+50%卷心菜;75%海带+25%卷心菜。(2) 2水平的菌种因子(体积分数):接种2%植物乳杆菌的海带液;接种1%植物乳杆菌和1%希腊魏斯氏菌L-1的海带液。结合以上不同因素的设计,我们共得到了6个不同的处理(3×2),使用了18瓶(6×3)。对18个三角瓶进行无菌接种后,摇匀,置于恒温培养箱中21 ℃下发酵。从第3天开始定期取样,一直取样至第6天。
1.3.8 微生物分析和pH值测定
参照GB 4789.2—2016进行菌落总数测定。用pH计测定pH值。
1.3.9 总糖和还原糖测定
将每天取出的样品8 000 r/min离心15 min。吸取上清液备用,总糖含量的测定采用苯酚-硫酸法[13],还原糖含量的测定采用DNS法[14]。
1.3.10 感官评价
对发酵结束后的海带蔬菜汁样品进行了消费者可接受性测试,采取10分制(表1)进行感官评定。
表1 感官评分标准
Table 1 Standards of sensory evaluation

感官项目好(9~10分)较好(7~8分)普通(5~6分)非常弱(3~4分)无(0~2分)色泽色泽明亮色泽清晰色泽一般色泽偏暗颜色浑浊气味浓郁的发酵清香和海带鲜味有发酵香和海带鲜味发酵香和海带鲜味不明显无芳香味,无异味无芳香味,有刺激气味口味酸咸味适宜酸咸味较淡或较浓酸咸味一般酸咸味偏高或偏低过酸过咸口感细腻较细腻质感一般无质感粗糙
1.4 数据处理
每个样本均进行3次平行,应用Origin 8.6和DPS数据软件进行数据处理和分析。
2 结果与分析
2.1 菌株L-1的形态、生理生化反应和种类鉴定
显微镜观测菌体呈不规则短棒状,成对或短链排列(图1-b),最适生长温度为35 ℃,其他生理特征见表2。测序结果显示菌株L-1的16S rDNA基因序列长度为1 480 bp;在BLAST数据库进行相似性比对,并使用MEGAX构建系统发育树(图1-c)。结果显示,菌株L-1与菌株希腊魏斯氏菌(Weissella hellenica)(Genbank登录号:EU7947360)的相似性达100%,并且在系统发育树上亲缘关系最近。根据L-1的形态特征、生理生化以及其16S rDNA序列分析,初步鉴定该菌株L-1为希腊魏斯氏菌(Weissella hellenica)。
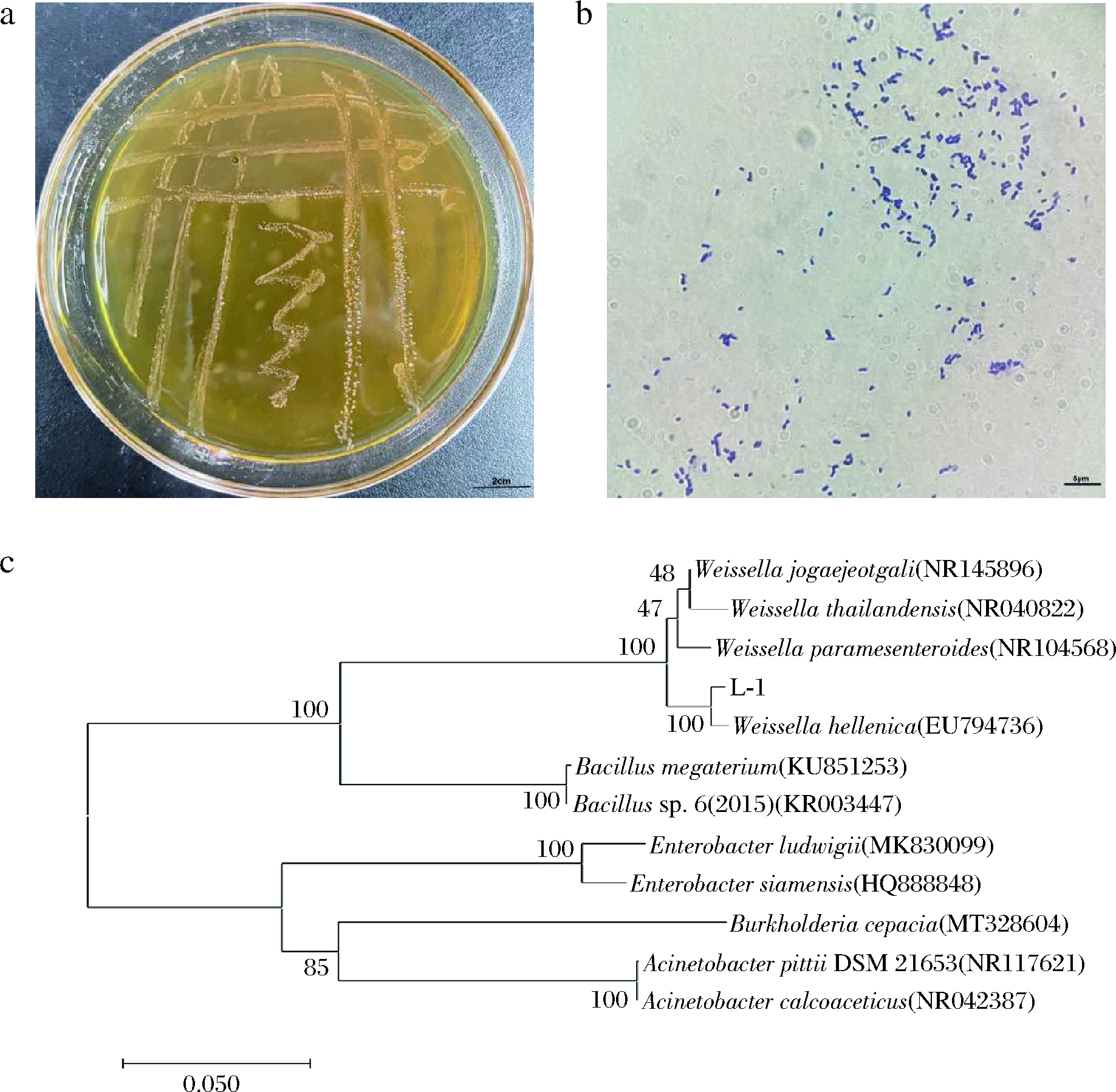
a-菌落形态;b-镜检图片;c-系统发育树
图1 菌株L-1菌种鉴定
Fig.1 Identification of strain L-1 used in the study
表2 菌株L-1的生理生化特征
Table 2 Physiological and biochemical charactersitics of strain L-1

菌株编号葡萄糖发酵产酸产气明胶液化接触酶试验葡聚糖产生试验甘露醇发酵精氨酸水解10%乙醇L-1+++-++--
注:“+”表示为阳性反应,“-”表示为阴性反应
2.2 菌株L-1的产酸能力
菌株L-1的产酸能力见图2,随着发酵时间的增加,菌株的产酸能力不断增强,当培养9 h时,发酵液pH已达到4.40,产酸速率达到1.99,据文献报道大多数乳酸菌在培养9 h后的产酸速率在0.43~1.29[15],本实验筛选到的希腊魏斯氏菌L-1在1.99,明显高于这个数值,具有较大的优势,说明菌株L-1的产酸速度非常快,这一特性将对后续发酵起到重要的作用。

图2 菌株L-1的产酸能力
Fig.2 Acid production capacity of strain L-1
2.3 胁迫下菌株L-1的耐受性
由图3可知,菌株L-1具有较广泛的耐盐能力,最高可耐受50 g/L NaCl,最适生长的盐质量浓度为0 g/L;在0 g/L盐浓度条件下,菌株L-1酸性pH的耐受范围为2~7,说明菌株L-1对较宽范围的酸性条件有良好的适应性。
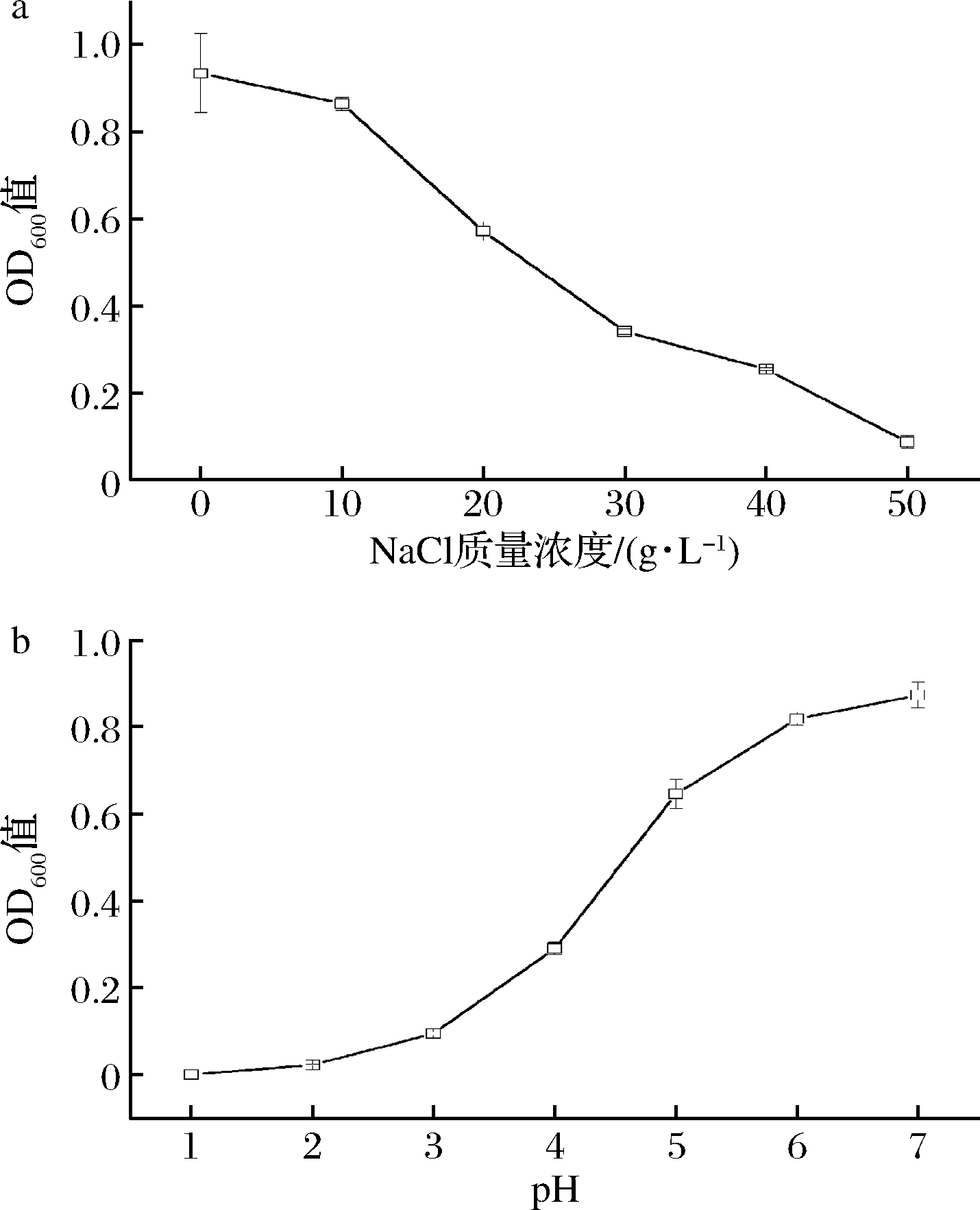
a-NaCl质量浓度;b-pH
图3 菌株L-1的耐盐与耐酸性能
Fig.3 Acid-resistent and halotolerant performance of strain L-1
2.4 海带蔬菜汁发酵过程中菌落总数和pH值变化
海带蔬菜汁发酵过程中菌落总数变化见图4-a。结果显示,海带的添加量影响了微生物的生长和发酵水平,菌落总数随着海带的增加而不断降低。在发酵第3天时,植物乳杆菌和希腊魏斯氏菌L-1都能够很好的代谢海带卷心菜中的有机质,所有样品中的菌落总数迅速增加,表现了较强的生长能力。在发酵初期,不管何种海带添加量,单独接种植物乳杆菌的菌落总数都要高于协同发酵的菌落总数。
在发酵过程中,2种接种方式的3种海带液的pH值在发酵前3 d呈快速下降趋势,然后缓慢下降,直至稳定。25%海带液中接种植物乳杆菌的海带液pH值稳定在3.33~3.35,而接种2种发酵菌剂的海带液pH值稳定在3.35~3.37;50%海带液中接种植物乳杆菌的海带液pH值稳定在3.51~3.55,而接种2种发酵菌剂的海带液pH值稳定在3.66~3.68;75%海带液中接种植物乳杆菌的海带液pH值稳定在3.72~3.75,而接种2种发酵菌剂的海带液pH值稳定在3.93~3.97(图4-b)。说明植物乳杆菌和希腊魏斯氏菌L-1可以利用海带卷心菜液中的营养物质生长,同时产生酸性代谢物质,促使环境pH值随着发酵的进行不断降低。

a-海带蔬菜汁发酵过程中菌落总数变化;b-海带蔬菜汁发酵过程中pH值变化
图4 海带蔬菜汁发酵过程中菌落总数和pH值变化
Fig.4 Changes in bacterial count and pH in kelp vegetable juice during fermentation
2.5 发酵过程中总糖和还原糖变化
如图5所示,在25%海带液中,接种植物乳杆菌后,总糖和还原糖含量分别降低了38.81%和26.58%,接种2种菌剂后,总糖和还原糖含量分别降低了43.28%和41.72%;在50%海带液中,接种植物乳杆菌后,总糖和还原糖含量分别降低了30.84%和28.39%,接种2种菌剂后,总糖和还原糖含量分别降低了35.98%和31.63%;在75%海带液中,接种植物乳杆菌后,总糖和还原糖含量分别降低了12.67%和10.32%,接种2种菌剂后,总糖和还原糖含量分别降低了15.77%和12.60%。海带中游离糖含量很少,高含量的海带降低了可用于发酵的糖类,降低了发酵速度。总糖含量的减少主要是来自于还原糖的减少。不管何种海带添加量,协同发酵组的总糖与还原糖消耗量都要高于单独接种植物乳杆菌,先前研究表明,卷心菜中主要的糖类为葡萄糖,其次是果糖和蔗糖[16],海带中还含有葡聚糖海带素和糖醇甘露醇[17],这些现成的碳来源可能更有利于希腊魏斯氏菌的定殖,并被其发酵利用。

a-海带体系发酵过程中总糖变化;b-海带体系发酵过程中还原糖变化
图5 海带体系发酵过程中总糖和还原糖变化
Fig.5 Changes in total sugar and reducing suger in kelp vegetable juice during fermentation
2.6 感官品质评价
图6表明,海带添加量对海带卷心菜发酵液的感官品质有较大的影响,其中对色泽影响最大,50%和75%的海带液中颜色较25%的海带液深,据报道,消费者认为颜色较浅是一种新型发酵海藻产品可以接受的外观[18]。希腊魏斯氏菌L-1协同植物乳杆菌发酵海带卷心菜液,尽管色泽、酸度描述分数低于单独接种植物乳杆菌实验组,但其具有明显的的酸鲜口感,同时,协同发酵实验组比单独接种植物乳杆菌发酵组的发酵液更具有愉悦香气和和谐口感。此外,在25%海带添加量下,协同发酵组在海带香味(7.5)和复合香味(8.9)方面也优于单菌种发酵组。希腊魏斯氏菌是异型发酵乳酸菌,其经过磷酸戊糖途径发酵后除主要产乳酸外还可以产生大量乙酸、乙醇与甘露醇等风味物质,具有产物多样性的特点[10],赋予产品更好的风味。其协同同型乳酸发酵菌植物乳杆菌可以明显改善植物乳杆菌发酵海带调味汁风味贫乏的缺点。

a-25%海带液;b-50%海带液;c-75%海带液
图6 海带发酵液感官品质评价
Fig.6 Sensory characteristics of kelp fermentation broth
3 结论
以西南地区典型农家泡菜为原料分离筛选了1株优势乳酸菌,经过16S rDNA序列分析,菌株L-1鉴定为希腊魏斯氏菌 (Weissella hellenica),具有优秀的产酸能力,最高可耐受pH为2、NaCl质量浓度为50 g/L。
将这一菌株协同植物乳杆菌(同型乳酸发酵菌)发酵海带蔬菜汁,结果表明25%(质量分数)海带配制的发酵产品更快达到较低的最终pH值,协同发酵组在海带香味(7.5)和复合香味(8.9)方面显著优于单菌种发酵组,而且具有更愉悦的香气与和谐口感。
[1] JESUMANI V,DU H,ASLAM M,et al.Potential use of seaweed bioactive compounds in skincare-A review[J].Marine Drugs,2019,17(12):688.
[2] DEL R O P G,GOMES-DIAS J S,ROCHA C M R,et al.Recent trends on seaweed fractionation for liquid biofuels production[J].Bioresource Technology,2020,299:122613.
O P G,GOMES-DIAS J S,ROCHA C M R,et al.Recent trends on seaweed fractionation for liquid biofuels production[J].Bioresource Technology,2020,299:122613.
[3] DE JESUS RAPOSO M F,DE MORAIS A M M B,DE MORAIS R M.Emergent sources of prebiotics:Seaweeds and microalgae[J].Marine Drugs,2016,14(2):27.
[4] LI N N,FU X D,XIAO M S,et al.Enzymatic preparation of a low-molecular-weight polysaccharide rich in uronic acid from the seaweed Laminaria japonica and evaluation of its hypolipidemic effect in mice[J].Food &Function,2020,11(3):2 395-2 405.
[5] ZENG J,AN D,JIAO C,et al.Cloning,expression,and characterization of a new pH-and heat-stable alginate lyase from Pseudoalteromonas carrageenovora ASY5[J].Journal of Food Biochemistry,2019,43(7):e12886.
[6] MOERDIJK-POORTVLIET T C W,DE JONG D L C,FREMOUW R,et al.Extraction and analysis of free amino acids and 5′-nucleotides,the key contributors to the umami taste of seaweed[J].Food Chemistry,2022,370:131352.
[7] ![]() S,KLEWICKA E.Algae in food:A general review[J].Critical Reviews in Food Science and Nutrition,2019,59(21):3 538-3 547.
S,KLEWICKA E.Algae in food:A general review[J].Critical Reviews in Food Science and Nutrition,2019,59(21):3 538-3 547.
[8] YAN F,POLK D B.Probiotics and probiotic-derived functional factors-mechanistic insights into applications for intestinal homeostasis[J].Frontiers in Immunology,2020,11:1428.
[9] XINOG T,LI J B,LIANG F,et al.Effects of salt concentration on Chinese sauerkraut fermentation[J].LWT-Food Science and Technology,2016,69:169-174.
[10] 张楠笛,祝林,许琴,等.食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味[J].食品科学,2020,41(14):102-108.
ZHANG N D,ZHU L,XU Q,et al.Improvement of the flavor of Sichuan pickle by co-fermentation with Weissella cibaria and Lactobacillus plantarum[J].Food Science,2020,41(14):102-108.
[11] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
DONG X Z,CAI M Y.Manual of Identification of Common Bacterial Systems [M].Beijing:Science Press,2001.
[12] 王雪艳.西藏高海拔地区酸奶中乳酸菌分离鉴定及其产酸能力评价[D].拉萨:西藏大学,2016.
WANG X Y.Isolate and authenticate lactic acid bacteria from the yogurt of Tibet’s high altitude regions and evaluate their acid-producing ability[D].Lasa:Tibet University,2016.
[13] JIANG Y P,QI X H,GAO K,et al.Relationship between molecular weight,monosaccharide composition and immunobiologic activity of Astragalus Polysaccharides[J].Glycoconjugate Journal,2016,33(5):755-761.
[14] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[15] 杨杨,石超,郭旭生.高寒草甸魏斯氏乳酸菌的分离鉴定及理化特性研究[J].草业学报,2014,23(1):266-275.
YANG Y,SHI C,GUO X S.Characterization and identification of Weissella species isolated from Kobresia littledalei growing in alpine meadows[J].Acta Prataculturae Sinica,2014,23(1):266-275.
[16] UUH-NARVAEZ J J,SEGURA-CAMPOS M R.Cabbage (Brassica oleracea var.capitata):A food with functional properties aimed to type 2 diabetes prevention and management[J].Journal of Food Science,2021,86(11):4 775-4 798.
[17] BRUHN A,BRYNNING G,JOHANSEN A,et al.Fermentation of sugar kelp (Saccharina latissima)-effects on sensory properties,and content of minerals and metals[J].Journal of Applied Phycology,2019,31(5):3 175-3 187.
[18] SKONBERG D I,FADER S,PERKINS L B,et al.Lactic acid fermentation in the development of a seaweed sauerkraut-style product:Microbiological,physicochemical,and sensory evaluation[J].Journal of Food Science,2021,86(2):334-342.