铁蛋白是一种在生物体内广泛存在的水溶性贮铁和解毒蛋白[1],由蛋白质外壳和铁核两部分组成。铁核的主要成分是非均匀性磷酸盐和铁的复合物[2],其最高可贮存4 500个铁原子[3]。蛋白外壳是由24个亚基组成的呈4-3-2对称的八面体结构[4],内外直径分别为8和12 nm[5]。蛋白外壳上存在的8条3倍和6条4倍(孔径约为0.3~0.5 nm)通道,主要是用于铁内核与外部环境的物质交换[6]。铁蛋白的主要功能是维持生物体内的铁代谢平衡[7-8]及通过清除铁介导的自由基来抑制Fenton反应,从而保护细胞免受因各种环境胁迫而导致的细胞氧化性损伤[9-10]。不含矿化铁核的铁蛋白称为脱铁铁蛋白[11]。脱铁铁蛋白可以通过还原释放机制将铁核释放到外界环境或者由工程菌如大肠杆菌直接生产[12-13]。研究表明,上述2种脱铁铁蛋白均具有自组装活性,即铁蛋白在极酸/碱(pH≤2.0或pH≥10.0)条件下,蛋白壳亚基之间会发生解离,将pH值调至7.0左右时,解离的亚基又能自组装成完整的铁蛋白外壳。另外,由于良好的均一性、单分散性、热稳定性和生物相容性等,使其常用作智能的纳米载体,用于药物的递送以及营养成分的封装。
天然铁蛋白本身可以作为一种吸收利用率极高的生物补铁源。此外,一些学者基于铁蛋白的可逆组装特性以及环境响应的通道“门控”特性(即扩大铁蛋白外壳上的通道)成功包埋了芦丁、表没食子儿茶素没食子酸酯、姜黄素、绿原酸和虾青素等食品生物活性物质,显著提高了活性物质的稳定性、生物利用度及水溶性等,扩大了铁蛋白在食品工业以及食品营养领域的应用[14]。不同于人重链铁蛋白(human H-chain ferritin,HuHF),日本囊对虾铁蛋白(Marsupenaeus japonicus ferritin,MjF)是一种潜在的可以去除污染食品系统中的重金属离子的食物源蛋白,主要是由于2种铁蛋白的半胱氨酸(Cys)残基位置不同:HuHF的Cys残基位于蛋白壳外,而MjF的Cys残基位于蛋白壳内。MjF能更好地结合镉(Cd2+)及汞(Hg2+)等重金属离子。因此,使用重组日本囊对虾铁蛋白(recombinant Marsupenaeus japonicus ferritin,rMjF)工程菌大批量纯化重组虾铁蛋白是十分必要的。
对于铁蛋白,常用柱层析进行进一步分离和纯化,如张晨曦等[15]和丁炳文等[16]通过Sephacryl S-500(300)凝胶过滤层析及DEAE阴离子交换层析纯化铁蛋白。由于凝胶过滤层析、阴离子交换层析、亲和层析等柱层析技术耗时长、过程繁琐、成本高,因此很大程度上限制了其批量化生产。硫酸铵的水溶液具有极高的离子强度,可以使蛋白质与H2O隔绝,降低蛋白质的溶解度[17]。蛋白分子间的疏水作用会使其相互聚集形成沉淀,从而促使蛋白和其他杂质(如糖类等)分离[18-19]。此外硫酸铵还具有易溶解、价格低、纯物质易获得、对蛋白质结构稳定和饱和溶液的密度相对较低等优点[20]。饱和硫酸铵盐析是重组铁蛋白分离纯化的一个重要步骤。本研究对重组虾铁蛋白的粗提取液进行20%~40%饱和度的(下同)硫酸铵处理(先采用20%饱和硫酸铵处理,收集上清液后将硫酸铵的饱和度提升至40%,收集沉淀复溶)后并结合透析、超滤等技术,成功制备出纯的rMjF,为rMjF的应用研究提供一定的参考价值。
1 材料与方法
1.1 实验材料
含日本囊对虾(Marsupenaeus japonicus)铁蛋白质粒(pET-3a)的大肠杆菌[BL21(DE-3)]由中国农业大学赵广华老师实验团队于2019年10月提供,于-80 ℃冰箱中冻存保藏。
1.2 仪器与设备
Scientz-ⅡD超声细胞破碎仪,宁波新芝生物科技股份有限公司;高速冷冻离心机,长沙湘智离心机仪器有限公司;高温高压灭菌锅,上海申安医疗器械有限公司;-80℃超低温冰箱,美国Thermo公司;SW-CJ1F超净工作台,苏州净化设备有限公司;电泳仪、垂直电泳槽、凝胶成像系统,美国Bio-Rad公司;JEM 1200EX透射电子显微镜(transmission electron microscope,TEM),日本JEOL公司;Zetasizer Nano ZS纳米粒度仪,英国Malvern公司;YC-2层析冷柜,北京博医康公司;Stirred Cell 8050/8003超滤装置,美国Minipore公司;CPA225D十万分之一电子天平,德国Sartorius公司;Nicoletl iS10傅里叶变换红外光谱仪,美国Thermo公司;ULUP-IV-10T超纯水仪,四川优普超纯科技有限公司;Vivaflow 200超滤膜包,德国Sartorius公司;TY-80A水平脱色摇床,江苏科析仪器有限公司;WD-9406胶片观测灯,北京六一仪器厂;THZ-98AB恒温震荡培养箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 含rMjF大肠杆菌的培养与破碎
参考DENG等[21]和MASUDA等[22]的方法,做一些改动。将冻存于-80 ℃的条件下的菌种活化,并将活化后的菌种接种于含氨苄青霉素(50.0 mg/mL)LB培养基(由超纯水配制)中。在37 ℃,180 r/min,pH=7.5的条件下,培养至OD600为0.6左右,采用200 μmol/L 异丙基β-D-硫代半乳糖苷诱导表达8 h,在温度为4 ℃,转速为10 000 r/min的条件下,离心10 min收集菌体。将收集的菌体再次悬于超纯水中进行超声细胞破碎(功率250 W,超声破碎30 min,开2 s,关3 s),至菌液完全澄清。
1.3.2 rMjF的分离与纯化
将破碎液进行加热处理(65 ℃,10 min),待热敏蛋白变性后,离心(10 000 r/min,4 ℃,5 min),收集上清液进行饱和硫酸铵处理。分别采用20%~40%(先采用20%饱和硫酸铵处理,收集上清液后将硫酸铵的饱和度提升至40%,收集沉淀用水溶解)、20%~60%(先采用20%饱和硫酸铵处理,收集上清液后将硫酸铵的饱和度提升至60%,收集沉淀用水溶解)和20%~40%~60%(将采用20%~40%饱和硫酸铵收集的沉淀用60%饱和硫酸铵溶液溶解)饱和硫酸铵复合处理rMjF。然后,将含目标蛋白的硫酸铵溶液置于超纯水中进行透析(透析袋截留分子质量为300 kDa,每隔8 h更换1次透析液,共进行3次)除去硫酸铵。将透析后的液体经0.22 μm(聚醚砜材质)的滤膜进一步澄清,然后用膜包(截留分子质量50 kDa)超滤浓缩,最后进行冷冻干燥保存。
1.3.3 纯度鉴定
参考刘文营[12]的方法,并做出一定的改进。采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)(浓缩胶的浓度为5%,分离胶的浓度为12%,80 V运行20 min后转为120 V)测定rMjF的纯度及其亚基的分子质量。
1.3.4 粒径的测定
参考丁炳文等[16]的方法,进行rMjF的粒径测定。使用马尔文粒度仪(Zetasizer Nano ZS;美国赛默飞)在25 ℃下进行粒径测试。
1.2.5 紫外扫描测定
参考张晨曦等[15]的方法,进行rMjF的紫外光谱表征。使用紫外扫描仪扫描220 ~400 nm下的紫外-可见光光谱。
1.3.6 纳米结构观测
参考张晨曦等[15]的方法,进行rMjF的纳米结构观察。纯化样品用20.0 mmol/L Tris-HCl缓冲液(pH=7.5)稀释至一定浓度后,将其放置于碳涂层铜栅上,用20 g/L醋酸铀酰染色3 min,透射电子显微镜在80 kV处对其进行成像。
1.3.7 傅里叶-红外光谱对rMjF二级结构的测定
参考丁炳文等[16]的方法,进行rMjF的红外光谱测定。将纯化的铁蛋白溶液进行冷冻干燥,然后与充分干燥的KBr混合研磨后制片,以充分干燥的KBr为空白背景。具体参数设定如下:红外光谱仪分辨率为4 cm-1,扫描次数为32次。之后结合PeakFit v 4.12软件对蛋白质的特征吸收带酰胺Ⅰ带进行rMjF二级结构分析。
1.4 数据处理
每个样品做3次平行,数据结果取平均值,之后使用Origin 9.0软件进行图表制作。
2 结果与分析
2.1 rMjF的分离纯化
铁蛋白是一种耐热蛋白,其受热展开的过渡温度(Tm)约为70 ℃,远高于一般蛋白质的Tm(50 ℃以下),且有研究表明铁蛋白外壳可以在80 ℃的高温下持续10 min不变性[23]。所以本实验通过65 ℃加热10 min 处理rMjF破碎液去除部分不耐热杂蛋白,之后进行饱和硫酸铵处理。铁蛋白经过饱和硫酸铵处理后,存在于20%饱和度的硫酸铵的上清液中,同时存在于60%饱和度的硫酸铵的沉淀中[4,15]。基于此,本实验将热处理后的rMjF粗提液上清液均分为3份,分别缓慢添加硫酸铵固体,使溶液中硫酸铵的最终饱和度达到20%、40%和60%,静置30 min后,分别取其上清液和沉淀进行SDS-PAGE凝胶电泳分析。
由图1可知,rMjF由分子质量约为20 kDa的单亚基组成,与WANG等[24]对非重组的MjF的亚基分子质量基本一致。经过饱和度20%、40%和60%的硫酸铵处理后,rMjF分别存在于饱和硫酸铵溶液的上清液、沉淀和沉淀中,与前人的研究基本一致[4,15]。杂蛋白存在于经20%饱和硫酸铵处理后的沉淀中,这可能是由于rMjF的硫酸铵溶解度曲线符合典型的蛋白质的硫酸铵溶解度曲线[25],即rMjF可以在低饱和度的硫酸铵溶液中溶解度增加(盐溶),在高饱和度的硫酸铵溶液中溶解度降低(盐析)。所以可以采用20%饱和硫酸铵处理去除沉淀中部分杂蛋白,然后通过提升其上清液(硫酸铵的饱和度为20%)的饱和度进一步提纯rMjF。

图1 不同饱和度的硫酸铵处理rMjF粗提物的SDS-PAGE电泳图
Fig.1 SDS-PAGE electrophoresis of rMjF crude extract treated with ammonium sulfate at different saturation
注:泳道1-20%饱和硫酸铵处理的上清液;泳道2-20%饱和硫酸铵处理的沉淀;泳道3-40%饱和硫酸铵处理的上清液;泳道4-40%饱和硫酸铵处理的沉淀;泳道5-60%饱和硫酸铵处理的上清液;泳道6-60%饱和硫酸铵处理的沉淀
采用考马斯亮蓝测定经60%、20%~40%、20%~60%和20%~40%~60%饱和硫酸铵处理的粗提液中蛋白浓度,与热处理后的粗提液对比,蛋白浓度分别减少了29.67%、49.7%、36.94%和48.81%。结果表明,rMjF粗提液经过饱和硫酸铵复合处理会大大降低杂蛋白的含量。凌雪萍等[26]通过采用50%~80%的饱和硫酸铵处理乳铁蛋白也得到了相同的结论。由图2可知,粗提上清液经20%~40%、20%~60%和20%~40%~60%饱和硫酸铵处理后,结合透析、超滤等技术,三者rMjF纯度都很高,即经过饱和硫酸铵复合处理结合非柱层析技术可以有效纯化rMjF。PALOMBARINI等[4]也通过20%~40%饱和硫酸铵处理结合其他非柱层析技术成功纯化了重组人重链铁蛋白。
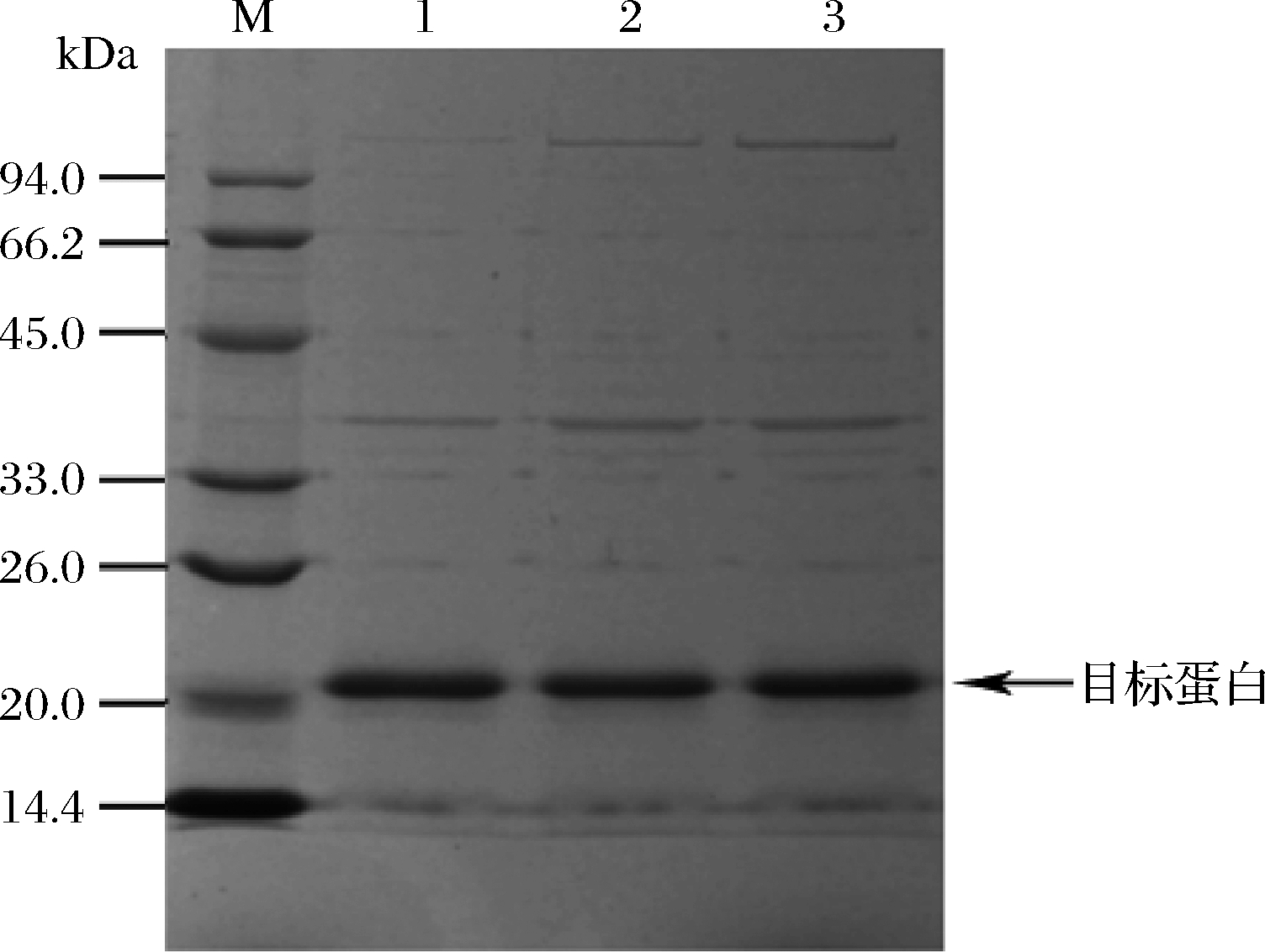
图2 梯度饱和硫酸铵处理rMjF粗提物后的SDS-PAGE电泳图
Fig.2 SDS-PAGE of rMjF crude extract treated with gradient saturated ammonium sulfate
注:泳道1-粗提液经20%~40%饱和硫酸铵双重处理后,经透析、超滤后的蛋白质;泳道2-粗提液经20%~60%饱和硫酸铵双重处理后,经透析、超滤的蛋白质;泳道3-粗提液经20%~40%~60%饱和硫酸铵的三重处理后,经透析、超滤的蛋白质
2.2 不同饱和度硫酸铵处理后的rMjF纳米粒径表征
由图3可知,经过20%~40%和20%~60%饱和硫酸铵复合处理提纯的rMjF与传统层析(60%硫酸铵处理结合柱层析技术)的rMjF体积分布表明,rMjF球体的粒径约为12 nm,这与铁蛋白外壳径12 nm 基本一致。但与传统的层析处理相比,经20%~40%和20%~60%饱和硫酸铵复合处理提纯的rMjF会发生一定的团聚现象。由图3的插图可以看出,经20%~40%~60%饱和硫酸铵的三重处理提纯的rMjF团聚现象更严重。然而,目前对于硫酸铵复合处理引起铁蛋白团聚的具体原因尚不清楚,需要之后进一步研究。为了减少铁蛋白的团聚,本实验对粗提液采用20%~40%饱和硫酸铵双重处理提纯的rMjF进行表征。
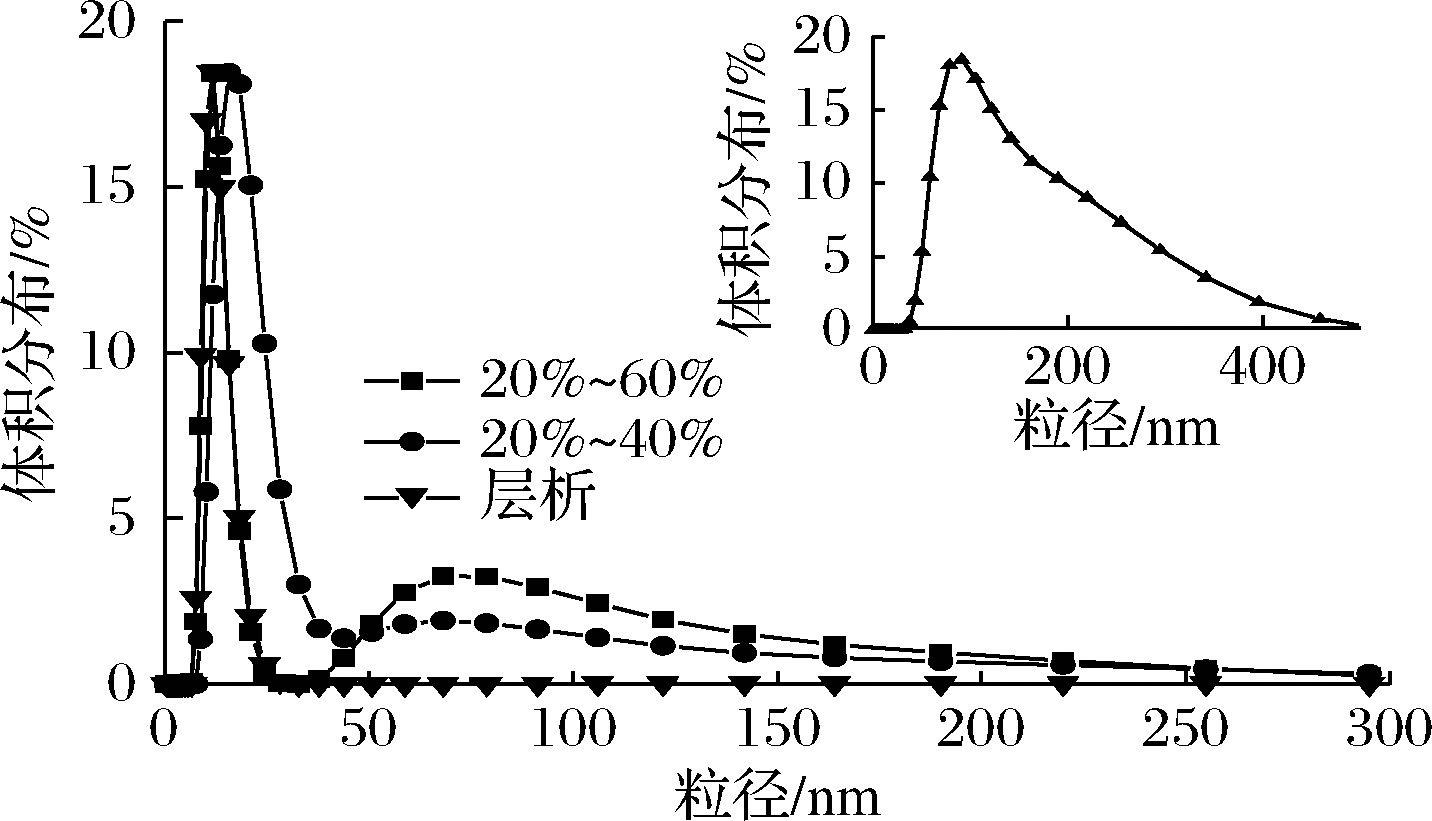
图3 不同饱和度硫酸铵处理后的蛋白粒径图
Fig.3 Protein particle size diagram after ammonium sulfate treatment with different saturation
注:右上角的插图为粗提液经20%~40%~60%饱和硫酸铵的三重处理提纯的蛋白粒径图
2.3 rMjF纳米结构观察
由图4可知,传统层析与未层析(20%~40%饱和硫酸铵处理)纯化的rMjF均具有较好的分散性及其粒径的均一性。蛋白腔内存在黑色的铀核,这主要是因为rMjF是脱铁铁蛋白,经乙酸铀染色后,乙酸铀会通过其外壳上的通道进入蛋白内部使腔内呈现黑色[27]。

a-层析制备的rMjF;b-非层析制备的rMjF
图4 纯化后rMjF的TEM图
Fig.4 TEM images of purified rMjF
2.4 rMjF的紫外光谱分析
利用紫外扫描层析与未层析(20%~40%饱和硫酸铵处理)纯化的rMjF。由图5可知,rMjF的最大吸收峰位于280 nm,这主要是由于蛋白质分子中存在含共轭双键的氨基酸(如酪氨酸、色氨酸等芳香族氨基酸),这些氨基酸在280 nm处有吸收峰。脱铁之前的铁蛋白由于铁核的存在会干扰光谱的吸收没有吸收峰[12],此结果进一步表明rMjF是脱铁铁蛋白。
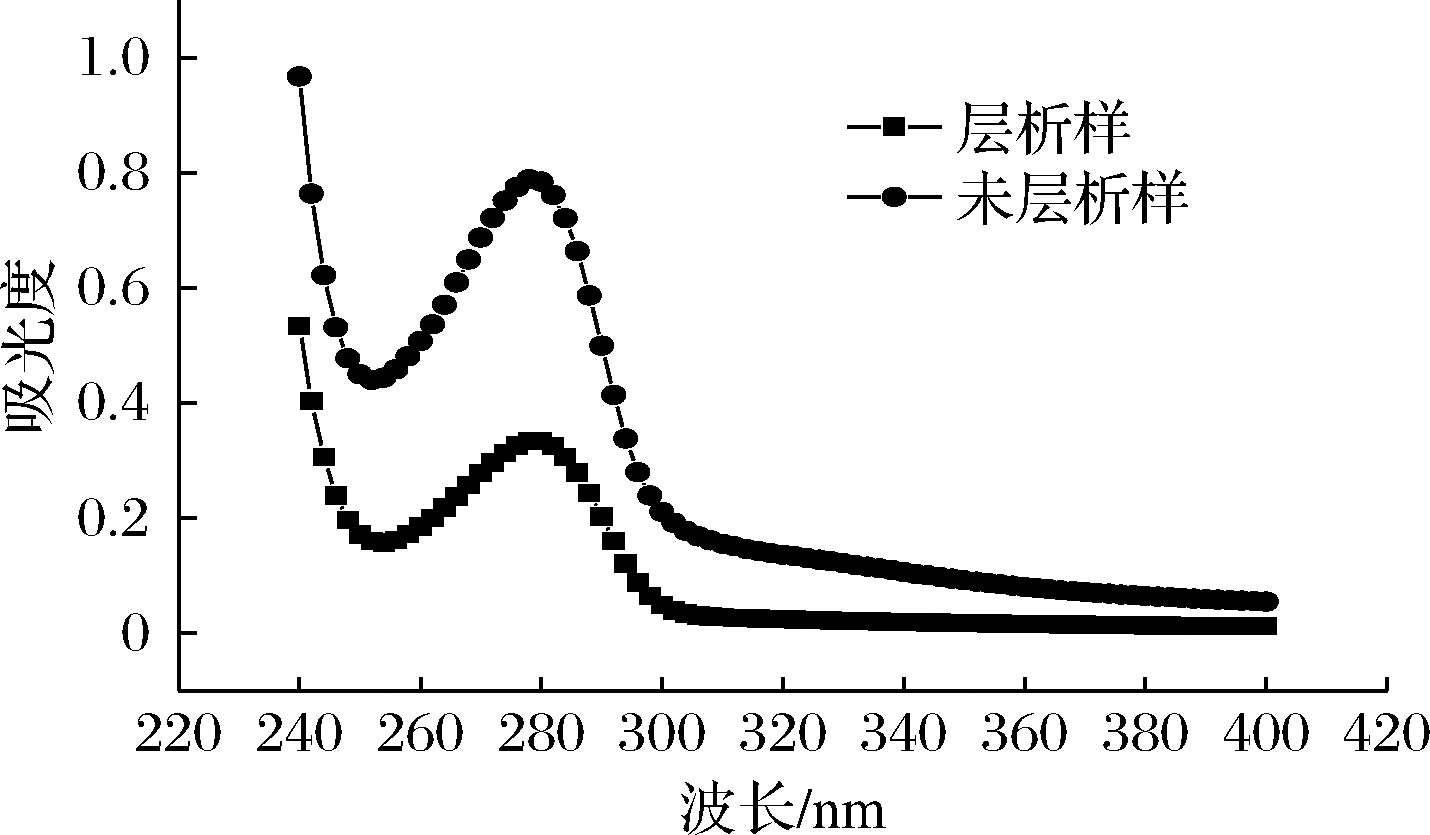
图5 rMjF的紫外扫描图
Fig.5 UV scan of rMjF
2.5 红外光谱分析rMjF二级结构
图6为rMjF的红外光谱图。蛋白质的红外光谱主要是由肽基的羰基伸缩振动、肽基N—H平面内弯曲振动和C—H伸缩振动所诱导的酰胺Ⅰ带和酰胺Ⅱ带组成[28]。酰胺Ⅰ带位于1 600~1 700 cm-1,主要涉及C![]() O振动,酰胺Ⅱ带位于1 500~1 600 cm-1内,主要是N—H弯曲振动和C—N伸缩振动[29]。蛋白质二级规则结构都是通过主链上的C
O振动,酰胺Ⅱ带位于1 500~1 600 cm-1内,主要是N—H弯曲振动和C—N伸缩振动[29]。蛋白质二级规则结构都是通过主链上的C![]() O和N—H间的氢键作用来维持的,通过测定C
O和N—H间的氢键作用来维持的,通过测定C![]() O振动的酰胺Ⅰ带优于酰胺Ⅱ带。所以酰胺Ⅰ带比酰胺Ⅱ带对蛋白质二级结构的变化更敏感[30]。基于此,本实验通过对酰胺Ⅰ带进行基线校正、Gaussian去卷积以及二阶导数拟合后得到rMjF红外光谱酰胺Ⅰ带拟合图(图7),参考BEAUCHEMIN等[31]对酰胺Ⅰ带蛋白质二级结构区域的划分(表1),再经表2可得rMjF的二级结构:α-螺旋占比为57.91%、β-折叠占比为11.39%、β-转角占比为21.17%、β-反平行占比为9.53%。α-螺旋中每个肽键的氨基氢和第4个肽键的羰基氧形成与螺旋长轴基本平行的氢键,结构最稳定。这进一步表明,此铁蛋白结构十分稳定。其中α-螺旋占比为57.91%,结果与丁炳文等[16]报道鲟鱼肝脏铁蛋白二级结构相近,这也可能是铁蛋白具有较高Tm的原因。
O振动的酰胺Ⅰ带优于酰胺Ⅱ带。所以酰胺Ⅰ带比酰胺Ⅱ带对蛋白质二级结构的变化更敏感[30]。基于此,本实验通过对酰胺Ⅰ带进行基线校正、Gaussian去卷积以及二阶导数拟合后得到rMjF红外光谱酰胺Ⅰ带拟合图(图7),参考BEAUCHEMIN等[31]对酰胺Ⅰ带蛋白质二级结构区域的划分(表1),再经表2可得rMjF的二级结构:α-螺旋占比为57.91%、β-折叠占比为11.39%、β-转角占比为21.17%、β-反平行占比为9.53%。α-螺旋中每个肽键的氨基氢和第4个肽键的羰基氧形成与螺旋长轴基本平行的氢键,结构最稳定。这进一步表明,此铁蛋白结构十分稳定。其中α-螺旋占比为57.91%,结果与丁炳文等[16]报道鲟鱼肝脏铁蛋白二级结构相近,这也可能是铁蛋白具有较高Tm的原因。
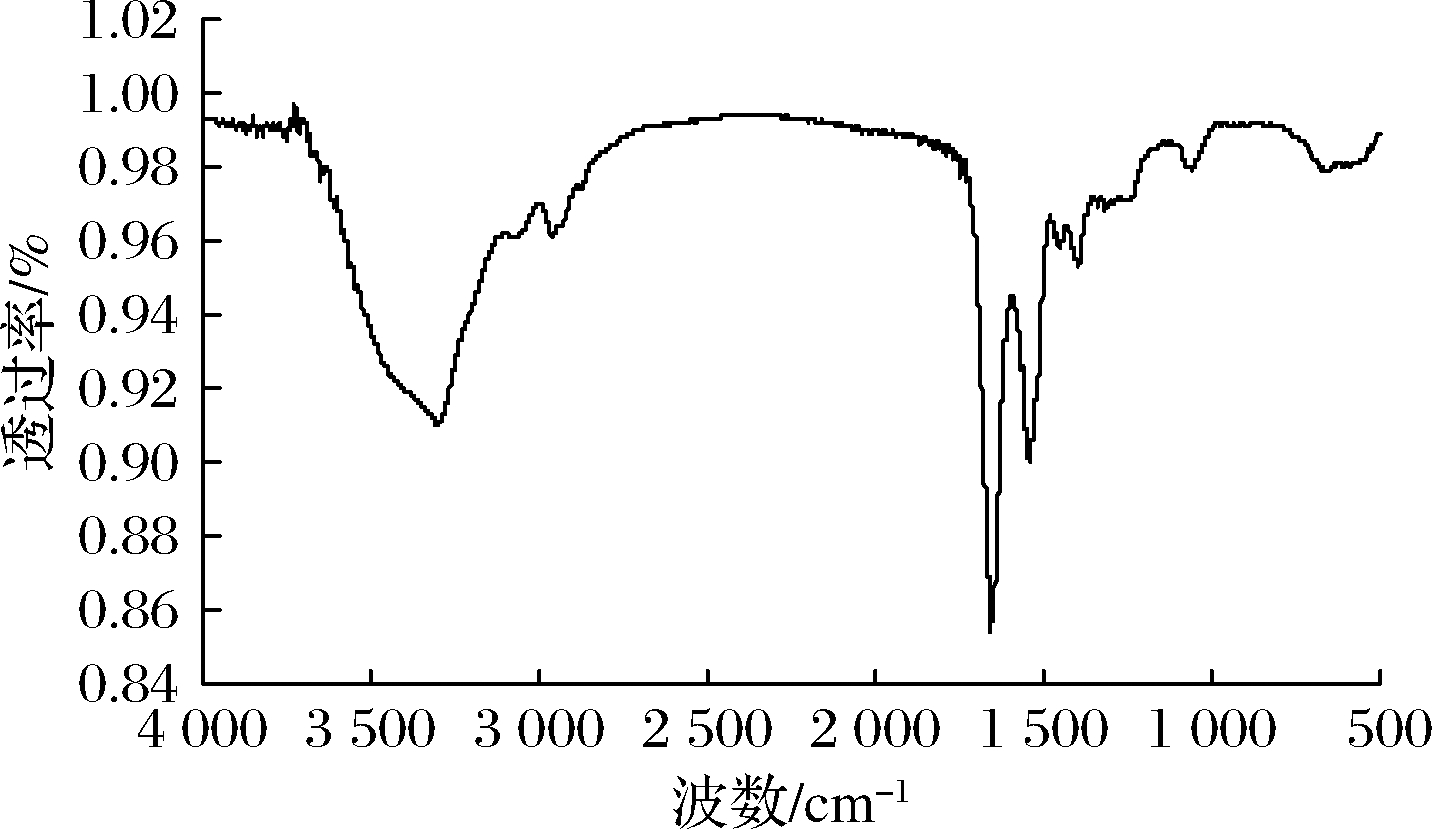
图6 rMjF的红外光谱图
Fig.6 Infrared spectra of rMjF
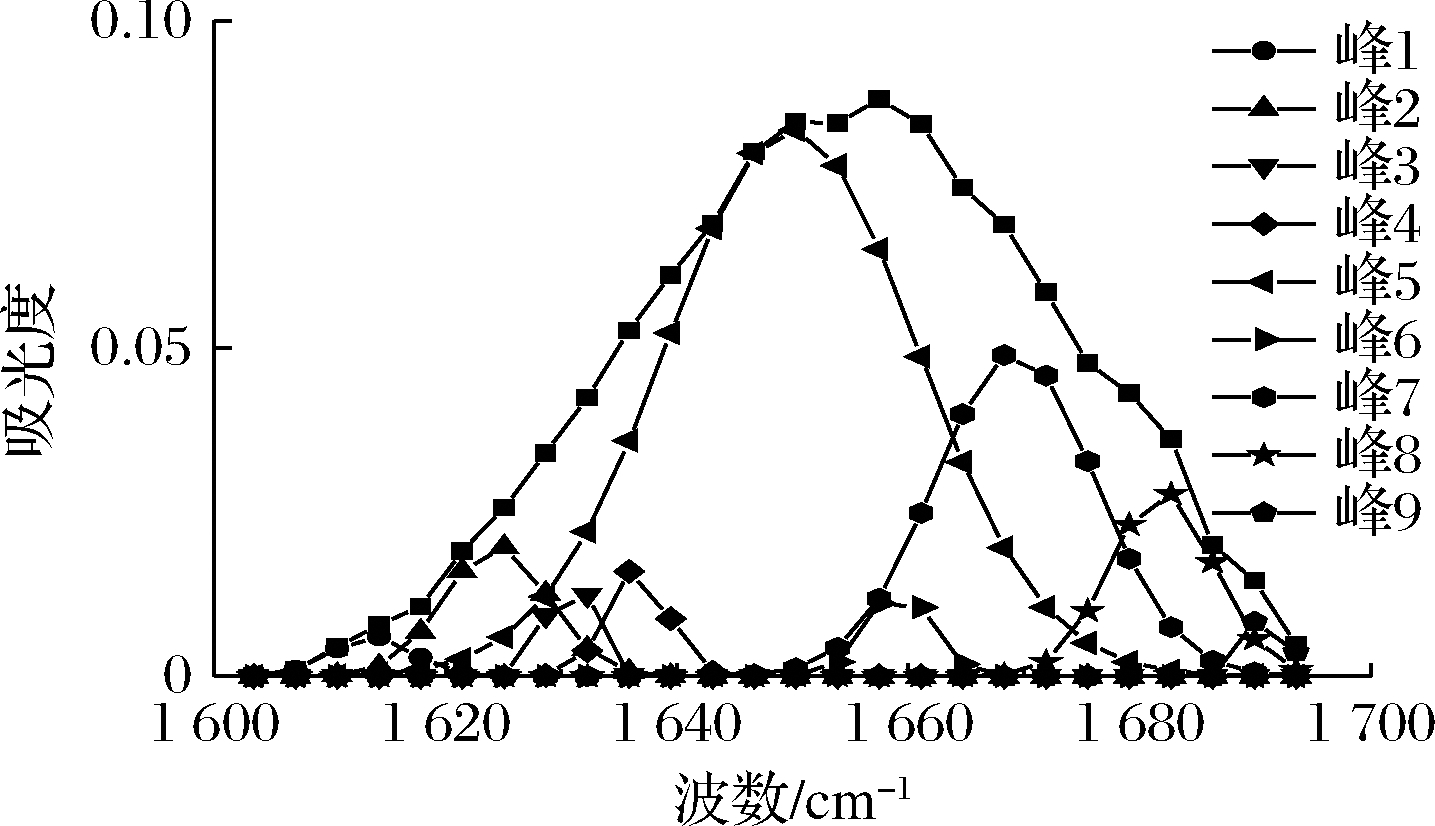
图7 rMjF红外光谱酰胺Ⅰ带拟合图
Fig.7 Infrared spectra rMjF amide Ⅰ bands fitting figure
表1 酰胺Ⅰ带拟合峰对应的二级结构[31]
Table 1 Amide Ⅰ bands corresponding to the secondary structure

酰胺I带区间/cm-1所属范围1692~1680β-反平行1680~1660β-转角1660~1650β-螺旋1648~1641无规卷曲1640~1610β-折叠
表2 红外光谱酰胺Ⅰ带拟合数据
Table 2 Fitting data of amide I bands of infrared spectrum
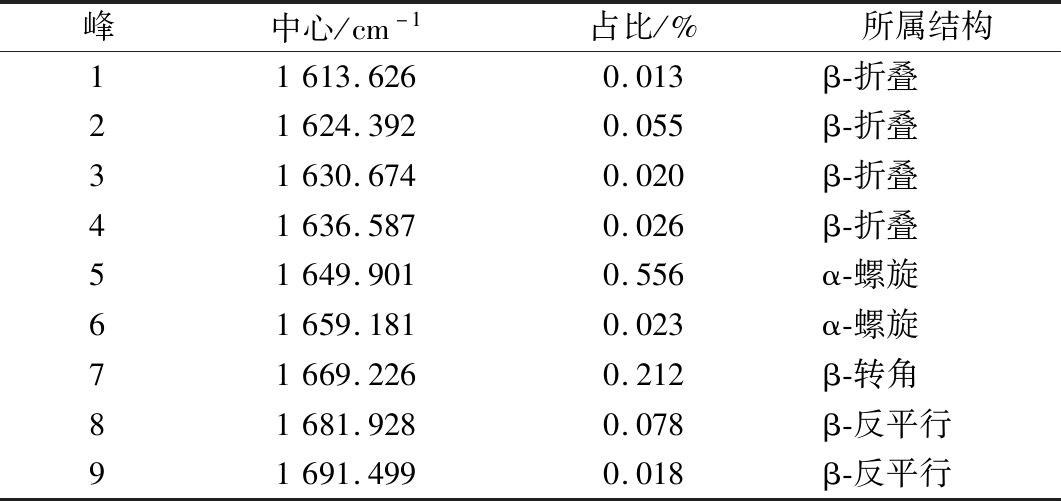
峰中心/cm-1占比/%所属结构11613.6260.013β-折叠21624.3920.055β-折叠31630.6740.020β-折叠41636.5870.026β-折叠51649.9010.556α-螺旋61659.1810.023α-螺旋71669.2260.212β-转角81681.9280.078β-反平行91691.4990.018β-反平行
3 结论
本研究对经过热处理(65 ℃,10 min)后rMjF的粗提液进行20%~40%饱和硫酸铵处理,并结合透析、超滤等非柱层析技术,成功制备出纯的rMjF。相较于离子交换层析等柱层析技术,本实验中rMjF分离纯化技术成本较低,易于操作,适用于工业化大批量生产,未来可考虑将rMjF作为纳米载体装载生物活性成分或者将其作为食品原料中重金属离子的吸附蛋白。大批量生产rMjF具有重要意义和广阔的开发前景。
[1] ZHAO G H.Phytoferritin and its implications for human health and nutrition[J].Biochimica et Biophysica Acta(BBAJ-General Subjects),2010,1 800(8):815-823.
[2] 王运九,肖潇,何璐,等.铁蛋白及其糖基化研究进展[J].临床军医杂志,2017,45(4):431-433.
WANG Y J,XIAO X,HE L,et al.Advances in ferritin and its glycosylation[J].Clinical Journal of Medical Officers,2017,45(4):431-433.
[3] FORD G C,HARRISON P M,RICE D W,et al.Ferritin:Design and formation of an iron-storage molecule[J].Philosophical Transactions of the Royal Society of London.Series B,Biological Sciences,1984,304(1 121):551-565.
[4] PALOMBARINI F,GHIRGA F,BOFFI A,et al.Application of crossflow ultrafiltration for scaling up the purification of a recombinant ferritin[J].Protein Expression and Purification,2019,163:105451.
[5] 刘佳林.重组融合蛋白在E.coli中可溶性表达及抗原活性研究[D].长春:吉林大学,2016.
LIU J L.The antigenic activity and soluble expression of recombinant fusion protein in E.coli[D].Changchun:Jilin University,2016.
[6] YANG R,ZHOU Z K,SUN G Y,et al.Ferritin,a novel vehicle for iron supplementation and food nutritional factors encapsulation[J].Trends in Food Science and Technology,2015,44(2):189-200.
[7] CURIE C,BRIAT J F.Iron transport and signaling in plants[J].Annual Review of Plant Biology,2003,54:183-206.
[8] LIU X F,THEIL E C.Ferritins:dynamic management of biological iron and oxygen chemistry[J].Chem Indorm,2005,36(24):167-175.
[9] DE K M,HORV
K M,HORV TH G V,DAVLETOVA S,et al.Plants ectopically expressing the ironbinding protein,ferritin,are tolerant to oxidative damage and pathogens[J].Nature Biotechnology,1999,17(2):192-196.
TH G V,DAVLETOVA S,et al.Plants ectopically expressing the ironbinding protein,ferritin,are tolerant to oxidative damage and pathogens[J].Nature Biotechnology,1999,17(2):192-196.
[10] RAVET K,TOURAINE B,BOUCHEREZ J,et al.Ferritins control interaction between iron homeostasis and oxidative stress in Arabidopsis[J].The Plant Journal,2009,57(3):400-412.
[11] 夏伟荣,李莹,柴智,等.铁蛋白-海藻酸钠纳米包埋ACE抑制肽[J].食品科学,2020,41(8):77-82.
XIA W R,LI Y,CHAI Z,et al.Encapsulation of ACE inhibitory peptide with ferritin-sodium alginate nanoparticles[J].Food Science,2020,41(8):77-82.
[12] 刘文营.鹰嘴豆铁蛋白的分离纯化表征及性质分析[D].石河子:石河子大学,2011.
LIU W Y.Purification,Characterization and biochemical properties of ferritin from chick pea seeds[D].Shihezi:Shihezi University,2011.
[13] FAN K L,JIA X H,ZHOU M,et al.Ferritin nanocarrier traverses the blood brain barrier and kills glioma[J].ACS Nano,2018,12(5):4 105-4 115.
[14] 陈海,马良,戴宏杰,等.铁蛋白纳米笼分子装载途径及食品活性物质递送的研究进展[J].食品与发酵工业,2022,48(3):304-310.
CHEN H,MA L,DAI H J,et al.Encapsulation strategies of ferritin and its application for food bioactive compounds delivery:A review[J].Food and Fermentation Industries,2022,48(3):304-310.
[15] 张晨曦,张晓荣,吕晨艳,等.超声辅助法制备铁蛋白-虾青素包埋物[J].食品科学,2021,42(11):94-101.
ZHANG C X,ZHANG X R,LYU C Y,et al.Ultrasound-assisted encapsulation of astaxanthin within ferritin nanocages with enhanced efficiency [J].Food Science,2021,42(11):94-101.
[16] 丁炳文,马贵红,李筱,等.热处理对鲟鱼肝脏铁蛋白稳定性的影响[J].食品科学,2022,43(8):66-73.
DING B W,MA G H,LI X,et al.Effect of heat treatment on the stability of liver ferritin from Acipenser baerii[J].Food Science,2022,43(8):66-73.
[17] 刘楠辛.DNA结合蛋白的表达、纯化及活性鉴定[D].泉州:华侨大学,2017.
LIU N X.Expression,purification and activity assay of DNA binding proteins[D].Quanzhou:Huaqiao University,2017.
[18] 王海丽.软枣猕猴桃蛋白酶的提取分离与嫩化牛肉效果的研究[D].延吉:延边大学,2013.
WANG H L.The extraction,isolation,and tenderization of beef by protease in Actinidia arguta[D].Yanji:Yanbian University,2013.
[19] 赵琼,王庭伊,黄艾祥.逐级盐析结合双水相法纯化贯筋藤凝乳酶[J].食品工业科技,2020,41(1):44-49.
ZHAO Q,WANG T Y,HUANG A X.Purification of milk-clotting enzyme from Dregea sinensis hemsl.by stepwise salting-out and aqueous two-phase extraction[J].Science and Technology of Food Industry,2020,41(1):44-49.
[20] MATULIS D.Selective precipitation of proteins[J].Current Protocols in Protein Science,2016,83(1):4.5.1-4.5.37.
[21] DENG J J,CHENG J J,LIAO X Y,et al.Comparative study on iron release from soybean (Glycine max) seed ferritin induced by anthocyanins and ascorbate[J].Journal of Agricultural and Food Chemistry,2010,58(1):635-641.
[22] MASUDA T,GOTO F,YOSHIHARA T,et al.The universal mechanism for iron translocation to the ferroxidase site in ferritin,which is mediated by the well conserved transit site[J].Biochemical and Biophysical Research Communications,2010,400(1):94-99.
[23] STEFANINI S,CAVALLO S,WANG C Q,et al.Thermal stability of horse spleen apoferritin and human recombinant H apoferritin[J].Archives of Biochemistry and Biophysics,1996,325(1):58-64.
[24] WANG Y J,ZANG J C,WANG C T,et al.Structural insights for the stronger ability of shrimp ferritin to coordinate with heavy metal ions as compared to human H-chain ferritin[J].International Journal of Molecular Sciences,2021,22(15):7 859.
[25] BURGESS R R,DEUTSCHER M P.Guide to Protein Purification[M].2nd.Pittsburgh:Academic Press,2009.
[26] 凌雪萍,庞广昌,李国强.乳铁蛋白的分离及纯化[J].食品与发酵工业,2003,29(5):7-10.
LING X P,PANG G C,LI G Q.Isolation and purification of lactoferrin from bovine colostrum[J].Food and Fermentation Industries,2003,29(5):7-10.
[27] YANG R,LIU Y Q,GAO Y J,et al.Nano-encapsulation of epigallocatechin gallate in the ferritin-chitosan double shells:Simulated digestion and absorption evaluation[J].Food Research International,2018,108:1-7.
[28] 刘昭清,万众,江政,等.罗非昔布与牛血清白蛋白之间相互作用的研究[J].分析科学学报,2020,36(3):421-426.
LIU Z Q,WAN Z,JIANG Z,et al.Study on the interaction between rofecoxib and bovine serum albumin[J].Journal of Analytical Science,2020,36(3):421-426.
[29] 杨凡,朱玲,吴港城,等.紫檀芪纳米复合物的构建及稳定性研究[J].食品与发酵工业,2021,47(12):128-132.
YANG F,ZHU L,WU G C,et al.The fabrication and stability of the pterostilbene nano complex[J].Food and Fermentation Industries,2021,47(12):128-132.
[30] 杨伟.乳铁蛋白、EGCG和果胶三元复合物的形成机制及结构表征[D].北京:中国农业大学,2015.
YANG W.Fabrication mechanism and structural characteristics of the ternary aggregates by lactoferrin,EGCG and pectin[D].Beijing:China Agricultural University,2015.
[31] BEAUCHEMIN R,N′SOUKPOÉ-KOSSI C N,THOMAS T J,et al.Polyamine analogues bind human serum albumin[J].Biomacromolecules,2007,8(10):3 177-3 183.