心血管疾病(cardiovascular diseases,CVDs)主要包括缺血性心脏病和中风等,是造成人类死亡的主要原因,也是致残的重要因素[1-2]。我国是全球CVDs死亡人数最高的国家,并呈逐年上升的趋势。在针对我国各省健康情况的全球疾病负担2017中指出,我国死亡率最高的疾病是中风和缺血性心脏病,中风从1990年的第三位上升为2017年的首位,缺血性心脏病从1990年的第七位上升到2017年的第二位[3]。2016年,约400万人死于CVDs[4]。目前CVDs已经成为一种全球性的疾病。
最近的证据表明,肠道微生物能够通过调节宿主代谢和炎症的方式进一步促进或预防CVDs以及相关疾病的发生发展。越来越多的证据表明,肠道微生物的组成会影响宿主的新陈代谢[5]。红肉、贝类、鸡蛋中含有丰富的胆碱、磷脂酰胆碱和L-肉碱[6]。这些食品经过肠道菌群的作用,生成三甲胺(trimethylamine,TMA),然后在肝脏中在黄素单氧化酶(flavin-containing monooxygenase,FMO)(特别是FMO1和FMO3)的作用下被转化成氧化三甲胺(trimethylamine-N-oxide,TMAO)[7]。最近的研究表明,TMAO能够促进动脉粥样硬化的发生发展,是CVDs的始动因素[8-9]。TMAO与心血管事件、预后和死亡风险均相关[10]。
随着肠道菌群与慢性疾病的研究不断增多,服用益生菌作为一种潜在的缓解及预防方式,越来越多地受到人们的关注。QIU等的研究发现植物乳杆菌ZDY04[11]和产气肠杆菌ZDY01[12]可以通过改善小鼠肠道菌群结构的方式减少血浆TMAO和盲肠TMA含量,进而减少CVDs的发生。本研究选取3株不同种的乳杆菌,通过高胆碱饮食模型,评价它们降低血浆TMAO和盲肠TMA的效果,以期为CVDs防治开发新的功能性乳杆菌。
1 材料与方法
1.1 试剂与设备
TMAO、TMA,Sigma-Aldrich公司;D9-TMAO,Cambridge公司;D9-TMA,Toronto Research Chemicals公司;小鼠肝脏FMO3、法尼酯X受体(recombinant farnesoid X receptor,FXR)的ELISA试剂盒,上海酶联生物科技有限公司;胶回收试剂盒,杭州倍沃医学科技有限公司;PCR引物,上海生工生物工程有限公司;粪便基因组DNA提取试剂盒,美国MP Biomedicals公司;聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)蛋白定量试剂盒,上海碧云天生物技术有限公司。
5424R高速离心机,德国艾本德股份公司;HPLC-MS/MS,赛默飞世尔科技公司;MiSeq测序仪,美国Illumina公司。
1.2 实验菌株
本实验使用的3株乳杆菌均来自江南大学食品生物技术中心菌种保藏中心,菌株信息见表1。
表1 乳杆菌信息表
Table 1 Lactobacillus strains information

序号物种菌株编号实验编号来源1植物乳杆菌FCQAS2M1Lp粪便样品2罗伊氏乳杆菌138-1CCFM8631粪便样品3鼠李糖乳杆菌FHeJJ-71Lrh粪便样品
1.3 实验动物及饲料
7周龄的无特定病原体级(specific pathogen-free,SPF)雌性C57BL/6 J小鼠,购自北京维通利华实验动物技术有限公司,适应1周后,开始进入正式实验,实验周期是4周[11]。小鼠标准饲料(LAD 3001M,胆碱质量分数为0.1%),1.0%胆碱饲料(LAD 3001M,胆碱质量分数为1.0%),购自南通特洛菲饲料科技有限公司。
1.4 实验方法
1.4.1 菌株的培养及悬浮液的制备
本动物实验所用到的3株乳杆菌均利用MRS培养基进行活化,使用之前以3%的接种量进行菌体活化,连续活化3代,活化之后扩大培养,6 000×g离心15 min收取乳杆菌的菌体。用预冷的0.9%生理盐水对乳杆菌的菌体清洗3次,以同样的离心条件收取乳杆菌的菌体。获得的菌体利用预冷的30%的蔗糖溶液重悬,进行菌落计数,保存于-80 ℃冰箱备用。使用时用预冷的无菌生理盐水对乳杆菌菌体清洗3次,并用无菌生理盐水将菌液稀释到活菌数为1×109 CFU/mL。
1.4.2 动物分组与处理条件
实验动物方案见表2。实验小鼠饲养于江南大学实验动物中心SPF级屏障中的IVC笼盒中[温度为(25±2) ℃,湿度为(50±5)%,循环光照,其中12 h光照,12 h黑暗],实验过程中所有小鼠均自由饮食饮水。所有动物实验均通过江南大学伦理委员会审阅和批准,且符合欧盟保护实验动物条例(2010/63/EU),所有实验均在江南大学实验动物中心完成。伦理审核编号为:JN.No20181215c0900530[270]。
表2 动物实验设计
Table 2 Animal experimental scheme
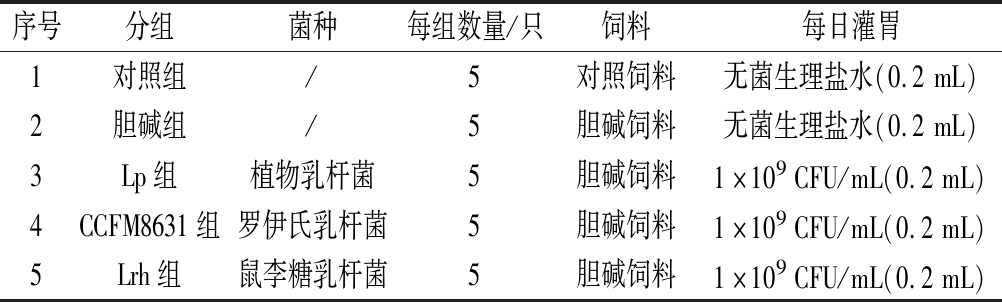
序号分组菌种每组数量/只饲料每日灌胃1对照组/5对照饲料无菌生理盐水(0.2mL)2胆碱组/5胆碱饲料无菌生理盐水(0.2mL)3Lp组植物乳杆菌5胆碱饲料1×109CFU/mL(0.2mL)4CCFM8631组罗伊氏乳杆菌5胆碱饲料1×109CFU/mL(0.2mL)5Lrh组鼠李糖乳杆菌5胆碱饲料1×109CFU/mL(0.2mL)
1.4.3 动物解剖及组织处理
实验结束前收集小鼠粪便保存于-80 ℃冰箱备用。实验最后阶段,小鼠禁食禁水过夜后在小鼠腹腔注射100 mg/kg体重的1%的戊巴比妥钠溶液进行麻醉,摘眼球取血,静置30 min后,3 000×g离心20 min取血浆,分装后置于-80 ℃保存。小鼠解剖后,肝脏、肾脏和脾脏称重后被迅速放入液氮中。计算小鼠肝脏、肾脏、脾脏的脏器指数,如公式(1)所示:
脏器指数![]()
(1)
1.4.4 小鼠血浆TMAO的样品处理
取20 μL血浆样品加入80 μL(体积比1∶4)乙腈沉淀血浆样品中的蛋白质,同时加入终浓度为2.0 μmol/L的D9-TMAO到血浆样品中作为内标。混匀,-80 ℃静置2 h,在4 ℃条件下12 000×g离心15 min,吸取上清液至进样瓶中,保存在-80 ℃冰箱备用。采用HPLC-MS/MS进行血浆TMAO的测定[13-14]。
1.4.5 小鼠盲肠TMA的样品处理
称取小鼠盲肠内容物,1 mg盲肠内容物加入20 μL V(乙腈)∶V(甲醇)∶V(水)=40∶40∶20的混合溶液,同时加入终浓度为2.0 μmol/L的D9-TMA到盲肠样品中作为内标,振荡混匀后在-80 ℃静置2 h,在4 ℃ 条件下12 000×g 离心15 min,吸取上清液至进样瓶中,保存在-80 ℃冰箱,采用HPLC-MS/MS进行盲肠TMA的测定[11]。TMA是极易挥发的小分子。在样品制备和检测过程中应快速操作,整个过程应保持低温。样本随机检测,以尽量减少由于处理时间造成的误差。
1.4.6 HPLC-MS/MS检测TMAO、TMA、D9-TMAO以及D9-TMA含量
参考之前文献报道的方法[13-14],利用Q Exactive的HPLC-MS/MS分析TMAO、TMA、D9-TMAO以及D9-TMA含量。液相色谱采用Amide色谱柱进行分离,流动相A:0.1 mmol/L的甲酸铵(pH 3.5),流动相B:乙腈,流速:0.3 mL/min。采用梯度洗脱的方式进行洗脱。质谱参数如下:离子源:ESI;多反应监测;正离子扫描。样品检测参数如表3所示。
表3 标准品检测参数
Table 3 Standard testing parameters

分析物分子式离子(m/z)[M+H]保留时间/min碰撞能量TMAOC3H9NO76.075695.9780D9-TMAOC3D9NO85.132185.97100TMAC3H9N60.080784.4610D9-TMAC3D9N69.137274.4610
1.4.7 小鼠肝脏FMO3和FXR蛋白的测定
小鼠肝脏FMO3和FXR的蛋白含量按照Elisa试剂盒(上海酶联)的操作手册进行测定。
1.4.8 小鼠肝脏FMO酶活力的测定
按照之前文献报道的方法检测肝脏FMOs的活性[15]。具体操作如下:小鼠肝脏组织在含有1 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)的RIPA裂解液中破碎匀浆,待肝脏组织裂解完全,根据BCA蛋白定量试剂盒的操作说明测定蛋白质含量。取1.0 mg肝脏蛋白质加入D9-TMA使其终浓度为100 μmol/L,同时加入100 mmol/L烟酰胺腺嘌呤二核苷酸磷酸混合均匀,最后加入10 mmol/L 4-羟乙基哌嗪乙磺酸(pH 7.4)缓冲液得到250 μL反应体系。37 ℃孵育8 h后,加入0.2 mol甲酸终止反应,随后过滤样品(ValueLab filter PTFE-Q 0.2 μm,安捷伦)转移到进样瓶,保存在-80 ℃冰箱,采用HPLC-MS/MS检测生成的D9-TMAO的含量。
1.4.9 16S rDNA扩增子测序
小鼠粪便DNA按照试剂盒的说明书进行操作,细菌的16S rDNA的扩增、纯化、定量、混样、文库构建及测序分析等参考之前的研究[16]。测序完成后,在QIIME2(Quantitative Insights Into Microbial Ecology,QIIME2,version 2019.7,https://view.qiime 2.org/)[17]进行物种分类注释,并利用在线网站进行微生物群落的α多样性和β多样性分析[18]、线性判别分析(linear discriminant analysis effect size,LEfSe)[19]及菌群与TMAO/TMA之间的相关性分析[20]。
1.5 数据统计分析
本论文中,所有的实验数据均采用平均值±标准差的形式表示,通过GraphPad Prism 6.0软件绘制统计分析图,通过SPSS(IBM SPSS Statistics 22)对各组平均值的差异进行单因素方差分析,当P<0.05时,数据具有显著性差异。
2 结果与分析
2.1 乳杆菌的摄入对高胆碱饲料饲养小鼠脏器指数的影响
实验结束后,比较了不同组之间小鼠的肝脏指数、肾脏指数和脾脏指数。如图1所示,对照组与胆碱组之间没有统计学差异,乳杆菌的摄入对胆碱饲料饲养小鼠的脏器指数也没有统计学上的影响。
a-肝脏指数;b-肾脏指数;c-脾脏指数
图1 小鼠脏器指数
Fig.1 Organ indices of mice
2.2 罗伊氏乳杆菌CCFM8631对高胆碱饲料饲养的小鼠血浆TMAO和盲肠TMA水平的影响
如图2所示,与对照组相比,胆碱组血浆TMAO水平和盲肠TMA水平显著升高,乳杆菌的摄入对血浆TMAO水平和盲肠TMA水平的影响各不相同,表现出菌种的特异性[21]。其中,罗伊氏乳杆菌CCFM8631可以显著降低血浆TMAO水平和盲肠TMA水平。这也预示着罗伊氏乳杆菌CCFM8631具有降低CVDs发病风险的潜力。
2.3 罗伊氏乳杆菌CCFM8631对高胆碱饲料饲养的小鼠肝脏FMO3和FXR的蛋白表达和FMOs酶活力的影响
如图3所示,对照组和胆碱组之间,肝脏FMO3和FXR的蛋白表达没有差异,乳杆菌的摄入,也没有显著影响FMO3和FXR的蛋白表达。进一步测定肝脏FMOs的活性,如图3-c所示,对照组和胆碱组的肝脏FMOs酶的活性没有显著差异。与胆碱组相比,乳杆菌的摄入,也没有显著影响肝脏FMOs酶的活性。
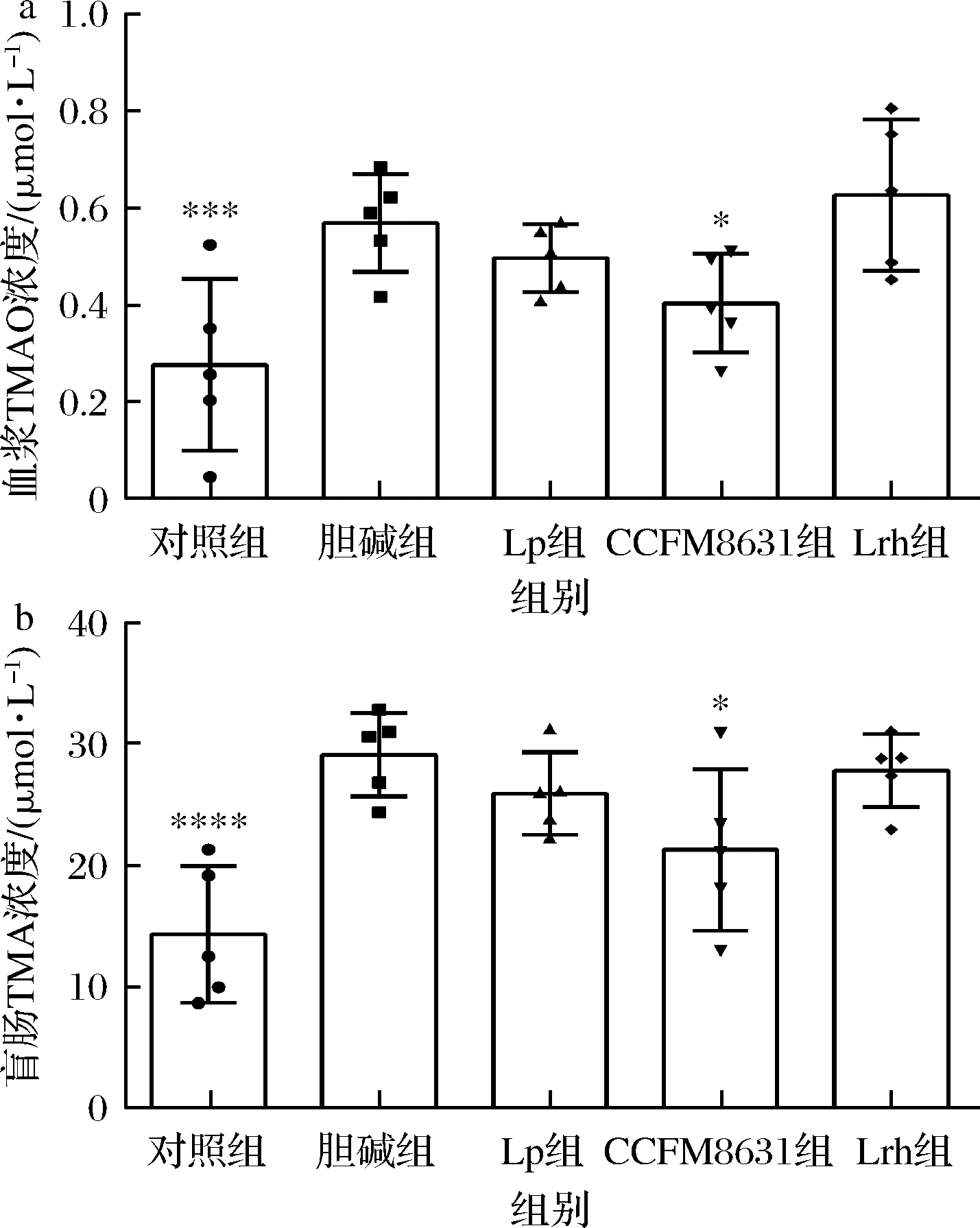
a-血浆TMAO水平;b-盲肠TMA水平
图2 罗伊氏乳杆菌CCFM8631对降低血浆TMAO和盲肠TMA水平的影响
Fig.2 Effect of Lactobacillus reuteri CCFM8631 on decrease the levels of plasma TMAO and cecal TMA in mice
注:与胆碱组相比,*表示P<0.05,***表示P<0.001,****表示P<0.000 1(下同)
2.4 罗伊氏乳杆菌CCFM8631的摄入对高胆碱饲料饲养的小鼠粪便菌群的影响
2.4.1 小鼠粪便菌群多样性分析
为了探究罗伊氏乳杆菌CCFM8631的摄入对胆碱饲料饲养的小鼠肠道菌群的影响,我们对小鼠的粪便样品进行了16S rDNA分析。由图4-a可知,通过对小鼠粪便菌群进行α多样性分析发现,与对照组相比,胆碱组在观测物种丰富度指数,香农多样性指数,Pielou均匀度指数和Faith系统发育多样性指数方面均没有显著性差异,这预示着胆碱饲料并未影响粪便菌群的α多样性。但是乳杆菌的摄入影响了粪便菌群的α多样性,罗伊氏乳杆菌CCFM8631显著升高了观测物种丰富度指数。这也预示着罗伊氏乳杆菌CCFM8631的摄入增加了肠道内菌群的丰富度。通过对小鼠粪便菌群进行β多样性分析,由图4-b可知,不同组之间分布较集中,没有显著的差异,说明胆碱饲料和罗伊氏乳杆菌CCFM8631的摄入对菌群的组成结构没有显著的影响。
2.4.2 罗伊氏乳杆菌CCFM8631对小鼠肠道菌群门水平相对丰度的影响
在门水平上,如图5所示,在所有实验组中,相对丰度较高的门是一致的,均是厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),放线菌门(Actinobacteria)。说明胆碱饲料和罗伊氏乳杆菌CCFM8631的摄入对小鼠肠道菌群门水平的相对丰度没有影响。

a-肝脏FMO3蛋白表达水平;b-肝脏FXR蛋白表达水平;c-肝脏FMOs酶活力
图3 罗伊氏乳杆菌CCFM8631对小鼠肝脏FMO3和FXR的蛋白表达和FMOs活性的影响
Fig.3 Effect of Lactobacillus reuteri CCFM8631 on affect the expression levels of FMO3 and FXR and the enzyme activity of hepatic FMOs
2.4.3 罗伊氏乳杆菌CCFM8631对小鼠肠道菌群属水平相对丰度的影响
通过Galaxy软件对小鼠粪便菌群进行LEfSe分析,设定差异阈值为LDA>2,P<0.05,共鉴定出具有显著性差异的属8个,如图6-a、图6-b所示,它们分别分布在对照组和CCFM8631组中。将筛选出具有显著性差异的8个属与血浆TMAO和盲肠TMA进行Pearson相关性分析,如图6-c所示,可以看出Ruminococcaceae UCG-013的丰度与盲肠TMA水平呈显著正相关,Parasutterella的丰度与血浆TMAO水平呈显著负相关,并且与盲肠TMA也表现出负相关的趋势。具有相关性趋势的属的相对丰度如图6-d所示,可以看出,在属水平上,与对照组相比,胆碱组显著提高了Ruminococcaceae UCG-013的相对丰度,显著降低了Parasutterella的相对丰度,但是罗伊氏乳杆菌CCFM8631的摄入改善了这一变化。

a-α多样性分析;b-β多样性分析
图4 罗伊氏乳杆菌CCFM8631对菌群多样性的影响
Fig.4 Effect of Lactobacillus reuteri CCFM8631 on the diversity of gut microbiota
3 讨论
胆碱是一种人体必需的微量营养素,在人体代谢中发挥着广泛的作用,参与了磷脂相关的细胞膜信号、与脂蛋白相关的脂质转运、与同型半胱氨酸减少相关的甲基代谢以及与乙酰胆碱相关的神经递质合成[22-23]。含胆碱食物(如鸡蛋、红肉、鱼类、贝类等)中的胆碱可以被肠道吸收[22]。长期缺乏或过量摄入胆碱均会对人体健康造成损害。例如,长期缺乏胆碱会损害肝功能,导致线粒体功能障碍、活性氧介导的DNA损伤、脂质代谢紊乱和磷脂酰胆碱合成[24-25]。但是,长期过量累积胆碱会增加CVDs的发病风险。胆碱是含有三甲胺基团的化合物,经肠道微生物代谢产生TMA,TMA经肝脏FMO的作用迅速进一步氧化成TMAO,这会导致动脉粥样硬化等疾病的发生,增加CVDs的发病风险[6]。如今,新出现的证据表明,对人体有害的可能是有毒性的TMA,而不是TMAO [26]。有效降低血浆TMAO和盲肠TMA浓度的益生菌可能为预防动脉粥样硬化和降低TMA引起的毒性提供有效且安全的方法。
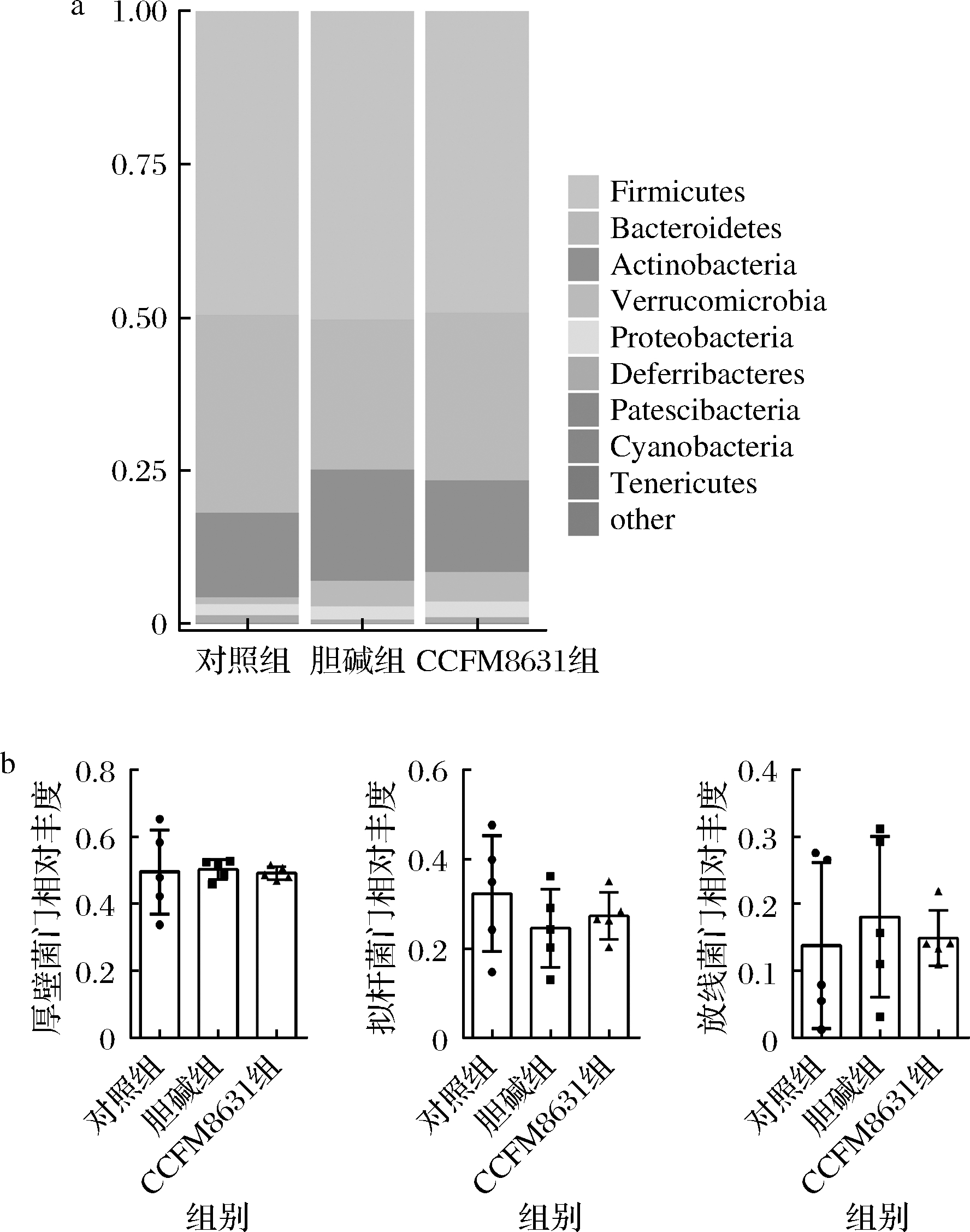
a-门水平上的微生物分布;b-门水平上相对丰度
图5 罗伊氏乳杆菌CCFM8631对门水平的影响
Fig.5 Effect of Lactobacillus reuteri CCFM8631 on phylum level of gut microbiota
肝脏FMO3在TMA生成TMAO的过程中起着极其重要的作用,肝脏FMO3过表达可以显著增加血浆的TMAO水平。FMO3的表达受胆汁酸的影响,其中包括胆汁酸激活核受体FXR[15]。在本研究中,血浆TMAO水平和盲肠TMA水平的降低与小鼠肝脏FMO3和FXR的蛋白表达和FMOs的活力无关,最可能的原因是乳杆菌的摄入导致了小鼠肠道菌群的变化,影响了代谢生成TMA的菌群丰度,导致小鼠盲肠TMA水平的降低和血浆TMAO水平的降低。
罗伊氏乳杆菌CCFM8631的摄入增加了肠道内菌群的丰富度,虽然对门水平没有影响,但可以显著提高Parasutterella属的相对丰度。Parasutterella是胃肠道健康人群粪便中的核心菌群[27],罗伊氏乳杆菌CCFM8631的摄入显著提高了粪便Parasutterella的相对丰度,这也预示着该乳杆菌的摄入有助于肠道菌群向着更健康的方向发展。Ruminococcaceae中的成员可以将植物多糖降解为葡萄糖和短链脂肪酸,从而刺激葡萄糖和肝脏甘油三酯的产生,增加循环系统中的葡萄糖和脂质水平[28]。有研究指出,Ruminococcaceae的丰度与apoE-/-小鼠的动脉粥样硬化病变严重程度呈正相关[29],与血液免疫球蛋白M水平和结肠炎炎症水平呈正相关[30]。经过胆碱饲料喂养的小鼠,粪便Ruminococcaceae UCG-013的丰度与盲肠TMA水平变化呈现正相关的趋势,罗伊氏乳杆菌CCFM8631的摄入减少了Ruminococcaceae UCG-013的相对丰度,虽然尚无直接证据证明Ruminococcaceae UCG-013能够代谢胆碱产生TMA,但Ruminococcaceae UCG-013丰度的变化可能调节了肠道内的免疫平衡,维持肠道的健康状态,减少动脉粥样硬化的发生。

a-LEfSe结果图;b-LEfSe分支图;c-血浆TMAO和盲肠TMA与显著差异的属之间的相关性分析;d-属水平上的相对丰度
图6 罗伊氏乳杆菌CCFM8631对属水平的影响
Fig.6 Effect of Lactobacillus reuteri CCFM8631 on genus level of gut microbiota
4 结论
本研究分别用3株不同种的乳杆菌处理胆碱饲料喂养的小鼠4周,发现罗伊氏乳杆菌CCFM8631可以显著缓解由胆碱导致的血浆TMAO和盲肠TMA含量的升高,这个缓解作用并不是通过影响肝脏FMO3和FXR蛋白的表达以及肝脏FMO的活性实现的,但罗伊氏乳杆菌CCFM8631显著提高了粪便中Parasutterella属的相对丰度并降低了Ruminococcaceae UCG-013属的相对丰度,相关性分析提示这两个属的微生物的丰度均与TMA的含量相关,提示罗伊氏乳杆菌CCFM8631可能通过影响了这两个属微生物的丰度实现了TMA的降低。虽然本研究中发现了可以减少血浆TMAO和盲肠TMA的生成的罗伊氏乳杆菌CCFM8631,为预防动脉粥样硬化提供了新的资源,但本研究使用的乳杆菌的种类和数量较少,尚无法得出不同种属在该功能上的特点。在未来的研究中,要扩大菌株的类别和来源,在开发新的功能性益生菌的同时,对其缓解动脉粥样硬化的机制进行更深入的探索。
[1] ABBAFATI C,ABBAS K M,ABBASI M,et al.Global burden of 369 diseases and injuries in 204 countries and territories,1990—2019:A systematic analysis for the Global Burden of Disease Study 2019 [J].Lancet,2020,396(10 258):1 204-1 222.
[2] MENSAH G A,ROTH G A,FUSTER V.The Global Burden of Cardiovascular Diseases and Risk Factors 2020 and Beyond [J].Journal of the American College of Cardiology,2019,74(20):2 529-2 532.
[3] ZHOU M G,WANG H D,ZENG X Y,et al.Mortality,morbidity,and risk factors in China and its provinces,1990—2017:A systematic analysis for the Global Burden of Disease Study 2017 [J].The Lancet,2019,394(10 204):1 145-1 158.
[4] LIU S W,LI Y C,ZENG X Y,et al.Burden of Cardiovascular Diseases in China,1990—2016 Findings From the 2016 Global Burden of Disease Study[J].JAMA Cardiology,2019,4(4):342-345.
[5] TURNBAUGH P J,LEY R E,MAHOWALD M A,et al.An obesity-associated gut microbiome with increased capacity for energy harvest [J].Nature,2006,444(7 122):1 027-1 031.
[6] WANG Z N,KLIPFELL E,BENNETT B J,et al.Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease [J].Nature,2011,472(7 341):57-63.
[7] KOETH R A,WANG Z N,LEVISON B S,et al.Intestinal microbiota metabolism of L-carnitine,a nutrient in red meat,promotes atherosclerosis [J].Nature Medicine,2013,19(5):576-585.
[8] TANG W H W,WANG Z N,LEVISON B S,et al.Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk[J].The New England Journal of Medicine,2013,368(17):1 575-1 584.
[9] TANG W H W,HAZEN S L.The contributory role of gut microbiota in cardiovascular disease[J].The Journal of Clinical Investigation,2014,124(10):4 204-4 211.
[10] HEIANZA Y,MA W J,MANSON J E,et al.Gut microbiota metabolites and risk of major adverse cardiovascular disease events and death:A systematic review and meta-analysis of prospective studies[J].Journal of the American Heart Association,2017,6(7):e004947.
[11] QIU L,TAO X Y,XIONG H,et al.Lactobacillus plantarum ZDY04 exhibits a strain-specific property of lowering TMAO via the modulation of gut microbiota in mice [J].Food Function,2018,9(8):4 299-4 309.
[12] QIU L,YANG D,TAO X Y,et al.Enterobacter aerogenes ZDY01 attenuates choline-induced trimethylamine N-oxide levels by remodeling gut microbiota in mice[J].Journal of Microbiology and Biotechnology Letters,2017,27(8):1 491-1 499.
[13] OCQUE A J,STUBBS J R,NOLIN T D.Development and validation of a simple UHPLC-MS/MS method for the simultaneous determination of trimethylamine N-oxide,choline,and betaine in human plasma and urine [J].Journal of Pharmaceutical and Biomedical Analysis,2015,109:128-135.
[14] ZHAO X Q,ZEISEL S H,ZHANG S C.Rapid LC-MRM-MS assay for simultaneous quantification of choline,betaine,trimethylamine,trimethylamine N-oxide,and creatinine in human plasma and urine [J].Electrophoresis,2015,36(18):2 207-2 214.
[15] BENNETT B J,DE AGUIAR VALLIM T Q,WANG Z N,et al.Trimethylamine-N-oxide,a metabolite associated with atherosclerosis,exhibits complex genetic and dietary regulation[J].Cell Metabolism,2013,17(1):49-60.
[16] MAO B Y,LI D Y,ZHAO J X,et al.Metagenomic insights into the effects of fructo-oligosaccharides(FOS) on the composition of fecal microbiota in mice[J].Journal of Agricultural and Food Chemistry,2015,63(3):856-863.
[17] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data [J].Nature Methods,2010,7(5):335-336.
[18] CHONG J,LIU P,ZHOU G Y,et al.Using MicrobiomeAnalyst for comprehensive statistical,functional,and meta-analysis of microbiome data [J].Nature Protocols,2020,15(3):799-821.
[19] SEGATA N,IZARD J,WALDRON L,et al.Metagenomic biomarker discovery and explanation [J].Genome Biology,2011,12(6):R60.
[20] BARBER N A,BATES S T,CASAMAYOR E O,et al.Using network analysis to explore co-occurrence patterns in soil microbial communities [J].The ISME Journal,2012,6(2):343-351.
N A,BATES S T,CASAMAYOR E O,et al.Using network analysis to explore co-occurrence patterns in soil microbial communities [J].The ISME Journal,2012,6(2):343-351.
[21] Probiotics Society of The Chinese Institute of Food Science A,Technology.Scientific consensus on probiotics(2020) [J].Journal of Chinese Institute Of Food Science and Technology,2020,20(5):303-307.
[22] YATES A A,SCHLICKER S A,SUITOR C W.Dietary reference intakes:The new basis for recommendations for calcium and related nutrients,B vitamins,and choline [J].Journal of the American Dietetic Association,1998,98(6):699-706.
[23] PENRY J T,MANORE M M.Choline:An important micronutrient for maximal endurance-exercise performance?[J].International Journal of Sport Nutrition and Exercise Metabolism,2008,18(2):191-203.
[24] CORBIN K D,ZEISEL S H.Choline metabolism provides novel insights into nonalcoholic fatty liver disease and its progression [J].Current Opinion in Gastroenterology,2012,28(2):159-165.
[25] SHERRIFF J L,O'SULLIVAN T A,PROPERZI C,et al.Choline,its potential role in nonalcoholic fatty liver disease,and the case for human and bacterial genes[J].Advances in Nutritions,2016,7(1):5-13.
[26] UFNAL M.Trimethylamine,a toxic precursor of trimethylamine oxide,lost in medical databases[J].Journal of Nutrition,2020,150(2):419.
[27] WILLING B P,DICKSVED J,HALFVARSON J,et al.A pyrosequencing study in twins shows that gastrointestinal microbial profiles vary with inflammatory bowel disease phenotypes[J].Gastroenterology,2010,139(6):1 844-1 854.
[28] B CKHED F,DING H,WANG T,et al.The gut microbiota as an environmental factor that regulates fat storage [J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15 718-15 723.
CKHED F,DING H,WANG T,et al.The gut microbiota as an environmental factor that regulates fat storage [J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15 718-15 723.
[29] LIU B N,ZHANG Y L,WANG R,et al.Western diet feeding influences gut microbiota profiles in apoE knockout mice [J].Lipids in Health and Disease,2018,17(1):1-8.
[30] WANG K,JIN X L,LI Q Q,et al.Propolis from different geographic origins decreases intestinal inflammation and bacteroides spp.populations in a model of dss-induced colitis[J].Molecular Nutrition &Food Research,2018,62(17):1800080.