人血清尿酸水平高于正常范围时就会引发高尿酸血症或痛风[1],治疗与预防的关键是降低尿酸浓度,降低尿酸浓度可通过减少核苷的摄入量或抑制黄嘌呤氧化酶(xanthine oxidase,XOD)活性来实现。高尿酸血症的治疗和预防手段为服用黄嘌呤抑制剂(别嘌呤醇、非布司他、托匹司他)[2]或排尿酸药(苯溴马隆、丙磺舒)[3],并且辅以严格的饮食控制,尽可能减少外源性嘌呤类物质摄入。许多研究表明乳酸菌对高尿酸血症具有治疗和预防作用,在肠道内乳酸菌可以分解食物中的核苷,降低核苷的含量,进而降低尿酸水平[4]。利用此原理,金方等[5]研究发现干酪乳杆菌ZM15能够降解核苷酸与核苷,显著降低模型大鼠的血尿酸水平。牛春华等[6]在体外筛选出能降解肌苷和鸟苷的植物乳杆菌UA149,其可能通过降低血清XOD活性缓解大鼠高尿酸血症。WANG等[7]检测到乳杆菌DM9218能够降低模型小鼠的血尿酸水平和XOD活性,对小鼠起到治疗作用。YAMADA等[8]通过同位素标记、体外HPLC测定和动物模型发现加氏乳杆菌PA-3表现出较强的腺嘌呤、腺苷和腺嘌呤核糖核苷酸(adenosine monophosphate,AMP)吸收能力,继而减少尿酸的合成。目前关于乳酸菌调节尿酸的研究还相对较少,乳酸菌在高尿酸血症中的应用前景还没有得到广泛的研究。因此,需要寻找高效的天然降尿酸乳酸菌,以辅助治疗高尿酸血症。
本研究旨在通过HPLC法和尿酸生成法评价乳酸菌对核苷的降解及对XOD的抑制作用,并通过耐酸、耐胆盐、胃肠道转运、黏附性和抗生素敏感性实验来研究其特性,最终优选出可以辅助治疗高尿酸血症的乳酸菌,以丰富我国降尿酸乳酸菌的菌种库。
1 材料与方法
1.1 实验材料
1.1.1 菌株
80株乳酸菌由内蒙古农业大学食品科学与工程学院民族特色食品研发团队提供。
1.1.2 药品与试剂
MRS培养基、肌苷、鸟苷、牛胆盐粉、药敏纸片,安耐吉化学;KH2PO4、K2HPO4,国药公司;胃蛋白酶、胰蛋白酶,Coolaber;黄嘌呤,Sigma;XOD、别嘌呤醇,Solarbio;PRMI 1640培养基,Gibco。
1.2 仪器与设备
Agilent LC1260液相色谱仪,美国安捷伦;KG-SX-500高压蒸汽灭菌锅,日本TOMY;58108冷冻高速离心机,德国Eppendorf;FS-150超声破碎仪,中国Ultrasonic processor公司;JY1002电子天平,上海蒲春计量仪器;细胞培养板,美国Axygen。
1.3 实验方法
1.3.1 核苷标准曲线的制作
取肌苷-鸟苷-中性磷酸钾溶液(12.6 mmol/L肌苷-12.6 mmol/L鸟苷-0.1 mol/L K3PO4,pH=7.0)0.9 mL,加入0.1 mL 0.1 mol/L HC1O4振荡混匀,吸取不同体积(20、15、10、5 μL)微滤膜过滤后用于进样分析。色谱条件:Agilent LC1260高效液相色谱仪;反相色谱柱为Agilent Zorbax Eclipse Plus-C18(4.6 mm×250 mm);流动相为等梯度50 mmol/L KH2PO4-K2HPO4(pH=6.8);柱温35 ℃;体积流量1 mL/min。在260 nm处测定肌苷与鸟苷含量,并通过曲线插值法进行定量[7]。
1.3.2 筛选高效降解核苷的乳酸菌
采用HPLC法测定反应液中的肌苷和鸟苷含量[9]。将菌株以3%的接种量接种于MRS肉汤培养基中,在37 ℃厌氧条件下活化两代。取乳酸菌培养液2 mL,在4 ℃条件下,5 000 r/min 离心10 min。然后用1 mL PBS洗涤2次,用无菌PBS调整菌悬液浓度为1×109CFU/mL,重悬于750 μL肌苷-鸟苷-中性磷酸钾溶液,37 ℃条件下、120 r/min振荡培养1 h。将所得菌液在4 ℃条件下、5 000 r/min 离心10 min,所得上清液与HClO4按体积比 9∶1 混合均匀后,取20 μL 用微滤膜过滤后HPLC分析。各菌株对核苷的降解率按照公式(1)计算:
菌株降解率![]()
(1)
式中:C1,初始鸟苷(肌苷)标准溶液的浓度,mmol/L;C2,剩余鸟苷(肌苷)标准溶液的浓度,mmol/L。
1.3.3 乳酸菌对XOD的抑制作用
将活化好的菌株于10 000 r/min离心10 min,菌体沉淀用无菌PBS洗涤2次,用无菌PBS调节菌液浓度至1×109 CFU/mL,在37 ℃条件下培养12 h,10 000 r/min离心10 min,收集上清液,过滤得到细胞代谢物。1×109 CFU/mL的菌液,在超声破碎条件下(200 W、工作5 s停5 s)进行10 min的脉冲破碎,所得液体于10 000 r/min离心10 min,过滤上清液后获得细胞内容物。
利用尿酸生成法[10]测定目的菌株抑制XOD活性作用,XOD可催化黄嘌呤氧化生成尿酸,尿酸在295 nm处有特征吸收峰,以每分钟295 nm处吸光度的增加来计算酶活性,共记录10 min。反应体系为1 mL,黄嘌呤200 μL,XOD 200 μL,PBS(pH 7.5)600、550、500、450、400、350 μL,相同浓度的菌体细胞代谢物与内容物0、50、100、150、200、250 μL,别嘌呤醇为阳性对照。计算样品对XOD的抑制率。各菌株的抑制率按照公式(2)计算:
菌株抑制率![]()
(2)
式中:A,空白组吸光度;B,样品组吸光度。
1.3.4 酸耐受性测定
参考李尧等[11]的方法,将菌株以3%的接种量接种于MRS肉汤培养基中,在37 ℃条件下活化两代。分别在pH为6.2(对照组)、2和3的酸性MRS液体培养基中接种1%活化后的菌株,37 ℃下培养3 h,在0、3 h时进行活菌计数。各菌株的存活率按照公式(3)计算:
菌株存活率![]()
(3)
1.3.5 胆盐耐受性测定
参考任大勇等[12]的方法,将菌株活化好后,按照1%的接种量将菌株分别接种于牛胆粉质量分数为0%(对照组)、0.3%的MRS液体培养基中,37 ℃条件下处理0、3 h后,在0、3 h时进行平板活菌计数。存活率计算同1.3.4。
1.3.6 胃肠道耐受能力测定
参考SON等[13]的方法,将菌株活化好后,取1 mL 该菌液后加入到9 mL模拟胃液(pH=3.0,3.5 g/L胃蛋白酶)中,37 ℃条件下静置培养0、3 h后分别取样,3 h时取1 mL上述培养液加入到9 mL模拟肠液(pH=6.8,1.0 g/L胰蛋白酶、0.3%胆盐)中,37 ℃ 条件下培养 0、3 h,在0、3 h时分别取样并采用MRS平板计数测定活菌总数。
1.3.7 黏附HT-29细胞能力测定
参考秦雅莉等[14]的方法,将菌株活化好后,离心收集菌体沉淀,用细胞完全培养基(PRMI 1640)培养液将菌体重悬至5×108CFU/mL备用,将传代5次后的HT-29细胞接种于12孔板中,待细胞长至单层后,加入1 mL供试菌株,培养2 h后,PBS冲洗2次,用300 μL的胰蛋白酶消化3 min,加入700 μL含有10%(体积分数)牛血清的1640培养液终止反应,并将所得溶液收集至无菌EP管中,计数,同时对空白组的细胞进行计数。黏附比按照公式(4)进行计算:
菌株黏附比![]()
(4)
1.3.8 抗生素敏感性测定
在MRS固体平板上涂布200 μL菌体培养液,在每个平板上放置3片抗生素药敏纸片,37 ℃培养24 h[15],用游标卡尺测量抑菌圈直径。
1.3.9 乳酸菌的鉴定
将纯化好的菌株接种于MRS液体培养基中,培养24 h,用试剂盒提取菌体基因组,并用PCR扩增其16S rDNA的基因片段。扩增引物序列为:27F:AGAGTTTGATCMTGGCTCAG;1492R:CRGYTACCTTGTTACGACTT,扩增产物由上海凌恩生物进行测定,测序结果在NCBI中比对分析。
1.4 数据统计
本试验数据用SPSS 26.0进行统计分析,数据以均值±标准偏差表示。用Origin绘制图形,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 鸟苷与肌苷的标准曲线
肌苷在本色谱条件下的保留时间为13.379 min,鸟苷的保留时间为10.105 min。以溶液浓度和峰面积进行线性回归,肌苷和鸟苷的标准曲线分别为Aino=4.75E7Cino+12 809,R2=1;Agua=4.70E7Cgua-171 597,R2=0.999 8。
2.2 筛选高效降解核苷乳酸菌
对从奶豆腐中分离出的80株乳酸菌的核苷降解能力进行测定,菌株均具有不同程度的核苷降解能力(80株乳酸菌的核苷降解能力结果省略)。表1列出了7株乳酸菌的核苷降解率,菌株的肌苷和鸟苷降解率均在74%以上。菌株NL02和NL07的核苷降解率最强,均在99%以上。本试验筛选出的菌株NL02、NL07、NL27和NL37对核苷的降解率高于麻菊美[9]筛选出的菌株弯曲乳杆菌5-1,菌株NL46、NL59和NL68对核苷的降解率略低于菌株弯曲乳杆菌5-1。同时可以发现,菌株对肌苷和鸟苷的降解能力呈正相关,可能是由于鸟苷和肌苷可被同一种酶催化降解,这表明在所测试的菌株中可能含有肌苷或鸟苷的水解酶。肌苷和鸟苷在人体中最终代谢为尿酸,当肌苷和鸟苷摄入量过多时就会导致尿酸水平超标,进而导致疾病发生。而在微生物和植物中存在尿囊素酶、尿囊酸酶和脲酶,这些酶可以把尿酸分解为对人体无毒性作用的CO2和NH3排除体外。
表1 菌株对肌苷和鸟苷的降解作用
Table 1 Degradation of inosine and guanosine by strains
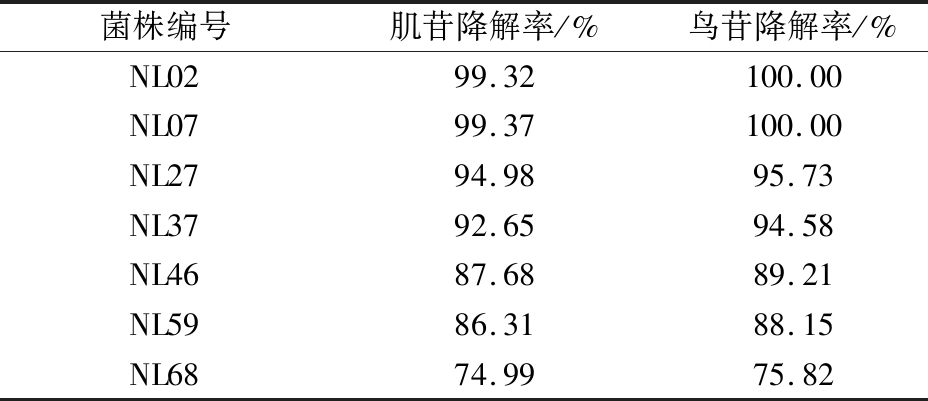
菌株编号肌苷降解率/%鸟苷降解率/%NL0299.32100.00NL0799.37100.00NL2794.9895.73NL3792.6594.58NL4687.6889.21NL5986.3188.15NL6874.9975.82
2.3 乳酸菌细胞代谢物对XOD的抑制作用
抑制XOD活性,能有效减少次黄嘌呤形成黄嘌呤并且抑制黄嘌呤形成尿酸,进而减少尿酸生成[10]。乳酸菌细胞代谢物对XOD的抑制作用如图1所示,随着样品添加量的增加,样品对XOD的抑制率也随之增加。当添加量最大时,别嘌呤醇对XOD的抑制率为35.31%,菌株NL02、NL07、NL27、NL37和NL46细胞代谢物对XOD的抑制率均在25%以上,而菌株NL59和NL68细胞代谢物对XOD的抑制率较低,分别为12.15%和15.75%。孙玮[16]研究桦褐孔菌提取物降尿酸功能时发现,高剂量的水提物(多糖)和醇提物与模型组相比均能显著降低模型大鼠血清XOD活性。推测本文中乳酸菌的细胞代谢物中可能也含有活性多糖以及其他活性物质,可以抑制XOD活性,减少尿酸的生成。
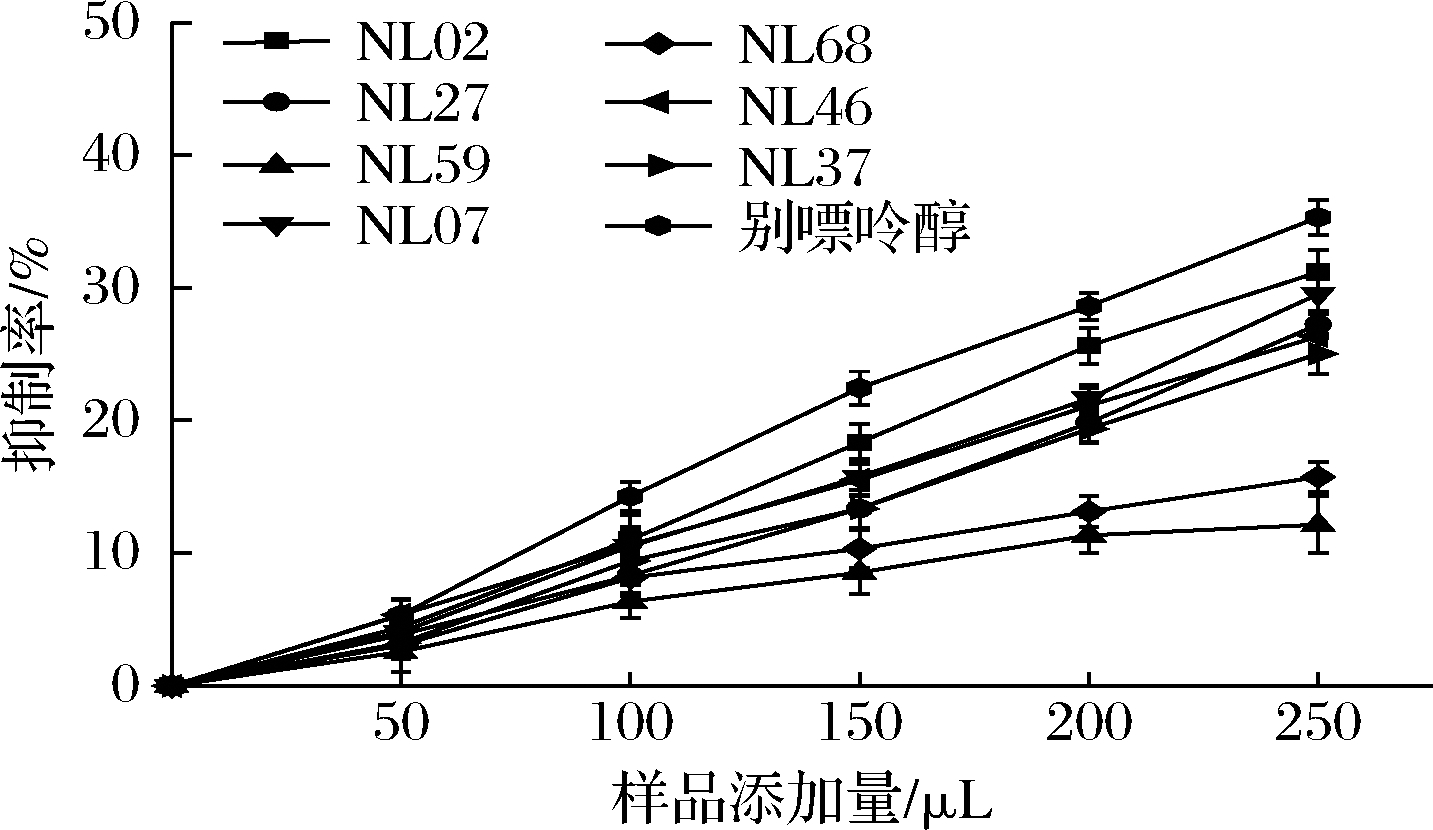
图1 乳酸菌细胞代谢物对XOD的抑制作用
Fig.1 Inhibition of XOD by metabolites of lactic acid bacteria cells
2.4 乳酸菌细胞内容物对XOD的抑制作用
乳酸菌细胞内容物对XOD的抑制作用如图2所示,当样品添加量为250 μL时,细胞内容物对XOD抑制作用的总体趋势为别嘌呤醇>NL02>NL46>NL07>NL37>NL27>NL68>NL59。这与王家彬等[17]研究一致,他发现短乳杆菌LB1lac20也具有黄嘌呤抑制能力。OOI等[18]研究发现杨梅素对XOD具有抑制作用,杨梅素被归类为具有超氧化物清除活性的XOD抑制剂。推测本文中乳酸菌的细胞代谢物和内容物均具有一定的抗氧化活性,对超氧化物具有一定的清除能力,所以可以抑制XOD的活性。结合菌株对核苷的降解率、菌株细胞代谢物、菌株内容物对XOD的抑制率,优选菌株NL02、NL07、NL27、NL37和NL46进行后续特性分析。
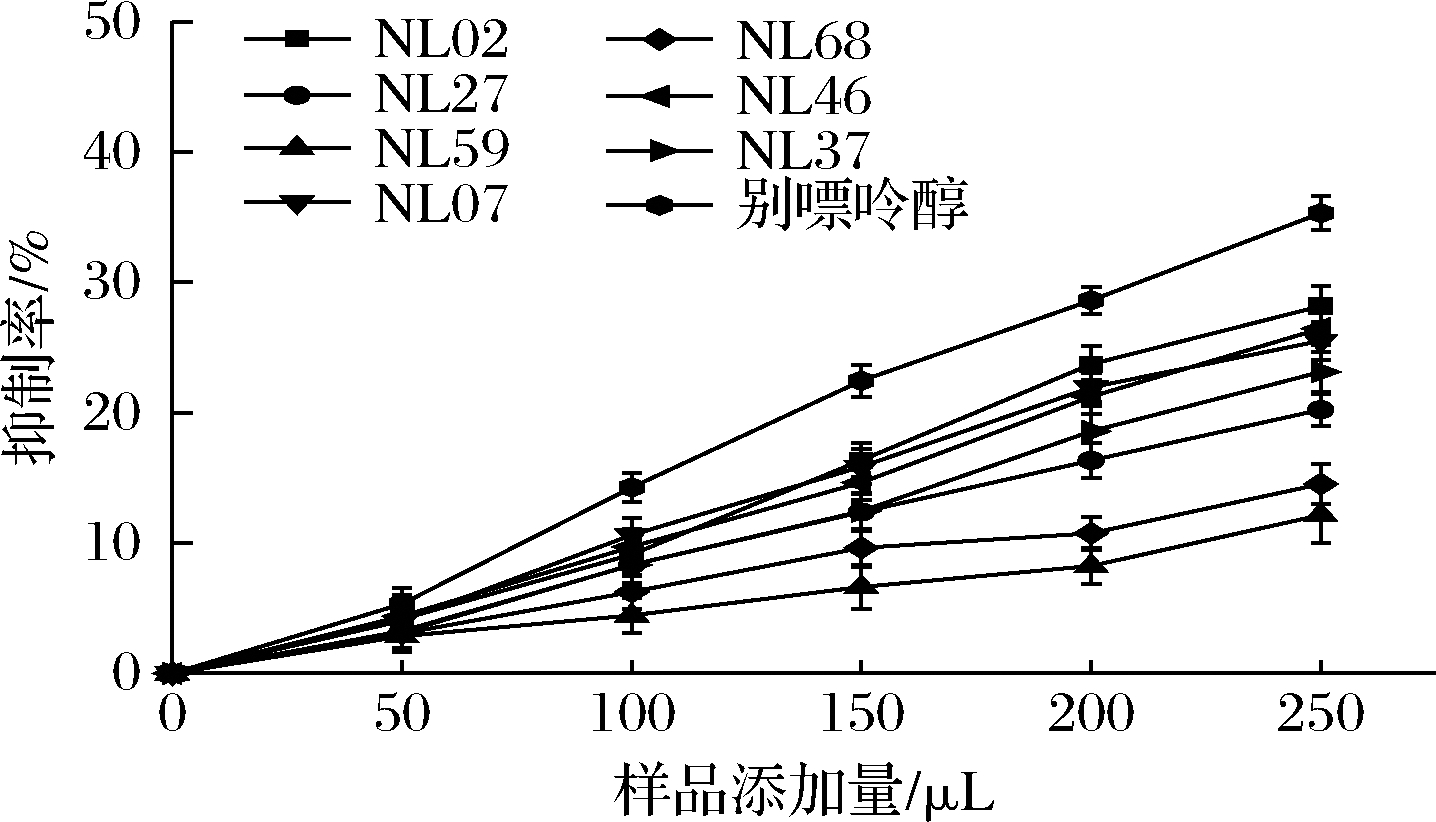
图2 乳酸菌细胞内容物对XOD的抑制作用
Fig.2 Inhibition of XOD by lactic acid bacteria cell contents
2.5 酸耐受性
一般情况下人体胃酸pH值为3.0,食物通过胃的时间一般为1~2 h[11]。乳酸菌能够在人体内发挥生理功能的前提是要耐受酸性条件。菌株在pH为6.2、3.0、2.0 酸性培养基中耐受能力如图3所示,pH为3.0 的条件对菌株的存活率影响较小,菌株的存活率均在84%以上。但pH为2.0的条件对菌株的存活率影响较大,菌株NL02、NL07、NL27、NL37的存活率在50%以上,显著高于菌株NL46,说明这4株乳酸菌在此条件下有一定的耐受能力,而菌株NL46的耐受能力较差。这与李尧等[11]的研究结果一致,酸度越低,菌株的耐受性越差。
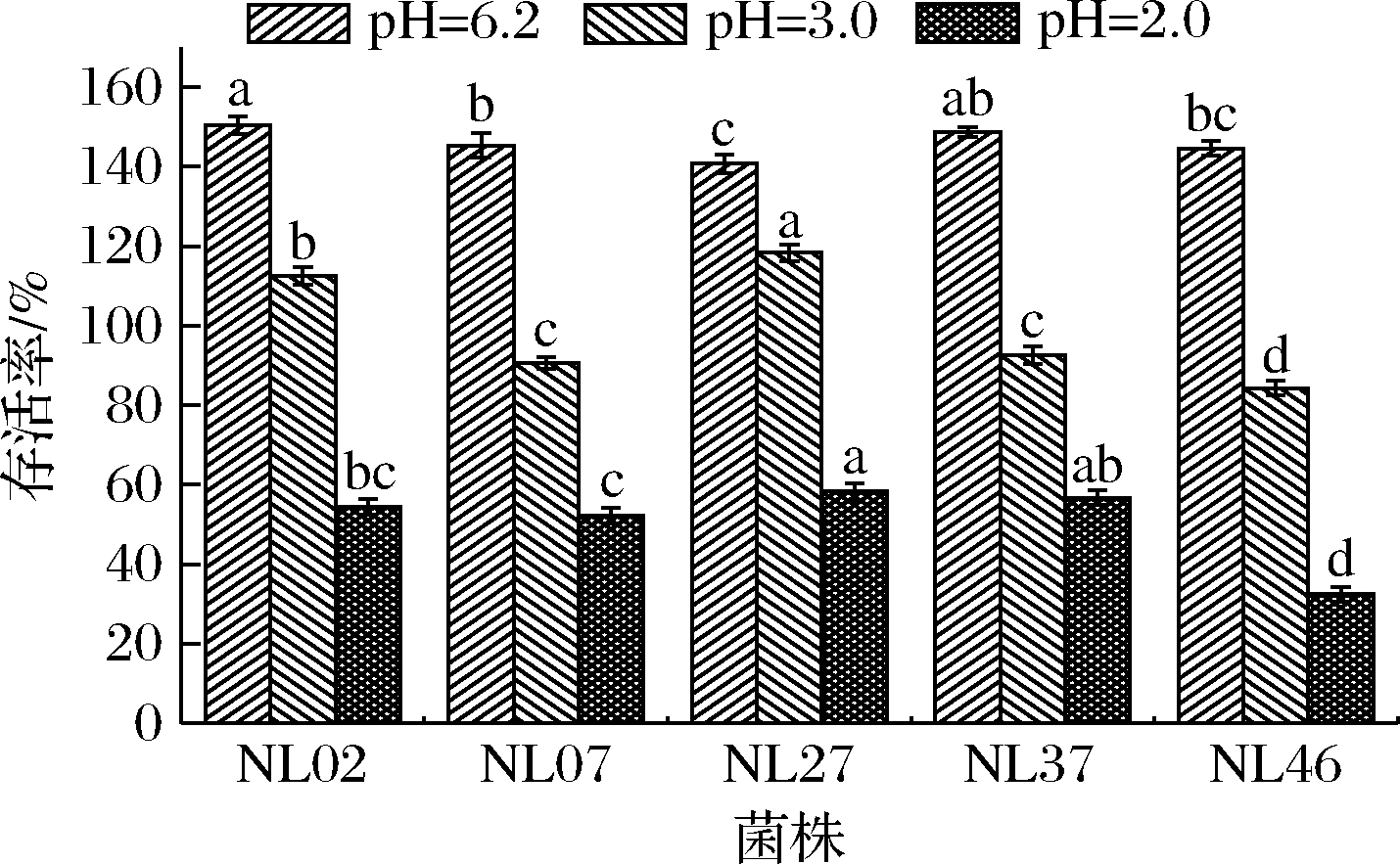
图3 菌株酸耐受结果
Fig.3 Acid tolerance result of strains
注:不同小写字母表示差异显著(P<0.05)(下同)
2.6 胆盐耐受性
人体正常胆盐的质量浓度为0.3~3 g/L[12],乳酸菌能够在肠道中存活、生长和发挥功效的另一个重要特性是耐受胆盐。图4为菌株在未添加胆盐和胆盐质量分数为0.3%条件下培养3 h后的存活率,菌株NL02、NL27和NL37在胆盐质量分数0.3%下的培养基中培养3 h后,存活率在56%以上,显著高于菌株NL07,说明菌株NL02、NL27和NL37在胆盐质量分数0.3%下有一定的耐受能力,满足了在肠道存活的基本要求,而菌株NL07的耐受性较差。这与任大勇等[12]研究结果一致,乳酸菌在有胆盐存在的培养基中生长,其存活率会下降。
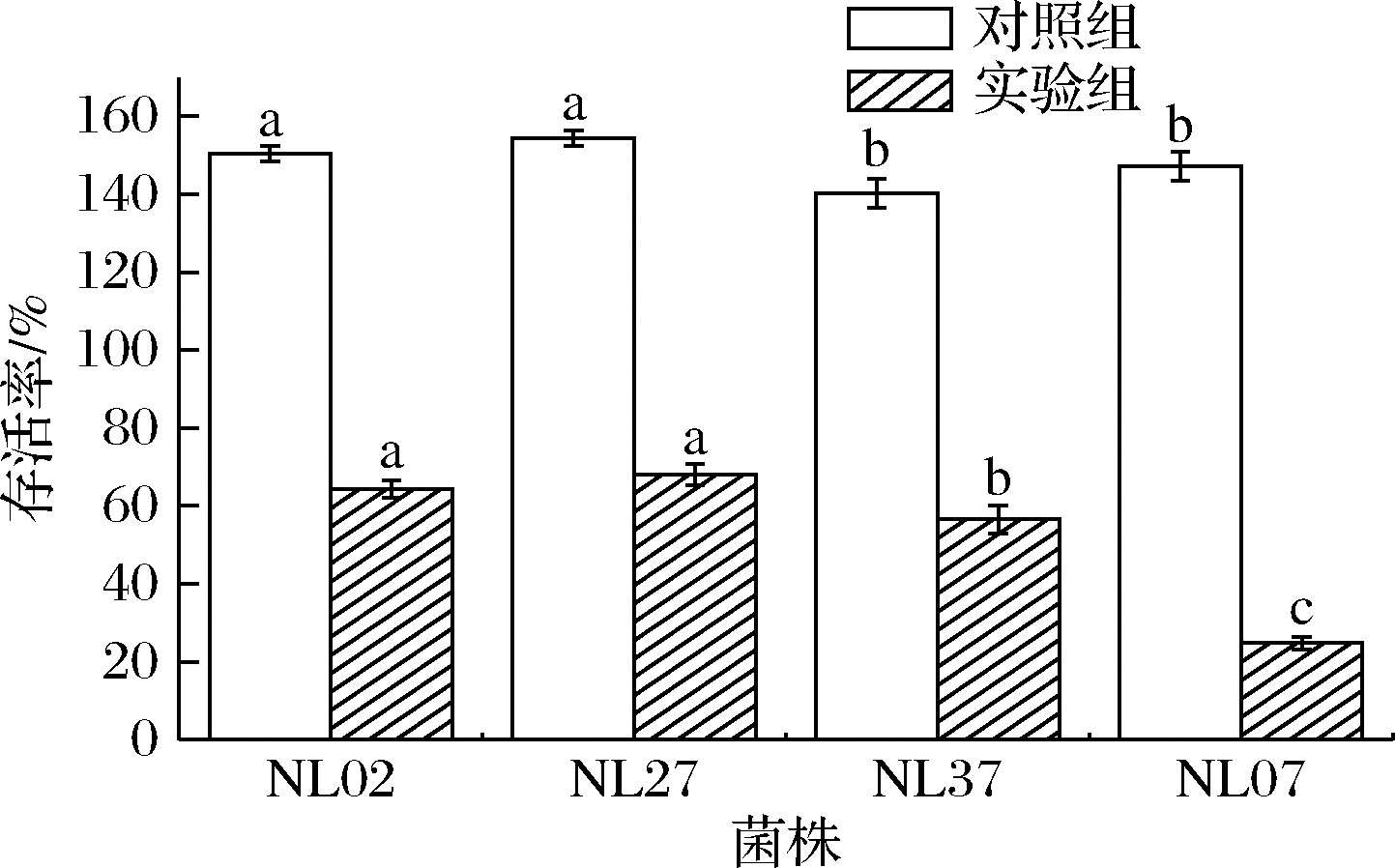
图4 菌株胆盐耐受结果
Fig.4 Bile salt tolerance result of strains
2.7 胃肠道耐受能力
乳酸菌能到达并存活于消化道是其发挥益生作用的关键。菌株的存活状况可通过模拟人体胃肠道后的存活率来反映。菌株在人工胃液中的耐受结果如表2所示,菌株NL02、NL27和NL37在人工胃液中的活菌数都呈现下降趋势,但所有菌株的活菌数都达107 CFU/mL,存活率皆在52%以上。在人工胃液处理3 h后进入人工肠液,结果如表3所示,菌株NL02和NL27的活菌数在106 CFU/mL以上,存活率也可达到42%以上,而菌株NL37的活菌数下降到106 CFU/mL以下,乳酸菌在胃肠道内存活并发挥作用的活菌数需达到106 CFU/mL以上,所以菌株NL02和NL27可以通过胃在肠道中存活一段时间,从而发挥其益生功能,而菌株NL37耐人工胃肠液的能力较差。
表2 菌株在人工胃液中的耐受性
Table 2 Tolerance of strains in artificial gastric juice
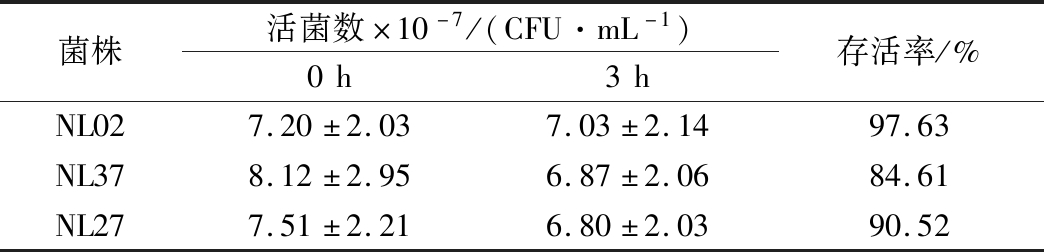
菌株活菌数×10-7/(CFU·mL-1)0h3h存活率/%NL027.20±2.037.03±2.1497.63NL378.12±2.956.87±2.0684.61NL277.51±2.216.80±2.0390.52
表3 菌株在人工肠液中的耐受性
Table 3 Tolerance of strains in artificial intestinal fluid

菌株活菌数×10-7/(CFU·mL-1)0h3h存活率/%NL027.03±2.145.52±1.9378.51NL376.87±2.062.21±1.8532.26NL276.80±2.034.60±2.0267.63
2.8 黏附HT-29细胞能力
降尿酸乳酸菌要在人体内发挥良好的生理功能的前提是要能耐受不利于其生存的体内环境(胃酸、胆盐和胃肠道消化液)。在有一定耐受能力的前提下,还要保证在定植位点具有一定的数量和增殖能力,才能发挥益生作用。体外细胞黏附模型可评价乳酸菌的黏附能力[19]。由图5可知,菌株NL02、NL27和NL37的黏附比分别为(5.56±1.61)、(3.91±1.05)和(1.31±1.34) CFU/cells,菌株NL02和NL27黏附于HT-29细胞的能力显著高于菌株NL37,菌株NL02黏附力高于秦雅莉等[14]筛选出的发酵乳杆菌SS-17。说明菌株NL02可以定植于肠道上皮,从而发挥其益生作用,菌株NL27和NL37黏附于HT-29细胞的能力较差。
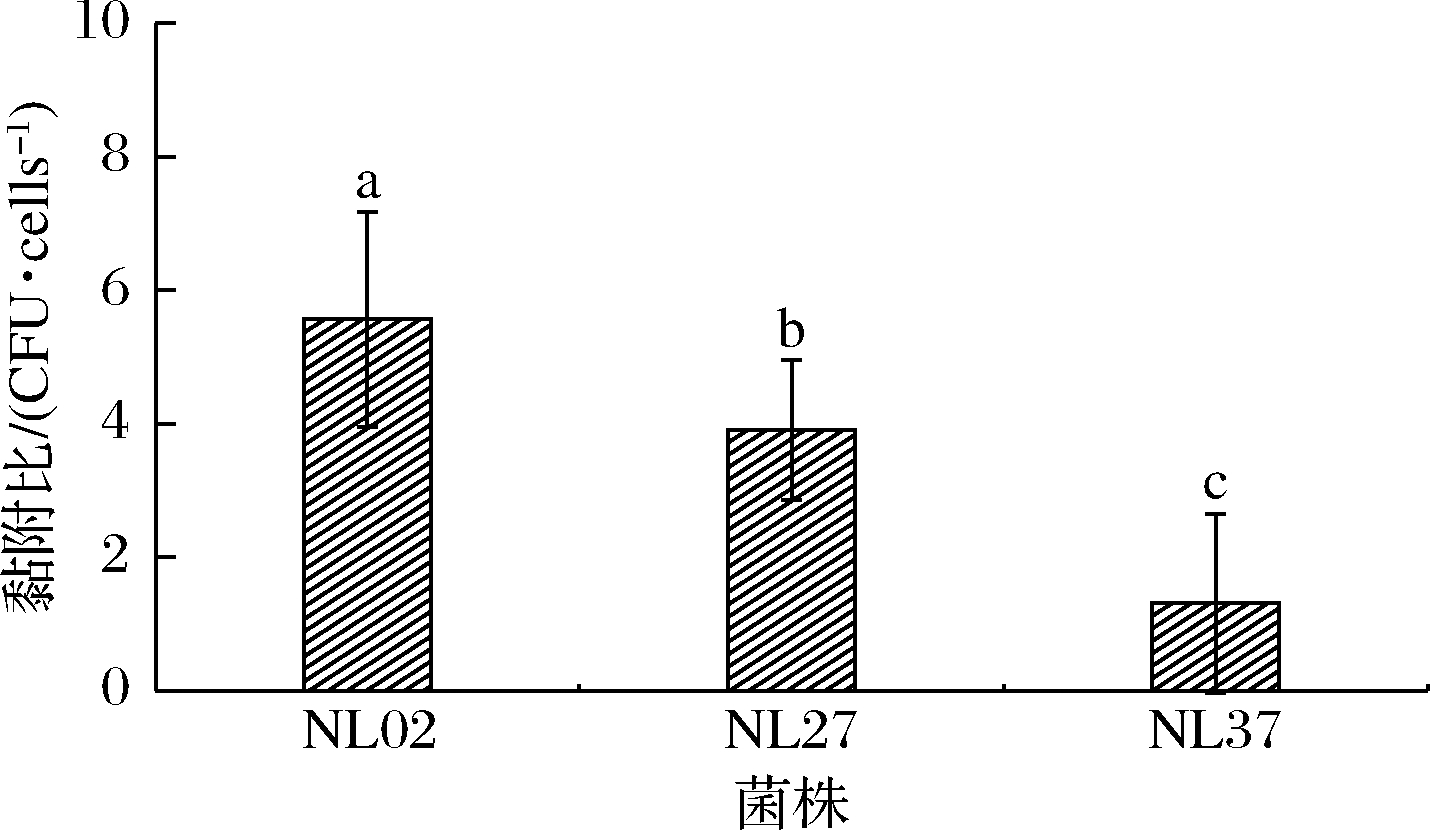
图5 菌株对HT-29细胞的黏附作用
Fig.5 Adhesion of strain to HT-29 cells
2.9 抗生素敏感性
目前,抗生素耐药性是全球公共卫生问题,有研究表明乳酸菌可通过食物转移抗生素抗性[20]。因此,在筛选益生菌时,评价其对临床相关抗生素的耐药性至关重要。本试验选用10种抗生素,对菌株NL02进行药物敏感性测定,根据CLSI的药敏试验标准,对菌株的抗生素敏感性进行判断。形成的抑菌圈越大,表明菌株对抗生素越敏感。菌株NL02的药物敏感性结果如表4所示,菌株NL02对四环素和环丙沙星呈中度敏感,对其余8种抗生素敏感,说明菌株NL02不具备耐药性。
表4 菌株抗生素敏感性结果
Table 4 Results of antibiotic susceptibility of the strain

抗生素种类纸片效价/μgNL02抑菌圈直径/mm敏感性庆大霉素 10.0019.12±0.85S链霉素 10.0018.05±1.18S卡那霉素 30.0017.35±1.27S氨苄青霉素10.0017.11±0.98S四环素 30.0015.63±0.89I克林霉素 15.0019.34±1.19S氯霉素 30.0020.21±1.15S环丙沙星 5.0016.23±0.83I利福平 5.0019.24±1.45S万古霉素 30.0018.71±0.75S
注:I-中度敏感;S-敏感
2.10 菌株的鉴定
将菌株NL02的16S rDNA测序结果在NCBI中进行BLAST分析,发现菌株NL02(NMDCN0000Q89)的16S rDNA与Lactobacillus reuteri strain 1509的同源性高达99.93%。采用MEGA 6.0软件构建的系统发育树见图6,由此可以判断菌株NL02属于罗伊氏乳杆菌(Lactobacillus reuteri)。
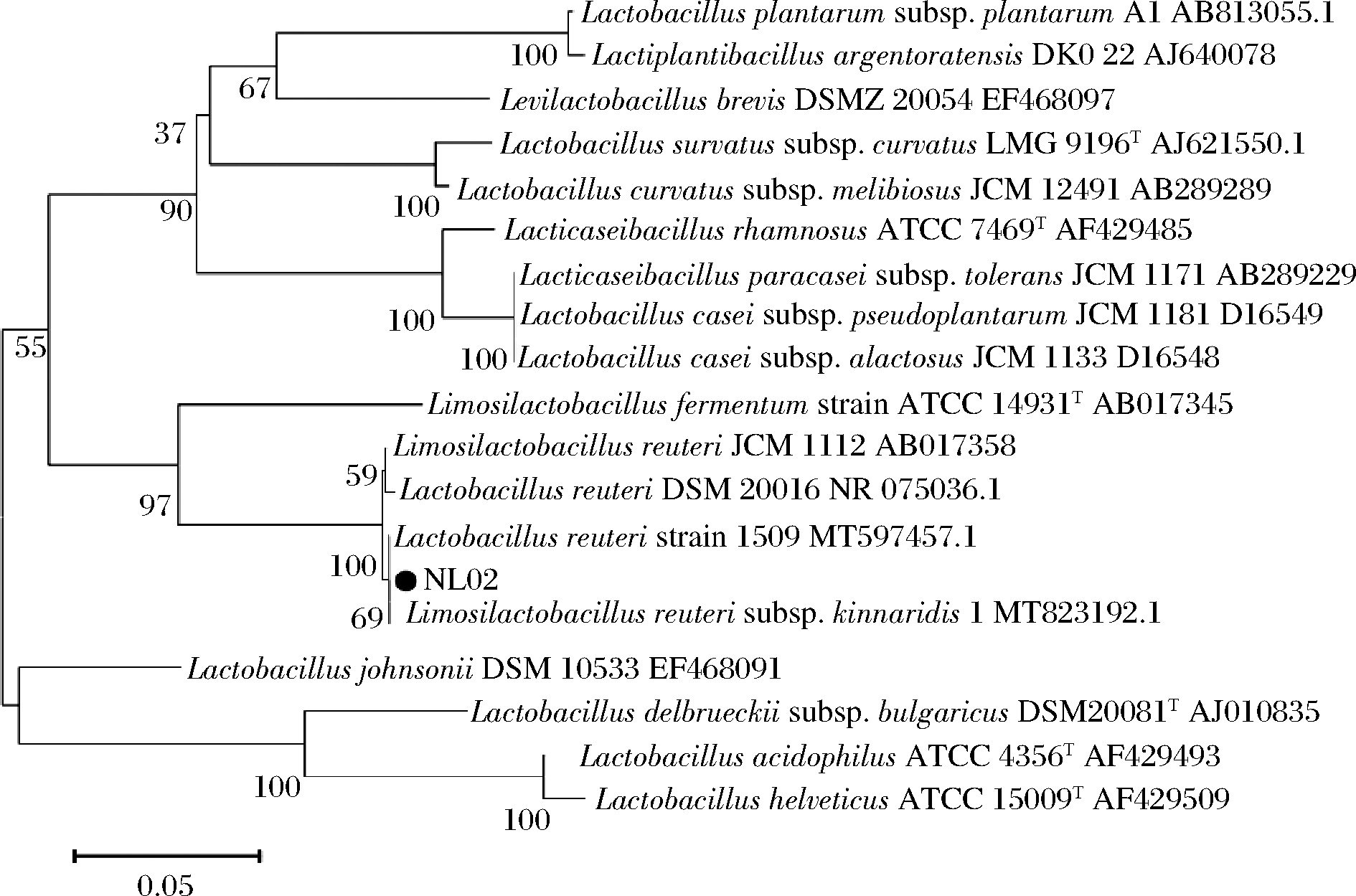
图6 基于16S rDNA 序列的系统发育树
Fig.6 Phylogenetic tree based on the 16S rDNA sequence of isolate and sequences of relating species
3 结论
综上,本研究发现的L.reuteri NL02对鸟苷的降解率为100%,对肌苷的降解率为99.32%,其细胞代谢物对XOD的抑制率为31.18%,细胞内容物对XOD的抑制率为28.18%,具有较好的潜在降尿酸能力,其降尿酸效果虽然不及合成药物,但具有低成本和高安全性的特点。L.reuteri NL02耐酸、耐胆盐、可在人体胃肠道内存活,可在人体肠道上皮黏附,并且对10中常见的抗生素不具备耐药性,对人体健康不存在潜在威胁,具有较好的益生潜力。
开发具有益生功能的乳酸菌是当前乳酸菌的一大研究趋势。L.reuteri NL02具有很大的降尿酸和益生潜力,后续可以进一步研究L.reuteri NL02在细胞和动物实验中的功效,以得到更直接准确的调控尿酸能力,并参与到高尿酸血症的预防和治疗中。
[1] GUO Y J,LI H L,LIU Z,et al.Impaired intestinal barrier function in a mouse model of hyperuricemia[J].Molecular Medicine Reports,2019,20(4):3 292-3 300.
[2] MATSUO H,ISHIKAWA E,MACHIDA H,et al.Efficacy of xanthine oxidase inhibitor for chronic kidney disease patients with hyperuricemia[J].Clinical and Experimental Nephrology,2020,24(4):307-313.
[3] RHEUMATOLOGY A F,REGISTRAR C P,RHEUMATOLOGIST P K,et al.The management of gout[J].Australian Prescriber,2016,39(4):119-122.
[4] GLIOZZI M,MALARA N,MUSCOLI S,et al.The treatment of hyperuricemia [J].International Journal of Cardiology,2016,213:23-27.
[5] 金方,杨虹.降血尿酸益生菌株的筛选和降血尿酸机理的探索[J].微生物学通报,2018,45(8):1 757-1 769.
JIN F,YANG H.Isolation of hypouricemic probiotics and exploration their effects on hyperuricemic rats[J].Microbiology China,2018,45(8):1 757-1 769.
[6] 牛春华,肖茹雪,赵子健,等.植物乳杆菌UA149的降尿酸作用[J].现代食品科技,2020,36(2):1-6;217.
NIU C H,XIAO R X,ZHAO Z J,et al.Serum uric acid lowering effect of Lactobacillus plantarum UA149 on hyperuricemic rats [J].Modern Food Science and Technology,2020,36(2):1-6;217.
[7] WANG H N,MEI L,DENG Y,et al.Lactobacillus brevis DM9218 ameliorates fructose-induced hyperuricemia through inosine degradation and manipulation of intestinal dysbiosis[J].Nutrition,2019,62:63-73.
[8] YAMADA N,IWAMOTO C,KANO H,et al.Evaluation of purine utilization by Lactobacillus gasseri strains with potential to decrease the absorption of food-derived purines in the human intestine[J].Nucleosides,Nucleotides and Nucleic Acids,2016,35(10-12):670-676.
[9] 麻菊美.降解嘌呤核苷乳酸菌的筛选及生物学特性研究[D].杭州:浙江大学,2017.
MA J M.Isolation of lactic acid bacteria with high ability of purine nucleoside-decomposing and evaluation of their biological properties[D].Hangzhou:Zhejiang University,2017.
[10] 刘慧敏.乳酸菌嘌呤降解菌株的筛选、基因组特征及其应用研究[D].扬州:扬州大学,2021.
LIU H M.Screening,genomic characteristics and application of purine degrading strains of lactic acid bacteria[D].Yangzhou:Yangzhou University,2021.
[11] 李尧,张羽竹,张利,等.分离自传统自然发酵食品中降胆固醇乳酸菌的筛选与评价[J].中国食品学报,2019,19(6):212-222.
LI Y,ZHANG Y Z,ZHANG L,et al.The screening and evaluation of cholesterol-lowering lactic acid bacteria isolated from traditional naturally fermented food[J].Journal of Chinese Institute of Food Science and Technology,2019,19(6):212-222.
[12] 任大勇,曲天铭,杨柳,等.东北传统发酵食品中降胆固醇乳酸菌的筛选及其降解机制[J].食品科学,2019,40(22):199-206.
REN D Y,QU T M,YANG L,et al.Screening of lactic acid bacterial isolates from traditional fermented foods in Northeast China for cholesterol-lowering property and mechanism of action analysis[J].Food Science,2019,40(22):199-206.
[13] SON S H,JEON H L,JEON E B,et al.Potential probiotic Lactobacillus plantarum Ln4 from kimchi:Evaluation of β-galactosidase and antioxidant activities[J].LWT - Food Science and Technology,2017,85:181-186.
[14] 秦雅莉,赵笑颍,沈圆圆,等.酸笋中具有抗炎活性乳酸菌的筛选及鉴定[J].食品科学,2022,43(8):121-127.
QIN Y L,ZHAO X Y,SHEN Y Y,et al.Screening and identification of anti-inflammatory lactic acid bacteria from sour bamboo shoot[J].Food Science,2022,43(8):121-127.
[15] 郑志瑶,王伟军,陈波,等.降胆固醇乳酸菌的筛选、鉴定与益生特性评价[J].中国食品学报,2020,20(12):239-247.
ZHENG Z Y,WANG W J,CHEN B,et al.Screening and identification of cholesterol-lowering lactic acid bacteria and evaluation of their probiotic characteristics[J].Journal of Chinese Institute of Food Science and Technology,2020,20(12):239-247.
[16] 孙玮.桦褐孔菌提取物降血脂降尿酸功能评价[D].天津:天津科技大学,2010.
SUN W.Functional assessment of Inonotus obliquu extract on hyperlipldemia and hyperuricemia[D].Tianjin:Tianjin University of Science &Technology,2010.
[17] 王家彬,潘力.降解核苷作用乳酸菌的筛选及其潜在降尿酸功能[J].食品科学,2022,43(10):199-206.
WANG J B,PAN L.Screening and uric acid-lowering potential of nucleoside-degrading lactic acid bacteria[J].Food Science,2022,43(10):199-206.
[18] OOI K L,ZAKARIA R,TAN M L,et al.The influence of chemical composition of potent inhibitors in the hydrolyzed extracts of anti-hyperuricemic plants to their xanthine oxidase activities[J].Journal of Ethnopharmacology,2021,278:114294.
[19] CELEBIOGLU H U,EJBY M,MAJUMDER A,et al.Differential proteome and cellular adhesion analyses of the probiotic bacterium Lactobacillus acidophilus NCFM grown on raffinose-an emerging prebiotic[J].Proteomics,2016,16(9):1 361-1 375.
[20] NAWAZ M,WANG J,ZHOU A P,et al.Characterization and transfer of antibiotic resistance in lactic acid bacteria from fermented food products[J].Current Microbiology,2011,62(3):1 081-1 089.