藏羊属于我国典型的草地型藏系绵羊,主要分布于四川、青海、甘肃等省的高原地区,能在海拔3 000 m 以上缺氧的环境中生存[1]。甘南藏羊可分为欧拉,甘加和乔科3种类型。其中,欧拉羊的数量和产肉量最多。欧拉藏羊肉具有高蛋白、低脂肪、无污染、富含矿物质和氨基酸等特点,是一种优质的天然绿色有机食品[2]。蛋白质是羊肉的主要组成部分,包括肌原纤维蛋白、肌浆蛋白和基质蛋白。其中,肌原纤维蛋白约占总蛋白含量的50%~55%[3-4]。此外,肌原纤维蛋白是具有生物学功能的盐溶性结构蛋白,它们的生化特性与肉制品的乳化、流变、凝胶、组织特性和风味有关,在肉制品的加工过程中起到非常重要的作用[5],但是由于肌原纤维蛋白的分子质量较大,结构较复杂,肽链展开不足,与水接触面积小,降低了溶解度,在一定程度上制约了乳化性、起泡性等其他功能特性,限制了其应用。因此,改善藏羊肉肌原纤维蛋白的特性至关重要。
蛋白质的改性可通过超高压、超声波、热处理、冻融等方式实现。其中,超高压是一种新型的非加热加工技术,能起到灭菌、钝化酶活性及改变蛋白质结构的作用[6-7]。肌原纤维蛋白被超高压处理后,其生化性质(乳化、发泡、胶凝等)可以通过分子间疏水作用、氢键、二硫键等化学作用得到改善[8-9]。目前,有关超高压对肌原纤维蛋白特性的影响已有报道。BRAVO等[10]研究发现,脱脂牛乳超离心上清液蛋白经超高压处理后,其溶解度随压力强度的增大呈先上升后下降的趋势,且在250 MPa时取得最大值。MARCOS 等[11]发现牛肉肌原纤维蛋白经超高压处理后溶解度随压力的增大呈现先上升后下降的趋势,且在200 MPa时溶解度达到最大。涂宗财等[12]研究发现,超高压处理能提高大豆分离蛋白的起泡性。XUE等[9]研究发现超高压处理能够改善鸡肉肌原纤维蛋白的溶解度。邱春江[13]研究发现鲢鱼经超高压处理后,提高了鲢鱼肌原纤维蛋白的表面疏水性。近年来,超高压技术已被用于牛肉、豆类、水产品等肌原纤维蛋白性的改性,但其对欧拉藏羊肉肌原纤维蛋白特性的影响尚未见报道。
因此,本研究以欧拉藏羊肉肌原纤维蛋白为实验对象,对其进行不同压力强度(0、150、250、350、450、550 MPa,保压10 min)处理后,测定肌原纤维蛋白的乳化性、起泡性、溶解度、浊度、巯基和羰基含量,探究超高压处理对藏羊肉肌原纤维蛋白特性的影响,以便为藏羊肉肌原纤维蛋白的改性和超高压技术的运用提供理论依据。
1 材料与方法
1.1 材料与试剂
随机选取自然放牧、健康状况良好、体重相近[(50±5) kg]的4~5岁甘南欧拉藏羊3只,采用伊斯兰教屠宰法屠宰放血后,迅速取其后腿肉,剔去结缔组织和表面筋膜等后,切成约10 g左右的小块,液氮冷冻运回实验室,并在-80 ℃冷冻贮藏,以备后期提取肌原纤维蛋白并测定相关指标。
NaCl、KCl、NaOH、NaKC4H4O6、CuSO4、NaH2PO4、Na2HPO4、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol tetraacetic acid,EGTA)等均为分析纯,北京索莱宝科技有限公司;金龙鱼大豆油,兰州北京华联超市。
1.2 仪器与设备
CQC2L-600超高压设备,北京速原中天股份有限公司;TG16G型高速冷冻离心机,江苏东华分析仪器有限公司;752 N紫外-可见分光光度计,上海仪电分析仪器有限公司;WB100-4F恒温水浴锅,琼安电气科技有限公司;380B型真空包装机,安盛科技有限公司等。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取
参考PARK等[14]的方法并略作修改。称取2 g肉样于离心管中,然后加入8 mL标准盐溶液(10 mmol/L 磷酸钾缓冲液,0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EGTA,pH 7.0),13 000 r/min 匀浆10 s,然后在4 ℃条件下离心( 3 000×g,20 min),倒掉上清液后,沉淀继续用8 mL标准盐溶液溶解,随后在4 ℃条件下以3 000×g的转速离心20 min,弃上清;沉淀用8 mL 0.1 mol/L NaCl溶液以上述条件洗涤2次,0.1 mol/L NaCl溶液溶解沉淀后,经组织捣碎机振荡均匀,用单层纱布过滤去除残留筋膜,然后用0.1 mol/L HCl调节pH为6.0,最后离心(4 ℃,3 000×g,20 min),弃去上清液,所得沉淀为肌原纤维蛋白。
1.3.2 超高压处理肌原纤维蛋白
在聚乙烯袋中装入稀释好的肌原纤维蛋白溶液20 mL,用真空机进行封口。先打开恒温槽预热,待温度达到(23±2) ℃时将样品放入加压舱内,设置处理压力分别为:0、150、250、350、450、550 MPa,保压10 min,高压介质为水。其中0 MPa样品不做任何处理。超高压处理后立即冰水浴冷却后测定相关指标,如不能及时测定置于4 ℃环境中贮存,并于48 h内使用。
1.3.3 乳化特性的测定
参考张维农等[15]方法并略作修改。首先用磷酸缓冲液(10 mmol/L,pH 7.0)将肌原纤维蛋白溶液调至5 mg/mL,然后吸取9 mL与3.0 mL大豆油混合,9 500 r/min均质1 min后,快速从乳浊液底部吸取20 μL,然后将其用1 g/L 十二烷基硫酸钠(sodium dodecyl sulfate,SDS)调到5 mL,使其充分混合,然后于500 nm处测吸光值A0,并在10 min后再次从底部吸取20 μL并用1 g/L SDS稀释至5 mL,测其吸光值A10,空白对照为1 g/L SDS。
乳化性![]()
(1)
乳化稳定性![]()
(2)
式中:T为常数,2.303;A0和A10为均质后乳浊液的吸光值;F为乳状液中油的体积分数25%;t为反应时间,10 min;C为蛋白质质量浓度,g/mL。
1.3.4 溶解度的测定
参考BENJAKUL等[16]方法并略作修改。首先将肌原纤维蛋白溶液用磷酸缓冲液(10 mmol/L,pH 7.0)稀释至2.5 mg/mL,吸取5 mL样品溶液于塑料离心管中,振荡使其充分溶解后,将其放置于4 ℃冰箱中1 h,取出后在4 ℃条件离心20 min(4 500 r/min),测定其离心前后上清液中蛋白质含量,按公式(3)计算:
溶解度![]()
(3)
1.3.5 起泡性的测定
参考张维农等[15]方法并略作修改。首先将肌原纤维蛋白溶液用磷酸缓冲液(10 mmol/L,pH 7.0)稀释至10 mg/mL,然后取5 mL样品溶液于玻璃量筒中,加入10 mL蒸馏水后体积记为V,均质2 min(10 000 r/min)后快速记录体积V0,放置30 min后,再次记录体积为V30。计算如公式(4)和公式(5)所示:
起泡性![]()
(4)
起泡稳定性![]()
(5)
1.3.6 表面疏水性测定
参考CHELH等[17]方法并略作修改,肌原纤维蛋白溶液用磷酸缓冲液(10 mmol/L,pH 7.0)稀释至2 mg/mL,取2 mL于离心管中,然后向离心管中加入200 μL 1 mg/mL溴酚蓝(pH 6.0),使其混合均匀。用2 mL磷酸缓冲液(20 mmol/L,pH 6.0)替换上述的样品溶液作为对照组。样品和对照组室温下振荡10 min,离心(7 000 r/min,15 min),取1 mL稀释10倍,在波长为595 nm处测定OD值。计算如公式(6)所示:
溴酚蓝结合量![]()
(6)
式中:A对照和A处理分别为对照组和处理组的OD值。
1.3.7 羰基含量的测定
参考LIU等[18]方法并略作修改。
1.3.8 巯基含量的测定
参考LIU等[18]方法并略作修改。
总巯基的测定:用磷酸缓冲液(10 mmol/L,pH 7.0)将肌原纤维蛋白溶液稀释至1 mg/mL,取0.5 mL与4.5 mL缓冲液中(8 mol/L尿素,0.01 mol/L EDTA,0.1 mol/L KH2PO4,pH 6.0)混合在离心管中,然后再加入100 μL Ellman试剂[0.01 mol/L (2-硝基苯甲酸),0.01 mol/L KH2PO4,pH 6.0],振荡30 s,充分混合,静置25 min,最后在412 nm处测其吸光值,消光系数为13 600 L/(mol·cm)。
活性巯基的测定:除缓冲液中没有尿素外,其他方法和总巯基一样。计算如公式(7)所示:
巯基含量![]()
(7)
式中:ρ为蛋白质量浓度,mg/mL;A表示样品OD值;73.53为常数。
1.3.9 浊度的测定
参照BENJAKUL等[19]方法略作修改。首先将肌原纤维蛋白溶液用磷酸缓冲液(10 mmol/L,pH 7.0)稀释为1 mg/mL,然后取5 mL于离心管中,在45 ℃水浴保持30 min,随后冷却到室温,其吸光度在波长为600 nm处测定。
1.4 数据处理
实验均进行3次重复。SPSS 22.0软件被用于统计分析来验证显著性差异,所有数值均通过单因素差异分析(ANOVA)结合Duncan′s多重范围检验进行评估,其中P<0.05被视为具有统计学意义。
2 结果与分析
2.1 超高压处理对藏羊肉肌原纤维蛋白羰基含量的影响
如图1所示,随着超高压处理强度的增加,肌原纤维蛋白的羰基含量显著上升(P<0.05),150~250 MPa范围内羰基含量变化没有显著性差异,在550 MPa时,比对照组高54.8%。由此可见,超高压处理引起了肌原纤维蛋白氧化程度的增加。

图1 超高压处理对藏羊肉肌原纤维蛋白羰基含量的影响
Fig.1 The effect of ultra-high pressure treatment on the carbonyl content of myofibrillar protein from Tibetan sheep meat
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 超高压处理对藏羊肉肌原纤维蛋白总巯基和活性巯基的影响
如图2所示,当压力强度增加时,显著降低了肌原纤维蛋白总巯基含量(P<0.05),而活性巯基含显著上升(P<0.05),在550 MPa时,总巯基含量比对照组低30.3%,活性巯基含量比对照组高56.7%。超高压处理能使肌原纤维蛋白总巯基含量降低,活性巯基含量增加。
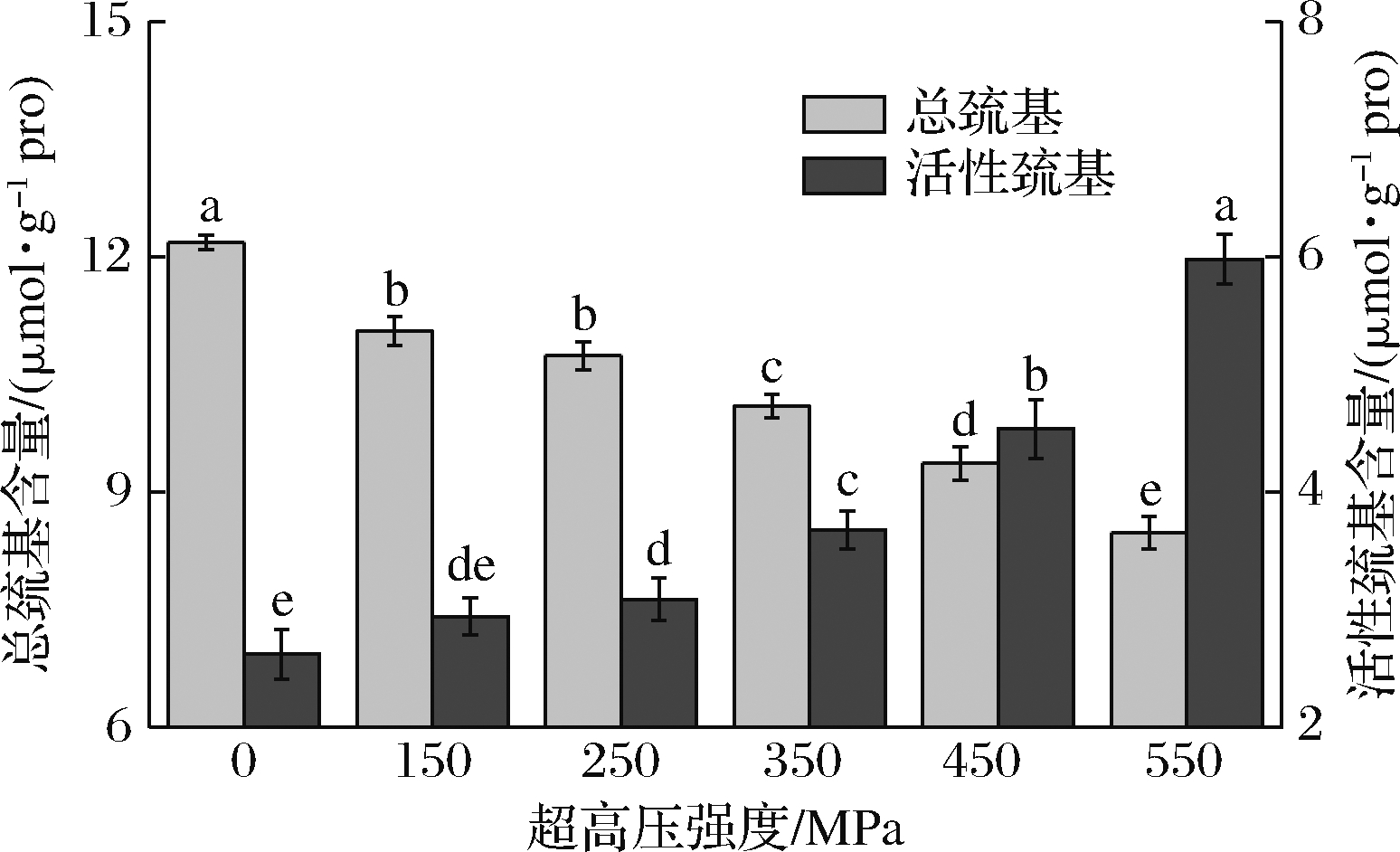
图2 超高压处理对藏羊肉肌原纤维蛋白总巯基和活性巯基含量的影响
Fig.2 The effect of ultra-high pressure treatment on the total sulfhydryl and active sulfhydryl of myofibrillar protein from Tibetan sheep meat
2.3 超高压处理对藏羊肉肌原纤维蛋白表面疏水性的影响
如图3所示,在压力强度不高于350 MPa时,表面疏水性随着压力强度的增加显著上升(P<0.05),且350 MPa时取得最大值94.9 μg,比对照组高39.8%,350~550 MPa没有显著性差异(P>0.05)。因此,超高压处理提高了肌原纤维蛋白的表面疏水性。
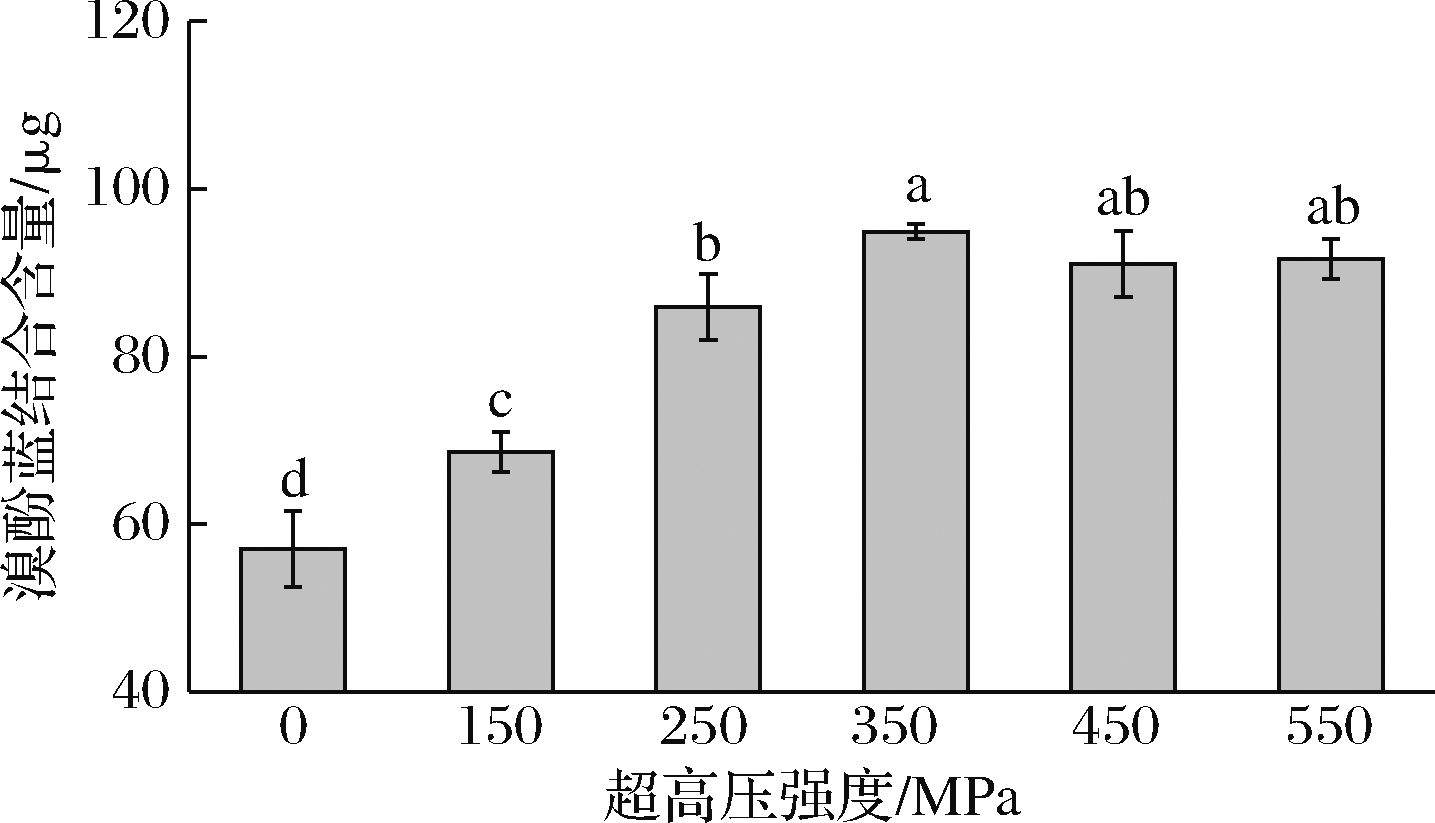
图3 超高压处理对藏羊肉肌原纤维蛋白表面疏水性的影响
Fig.3 The effect of ultra-high pressure treatment on the surface hydrophobicity of myofibrillar protein from Tibetan sheep meat
2.4 超高压处理对藏羊肉肌原纤维蛋白溶解度的影响
如图4所示,在压力强度不高于350 MPa时,溶解度随压力强度的增加显著上升(P<0.05),并且在350 MPa时取得最大值93.3%,比对照组高54.8%(P<0.05),压力强度高于350 MPa时,溶解度随压力强度的增加呈降低的趋势,且450~550 MPa溶解度差异不显著(P>0.05)。超高压强度处理能提高肌原纤维蛋白的溶解度。
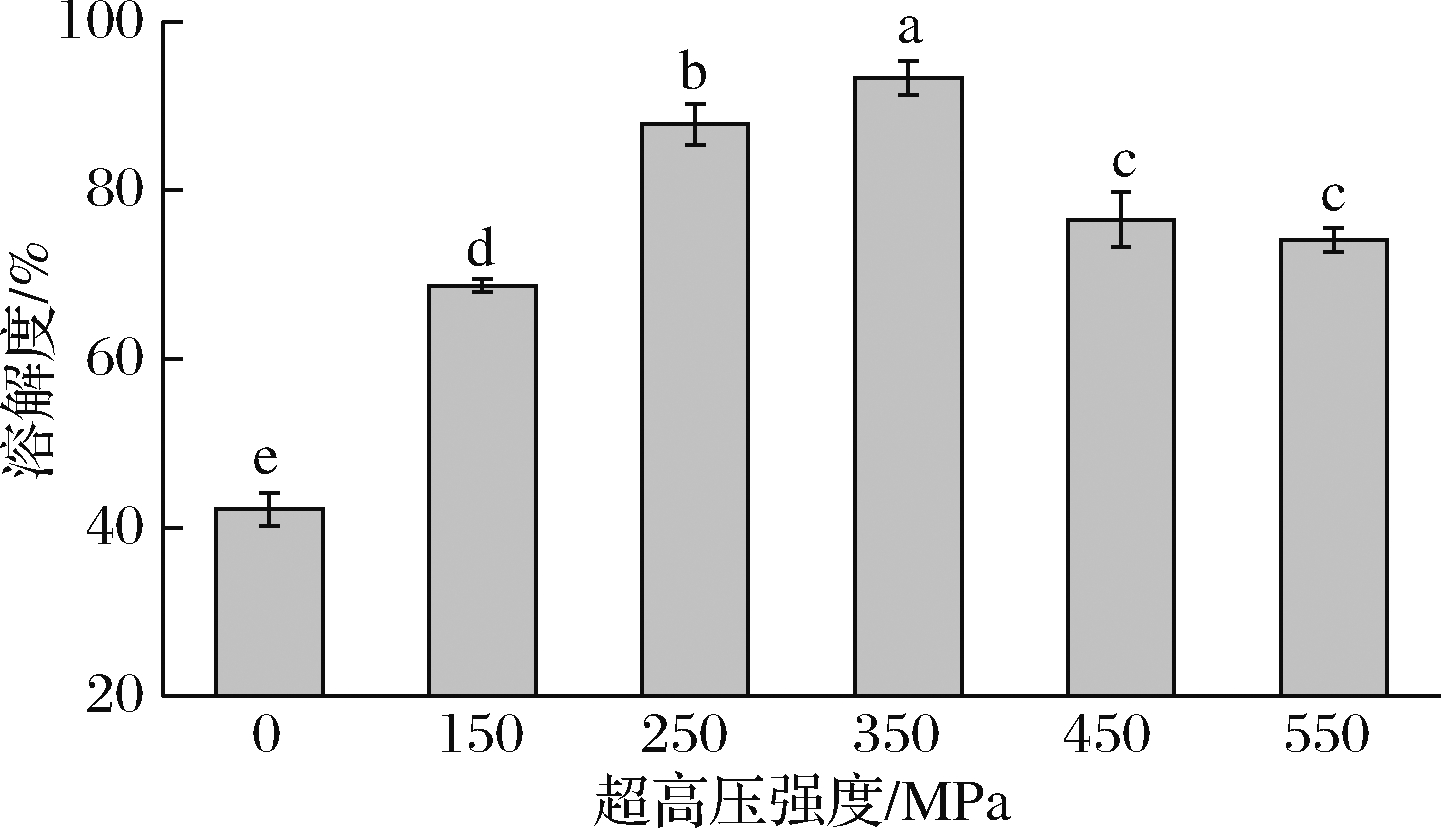
图4 超高压处理对藏羊肉肌原纤维蛋白溶解度的影响
Fig.4 The effect of ultra high-pressure treatment on the solubility of myofibrillar protein from Tibetan sheep meat
2.5 超高压处理对藏羊肉肌原纤维蛋白浊度的影响
如图5所示,在150~350 MPa范围内,随着超高压强度的增加藏羊肉肌原纤维蛋白的浊度显著下降(P<0.05),且在450 MPa时取得最小值0.60,比对照组低20%,350 MPa以后差异不显著(P>0.05),由此可见,超高压处理可以降低肌原纤维蛋白的浊度。
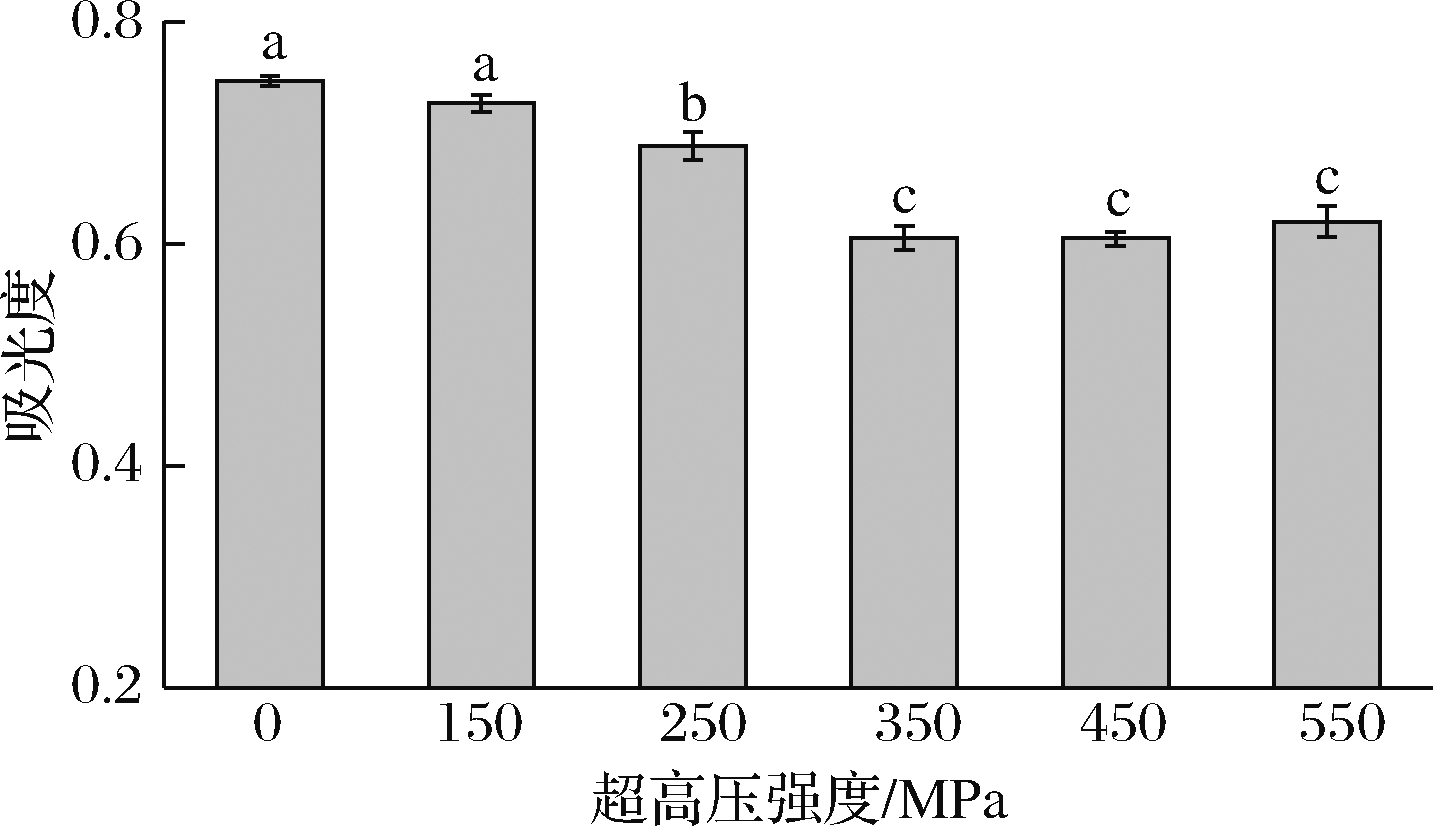
图5 超高压处理对藏羊肉肌原纤维蛋白浊度的影响
Fig.5 The effect of ultra-high pressure treatment on the turbidity of myofibrillar protein from Tibetan sheep meat
2.6 超高压处理对藏羊肉肌原纤维蛋白起泡性及起泡稳定性的影响
如图6所示,在0~250 MPa,起泡性显著上升(P<0.05),在350~450 MPa差异不显著(P>0.05),550 MPa时起泡性显著降低;在0~350 MPa,起泡稳定性随着压力强度的增加显著上升(P<0.05),且在350 MPa 时获得最大值75%,比对照组高26.7%(P<0.05),450~550 MPa没有显著性差异(P>0.05)。说明,超高压处理改善了肌原纤维蛋白的起泡性能。

图6 超高压处理对藏羊肉肌原纤维蛋白起泡性及起泡稳定性的影响
Fig.6 The effect of ultra-high pressure treatment on the foamability and foaming stability of myofibrillar protein from Tibetan sheep meat
2.7 超高压处理对藏羊肉肌原纤维蛋白乳化性及乳化稳定性的影响
如图7所示,藏羊肉肌原纤维蛋白的乳化性随压力强度的增加呈现先增加后下降的趋势(P<0.05),并且在 350 MPa 时达到最大值 76.3 m2/g,比对照组高56.6%,在压力强度不高于250 MPa时,随着压力强度的增加,肌原纤维蛋白的乳化稳定性增强,在250 MPa时取得最大值,并且比对照组高13.1%。超高压处理改善了肌原纤维蛋白的乳化性能。
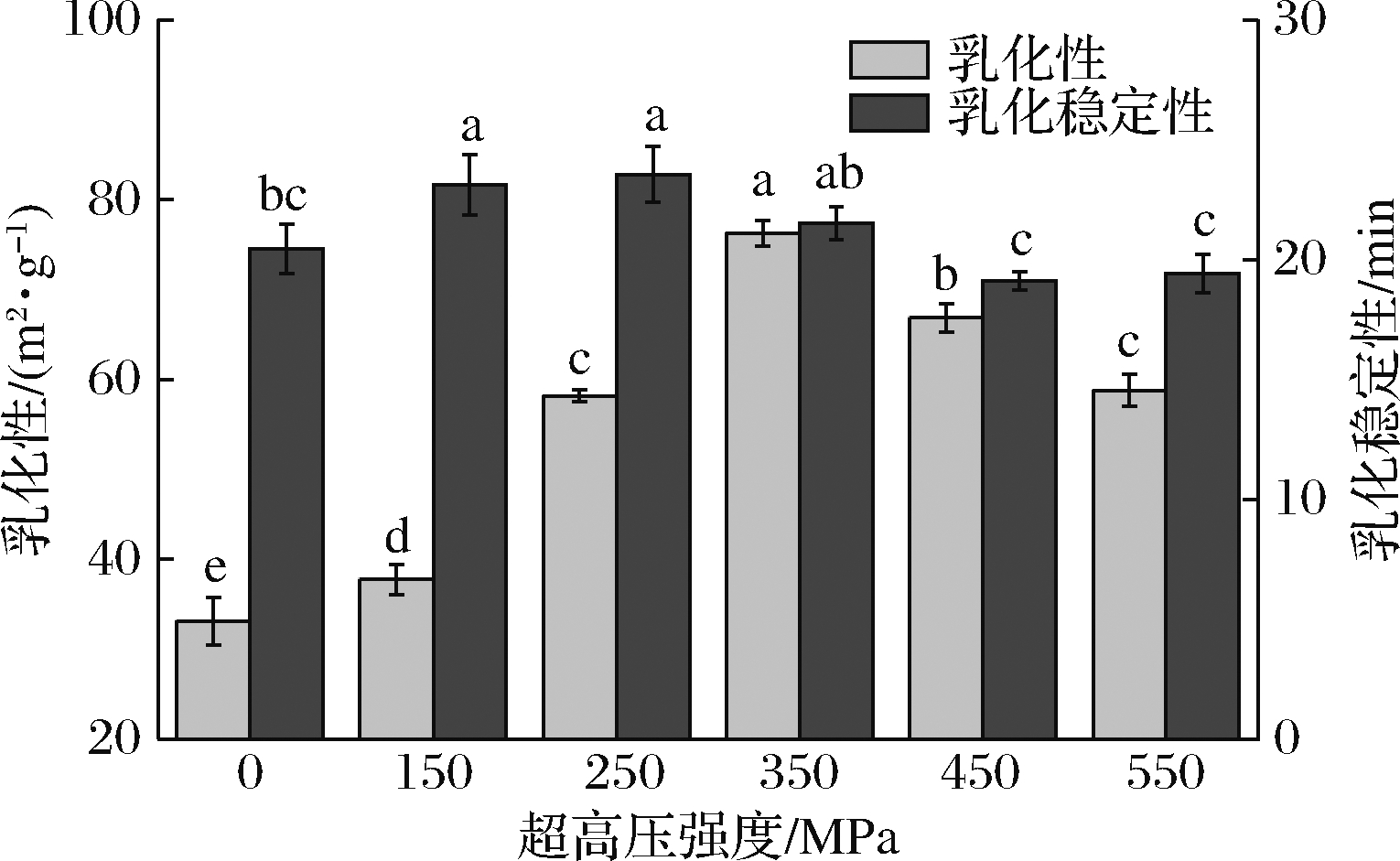
图7 超高压处理对藏羊肉肌原纤维蛋白乳化性及乳化稳定性的影响
Fig.7 The effect of ultra-high pressure treatment on the emulsifying activity and emulsifying stability of myofibrillar protein from Tibetan sheep meat
3 讨论
羰基反映蛋白质的氧化程度,羰基含量越高,说明蛋白质的结构变化越大[20]。巯基是蛋白质中最具有反应活性的功能基团,蛋白质的稳定性与巯基的含量有关[5]。本研究发现,肌原纤维蛋白经超高压处理后,其活性巯基和羰基含量显著增加,而总巯基含量显著降低。原因可能是肌原纤维蛋白经超高压处理后,其分子结构展开,包埋在内部的巯基基团暴露其表面,增加了活性巯基含量,并且暴露在蛋白表面的一些巯基与氧气结合形成了二硫键,降低了总巯基含量;而羰基含量增加的原因是蛋白经超高压处理后结构发生变化,引起各种氧化酶产生活性氧和非氧自由基[21]。郭丽萍[21]研究发现超高压处理使猪肉肌浆蛋白的羰基含量升高。李长乐[22]研究发现鲣鱼肌原纤维蛋白总巯基含量在100~500 MPa时表现出下降,而活性巯基含量升高。本研究结果与上述报道一致。
表面疏水性能反映蛋白质结构的变化情况,蛋白质中的非极性氨基酸和疏水基团与表面疏水性具有一定的相关性[5]。本研究发现,在压力强度不高于350 MPa时,表面疏水性随着压力强度的增加呈显著性上升,高于350 MPa后,表面疏水性降低。可能原因是350 MPa以下的压力改变了蛋白质分子的空间结构,暴露了一些疏水性氨基酸残基,从而导致表面疏水性增加。但当压力强度超过350 MPa后蛋白质结构展开,更多的氨基酸暴露出来并且重新开始分布,使得部分疏水性下降。本研究结果与邱春江[13]报道的研究结果相一致。
溶解度是反映蛋白质功能性质的重要指标。本研究发现,随超高压强度的增强,肌原纤维蛋白的溶解度呈先上升后下降。可能是由于压力低于350 MPa时蛋白质经适度变性后与水分子的结合能力增强,造成溶解度升高,而过大的压力强度会使蛋白质空间结构遭到破坏,疏水基团暴露并聚集形成不溶性聚集体,从而降低了溶解度[11]。本试验结果与MARCOS等[11]关于牛肉肌原纤维蛋白溶解度在0.1~400 MPa范围内随压力增大呈先上升后下降趋势的报道相一致。BRAVO等[10]发现超高压处理乳清蛋白也有类似的现象。溶解度是由电荷频率和表面疏水性所决定,当电荷频率越高、表面疏水性越低时,肌原纤维蛋白的溶解度越高,反之则越小。本研究结果表明溶解度随表面疏水性的增加而变大,这可能是由于电荷频率对肌原纤维蛋白溶解度的影响远远大于表面疏水性的作用。
浊度是反映蛋白质颗粒大小的指标。本研究发现,肌原纤维蛋白的浊度随压力强度的增大呈先下降后略微升高趋势。结果与WU等[4]报道的研究结果相一致,其研究发现牡蛎肌原纤维蛋白浊度在0~120 MPa时表现出显著下降。其原因可能是在超高压的作用下,一些大的聚集体逐渐解体,使蛋白质颗粒变小,导致浊度降低。因蛋白质颗粒变小,暴露出更多的表面积,增加了水分子与蛋白质的结合能力,从而导致溶解度升高,这与上述溶解度增加的结果一致。
反映蛋白质功能性质的重要指标包括起泡性和乳化性,一般情况下蛋白质分子越小,起泡能力越弱[23]。乳化性是指蛋白质能使油水结合形成稳定乳化液的能力[24]。乳化稳定性是指在水油不分离情况下蛋白质能保持乳浊液的能力[25]。本研究发现,藏羊肉肌原纤维蛋白的起泡性和乳化性随着压力强度的增大呈先上升后降低。MARCOS等[11]报道的牛血清蛋白的起泡性能随着压力强度的增加先升高后降低。李长乐[22]研究发现鲣鱼肌原纤维蛋白被压力处理后,提高了肌原纤维蛋白的乳化性能。本研究结果与上述报道一致。可能原因是较低的压力使得蛋白质结构发生适度解离,使内部疏水基团暴露出,导致乳浊液水油界面的张力减小,增加了分子柔性,有助于起泡性能和乳化性能增强。之后,随着压力的进一步增大蛋白质的结构被破坏,导致暴露出的疏水基团再次聚合增加了乳浊液中不溶性物质的含量,削弱了乳化性能和起泡性能[22]。
4 结论
超高压(150~550 MPa)处理藏羊肉肌原纤维蛋白后,其乳化性、乳化稳定性、溶解度、起泡性、起泡稳定性及表面疏水性随着压力的增大呈先上升后下降的趋势,压力强度为350 MPa时,乳化性、溶解度、起泡稳定性和表面疏水性达到最大值,浊度呈先下降后保持稳定,压力强度为450 MPa时,达到最小值。另外,羰基含量和活性巯基含量显著上升,总巯基含量显著下降。总之,适宜的压力条件可以显著改善藏羊肉肌原纤维蛋白的功能特性,并且防止氧化,从而为肉制品开发奠定基础。
[1] NIU L L,CHEN X Y,XIAO P,et al.Detecting signatures of selection within the tibetan sheep mitochondrial genome[J].Mitochondrial Dna Part A DNA Mapping Sequencing &Analysis,2017,28(6):801-809.
[2] 张攀高,师希雄,田铸,等.宰后N-硝基-L-精氨酸甲酯盐酸盐处理对藏羊肉品质的影响[J].食品科学,2021,42(19):43-48.
ZHANG P G,SHI X X,TIAN Z,et al.Effect of N-nitro-L-arginine methyl ester hydrochloride on tibetan sheep meat quality during postmortem aging[J].Food science,2021,42(19):43-48.
[3] LIU R,LONERGAN S,STEADHAM E,et al.Effect of nitric oxide on myofibrillar proteins and the susceptibility to calpain-1 proteolysis[J].Food Chemistry,2019,276:63-70.
[4] WU F,SHI X J,ZOU H N,et al.Effects of high-pressure homogenization on physicochemical,rheological and emulsifying properties of myofibrillar protein[J].Journal of food engineering,2019,263:272-279.
[5] LI G S,CHEN Y T,XUAN S F,et al.Effects of ultra-high pressure on the biochemical properties and secondary structure of myofibrillar protein from Oratosquilla oratoria muscle[J].Journal of Food Process Engineering,2019,42(6):e13231.
[6] CHAPLEAU N,MANGAVEL C,COMPOINT J P,et al.Effect of high-pressure processing on myofibrillar protein structure[J].Journal of the Science of Food and Agriculture,2004,84(1):66-74.
[7] 奚秀秀,徐宝才,许世闯,等.超高压对肉制品的杀菌效果及杀菌机制的研究进展[J].肉类研究,2016,30(8):39-43.
XI X X,XU B C,XU S C,et al.Effects of ultra-high pressure processing on survival of microorganisms in meat products and microbial inactivation mechanisms:A review[J].Meat Research,2016,30(8):39-43.
[8] 孙颜君,孙颜杰.超高压技术在乳制品加工中应用的研究进展[J].中国乳品工业,2016,44(2):26-31.
SUN Y J,SUN Y J.Recent advances in the use of high pressure technology in dairy processing[J].China Dairy Industry,2016,44(2):26-31.
[9] XUE S W,XU X L,SHAN H M,et al.Effects of high-intensity ultrasound,high-pressure processing,and high-pressure homogenization on the physicochemical and functional properties of myofibrillar proteins[J].Innovative Food Science and Emerging Technologies,2018,45:354-360.
[10] BRAVO F I,FELIPE X,L PEZ-FANDI
PEZ-FANDI O R,et al.Skim milk protein distribution as a result of very high hydrostatic pressure[J].Food Research International,2015,72:74-79.
O R,et al.Skim milk protein distribution as a result of very high hydrostatic pressure[J].Food Research International,2015,72:74-79.
[11] MARCOS B,MULLEN A M.High pressure induced changes in beef muscle proteome:Correlation with quality parameters[J].Meat Science,2014,97(1):11-20.
[12] 涂宗财,汪菁琴,阮榕生,等.动态超高压微射流均质对大豆分离蛋白起泡性、凝胶性的影响[J].食品科学,2006,27(10):168-170.
TU Z C,WANG J Q,RUAN R S,et al.Effect of dynamic high-pressure microfluidization on foaming,gelation properties of soy protein isolate[J].Food science,2006,27(10):168-170.
[13] 邱春江.超高压对鲢鱼中关键酶与结构蛋白质构影响的研究[D].无锡:江南大学,2014.
QIU C J.Effect of ultra-high pressure technology on key enzymes and structural proteins in silver carp processing[D].Wuxi:Jiangnan University,2014.
[14] PARK D,XIONG Y L,ALDERTON A L.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J].Food Chemistry,2007,101(3):1 239-1 246.
[15] 张维农,刘大川,胡小泓.花生蛋白产品功能特性的研究[J].中国油脂,2002,(5):60-65.
ZHANG W N,LIU D C,HU X H.Study on the functional characteristic of peanut protein products[J].China Oils and Fats,2002,(5):60-65.
[16] BENJAKUL S,VISESSANGUAN W,THONGKAEW C,et al.Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J].Food Research International,2003,36:787-795.
[17] CHELH I,GATELLIER P,SANTÉ-LHOUTELLIER V.A simplified procedure for myofibril hydrophobicity determination[J].Meat Science,2006,74(4):681-683.
[18] LIU G,XIONG Y L,BUTTERFIELD D A.Chemical,physical,and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolates[J].Journal of Food Science,2000,65(5):811-818.
[19] BENJAKUL S,VISESSANGUAN W,ISHIZAKI S,et al.Differences in gelation characteristics of natural actomyosin from two species of bigeye snapper,Priacanthus tayenus and Priacanthus macracanthus[J].Journal of Food Science,2001,66(9):1 311-1 318.
[20] ZHANG W G,XIAO S,AHN D U.Protein oxidation:Basic principles and implications for meat quality[J].Critical Reviews in Food Science and Nutrition,2013,53(11):1 191-1 201.
[21] 郭丽萍.超高压结合热处理对猪肉蛋白质氧化、结构及特性的影响[D].绵阳:西南科技大学,2016.
GUO L P.Effects of combined ultra-high pressure and thermal treatment on the oxidation,structure and properties of pork proteins[D].Mianyang:Southwest University of Science and Technology,2016.
[22] 李长乐.不同处理方式对鲣鱼肌原纤维蛋白性质与结构的影响[D].上海:上海海洋大学,2018.
LI C L.The effects of different treatments on myofibrillar protein properties and structure of skipjack[D].Shanghai:Shanghai Ocean University,2018.
[23] 郭荣荣,潘思轶,王可兴.碱法与酶法提取大米蛋白工艺及功能特性比较研究[J].食品科学,2005,26(3):173-177.
GUO R R,PAN S Y,WANG K X.Comparing research on functionality of rice protein extracted by alkali and enzyme[J].Food Science,2005,26(3):173-177.
[24] FASINU E G,IKHU-OMOREGBE D I O,JIDEANI V A.Influence of selected physicochemical factors on the stability of emulsions stabilized by bambara groundnut flour and starch[J].Journal of Food Science &Technology,2015,52(11):7 048-7 058.
[25] PERREAULT V,HÉNAUX L,BAZINET L,et al.Pretreatment of flaxseed protein isolate by high hydrostatic pressure:Impacts on protein structure,enzymatic hydrolysis and final hydrolysate antioxidant capacities[J].Food Chemistry,2017,221(2):1 805-1 812.